具备药物临床试验机构资格的医疗机构及认定专业
临床试验机构应当具备的资格和要求

临床试验机构应当具备的资格和要求
临床试验机构应当具备以下资格和要求:
1. 过硬的专业水平:临床试验机构必须有一支专业的团队,包括临床医生、临床研究人员和其他相关专业人员。
他们应当具备相关的临床研究经验和知识,并能够独立进行临床试验的设计、实施、监督和报告等工作。
2. 合法的机构注册和许可:临床试验机构应当在当地相关部门进行注册和许可,具备合法的临床研究机构身份。
这包括获得合法的临床试验许可证、药品和医疗器械经营许可证等。
3. 良好的研究设施和设备:临床试验机构必须有适合进行临床试验的研究设施和设备。
这包括符合卫生标准的临床实验室、药品和医疗器械储存室、数据管理系统等。
4. 符合伦理准则和法律法规:临床试验机构应当遵守伦理准则和法律法规,保护试验对象的权益和安全,确保试验的科学性和可靠性。
他们应当进行伦理审查和必要的伦理委员会批准,确保试验操作的合法性和科学性。
5. 良好的质量管理体系:临床试验机构应当建立和执行严格的质量管理体系,确保试验过程的可追溯性和结果的准确性。
他们应当进行内部审核和外部评估,不断提升质量管理能力。
6. 具备足够的经济支持和人力资源:临床试验机构需要具备足够的经济支持和人力资源,以确保试验的顺利进行。
他们应当
具备充足的资金和研究人员,能够按时完成试验目标。
总之,临床试验机构应当具备专业水平、合法注册、良好设施、伦理合规、质量管理和经济支持等必要条件,以保证临床试验的科学性、可靠性和安全性。
药物临床试验机构资格认定检查细则试行2014
23
A2.18
有专用办公室;配置有办公桌/工位、传真机、直拨电话、联网计算机、打印机、复印设备、碎纸机等办公设施设备
现场检查机构办公室设施设备
A3
质量管理
24
A3.1
制定有药物临床试验质量管理制度、SOP、质量检查表等,确保可操作性
查质量管理制度、SOP、质量检查表
25
A3.2*
任命有机构质量管理员
查书面文件
73
B2.5
独立顾问选聘的SOP
查书面文件
74
B2.6*
伦理审查的SOP(包括审查方式、会议管理、审查流程及审查结果的送达等)
查书面文件
75
B2.7*
伦理委员会接受试验相关纠纷的投诉与处理的SOP
查书面文件
76
B2.8
文件与档案管理的SOP(包括建档、保存、查阅与复印)
查书面文件
B3
档案管理
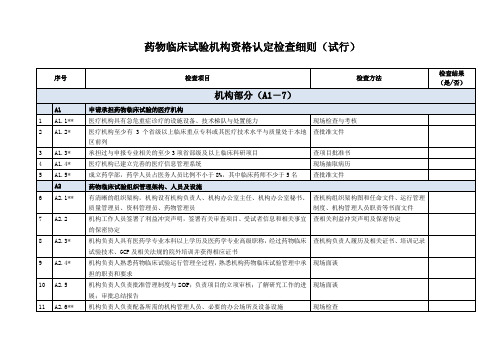
药物临床试验机构资格认定检查细则(试行)
序号
检查项目
检查方法
检查结果
(是/否)
机构部分(A1-7)
A1
申请承担药物临床试验的医疗机构
1
A1.1**
医疗机构具有急危重症诊疗的设施设备、技术梯队与处置能力
现场检查与考核
2
A1.2*
医疗机构至少有3个省级以上临床重点专科或其医疗技术水平与质量处于本地区前列
A4
资料档案管理
28
A4.1
制定有药物临床试验资料档案管理制度与SOP
查资料档案管理文件
29
A4.2
任命有资料管理员,经过GCP相关法规的培训,熟练掌握资料档案管理制度及SOP,熟悉资料档案的管理要求
2017年具有药物临床试验机构资格的619家医疗机构

国家食品药品监督管理总局国家卫生和计划生育委员会关于药物临床试验机构开展人体生物等效性试验的公告(2017年第119号)2017年10月13日发布为落实《国务院关于改革药品医疗器械审评审批制度的意见》,更好地服务以临床价值为导向的药物创新,有效落实申请人主体责任,现就生物等效性试验有关工作公告如下:一、根据《中华人民共和国药品管理法》《药物临床试验机构资格认定办法(试行)》的有关规定,药品监督管理部门会同卫生行政部门已经认定具有药物临床试验机构资格的医疗机构619家。
经认定的药物临床试验机构均可以开展人体生物等效性试验。
二、药物临床试验机构开展人体生物等效性试验,其伦理审查和试验管理应当符合《涉及人的生物医学研究伦理审查办法》及相关指导原则中的要求、条件和程序,有效保护受试者的权益并保障其安全。
三、注册申请人开展人体生物等效性试验前,应当将拟开展的人体生物等效性试验项目在国家食品药品监督管理总局指定的化学仿制药生物等效性与临床试验备案信息平台(网址:)备案。
四、注册申请人和药物临床试验机构应当遵循《药物临床试验质量管理规范》《药物Ⅰ期临床试验管理指导原则(试行)》及相关技术要求,确保人体生物等效性试验数据真实、完整、可靠,并对全部试验数据承担法律责任。
现场检查未通过的,其数据在药品审评时将不被接受。
五、各省级药品监督管理部门负责对本行政区域内药物临床试验机构开展的人体生物等效性试验项目的监督,负责试验项目的现场检查。
对试验数据真实、完整、可靠承担监督责任。
特此公告。
附件:具有药物临床试验机构资格的医疗机构食品药品监管总局国家卫生计生委2017年9月1日2017年第119号公告附件.docx附件具有药物临床试验机构资格的医疗机构精选。
药物临床试验机构资格认定办法

《药物临床试验机构资格认定办法》是一份2004年颁布的法律法规。
中文名药物临床试验机构资格认定办法根据中华人民共和国药品管理法申请标准已取得医疗机构执业许可效力级别法律施行时间2004年3月1日负责单位由国家食品药品监督管理局办法全文第一章总则第一条为加强药物临床试验的监督管理,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本办法。
第二条药物临床试验机构资格认定(以下简称“资格认定”)是指资格认定管理部门依照法定要求对申请承担药物临床试验的医疗机构所具备的药物临床试验条件,药物临床试验机构的组织管理、研究人员、设备设施、管理制度、标准操作规程等进行系统评价,作出其是否具有承担药物临床试验资格决定的过程。
第三条国家食品药品监督管理局与卫生部共同制定和修订《药物临床试验机构资格认定办法》。
第四条国家食品药品监督管理局主管全国资格认定管理工作。
卫生部在其职责范围内负责资格认定管理的有关工作。
第五条省、自治区、直辖市食品药品监督管理局(药品监督管理局)和卫生厅(局)负责本行政区域内资格认定的初审和形式审查及日常监督管理工作。
第二章资格认定的申请第六条申请资格认定的医疗机构应具备以下条件:(一)已取得医疗机构执业许可;(二)申请资格认定的专业应与医疗机构执业许可诊疗科目一致;(三)具有与药物临床试验相适应的设备设施;(四)具有与承担药物临床试验相适应的诊疗技术能力;(五)具有与承担药物临床试验相适应的床位数和受试者人数;(六)具有承担药物临床试验的组织管理机构和人员;(七)具有能够承担药物临床试验的研究人员并经过药物临床试验技术与法规的培训;(八)具有药物临床试验管理制度和标准操作规程;(九)具有防范和处理药物临床试验中突发事件的管理机制和措施。
第七条申请资格认定的医疗机构应根据所具备的药物临床试验的技术要求及设施条件和专业特长,申请相应的药物临床试验专业资格认定。
第八条申请资格认定的医疗机构,应填写《药物临床试验机构资格认定申请表》(附件1),并向所在地省级卫生厅(局)报送资格认定申请的书面资料及电子软盘。
GCP与药物临床试验机构的资格认证

解读《药物临床试验机构资格认定检查细则》(试行)

解读《药物临床试验机构资格认定检查细则》(试行)2014年9月5日,国家食品药品监督管理局颁布了《药物临床试验机构资格认定检查细则(试行)》征求意见稿,该文件是总局审核查验中心根据《药物临床试验质量管理规范》以及药物临床试验机构管理的有关规定,对《药物临床试验机构资格认定标准》的相关条款进行全面细化而产生。
本文将主要从《药物临床试验机构资格认定检查细则》(试行)的制定意义、检查内容、检查方法以及存在问题等几个方面进行阐述,为药物临床试验机构迎接资格认定检查工作及规范管理提供一定参考。
标签:药物临床试验机构资格认定;解读2014年9月初,国家食品药品监督管理局为进一步提高药物临床试验质量,强化受试者权益和安全保障,加强药物临床试验机构的现场检查,审核查验中心根据《药物临床试验质量管理规范》[1]以及药物临床试验机构管理的有关规定,对《药物临床试验机构资格认定标准》[2]的相关条款进行了细化,制定了《药物临床试验机构资格认定检查细则(试行)》[3](以下简称《细则》),本文将对《细则》的制定意义、检查内容、检查方法以及存在问题等进行细致阐述,希望机构人员及研究者等其相关人员充分理解检查要求,以进一步指导机构资格认定检查工作并规范机构及项目管理。
1意义药物临床试验机构资格认定是指政府主管部门依照法定要求,对申请承担药物临床试验的医疗机构所具备的条件、组织管理、研究人员、设备设施、管理制度、标准操作规程等进行系统评价,做出其是否具有承担药物临床试验资格决定的过程。
2004年2月29日,国家食品药品监督管理局(SFDA)发布”关于印发《药物临床试验机构资格认定办法(试行)》的通知”(国食药监安[2004]44号),并同时颁发了该局与卫生部共同制定的《药物临床试验机构资格认定办法(试行)》[3]。
按照该办法的要求,我国政府主管部门自2004年3月1日开始对全国药物临床试验机构的资格进行认定。
规定明确提出:”已取得药物临床试验机构资格的医疗机构每3年进行一次资格认定复核检查”。
具备药物临床试机构资格的医疗机构及认定专业名单

四川
自贡市第一人民医院(自贡市传染病医院)
呼吸内科、内分泌、肾病学、肿瘤、神经内科、血液内科
910
四川
攀枝花市中心医院
普外科(除肝胆外)、泌尿科、肿瘤、儿科(小儿呼吸、小儿血液)、妇产
911
四川
德阳市人民医院
呼吸内科、消化内科、神经内科、心血管内科、肾病学、肿瘤、肝病、骨科、普通外科、麻醉
912
新疆
乌鲁木齐市第四人民
医院
精神
921
新疆
新疆医科大学第五附属医院
神经内科、内分泌、消化内科、心血管内科
922
新疆
新疆医科大学第二附属医院
肿瘤、消化、神经内科、心内科、神经外科
923
898
广东
佛山市禅城区中心医院
神经内科、呼吸内科、心血管内科、肿瘤、小儿呼吸、普外科、脊柱外科、泌尿外科、麻醉、中医妇科
899
广东
深圳市南山区人民医院
疼痛、传染、康复医学、骨科(脊柱外科)、肾病学、消化内科、心血管内科、神经内科、内分泌、呼吸内科、眼科
900
重庆
重庆市公共卫生医疗救治中心(重庆市传染病医院)
附件
具备药物临床试验机构资格的
医疗机构及认定专业
医疗机构所在地
医疗机构名称
认定专业
证书编号
北京
北京中医药大学第三附属医院
中医神经内科、中医心血管内科、中医消化内科、中医呼吸内科、中医骨伤、中医肿瘤、中医外科(乳腺)
837
北京
北京清华长庚医院
内分泌、神经内科、心血管内科、感染性疾病、重症医学、普通外科(血管、肝胆、胃肠、甲乳)、麻醉、骨科、整形外科、妇科、康复医学、皮肤与性病学
关于印发《药物临床试验机构资格认定办法(试行)》的通知

关于印发《药物临床试验机构资格认定办法(试行)》的通知国食药监安[2004]44号2004年02月19日发布各省、自治区、直辖市食品药品监督管理局(药品监督管理局),卫生厅(局),解放军总后卫生部:为贯彻执行《中华人民共和国药品管理法》及《中华人民共和国药品管理法实施条例》,加强药物临床试验的监督管理,确保药物临床试验在具有药物临床试验资格的机构中进行,国家食品药品监督管理局和卫生部共同制定了《药物临床试验机构资格认定办法(试行)》(以下简称《办法》),并实施药物临床试验机构的资格认定。
现将《办法》印发给你们,并将有关事项通知如下,请遵照执行。
一、对药物临床试验机构进行资格认定,是保证药物临床试验过程规范,结果科学可靠,保护受试者权益并保障其安全的有效手段,亦是保证药物临床研究质量的重要措施。
各省、自治区、直辖市食品药品监督管理局(药品监督管理局)和卫生厅(局)应予高度重视,严格按照《办法》的规定,根据各自的职责,认真做好本行政区域内的药物临床试验机构资格认定工作,并做好药物临床试验的监督管理工作及加强对伦理委员会的监管。
二、自2004年3月1日起,拟申请资格认定的医疗机构或原国家药品临床研究基地拟增补新的药物临床试验专业,应根据《办法》中申请资格认定的医疗机构应具备的条件,参照《药物临床试验机构资格认定标准》进行自查,提出资格认定的申请。
三、自2004年8月1日起,对原国家药品临床研究基地将进行复核检查。
国家药品临床研究基地应总结药物临床试验的经验,完善药物临床试验的管理和质量保证体系,参照《药物临床试验机构资格认定标准》进行自查,提出资格认定的复核检查申请。
国家药品临床研究基地增补专业资格认定的申请亦可同时进行。
四、申请药物临床试验机构资格认定的医疗机构,可从国家食品药品监督管理局网站下载《药物临床试验机构资格认定申请表》()。
五、自2005年3月1日起,未提出资格认定申请和检查不合格的国家药品临床研究基地,将不再具有承担药物临床试验的资格,但对已经承担尚未结束的药物临床试验项目,仍可继续进行,直至该药物临床试验完成为止。
2024执业药师《药事管理与法规》考点

2024执业药师《药事管理与法规》322个考点(88-153)第三章药品研制与生产管理88.药品监督管理部门对【质量可疑药品】进行的抽查检验:(属于监督抽检)89.药品监督管理部门为评价某类或一定区域药品质量状况而开展的抽查检验:(属于评价抽检)90.药品【抽查检验】:(不向被抽样的企业收取费用,所需费用由财政支出)91.药品抽检当事人对药品检验机构的药品检验结果有异议:(可提出【复验】)92.药品质量公告主要针对的公告是:(抽查检验结果)93.首次在中国销售的药品:(需要进行【指定检验】)94.每批产品上市销售前或进口时,都应当通过批签发审核检查的:(疫苗类制品、血液制品、用于血源筛查的体外诊断试剂以及国家药监规定的其他生物制品)95.职业化专业化药品检查员制度政策措施【到2020年底,国务院药品监管部门和省级药品监管部门基本完成职业化专业化药品检查员制度体系建设】:(合理确定队伍规模,规范检查员编制管理,创新检查员管理机制,多渠道充实检查员队伍;【国务院药品监管部门】建立检查员分级分类管理制度,将检查员划分为初级检查员、中级检查员、高级检查员、专家级检查员4个层级,每个层级再细分为若干级别;强化检査员业务培训,鼓励检查员提升能力水平;完善检查员参加相应职称评审的政策,建立检查员薪酬待遇保障机制,强化纪律约束和监督)96.GLP:(药物【非临床】研究质量管理规范)97.GCP:(药物【临床试验】质量管理规范)98.GMP:(药品【生产质量】管理规范)99.GSP:(药品【经营质量】管理规范)100.GAP:(【中药材】生产质量管理规范)101.初步的临床药理学及人体安全性评价阶段【I期】:(观察人体的耐受程度和药动学)102.治疗作用的初步评价阶段【Ⅱ期】:(【初步观察】对患者的治疗作用和安全性)103.治疗作用的确证阶段【Ⅲ期】:(【进一步验证】治疗作用和安全性)104.上市后药品临床再评价阶段【Ⅳ期】:(考察药品【广泛使用】时的疗效与不良反应)105.临床试验机构资格认定【备案管理】以及临床实验申请【默示许可制度】:(具备临床试验条件的机构在药品监管部门指定网站登记备案后,可接受药品医疗器械注册申请人委托开展临床试验。
临床试验机构备案流程与要求

临床试验机构备案流程与要求下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!临床试验机构备案流程与要求如下:一、临床试验机构备案概述临床试验机构备案是指国家食品药品监督管理局对开展药物临床试验的医疗机构进行备案管理。
药物临床试验检查内容表

附件 2 :药物临床试验检查内容表临床研究工程名称:研究药物分类:SFDA 批准文号:批准日期:年月日研究开始日期:年月日是否不适用一、临床试验机构名称临床试验的研究单位具有国家认定的药物临床实验机构和专业资格临床试验机构及专业名称:认定时间:年月二、临床研究的准备申办者提供试验用药品及其临床前研究资料和已有的临床疗效及平安性资料临床研究单位的设施与条件符合平安有效地进行临床试验的需要所有研究者均具备该临床试验的专业特长、资格和能力并经过GCP 培训参加临床试验人员:医生名、护士名、其它本专业经过GCP 培训人数:专业负责人:研究者与申办者就临床试验的监督、稽查以及职责分工等达成书面协议临床试验合同签署日期:年月日三、受试者的权益保障临床试验方案及知情同意书在试验开始前获得伦理委员会批准独立的伦理委员会所在单位:申请日期:年月日讨论日期:年月日讨论结论:同意修改后同意试验期间临床试验方案和知情同意书的任何修改,均获得伦理委员会的批准试验方案有无修改:有□知情同意书有无修改:有□无□,是否再次批准或备案:是□无□ ,是否再次批准或备案:是□否□否□是否不适用试验期间发生的任何,均及时向药监、卫生、申办者和伦理委员会报告严重不良事件〔SAE〕有□ 无□如有:SAE 发生日期:年月日,报告日期:年月日受试者知情同意书的内容及表述符合GCP 〔第十四条〕的要求所有受试者都有知情同意书,且知情过程符合GCP 〔第十五条〕的要求四、临床试验方案临床试验方案由研究者和申办者共同商定并签字定稿日期:年月日双方有无签字:有□ 无□临床试验方案所包含的内容符合GCP 〔第十七条22 项内容〕的要求规定了在临床试验中必要时对试验方案进行修正的操作规程五、研究者职责研究者按照临床试验方案和GCP 的规定实施临床试验试验开始时间:年月日试验结束时间:年月日方案入组病例数:实际入组病例数:了解并熟悉试验用药的性质、作用、疗效及平安性掌握试验期间发现的所有与该药品有关的新信息所在医疗机构具备处理紧急情况的必要条件实施标准操作规程以保证实验室检查结果正确可靠保证有足够数量并符合试验入选标准的受试者进入临床试验保证受试者在受试期间出现不良事件时均能得到适当的治疗如发生严重不良事件立即对受试者采取适当的治疗措施并及时报告病例报告表的填写准确、完整、及时、合法接受申办者派遣的监察员或稽查员的监察和稽查接受SDA 的稽查和视察六、申办者职责为研究者提供手册,其内容包括按规定应有的试验用药的资料和数据是否不适用在获得SFDA 批准及伦理委员会批准后按方案和GCP 组织临床试验与研究者共同设计临床试验方案并以合同方式确定双方的职责和分工向研究者提供易于识别及有正确编码的试验药品、对照品和抚慰剂保证试验用药品质量合格并进行适当包装建立试验用药品登记、保管、分发、使用、回收的管理制度和记录系统任命为研究者所接受的监察员,监查临床试验的进行建立临床试验的质量控制和质量保证系统发生严重不良事件后及时报告SFDA发生严重不良事件后及时通报同一试验的其他研究者提前终止或暂停临床试验时,立即通知研究者、伦理委员会和SFDA七、监查员职责适当的医学、药学或相关专业学历并经过必要的培训监查员人数:医学专业人药学专业人GCP 培训合格,并熟悉药品临床研究审批管理有关法律、法规参加过GCP 或监查员培训的人数:人熟悉试验药品临床前和临床方面的信息以及临床试验方案按照GCP 〔第四十七条〕要求制定了标准操作规程制定日期:年月日第版每次访视后均向申办者提交临床试验监查的书面报告监查总次数:次监查报告:有□ 无□八、记录与报告研究者的任何观察和发现均正确而完整地记录于病历报告表上所有病例报告表填写正确且与原始资料一致,且有记录者签名所有错误或遗漏均已改正或注明,且经研究者签名并注明日期每一受试者的剂量改变、治疗变更、合并用药等情况均有记录受试者任何原因的退出与失访,均在病例报告表中有详细说明所有不良事件均被记录在案严重不良事件在规定时间内报告是否不适用对显著偏离或在临床试验可接受范围外的数据均被核实且有研究者说明临床试验总结报告与临床试验方案一致,符合GCP 〔第五十一〕条要求九、数据管理与统计分析临床试验的数据管理与统计分析有相应的专业人员参加生物统计单位或部门:负责人:数据管理单位或部门:负责人:根据临床试验方案制定了统计分析方案书统计分析方案:有□ 无□ 定稿日期:年月日与临床试验内容是否一致:是□ 否□临床试验的中期分析,应说明理由并有确定的操作程序中期分析:有□ 无□ 时间:年月日试验方案中有无规定:有□ 无□ 有无揭盲:有□无□临床试验中受试者分配必须符合随机化原那么随机分配表:有□ 无□随机分组方式:药物随机编码□ 随机分组信件□双盲试验在其试验方案中,应确定保持盲态的方法和保护受试者的措施药物编盲记录:有□ 无□ 应急信件:有□ 无□数据和平安监察委员会:有□ 无□紧急情况下对个别受试者的破盲,在病例报告表上述明理由试药期间有无紧急破盲:有□ 无□ 破盲病例数:具有数据管理的系统化程序,且所有实际操作步骤均被记录在案数据管理方案与报告:有□ 无□ 数据管理软件:电子记录应具有原始、实时、准确、完整、可靠和可溯源性,并有平安保障措施数据库及详细库结构文档:有□ 无□临床试验统计结果的表达和分析过程,均采用了标准的统计学方法和统计学软件统计分析软件:统计分析程序源代码:有□ 无□临床试验总结报告和统计分析报告相符统计分析报告日期:年月日临床试验总结报告日期:年月日十、试验用药品的管理试验用药品的使用有专人负责管理,所有的试验用药品仅用于该试验受试者,试验结束后剩余药品均按规定回收管理试验用药物的交接记录:有□ 无□试验用药物的分发和回收记录:有□ 无□试验用药物及包装的回收与处理记录:有□无□药物剂量与用法符合试验方案的规定是否不适用双盲试验中试验药物与对照药品或抚慰剂在外形、气味、包装、标签等特征一致监查员对试验用药物的供应、使用、储藏及剩余药品的处理过程进行检查十一、临床试验质量保证申办者采用标准操作规程,以保证临床试验的质量控制和质量保证的实施标准操作规程制定日期:年月日第版研究者采用标准操作规程,以保证临床试验的质量控制和质量保证的实施标准操作规程制定日期:年月日第版数据管理采用标准操作规程,以保证所有数据完整、正确标准操作规程制定日期:年月日第版统计分析采用标准操作规程,以保证统计分析科学、结果正确标准操作规程制定日期:年月日第版十二、多中心临床试验临床试验开始前,召开了临床试验方案讨论会和临床试验启动会会议日期:年月日会议记录:有□ 无□各中心同期进行临床试验各中心以相同程序管理实验用药物根据同一试验方案培训参加该试验的研究者培训日期:年月日培训记录:有□ 无□各中心的实验室检测及临床评价方法均有统一的质量控制实验室质量控制是否合格:是□ 否□抽查化验单与实验室电脑记录是否一致:是□ 否□十三、其它药物临床试验机构按其所具有的专业承当相应的药物临床研究凡承当药物临床试验的负责单位,必须同时参加该品种的临床试验药物临床试验单位不得将所承当的药物临床试验工作转让给未获准进行药物临床试验的单位药品临床研究机构同一专业不得同时进行不同申办者相同品种的药物临床研究完成该项临床试验期间,本专业同时进行的其它临床试验:有□ 无□如有,临床试验名称:检查人员签字:检查时间:。
药物临床试验现场核查要点及常见问题介绍_于磊

附件: 北京市具备药物临床试验机构资格的医疗机构及认定专业
( 截至 2008 年 7 月 20 日)
机构名称 北京市结核病胸部肿瘤研究所 首都医科大学附属北京安定医院 卫生部北京医院 北京大学第一医院 北京大学第三医院 北京大学临床药理研究所 北京大学人民医院
中国中医研究院广安门医院
首都医科大学附属北京安贞医院 首都医科大学附属北京儿童医院 中 国 人 民 解 放 军 302 医 院 中 国 人 民 解 放 军 306 医 院 中 国 人 民 解 放 军 304 医 院 中国人民解放军北京军区总医院 北京大学第一医院口腔医院 中国人民解放军总医院
空军总医院 军事医学科学院附属医院 北京世纪坛医院 中国人民解放军第二炮兵总医院 首都医科大学附属北京中医医院
2 、临 床 试 验 单 位 相 应 的 资 质 、人 员 、 设备和仪器
自 2005 年 3 月 1 日 起 , 未 提 出 资 格 认定申请和检查不合格的国家临床试验 研究基地不再具有承担临床试验的资 格, 因此现场核查时须核实临床试验单 位及相关专业是否具备承担药物临床试 验 的 资 格 。截 至 2008 年 7 月 20 日 , 北 京 市 经 过 资 格 认 定 的 临 床 机 构 共 有 41 家 ( 详见附件) 。
公告专业( 认定专业) 结 核 、肿 瘤 精 神 、戒 毒 心 血 管 、呼 吸 、胃 肠 外 营 养 、肿 瘤 、内 分 泌 、血 液 、神 经 心 血 管 、呼 吸 、消 化 、肝 病 、肾 病 、泌 尿 、内 分 泌 、神 经 、麻 醉 、骨 科 、放 射 、妇 产 及 生 育 调 节 、皮 肤 心 血 管 、呼 吸 、消 化 、神 经 、妇 产 及 生 育 调 节 、血 液 、肿 瘤 抗生素 心 血 管 、血 液 、呼 吸 、肝 病 、普 通 外 科 、骨 科 、消 化 、内 分 泌 、免 疫 、肾 病 、肿 瘤 、泌 尿 、妇 产 、眼 科 、耳 鼻 喉 科 、皮 肤 、麻 醉 专 业 、胃 肠 外 营 养 、创 伤 中 医 肿 瘤 、中 医 皮 肤 、中 医 泌 尿 、中 医 肛 肠 、中 医 眼 科 、中 医 心 血 管 、中 医 肾 病 、中 医 内 分 泌 、中 医 风 湿 、中 医 妇 科 、中 医 呼 吸 、中 医 骨 科 、中 医 普 通 外 科 、中 医 消 化 、中 医 神 经 内 科 、中 医 耳 鼻 喉 科 、中 医 口 腔 、中 医 艾 滋 病 专 业 、糖 尿 病 心 血 管 、神 经 儿 科 、外 科 、妇 科 、抗 感 染 、心 血 管 、肾 病 、呼 吸 、消 化 、脑 血 管 、内 分 泌 ( 乳 腺 ) 戒 毒 、镇 痛 心 血 管 、呼 吸 、妇 产 、泌 尿 、消 化 、血 液 、肿 瘤 、风 湿 免 疫 、麻 醉 、器 官 移 植 、普 通 外 科 、皮 肤 专 业 肝 病 、艾 滋 病 抗 感 染 、变 态 反 应 、免 疫 、神 经 、心 血 管 、眼 科 、肾 病 、呼 吸 、消 化 、胃 肠 外 营 养 、放 射 、麻 醉 、血 液 、内 分 泌 、 耳 鼻 喉 、妇 产 及 生 育 调 节 、皮 肤 精神 心 血 管 、消 化 、神 经 、肾 病 、血 液 、肿 瘤 、骨 科 、热 带 病 、泌 尿 、胃 肠 外 营 养 肿瘤 心血管 肿瘤 心 血 管 、内 分 泌 、肿 瘤 、肾 病 、免 疫 、呼 吸 、妇 产 及 生 育 调 节 心 血 管 、血 液 、呼 吸 、消 化 、外 科 、妇 科 、儿 科 、神 经 、内 分 泌 心 血 管 、周 围 血 管 、皮 肤 、神 经 、消 化 口腔 肝 病 、感 染 、艾 滋 病 、中 医 肝 病 心 血 管 、内 分 泌 、眼 科 、耳 鼻 咽 喉 心 血 管 、消 化 、呼 吸 、神 经 内 科 、风 湿 、烧 伤 、骨 科 中 医 呼 吸 、中 医 心 血 管 、中 医 神 经 内 科 、中 医 内 分 泌 、中 医 消 化 、中 医 肿 瘤 、中 医 外 科 、中 医 妇 产 、中 医 眼 科 、中 医 耳 鼻 咽 喉 、中 医 皮 肤 心 血 管 、心 胸 外 科 、呼 吸 、麻 醉 、神 经 内 科 、普 通 外 科 、泌 尿 、医 学 影 像 ( 核 医 学 ) 小 儿 内 分 泌 、小 儿 肾 病 、小 儿 心 脏 病 、小 儿 呼 吸 、小 儿 中 医 、小 儿 血 液 病 、小 儿 神 经 病 学 、小 儿 皮 肤 专 业 消 化 、肝 病 、感 染 、艾 滋 病 、中 医 肝 病 内 分 泌 、心 血 管 、骨 科 、口 腔 呼 吸 、烧 伤 整 形 、骨 科 消 化 、神 经 内 科 、肝 病 、内 分 泌 、肿 瘤 、心 血 管 、呼 吸 口腔 肿 瘤 、心 血 管 、消 化 、内 分 泌 、皮 肤 、血 液 、免 疫 、神 经 、呼 吸 、抗 感 染 、肾 病 、放 射 、创 伤 、泌 尿 、妇 产 及 生 育 调 节 、耳 鼻 喉 呼 吸 、皮 肤 抗 辐 射 、抗 毒 、肿 瘤 及 肿 瘤 镇 痛 、戒 毒 、血 液 肿 瘤 、心 血 管 、呼 吸 、神 经 内 科 、妇 产 、普 通 外 科 专 业 呼 吸 、内 分 泌 、心 血 管 、神 经 内 科 中 医 心 血 管 、中 医 呼 吸 、中 医 消 化 、中 医 肾 病 、中 医 肿 瘤 、中 医 皮 肤 、中 医 脑 血 管 、中 医 外 科 、中 医 妇 科 、中 医 肛 肠 、中 医 骨 科
药物临床试验机构管理规定

药物临床试验机构管理规定(征求意见稿)第一章总则第一条为加强药物临床试验机构的监督管理,根据《人民国药品管理法》和《人民国药品管理法实施条例》,按照《药物临床试验质量管理规》(GCP)和《药品注册管理办法》等有关要求,制定本规定。
第二条药物临床试验机构是指资格认定管理部门依照法定要求认定的,具有承担药物临床试验资格的机构。
药物临床试验专业(简称“试验专业”)是指药物临床试验机构过药物临床试验资格认定的专业。
第三条经食品药品监督管理总局(简称“食品药品监管总局”)批准的药物临床试验,须在具有药物临床试验资格的机构中进行。
第四条本规定适用于药物临床试验机构的资格认定、运行管理、监督检查、定期评估和现场检查等。
第二章资格认定第五条药物临床试验机构资格认定(简称“资格认定”)是指资格认定管理部门对申请承担药物临床试验的医疗机构所具备的药物临床试验条件,包括药物临床试验的组织管理、研究人员、设备设施、管理制度、标准操作规程等进行系统评价,作出其是否具有承担药物临床试验资格决定的过程。
第六条申请资格认定的医疗机构应具备以下条件:(一)已取得医疗机构执业可;(二)具有与承担药物临床试验相适应的诊疗技术能力;(三)具有急危重症诊疗的设施设备、人员配备与处置能力;(四)具有承担药物临床试验的组织管理机构和人员;(五)具有与药物临床试验相适应的独立的办公场所、临床试验用药房、资料室及必要的设备设施;(六)具有与药物临床试验相适应的医技科室;(七)具有药物临床试验管理制度和标准操作规程;(八)具有防和处理药物临床试验中突发事件的管理机制和措施;(九)具有经过药物临床试验技术与相关法规的培训、能够承担药物临床试验的研究人员;(十)申请资格认定的专业近三年按照GCP要求开展过上市后药品的临床研究,具有与承担药物临床试验相适应的床位数和受试者人数;(十一)具有能够承担药物临床试验伦理审查任务的伦理委员会。
第七条申请资格认定的医疗机构,应根据所具备的药物临床试验的条件和专业特长,结合开展药物临床试验的实际需求,申请相应的试验专业资格认定。
药物临床试验机构管理的标准与操作指南

药物临床试验机构管理的标准与操作指南编者按科技在发展,时代在进步,无数科技成果的取得无不经历了科学的方案设计、严谨实验过程、真实细致完整准确的实验记录.在今天,用事实说话、数据说话已经成为科学界乃至全球各领域达成的共识。
我们经历20多年的药物临床试验研究与监管的实践,国家法律强制执行《药物临床试验质量管理规范》亦已十余载。
自从2004年资格认定启动迄今,400余家获得药物临床试验资格的机构,其药物临床试验技术水平、运行规范状况及临床试验质量管理等方面的发展极不平衡,仍有不少机构在药物临床试验过程中低级错误频发,表明我们的机构管理模式和机制均存在诸多问题。
面对如此严峻的形势,国内药物临床试验机构发展方向应怎么走?怎样缩小与国外研究水平的差距?是摆在我们面前的亟待解决的难题。
我国从事药物临床试验的资深丏家熊宁宁、洪明晃、熊玉卿、修清玉等教授在CFDA的领导下,依据我国法规政策和国际相关指南,结合我国药物临床试验的具体情况,研究撰写了《药物临床试验机构管理的标准与操作指南,3.7版,》,为我们从事药物临床试验管理工作的同行们提出了一个值得关注的指引,现将其发布,供各机构共同探讨,献计献策,使其成为符合国际临床研究规范、可执行的中国药物临床试验的行业标准、业界指南。
----曹彩为规范药物临床试验机构的管理,提高药物临床试验的研究和管理水平,依据国家食品药品监督管理局(SFDA)《药物临床试验质量管理规范》(GCP)和《药物临床试验机构资格认定办法(试行)》等法规和有关规定,制定本指南。
药物临床试验机构是指通过SFDA“药物临床试验机构资格认定”的医疗机构。
具备药物临床试验机构资格的医疗机构,可以在认定专业范围内承担申请注册的药物、医疗器械的临床试验工作。
药物临床试验机构的建设与管理须遵循本指南,并接受药品监督管理部门的监督管理。
第一章医疗机构一、组织管理体系标准,医疗机构依据法律、法规、政策和指南,建立药物临床试验平台,建立药物临床试验机构管理的组织架构,保证本机构医疗与研究的条件和能力符合药物临床试验机构资格认定的要求。
基地目录——2009年4月13日

国家食品药品监督管理局药物临床试验机构资格认定公告(第19号)国食药监注[2009]56号2009年2月3日发表根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定中国人民解放军总医院等7家医疗机构具有药物临床试验机构资格,并予以颁发证书。
特此公告。
附件:具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局二○○九年二月三日附件:具备药物临床试验机构资格的医疗机构及认定专业医疗机构名称认定专业证书编号中国人民解放军总医院中医心血管、儿科肿瘤、麻醉、普通外科、肿瘤、心血管、内分泌、皮肤、血液、免疫、神经内科、创伤、泌尿、呼吸、妇产、耳鼻咽喉、肾病、医学影像(诊断)0230甘肃省肿瘤医院肿瘤0231 山西省中医院中医内分泌、中医妇产、中医肿瘤、中医肝病、中医呼吸、中医心血管、中医消化、中医肾病0232山西医科大学第二医院心血管、呼吸、血液、肾病、神经内科、骨科、泌尿、普通外科、妇产、耳鼻咽喉、麻醉0233湖南省人民医院普通外科、肝胆外科、骨科、泌尿外科、耳鼻咽喉头颈外科、心血管、消化、呼吸、神经内科、肾脏内科、儿科呼吸、妇产0234宁夏医科大学附属医院呼吸、心血管、消化、肿瘤 0235北京大学第三医院骨科、运动医学、普通外科、眼科、内分泌、肾病、泌尿、皮肤、儿科呼吸、儿科消化、医学影像(诊断、治疗)、心血管、呼吸、消化、神经内科、妇产、血液、肿瘤0236国家食品药品监督管理局药物临床试验机构资格认定公告(第18号)国食药监注[2009]52号2009年01月22日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定南京市第二医院等8家医疗机构具有药物临床试验机构资格,并予以颁发证书。
特此公告。
附件:具备药物临床试验机构资格的医疗机构及认定专业国家食品药品监督管理局二○○九年一月二十二日附件:具备药物临床试验机构资格的医疗机构及认定专业医疗机构名称认定专业证书编号南京市第二医院肝病、感染 0222中山大学附属第二医院心血管、内分泌、消化、皮肤、妇产、骨科、呼吸、神经内科、医学影像(诊断)0223首都医科大学附属北京安定医院精神、戒毒 0224山西医科大学第一医院呼吸、内分泌、皮肤、耳鼻咽喉、精神、神经内科、消化、中医消化、医学影像(核医学)、血液、风湿免疫、感染0225上海市中医医院中医肿瘤、中医消化、中医心血管、中医骨伤、中医肛肠、中医呼吸、中医血液0226吉林大学第一医院神经内科、消化、肿瘤、感染、骨科、心血管、泌尿、妇产、肾病、心脏大血管外科、眼科、小儿呼吸、小儿神经内科、小儿消化、小儿心血管0227上海中医药大学附属龙华医院中医肿瘤、中医外科、中医泌尿、中医风湿、中医肛肠、中医骨伤、中医呼吸、中医神经内科、中医肾病、中医内分泌(中医糖尿病)、中医消化、中医心血管0228西藏自治区人民医院高原病、心血管、消化 0229 国家食品药品监督管理局药物临床试验机构资格认定公告(第17号)国食药监安[2008]519号2008年09月17日发布根据《中华人民共和国药品管理法》和《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,认定安徽省立医院等11家医疗机构具有药物临床试验机构资格,并予以颁发证书。
药物临床试验机构管理规定

药物临床试验机构管理规定(征求意见稿)第一章总则第一条为加强药物临床试验机构的监督管理,根据《中华人民共和国药品管理法》和《中华人民共和国药品管理法实施条例》,按照《药物临床试验质量管理规范》(GCP)和《药品注册管理办法》等有关要求,制定本规定。
第二条药物临床试验机构是指资格认定管理部门依照法定要求认定的,具有承担药物临床试验资格的机构.药物临床试验专业(简称“试验专业”)是指药物临床试验机构中通过药物临床试验资格认定的专业。
第三条经国家食品药品监督管理总局(简称“食品药品监管总局")批准的药物临床试验,须在具有药物临床试验资格的机构中进行.第四条本规定适用于药物临床试验机构的资格认定、运行管理、监督检查、定期评估和现场检查等.第二章资格认定第五条药物临床试验机构资格认定(简称“资格认定")是指资格认定管理部门对申请承担药物临床试验的医疗机构所具备的药物临床试验条件,包括药物临床试验的组织管理、研究人员、设备设施、管理制度、标准操作规程等进行系统评价,作出其是否具有承担药物临床试验资格决定的过程.第六条申请资格认定的医疗机构应具备以下条件:(一)已取得医疗机构执业许可;(二)具有与承担药物临床试验相适应的诊疗技术能力;(三)具有急危重症诊疗的设施设备、人员配备与处置能力;(四)具有承担药物临床试验的组织管理机构和人员;(五)具有与药物临床试验相适应的独立的办公场所、临床试验用药房、资料室及必要的设备设施;(六)具有与药物临床试验相适应的医技科室;(七)具有药物临床试验管理制度和标准操作规程;(八)具有防范和处理药物临床试验中突发事件的管理机制和措施;(九)具有经过药物临床试验技术与相关法规的培训、能够承担药物临床试验的研究人员;(十)申请资格认定的专业近三年按照GCP要求开展过上市后药品的临床研究,具有与承担药物临床试验相适应的床位数和受试者人数;(十一)具有能够承担药物临床试验伦理审查任务的伦理委员会。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
639
江西
江西省妇幼保健院
妇科肿瘤、妇科、产科、生殖健康、辅助生殖(不孕)、中医妇产
640
江西
南昌市洪都中医院
针灸、骨科、内分泌、神经内科、心血管内科
641
江西
南昌大学第四附属医院
消化内科、呼吸内科、神经内科、肿瘤、心血管内科
642
江西
九江学院附属医院
神经内科、皮肤病、呼吸内科、肾病、内分泌、泌尿外科、肿瘤、消化内科
肿瘤、肾病、心血管内科
588
河北
秦皇岛市第一医院
内分泌、肿瘤、心血管内科、呼吸内科、消化内科、普通外科、妇科、肾病
589
河北
秦皇岛市中医医院
内分泌科、心血管
590
河北
秦皇岛市第二医院
神经内科、普通外科、心血管内科
591
河北
沧州市人民医院
内分泌、重症医学、神经内科、消化内科、胸外科、肿瘤、心血管内科、肾病、呼吸内科
665
河南
郑州市中心医院
耳鼻咽喉、妇产、骨科、呼吸内科、介入放射、口腔颌面外科、免疫、麻醉 、泌尿外科、内分泌、普通外科、神经内科、消化内科、血液内科、心血管内科、胸外科、眼科、肿瘤、中医内科、皮肤病
666
河南
郑州市第七人民医院(郑州市心血管病医院)
心血管内科、心脏大血管外科、泌尿外科、小儿呼吸、神经内科
623
江苏
南京医科大学眼科医院
眼科
624
江苏
淮安市第二人民医院
肾病、血液内科、消化内科、神经内科、呼吸内科、内分泌、骨科、肿瘤(内科)、普通外科、老年病(老年心血管、老年内分泌、老年呼吸)
625
浙江
衢州市人民医院
重症医学、消化内科、心血管内科、肿瘤、神经内科、普通外科
626
浙江
丽水市中心医院
心血管内科、医学影像、神经内科、血液内科、肾病、消化内科、传染科、肿瘤、呼吸内科、普通外科、眼科、骨科
599
辽宁
锦州市中心医院
心血管内科、神经内科、内分泌、免疫、呼吸内科、肿瘤、眼科
600
辽宁
沈阳市第四人民医院
眼科、心血管内科
601
辽宁
沈阳市骨科医院
骨科、中医骨伤
602
辽宁
大连市中心医院
心血管内科、肾内科、内分泌、神经内科、呼吸内科、消化内科、耳鼻咽喉、肿瘤内科
603
吉林
吉林市人民医院
心血管内科、内分泌、肾病、神经内科、消化内科、呼吸内科、肿瘤
湖南
爱尔眼科医院集团股份有限公司长沙爱尔眼科医院
眼科
678
湖南
湖南省妇幼保健院
中医妇科、妇科、产科、小儿呼吸、麻醉
679
湖南
湖南医药学院第一附属医院(原怀化市第三人民医院)
心血管内科、神经内科、呼吸内科、眼科
680
湖南
娄底市中心医院
骨科、心血管内科、血液内科、肿瘤、消化内科
681
湖南
邵阳市中心医院
心血管内科、神经内科、肿瘤、感染科肝炎
607
黑龙江
佳木斯市肿瘤医院、佳木斯市结核病防治院
肿瘤、结核病
608
黑龙江
齐齐哈尔市第一医院
神经内科、心血管内科、呼吸内科、内分泌、肾病、风湿病
609
黑龙江
齐齐哈尔医学院附属第三医院
消化内科、呼吸内科、神经内科、心血管内科、肿瘤、骨科
610
上海
上海交通大学医学院附属瑞金医院卢湾分院
心血管内科、麻醉、泌尿外科
584
河北
河北大学附属医院
心血管内科、消化内科、神经内科、呼吸内科、肾病、肿瘤、骨科、泌尿外科、神经外科、妇科
585
河北
邯郸市中心医院
神经内科、心血管内科、小儿神经病、内分泌、呼吸内科、肿瘤、消化内科
586
河北
邯郸市第一医院
神经内科、心血管、血液内科、内分泌、肿瘤内科、呼吸内科
587
河北
邢台医学高等专科学校第二附属医院
615
上海
上海市第七人民医院
心血管内科、神经内科、普通外科、中医内科(肾病)、中医骨伤科、泌尿外科、妇产
616
上海
上海市浦东新区公利医院
内分泌、肿瘤、心血管内科、神经内科、呼吸内科、消化内科、妇科、耳鼻咽喉、泌尿外科
617
上海
上海市浦东医院
普通外科、骨科、心血管内科、内分泌科、消化内科、呼吸内科、妇产、肿瘤、神经内科、肾病
658
河南
洛阳市中心医院
心血管内科、神经内科、呼吸内科、消化内科、内分泌、免疫、肿瘤、感染性疾病
659
河南
河南科技大学第一附属医院
肿瘤、心血管内科、呼吸内科、内分泌、神经内科、神经外科、血液内科、烧伤
660
河南
洛阳市第一人民医院
心血管内科、神经内科、消化内科、普通外科、眼科、妇科、耳鼻咽喉
661
河南
山东
胜利油田中心医院
心血管内科、神经内科、消化内科、血液内科、皮肤、麻醉
655
山东
潍坊市人民医院
血液内科、骨科、肿瘤、神经内科、内分泌、肾病、消化内科
656
山东
淄博市中心医院
重症医学、消化内科、呼吸内科、内分泌、心血管内科、神经外科、血液内科、耳鼻咽喉
657
河南
郑州市第一人民医院
烧伤、神经内科、消化内科、呼吸内科、内分泌、肿瘤、心血管内科、妇产、骨科、小儿呼吸
中医神经内科、中医骨伤、中医消化、中医心血管、中医肾病、中医儿科、中医妇产、中医呼吸、中医肛肠、中医外科
621
江苏
泰州市人民医院
心血管内科、消化内科、神经内科、呼吸内科、内分泌、免疫、骨科、神经外科、烧伤、肿瘤(内科)、妇科、麻醉、传染、耳鼻咽喉、重症医学
622
江苏
徐州矿务集团总医院
神经内科、呼吸内科、心血管内科、肿瘤(内科)、内分泌、普通外科、骨科
577
北京
首都医科大学附属北京潞河医院
呼吸内科、消化内科、神经内科、心血管内科、血液内科、内分泌、骨科、产科、妇科、肿瘤、普通外科
578
北京
北京市房山区中医医院
中医心血管、中医内分泌、中医神经内科、中医呼吸、中医消化、中医肾病、中医肿瘤
579
北京
北京市平谷区医院
心血管内科、呼吸内科、内分泌、骨科
580
631
浙江
湖州市第三人民医院
精神病、免疫
632
浙江
温州市中医院
中医(妇科)、中医[感染科(肝病)]、中医(骨伤)、中医(消化内科)、中医(肾内科)、中医(肿瘤内科)、中医(呼吸内科)、中医(内分泌)、中医(神经内科)、中医(心血管内科)、中医(老年病)
633
浙江
杭州市第七人民医院
精神病
634
安徽
安徽省肿瘤医院
627
浙江
湖州市中心医院
呼吸内科、感染、心血管内科、消化内科、内分泌、肿瘤
628
浙江
宁波市康宁医院
精神卫生
629
浙江
绍兴市人民医院
心血管内科、呼吸内科、血液内科、肿瘤、内分泌、骨科、泌尿外科、普通外科、麻醉
630
浙江
浙江省新华医院
呼吸内科、心血管内科、神经内科、消化内科、内分泌、免疫、骨科、泌尿外科
682
湖南
邵阳学院附属第一医院(邵阳市第一人民医院)
儿科(呼吸方向)、普外科
683
湖南
湘潭市第一人民医院
神经内科、内分泌、肿瘤、呼吸内科、耳鼻咽喉、骨科
684
湖南
湘雅博爱康复医院
康复医学(神经康复)
685
广东
江门市五邑中医院
中医心血管、中医神经内科、中医肾病、中医消化、中医妇科
686
广东
广州市番禺区中心医院(广州市番禺区人民医院)
618
上海
上海市同仁医院(上海市长宁区中心医院)
呼吸内科、心血管内科、肝炎(传染科)、普外科、消化内科、肿瘤、内分泌、肾病、血液内科、医学影像(CT诊断、磁共振成像诊断)
619
上海
上海市中西医结合医院
中医外科、中医内科(脑病)、中医骨伤、泌尿外科、内分泌、心血管内科、消化内科、呼吸内科
620
江苏
泰州市中医院
611
上海
上海市第一妇婴保健院
妇科、产科、计划生育、生殖健康与不孕症、麻醉
612
上海
上海市浦东新区人民医院
神经内科、呼吸内科、内分泌、心血管内科、妇科
613
上海
上海市浦东新区周浦医院
心血管内科、骨科、神经内科、呼吸内科、普通外科、妇产
614
上海
上海市静安区闸北中心医院(上海市闸北区中心医院)
血液内科、肾病、骨伤
672
湖北
武汉市第五医院
肿瘤、心血管内科、肾病、重症医学、妇科
673
湖北
武汉市普仁医院
消化内科、内分泌、心血管内科、肿瘤、普通外科、眼科
674
湖北
咸宁市中心医院
呼吸内科、普通外科、消化内科
675
湖北
襄阳市第一人民医院
神经内科、心血管内科、肿瘤、骨科、消化内科、麻醉
676
湖北
武汉爱尔眼科医院
眼科
677
604
吉林
梅河口市中心医院(爱民医院)
中医科、麻醉、消化内科、呼吸内科、内分泌、肾病、心血管内科、肿瘤、神经内科、普通外科、骨科、传染
605
吉林
吉林省神经精神病医院
精神科、神经内科
606பைடு நூலகம்
黑龙江
