草酸标准溶液的配制及标定
草酸溶液

草酸标准溶液的配制及标定简介:乙草酸又称乙二酸,是最简单的有机二元酸之一,分子式为HC2O4,分子量为290.04。
Leagene草酸水溶液(1%)主要由草酸、去离子水组成。
属于弱酸,常用于漂白组织切片,是一种非常重要的辅助试剂。
一、配制:1、0.1 mol/L草酸标准溶液 : 称取6.4g草酸,溶于1000ml水中,混匀。
2、仪器:量筒,三角瓶,烧杯,试管,酸式滴定管,天平,玻璃棒,容量瓶,PH试纸。
二、标定:1、原理:KMnO4 + 3H2SO4 + 5H2C2O4→ 2MnSO4 + 10CO2↑ + 8H2O2、标定过程:准确量取20ml草酸溶液加到250ml三角瓶中,再加100ml含有8ml H2SO4的水溶液。
用C (1/5KMnO4)= 0.1mol/L高锰酸钾标准溶液滴定近终点时,加热至70℃,继续滴定至溶液呈粉红色,保持30秒不褪色为终点。
同时做空白试验。
3、计算;(V1-V2)×C1 C(1/2C2H2O4)= V式中:C1-高锰酸钾标准溶液摩尔浓度, mol/L;V1-滴定消耗高锰酸钾用量数, ml;V2 -空白试验高锰酸钾用量数, ml;V-吸取草酸溶液数, ml三、配制标准草酸溶液(0.1mol·L-1)用天平准确称取3.0~3.3g草酸(C2H2O4·2H2O),倒入小烧杯中,加少量蒸馏水溶解(若一次加水不能溶解,先将上部溶液转入容量瓶中,再加少量水溶解,直至草酸全部溶解。
注意溶解草酸用水总量应控制在150mL以内)。
溶液转入250mL容量瓶中,烧杯用少量蒸馏水洗,洗涤液转入容量瓶中,共需洗涤3~4次。
加蒸馏水至容量瓶的刻度线,摇匀。
四、注意事项:1、密闭保存,放置阴凉处,防止阳光直射。
2、一旦开启尽快用完,因为其有效成分易挥发。
3、为了您的安全和健康,请穿实验服(口罩等)并戴一次性手套操作。
4、操作时防止水溶液受热。
5、反应开始时速度很慢,为了加速反应,须将溶液温度加热至70℃左右,不可太高,否则将引起C2H2O4的分解: H2C2O4→ CO↑ + CO2↑ + H2O6 .溶液有效期一个月。
草酸标准溶液的配制及标定

草酸标准溶液的配制及标定
草酸标准溶液的配制及标定
⼀、配制:
0.1 mol/L草酸标准溶液 : 称取6.4g草酸,溶于1000ml⽔中,混匀。
⼆、标定:
1、原理:
KMnO4 + 3H2SO4 + 5H2C2O4 → 2MnSO4 + 10CO2↑ + 8H2O
2、标定过程:
准确量取20ml草酸溶液加到250ml三⾓瓶中,再加100ml含有8ml H2SO4的⽔溶液。
⽤C (1/5KMnO4)= 0.1mol/L⾼锰酸钾标准溶液滴定近终点时,加热⾄70℃,继续滴定⾄溶液呈粉红⾊,保持30秒不褪⾊为终点。
同时做空⽩试验。
3、计算;(V1-V2)×C1 C(1/2C2H2O4)= V
式中:
C1-⾼锰酸钾标准溶液摩尔浓度, mol/L;V1-滴定消耗⾼锰酸钾⽤量数, ml;V2 -空⽩试验⾼锰酸钾⽤量数, ml;V-吸取草酸溶液数, ml
4、注意事项:
(1)反应开始时速度很慢,为了加速反应,须将溶液温度加热⾄70℃左右,不可太⾼,否则将引起H2C2O4的分解:
H2C2O4 → CO↑ + CO2 ↑ + H2O
(2)溶液有效期⼀个⽉。
1.配制标准草酸溶液(0.1mol·L-1)
⽤天平准确称取3.0~3.3g草酸(H2C2O4·2H2O),倒⼊⼩烧杯中,加少量蒸馏⽔溶解(若⼀次加⽔不能溶解,先将上部溶液转⼊容量瓶中,再加少量⽔溶解,直⾄草酸全部溶解。
注意溶解草酸⽤⽔总量应控制在150mL以内)。
溶液转⼊250mL容量瓶中,烧杯⽤少量蒸馏⽔洗,洗涤液转⼊容量瓶中,共需洗涤3~4次。
加蒸馏⽔⾄容量瓶的刻度线,摇匀。
标准溶液的配置及标定方法

标准溶液的配置及标定方法1、0.1moL/L 氢氧化钠的配制及标定(1) 配制:将氢氧化钠配制成饱和溶液(约为52%),贮存于乙烯塑料瓶内,密闭放置数日,使碳酸钠沉淀。
小心吸取8.2mL上清液,加无二氧化碳的纯水稀释为1000mL。
(2)标定:准确称取0.5~0.6g于105~110℃烘干至恒重的基准邻苯二甲酸氢钾,共称三份。
分别置于250mL三角瓶内,加入不含二氧化碳的纯水使邻苯二甲酸氢钾溶解。
加2滴1%酚酞指示剂溶液,用0.1moL/L氢氧化钠溶液滴定至溶液显淡粉红色,即到终点。
同时作空白。
按下式计算氢氧化钠溶液的准确浓度:C=m×1000/(V-V)×204.22 21式中:C-----氢氧化钠溶液的浓度,moL/L;m----邻苯二甲酸氢钾质量,g;V----滴定邻苯二甲酸氢钾氢氧化钠用量,mL;1V----空白试验氢氧化钠用量,mL;2204.22--邻苯二甲酸氢钾的式量。
(3)贮存于塑料瓶中,如需要其它浓度的氢氧化钠溶液,可取浓氢氧化钠溶液照上法稀释后标定,或直接以0.1moL/L标准溶液稀释即得。
2、0.1moL/L盐酸标准溶液配制及标定(1)配制:量取9mL浓盐酸,用纯水稀释为1000mL,混匀。
此溶液的浓度为0.1moL/L。
(2)标定:准确称取0.15~0.2g于270~300℃灼烧至恒重的基准无水碳酸钠。
共称三份,分别于250mL三角烧瓶中,各加50mL纯水使之溶解,加1~2滴甲基橙指示剂,用上述盐酸滴定至溶液由黄色变为橙色。
同时作空白试验。
按下式计算HCL溶液的准确浓度:C= 2m×1000/(V-V)*M21 1式中:C-----盐酸溶液的浓度,moL/L;m---无水碳酸钠的质量,g;V---滴定碳酸钠消耗的盐酸溶液体积,mL;1V---空白试验消耗盐酸的体积,mL;2M(106.0)--碳酸钠的式量。
3、0.02moL/L乙二胺四乙酸二钠标准溶液配制及标定(1)配制:称取7.5g乙二胺四乙酸二钠(即EDTA—2Na),溶于纯水中,并稀释为1000mL,摇匀即得。
标准溶液的配制和标定方法

标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.313mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取 120gNaOH,溶于 100mL无 CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无 CO2的水稀释至1000mL,摇匀。
C(NaOH), mol/L NaOH饱和溶液, mL1560.5280.31317.5280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于 105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至 0.0001 g ,溶于下列规定体积的无 CO2的水中,加 2 滴酚酞指示液( 10 g/L ),用配制好的 NaOH溶液滴定至溶液呈粉红色并保持 30S。
同时做空白试验。
C(NaOH),mol/L基准邻苯二甲酸氢钾 ,g无 CO水 ,mL21 6.0800.5 3.0800.313 1.878800.10.6802.计算:氢氧化钠标准溶液浓度按下式计算:MC( NaOH)= ------------------------(V—V0)× 0.2042式中: C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L ;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042 ——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol 。
二、盐酸标准溶液的配制和标定(依据国标 GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL 水中,摇匀。
草酸标准溶液的配制及标定

草酸标准溶液的配制及标定草酸标准溶液的配制和标定是化学分析中常用的操作之一,以下是具体的步骤:一、草酸标准溶液的配制1.准备所需试剂:草酸、碳酸钠、溴酚蓝指示剂、甲基橙指示剂、氢氧化钠、酚酞指示剂、乙醇、冰乙酸等。
2.将草酸溶解在乙醇中,配制成一定浓度的草酸溶液。
3.按照所需的浓度计算出草酸溶液的体积,并加入适量的碳酸钠,使其完全溶解。
4.加入适量的溴酚蓝指示剂和甲基橙指示剂,使其显色。
5.将配制好的草酸标准溶液转移至容量瓶中,并加入适量的酚酞指示剂和乙醇,使其显色。
6.用胶头滴管逐滴加入氢氧化钠溶液,直至颜色变化,记录此时氢氧化钠的体积。
7.重复上述步骤,至少进行三次实验,以得到平均值。
8.根据实验结果计算出草酸标准溶液的浓度。
二、草酸标准溶液的标定1.准备所需试剂:草酸标准溶液、酚酞指示剂、氢氧化钠、乙醇等。
2.取适量草酸标准溶液于三角瓶中,加入适量酚酞指示剂,摇匀。
3.用氢氧化钠滴定上述溶液,直至颜色变化,记录此时氢氧化钠的体积。
4.重复上述步骤,至少进行三次实验,以得到平均值。
5.根据实验结果计算出草酸标准溶液的浓度。
三、注意事项1.在配制草酸标准溶液时,需使用精确的计量仪器和合适的溶剂,以保证配制出的溶液浓度准确。
2.在标定草酸标准溶液时,需使用合适的指示剂和滴定管,控制滴定的速度和反应终点,以保证标定结果的准确性。
3.实验操作过程中要注意安全,避免试剂对皮肤和眼睛的接触。
如有意外情况发生,应立即停止实验并寻求帮助。
4.实验结束后要及时清理实验现场,将废液倒入指定的废液收集容器中,以免对环境和人员造成危害。
5.对于实验结果要进行分析和判断,如发现异常数据或误差较大时,应重新进行实验或对实验条件进行检查,以确保实验结果的可靠性。
6.在实验过程中要注意记录实验数据和操作步骤,以便后续查阅和审核。
7.在使用实验仪器和试剂时要注意保养和维护,以保证其性能和使用寿命。
8.在实验过程中要遵守实验室规定和操作规程,不得随意更改实验条件和操作步骤。
实验二 酸碱标准溶液的配制与标定

实验二酸碱标准溶液的配制与标定一、实验目的:1.掌握间接法配制HCl、NaOH标准溶液的方法。
2. 熟练掌握差减称量法称取基准物的方法及滴定操作基本技能。
3.学习酸碱标准溶液的标定方法。
二、实验原理:在酸碱滴定法中,常用到盐酸或氢氧化钠标准溶液,它们都不宜直接配制,因为浓盐酸易挥发,浓度和纯度不一,固体氢氧化钠中常因吸收空气中的二氧化碳和水蒸气,而含有碳酸钠和水分,因此,只能先将它们配制成近似浓度的溶液。
然后通过标定来确定它们的准确浓度。
1.标定盐酸的基准物质:硼砂Na2B4O7·10H2O和无水碳酸钠Na2CO3。
(1)硼砂(四硼酸钠,Na2B4O7·10H2O):易制得纯品,不易吸水,性质比较稳定,而且摩尔质量较大(381.37g/mol),称量误差小,是标定HCl溶液常用的基准物质,但硼砂易风化失水,需保存在相对湿度为60%密闭容器中。
1︰2反应,其标定反应为:Na2B4O7·10H2O + 2HCI =2NaCI + 4H3BO3 + 5H2O 在化学计量点时,由于生成的硼酸是弱酸,溶液pH=5.1,可用甲基橙作指示剂。
(2)无水碳酸钠(Na2CO3):容易制得纯品,摩尔质量为105.99g/mol,但易吸湿,使用前应在3000C干燥1小时,保存在干燥器中,用时称量要快,以免吸水而引入误差。
1︰2反应,其标定反应为:Na2CO3 + 2HCI =2NaCI + CO2+ H2O计量点时,溶液pH =3.9,可用甲基红作指示剂。
本实验采用的方法是:称取硼砂后直接用盐酸滴定的方法进行操作,根据所称硼砂的质量和滴定所用盐酸溶液的体积,求出盐酸溶液的准确浓度。
2.标定氢氧化钠的基准物质:邻苯二甲酸氢钾和草酸。
(1)邻苯二甲酸氢钾(KHC8H4O4):易制得纯品,在空气中不吸水,易保存,且摩尔质量较大(204.23g/mol),称量误差小,是标定NaOH溶液较为理想的基准物质。
草酸的测定

草酸的测定1.适用范围适用于工业草酸的测定。
2 测试方法2.1 草酸含量的测定2.1.1 原理草酸是一种弱酸,可用NaOH标准溶液滴定,选择酚酞为指示剂。
反应过程如下:H2C2O4+2NaOH→Na2C2O4+2H2O2.1.2 试剂2.1.2.1 NaOH标准溶液:0.1mol/L。
2.1.2.1.1配制:称取约4.2g分析纯氢氧化钠于已装有200mL刚煮沸而冷却的蒸馏水中,搅拌溶解后,用刚煮沸的蒸馏水稀至1000mL。
2.1.2.1.2标定:精确称取已于125℃烘至恒重的邻苯二甲酸氢钾约0.5g,溶于100mL蒸馏水中,加1%酚酞指示剂1~2滴,用待标的氢氧化钠溶液滴至微红色为终点。
氢氧化钠的浓度(mol/L)按下式计算:氢氧化钠(mol/L)=gV×0.20423 (1)式中:g——邻苯二甲酸氢钾的质量,g;V——滴定消耗氢氧化钠标准溶液的体积,mL;0.20423——与0.001 mol/L氢氧化钠相当的以克表示的邻苯二甲酸氢钾的质量。
2.1.2.2酚酞指示剂:1%乙醇溶液。
2.1.3 分析步骤准确称取样品约2.5g,置于250mL容量瓶中,加水溶解并稀释至刻度。
吸取25.00ml于250mL的三角瓶中,加酚酞指示剂2滴,用0.1mol/LNaOH 标准溶液滴定至溶液呈微红色。
2.1.4 计算草酸(H2C2O4)含量%(X)按下式计算:X% = cV×0.06304×250m×25×100 (2)式中:c——NaOH标准溶液的摩尔浓度,mol/L;V——滴定时消耗NaOH标准溶液的的体积,mL;0.06304——与0.001mol/LNaOH相当的以克表示的草酸的质量;m——样品重量,g。
草酸标准溶液的配制及标定

草酸标准溶液的配制及标定
、配制:
0.1 mol/L草酸标准溶液
称取6.4g草酸,溶于1000ml水中,混匀
1、原理:
KMnO4 + 3H2SO4 + 5H2C2O4 —2MnSO4 + IOCO2 f+ 8H2O
2、标定过程:
准确量取20ml草酸溶液加到250ml三角瓶中,再加100ml含有8ml
H2SO4的水溶液。
用C(i/5KMno 4)= 0.1mol/L咼锰酸钾标准溶液滴定近
终点时,加热至70 C,继续滴定至溶液呈粉红色,保持30秒不褪色为终点。
同时做空白试验。
3、计算:
(V i—V2)x C i
C( 1/2C2H2O4)= -------------------------------------------
V
式中:
C l —高锰酸钾标准溶液摩尔浓度,mol/L ;
V i—滴定消耗高锰酸钾用量数,ml;
V2 —空白试验高锰酸钾用量数,ml;
V—吸取草酸溶液数,ml。
4、注意事项:
(1)反应开始时速度很慢,为了加速反应,须将溶液温度加热至70C左右,不可太高,否则将引起H2C2O4的分解:
H2C2O4 T COf + CO 2 f+ H2O
(2)溶液有效期一个月。
三、方法来源:
本方法参考国家标准(GB601-77)方法制订。
KMnO4标准溶液的配制与标定和石灰石中钙的含量测定

KMnO4标准溶液的配制与标定和石灰石中钙的含量测定吴凡指导吴明君教授(四川农业大学生命科学与理学院,四川雅安,625014)摘要本次实验用间接滴定法测定石灰石中的钙含量。
了解高锰酸钾标准溶液的配制方法和保存条件,用Na2C2O4为基准物进行标定高锰酸钾标准溶液的原理以及间接滴定法测定物质中组分含量,以KMnO4自身为指示剂,测得KMnO4标准溶液的浓度为(0.02268±0.00002)mol•L-1。
然后用已标定的KMnO4标准溶液来滴定处理过后的石灰石。
测得石灰石中的钙含量为((37.94±0.38) )%,标准偏差为0.0030.关键词间接滴定法;KMnO4标准溶液;Na2C2O4基准物;石灰石中的钙含量KMnO4 standard solution and the determination of the calcium content in the calibration and limestoneWu FanSichuan Agricultural UniversityAbstractThe experimental determination of the amount of calcium in the limestone indirect titration. Understand the method of preparation and storage conditions of the standard solution of potassium permanganate, with Na2C2O4 standard reference material calibration potassium permanganate solution principle as well as indirect titration material component content, KMnO4 itself as indicator measured KMnO4 the concentration of the standard solution (0.02268 ± 0.00002) mol • L-1. Then titrated KMnO4 standard solution calibration limestone after treatment. Measured the calcium content of the limestone ((37.94 ± 0.38)), a standard deviation of 0.0030.前言天然石灰石是工业生产中重要的原材料之一,它的主要成分是CaC2O4,此外还含有SiO2,Fe2O3,Al2O3及MgO杂质。
标准溶液的配置及标定方法

标准溶液的配置及标走方法Is O.lmoL/L氢氧化钠的配制及标定⑴配制:将氢氧化钠配制成饱和溶液(约为52% ),贮存于乙烯塑料瓶内,密闭放置数日,使碳酸钠沉淀。
小心吸取8.2mL上清液,加无二氧化碳的纯水稀释为lOOOmL。
(2)标定:准确称取0.5 ~ 0.6g于105 ~ 110°C烘干至恒重的基准邻苯二甲酸氢钾,共称三份。
分别置于250mL三角瓶内,加入不含二氧化碳的纯水使邻苯二甲酸氢钾溶解。
加2滴1%酚酎指示剂溶液,用0.1moL/L氢氧化钠溶液滴定至溶液显淡粉红色即到终点。
同时作空白。
按下式计算氢氧化钠溶液的准确浓度:C=mx 1000/(V-V)x 204.22 21式中:C氢氧化钠溶液的浓度,moL/L ;m---邻苯二甲酸氢钾质量,g ;V——滴定邻苯二甲酸氢钾氢氧化钠用量,mL ;1 V-…空白试验氢氧化钠用量,mL ; 2 204.22—邻苯二甲酸氢钾的式量。
(3 )贮存于塑料瓶中,如需要其它浓度的氢氧化钠溶液,可取浓氢氧化钠溶液照上法稀释后标定,或直接以O.lmoL/L标准溶液稀释即得。
2、0.1moL/L盐酸标准溶液配制及标定(1 )配制:量取9inL浓盐酸,用纯水稀释为lOOOmL ,混匀。
此溶液的浓度为0.1moL/L o(2 )标定:准确称取0.15 -0.2g于270 ~ 300°C灼烧至恒重的基准无水碳酸钠。
共称三份,分别于250inL三角烧瓶中,各加50mL纯水使之溶解,加1 ~ 2滴甲基橙指示剂,用上述盐酸滴定至溶液由黄色变为橙色。
同时作空白试验。
按下式计算HCL溶液的准确浓度:C= 2m x 1000/ ( V-V ) *M21 1式中:C盐酸溶液的浓度,moL/L ;m…无水碳酸钠的质量,g ;V…滴定碳酸钠消耗的盐酸溶液体积,niL; 1 V—空白试验消耗盐酸的体积,mL ; 2 M ( 106.0 )--碳酸钠的式量。
3、0・02moL/L乙二胺四乙酸二钠标准溶液配制及标定(1 )配制:称取7-5g乙二胺四乙酸二钠(即EDTA-2Na ),溶于纯水中,并稀释为lOOOmL ,摇匀即得。
2020版《中国药典》草酸滴定液配制与标定操作规程
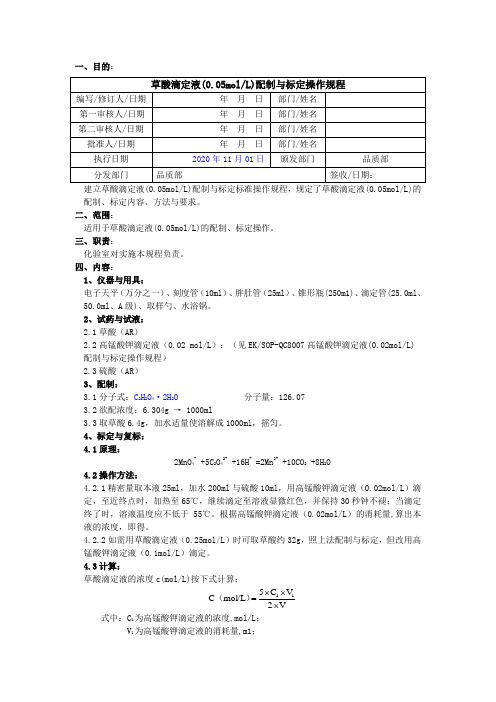
一、目的:建立草酸滴定液(0.05mol/L)配制与标定标准操作规程,规定了草酸滴定液(0.05mol/L)的配制、标定内容、方法与要求。
二、范围:适用于草酸滴定液(0.05mol/L)的配制、标定操作。
三、职责:化验室对实施本规程负责。
四、内容:1、仪器与用具:电子天平(万分之一)、刻度管(10ml )、胖肚管(25ml )、锥形瓶(250m1)、滴定管(25.0ml 、50.0ml 、A 级)、取样勺、水浴锅。
2、试药与试液:2.1草酸(AR )2.2高锰酸钾滴定液(0.02 mol/L ):(见EK/SOP-QC8007高锰酸钾滴定液(0.02mol/L)配制与标定操作规程)2.3硫酸(AR )3、配制:3.1分子式:C 2H 2O 4·2H 2O 分子量:126.073.2欲配浓度:6.304g → 1000ml3.3取草酸6.4g ,加水适量使溶解成1000ml ,摇匀。
4、标定与复标:4.1原理:2MnO 4- +5C 2O 42- +16H + =2Mn 2+ +10CO 2 +8H 2O4.2操作方法:4.2.1精密量取本液25ml ,加水200ml 与硫酸10ml ,用高锰酸钾滴定液(0.02mol/L )滴定,至近终点时,加热至65℃,继续滴定至溶液显微红色,并保持30秒钟不褪;当滴定终了时,溶液温度应不低于55℃。
根据高锰酸钾滴定液(0.02mol/L )的消耗量,算出本液的浓度,即得。
4.2.2如需用草酸滴定液(0.25mol/L )时可取草酸约32g ,照上法配制与标定,但改用高锰酸钾滴定液(0.1mol/L )滴定。
4.3计算:草酸滴定液的浓度c(mol/L)按下式计算:V2V C 5mol/L C 11⨯⨯⨯=)( 式中:C 1为高锰酸钾滴定液的浓度,mol/L ;V 1为高锰酸钾滴定液的消耗量,m1;V 为草酸滴定液的消耗量,ml。
5、贮藏:置玻璃塞的棕色玻瓶中,密闭保存。
草酸含量的测定

草酸含量的测定
草酸含量的测定:
①草酸含量测定通常采用容量分析法其中高锰酸钾滴定法是最经典且广泛应用的方法之一;
②实验开始前需准确称取一定量样品溶解于适量蒸馏水中并加入稀硫酸调节溶液酸度利于后续反应进行;
③配制标准高锰酸钾溶液作为滴定剂使用前必须标定其准确浓度一般通过已知浓度草酸标准溶液滴定实现;
④滴定过程中高锰酸钾溶液逐滴滴入样品溶液中高锰酸钾将草酸氧化成二氧化碳和水自身还原为二氧化锰;
⑤终点判断依据溶液颜色变化当最后一滴高锰酸钾加入时溶液由无色变为浅粉色并在半分钟内不褪色即为终点;
⑥记录消耗高锰酸钾溶液体积根据反应方程式计算样品中草酸含量公式为草酸含量=消耗高锰酸钾体积×高锰酸钾浓度×草酸摩尔质量/样品质量;
⑦为提高结果准确性实验至少重复三次取平均值减少偶然误差影响;
⑧对于食品化妆品等复杂基质样品测定前还需进行适当预处理如提取净化等步骤以消除干扰物质影响;
⑨除了容量法外还可采用紫外可见分光光度法高效液相色谱法等现代分析技术进行草酸定量分析;
⑩随着分析化学发展更多灵敏度高特异性强方法将不断涌现推
动草酸及其他有机酸检测技术进步;。
标准溶液的配制及标定

标准溶液的配制及标定一、概述:标准溶液是已知准确浓度的溶液。
标准溶液在容量分析中广泛应用,它是根据加入已知浓度和体积的标准溶液以求出被测物质的含量,因此际准溶液必须准确可靠。
根据物质的性质、特点分别按下列方法配制。
1.直接配制法:准确称取一定量的基准物质,加水溶解后,移入容量瓶中以水桥至刻度,根据物质的质量和溶液的体积,计算出标准溶液的准确浓度。
直接配制法的优点是方便,配好就可以使用。
基准物质:所谓基准物质是用来直接配制标准溶液或标定未知浓度溶液的物质,基准物质应符合下列要求:(1)纯度高,一般要求在99. 9%以上。
(2)组成恒定,实际组成与化学式完全相符,如含结晶水,其含量也应固定不变,与化学式完全一致。
(3)性质稳定,不易分解、吸湿、吸收C02、被空气氧化等。
(4)具有较人的摩尔质量,可减少称量误差(称取量人).2.间接配制法:有些物质不符合基准物质的条件,就必须采用间接配制法。
如NaOH易吸收空气中的水份和CO:: I:, HC1易挥发:HzSOl易吸水:KMnOl易发生氧化还原反应等。
所以先配成接近所需浓度的溶液,再用基准物质或另一种已知准确浓度的标准溶液来测定其准确浓度,这个操作过程称为“标定”。
标定方法有两种。
(1)用基准物质标定:称取一定量基准物质,溶解后用待标定的溶液滴定,根据基准物质的质帚及消耗标定溶液的体积,即可算出该溶液的准确浓度。
(2)用另一种标准溶液标定(比较法)。
准确吸取一定量的待标定溶液,用已知准确浓度的标准溶液滴定;或准确吸取一定量标准溶浓,用待标定溶液滴定。
根据两种溶液的体枳及标准溶液浓度就可算出待标定溶液的准确浓度.二、配制标准溶液一般规定:1.配制室内应尽量设法调节室内温度在2 0°C左右,避免受强烈的阳光照射,并且应当与其它产生有影响气体的操作分隔。
2.配制标液所需试剂应当选用分析纯品试剂,标定所用基准物质必须使用纯度很高的所谓“保证试剂”,必要时还需要进行提纯。
工业草酸含量测定

工业草酸中华人民共和国国家标准工业草酸 Oxalic acid for industrial use GB1626-88本标准适用于由发生炉煤气、黄磷尾气与氢氧化钠合成以及硝酸氧化葡萄糖制得的草酸。
主要用于制药、稀土元素、冶炼、纤维漂白等工业。
分子式:H2C2O4·2H2O 分子量:126.06(1975年国际原子量)一、技术条件1、外观:白色结晶2、本产品应符合下列要求:指标名称一级品二级品含量(以H4C2O4.2H2O计)% ≥ 99.6 99.00硫酸根(以SO42-计)% ≤ 0.08 0.20灰分% ≤ 0.08 0.20重金属(以Pb计)% ≤ 0.001 0.02铁(以Fe计)% ≤ 0.0015 0.01氯化物(以Cl计)% ≤ 0.0003 0.01二、检验规则3、本产品应由本生产厂的技术检验部门检验,生产厂应保证所有出厂的产品都符合本标准要求。
4、用户有权按本标准规定的技术条件、检验规则和实验方法对本产品进行校验。
5、取样时以批为单位,每批重量不大于15吨,在10%的袋中取样,当袋数较少时,取样袋数不少于5袋。
6、检验本样时,应先对本产品作外观检查,不符合外观要求者不予取样。
7、本产品取样时,应用不锈钢管或硬质塑料管制作的取样管。
取样时先将取样管插入袋底然后拔出中心管,在袋内旋转360度。
将选取的试样混合均匀,以回分法取平均试样约1公斤,装入两个清洁干燥、带磨口塞的广口瓶中,瓶上贴有注明生产厂名称、产品名称、产品批号、取样日期和取样地点的标签,一瓶作为技术检验用,另一瓶保存以备仲裁。
仲裁样品出口保存六个月,内销保存三个月。
8、在技术检验中,如有一项不符合标准要求,经过重新取样复查后仍不符合要求者,则该批产品为不合格品。
四、包装、标志、运输和储存15、草酸装入内套塑料薄膜、外套纤维制品袋中,每袋净重50千克或25千克。
16、包装袋上注明:生产厂名、产品名称、批号、毛重、净重,并印有相应防护标志。
1007草酸钠滴定液(0.1 molL)

变更记载
1.目的:
建立一个草酸钠滴定液(0.1mol/l)配制与标定的标准操作程序。
2.范围:
适用于草酸钠滴定液(0.1mol/l)配制与标定的操作。
3.职责:
滴定液配制员按此程序执行,质量管理部负责人负责监督。
4. 程序:
4.1 误差要求
4.2 仪器与用具
三角烧瓶(250 mL ),滴定管(50 mL )。
4.3 操作步骤 4.3.1 1/2Na 2C 2O 4 = 134.00 6.7 g → 1000 mL 。
4.3.2配制:取草酸钠6.7 g ,加300 mL (1+29)硫酸溶液并用水稀释至1000 mL ,摇匀。
4.3.3标定:量取30.00~3
5.00 mL 配制好的草酸钠溶液,加100 mL 硫酸溶液(8+92),用高锰酸钾标准溶液滴定,近终点时加热至65 ℃,继续滴定至溶液显粉红色保持30 s 不褪色当滴定终了时溶液温度不低于55 ℃,同时作空白试验。
10I (V -V )F F=V
式中:
F —— 草酸钠滴定液的校正因子;
I F —— 高锰酸钾滴定液的校正因子;
V —— 草酸钠滴定液的用量,mL ;
1
V —— 滴定所消耗高锰酸钾滴定液的体积,mL ; 0
V —— 空白试验所耗高锰酸钾滴定液的体积,mL 。
标准溶液配制和标定要点

1、氢氧化钠标准滴定溶液1.1配制称取110 g氢氧化钠,溶于100 ml无二氧化碳的水中,摇匀,注人聚乙烯容器中,密闭放置至溶液清亮。
按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1 000MI,摇匀。
表11.2 标定按表 2 的规定称取于 105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30 s。
同时做空白试验。
表2氢氧化钠标准滴定溶液的浓度〔c(NaOH)],数值以摩尔每升(mol/ L)表示,按式(1)计算:m×1000c(NaOH)= -------------( V1-V2)M式中 :m—邻苯二甲酸氢钾的质量的准确数值,单位为克(9);V1 —氢氧化钠溶液的体积的数值,单位为毫升(mL);V2 一空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M一邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)【M(KHC8H4O4)= 204.22 】2、硫酸标准滴定溶液2.1配制按表3的规定量取硫酸,缓缓注人1 000 mL水中,冷却,摇匀。
表32.2标定按表4的规定称取于270℃—300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50m l.水中,加5甲基红—亚甲基蓝指示剂(或滴澳甲酚绿一甲基红指示液),用配制好的硫酸溶液滴定至溶液由绿色变为紫色(绿色变为暗红色),煮沸2 min,冷却后继续滴定至溶液再呈紫色(暗红色)。
同时做空白试验。
表4硫酸标准滴定溶液的浓度[c(1/2H2SO4)],数值以摩尔每升(mol/L)表示m×1000c(1/2H2SO4)= -------------( V1-V2)M式中:m—无水碳酸钠的质量的准确数值,单位为克(g);V1—硫酸溶液的体积的数值,单位为毫升(mL) ;V2—空白试验硫酸溶液的体积的数值,单位为毫升(mL) ;M—无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M(1/2Na2CO3 )=52.994]3、氯化钠标准溶液(1ml含1mg氯离子):称取基准试剂或者优级纯的3-4g氯化钠置于瓷坩埚内,于高温炉内升温至500度灼烧10分钟,然后放入干燥器内冷却至室温,然后准确称取1.649g氯化钠,先溶于少量除盐水,然后在容量瓶中稀释至1000ml。
草酸溶液

草酸标准溶液的配制及标定简介:,分子量为CO 乙草酸又称乙二酸,是最简单的有机二元酸之一,分子式为H422主要由草酸、去离子水组成。
属于弱酸,常用于漂白组织草酸水溶液(1%)90.04。
Leagene切片,是一种非常重要的辅助试剂。
一、配制:、水中,混匀。
0.1 mol/L草酸标准溶液: 称取6.4g草酸,溶于11000ml、仪器:量筒,三角瓶,烧杯,试管,酸式滴定管,天平,玻璃棒,容量2试纸。
PH瓶,二、标定:原理:1、OO →2MnSO + 10CO↑+ 8H + 5HKMnO + 3HSOC2422422442、标定过程:C再加100ml含有8ml H2SO4的水溶液。
用准确量取20ml草酸溶液加到250ml三角瓶中,℃,继续滴定至溶液高锰酸钾标准溶液滴定近终点时,加热至701/5KMnO4)= 0.1mol/L(30秒不褪色为终点。
同时做空白试验。
呈粉红色,保持; 3、计算V)=1/2CHO(V1-V2)×C1 C(422式中:ml;滴定消耗高锰酸钾用量数,高锰酸钾标准溶液摩尔浓度,mol/L;V1-C1-ml 吸取草酸溶液数,V-V2 -空白试验高锰酸钾用量数,ml;)·0.1molL-1三、配制标准草酸溶液((若加少量蒸馏水溶解),倒入小烧杯中,HO·2HO3.3g用天平准确称取3.0~草酸(C2422再加少量水溶解,直至草酸全部溶解。
注先将上部溶液转入容量瓶中,一次加水不能溶解,烧杯用少量蒸馏容量瓶中,溶液转入250mL150mL意溶解草酸用水总量应控制在以内)。
~4次。
加蒸馏水至容量瓶的刻度线,摇匀。
水洗,洗涤液转入容量瓶中,共需洗涤3四、注意事项:1、密闭保存,放置阴凉处,防止阳光直射。
2、一旦开启尽快用完,因为其有效成分易挥发。
3、为了您的安全和健康,请穿实验服(口罩等)并戴一次性手套操作。
4、操作时防止水溶液受热。
5、反应开始时速度很慢,为了加速反应,须将溶液温度加热至70℃左右,不可太高,否则将引起CHO的分解:HCO →CO↑+ CO ↑+ HO 224422226 .溶液有效期一个月。
标准溶液的配制及标定 Microsoft Word 文档

标准及常用溶液的配置及标定1 目的:准确的配制标准及常用溶液,使测量用试剂达到检验要求。
2 适用范围:适用于标准及常用溶液的配制。
3 职责:3.1 化验员负责配制标准及常用溶液。
3.2 质检办主任负责对标准溶液的配置进行监督、检查。
4 配制4.1 配制0.1N氢氧化钠标准溶液4.1.1称取120g氢氧化钠(AR),加100ml蒸馏水,振摇使之溶解成饱和溶液,冷却后置于聚乙烯塑料瓶中,密闭,放置数日,澄清后备用。
4.1.2 吸取以上氢氧化钠饱和溶液5.6ml,加无CO2蒸馏水(新煮沸15-30分钟后并冷却),定容至1000 ml,摇匀。
4.1.3 配制1%酚酞指示剂:称取酚酞1g,溶于60ml95%的乙醇溶液中,定容至100ml。
4.1.4 标定:将基准邻苯二甲酸氢钾干燥至恒重(105-110℃烘箱中烘干1-2小时并冷却),称取约0.6 g(精确至0.0001 g)加80ml无CO2的蒸馏水充分溶解至锥形瓶中,加2-3滴酚酞指示剂。
用所配制的氢氧化钠标准溶液滴定至溶液呈粉红色,保持30秒不褪色。
记录所消耗的氢氧化钠滴定溶液的用量。
4.1.5 空白试验用80ml无CO2的蒸馏水作空白试验,记录所消耗的氢氧化钠标准溶液用量。
4.1.6 计算:氢氧化钠标准溶液的浓度按下式计算,mC= —————————(V1-V2)×0.2042式中:C——氢氧化钠标准滴定溶液的实际浓度(mol/L);m——基准邻苯二甲酸氢钾的质量(g);V1——氢氧化钠标准滴定溶液用量(ml);V2——空白试验中氢氧化钠标准溶液滴定溶液用量(ml);0.2042——与1.00 ml氢氧化钠标准滴定溶液相当的基准邻苯二甲酸氢甲的质量(g)。
4.1.7 用邻苯二甲酸氢钾标定三次,取三次的平均值作为最终结果。
4.1.8 复标周期:30天4.2 45.0%糖溶液的配制4.2.1 用感量1/100克天平准确称取蔗糖(分析纯)45.00克溶于55ml蒸馏水中,待全部溶解,混合均匀后用阿贝折射仪测量其浓度。
标准溶液的配制和标定方法

标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.313mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取 120gNaOH,溶于 100mL无 CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无 CO2的水稀释至1000mL,摇匀。
C(NaOH), mol/L NaOH饱和溶液, mL1560.5280.31317.5280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于 105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至 0.0001 g ,溶于下列规定体积的无 CO2的水中,加 2 滴酚酞指示液( 10 g/L ),用配制好的 NaOH溶液滴定至溶液呈粉红色并保持 30S。
同时做空白试验。
C(NaOH),mol/L基准邻苯二甲酸氢钾 ,g无 CO水 ,mL21 6.0800.5 3.0800.313 1.878800.10.6802.计算:氢氧化钠标准溶液浓度按下式计算:MC( NaOH)= ------------------------(V—V0)× 0.2042式中: C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L ;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042 ——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol 。
二、盐酸标准溶液的配制和标定(依据国标 GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL 水中,摇匀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
草酸标准溶液的配制及标定
一、配制:
0.1 mol/L草酸标准溶液 : 称取6.4g草酸,溶于1000ml水中,混匀。
二、标定:
1、原理:
KMnO4 + 3H2SO4 + 5H2C2O4 → 2MnSO4 + 10CO2↑ + 8H2O
2、标定过程:
准确量取20ml草酸溶液加到250ml三角瓶中,再加100ml含有8ml H2SO4的水溶液。
用C (1/5KMnO4)= 0.1mol/L高锰酸钾标准溶液滴定近终点时,加热至70℃,继续滴定至溶液呈粉红色,保持30秒不褪色为终点。
同时做空白试验。
3、计算;(V1-V2)×C1 C(1/2C2H2O4)= V
式中:
C1-高锰酸钾标准溶液摩尔浓度, mol/L;V1-滴定消耗高锰酸钾用量数, ml;V2 -空白试验高锰酸钾用量数, ml;V-吸取草酸溶液数, ml
4、注意事项:
(1)反应开始时速度很慢,为了加速反应,须将溶液温度加热至70℃左右,不可太高,否则将引起H2C2O4的分解: H2C2O4 → CO↑ + CO2 ↑ + H2O
(2)溶液有效期一个月。
1.配制标准草酸溶液(0.1mol·L-1)
用天平准确称取3.0~3.3g草酸(H2C2O4·2H2O),倒入小烧杯中,加少量蒸馏水溶解(若一次加水不能溶解,先将上部溶液转入容量瓶中,再加少量水溶解,直至草酸全部溶解。
注意溶解草酸用水总量应控制在150mL以内)。
溶液转入250mL容量瓶中,烧杯用少量蒸馏水洗,洗涤液转入容量瓶中,共需洗涤3~4次。
加蒸馏水至容量瓶的刻度线,摇匀。
