无机化学第十四章
高中化学竞赛-无机化学14

∵弱场
高自旋
强场
∴与事实相符.
无机化学
低自旋
§14-2. 钛、钒
2-1.钛. 3d24s2 2-2.钒. . 3d34s2
无机化学
2-1.钛. 3d24s2
1.单质:银白色金属.ρ=4.506g .cm-3(铁的一半) 较高机械温度,表面致密氧化膜,有良好的抗腐蚀性, 制造飞机、坦克有关设备.
无机化学
5-1. 单质:银白色金属.
①有磁性(其合金磁化后可做永久磁铁) ②中等活泼,能溶于稀酸. ③加热下可与许多非金属反应, ④ 铁 可 与 热 的 浓 碱 反 应 . 而 Co 、 Ni 不 反
应. 熔融碱应选用镍坩埚. ⑤与CO反应生成羰基化合物.
些F羰e(基CO化)合5 、物C.(CO)8 、 Ni(CO)4 加 热 这
M具有较强还原性;
还原性:第一过渡系列 > 第二 < 第三(同族↓)而主
族同一族自上而下还原性↑,表现在; ①与酸反应. 第一过渡系列与稀酸; ②与活泼非金属反应.
其中Sc,La的还原性较强,在空气中迅速被氧 化,在水中反应放出H2, 也能溶于酸 。
无机化学
1-5. 过渡元素氧化物的酸碱性
同一周期从左→右 酸性↑ 碱性↓. Sc2O3 TiO2 CrO3 Mn2O7 碱性 两性 酸性 强酸性
无机化学
1-1. 过渡元素的价电子层结构.
(n-1)d1~10ns1~2 (Pd:4d105s0) d电子数较多.d电子可部分或全部成键. d轨道未充满可接受孤电子
无机化学
1-2过渡元素的原子半径和电离势.
无机化学课件氮族元素

(iii) 王水的氧化性:浓HNO3:浓HCl为3:1 叫做 王水,它的氧化性比硝酸更强,可溶解金、铂等不活 泼金属(实际上是多种氧化剂+配位剂Clˉ在起作用)
D.硝化反应—— 与有机化合物发生反应,生成 硝基化合物(RNO2).
硝酸盐NO3ˉ: (i) 结构: 正三角形,sp2杂化,有个大π36键
盐溶液显酸性(水解) 与碱溶液的反应:
NH4+ + OH- == NH3 + H2O
(iii) NH4+ 的鉴别: A. 若NH4+量多,可用加强碱加热,用湿润的蓝 色石蕊试纸(变兰)检验气体;
B. 若NH4+量少,加Nessler试剂(K2[HgI4]的KOH 溶液)检验(通常为红棕色)
NH4+ + [HgI4]2- + OH-
白磷、红磷的物理性质
白磷
红磷
色、态
白色蜡状
红棕色粉末
溶解性 毒性
着火点
不溶于水,溶于CS2 剧毒
40℃ , 易自燃
不溶于水和CS2 无毒 240℃
保存 用途 分子结构
相互转化
密封,保存于冷水中
密封,防止吸湿
制高纯度磷酸
制安全火柴、火药
P4 正四面体 键角60°
结构复杂
白磷
隔绝空气加热到260℃ 红磷
氨气的化学性质:
可发生三类反应:
A. 加合反应:NH3作为一种典型的Lewis碱,可与许多 金属离子(如Ag+、Cu2+、Co3+、Ni2+)形成配合物;与某些盐 晶体加合(如8NH3+CaCl2 → CaCl2·8NH3 )
B. 取代反应:NH3中的氢可被活泼的金属取代生成氨 基化合物(-NH2)和氢气。
最新北师大考研无机化学复习题第十四章

最新北师⼤考研⽆机化学复习题第⼗四章第14 章p 区元素(⼆)⼀、教学基本要求1.了解16-18族元素的特点;2.了解重点元素硫、卤素的存在、制备和⽤途;3. 掌握重点元素硫、卤素的单质及其化合物的性质,会⽤结构理论和热⼒学解释它们的某些化学现象;4. 了解第1个稀有⽓体化合物的诞⽣及其对化学发展的贡献。
⼆、要点1.薄膜法(membrane process)⼯业上利⽤离⼦交换电解NaCl⽔溶液⽣产Cl2的⼀种⽅法,隔开阳极室和阴极室的薄膜式⼀带有⽀链(⽀链上有磺酸基或羧基)的聚全氟⼄烯⾻架⾼分⼦离⼦交换膜,这种阳离⼦交换膜允许Na+由阳极室流向阴极室以保持电解过程中两室的电荷平衡,⽽不让OH-按相反⽅向流向阳极室。
2. 臭氧空洞(ozone hole)指的是因空⽓污染物质,特别是氧化氮和卤代烃等⽓溶胶污染物的扩散、侵蚀⽽造成⼤⽓臭氧层被破坏和减少的现象。
经过跟踪、监测,科学家们找到了臭氧空洞的成因:⼀种⼤量⽤作制冷剂、喷雾剂、发泡剂等化⼯制剂的氟氯烃是导致臭氧减少的"罪魁祸⾸"。
另外,寒冷也是臭氧层变薄的关键,这就是为什么⾸先在地球南北极最冷地区出现臭氧空洞的原因了。
3.恒沸溶液(azeotropic solution)恒沸溶液即恒沸混合物。
在⼀定条件下,当某些溶液的组成与其相平衡的蒸⽓组成相同时,溶液在蒸馏时期沸点保持恒定,故称恒沸溶液。
例如,在⼀⼤⽓压下,氯化氢和⽔的恒沸混合物中含氯化氢的重量百分数为20.24,其恒沸点是108.6℃。
4.制备某些重要含硫⼯业产品的途径:化合态硫或天然单质硫2 22SO4 2Cl23H3H 2SO4三、学⽣⾃测练习题1.是⾮题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)1.1 所有卤素都有可变的氧化数。
( )1.2 实验室中⽤MnO2和任何浓度HCl作⽤,都可以制取氯⽓。
( )1.3 卤素单质的聚集状态、熔点、沸点都随原⼦序数增加⽽呈有规律变化,这是因为各卤素单质的分⼦间⼒有规律地增加的缘故。
[实用参考]无机化学-碳族元素.ppt
![[实用参考]无机化学-碳族元素.ppt](https://img.taocdn.com/s3/m/b8f4c5919ec3d5bbfc0a744d.png)
直线形 直线形
C2H2、HCN CO
2019/8/9 4
一、碳族元素在自然界的分布 二、碳族元素的单质 三、氧化物 四、含氧酸及其盐 五、氢化物 六、卤化物和硫化物
2019/8/9 5
一、自然界的分布
C 单质状态:主要是金刚石和石墨。化合
物:煤、石油、天然气、动植物、
石灰石、白云石、CO2等。
Si靠Si-O键联结成各种链状、层状和立体
2019/8/9 15
Pb: 质软、密度大(11.35g·cm-3),纯铅在空气中不稳定 →Pb(OH)2或Pb2(OH)2CO3
C(石墨)→(金刚石)石理墨:转化为金刚石的机
△fGmθ/kJ·mol-1 0
ρ/g·cm-3
2.260
2.9 ⑴ 溶剂说:石墨先溶解 3.515 在溶剂(金属催化剂)
△fHmθ/kJ·mol-1
O
1.897 中成为单个碳原子,然 后在冷却时直接生成金
反应的特点? 吸热、体积减小 刚石。
欲使反应正向进行,采取的措施?⑵ 固相转化说:石墨的
第十四章 碳族元素
§14-1 碳族元素的通性 §14-2 碳族元素的单质及其化合物 §14-3 无机化合物的水解性
2019/8/9 1
元素符号 C Si Ge Sn
Pb
价电层结构 2s22p2 3s23p2 4s24p2 5s25p2
6s26p2
电负性
2.01 1.96(Ⅳ) 2.33 (Ⅳ) 2.25 1.90 (Ⅳ) 1.80(Ⅱ) 1.87 (Ⅱ)
2019/8/9 9
上图:纳米管在预先做 好阵列的硅晶片上催化 生长的结果。把Si晶片 置于一个充满乙烯容器 内,在特定的晶面上涂上 催化剂,加热后,高纯 的碳管以惊人的速度生 长,其速度可以达到每 小时500英里。
张祖德《无机化学习题》及答案第十四章

第十四章 答案1. 金刚石中碳原子采取sp 3杂化,C 原子与C 原子之间以共价键结合形成原子晶体,∴金刚石的主要特征为高硬度,高熔点,高沸点,不导电。
石墨中碳原子采取sp 2杂化,一个C 原子与三个C 原子以共价键连接形成层状结构,每个C 原子上还有一个垂直于层状平面的p 轨道,这些p 轨道重叠形成离域π键,其p 电子离域在每一层上,另外层与层之间是分子间作用力,∴石墨是混合型晶体,它的主要特征为具有润滑性,导电性和导热性。
2. CO 与N 2物理性质相似之处:具有较低的熔点和沸点,具有相近的临界温度和临界压力:m.p. (℃) b.p. (℃) 临界压力(atm) 临界温度(℃)C O-200 -190 36-140 N 2 -210 -196 33-146 化学性质相似之处:CO 与N 2都不助燃;化学性质不同之处:CO 作还原剂,N 2的还原性很差;CO 可以作为配体,而N 2配位能力弱。
CO 与N 2分子性质之所以不同是因为,在CO 分子中O 原子上的一对电子占有C 原子的2p 轨道,增强了C 的电子密度,∴C 原子的配位能力强于N 2( )分子中的N 原子。
CO 2与N 2O 相似性很小,而差异性很大,显然它们并不是等电子体之故。
3. SiCl 4↑(1)Na 2SiO 3(2)←−−Si (3)−−→SiHCl 3 ↑(4)(5)4(6)←−−SiO 2(7)−−→Na 2SiO 3(8)−−→H 2SiO 3(1) Si + 2Cl (2) Si + 2NaOH + H 2O 2SiO 3 + 2H 2↑3 + H 2 (4) SiO 2 + 2Mg(5) 3SiF 4+ 4H 2O 4SiO 4 + 2H 2SiF 6 (6) SiO 2 + 4HF4 + 2H 2O(7) SiO 2 + Na 2CO 32SiO 3+ CO 2↑ (8) SiO 32- + 2H +2SiO 3↓4. SiO 2晶体属于原子晶体,基本单元为SiO 4,Si 原子为四面体中心,四个O 原子位于正四面体的顶点,原子之间以—O —Si —O —共价键相连,∴以固体状态存在;而CO 2是直线型分子,低温下固体CO 2属于分子晶体,每个CO 2分子通过分子间作用力连接,作用力很弱,温度略微上升,分子间作用力就被破坏而形成单个CO 2分子,∴常温时为气态。
无机化学下册:第十四章 氮族教学内容

Hg
NH4++ 2[HgI4]2-+4OH-=[O
NH2]I↓ +7I- + 3H2O
Hg
22
2. N2H4
联氨(肼 NH2-NH2) 羟氨(NH2-OH) 氮化物 (N ) 氢叠氮酸(HN3)
H •• N
H
H •• N
H
••
N
•
•
N •• N
•
••
sp杂化
sp3杂化, 氧化数-2
H
N
••
H
OH
sp3杂化, 氧化数-1
在无水的条件下
(Ca Sr Ba类似)
b. 与IIIA,IVA生成共价化合物
2B+N2====2BN (白热)
与C2为等电子体,有两种结构
13
c. 与过渡金属形成间充型氮化物
N的固定
放电 N2+O2====2NO
3. N2的制备
实 验 室 制 法
工业制法是分镏液化空气而得到
△
NH4Cl+NaNO2 ===N2+2H2O+NaCl
无机化学
第十四章 氮族元素
教学要求
1、熟悉氮元素在本族元素中的特殊性。 2、掌握氮、磷以及它们的氢化物,含氧酸及其盐的结 构、性质、制备和用途。 3、熟悉本族元素不同氧化态间的转化关系。 4、掌握砷、锑、铋单质及其化合物的性质递变规律。 5、从结构特点上分析理解本族元素的通性和特性。
VA族 氮 磷 砷 锑 铋
AgBr
N2+ Ag+HBr+H2O
NH2OH
AgBr过量
△
N2O+ Ag+HBr+H2O 产物复杂
无机及分析化学 第十四章

BCl+3H2O=H3BO3+3HCl
Cl2+H2O=HClO+HCl
为加速反应,得到浓度较大的次氯酸,可往绿水中加入HgO、CaCO3等可与 HCl作用的物质。
常温下HClO具有刺鼻的气味,其稀溶液无色,浓溶液显黄色,主要化学性质
表现为不稳定性和强氧化性。
次氯酸在溶液中的分解有两种方式: 2HClO=2HCl+O2
3HClO=2HCl+HClO3
(2) 氯酸及其盐 氯酸可由氯酸钡与稀硫酸反应制得::
Ba(ClO3)2+H2SO4=BaSO4+2HClO3
氯酸仅可存在于溶液中,若将其含量提高到40%即分解,含量再高,就会迅速 分解并发生爆炸。氯酸是强酸,其强度接近于盐酸和硝酸,氯酸又是强氧化剂, 它能将单质碘氧化:
I2+2ClO3-=Cl2+2IO3-
4. 与H2O的反应 卤素单质与水可以发生如下的两类反应: (1)对水的氧化反应:
2X2+2H2O=4H++4X-+O2
X2是氧化剂,中性条件下,卤素单质反应速率不一致,氟较激烈,Cl2较缓慢, I2与H2O不反应。 (2) 卤素在水中的歧化反应:
X2+H2O=H++X-+HXO
卤素单质的活泼性很强,主要的性质是氧化性,反应活性随F2>Cl2 > Br2 > I2
递减。 1. 与金属和非金属的反应 F2可与除O2、He、Ne和Ar外几乎所有的单质作用,大多数反应非常剧烈。Cl2 也可以发生反应,但活泼性差些。Br2及I2的反应活性小于Cl2,常温下只能与 活泼金属作用,与其他金属反应需加热。
卤素的相似性: 1. 游离状态二聚体,通常具有挥发性和刺激性气味;
无机化学第四版第十四章习题答案

无机化学第四版第十四章习题答案(Inorganic chemistry, Fourth Edition, fourteenth chapter, exercises, answers)Fourteenth chapter halogen14-1 why do not use KF water solution when making fluorine by electrolysis? Why liquid hydrogen fluoride does not conduct electricity while potassium fluoride anhydrous hydrogen fluoride solution can conduct electricity?1 solution: because F2 reacts with water, there is no free ion in the liquid HF molecule, so it can not conduct electricity. In the anhydrous HF solution of KF, K+ and HF2- exist;14-2 what are the special characteristics of fluorine in this element? What are the characteristics of hydrogen fluoride and hydrofluoric acid?2, solution: (1) as the radius of the F is very small, so F2 can dissociation is very small, the F- hydration heat of other halogen ions.(2) hydrogen bonds exist between HF molecules, so the boiling point and heat of vaporization of HF molecules are especially high.(3) AgF is a compound easily soluble in water.(4) the product of F2 reaction with water is complex.(5) HF is a weak acid with increasing acidity and increasingconcentration.(6) HF can react with SiO2 or silicate to form gaseous SiF4;14-3 (1) the reaction tendency of Cl2 was generated by comparing KMnO4, K2Cr2O7 and MnO2 with hydrochloric acid (1mol.L-1) according to the electrode potential.(2) what is the minimum concentration of hydrochloric acid if MnO2 is reacted with hydrochloric acid to cause Cl2 to occur successfully?3, Xie: (1) according to the relationship between electrode potential, we can see the reaction trend:KMnO4>K2Cr2O7>MnO2;14-4 according to the potential map, the reaction equilibrium constant of Br2 in alkaline aqueous solution is reduced to Br- and BrO3- at 298K.4. Solution: by formula: -ZFE=-RTlnKGet: K=exp (ZFE/RT)=2.92 * 103814-5, three, fluorinated nitrogen NF3 (boiling point -129 degrees Celsius) does not show Lewis alkaline, and relatively low molecular mass compounds NH3 (boiling point -33 degrees Celsius) is a well known Lewis base. (a) to explain the reasonwhy their volatility is so great; (b) explain why they differ in alkalinity.5. Xie: (1) NH3 has a higher boiling point because of the hydrogen bond between the molecules.(2) the NF3 atom has a large radius of F atoms, which makes it difficult to match Lewis acid because of steric hindrance.In addition, the electronegativity of the F atom is larger, which weakens the electronegativity of the central atom N.14-6 from bittern making Br2 available chlorine oxidation method. But from a thermodynamic point of view, Br- can be oxidized to Br2 by O2. Why not use O2 to make Br2?14-7 pass Cl2 can be used in slaked lime to obtain bleaching powder, and hydrochloric acid can be added to Cl2 in the solution of bleaching powder. The two phenomena are explained by using electrode potential.7, Xie: because Cl2 pass into the hydrated lime is in alkaline medium, and because of, so Cl2 in alkaline conditions prone to disproportionation reaction.When the hydrochloric acid is added to the bleach solution, the following reaction can be carried to the right:HClO + Cl- + H+ = Cl2 + H2O14-8 which of the following oxides are anhydrides: OF2, Cl2O7,ClO2, Cl2O, Br2O and I2O5? If the anhydride is prepared, the reaction is obtained by the corresponding acid or other method of getting the anhydride.8 solution: Cl2O7 is the anhydride of HClO4. Cl2O, Br2O are HClO, HBrO anhydrides, respectively14-9 how do you identify the three salts of KClO, KClO3, and KClO4?9 、 solution: add a small amount of solid into the dried test tube, and then do the following experimentAdd dilute hydrochloric acid, that is, Cl2 gas release is KClO;KClO+2HCl=KCl+Cl2+H2OAdding concentrated hydrochloric acid has Cl2 and emits, and the solution turns yellow is KClO3;8KC1O3+24HCl (strong) =9Cl2 = +8KCl+60ClO2 (yellow) +12H2OThe other is KClO414-10 the reaction equation for preparing HIO4, KIO3, I2O5 and KIO4 was prepared with I2 as raw material.The solubility of 14-11 (1) I2 in water is very small. The concentration of I2 saturated solution is calculated from the following 2.5 reactions at 298K.I2 (s) + 2e- = 2I-; 0.535V = Phi thetaI2 (AQ) + 2e- = 2I-; 0.621V = Phi theta(2) 0.100mol I2 was dissolved in 1.00L 0.100mol.L-1 KI solution and I3- solution was obtained. The Kc value of the I3- generation reaction is 0.752, and the concentration of I2 in the I3- solution is calculated.14-11, (1) I2 (AQ) =I2 (s)K=exp (ZFE/RT)=812K=1/[I2 (AQ)]I2 (AQ) =1/812=0.00123mol/L(2) I2+I-=I3-;KC=; so [I2]=?The solution is x=0.0934mol/L.Explain the following phenomena: 14-12 by adding a small amount of NaClO in the electrode potential of starch potassium iodide solution, blue A solution, adding excessive NaClO, B get a colorless solution, then acidified and add a small amount of solid Na2SO3 in B solution, A blue reproduction, when the excessive amount of Na2SO3 blue and then faded become colorlesssolution C, A the solution then add NaIO3 solution and blue. Point out A, B, C why each kind of substance, and write out the reaction equation of each step.12, Xie: A:I2;B:NaIO3;C:NaI14-13 write out the equation for the reaction of iodate and excess H2O2, such as adding starch to the system. What do you see?13 solution: HIO3+3H2O2=3O2+HI+3H2O; if the starch is added to the system, the solution turns blue slowly and then fades.14-14 write out the molecular formula of three metal halides with covalent bonds, and explain the common properties of this type of halides.14 and Xie: (AlCl3) 2; (AlBr3) 2; (AlI3) 2; all molecules contain coordinate bonds14-15 what is a multi halide? What is the trend of the formation of Br3- and Cl3- ions in comparison with I3- ions?14-16 what are halogen compounds?(a) write ClF3, BrF3 and IF3 halogen halide complexes, central atom hybridization orbitals, molecular electronicconfigurations and molecular configurations.(b) is there any risk of explosion when the following compounds are exposed to BrF3? Explain why.SbF5; CH3OH; F2; S2Cl2(c) why are halogenated compounds often diamagnetic, covalent, and chemically active than halogen?14-17 laboratory has a calcium halide, soluble in water, try to use concentrated H2SO4 to determine the nature and name of this salt.17. Solution: different phenomena can be identified by the reaction of halide with concentrated sulfuric acid.14-18 please click the following example,The bromine, iodine, and halogen ions containing various conversion and transformation conditions as oxygen acid interaction diagram.。
大连理工大学无机化学课件第14章

无 机 化 学 基 础 教 程
HNO3 非金属单质 相应高价酸 NO
4HNO3 3C 3CO2 (g) 4NO(g) 2H2O 5HNO3 3P 3H3PO4 5NO(g) 2HNO3 S H2SO 4 2NO 10HNO 3I2 6HIO3 10NO 2H2O 3
O2 △
性质:
P4O6白色易挥发的蜡状晶体,易溶于有机溶剂。 P4O10白色雪花状晶体,强吸水性。
无 机 化 学 基 础 教 程
P4O6 6H2O(冷) 4H3PO3
P4O6 6H2O(热) 4H3PO4 PH3 5P4O6 18H2O(热) 12H3PO4 8P P4O10 6H2O 4H3PO4 P4O10 6H2SO 4 6SO3 4H3PO4 P4O10 12HNO 6N2O5 4H3PO4 3
4Zn 10HNO3 (很稀,1 : 10) 4Zn(NO3 ) 2 NH 4 NO 3 3H 2 O
规律:HNO3越稀,金属越活泼, HNO3 被还原的氧化值越低。
冷的浓硝酸使Fe, Al, Cr钝化 王水:(氧化配位溶解)
Au HNO3 4HCl H[AuCl4 ] NO 2H2O
Ag 2 NH3 [Ag(NH3 ) 2 ]
④ 取代反应
570C
2NH3 2Na 2NaNH2 H 2
催化
NH2-NH2联氨(肼),NH 亚氨基,N 氮化物
(2) 铵盐
①铵盐一般为无色晶体,绝大多数易溶于水
水解:NH + H2O
无 机 化 学 基 础 教 程
4
H3O+ + NH3
无机化学第五版第十四章

在O3中,中心氧原子的δ=6-2-6×3畅443畅44+3畅44=1左侧端基氧原子:δ=6-4-4×12=0右侧端基氧原子:δ=6-6-2×12=-1 当然,对O3这一特例,部分电荷的计算与形式电荷的计算是一致的,这是一种巧合。
通过计算表明O3是极性分子,正电荷的中心靠近中心氧原子,负电荷中心靠近端基氧原子。
必须指出的是:这种计算虽然能说明O3的极性,但仍然很粗糙,实际上两个端基氧原子的电荷密度是相等的。
O3中有Π43键,端基O 与中心O之间并不是一个双键、一个配键。
这正是Lewis结构的不足所致。
在CO中,δ(C)=4-2-6×2.552.55+3.44=-0.554δ(O)=6-2-6×3.442.55+3.44=+0.554由此可以推断:在CO中正电荷中心靠近O,负电荷中心靠近C。
这一推断与实验事实是一致的(分子轨道理论也对CO的极性做出了解释)。
通过部分电荷的计算,讨论O3,CO的极性,以便开阔思路,可尝试推广之。
主要参考文献 [1]Bodner G M.Core Text Chemistry Structure&Dynamics.John Wiley&Sons Inc,1996. [2]Shriver D F.Inorganic Chemistry.2nd ed.Oxford University Press,1994. 中译本:高忆慈,译.无机化学.2版.北京:高等教育出版社,1997.三、习题解析 1(141)畅试写出下列物质之间的反应方程式((1),(4)略)。
(2)液氨和钠; (3)浓硝酸和汞; (5)稀硝酸和银;(6)锡和浓硝酸; (7)氯化铵溶液与亚硝酸钠溶液;(8)酸性溶液中碘化钾与亚硝酸钠。
解:(2)2N H3(l)+2Na(s)NaN H2(am)+H2(g) (3)H g(l)+4H N O3(浓)H g(N O3)2(aq)+2N O2(g)+2H2O(l) (5)3Ag(s)+4H NO3(稀)3AgN O3(aq)+NO(g)+2H2O(l) (6)Sn(s)+4H N O3(浓)β-H2SnO3(s)+4N O2(g)+H2O(l) (7)N H4Cl(aq)+NaN O2(aq)△N2(g)+NaCl(aq)+2H2O(l) (8)2I-(aq)+2N O-2(aq)+4H+(aq)I2(aq)+2N O(g)+2H2O(l) 2(142)畅完成并配平下列反应方程式((1),(2)略): (3)Cu(N O3)2△(4)H g(N O3)2△ 解:(3)2Cu(N O3)2(s)△2CuO(s)+4NO2(g)+O2(g) (4)H g(N O3)2△H g(g)+2N O2(g)+O2(g) 樉熟悉硝酸盐受热分解的规律。
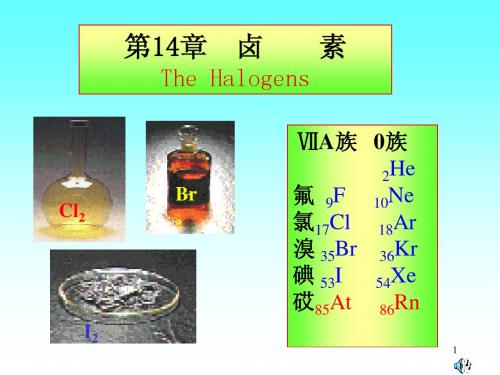
大学无机化学第14章 卤素
4
ø2
(0.4556 1 1.0774 1)V 0.7665 V 2
ø3
(0.6126 6 - 1.0774 1)V 0.5196 V 5
12
(2)
0.7665
BrO
3
0.5357
BrO
-
0.4556
Br2
1.0774
Br
-
0.5196
Br2、BrO 可以歧化。
13
电解液中,常加入少量的氟化物如LiF、 AlF3等,以降低电解质的熔点,减少HF的挥 发。阳极和阴极用隔板隔开,气体氟经过 净化后,以17.7~17.8 MPa的压力压入特 22 制钢瓶中。
2-3
2、合成法 1986年Karl Chrite 首次 用化学方法合成了F2: (1)4KMnO4+4KF+20HF==4K2MnF6+10H2O+3O2 ↑ (2)SbCl5+5HF====SbF5+5HCl 423K (3)2K2MnF6+4SbF5 ==== 4KSbF6+2MnF3+F2 ↑
注意: 氟与稀碱反应是 2F2+2OH-=2F-+OF2+H2O 氟与浓碱反应是 2F2+4OH-=4F-+O2+2H2O 卤素与碱反应是制备次卤酸盐和卤酸盐的 常用方法,在酸性条件下均可发生反岐化反 应
3Br2+2OH-=5Br-+BrO3-+3H2O
5Br-+BrO3-+6H+= 3Br2+3H2O
-
(3) 因为 BrO 能歧化 ,不稳定。 所以 Br 2 (l) 与 NaOH 混合最稳定的产物
《无机化学》第3版 宋天佑 14_碳族元素

CaCO3 难溶,而 C(a HCO3)2 的溶解度比它大些。
其原因是 CaCO3 中 Ca2+ 和 CO32- 电荷高,是 + 2 对 - 2,相 互间的引力要大些,故不易溶解。
但 Ca2+ 和 HCO3- 之间的引 力相对小些,是 + 2 对 1,较易 于溶解。
14. 1. 2 碳的含氧化合物
碳的氧化物主要有两种: 一氧化碳和二氧化碳。
1. 一氧化碳
CO 为无色无臭有毒气体,在 水中溶解度较小。
实验室中制取 CO 经常采用 两种方法:
① 向热浓硫酸中滴加甲酸
HCOOH —热浓—H—2SO—4 CO↑ + H2O
② 使草酸与浓硫酸共热
H2C2O4(s)—热浓—H—2SO—4 CO ↑+ CO2 ↑+ H2O
通入水蒸气时,发生另一反应
C + H2O —— CO + H2 △rHm = 131 kJ•mol-1
得到的气体体积组成为 CO 40%, CO2 5%,H2 50%。
这种混合气体称为水煤气。
发生炉煤气和水煤气都是工业 上的燃料气。
CO 为还原性气体,是冶金工 业的还原剂,可以将金属氧化物矿 物还原成金属。
CaCO3 —— Ca2+ + CO32Ca(HCO3)2 —— Ca2+ + 2HCO3-
所以通入 CO2 ,可以将 CaCO3 转化成Ca(HCO3)2 而发生溶解:
CaCO3 + CO2 + H2O —— Ca(HCO3)2
Na2CO3,K2CO3 和(NH4)2CO3 等均易溶于水。
北师大无机化学四版习题答案14章碳硅硼

第14章 碳、硅、硼14.1. 对比等电子体CO 与N 2的分子结构及主要物理、化学性质。
解:CO 和N 2是等电子体(14e ),分子轨道能级图相似,分子中都有三重键:∶N ≡N ∶、C O δ+δ-∶∶,键能相近。
一般条件下,两种物质都是气体,很少溶于水;熔、沸点,临界压力,临界温度等一些物理性质也相似。
但CO 和N 2分子中三重键特点并不完全相同,N 2分子中负电荷分布是对称的,而CO 却是不对称的。
C 原子略带负电荷,再加上C 的电负性比N 小,因此CO 比N 2较易给出电子对向过渡金属原子(离子)配位,除形成σ―配键外,还有π―反馈键形成,故生成的配合物较稳定。
而N 2的配位能力远不如CO ,分子氮配合物远不如羰基化合物稳定。
所以CO 的键能虽比N 2略大,但化学性质却比N 2要活泼,不象N 2那样“惰性”。
14.2 概述CO 的实验室制法及收集方法,写出CO 与下列物质起反应的方程式并注明反应的条件:(1)Ni ;(2)CuCl ;(3)NaOH ;(4)H 2 ;(5)PdCl 2 解:CO 的实验室制法:HCOOH浓H 2SO 42O用排水集气法收集。
(1)Ni + 4CO100 -250atm 423 -493KNi(CO)4(2)(3)CO + NaOH HCOONa1.01×103kPa473K(4)CO + 3H 2CH 4 + H 2O Fe 、Co 、Ni523K,101kPa(5) CO + PdCl 2 + H 2O === Pd ↓ + CO 2 + 2HCl14.3. 某实验室备有CCl 4、干冰和泡沫灭火器(内为Al 2(SO 4)3和NaHCO 3),还有水源和砂。
若有下列失火情况,各宜用哪种方法灭火并说明理由: (1)金属镁着火; (2)金属钠着火;(3)黄磷着火; (4)油着火; (5)木器着火。
解:14.4. 标准状况时,CO 2的溶解度为170 mL / 100g 水:(1)计算在此条件下,溶液中H 2CO 3的实际浓度。
武汉大学版无机化学课后习题答案--14氮族元素

武汉大学版无机化学课后习题答案--14氮族元素第十四章 氮族元素1. 用MO 理论讨论N 2和NO 分子中的成键情况,并指出两者键级是多少? 答:N 2 :2222222*222pp p s s KK σππσσ 键级3 NO :1*22222222*222pp p p s s KK πσππσσ 键级2.5。
2.解释下列问题:(1)虽然氮的电负性比磷高,但是磷的化学性质比氮活泼?(2)为什么Bi(V)的氧化能力比同族其他元素强?答:(1) 氮的电负性比P 高,但氮不如P 活泼,这是由俩者单质的结构不同决定的。
N 的半径很小,但N 原子间形成三重键,叁键的键能很高,难以断开,因而N 2很不活泼。
P 原子半径很大,而使P 原子间的p 轨道重叠很小,不能形成多重键。
P-P 单键键能很小,很容易断开。
特别白磷的P-P-P 键角小张力大,更活泼。
(2) Bi(v)的氧化能力比同族其他元素强的多,出现了充满4f、5d,而4f、5d对电子的屏蔽作用较小,而6s具有较大的穿透能力,所以6s电子能级显著降低,不易失去,有“惰性电子对效应”。
失去2 个6s电子的Bi(v 更倾向于得到2个电子形成更稳定的Bi3+。
3.试从分子结构上比较NH3、HN3、N2H4和NH2OH等的酸碱性。
答:NH3结构见书648HN3结构见书658N2H4结构见书655NH2OH结构见书658得出酸性HN3> NH2OH > N2H4> NH3碱性相反。
4.试比较下列化合物的性质:(1)NO-3和NO-2的氧化性;(2)NO2、NO和N2O在空气中和O2反应的情况;(3)N2H4和NH2OH的还原性。
答:(1) 氧化性NO2->NO3-;(2) NO2不与空气反应;NO与空气在常温下即可反应,产生红棕色烟雾。
N2O也不与空气反应。
(3)还原性:N2H4 >NH2OH5.硝酸铵可以有下列两种热分解方式:NH4NO3(s)=NH3(g)+HNO3(g)ΔHθ=171kJ·mol-1NH4NO3(s)= N2O(g)+2 H2O(g) ΔHθ=-23 kJ·mol-1根据热力学的观点,硝酸铵固体按照哪一种方式分解的可能性较大。
无机化学第十四章-铅族元素

无机化学第十四章-铅族元素
本文档将介绍无机化学第十四章中的铅族元素。
铅族元素是周期表中的第14族元素,包括铅(Pb)、锡(Sn)、锗(Ge)、硅(Si)、砷(As)和锑(Sb)。
铅(Pb)
铅是铅族元素中最常见的成员之一。
它是一种重金属,具有较高的密度和良好的延展性。
铅被广泛用于电池、管道、防辐射材料等应用中。
然而,铅也是一种有毒物质,在过量暴露下可能对人类健康产生负面影响。
锡(Sn)
锡是另一个重要的铅族元素。
它是一种延展性较好的金属,常用于制造锡箔、合金和焊接材料等。
锡也被广泛应用于食品罐头的镀锡过程中。
锗(Ge)
锗是一种具有半导体性质的铅族元素。
它在电子技术领域中发
挥着重要作用,常用于制造二极管、太阳能电池等。
硅(Si)
硅是铅族元素中最广泛应用的成员。
它是一种常见的半导体材料,被广泛用于电子器件的制造中。
硅还可以制成玻璃和陶瓷材料。
砷(As)
砷是一种具有毒性的铅族元素。
它广泛存在于自然界中,但在
大量暴露下对健康有害。
砷也有一些重要的应用领域,如制造农药
和防腐剂等。
锑(Sb)
锑是一种具有金属和非金属特性的铅族元素。
它常用于制造阻
燃材料、半导体器件和合金等。
以上是无机化学第十四章-铅族元素的简单介绍。
铅族元素在工业和科学领域中有着重要的应用,但我们也要注意它们的潜在危害和环境影响。
无机化学[第十四章氮族元素]课程预习
![无机化学[第十四章氮族元素]课程预习](https://img.taocdn.com/s3/m/753880ec5f0e7cd185253620.png)
第十四章氮族元素知识点归纳一、氮的单质单质氮在常况下是一种无色无味的气体,在标准状况下密度为1.25g/dm3。
工业上生产氮一般是由分馏液态空气在15.2MPa压力下装入钢瓶备用,或做成液氮存在于液瓶中,实验室中制备少量氮气。
N2分子是已知的双原子分子中最稳定的.在高温高压并有催化剂存在的条件下,氮气可以和氢气反应生成氨:二、氦的成键特征N原子价最子层结构为2s2p3,即有3个成单电子和一个孤电子对,在形成化合物时,其成键特征如下:(1)形成离子键N原子有较高的电负性,它同电负性较低的金属形成一些二元氮化物即能够获得部分负电荷而形成N3-离子。
(2)形成共价键N电子同电负性较高的非金属形成化合物时它总是以不同的共价键同其他原子相结合,这些共价键一般有以下几种:三、氮的氢化物1.氨(1)氨的制备氨是氮的最重要化合物之一,在工业上氨的制备是用氮气和氢气在高温高压和催化剂存在下合成的:(2)氨分子的结构在NH3中,氨采取不等性sp3杂化,有一对孤电子对,分子呈三角锥形结构,键角为107。
18’。
这种结构使得NH3分子有较强的极性。
(3)氨的物理性质和化学性质NH3具有相对高的凝固点、溶解热、蒸发热、溶解度和介电常数,氨极易溶于水。
在水中的溶解度比任何气体都大,237K时1 dm3的水能溶解1200dm3的氨。
氨的主要化学性质有:①还原性KH3和NH4+离子中N的氧化价为+3,因此它们在一定条件下只能有失去电子的倾向而显还原性。
常温下,氨在水溶液中能被Cl2,H2O2,KMnO4等氧化。
例如:③加合反应氨中氮原子上的孤电子对能与其他离子或分子形成配位键,结果形成了各种形式的氨合物,氨能与许多金属离子形成氨配合物如[Ag(NH3)2]+。
④弱碱性氨极易溶于水,它在水中主要是形成水合分子,同时在水中只有一部分水合氨分子发生电离作用。
NH3·H2O的K b=1.8×10—5,可与酸发生中和反应.(4)铵盐氨和酸作用可得到相应的铵盐,铵盐一般是无色晶体,易溶于水,而且是强电解质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•氨 (NH3)
结构: N:sp3杂化,三角锥形
..
N
107.3o
H
H
H
制备: 实验室:
2NH 4Cl Ca(OH) 2 CaCl 2 2H 2O 2NH 3 (g)
工业: N2 3H2 450~5 00C 30MPa Fe2NH3 性质:
① 易溶于水,易形成一元弱碱
NH3 H2O
NH3 H2O
Sb(OH)-4 Cl2 Na 2OH Na[Sb(OH)6 ](s,白) 2Cl-
Bi(OH) 3 Cl2 3NaOH NaBiO 3(s,土黄) 2NaCl 3H2O
M(V)的氧化性(由As到Bi氧化性增强)
H3AsO4 2I- 2H 强酸性 H3AsO3 I2 H2O
• •
顺磁性
分子轨道电子排布式:
(σ
1s
)
2
(σ
* 1s
)
2
(σ
2s
)
2
(σ
*
2s
)
2
(σ
2
p
)
2
(π
2
p
)
4
(π
*
2
p
)
2
酸性介质中:(氧化性强) O2 4H 4e- 2H2O E = 1.229V
碱性介质中: O2 2H2O 4e- 4OH- E = 0.401V
2. 臭氧(O3) 结构:
分子 晶体
分子 晶体
红硒 (分子晶体)
灰硒 (链状晶体)
2,4,6
链状 晶体
2,6
金属 晶体
单质Se
单质Te
H2R
H2O H2S H2Se H2Te
化学活性: 小
大
稳 定 性: 大
小
酸 性: 弱
强
熔 沸 点: 最高 小
大
14.2.2 氧及其化合物
1. 氧( O2)
结构式:
O O •
•
••• •••
Cu(NO3 )2 2NO2 2H2O 3Cu(NO3 )2 2NO 4H2O
4Zn 10HNO3 (较稀,2mol·L-1)
4Zn(NO3 )2 N2O 5H2O
规律:HNO3越稀,金属越活泼, HNO3 被还原的氧化值越低。
② 热稳定性差,保存在棕色瓶中
4HNO 3 4NO 2 O2 2H 2O
NH
4
Байду номын сангаас
OH
_
② 强还原性
4NH3 3O2 (纯) 2N2 6H2O 4NH3 5O2 (空气) Pt 4NO 6H2O
③ 加合反应
H NH3 NH4 Ag 2NH3 [Ag(NH3 )2 ]
④ 取代反应
2NH 3 2Na 5催70化C 2NaNH 2 H 2
•铵盐
①铵盐一般为无色晶体,绝大多数易溶于水
•氧化性(弱) 2Sb3 3Sn 2Sb 3Sn2 (鉴定Sb3+)
2Bi3 3Sn(OH)24- 6OH
2Bi 3Sn(OH)62 (鉴定Bi3+)
5.砷、锑、铋的硫化物
As2S3(黄) Sb2S3(橙) As2S5(黄) Sb2S5(橙)
Bi2S3(黑)
性质:•均不溶于水和稀酸。
•(浓HCl)配位溶解
焦磷酸、聚磷酸、偏磷酸。
•焦磷酸 H4P2O7
O
HO P O
OH
H HO
O
P OH
OH
O HO P O
OH
O
P OH +H2O
OH
•聚磷酸
聚磷酸(n个磷酸脱n-1个H2O)
n=3 三(聚)磷酸
O
O
n=2 焦磷酸
O
HO P O H HO P O H HO P OH
OH
OH
OH
O
O
O
HO P O P O
性质:① 易溶于水; ② 水溶液在酸性条件下才有氧化性, 固体在高温时有氧化性; ③ 热稳定性差。
K ~ Mg:2NaNO3 2NaNO2 O2 Mg ~ Cu:2Pb(NO3)2 2PbO 4NO2 O2
Cu以后:2AgNO3 2Ag 2NO2 O2
亚硝酸、硝酸及其盐的性质对比
● 酸性: HNO 3 HNO 2 ● 氧化性:
••
性质:
Π4 3
•不稳定性
中心O:sp2杂化形成 键角:117o
μ=1.8×10-30C•m
(极性单质)
2O 3 3O 2 Δ r H m = 285 .4kJ • mol -1 •氧化性
O3 2H 2eO3 H2O 2e-
O2 H2O EA = 2.075V O2 2OH EB = 1.247V
Sb2S3 12Cl- 6H 2SbCl36- 3H2S
Bi 2S3
8Cl-
6H
2BiCl
4
3H2S
Sb 2S5
12Cl
10 H
2SbCl
6
5H 2S
As2S3、As2S5不溶
•碱溶
NaOH
M2S3 6OH - MO33- MS33- 3H 2O
4M
2S5
24OH
-
3MO
3. 过氧化氢(H2O2)
94o
结构: 性质:
97pm
H
97 o
149pm
O
O
97 o
H
•弱酸性
H2O2
第十四章 p区元素(二)
§14.1 氮族元素 §14.2 氧族元素
§14.1 氮族元素
14.1.1 氮族元素概述 14.1.2 氮族元素的单质 14.1.3 氮的化合物 14.1.4 磷的化合物
14.1.1 氮族元素概述
氮族(VA):N,P,As,Sb, Bi 价电子构型:ns2np3
N P As Sb Bi
14.2.1 氧族元素概述
氧族
(VIA) 元素
O
S
非金属
存在 单质或矿物
价层电 子构型
2s22p4
3s23p4
电负性 3.44 2.58
Se
Te
Po
准金属
放射性金属
共生于重金属硫化物中
4s24p4 5s25p4
6s26p4
2.55
2.10
2.0
氧化值 -2, (-1) ±2,4,6 ±2,4,6
晶体
3.氮的含氧酸及其盐
•亚硝酸(HNO2)
结构:
H
。
102
O
N
。
110
O
N:sp2杂化后: π
性质: ① 不稳定
2HNO2
② 弱酸
HNO 2
H2O N2O3
(蓝色)
H
_
NO 2
Ka = 6.0×10 _ 4
H2O NO NO2
•硝酸 (HNO3) 结构:
N:sp2杂化后
Π
Π4 3
物理性质 : 纯硝酸:无色液体,密度为1.53g·cm-3 浓硝酸:含HNO3 69%,密度 1.4g·cm-3
E (HNO2/NO) = 1.04V E (NO3- /NO) = 0.96V
● 热稳定性: HNO 3 HNO 2
14.1.4 磷的化合物
•磷酸 H3PO4
O
结构:
P
HO
性质:三元中强酸 OH
OH
Ka1 = 6.7 103 Ka3 = 4.51013
Ka2 = 6.2108
特性:脱水缩合后形成
OH
OH
P OH 2H 2O OH
•偏磷酸
偏磷酸 (n个H3PO4脱n个H2O) 偏磷酸:HPO3(n=1),四偏磷酸:(HPO3)4
O
O
O
O
HO P O H HO P OH
HO P O P OH
O
O
H
H
O
O
H
H
HO P O P OH
O
O
HO P OH H O P OH
O
O
O
O
+4H2O
酸性变化一般规律 •缩合度增加,酸性增强。
34
5MS
34
12H
2O
(M=As,Sb) Bi 2S3 不溶
Na2S
M2S3 3S2M2S5 3S2-
2MS332MS34-
(M=As,Sb) Bi2S3不溶
•氧化性酸(HNO3)溶解
Bi 2S3
2NO
3
8H
2Bi
3
3S
2NO
4H 2O
§14.2 氧族元素
14.2.1 氧族元素概述 14.2.2 氧及其化合物 14.2.3 硫及其化合物
2.氮的氧化物
• 一氧化氮(NO) 性质: 无色气体,水中溶解度较小。
2NO O2 2NO2 2NO Cl2 2NOCl(氯化亚硝酰) Fe2 NO [Fe(NO)]2
• 二氧化氮(NO2)
结构:
:
性质:
N:价电子2s22p3
Π
sp2杂化后
Π3
3
① 有毒,有特殊臭味的红棕色气体
② 2NO(2 红棕色)1冷40却C N 2O(4 无色) ③ 溶于水 3NO 2 H 2O 2HNO 3 NO
③ 与有机化合物发生硝化反应
C6 H 6 HNO 3 H2SO4 C6 H5 NO 2 H 2O
多为黄色
CH3C6H5 3HNO3 H2SO4 △ CH3C6H2 (NO2 )3 3H2O TNT(三硝基甲苯)
•硝酸盐
NO
3
的结构:N:sp2杂化后
Π
