2相平衡和相图PPT课件
合集下载
第六章相平衡与相图第二讲

液相点: 固相点:
4 P ( E F 0,L相消失)
F 2 F 1
C
D J H
A C
L%=
FG 100% PF
B%=
PG 100% PF
L%=
DG 100% PD
AmBn%=
PG 100% PD
小结: 至此,我们遇到两种二元无变量点,即低共熔点E和 转熔点P,在这两个无变量点上都表示一个液相与两个固 相之间的三相平衡,但它们的区别在于: 低共熔点E的相平衡关系是:
终点,F=0
p
转熔(加热)
(3) 析晶路线分析
熔体1析晶过程分析:
图中的1、2、3、4、5点
1 K b M
T a L+A E A+C
C的组成为AmBn 在转熔点P处,
L
P L+C
D
L+B
F
Lp B C
J C+B B
L p B C
L和B同时消失 P点是回吸点 也是析晶终点
3、生成一个不一致熔融化合物的二元相图
不一致熔化合物:是不稳定化合物。加热这种化合物到某一 温度
便分解成一种液相和一种晶相,二者组成与化 合物组成皆不相同。
(1) 相图特点:组分A与组分B生成化合物AmBn;
T a L+A E b L+B T
P
且AmBn的组成点位于其液相线的组成范围以外
L
P L+ AmBn
A+AmBn
L +AmBn
整个相图可分解成两个具有 低共熔点的二元系统,即:
A Am Bn和Am Bn B
E1是A Am Bn分二元系统的低共熔点 , 。 B E2是Am Bn B分二元系统的低共熔点
《材料科学基础》课件——第五章相平衡与相图第一节第二节第三节第四节

相和相平衡
Байду номын сангаас四、自由度与相律
1、自由度:平衡系统中独立可变的因素
自由度数:独立可变的强度变量的最大数目
(强度变量与广度变量的区别)
2、相律:自然规律
在平衡系统中由于受平衡条件的制约,系统内
存在的相数有一定限制。 组元数 相数P≥1
吉布斯相律:不可为负数
f=c-p+n
外界影 响因素
通常外界影响因素只考虑T、P,所以f=c-p+2
• 掌握匀晶,包晶,共晶相图的特点,进而了解二元合金的一些平衡凝固,固 相转变的规律。
• 重点难点: • 二元系相图的建立,杠杆定律 • 包晶相图,共晶相图,共晶合金 • 相图分析,各种液固,固相转变的判断
材料的性能决定于内部的组织结构,而组织结构
又由基本的相所组成。
相:均匀而具有物理特性的部分,并和体系的其他 部分有明显界面。
晶型转变过程都是在恒温下进行,并伴随有体 积、密度的变化。 2、SiO2系统相图 α-石英与β-石英相变相当慢, β-石英常因冷却过快而被保留 到室温,在常压下,低于573℃
单元系相图
β-石英很稳定,所以自然界或低温时最常见的是 β-石英。晶型转变时,体积效应特别显著。 Al2O3、ZrO2也具有多晶型转变。 3、聚合物相图 (1)状态由分子间作用力决定,分子间约束力弱
共晶相图,平衡凝固,共晶合金,包晶相图,形成化合物的相图,含有双液 共存区的相图,熔晶相图等 ,二元相图的几何规律 ,单相,双相及三相共 存区,相图特征 ,二元系相图的分析,分析的方法与步骤,分析举例。
• 教学目的: • 学习相平衡与相图的基本知识,了解相图在材料科学学习中的重要性,学会
相图的使用。
物理化学课件二组分相图相图解读

2
压力-组成图(p~ xB图)
设组分A和B形成理想液态混合物(见图). 气-液平衡时蒸气总压p与液相组成xB的关系: 在温度T下两相平衡时, 由拉乌尔定律
* * xB pA pA xA , pB pB
T一定
g p y A yB pA pB xA xB l
•理想液态混合物的 气 - 液平衡
A和B均满足 pB = p*B xB
t 一定 p
p
l (A+B) M
* B
nGxG + nLxL = (nG + nL) xM 得
L 总 nG n n B B B
L
G
nL xG xM MG 推导 nG xM xL LM
B 既是系统点又是相点
A
xL xM xG nL nM nG
xB
7
• 实际混合物中苯(B)和甲苯(A)双液系的性质接近理想 混合物, 在79.7 ℃下实测 压力-组成 数据如下:
液相组成 xB 0 0.1161 0.2271 0.3383 0.4532 0.5451 0.6344 0.7327 0.8243 0.9189 0.9565 1.000
8
相点
系统点
液相线
• 点, 线, 区的含义 及各状态下自由 度数; • 会读系统总组成 g p 与相组成 ; yA yB pA pB 气相线 xA xB 相点 l
T一定
结线 •理想液态混合物的 气 - 液平衡
蒸气压组成相图 A和B均满足 pB = p*B xB
9
2. 温度-组成图(T~ xB图)
在恒压下表示二组分系统气-液平衡时的温度和
组成的关系. 根据实验数据可以作出T~x图(包括气相线和液 相线). 例如:苯~甲苯的T~x图如下:
物理化学课件二组分相图相图

* A A
气相线(p~y图) 将气相线与液相线画在同一张图上得:
6
系统点
p
相点
t 一定
l (A+B) M
L
G
• 系统点: 表示系统总状态 p (总组成)的点(例如M点); 结线 • 相点:表示各个相的状态的 点( 只有一个相时,系统点 就是相点) (例如L、G点).
* B
* pA
g (A+B)
• 结线: 两个平衡相点的连 结线。 相点
0.18 l A+B)
气相线
g(A+B)
0.12
0.06 g (A+B) 0.2 0.4 xB 0.6 0.8 1.0 B
p
* A
0.0 A
•H2O(A) - C3H6O (B)系统的压力-组成图
20
具有最大正偏差系统的压力-组成图 液相线和气相线在最高点处相切
1. 0 60 50
t =35 ℃
l L G
* f AB < f AA * f AB < f BB
•若纯组分有缔合作用, 在形成混合物后发生离解, 因分子数 增多而产生正偏差.
•混合时常有吸热及体积增大现象. 关于负偏差: •若两组分分子间的吸引力大于各纯组分分子间吸引力, 形成 混合物后, 分子就较难逸出液面而产生负偏差. * * f AB > f AA f AB > f BB
•若形成混合物后分子发生缔合, 因分子数减少而产生负偏差.
•混合时常有放热及体积缩小现象.
19
②. 压力-组成图
一般正偏差和一般负偏 差系统的压力-组成图 与理想系统的主要 差别是液相线不是直 线. 如: 统. 水和丙酮系
相图与相平衡PPT课件

第36页/共49页
1200
同成分点:
1100
铁 电
48.4% Li2O
1000
相 变
51.6% Nb2O5
固溶体结构式:
Li0.938 NbO2.969
Nb2O5 46 48 50
摩尔分数
52 Li2O
非化学计量比 !!
Li2O Nb2O5 二元系相图(部分)
第37页/共49页
同成分生长会给晶体带来大量的本征缺陷,如 高达摩尔分数 1%的反位铌( N)bL和i 摩尔分数 的4锂%
1875 1835
MP
LG
LP
PG
1865
G : 3Y2O3 • 5Al2O3 YAG
M : 2Y2O3 • Al2O3
M G
Y2O3 M
P
摩尔分数
G Al2O3
Y2O3 Al2O3 二元系相图(部分)
第31页/共49页
ⅱ)助熔剂法生长 (稳定化合物、固态相变)
1700 1600 1500 1400 1300
• 一个相中可以包含几种物质(组元)
• 一种物质可以形成几个相
通常将具有 n 个独立组元的系统称为 n 元 系统。只有在特定条件下,独立组元和组元的 含义才相同。即
• 系统中不存在化学反应
• 同一相内不存在浓度制约关系
第11页/共49页
ⅲ)自由度(数)
在不引起旧相消失和新相产生的前提下, 可以在一定范围内独立改变的 (如相数、相态、 组成、温度和压力等)的最大数目称为相平衡 体系在指定相态下的自由度数。
相图是描述多相平衡体系中相的存在状 态和变化规律与成分、温度及压力等之间 关系的一种热力学图示。相图是将晶体生 长与热力学联系起来的媒介,具有直观性 和整体性的优点。
1200
同成分点:
1100
铁 电
48.4% Li2O
1000
相 变
51.6% Nb2O5
固溶体结构式:
Li0.938 NbO2.969
Nb2O5 46 48 50
摩尔分数
52 Li2O
非化学计量比 !!
Li2O Nb2O5 二元系相图(部分)
第37页/共49页
同成分生长会给晶体带来大量的本征缺陷,如 高达摩尔分数 1%的反位铌( N)bL和i 摩尔分数 的4锂%
1875 1835
MP
LG
LP
PG
1865
G : 3Y2O3 • 5Al2O3 YAG
M : 2Y2O3 • Al2O3
M G
Y2O3 M
P
摩尔分数
G Al2O3
Y2O3 Al2O3 二元系相图(部分)
第31页/共49页
ⅱ)助熔剂法生长 (稳定化合物、固态相变)
1700 1600 1500 1400 1300
• 一个相中可以包含几种物质(组元)
• 一种物质可以形成几个相
通常将具有 n 个独立组元的系统称为 n 元 系统。只有在特定条件下,独立组元和组元的 含义才相同。即
• 系统中不存在化学反应
• 同一相内不存在浓度制约关系
第11页/共49页
ⅲ)自由度(数)
在不引起旧相消失和新相产生的前提下, 可以在一定范围内独立改变的 (如相数、相态、 组成、温度和压力等)的最大数目称为相平衡 体系在指定相态下的自由度数。
相图是描述多相平衡体系中相的存在状 态和变化规律与成分、温度及压力等之间 关系的一种热力学图示。相图是将晶体生 长与热力学联系起来的媒介,具有直观性 和整体性的优点。
第二章相平衡及相图

pA p x
* A
* A A
* A
p pA pA p (1 xB ) xB * pA 适用条件:理想稀溶液中溶剂或理想液态混合物。
如果溶液中只有A,B两个组分,则
2-4-2 享利定律
在一定温度下,稀溶液中挥发性溶质在气相中 的平衡分压与在溶液中的摩尔分数(或质量摩尔浓 度、物质的量浓度)成正比。
def
S - R - R′
§2-1
R’包括:
相律
1)当规定系统中部分物种只通过化学反应由
另外物种生成时,由此可能带来的同一相的 组成关系。 2)由电中性条件带来的同一相的组成关系。
例1 (1) 仅由 NH4Cl(s) 部分分解,建立如下反应
平衡:
NH4Cl (s) =NH3(g)+HCl(g)
(2) 仅由CaCO3(s)部分分解,建立如下反应平衡: CaCO3 (s) = CaO(s)+CO2(g)
pB kx,B xB
pB kb,BbB
pB kc,BcB
式中比例系数称为亨利系数。 适用条件:稀溶液中挥发性溶质,且溶质在 气相和在溶液中的分子状态必须相同。
2-4-3 拉乌尔定律和亨利定律对比
1 共同点 (1)适用于稀溶液; (2)表达形式相似。 2区别
(1)比例常数不同;
(2)针对的具体对象不同。
和1molB(l)形成理想混合物,则
ΔmixS= J/K,
ΔmixH=
ΔmixG=
kJ,
kJ。
答案: ΔmixS = 11.53 J/K, ΔmixH = 0 kJ, ΔmixG = -3.44 kJ。
§2-6
理想稀溶液
2-6-1 理想稀溶液的定义 一定温度下,溶剂和溶质分别服 从拉乌尔定律和亨利定律的无限稀薄溶 液。
6.1二元相图-相图的基本知识

• 2.相律
• 相律是表示在平衡条件下,系统的自由度数、组元数和平 衡相数之间的关系式。
• 自由度数是指在不改变系统平衡相的数目的条件下,可以 独立改变的,不影响合金状态的因素(如温度、压力、平 衡相成分)的数目。
f c p2
• 对于不含气相的凝聚体系,压力在通常范围的变化对平衡 的影响极小,一般可认为是常量。
相是体系中具有相同物理与化学性质的 均匀部分的总和,相与相之间有界面, 各相可以用机械方法加以分离,越过界 面时性质发生突变。 相
特征:
• 1.一个相中可以包含几种物质,即几种物质可以形成一个 相;
• 2.一种物质可以有几个相;
• 3.固体机械混合物中有几种物质就有几个相;
• 4.一个相可以连续成一个整体,也可以不连续。
时,合金全部转变为α固溶体; • 若继续从α4点冷却到室温,为单一的α固溶体。
温度
t1 t2 t3 t4
成分 l1 l2
l3
l4
L 质量分数
100%
2 X0 2 l2
3 X0 3 l3
0%
α
变化趋势 成分 质量分数 变化趋势
α1
0%
α2
X 0 l2
2 l2
α3
X 0 l3
3 l3
WL
WS
WL
WS
WL WS WOWLWL X1 WS X 2 WO X
a
WL X 2 X ob WS X X1 oa
(X1) WL X1
WL ob 100% Wo ab Ws oa 100% Wo ab
WS X2
WS
o(X)
b (X2)
X2-X
X
X-X1
6.1.3 相图的建立
第八章 相平衡与相图原理PPT课件

(2)在两切点之间成分范围内的二元合金,具有
切点成分的相平衡共存时系统的吉布斯自由能最低
精选PPT课件
14
2、二元系两相平衡
在这两条曲线的公切线上得到两个公切点 a 和 b 。
这两个切点就是合金处于 α + β 两相平衡时,两个
平衡相的成分。
精选PPT课件
15
三相呈两个两相平衡时的自由能曲线
精选PPT课件
•(2)相律给出了平衡状态下体系中存在的相数与 组元数及温度、压力之间的关系,对分析和研究相 图有重要的指导作用。
•(3)相律只能表示体系中组元和相的数目,不能 指明组元或相的类型和含量
•(4)相律不能预告反应动力学(速度)
精选PPT课件
7
补充:单元系相图 特征:C=1, f=C-P+2=3-P
一、相图的建立
3、组织:人们用肉眼或借助某种工具(放大镜、 光学显微镜、电子显微镜等)所观察到的材料形貌。
4、组织组成物:组织中形貌相同的组成部分。
精选PPT课件
2
5、相:体系中具有相同物理与化学性质的,且与其他部分 以界面分开的均匀部分称为相。
相的理解: (1)一个相中可以包含几种物质,即几种物质可以形成
一个相; (2)一种物质可以有几个相; (3)固体机械混合物中有几种物质就有几个相。
精选PPT课件
8
二、相图分析
• 1. 三个单相区:
f=1-1+2=2
2. 三个两相线:
oa代表水汽二相图共存 (蒸发曲线); ob代表冰汽二相的平衡共存 (升华曲线); oc线则代表冰水二相图共存(冰的熔融曲线)
f=1-2+2=1
精选PPT课件
9
相平衡和相图
材料科学基础
30
第六章 相平衡和相图
C 例:根据下列相图 (1) 用连线规则划分副三角形。 (2) 用箭头标出界线上温度变化方向及界线性质。 C (3) 判断S、S1、S2化合物的性质。 (4) 写出各无变量点的性质及反应式。 (5)在相图下侧画出A-B二元系统相图。 u v (6) 分析熔体M1、M2的析晶路程。 S (M1在SO连线上)
第六章 相平衡和相图
13
3、背向线规则
在浓度三角形中,一个三元系统的组成点愈靠近某个顶点,
该顶点所代表的组分的含量就愈高;反之,愈少。
C 若熔体在冷却时析出某一
顶点所代表的组元,则液
相中组成点必定沿着该顶 点与熔体组成点的连线向 背离该顶点的方向 A
材料科学基础
D
B
第六章 相平衡和相图
14
4、杠杆规则
C C
b L .2 N
a
e2
K
1
.
B
x B
z y
熔体1
L LB 1[B,(B)] a[B,B+(A)] f=3 f=2
L B+N f=1
L B+A K[x,B+A+(N)] f=1
e1
L+AB+N f=0
K[y(A消失),N+B]
LN+B+C L[z,N+B+(C)] f=0
L(液相消失)[1,N+B+C]
所谓一致熔融化合物是一种稳定 的化合物。它与正常的纯物质一 样具有固定的熔点,融化时,所
产生的液相与固相的化合物组成 相同,故称一致熔融
材料科学基础
2
第六章 相平衡和相图
2、不一致熔融化合物: 一种不稳定的化合物,加热这种 化合物到某一温度便发生分解, 分解产物是一种液相和一种晶相, 二者组成与原来化合物组成完全 不同。 点:纯物质熔点;低共熔点; 转熔点等 线:液相线(3条)固相线等;
30
第六章 相平衡和相图
C 例:根据下列相图 (1) 用连线规则划分副三角形。 (2) 用箭头标出界线上温度变化方向及界线性质。 C (3) 判断S、S1、S2化合物的性质。 (4) 写出各无变量点的性质及反应式。 (5)在相图下侧画出A-B二元系统相图。 u v (6) 分析熔体M1、M2的析晶路程。 S (M1在SO连线上)
第六章 相平衡和相图
13
3、背向线规则
在浓度三角形中,一个三元系统的组成点愈靠近某个顶点,
该顶点所代表的组分的含量就愈高;反之,愈少。
C 若熔体在冷却时析出某一
顶点所代表的组元,则液
相中组成点必定沿着该顶 点与熔体组成点的连线向 背离该顶点的方向 A
材料科学基础
D
B
第六章 相平衡和相图
14
4、杠杆规则
C C
b L .2 N
a
e2
K
1
.
B
x B
z y
熔体1
L LB 1[B,(B)] a[B,B+(A)] f=3 f=2
L B+N f=1
L B+A K[x,B+A+(N)] f=1
e1
L+AB+N f=0
K[y(A消失),N+B]
LN+B+C L[z,N+B+(C)] f=0
L(液相消失)[1,N+B+C]
所谓一致熔融化合物是一种稳定 的化合物。它与正常的纯物质一 样具有固定的熔点,融化时,所
产生的液相与固相的化合物组成 相同,故称一致熔融
材料科学基础
2
第六章 相平衡和相图
2、不一致熔融化合物: 一种不稳定的化合物,加热这种 化合物到某一温度便发生分解, 分解产物是一种液相和一种晶相, 二者组成与原来化合物组成完全 不同。 点:纯物质熔点;低共熔点; 转熔点等 线:液相线(3条)固相线等;
材料科学基础课件第六章--相平衡与相图

F = C-P+n
自由 度数
独立组 元数
F = C-P+2
对凝聚态体系, 压力恒定或影响 较小,其相律为:
F = C-P+1
组元数C多,自 由度F大;相数P 多,自由度小
6.1.3 相平 衡研究方法
动态法
静态法 (淬冷法)
热分 析法
差热分 析法
T/℃
(1ቤተ መጻሕፍቲ ባይዱ 热分析法
1
2
3
原理:根据系统在冷却
ab c
100 80Bi 60Bi 20Bi 100 Bi 20Cd 40Cd 80Cd Cd
T/℃
ab c d e
t/s
Bi-Cd合金冷却曲线
546.15K
596.15K
L
L+Bi(s) ●
L+Cd(s)
20 40 Bi(s)+Cd(s) 80
0 Bi
WCd/%
100 Cd
Bi-Cd系统相图
液相线:由凝固开始温度连接起来的相界线 固相线:由凝固终结温度连接起来的相界线
元系统相图
P ●:熔点
■:转变点
2
L
●
Ⅱ
3
■
1
●
Ⅰ
O T0 T2 T1 T3
T
图 6-7 具有不可逆多晶转变的
单元系统相图
晶体I T3 晶体II
晶体Ⅰ 晶体Ⅱ 液相
(1) 晶体I、Ⅱ有稳定区 (2) 转变温度T3<T1 、T2(熔点)
T1 液 相 T2
(1)晶体Ⅱ无稳定区 (2)T3>T1、T2
6.2.2 单元系统专业相图
G
E
H
A+B
A
相平衡和相图(共294张PPT)

C=1,称为单元系统; C=2,称为二元系统; C=3,称为三元系统学反响,那么: 独立组元数=物种数〔即组元数〕
〔2〕如果系统中存在化学反响并建立了平衡,
那么: 独立组元数=物种数一独立化学反响数
〔指独立化学平衡关系式数〕
例如,由CaCO3、CaO、CO2组成 的系统,在高温下存在下述反响:
〔1〕稳定相平衡局部〔即实线局部〕 相区: FCD是液相区; ABE是β-晶型的相区; EBCF是α-晶型的相区, 在ABCD以下是气相区。
相界线:
CD线:是液相和气相两相平衡共存线,即液相
的蒸发曲线; BC线:是α-晶型和气相两相平衡共存线,即α-
晶型的升华曲线;
AB线:是β-晶型和气相两相平衡共存线,即β晶型的升华曲线;
〔或延长线〕的交点是该晶体的熔点。
②两种晶型的升华曲线的交点是两种晶型的多晶转 变点。
③在同一温度下,蒸气压低的相更加稳定。所以, 介稳平衡的虚线,总是在稳定平衡的实线上方 。
④交汇于三相点的三条平衡曲线互相之间 的位置遵循下面两条准那么:
a、每条曲线越过三相点的延长线必定在另 外两条曲线之间。
b、同一温度时,在三相点附近比容差最大 的两相之间的单变量曲线或其介稳延长 线居中间位置。
假设该反响能够到达平衡,那么有 一个独立的化学反响平衡常数。
此时,虽然组元数=3,但独立组元 数C=3-1=2。
4、自由度 在一定范围内,可以任意改变而不
引起旧相消失或新相产生的独立变量称 为自由度,平衡系统的自由度数用F表示。
这些变量主要指组成〔即组分的浓 度〕、温度和压力等。
5、外界影响因素 影响系统平衡状态的外界因素包括:温度、压力、电
主要区别在于固-液平衡的熔融曲线OC线倾斜
〔2〕如果系统中存在化学反响并建立了平衡,
那么: 独立组元数=物种数一独立化学反响数
〔指独立化学平衡关系式数〕
例如,由CaCO3、CaO、CO2组成 的系统,在高温下存在下述反响:
〔1〕稳定相平衡局部〔即实线局部〕 相区: FCD是液相区; ABE是β-晶型的相区; EBCF是α-晶型的相区, 在ABCD以下是气相区。
相界线:
CD线:是液相和气相两相平衡共存线,即液相
的蒸发曲线; BC线:是α-晶型和气相两相平衡共存线,即α-
晶型的升华曲线;
AB线:是β-晶型和气相两相平衡共存线,即β晶型的升华曲线;
〔或延长线〕的交点是该晶体的熔点。
②两种晶型的升华曲线的交点是两种晶型的多晶转 变点。
③在同一温度下,蒸气压低的相更加稳定。所以, 介稳平衡的虚线,总是在稳定平衡的实线上方 。
④交汇于三相点的三条平衡曲线互相之间 的位置遵循下面两条准那么:
a、每条曲线越过三相点的延长线必定在另 外两条曲线之间。
b、同一温度时,在三相点附近比容差最大 的两相之间的单变量曲线或其介稳延长 线居中间位置。
假设该反响能够到达平衡,那么有 一个独立的化学反响平衡常数。
此时,虽然组元数=3,但独立组元 数C=3-1=2。
4、自由度 在一定范围内,可以任意改变而不
引起旧相消失或新相产生的独立变量称 为自由度,平衡系统的自由度数用F表示。
这些变量主要指组成〔即组分的浓 度〕、温度和压力等。
5、外界影响因素 影响系统平衡状态的外界因素包括:温度、压力、电
主要区别在于固-液平衡的熔融曲线OC线倾斜
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例如: ① 几种化合物混合在一起能合成出什么?(方向) ② 能得到多少预计的相组成?(限度)
第一节 一元系统相图
单元系统中,只有一种组分,不存在浓度问题,影响因素只 有温度和压力。
F = C - P +n C=1,n=2 故:F = c-p + 2 = 3 - p 则:Pmin=1,fmax=2 Pmax=3,fmin=0
原因:亚稳相向稳定相的转化需要克服能量势垒。
• 稳定相与亚稳相的区别:
(1) 每一个稳定相有一个稳定存在的温度范围, 超过这个范围就变成亚稳相。
可以 忽略压强的影响,相律中的“n”应为“1”。
3. 必须正确判断独立组分数、独立化学反应式、相数以及限 制条件数,才能正确应用相律。
4. 自由度只取“0”以上的正值。如果出现负值,则说明体系可 能处于非平衡态。
相平衡: • 相与相之间的平衡,是动态平衡。 • 相平衡在一定条件下建立,当条件被破坏时,平衡
问题1:为什么不把过冷水及玻璃称为不稳定相而 称为亚稳相?
原因:一方面亚稳相的蒸气压比同一温度范围内的 稳定相高;另一方面由于热力学所讨论的是平衡 过程,这过程可能较快,也可能无限缓慢。虽然 热力学规定了总的变化趋势,但亚稳相能在自然 界长期的存在。
如玻璃长期不结晶;金刚石不转化成石墨等。
问题2:为什么会有在一定限度内的稳定性呢?
C
P
溶解 L
S
临界点
A
蒸发
O
D
升华
g
B
解释界线的斜率:
温度
由克劳修斯-克拉珀龙方程dp/dT=q/TΔV ,
式中:p代表压力,
T代表温度,
q代表相变热效应,
ΔV代表相变前后的体积变化。
• 根据上式讨论升华、蒸发、熔融三条平衡曲线的斜率。
• 从低温型向高温转变, q >0;
L g ;S g ΔV>0, 则斜率>0 ;
也被破坏,并在新的条件下建立新的平衡。
相图即平衡相图,反映的是体系所处的热力学平衡状 态,即仅指出在一定条件下体系所处的平衡态 (其 中所包含的相数,各相的状态、数量和组成), 与 达平衡所需的时间无关。相图是从热力学角度研究 问题,具有热力学研究的特点。
利用相图可知某一确定组成在某温度下存在哪些 相及各相的相对含量,但一切未达到平衡的现象在相 图上得不到反映。相图是从热力学角度研究问题,具 有热力学研究的特点。
固体:有几种物质就有几个相,但如果是固溶体时为一个相。 因为在 固溶体晶格上各组分的化学质点随机分布均匀,其物理性 质和化学性质符合相均匀性的要求,因而几个组分形成的固溶体 是 一个相。
液体:视其混溶程度而定。
p - 相数, p = 1 单相系统,p = 2 双相系统,p = 3 三相系统
2、组分、独立组分 (组元)组分:组成系统的物质。 独立组分:足以表示形成平衡系统中各相所需要的最少数目的 组分: c = 组分数-独立化学反应数目-限制条件 例如:
一、水的相图
二、一元相图的型式
三、可逆和不可逆的多晶转变
四、SiO2系统的相图
五、ZrO2 系统
一、水的相图
2000个大气压以上,可得重冰,比重大于水。
C
P
溶解 L
S
临界点
蒸发
O D
升华
g
B
温度
T=374℃ P=217.7大气压
注意:
冰点:是一个大气压下被空气饱和的水和冰的平衡共存温度(273.15K); 三相点O:是在它自己的蒸汽压力(0.610kPa)下的凝固点(273.16K)。
•
Al2-Al2O3-SiO2三元系统
• 注意区分:2CaO.SiO2(C2S) ;
•
CaO-SiO2;
•
K2O.Al2O3.4SiO2 -SiO2
3、自由度 (f) 定义: 温度、压力、组分浓度等可能影响系统平衡状态的变量中,
可以在一定范围内改变而不会引起旧相消失新相产生的独立变量的 数目, 具体看一个二元系统的自由度。
而S L 冰变成水ΔV<0 , 斜率<0 。
对于同一种物质来说肯定有q升华>q蒸发,所以
dP dP dT 升 dT 蒸
在熔融情况下,ΔV很小,所以斜率一定很大,于是
dp dp dp dT 熔 dT 升 dT 蒸 其它金属或SiO2 , ΔV>0 ,则斜率>0 。 如对于有晶型转变的,由于ΔV很小,因而其界线几乎是 垂直的。
般为温度、压力,n=2。
• 凝聚系统:只考虑固相的系统,压力可忽略,n=1 (温度变量)
1、相:指系统中具有相同的物理性质和化学性质的均匀部分。
注:均匀指微观尺度上的均匀,而非一般意义上的均匀。
(i) 相与相之间有界面,可以用物理或机械办法分开。
(ii) 一个相可以是均匀的,但不一定是一种物质。
气体:一般是一个相,如空气组分复杂。
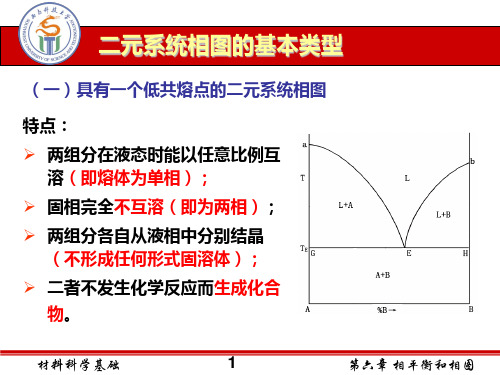
L f=2
L+A f=1
f =0 E
L+B f=1
A+B f=1
A
B
相律应用必须注意以下四点: 1. 相律是根据热力学平衡条件推导而得,因而只能处理真实 的热力学平衡体系。 2. 相律表达式中的“n”通常为“2”是代表外界条件温度和压
强。 如果电场、磁场或重力场对平衡状态有影响,则相律中的 “2”应为“3”、“4”、“5”。如果研究的体系为固态物质,
CaCO3 CaO CO2 c = 3-1-0 = 2
系统中化学物质和组分的关系: ①当物质之间没有化学反应时,化学物质数目=组分数; ②当物质之间发生化学反应时,
组分数 = 化学物质数 – 在稳定条件下的化学反应数。
• 在硅酸盐系统中经常采用氧化物作为系统的组 分。
• 如:SiO2一元系统
C
P
溶解 L
S
蒸发
O
D
升华
g
B
临界点
A
温度
• AO线可延伸到D点。OD线在OB线之上,这表示过冷
水的蒸气压要比同温度下的冰蒸气压大。
• 过冷水不如冰稳定,处于亚稳状态,可作为亚稳相。
• 许多物质从高温熔融状态较快地冷却经过熔点时来不 及结晶得到的玻璃相也是一种亚稳相。
• OD线以上的区域称为亚稳区。
第二章 相平衡与相图
主要内容
★ 系统阐述相图的基本原理 ★ 结合实际介绍相图在无机非金属材料 的研究和生产实践中的具体应用。
相律
• f+P=C+n
• 其中:P——相数;
•
C——独立组元数
•
f——自由度:在一定范围内可任意独立改变
而不至于引起旧相消失或新相出现的变数。
•
n——影响系统相平衡的外界因素的总和。一
第一节 一元系统相图
单元系统中,只有一种组分,不存在浓度问题,影响因素只 有温度和压力。
F = C - P +n C=1,n=2 故:F = c-p + 2 = 3 - p 则:Pmin=1,fmax=2 Pmax=3,fmin=0
原因:亚稳相向稳定相的转化需要克服能量势垒。
• 稳定相与亚稳相的区别:
(1) 每一个稳定相有一个稳定存在的温度范围, 超过这个范围就变成亚稳相。
可以 忽略压强的影响,相律中的“n”应为“1”。
3. 必须正确判断独立组分数、独立化学反应式、相数以及限 制条件数,才能正确应用相律。
4. 自由度只取“0”以上的正值。如果出现负值,则说明体系可 能处于非平衡态。
相平衡: • 相与相之间的平衡,是动态平衡。 • 相平衡在一定条件下建立,当条件被破坏时,平衡
问题1:为什么不把过冷水及玻璃称为不稳定相而 称为亚稳相?
原因:一方面亚稳相的蒸气压比同一温度范围内的 稳定相高;另一方面由于热力学所讨论的是平衡 过程,这过程可能较快,也可能无限缓慢。虽然 热力学规定了总的变化趋势,但亚稳相能在自然 界长期的存在。
如玻璃长期不结晶;金刚石不转化成石墨等。
问题2:为什么会有在一定限度内的稳定性呢?
C
P
溶解 L
S
临界点
A
蒸发
O
D
升华
g
B
解释界线的斜率:
温度
由克劳修斯-克拉珀龙方程dp/dT=q/TΔV ,
式中:p代表压力,
T代表温度,
q代表相变热效应,
ΔV代表相变前后的体积变化。
• 根据上式讨论升华、蒸发、熔融三条平衡曲线的斜率。
• 从低温型向高温转变, q >0;
L g ;S g ΔV>0, 则斜率>0 ;
也被破坏,并在新的条件下建立新的平衡。
相图即平衡相图,反映的是体系所处的热力学平衡状 态,即仅指出在一定条件下体系所处的平衡态 (其 中所包含的相数,各相的状态、数量和组成), 与 达平衡所需的时间无关。相图是从热力学角度研究 问题,具有热力学研究的特点。
利用相图可知某一确定组成在某温度下存在哪些 相及各相的相对含量,但一切未达到平衡的现象在相 图上得不到反映。相图是从热力学角度研究问题,具 有热力学研究的特点。
固体:有几种物质就有几个相,但如果是固溶体时为一个相。 因为在 固溶体晶格上各组分的化学质点随机分布均匀,其物理性 质和化学性质符合相均匀性的要求,因而几个组分形成的固溶体 是 一个相。
液体:视其混溶程度而定。
p - 相数, p = 1 单相系统,p = 2 双相系统,p = 3 三相系统
2、组分、独立组分 (组元)组分:组成系统的物质。 独立组分:足以表示形成平衡系统中各相所需要的最少数目的 组分: c = 组分数-独立化学反应数目-限制条件 例如:
一、水的相图
二、一元相图的型式
三、可逆和不可逆的多晶转变
四、SiO2系统的相图
五、ZrO2 系统
一、水的相图
2000个大气压以上,可得重冰,比重大于水。
C
P
溶解 L
S
临界点
蒸发
O D
升华
g
B
温度
T=374℃ P=217.7大气压
注意:
冰点:是一个大气压下被空气饱和的水和冰的平衡共存温度(273.15K); 三相点O:是在它自己的蒸汽压力(0.610kPa)下的凝固点(273.16K)。
•
Al2-Al2O3-SiO2三元系统
• 注意区分:2CaO.SiO2(C2S) ;
•
CaO-SiO2;
•
K2O.Al2O3.4SiO2 -SiO2
3、自由度 (f) 定义: 温度、压力、组分浓度等可能影响系统平衡状态的变量中,
可以在一定范围内改变而不会引起旧相消失新相产生的独立变量的 数目, 具体看一个二元系统的自由度。
而S L 冰变成水ΔV<0 , 斜率<0 。
对于同一种物质来说肯定有q升华>q蒸发,所以
dP dP dT 升 dT 蒸
在熔融情况下,ΔV很小,所以斜率一定很大,于是
dp dp dp dT 熔 dT 升 dT 蒸 其它金属或SiO2 , ΔV>0 ,则斜率>0 。 如对于有晶型转变的,由于ΔV很小,因而其界线几乎是 垂直的。
般为温度、压力,n=2。
• 凝聚系统:只考虑固相的系统,压力可忽略,n=1 (温度变量)
1、相:指系统中具有相同的物理性质和化学性质的均匀部分。
注:均匀指微观尺度上的均匀,而非一般意义上的均匀。
(i) 相与相之间有界面,可以用物理或机械办法分开。
(ii) 一个相可以是均匀的,但不一定是一种物质。
气体:一般是一个相,如空气组分复杂。
L f=2
L+A f=1
f =0 E
L+B f=1
A+B f=1
A
B
相律应用必须注意以下四点: 1. 相律是根据热力学平衡条件推导而得,因而只能处理真实 的热力学平衡体系。 2. 相律表达式中的“n”通常为“2”是代表外界条件温度和压
强。 如果电场、磁场或重力场对平衡状态有影响,则相律中的 “2”应为“3”、“4”、“5”。如果研究的体系为固态物质,
CaCO3 CaO CO2 c = 3-1-0 = 2
系统中化学物质和组分的关系: ①当物质之间没有化学反应时,化学物质数目=组分数; ②当物质之间发生化学反应时,
组分数 = 化学物质数 – 在稳定条件下的化学反应数。
• 在硅酸盐系统中经常采用氧化物作为系统的组 分。
• 如:SiO2一元系统
C
P
溶解 L
S
蒸发
O
D
升华
g
B
临界点
A
温度
• AO线可延伸到D点。OD线在OB线之上,这表示过冷
水的蒸气压要比同温度下的冰蒸气压大。
• 过冷水不如冰稳定,处于亚稳状态,可作为亚稳相。
• 许多物质从高温熔融状态较快地冷却经过熔点时来不 及结晶得到的玻璃相也是一种亚稳相。
• OD线以上的区域称为亚稳区。
第二章 相平衡与相图
主要内容
★ 系统阐述相图的基本原理 ★ 结合实际介绍相图在无机非金属材料 的研究和生产实践中的具体应用。
相律
• f+P=C+n
• 其中:P——相数;
•
C——独立组元数
•
f——自由度:在一定范围内可任意独立改变
而不至于引起旧相消失或新相出现的变数。
•
n——影响系统相平衡的外界因素的总和。一
