一些半反应的标准电极电势
标准电极电势表

标准电极电势表标准电极电势可以用来计算化学电池或原电池的电化学势或电极电势。
本表中所给出的电极电势以标准氢电极为参比电极,溶液中离子有效浓度为1mol/L ,气体分压为100kPa ,温度为298K ,所有离子的数据都在水溶液中测得。
[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。
注:(s ) – 固体;(l ) – 液体;(g ) – 气体;(aq ) – 水溶液;(Hg ) – 汞齐。
半反应 E° (V)[注 1] 来源Ba + + e − Ba(s ) −4.38 [10][1][3]Sr + + e − Sr(s ) −4.10 [11][1][3]Ca + + e − Ca(s ) −3.8 [11][1][3]Pr 3+ + e − Pr 2+ −3.1 [11] N2(g ) + H + + e − HN 3(aq ) −3.09 [6] Li + + e − Li(s ) −3.0401 [5]N2(g ) + 4 H 2O + 2 e − 2 NH 2OH (aq ) + 2 OH − −3.04 [6] Cs + + e − Cs(s ) −3.026 [5]Ca(OH)2(s ) + 2 e − Ca(s ) + 2 OH − −3.02 [11] Rb + + e − Rb(s ) −2.98 [4]K + + e − K(s ) −2.931 [5]半反应E°(V)[注 1]来源Mg++ e−Mg(s) −2.93 [10]Ba2++ 2 e−Ba(s) −2.912 [5]−La(s) + 3OH−−2.90 [5]La(OH)Fr++ e−Fr(s) −2.9 [11]Sr2++ 2 e−Sr(s) −2.899 [5]−Sr(s) + 2 OH−−2.88 [11]Sr(OH)Ca2++ 2 e−Ca(s) −2.868 [5]Eu2++ 2 e−Eu(s) −2.812 [5]Ra2++ 2 e−Ra(s) −2.8 [5]Yb2++ 2 e−Yb(s) −2.76 [11][1]Na++ e−Na(s) −2.71 [5][9]Sm2++ 2 e−Sm(s) −2.68 [11][1]No2++ 2 e−No(s) −2.50 [11]−Hf(s) + 4 OH−−2.50 [11]HfO(OH)半反应E°(V)[注 1]来源−Th(s) + 4 OH−−2.48 [11]Th(OH)Md2++ 2 e−Md(s) −2.40 [11]La3++ 3 e−La(s) −2.379 [5]Y3++ 3 e−Y(s) −2.372 [5]Mg2++ 2 e−Mg(s) −2.372 [5]−Zr(s) + 4OH−−2.36 [5]ZrO(OH)Pr3++ 3 e−Pr(s) −2.353 [11]Ce3++ 3 e−Ce(s) −2.336 [11]Er3++ 3 e−Er(s) −2.331 [11]Ho3++ 3 e−Ho(s) −2.33 [11]−+ 3 e−Al(s) + 4 OH−−2.33Al(OH)−Al(s) + 3OH−−2.31Al(OH)Tb3++ 3 e−Tb(s) −2.28。
无机化学模拟题

《无机化学》模拟题一. 判断题1. 任何单质、化合物或水化离子,298.15K 时的标准摩尔生成焓均大于零。
( )2. 密闭系统中,温度趋近0K 时,所有放热反应均能自发进行。
( )3. 在下列浓差电池中,只有溶液浓度a <b 时,原电池符号才是正确的。
( )(–) Cu | Cu 2+(a )Cu 2+(b ) | Cu (+)4. 一定温度下,已知AgF 、AgCl 、AgBr 和AgI 的K s 依次减小,所以它们的溶解度(以mol •dm -3为单位)也依次降低。
( )5. 色散力不仅存在于非极性分子之间,也存在于极性分子之间。
( )6. 已知HCN 是直线形分子,所以它是非极性分子。
( )7. PbI 2和CaCO 3的标准溶度积数值相近(约为10-9),所以两者饱和溶液中Pb 2+和Ca 2+的离 子浓度(以mol ⋅dm -3为单位)也近似相等。
( )8. 取向力不仅存在于非极性分子之间,也存在于极性分子之间。
( )9. 下列各半反应所对应的标准电极电势值是相同的。
( ) O 2+2H 2O+4e -=4OH -,21O 2+H 2O+2e -=2OH -,2OH -=21O 2+H 2O+2e - 10. 钢铁在大气中的中性或弱酸性水膜中主要发生吸氧腐蚀,只有在酸性较强的水膜中才主 要发生析氢腐蚀。
( ) 11. 在某温度下,对于反应O 2(g) + S(g) = SO 2(g),其∆r H = ∆f H (SO 2,g)。
( ) 12. 由量子数n 、l 、m 、m s 的具体数值可完全确定一个电子的运动状态。
( ) 13. 在配离子中,中心离子的配位数等于每个中心离子所拥有的配位体的数目。
( ) 14. HBr 的沸点比HCl 高,但又比HF 的低。
( ) 15. H 、G 、S 、U 均为状态函数,W 、q 不是状态函数。
( ) 16. 某反应的标准平衡常数数值很大K = 2.4 ⨯1034,表明该反应在此温度可在极短时间内完 成。
fe的标准电极电势_概述及解释说明

fe的标准电极电势概述及解释说明1. 引言1.1 概述标准电极电势是描述一个半电池系统中金属或物质氧化还原能力的重要物理量之一。
在研究和应用过程中,了解各种金属离子之间的电位差对于判断氧化还原反应是否会发生以及反应方向的确定非常关键。
1.2 文章结构本文将围绕着fe的标准电极电势进行详细的概述和解释说明。
具体而言,文章将分为五个部分:引言、fe的标准电极电势概述、fe的标准电极电势解释说明、实验验证和实际应用案例分析、结论及展望。
1.3 目的本文旨在系统地介绍和解释fe的标准电极电势以及其在实践中的重要性。
通过对影响fe标准电极电势的因素、fe与其他金属之间的比较和联系以及与化学反应动力学关系方面进行探讨,我们可以更好地理解和利用这一物理量。
此外,文章还将通过实验验证和实际案例分析来强调其在科学研究和工程领域中所起到的作用,并对未来研究方向进行展望。
对于读者和相关领域的研究人员,本文将提供一份全面而清晰的参考资料,以便更好地掌握和应用fe的标准电极电势。
2. fe的标准电极电势概述:2.1 什么是标准电极电势:在化学反应中,电极是指将化学能转化为电能或将电能转化为化学能的界面。
标准电极电势是指当气体压力为1个大气压,溶液浓度为1摩尔/升,并且温度为298K(25摄氏度)时,某个半电池中发生的还原或氧化半反应的电动势。
2.2 fe的标准电极电势定义和测量方法:fe代表铁(Fe)元素,其标准电极电势通常用E°(Fe)来表示。
在标准条件下,铁离子(Fe3+)与铁原子(Fe)之间存在一个可逆的半反应:Fe3+(aq) + 3e- →Fe(s)标准态下这个半反应的标准电位被定义为0V。
因此,对于铁而言,它的标准电极电势E°(Fe)等于0V。
测量fe的标准电极电势可以使用参照法或者相对法。
参照法是将待测体系连接到一种已知标准体系上进行测量;相对法则通过比较待测半电池与标准氢电极或其他已知标准体系之间的电势差来测量。
标准电极电势的定义

标准电极电势的定义标准电极电势是指在标准状态下,电极与标准氢电极之间的电势差。
标准状态是指电解质浓度为1mol/L,气体的压强为1atm,温度为25摄氏度的状态。
标准氢电极被定义为电极电势为0V的电极,作为其他电极电势的参照电极。
标准电极电势的测定对于电化学研究具有重要意义,它可以用来推断化学反应的进行方向和速率,也可以用来计算电池的电动势。
在电化学中,电极是电解质溶液与电解质溶液之间的界面,它可以是金属电极,也可以是非金属电极。
当电极与电解质溶液接触时,电极表面会发生氧化还原反应,从而产生电势差。
标准电极电势的测定需要建立在标准氢电极的基础上,因为标准氢电极的电极电势被定义为0V,可以作为其他电极电势的参照。
标准电极电势的测定通常通过电化学电池来实现。
电化学电池由两个电极和它们之间的电解质溶液组成。
在测定标准电极电势时,需要将待测电极和标准氢电极分别放入两个半电池中,并将它们与电桥或电位计连接起来。
通过测量电极与标准氢电极之间的电势差,就可以得到待测电极的标准电极电势。
标准电极电势的测定结果可以用来推断化学反应的进行方向和速率。
根据标准电极电势的正负可以判断反应是自发进行的还是需要外界能量的输入。
标准电极电势还可以用来计算电池的电动势,从而评价电池的性能。
在工业生产和科学研究中,标准电极电势的测定对于探索新的电化学反应和开发新的电化学材料具有重要意义。
总之,标准电极电势是电化学研究中的重要概念,它可以通过实验测定得到,并且具有重要的理论和应用价值。
通过对标准电极电势的研究,可以深入理解电化学反应的本质,推动电化学领域的发展。
希望本文的介绍能够帮助读者更好地理解标准电极电势的定义和意义。
磷酸铁锂的标准电极电势

磷酸铁锂的标准电极电势
磷酸铁锂是一种广泛用于锂离子电池中的正极材料,其标准电极电势是多少呢?
磷酸铁锂的标准电极电势通常指的是其氧化半反应的标准电极
电势,即:
FePO4 + e- -> FePO4- 的标准电极电势为0.32 V(在标准条件下,即温度为25℃、压力为1 atm、离子浓度为1 mol/L时)。
这意味着在锂离子电池中,磷酸铁锂的正极反应可以产生约3.5 V的电势差,从而驱动电池输出电能。
当电池放电时,磷酸铁锂被
氧化为铁离子和LiFePO4,同时放出电子,这些电子通过电路流回电池的负极,完成电池的电化学反应。
磷酸铁锂的高安全性、稳定性和长寿命使其成为了现代电动汽车、移动电源等领域的理想候选材料。
因此,研究和优化其电化学性能以提高电池的性能和可靠性一直是锂离子电池行业的热点问题。
- 1 -。
标准电极电势表

标准电极电势表目录[隐藏]电极电势的产生—双电层理论定义公式电极电势内容标准电极电势表[编辑本段]电极电势的产生—双电层理论德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double lay er theory)解释电极电势的产生的原因。
当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。
金属性质越活泼,这种趋势就越大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度越大,这种趋势也越大。
在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。
通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。
电极电势以符号E Mn+/ M表示, 单位为V(伏)。
如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。
电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。
[编辑本段]定义标准电极电势是可逆电极在标准状态及平衡态时的电势,也就是标准态时的电极电势.标准电极电势有很大的实用价值,可用来判断氧化剂与还原剂的相对强弱,判断氧化还原反应的进行方向,计算原电池的电动势、反应自由能、平衡常数,计算其他半反应的标准电极电势,等等。
将半反应按电极电势由低到高排序,可以得到标准电极电势表,可十分简明地判断氧还反应的方向.[编辑本段]公式任何温度下标准氢电极的标准电极电势值都为0,但其他电极电势值会受到温度影响。
以Ni/NiO电极为例,它可以用作高温伪参比电极,在0-400°C时的电极电势大致符合以下公式:E°(T)=-0.0003T+0.1414,T为温度[编辑本段]电极电势内容1 在酸性溶液中(298K)电对方程式Eq/VLi(I)-(0) Li++e-=Li -3.0401Cs(I)-(0) Cs++e-=Cs -3.026Rb(I)-(0) Rb++e-=Rb -2.98K(I)-(0) K++e-=K -2.931Ba(II)-(0) Ba2++2e-=Ba -2.912Sr(II)-(0) Sr2++2e-=Sr -2.89Ca(II)-(0) Ca2++2e-=Ca -2.868Na(I)-(0) Na++e-=Na -2.71La(III)-(0) La3++3e-=La -2.379Mg(II)-(0) Mg2++2e-=Mg -2.372Ce(III)-(0) Ce3++3e-=Ce -2.336H(0)-(-I) H2(g)+2e-=2H--2.23Al(III)-(0) AlF63-+3e-=Al+6F--2.069Th(IV)-(0) Th4++4e-=Th -1.899Be(II)-(0) Be2++2e-=Be -1.847U(III)-(0) U3++3e-=U -1.798Hf(IV)-(0) HfO2++2H++4e-=Hf+H2O -1.724Al(III)-(0) Al3++3e-=Al -1.662Ti(II)-(0) Ti2++2e-=Ti -1.630Zr(IV)-(0) ZrO2+4H++4e-=Zr+2H2O -1.553Si(IV)-(0) [SiF6]2-+4e-=Si+6F--1.24Mn(II)-(0) Mn2++2e-=Mn -1.185Cr(II)-(0) Cr2++2e-=Cr -0.913Ti(III)-(II) Ti3++e-=Ti2+-0.9B(III)-(0) H3BO3+3H++3e-=B+3H2O -0.8698*Ti(IV)-(0) TiO2+4H++4e-=Ti+2H2O -0.86Te(0)-(-II) Te+2H++2e-=H2Te -0.793Zn(II)-(0) Zn2++2e-=Zn -0.7618Ta(V)-(0) Ta2O5+10H++10e-=2Ta+5H2O -0.750Cr(III)-(0) Cr3++3e-=Cr -0.744Nb(V)-(0) Nb2O5+l0H++10e-=2Nb+5H2O -0.644 As(0)-(-III) As+3H++3e-=AsH3 -0.608U(IV)-(III) U4++e-=U3+-0.607Ga(III)-(0) Ga3++3e-=Ga -0.549P(I)-(0) H3PO2+H++e-=P+2H2O -0.508P(III)-(I) H3PO3+2H++2e-=H3PO2+H2O -0.499 *C(IV)-(III) 2CO2+2H++2e-=H2C2O4 -0.49Fe(II)-(0) Fe2++2e-=Fe -0.447Cr(III)-(II) Cr3++e-=Cr2+-0.407Cd(II)-(0) Cd2++2e-=Cd -0.4030Se(0)-(-II) Se+2H++2e-=H2Se(aq) -0.399Pb(II)-(0) PbI2+2e-=Pb+2I--0.365Eu(III)-(II) Eu3++e-=Eu2+-0.36Pb(II)-(0) PbSO4+2e-=Pb+SO42--0.3588In(III)-(0) In3++3e-=In -0.3382Tl(I)-(0) Tl++e-=Tl -0.336Co(II)-(0) Co2++2e-=Co -0.28P(V)-(III) H3PO4+2H++2e-=H3PO3+H2O -0.276 Pb(II)-(0) PbCl2+2e-=Pb+2Cl--0.2675Ni (II)-(0) Ni2++2e-=Ni -0.257V(III)-(II) V3++e-=V2+-0.255Ge(IV)-(0) H2GeO3+4H++4e-=Ge+3H2O -0.182 Ag(I)-(0) AgI+e-=Ag+I--0.15224Sn(II)-(0) Sn2++2e-=Sn -0.1375Pb(II)-(0) Pb2++2e-=Pb -0.1262*C(IV)-(II) CO2(g)+2H++2e-=CO+H2O -0.12P(0)-(-III) P(white)+3H++3e-=PH3(g) -0.063Hg(I)-(0) Hg2I2+2e-=2Hg+2I--0.0405Fe(III)-(0) Fe3++3e-=Fe -0.037H(I)-(0) 2H++2e-=H2 0.0000Ag(I)-(0) AgBr+e-=Ag+Br-0.07133S(II.V)-(II) S4O62-+2e-=2S2O32-0.08*Ti(IV)-(III) TiO2++2H++e-=Ti3++H2O 0.1S(0)-(-II) S+2H++2e-=H2S(aq) 0.142Sn(IV)-(II) Sn4++2e-=Sn2+0.151Sb(III)-(0) Sb2O3+6H++6e-=2Sb+3H2O 0.152Cu(II)-(I) Cu2++e-=Cu+0.153Bi(III)-(0) BiOCl+2H++3e-=Bi+Cl-+H2O 0.1583 S(VI)-(IV) SO42-+4H++2e-=H2SO3+H2O 0.172 Sb(III)-(0) SbO++2H++3e-=Sb+H2O 0.212Ag(I)-(0) AgCl+e-=Ag+Cl-0.22233As(III)-(0) HAsO2+3H++3e-=As+2H2O 0.248Hg(I)-(0) Hg2Cl2+2e-=2Hg+2Cl-(饱和KCl) 0.26808 Bi(III)-(0) BiO++2H++3e-=Bi+H2O 0.320U(VI)-(IV) UO22++4H++2e-=U4++2H2O 0.327C(IV)-(III) 2HCNO+2H++2e-=(CN)2+2H2O 0.330V(IV)-(III) VO2++2H++e-=V3++H2O 0.337Cu(II)-(0) Cu2++2e-=Cu 0.3419Re(VII)-(0) ReO4-+8H++7e-=Re+4H2O 0.368Ag(I)-(0) Ag2CrO4+2e-=2Ag+CrO42-0.4470S(IV)-(0) H2SO3+4H++4e-=S+3H2O 0.449Cu(I)-(0) Cu++e-=Cu 0.521I(0)-(-I) I2+2e-=2I-0.5355I(0)-(-I) I3-+2e-=3I-0.536As(V)-(III) H3AsO4+2H++2e-=HAsO2+2H2O 0.560 Sb(V)-(III) Sb2O5+6H++4e-=2SbO++3H2O 0.581 Te(IV)-(0) TeO2+4H++4e-=Te+2H2O 0.593U(V)-(IV) UO2++4H++e-=U4++2H2O 0.612**Hg(II)-(I) 2HgCl2+2e-=Hg2Cl2+2Cl-0.63Pt(IV)-(II) [PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68O(0)-(-I) O2+2H++2e-=H2O2 0.695Pt(II)-(0) [PtCl4]2-+2e-=Pt+4Cl-0.755*Se(IV)-(0) H2SeO3+4H++4e-=Se+3H2O 0.74Fe(III)-(II) Fe3++e-=Fe2+0.771Hg(I)-(0) Hg22++2e-=2Hg 0.7973Ag(I)-(0) Ag++e-=Ag 0.7996Os(VIII)-(0) OsO4+8H++8e-=Os+4H2O 0.8N(V)-(IV) 2NO3-+4H++2e-=N2O4+2H2O 0.803 Hg(II)-(0) Hg2++2e-=Hg 0.851Si(IV)-(0) (quartz)SiO2+4H++4e-=Si+2H2O 0.857 Cu(II)-(I) Cu2++I-+e-=CuI 0.86N(III)-(I) 2HNO2+4H++4e-=H2N2O2+2H2O 0.86 Hg(II)-(I) 2Hg2++2e-=Hg22+0.920N(V)-(III) NO3-+3H++2e-=HNO2+H2O 0.934Pd(II)-(0) Pd2++2e-=Pd 0.951N(V)-(II) NO3-+4H++3e-=NO+2H2O 0.957N(III)-(II) HNO2+H++e-=NO+H2O 0.983I(I)-(-I) HIO+H++2e-=I-+H2O 0.987V(V)-(IV) VO2++2H++e-=VO2++H2O 0.991V(V)-(IV) V(OH)4++2H++e-=VO2++3H2O 1.00Au(III)-(0) [AuCl4]-+3e-=Au+4Cl- 1.002Te(VI)-(IV) H6TeO6+2H++2e-=TeO2+4H2O 1.02N(IV)-(II) N2O4+4H++4e-=2NO+2H2O 1.035N(IV)-(III) N2O4+2H++2e-=2HNO2 1.065I(V)-(-I) IO3-+6H++6e-=I-+3H2O 1.085Br(0)-(-I) Br2(aq)+2e-=2Br- 1.0873Se(VI)-(IV) SeO42-+4H++2e-=H2SeO3+H2O 1.151 Cl(V)-(IV) ClO3-+2H++e-=ClO2+H2O 1.152Pt(II)-(0) Pt2++2e-=Pt 1.18Cl(VII)-(V) ClO4-+2H++2e-=ClO3-+H2O 1.189I(V)-(0) 2IO3-+12H++10e-=I2+6H2O 1.195Cl(V)-(III) ClO3-+3H++2e-=HClO2+H2O 1.214Mn(IV)-(II) MnO2+4H++2e-=Mn2++2H2O 1.224O(0)-(-II) O2+4H++4e-=2H2O 1.229Tl(III)-(I) T13++2e-=Tl+ 1.252Cl(IV)-(III) ClO2+H++e-=HClO2 1.277N(III)-(I) 2HNO2+4H++4e-=N2O+3H2O 1.297**Cr(VI)-(III) Cr2O72-+14H++6e-=2Cr3++7H2O 1.33 Br(I)-(-I) HBrO+H++2e-=Br-+H2O 1.331Cr(VI)-(III) HCrO4-+7H++3e-=Cr3++4H2O 1.350Cl(0)-(-I) Cl2(g)+2e-=2Cl- 1.35827Cl(VII)-(-I) ClO4-+8H++8e-=Cl-+4H2O 1.389Cl(VII)-(0) ClO4-+8H++7e-=1/2Cl2+4H2O 1.39Au(III)-(I) Au3++2e-=Au+ 1.401Br(V)-(-I) BrO3-+6H++6e-=Br-+3H2O 1.423I(I)-(0) 2HIO+2H++2e-=I2+2H2O 1.439Cl(V)-(-I) ClO3-+6H++6e-=Cl-+3H2O 1.451Pb(IV)-(II) PbO2+4H++2e-=Pb2++2H2O 1.455Cl(V)-(0) ClO3-+6H++5e-=1/2Cl2+3H2O 1.47Cl(I)-(-I) HClO+H++2e-=Cl-+H2O 1.482Br(V)-(0) BrO3-+6H++5e-=l/2Br2+3H2O 1.482Au(III)-(0) Au3++3e-=Au 1.498Mn(VII)-(II) MnO4-+8H++5e-=Mn2++4H2O 1.507Mn(III)-(II) Mn3++e-=Mn2+ 1.5415Cl(III)-(-I) HClO2+3H++4e-=Cl-+2H2O 1.570Br(I)-(0) HBrO+H++e-=l/2Br2(aq)+H2O 1.574N(II)-(I) 2NO+2H++2e-=N2O+H2O 1.591I(VII)-(V) H5IO6+H++2e-=IO3-+3H2O 1.601Cl(I)-(0) HClO+H++e-=1/2Cl2+H2O 1.611Cl(III)-(I) HClO2+2H++2e-=HClO+H2O 1.645Ni(IV)-(II) NiO2+4H++2e-=Ni2++2H2O 1.678Mn(VII)-(IV) MnO4-+4H++3e-=MnO2+2H2O 1.679Pb(IV)-(II) PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.6913 Au(I)-(0) Au++e-=Au 1.692Ce(IV)-(III) Ce4++e-=Ce3+ 1.72N(I)-(0) N2O+2H++2e-=N2+H2O 1.766O(-I)-(-II) H2O2+2H++2e-=2H2O 1.776Co(III)-(II) Co3++e-=Co2+(2mol·L-1 H2SO4) 1.83Ag(II)-(I) Ag2++e-=Ag+ 1.980S(VII)-(VI) S2O82-+2e-=2SO42- 2.010O(0)-(-II) O3+2H++2e-=O2+H2O 2.076O(II)-(-II) F2O+2H++4e-=H2O+2F- 2.153Fe(VI)-(III) FeO42-+8H++3e-=Fe3++4H2O 2.20O(0)-(-II) O(g)+2H++2e-=H2O 2.421F(0)-(-I) F2+2e-=2F- 2.866F2+2H++2e-=2HF 3.0532 在碱性溶液中(298K)电对方程式Eq/VCa(II)-(0) Ca(OH)2+2e-=Ca+2OH--3.02Ba(II)-(0) Ba(OH)2+2e-=Ba+2OH--2.99La(III)-(0) La(OH)3+3e-=La+3OH--2.90Sr(II)-(0) Sr(OH)2·8H2O+2e-=Sr+2OH-+8H2O -2.88Mg(II)-(0) Mg(OH)2+2e-=Mg+2OH--2.690Be(II)-(0) Be2O32-+3H2O+4e-=2Be+6OH--2.63Hf(IV)-(0) HfO(OH)2+H2O+4e-=Hf+4OH--2.50Zr(IV)-(0) H2ZrO3+H2O+4e-=Zr+4OH--2.36Al(III)-(0) H2AlO3-+H2O+3e-=Al+OH--2.33P(I)-(0) H2PO2-+e-=P+2OH--1.82B(III)-(0) H2BO3-+H2O+3e-=B+4OH--1.79P(III)-(0) HPO32-+2H2O+3e-=P+5OH--1.71Si(IV)-(0) SiO32-+3H2O+4e-=Si+6OH--1.697P(III)-(I) HPO32-+2H2O+2e-=H2PO2-+3OH--1.65Mn(II)-(0) Mn(OH)2+2e-=Mn+2OH--1.56Cr(III)-(0) Cr(OH)3+3e-=Cr+3OH--1.48*Zn(II)-(0) [Zn(CN)4]2-+2e-=Zn+4CN--1.26Zn(II)-(0) Zn(OH)2+2e-=Zn+2OH--1.249Ga(III)-(0) H2GaO3-+H2O+2e-=Ga+4OH--1.219Zn(II)-(0) ZnO22-+2H2O+2e-=Zn+4OH--1.215Cr(III)-(0) CrO2-+2H2O+3e-=Cr+4OH--1.2Te(0)-(-I) Te+2e-=Te2--1.143P(V)-(III) PO43-+2H2O+2e-=HPO32-+3OH--1.05*Zn(II)-(0) [Zn(NH3)4]2++2e-=Zn+4NH3 -1.04*W(VI)-(0) WO42-+4H2O+6e-=W+8OH--1.01*Ge(IV)-(0) HGeO3-+2H2O+4e-=Ge+5OH--1.0Sn(IV)-(II) [Sn(OH)6]2-+2e-=HSnO2-+H2O+3OH--0.93 S(VI)-(IV) SO42-+H2O+2e-=SO32-+2OH--0.93Se(0)-(-II) Se+2e-=Se2--0.924Sn(II)-(0) HSnO2-+H2O+2e-=Sn+3OH--0.909P(0)-(-III) P+3H2O+3e-=PH3(g)+3OH--0.87N(V)-(IV) 2NO3-+2H2O+2e-=N2O4+4OH--0.85H(I)-(0) 2H2O+2e-=H2+2OH--0.8277Cd(II)-(0) Cd(OH)2+2e-=Cd(Hg)+2OH--0.809Co(II)-(0) Co(OH)2+2e-=Co+2OH--0.73Ni(II)-(0) Ni(OH)2+2e-=Ni+2OH--0.72As(V)-(III) AsO43-+2H2O+2e-=AsO2-+4OH--0.71Ag(I)-(0) Ag2S+2e-=2Ag+S2--0.691As(III)-(0) AsO2-+2H2O+3e-=As+4OH--0.68Sb(III)-(0) SbO2-+2H2O+3e-=Sb+4OH--0.66*Re(VII)-(IV) ReO4-+2H2O+3e-=ReO2+4OH--0.59*Sb(V)-(III) SbO3-+H2O+2e-=SbO2-+2OH--0.59Re(VII)-(0) ReO4-+4H2O+7e-=Re+8OH--0.584*S(IV)-(II) 2SO32-+3H2O+4e-=S2O32-+6OH--0.58Te(IV)-(0) TeO32-+3H2O+4e-=Te+6OH--0.57Fe(III)-(II) Fe(OH)3+e-=Fe(OH)2+OH--0.56S(0)-(-II) S+2e-=S2--0.47627Bi(III)-(0) Bi2O3+3H2O+6e-=2Bi+6OH--0.46N(III)-(II) NO2-+H2O+e-=NO+2OH--0.46*Co(II)-C(0) [Co(NH3)6]2++2e-=Co+6NH3 -0.422Se(IV)-(0) SeO32-+3H2O+4e-=Se+6OH--0.366Cu(I)-(0) Cu2O+H2O+2e-=2Cu+2OH--0.360Tl(I)-(0) Tl(OH)+e-=Tl+OH--0.34*Ag(I)-(0) [Ag(CN)2]-+e-=Ag+2CN--0.31Cu(II)-(0) Cu(OH)2+2e-=Cu+2OH--0.222Cr(VI)-(III) CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13 *Cu(I)-(0) [Cu(NH3)2]++e-=Cu+2NH3 -0.12O(0)-(-I) O2+H2O+2e-=HO2-+OH--0.076Ag(I)-(0) AgCN+e-=Ag+CN--0.017N(V)-(III) NO3-+H2O+2e-=NO2-+2OH-0.01Se(VI)-(IV) SeO42-+H2O+2e-=SeO32-+2OH-0.05 Pd(II)-(0) Pd(OH)2+2e-=Pd+2OH-0.07S(II,V)-(II) S4O62-+2e-=2S2O32-0.08Hg(II)-(0) HgO+H2O+2e-=Hg+2OH-0.0977Co(III)-(II) [Co(NH3)6]3++e-=[Co(NH3)6]2+0.108Pt(II)-(0) Pt(OH)2+2e-=Pt+2OH-0.14Co(III)-(II) Co(OH)3+e-=Co(OH)2+OH-0.17Pb(IV)-(II) PbO2+H2O+2e-=PbO+2OH-0.247I(V)-(-I) IO3-+3H2O+6e-=I-+6OH-0.26Cl(V)-(III) ClO3-+H2O+2e-=ClO2-+2OH-0.33Ag(I)-(0) Ag2O+H2O+2e-=2Ag+2OH-0.342Fe(III)-(II) [Fe(CN)6]3-+e-=[Fe(CN)6]4-0.358Cl(VII)-(V) ClO4-+H2O+2e-=ClO3-+2OH-0.36*Ag(I)-(0) [Ag(NH3)2]++e-=Ag+2NH3 0.373O(0)-(-II) O2+2H2O+4e-=4OH-0.401I(I)-(-I) IO-+H2O+2e-=I-+2OH-0.485*Ni(IV)-(II) NiO2+2H2O+2e-=Ni(OH)2+2OH-0.490Mn(VII)-(VI) MnO4-+e-=MnO42-0.558Mn(VII)-(IV) MnO4-+2H2O+3e-=MnO2+4OH-0.595 Mn(VI)-(IV) MnO42-+2H2O+2e-=MnO2+4OH-0.60Ag(II)-(I) 2AgO+H2O+2e-=Ag2O+2OH-0.607Br(V)-(-I) BrO3-+3H2O+6e-=Br-+6OH-0.61Cl(V)-(-I) ClO3-+3H2O+6e-=Cl-+6OH-0.62Cl(III)-(I) ClO2-+H2O+2e-=ClO-+2OH-0.66I(VII)-(V) H3IO62-+2e-=IO3-+3OH-0.7Cl(III)-(-I) ClO2-+2H2O+4e-=Cl-+4OH-0.76Br(I)-(-I) BrO-+H2O+2e-=Br-+2OH-0.761Cl(I)-(-I) ClO-+H2O+2e-=Cl-+2OH-0.841*Cl(IV)-(III) ClO2(g)+e-=ClO2-0.95O(0)-(-II) O3+H2O+2e-=O2+2OH- 1.24标准电极电势表半反应E°(V) 来源& -9Zz 9N N2(g) + H+ + e− HN3(aq) -3.09 [6]Li+ + e− Li(s) -3.0401 [5]N2(g) + 4H2O + 2e− 2N H2OH(aq) + 2OH− -3.04 [6] Cs+ + e− Cs(s) -3.026 [5]Rb+ + e− Rb(s) -2.98 [4]K+ + e− K(s) -2.931 [5]Ba2+ + 2e− Ba(s) -2.912 [5]La(OH)3(s) + 3e− La(s) + 3OH− -2.90 [5]Sr2+ + 2e−Sr(s) -2.899 [5]Ca2+ + 2e− Ca(s) -2.868 [5]Eu2+ + 2e− Eu(s) -2.812 [5]Ra2+ + 2e− Ra(s) -2.8 [5]Na+ + e− Na(s) -2.71 [5][9]La3+ + 3e− La(s) -2.379 [5]Y3+ + 3e− Y(s) -2.372 [5]Mg2+ + 2e− Mg(s) -2.372 [5]ZrO(OH)2(s) + H2O + 4e− Zr(s) + 4OH− -2.36 [5]Al(OH)4− + 3e− Al(s) + 4OH− -2.33Al(OH)3(s) + 3e− Al(s) + 3OH− -2.31H2(g) + 2e− 2H− -2.25Ac3+ + 3e− Ac(s) -2.20Be2+ + 2e− Be(s) -1.85U3+ + 3e− U(s) -1.66 [7]Al3+ + 3e− Al(s) -1.66 [9]Ti2+ + 2e− Ti(s) -1.63 [9]ZrO2(s) + 4H+ + 4e− Zr(s) + 2H2O -1.553 [5]Zr4+ + 4e− Zr(s) -1.45 [5]TiO(s) + 2H+ + 2e− Ti(s) + H2O -1.31Ti2O3(s) + 2H+ + 2e− 2T iO(s) + H2O -1.23Ti3+ + 3e− Ti(s) -1.21Te(s) + 2e− Te2− -1.143 [2]V2+ + 2e− V(s) -1.13 [2]Nb3+ + 3e− Nb(s) -1.099Sn(s) + 4H+ + 4e− SnH4(g) -1.07Mn2+ + 2e− Mn(s) -1.029 [9]SiO2(s) + 4H+ + 4e− Si(s) + 2H2O -0.91B(OH)3(aq) + 3H+ + 3e− B(s) + 3H2O -0.89TiO2+ + 2H+ + 4e− Ti(s) + H2O -0.86Bi(s) + 3H+ + 3e− BiH3 -0.8H2H2O + 2e− H2(g) + 2OH− -0.8277 [5]Zn2+ + 2e− Zn(Hg) -0.7628 [5]Zn2+ + 2e− Zn(s) -0.7618 [5]Ta2O5(s) + 10H+ + 10e− 2T a(s) + 5H2O -0.75Cr3+ + 3e− Cr(s) -0.74Au[Au(CN)2]− + e− Au(s) + 2C N− -0.60Ta3+ + 3e− Ta(s) -0.6PbO(s) + H2O + 2e− Pb(s) + 2OH− -0.58Ti2T iO2(s) + 2H+ + 2e− Ti2O3(s) + H2O -0.56Ga3+ + 3e− Ga(s) -0.53U4+ + e− U3+ -0.52 [7]P H3PO2(aq) + H+ + e− P(白磷[10]) + 2H2O -0.508 [5]P H3PO3(aq) + 2H+ + 2e− H3PO2(aq) + H2O -0.499 [5] P H3PO3(aq) + 3H+ + 3e− P(红磷)[10] + 3H2O -0.454 [5] Fe2+ + 2e− Fe(s) -0.44 [9]C2C O2(g) + 2H+ + 2e− HOOCCOOH(aq) -0.43Cr3+ + e− Cr2+ -0.42Cd2+ + 2e− Cd(s) -0.40 [9]GeO2(s) + 2H+ + 2e− GeO(s) + H2O -0.37Cu2O(s) + H2O + 2e− 2C u(s) + 2O H− -0.360 [5]PbSO4(s) + 2e− Pb(s) + SO42− -0.3588 [5]PbSO4(s) + 2e− Pb(Hg) + SO42− -0.3505 [5]Eu3+ + e− Eu2+ -0.35 [7]In3+ + 3e− In(s) 0.34 [2]Tl+ + e− Tl(s) -0.34 [2]Ge(s) + 4H+ + 4e− GeH4(g) -0.29Co2+ + 2e− Co(s) -0.28 [5]P H3PO4(aq) + 2H+ + 2e− H3PO3(aq) + H2O -0.276 [5] V3+ + e− V2+ 0.26 [9]Ni2+ + 2e− Ni(s) -0.25As(s) + 3H+ + 3e− AsH3(g) -0.23 [2]MoO2(s) + 4H+ + 4e− Mo(s) + 2H2O -0.15Si(s) + 4H+ + 4e− SiH4(g) -0.14Sn2+ + 2e− Sn(s) -0.13O2(g) + H+ + e− HO2•(aq) -0.13Pb2+ + 2e− Pb(s) -0.13 [9]WO2(s) + 4H+ + 4e− W(s) + 2H2O -0.12P(红磷) + 3H+ + 3e− PH3(g) -0.111 [5]C CO2(g) + 2H+ + 2e− HCOOH(aq) -0.11Se(s) + 2H+ + 2e− H2Se(g) -0.11C CO2(g) + 2H+ + 2e− CO(g) + H2O -0.11SnO(s) + 2H+ + 2e− Sn(s) + H2O -0.10SnO2(s) + 2H+ + 2e− SnO(s) + H2O -0.09WO3(aq) + 6H+ + 6e− W(s) + 3H2O -0.09 [2]P(白磷) + 3H+ + 3e− PH3(g) -0.063 [5]C HCOOH(aq) + 2H+ + 2e− HCHO(aq) + H2O -0.03 H 2H+ + 2e− H2(g) ≡ 0S4O62− + 2e− 2S2O32− +0.08Fe3O4(s) + 8H+ + 8e− 3F e(s) + 4H2O +0.085 [8]N2(g) + 2H2O + 6H+ + 6e− 2N H4OH(aq) +0.092 HgO(s) + H2O + 2e− H g(l) + 2O H− +0.0977Cu(NH3)42+ + e− Cu(NH3)2+ + 2N H3 +0.10 [2]Ru(NH3)63+ + e− Ru(NH3)62+ +0.10 [7]N2H4(aq) + 4H2O + 2e− 2N H4+ + 4O H− +0.11 [6] Mo H2MoO4(aq) + 6H+ + 6e− Mo(s) + 4H2O +0.11 Ge4+ + 4e− Ge(s) +0.12C(s) + 4H+ + 4e− CH4(g) +0.13 [2]C HCHO(aq) + 2H+ + 2e− CH3OH(aq) +0.13S(s) + 2H+ + 2e− H2S(g) +0.14Sn4+ + 2e− Sn2+ +0.15Cu2+ + e− Cu+ +0.159 [2]S HSO4− + 3H+ + 2e− SO2(aq) + 2H2O +0.16UO22+ + e− UO2+ +0.163 [7]S SO42− + 4H+ + 2e− SO2(aq) + 2H2O +0.17TiO2+ + 2H+ + e− Ti3+ + H2O +0.19Bi3+ + 2e− Bi+ +0.2SbO+ + 2H+ + 3e− Sb(s) + H2O +0.20As H3AsO3(aq) + 3H+ + 3e− As(s) + 3H2O +0.24 GeO(s) + 2H+ + 2e− Ge(s) + H2O +0.26UO2+ + 4H+ + e− U4+ + 2H2O +0.273 [7]Re3+ + 3e− Re(s) +0.300Bi3+ + 3e− Bi(s) +0.32VO2+ + 2H+ + e− V3+ + H2O +0.34Cu2+ + 2e− Cu(s) +0.340 [2]Fe [Fe(CN)6]3− + e− [Fe(CN)6]4− +0.36O2(g) + 2H2O + 4e− 4OH−(aq) +0.40 [9]Mo H2MoO4 + 6H+ + 3e− Mo3+ +2H2O +0.43Bi+ + e− Bi(s) +0.50C CH3OH(aq) + 2H+ + 2e− CH4(g) + H2O +0.50S SO2(aq) + 4H+ + 4e− S(s) + 2H2O +0.50Cu+ + e− Cu(s) +0.520 [2]C CO(g) + 2H+ + 2e− C(s) + H2O +0.52I2(s) + 2e− 2I− +0.54 [9]I3− + 2e− 3I− +0.53 [9]Au [AuI4]− + 3e− Au(s) + 4I− +0.56As H3AsO4(aq) + 2H+ + 2e− H3AsO3(aq) + H2O +0.56 Au [AuI2]− + e− Au(s) + 2I− +0.58MnO4− + 2H2O + 3e− MnO2(s) + 4O H− +0.59S2O32−+ 6H+ + 4e− 2S(s) + 3H2O +0.60Mo H2MoO4(aq) + 2H+ + 2e− MoO2(s) + 2H2O +0.65 O2(g) + 2H+ + 2e− H2O2(aq) +0.70Tl3+ + 3e− Tl(s) +0.72PtCl62− + 2e− PtCl42− + 2C l− +0.726 [7]Se H2SeO3(aq) + 4H+ + 4e− Se(s) + 3H2O +0.74PtCl42− + 2e− Pt(s) + 4C l− +0.758 [7]Fe3+ + e− Fe2+ +0.77Ag+ + e− Ag(s) +0.7996 [5]Hg22+ + 2e− 2H g(l) +0.80N NO3−(aq) + 2H+ + e− NO2(g) + H2O +0.80Au [AuBr4]− + 3e− Au(s) + 4B r− +0.85Hg2+ + 2e− Hg(l) +0.85MnO4− + H+ + e− HMnO4− +0.90Hg 2H g2+ + 2e− Hg22+ +0.91 [2]Pd2+ + 2e− Pd(s) +0.915 [7]Au [AuCl4]− + 3e− Au(s) + 4C l− +0.93MnO2(s) + 4H+ + e− Mn3+ + 2H2O +0.95Au [AuBr2]− + e− Au(s) + 2B r− +0.96Br2(l) + 2e− 2B r− +1.07Br2(aq) + 2e− 2B r− +1.09 [9]I IO3− + 5H+ + 4e− HIO(aq) + 2H2O +1.13Au [AuCl2]− + e− Au(s) + 2C l− +1.15Se HSeO4− + 3H+ + 2e− H2SeO3(aq) + H2O +1.15 Ag2O(s) + 2H+ + 2e− 2A g(s) + H2O +1.17ClO3− + 2H+ + e− ClO2(g) + H2O +1.18Pt2+ + 2e− Pt(s) +1.188 [7]ClO2(g) + H+ + e− HClO2(aq) +1.19I 2I O3− + 12H+ + 10e− I2(s) + 6H2O +1.20ClO4− + 2H+ + 2e− ClO3− + H2O +1.20O2(g) + 4H+ + 4e− 2H2O +1.23 [9]MnO2(s) + 4H+ + 2e− Mn2+ + 2H2O +1.23Tl3+ + 2e− Tl+ +1.25Cl2(g) + 2e− 2C l− +1.36 [9]Cr2O7−−+ 14H+ + 6e− 2C r3+ + 7H2O +1.33CoO2(s) + 4H+ + e− Co3+ + 2H2O +1.42N 2N H3OH+ + H+ + 2e− N2H5+ + 2H2O +1.42 [6]I 2H IO(aq) + 2H+ + 2e− I2(s) + 2H2O +1.44Ce4+ + e− Ce3+ +1.44BrO3− + 5H+ + 4e− HBrO(aq) + 2H2O +1.45PbO β-PbO2(s) + 4H+ + 2e− Pb2+ + 2H2O +1.460 [2] PbO α-PbO2(s) + 4H+ + 2e− Pb2+ + 2H2O +1.468 [2] Br 2B rO3− + 12H+ + 10e− Br2(l) + 6H2O +1.48Cl 2ClO3− + 12H+ + 10e− Cl2(g) + 6H2O +1.49MnO4− + 8H+ + 5e− Mn2+ + 4H2O +1.51O HO2• + H+ + e− H2O2(aq) +1.51Au3+ + 3e− Au(s) +1.52NiO2(s) + 4H+ + 2e− Ni2+ + 2OH− +1.59Cl 2H ClO(aq) + 2H+ + 2e− Cl2(g) + 2H2O +1.63Ag2O3(s) + 6H+ + 4e− 2A g+ + 3H2O +1.67Cl HClO2(aq) + 2H+ + 2e− HClO(aq) + H2O +1.67Pb4+ + 2e− Pb2+ +1.69 [2]MnO4− + 4H+ + 3e− MnO2(s) + 2H2O +1.70O H2O2(aq) + 2H+ + 2e− 2H2O +1.78AgO(s) + 2H+ + e− Ag+ + H2O +1.77Co3+ + e− Co2+ +1.82Au+ + e− Au(s) +1.83 [2]BrO4− + 2H+ + 2e− BrO3− + H2O +1.85Ag2+ + e− Ag+ +1.98 [2]S2O82− + 2e− 2SO42− +2.07O3(g) + 2H+ + 2e− O2(g) + H2O +2.075 [7]Mn HMnO4− + 3H+ + 2e− MnO2(s) + 2H2O +2.09 F2(g) + 2e− 2F− +2.87 [2][9]F2(g) + 2H+ + 2e− 2H F(aq) +3.05 [2]。
各种氧化还原反应所需要的电势

各种氧化还原反应所需要的电势取决于反应的物质以及反应条件。
氧化还原反应的电势可以通过标准电极电势(标准电势)进行测量和比较。
标准电极电势是指在标准状态下,即物质浓度为1 mol/L、压力为1 atm、温度为25°C时,相应氧化或还原半反应的电势。
以下是一些常见氧化还原反应的标准电极电势值(单位:伏特):
-氢气(H2)/氢离子(H+)半反应:0 V
-标准氧气(O2)/氧化物离子(O2-)半反应:+0.82 V
-铁(Fe2+)/铁(Fe3+)半反应:+0.77 V
-锌(Zn)/锌离子(Zn2+)半反应:-0.76 V
-铜(Cu)/铜离子(Cu2+)半反应:+0.34 V
这些数值表示了在标准条件下,对应氧化还原半反应的电势差。
如果一个反应的电势大于0V,则说明该反应具有足够的驱动力向正方向进行(发生氧化反应)。
相反,如果一个反应的电势小于0V,则说明该反应在标准条件下是不利的(发生还原反应)。
需要注意的是,这些数值仅表示了标准条件下的情况。
在实际应用中,反应的电势可能会受到温度、浓度、压力等因素的影响而发生变化。
因此,在非标准条件下进行氧化还原反应时,需要考虑这些因素对反应电势的影响,并进行修正计算。
标准电极电势__概述说明以及解释

标准电极电势概述说明以及解释1. 引言1.1 概述标准电极电势是物理化学领域中一个重要的概念,用于描述化学反应中电子转移的趋势和方向。
它是指在特定条件下,相对于参比电极,某个电极半反应发生的能力和倾向性。
标准电极电势可用于推测氧化还原反应的进行程度以及判断各种物质之间的氧化还原性质。
本文将详细介绍标准电极电势的定义、原理及重要性,并举例说明不同参比电极的特点及其适用范围。
1.2 文章结构本文主要分为以下几个部分:第二部分介绍了标准电极电势的定义和原理,包括对标准电极和参比电极概念进行了阐述,并解释了电势差与标准电极电势之间的关系。
第三部分探讨了标准氢电极(SHE)在化学反应中的重要性和应用。
我们将介绍SHE的定义和特点,并解释其在化学反应中作为参比电极所扮演的角色。
同时也会探讨使用SHE进行其他物质标准电势测量的原理和方法。
第四部分将介绍其他常见的标准参比电极,包括银/银离子参比电极、铜/铜离子参比电极以及铅/铅离子参比电极。
我们将对它们的概述进行分析,并探讨它们在不同场景下的使用特点。
最后,在结论部分,我们将总结标准电极电势的重要性和应用,并归纳各种参比电极的特点及其适用范围,为读者提供一个清晰而全面的认识。
1.3 目的本文旨在向读者介绍标准电极电势这一重要概念,并解释其原理和应用。
通过详细描述不同参比电极的特点,读者可以更好地理解在化学反应中如何选择合适的参比电极以及如何利用标准电极电势来推断反应进程和氧化还原性质。
同时,本文也希望能够唤起读者对于物理化学领域中其他相关概念和实验方法的兴趣。
2. 标准电极电势的定义和原理:2.1 标准电极和参比电极的概念在电化学中,标准电极是用作参考的基准电极,其电势被定义为零。
这样的一个标准是为了方便比较其他电极相对于该基准的电势差。
标准电极由一个半反应(half-reaction)构成,其中半反应既可以是氧化还原反应也可以是非氧化还原反应。
而参比电极则是用来与待测物质之间进行比较测量的第二个电极。
ce4+和ce3+的标准电极电势

ce4+和ce3+的标准电极电势
Ce4+和Ce3+的标准电极电势分别是1.72V和1.44V。
Ce4+和
Ce3+是铈的两种氧化态,它们之间的转化可以用以下半反应表示:
Ce4+ + e-> Ce3+,标准电极电势为+1.72V.
根据标准电极电势的定义,Ce4+/Ce3+电极对的标准电极电势为1.72V-1.44V=0.28V。
这意味着在标准状态下,Ce4+/Ce3+电极对的
电极反应是自发进行的。
这些数值对于电化学和化学分析等领域具
有重要意义,因为它们可以用来预测化学反应的方向和速率。
同时,它们也可以用来计算电池的电动势和其他相关参数。
因此,了解
Ce4+和Ce3+的标准电极电势对于理解相关化学反应和应用具有重要
意义。
一些常见半反应的标准电极电势
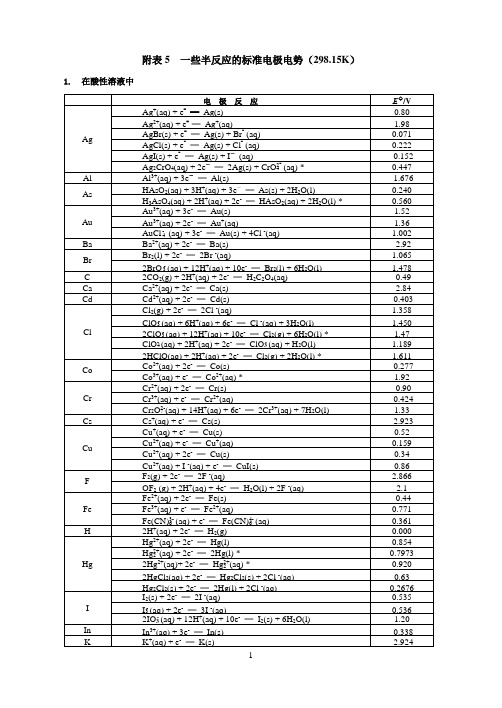
Au
1.52
Au3+(aq)+ 2e-═Au+(aq)
1.36
1.002
Ba
-2.92
Br
1.065
2BrO3-(aq)+ 12H+(aq)+ 10e-═Br2(l) + 6H2O(l)
1.478
C
-0.49
Ca
-2.84
Cd
-0.403
Cl
1.358
ClO3-(aq)+ 6H+(aq)+ 6e-═Cl-(aq)+ 3H2O(l)
*数据摘自CRC Handbook of Chemistry and Physics, 82 ed. 2001~2002.
氢2.1锂0.98铍1.57硼2.04碳2.55氮3.04氧3.44氟3.98
钠0.93镁1.31铝1.61硅1.90磷2.19硫2.58氯3.16
钾0.82钙1.00锰1.55铁1.83镍1.91铜1.9锌1.65镓1.81锗2.01砷2.18硒2.48溴2.96
Na
-2.713
Ni
-0.257
O
0.695
1.229
O3(g)+ 2H+(aq)+ 2e-═O2(g)+ H2O(l)
2.075
1.763
P
H3PO4(aq)+ 2H+(aq)+ 2e-═H3PO3(aq)+ H2O(l)
-0.276
Pb
-0.125
1.69
PbO2(s) + 4H+(aq)+ 2e-═Pb2+(aq)+ 2H2O(l)
标准电极电势表

标准电极电势表标准电极电势表目录[隐藏]电极电势的产生—双电层理论定义公式电极电势内容标准电极电势表[编辑本段]电极电势的产生—双电层理论德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double layer th eory)解释电极电势的产生的原因。
当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。
金属性质越活泼,这种趋势就越大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度越大,这种趋势也越大。
在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(e lectron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。
通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。
电极电势以符号E Mn+/ M表示, 单位为V(伏)。
如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。
电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。
[编辑本段]定义标准电极电势是可逆电极在标准状态及平衡态时的电势,也就是标准态时的电极电势.标准电极电势有很大的实用价值,可用来判断氧化剂与还原剂的相对强弱,判断氧化还原反应的进行方向,计算原电池的电动势、反应自由能、平衡常数,计算其他半反应的标准电极电势,等等。
将半反应按电极电势由低到高排序,可以得到标准电极电势表,可十分简明地判断氧还反应的方向.[编辑本段]公式任何温度下标准氢电极的标准电极电势值都为0,但其他电极电势值会受到温度影响。
以Ni/NiO电极为例,它可以用作高温伪参比电极,在0-400°C时的电极电势大致符合以下公式:E°(T)=-0.0003T+0.1414 ,T为温度[编辑本段]电极电势内容1 在酸性溶液中(298K)电对方程式Eq/VLi(I)-(0) Li++e-=Li -3.0401Cs(I)-(0) Cs++e-=Cs -3.026Rb(I)-(0) Rb++e-=Rb -2.98K(I)-(0) K++e-=K -2.931Ba(II)-(0) Ba2++2e-=Ba -2.912Sr(II)-(0) Sr2++2e-=Sr -2.89Ca(II)-(0) Ca2++2e-=Ca -2.868Na(I)-(0) Na++e-=Na -2.71La(III)-(0) La3++3e-=La -2.379Mg(II)-(0) Mg2++2e-=Mg -2.37 2Ce(III)-(0) Ce3++3e-=Ce -2.336H(0)-(-I) H2(g)+2e-=2H--2.23Al(III)-(0) AlF63-+3e-=Al+6F--2.069Th(IV)-(0) Th4++4e-=Th -1.899Be(II)-(0) Be2++2e-=Be -1.847U(III)-(0) U3++3e-=U -1.798Hf(IV)-(0) HfO2++2H++4e-=Hf +H2O -1.724Al(III)-(0) Al3++3e-=Al -1.662Ti(II)-(0) Ti2++2e-=Ti -1.630Zr(IV)-(0) ZrO2+4H++4e-=Zr+2 H2O -1.553Si(IV)-(0) [SiF6]2-+4e-=Si+6F--1.24Mn(II)-(0) Mn2++2e-=Mn -1.18 5Cr(II)-(0) Cr2++2e-=Cr -0.913Ti(III)-(II) Ti3++e-=Ti2+-0.9B(III)-(0) H3BO3+3H++3e-=B+3H2O -0.8698*Ti(IV)-(0) TiO2+4H++4e-=Ti+2 H2O -0.86Te(0)-(-II) Te+2H++2e-=H2Te -0.793Zn(II)-(0) Zn2++2e-=Zn -0.7618Ta(V)-(0) Ta2O5+10H++10e-=2T a+5H2O -0.750Cr(III)-(0) Cr3++3e-=Cr -0.744Nb(V)-(0) Nb2O5+l0H++10e-=2 Nb+5H2O -0.644As(0)-(-III) As+3H++3e-=AsH3-0.608U(IV)-(III) U4++e-=U3+-0.607Ga(III)-(0) Ga3++3e-=Ga -0.54 9P(I)-(0) H3PO2+H++e-=P+2H2 O -0.508P(III)-(I) H3PO3+2H++2e-=H3P O2+H2O -0.499*C(IV)-(III) 2CO2+2H++2e-=H2C 2O4 -0.49Fe(II)-(0) Fe2++2e-=Fe -0.447Cr(III)-(II) Cr3++e-=Cr2+-0.40 7Cd(II)-(0) Cd2++2e-=Cd -0.403 0Se(0)-(-II) Se+2H++2e-=H2Se (aq) -0.399Pb(II)-(0) PbI2+2e-=Pb+2I--0. 365Eu(III)-(II) Eu3++e-=Eu2+-0.3 6Pb(II)-(0) PbSO4+2e-=Pb+SO42--0.3588In(III)-(0) In3++3e-=In -0.3382Tl(I)-(0) Tl++e-=Tl -0.336Co(II)-(0) Co2++2e-=Co -0.28P(V)-(III) H3PO4+2H++2e-=H3P O3+H2O -0.276Pb(II)-(0) PbCl2+2e-=Pb+2Cl--0.2675Ni (II)-(0) Ni2++2e-=Ni -0.257V(III)-(II) V3++e-=V2+-0.255Ge(IV)-(0) H2GeO3+4H++4e-=G e+3H2O -0.182Ag(I)-(0) AgI+e-=Ag+I--0.152 24Sn(II)-(0) Sn2++2e-=Sn -0.137 5Pb(II)-(0) Pb2++2e-=Pb -0.126 2*C(IV)-(II) CO2(g)+2H++2e-=CO +H2O -0.12P(0)-(-III) P(white)+3H++3e-=P H3(g) -0.063Hg(I)-(0) Hg2I2+2e-=2Hg+2I--0.0405Fe(III)-(0) Fe3++3e-=Fe -0.037H(I)-(0) 2H++2e-=H2 0.0000Ag(I)-(0) AgBr+e-=Ag+Br-0.07 133S(II.V)-(II) S4O62-+2e-=2S2O32-0.08*Ti(IV)-(III) TiO2++2H++e-=Ti3++H2O 0.1S(0)-(-II) S+2H++2e-=H2S(aq) 0.142Sn(IV)-(II) Sn4++2e-=Sn2+0.15 1Sb(III)-(0) Sb2O3+6H++6e-=2Sb +3H2O 0.152Cu(II)-(I) Cu2++e-=Cu+0.153Bi(III)-(0) BiOCl+2H++3e-=Bi+Cl-+H2O 0.1583S(VI)-(IV) SO42-+4H++2e-=H2 SO3+H2O 0.172Sb(III)-(0) SbO++2H++3e-=Sb +H2O 0.212Ag(I)-(0) AgCl+e-=Ag+Cl-0.22 233As(III)-(0) HAsO2+3H++3e-=As +2H2O 0.248Hg(I)-(0) Hg2Cl2+2e-=2Hg+2Cl -(饱和KCl) 0.26808Bi(III)-(0) BiO++2H++3e-=Bi+H2O 0.320U(VI)-(IV) UO22++4H++2e-=U4++2H2O 0.327C(IV)-(III) 2HCNO+2H++2e-=(C N)2+2H2O 0.330V(IV)-(III) VO2++2H++e-=V3++H2O 0.337Cu(II)-(0) Cu2++2e-=Cu 0.3419Re(VII)-(0) ReO4-+8H++7e-=R e+4H2O 0.368Ag(I)-(0) Ag2CrO4+2e-=2Ag+Cr O42-0.4470S(IV)-(0) H2SO3+4H++4e-=S+3 H2O 0.449Cu(I)-(0) Cu++e-=Cu 0.521I(0)-(-I) I2+2e-=2I-0.5355I(0)-(-I) I3-+2e-=3I-0.536As(V)-(III) H3AsO4+2H++2e-=H AsO2+2H2O 0.560Sb(V)-(III) Sb2O5+6H++4e-=2S bO++3H2O 0.581Te(IV)-(0) TeO2+4H++4e-=Te+2H2O 0.593U(V)-(IV) UO2++4H++e-=U4++2H2O 0.612**Hg(II)-(I) 2HgCl2+2e-=Hg2Cl2+2Cl-0.63Pt(IV)-(II) [PtCl6]2-+2e-=[PtCl4] 2-+2Cl-0.68O(0)-(-I) O2+2H++2e-=H2O2 0. 695Pt(II)-(0) [PtCl4]2-+2e-=Pt+4Cl -0.755*Se(IV)-(0) H2SeO3+4H++4e-=S e+3H2O 0.74Fe(III)-(II) Fe3++e-=Fe2+0.771Hg(I)-(0) Hg22++2e-=2Hg 0.797 3Ag(I)-(0) Ag++e-=Ag 0.7996Os(VIII)-(0) OsO4+8H++8e-=Os +4H2O 0.8N(V)-(IV) 2NO3-+4H++2e-=N2 O4+2H2O 0.803Hg(II)-(0) Hg2++2e-=Hg 0.851Si(IV)-(0) (quartz)SiO2+4H++4e-=Si+2H2O 0.857Cu(II)-(I) Cu2++I-+e-=CuI 0.86N(III)-(I) 2HNO2+4H++4e-=H2N 2O2+2H2O 0.86Hg(II)-(I) 2Hg2++2e-=Hg22+0. 920N(V)-(III) NO3-+3H++2e-=HNO 2+H2O 0.934Pd(II)-(0) Pd2++2e-=Pd 0.951N(V)-(II) NO3-+4H++3e-=NO+2H2O 0.957N(III)-(II) HNO2+H++e-=NO+H2 O 0.983I(I)-(-I) HIO+H++2e-=I-+H2O 0.987V(V)-(IV) VO2++2H++e-=VO2++H2O 0.991V(V)-(IV) V(OH)4++2H++e-=VO 2++3H2O 1.00Au(III)-(0) [AuCl4]-+3e-=Au+4C l- 1.002Te(VI)-(IV) H6TeO6+2H++2e-=T eO2+4H2O 1.02N(IV)-(II) N2O4+4H++4e-=2NO +2H2O 1.035N(IV)-(III) N2O4+2H++2e-=2HN O2 1.065I(V)-(-I) IO3-+6H++6e-=I-+3H2O 1.085Br(0)-(-I) Br2(aq)+2e-=2Br- 1. 0873Se(VI)-(IV) SeO42-+4H++2e-=H2SeO3+H2O 1.151Cl(V)-(IV) ClO3-+2H++e-=ClO 2+H2O 1.152Pt(II)-(0) Pt2++2e-=Pt 1.18Cl(VII)-(V) ClO4-+2H++2e-=Cl O3-+H2O 1.189I(V)-(0) 2IO3-+12H++10e-=I2+6H2O 1.195Cl(V)-(III) ClO3-+3H++2e-=HCl O2+H2O 1.214Mn(IV)-(II) MnO2+4H++2e-=Mn2++2H2O 1.224O(0)-(-II) O2+4H++4e-=2H2O 1.229Tl(III)-(I) T13++2e-=Tl+ 1.252Cl(IV)-(III) ClO2+H++e-=HClO2 1.277+3H2O 1.297**Cr(VI)-(III) Cr2O72-+14H++6e -=2Cr3++7H2O 1.33Br(I)-(-I) HBrO+H++2e-=Br-+H2O 1.331Cr(VI)-(III) HCrO4-+7H++3e-=Cr3++4H2O 1.350Cl(0)-(-I) Cl2(g)+2e-=2Cl- 1.35 827Cl(VII)-(-I) ClO4-+8H++8e-=C l-+4H2O 1.389Cl(VII)-(0) ClO4-+8H++7e-=1/2 Cl2+4H2O 1.39Au(III)-(I) Au3++2e-=Au+ 1.401Br(V)-(-I) BrO3-+6H++6e-=Br -+3H2O 1.423I(I)-(0) 2HIO+2H++2e-=I2+2H2 O 1.439Cl(V)-(-I) ClO3-+6H++6e-=Cl -+3H2O 1.451++2H2O 1.455Cl(V)-(0) ClO3-+6H++5e-=1/2C l2+3H2O 1.47Cl(I)-(-I) HClO+H++2e-=Cl-+H2O 1.482Br(V)-(0) BrO3-+6H++5e-=l/2B r2+3H2O 1.482Au(III)-(0) Au3++3e-=Au 1.498Mn(VII)-(II) MnO4-+8H++5e-=Mn2++4H2O 1.507Mn(III)-(II) Mn3++e-=Mn2+ 1.54 15Cl(III)-(-I) HClO2+3H++4e-=Cl -+2H2O 1.570Br(I)-(0) HBrO+H++e-=l/2Br2(a q)+H2O 1.574N(II)-(I) 2NO+2H++2e-=N2O+H 2O 1.591I(VII)-(V) H5IO6+H++2e-=IO3-+3H2O 1.601Cl(I)-(0) HClO+H++e-=1/2Cl2+H2O 1.611Cl(III)-(I) HClO2+2H++2e-=HClO +H2O 1.645Ni(IV)-(II) NiO2+4H++2e-=Ni2++2H2O 1.678Mn(VII)-(IV) MnO4-+4H++3e-=MnO2+2H2O 1.679Pb(IV)-(II) PbO2+SO42-+4H++2 e-=PbSO4+2H2O 1.6913Au(I)-(0) Au++e-=Au 1.692Ce(IV)-(III) Ce4++e-=Ce3+ 1.72N(I)-(0) N2O+2H++2e-=N2+H2 O 1.766O(-I)-(-II) H2O2+2H++2e-=2H 2O 1.776Co(III)-(II) Co3++e-=Co2+(2mo l·L-1 H2SO4) 1.83Ag(II)-(I) Ag2++e-=Ag+ 1.980S(VII)-(VI) S2O82-+2e-=2SO42- 2.010O(0)-(-II) O3+2H++2e-=O2+H 2O 2.076O(II)-(-II) F2O+2H++4e-=H2O +2F- 2.153Fe(VI)-(III) FeO42-+8H++3e-=F e3++4H2O 2.20O(0)-(-II) O(g)+2H++2e-=H2O 2.421F(0)-(-I) F2+2e-=2F- 2.866F2+2H++2e-=2HF 3.0532 在碱性溶液中(298K)电对方程式Eq/VCa(II)-(0) Ca(OH)2+2e-=Ca+2OH --3.02Ba(II)-(0) Ba(OH)2+2e-=Ba+2OH --2.99La(III)-(0) La(OH)3+3e-=La+3OH --2.90Sr(II)-(0) Sr(OH)2·8H2O+2e-=Sr+2OH-+8H2O -2.88Mg(II)-(0) Mg(OH)2+2e-=Mg+2O H--2.690Be(II)-(0) Be2O32-+3H2O+4e-=2Be+6OH--2.63Hf(IV)-(0) HfO(OH)2+H2O+4e-=H f+4OH--2.50Zr(IV)-(0) H2ZrO3+H2O+4e-=Zr +4OH--2.36Al(III)-(0) H2AlO3-+H2O+3e-=A l+OH--2.33P(I)-(0) H2PO2-+e-=P+2OH--1.82B(III)-(0) H2BO3-+H2O+3e-=B +4OH--1.79P(III)-(0) HPO32-+2H2O+3e-=P +5OH--1.71Si(IV)-(0) SiO32-+3H2O+4e-=Si +6OH--1.697P(III)-(I) HPO32-+2H2O+2e-=H2 PO2-+3OH--1.65Mn(II)-(0) Mn(OH)2+2e-=Mn+2O H--1.56Cr(III)-(0) Cr(OH)3+3e-=Cr+3OH --1.48*Zn(II)-(0) [Zn(CN)4]2-+2e-=Zn +4CN--1.26Zn(II)-(0) Zn(OH)2+2e-=Zn+2OH --1.249Ga(III)-(0) H2GaO3-+H2O+2e-=Ga+4OH--1.219Zn(II)-(0) ZnO22-+2H2O+2e-=Z n+4OH--1.215Cr(III)-(0) CrO2-+2H2O+3e-=Cr +4OH--1.2Te(0)-(-I) Te+2e-=Te2--1.143P(V)-(III) PO43-+2H2O+2e-=HP O32-+3OH--1.05*Zn(II)-(0) [Zn(NH3)4]2++2e-=Zn +4NH3 -1.04*W(VI)-(0) WO42-+4H2O+6e-=W+8OH--1.01*Ge(IV)-(0) HGeO3-+2H2O+4e-=Ge+5OH--1.0Sn(IV)-(II) [Sn(OH)6]2-+2e-=HS nO2-+H2O+3OH--0.9332-+2OH--0.93Se(0)-(-II) Se+2e-=Se2--0.92 4Sn(II)-(0) HSnO2-+H2O+2e-=S n+3OH--0.909P(0)-(-III) P+3H2O+3e-=PH3(g)+3OH--0.87N(V)-(IV) 2NO3-+2H2O+2e-=N2 O4+4OH--0.85H(I)-(0) 2H2O+2e-=H2+2OH--0.8277Cd(II)-(0) Cd(OH)2+2e-=Cd(Hg)+2OH--0.809Co(II)-(0) Co(OH)2+2e-=Co+2OH --0.73Ni(II)-(0) Ni(OH)2+2e-=Ni+2OH--0.72As(V)-(III) AsO43-+2H2O+2e-=AsO2-+4OH--0.71Ag(I)-(0) Ag2S+2e-=2Ag+S2--0.691s+4OH--0.68Sb(III)-(0) SbO2-+2H2O+3e-=S b+4OH--0.66*Re(VII)-(IV) ReO4-+2H2O+3e-=ReO2+4OH--0.59*Sb(V)-(III) SbO3-+H2O+2e-=S bO2-+2OH--0.59Re(VII)-(0) ReO4-+4H2O+7e-=R e+8OH--0.584*S(IV)-(II) 2SO32-+3H2O+4e-=S 2O32-+6OH--0.58Te(IV)-(0) TeO32-+3H2O+4e-=T e+6OH--0.57Fe(III)-(II) Fe(OH)3+e-=Fe(OH)2+OH--0.56S(0)-(-II) S+2e-=S2--0.47627Bi(III)-(0) Bi2O3+3H2O+6e-=2Bi +6OH--0.46N(III)-(II) NO2-+H2O+e-=NO+2 OH--0.46*Co(II)-C(0) [Co(NH3)6]2++2e-=Co+6NH3 -0.422Se(IV)-(0) SeO32-+3H2O+4e-=Se+6OH--0.366Cu(I)-(0) Cu2O+H2O+2e-=2Cu+2OH--0.360Tl(I)-(0) Tl(OH)+e-=Tl+OH--0.34*Ag(I)-(0) [Ag(CN)2]-+e-=Ag+2 CN--0.31Cu(II)-(0) Cu(OH)2+2e-=Cu+2OH --0.222Cr(VI)-(III) CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13*Cu(I)-(0) [Cu(NH3)2]++e-=Cu+2NH3 -0.12O(0)-(-I) O2+H2O+2e-=HO2-+OH--0.076Ag(I)-(0) AgCN+e-=Ag+CN--0.017N(V)-(III) NO3-+H2O+2e-=NO2-+2OH-0.01Se(VI)-(IV) SeO42-+H2O+2e-=S eO32-+2OH-0.05Pd(II)-(0) Pd(OH)2+2e-=Pd+2OH -0.07S(II,V)-(II) S4O62-+2e-=2S2O32-0.08Hg(II)-(0) HgO+H2O+2e-=Hg+2 OH-0.0977Co(III)-(II) [Co(NH3)6]3++e-=[Co (NH3)6]2+0.108Pt(II)-(0) Pt(OH)2+2e-=Pt+2OH-0.14Co(III)-(II) Co(OH)3+e-=Co(OH)2+OH-0.17Pb(IV)-(II) PbO2+H2O+2e-=PbO +2OH-0.247I(V)-(-I) IO3-+3H2O+6e-=I-+6OH-0.26Cl(V)-(III) ClO3-+H2O+2e-=ClO 2-+2OH-0.33Ag(I)-(0) Ag2O+H2O+2e-=2Ag+2OH-0.342Fe(III)-(II) [Fe(CN)6]3-+e-=[Fe(C N)6]4-0.358Cl(VII)-(V) ClO4-+H2O+2e-=Cl O3-+2OH-0.36*Ag(I)-(0) [Ag(NH3)2]++e-=Ag+2NH3 0.373O(0)-(-II) O2+2H2O+4e-=4OH-0.401I(I)-(-I) IO-+H2O+2e-=I-+2O H-0.485*Ni(IV)-(II) NiO2+2H2O+2e-=Ni(O H)2+2OH-0.490Mn(VII)-(VI) MnO4-+e-=MnO42-0.558Mn(VII)-(IV) MnO4-+2H2O+3e-=MnO2+4OH-0.595Mn(VI)-(IV) MnO42-+2H2O+2e-=MnO2+4OH-0.60Ag(II)-(I) 2AgO+H2O+2e-=Ag2O +2OH-0.607Br(V)-(-I) BrO3-+3H2O+6e-=B r-+6OH-0.61Cl(V)-(-I) ClO3-+3H2O+6e-=Cl -+6OH-0.62Cl(III)-(I) ClO2-+H2O+2e-=ClO -+2OH-0.66I(VII)-(V) H3IO62-+2e-=IO3-+3 OH-0.7Cl(III)-(-I) ClO2-+2H2O+4e-=C l-+4OH-0.76Br(I)-(-I) BrO-+H2O+2e-=Br-+2OH-0.761Cl(I)-(-I) ClO-+H2O+2e-=Cl-+2OH-0.841*Cl(IV)-(III) ClO2(g)+e-=ClO2-0.95O(0)-(-II) O3+H2O+2e-=O2+2O H- 1.24标准电极电势表半反应E°(V) 来源& -9Zz 9N N2(g) + H+ + e− HN3(aq) -3.09 [6]Li+ + e− Li(s) -3.0401 [5]N2(g) + 4 H2O + 2 e− 2 N H2OH(aq) + 2 O H− -3.04 [6]Cs+ + e− Cs(s) -3.026 [5]Rb+ + e− Rb(s) -2.98 [4]K+ + e− K(s) -2.931 [5]Ba2+ + 2 e− Ba(s) -2.912 [5]La(OH)3(s) + 3 e− La(s) + 3OH− -2.9 0 [5]Sr2+ + 2 e− Sr(s) -2.899 [5]Ca2+ + 2 e− Ca(s) -2.868 [5]Eu2+ + 2 e− Eu(s) -2.812 [5]Ra2+ + 2 e− Ra(s) -2.8 [5]Na+ + e− Na(s) -2.71 [5][9]La3+ + 3 e− La(s) -2.379 [5]Y3+ + 3 e− Y(s) -2.372 [5]Mg2+ + 2 e− Mg(s) -2.372 [5]ZrO(OH)2(s) + H2O + 4 e− Zr(s) + 4 OH− -2.36 [5]Al(OH)4− + 3 e− Al(s) + 4 O H− -2.33Al(OH)3(s) + 3 e− Al(s) + 3OH− -2.3 1H2(g) + 2 e− 2 H− -2.25Ac3+ + 3 e− Ac(s) -2.20Be2+ + 2 e− Be(s) -1.85U3+ + 3 e− U(s) -1.66 [7]Al3+ + 3 e− Al(s) -1.66 [9]Ti2+ + 2 e− Ti(s) -1.63 [9]ZrO2(s) + 4 H+ + 4 e− Zr(s) + 2 H2O -1.553 [5]Zr4+ + 4 e− Zr(s) -1.45 [5]TiO(s) + 2 H+ + 2 e− Ti(s) + H2O -1.31Ti2O3(s) + 2 H+ + 2 e− 2 T iO(s) + H2 O -1.23Ti3+ + 3 e− Ti(s) -1.21Te(s) + 2 e− Te2− -1.143 [2]V2+ + 2 e− V(s) -1.13 [2]Nb3+ + 3 e− Nb(s) -1.099Sn(s) + 4 H+ + 4 e− SnH4(g) -1.07Mn2+ + 2 e− Mn(s) -1.029 [9]SiO2(s) + 4 H+ + 4 e− Si(s) + 2 H2O -0.91B(OH)3(aq) + 3 H+ + 3 e− B(s) + 3 H 2O -0.89TiO2+ + 2 H+ + 4 e− Ti(s) + H2O -0.86Bi(s) + 3 H+ + 3 e− BiH3 -0.8H2 H2O + 2 e− H2(g) +2 O H− -0.827 7 [5]Zn2+ + 2 e− Zn(Hg) -0.7628 [5]Zn2+ + 2 e− Zn(s) -0.7618 [5]Ta2O5(s) + 10 H+ + 10 e− 2 T a(s) + 5 H2O -0.75Cr3+ + 3 e− Cr(s) -0.74Au[Au(CN)2]− + e− Au(s) + 2 C N− -0.60Ta3+ + 3 e− Ta(s) -0.6PbO(s) + H2O + 2 e− Pb(s) + 2 O H−-0.58Ti2 T iO2(s) + 2 H+ + 2 e− Ti2O3(s) + H2O -0.56Ga3+ + 3 e− Ga(s) -0.53U4+ + e− U3+ -0.52 [7]P H3PO2(aq) + H+ + e− P(白磷[10]) + 2 H2O -0.508 [5]P H3PO3(aq) + 2 H+ + 2 e− H3PO2(a q) + H2O -0.499 [5]P H3PO3(aq) + 3 H+ + 3 e− P(红磷) [10] + 3H2O -0.454 [5]Fe2+ + 2 e− Fe(s) -0.44 [9]C2 C O2(g) + 2 H+ + 2 e− HOOCCOO H(aq) -0.43Cr3+ + e− Cr2+ -0.42Cd2+ + 2 e− Cd(s) -0.40 [9]GeO2(s) + 2 H+ + 2 e− GeO(s) + H2 O -0.37Cu2O(s) + H2O + 2 e− 2 C u(s) + 2 O H− -0.360 [5]PbSO4(s) + 2 e− Pb(s) + SO42− -0.3 588 [5]PbSO4(s) + 2 e− Pb(Hg) + SO42− -0. 3505 [5]Eu3+ + e− Eu2+ -0.35 [7]In3+ + 3 e− In(s) 0.34 [2]Tl+ + e− Tl(s) -0.34 [2]Ge(s) + 4 H+ + 4 e− GeH4(g) -0.29Co2+ + 2 e− Co(s) -0.28 [5]P H3PO4(aq) + 2 H+ + 2 e− H3PO3(a q) + H2O -0.276 [5]V3+ + e− V2+ 0.26 [9]Ni2+ + 2 e− Ni(s) -0.25As(s) + 3 H+ + 3 e− AsH3(g) -0.23 [2]MoO2(s) + 4 H+ + 4 e− Mo(s) + 2 H2 O -0.15Si(s) + 4 H+ + 4 e− SiH4(g) -0.14Sn2+ + 2 e− Sn(s) -0.13O2(g) + H+ + e− HO2•(aq) -0.13Pb2+ + 2 e− Pb(s) -0.13 [9]WO2(s) + 4 H+ + 4 e− W(s) + 2 H2O -0.12P(红磷) + 3 H+ + 3 e− PH3(g) -0.111[5]C CO2(g) + 2 H+ + 2 e− HCOOH(aq) -0.11Se(s) + 2 H+ + 2 e− H2Se(g) -0.11C CO2(g) + 2 H+ + 2 e− CO(g) + H2 O -0.11SnO(s) + 2 H+ + 2 e− Sn(s) + H2O -0.10SnO2(s) + 2 H+ + 2 e− SnO(s) + H2 O -0.09WO3(aq) + 6 H+ + 6 e− W(s) + 3 H2 O -0.09 [2]P(白磷) + 3 H+ + 3 e− PH3(g) -0.063[5]C HCOOH(aq) + 2 H+ + 2 e− HCHO (aq) + H2O -0.03H 2 H+ + 2 e− H2(g) ≡ 0S4O62− + 2 e− 2 S2O32− +0.08Fe3O4(s) + 8 H+ + 8 e− 3 F e(s) + 4 H 2O +0.085 [8]N2(g) + 2 H2O + 6H+ + 6 e− 2 N H4O H(aq) +0.092HgO(s) + H2O + 2 e− Hg(l) + 2 O H−+0.0977Cu(NH3)42+ + e− Cu(NH3)2+ + 2 N H 3 +0.10 [2]Ru(NH3)63+ + e− Ru(NH3)62+ +0.10 [7]N2H4(aq) + 4 H2O + 2 e− 2 N H4+ + 4 O H− +0.11 [6]Mo H2MoO4(aq) + 6 H+ + 6 e− Mo(s) + 4 H2O +0.11Ge4+ + 4 e− Ge(s) +0.12C(s) + 4 H+ + 4 e− CH4(g) +0.13 [2]C HCHO(aq) + 2 H+ + 2 e− CH3OH(a q) +0.13S(s) + 2 H+ + 2 e− H2S(g) +0.14Sn4+ + 2 e− Sn2+ +0.15Cu2+ + e− Cu+ +0.159 [2]S HSO4− + 3 H+ + 2 e− SO2(aq) + 2 H2O +0.16UO22+ + e− UO2+ +0.163 [7]S SO42− + 4 H+ + 2 e− SO2(aq) + 2 H2O +0.17TiO2+ + 2 H+ + e− Ti3+ + H2O +0.1 9Bi3+ + 2e− Bi+ +0.2SbO+ + 2 H+ + 3 e− Sb(s) + H2O +0.20As H3AsO3(aq) + 3 H+ + 3 e− As(s) + 3 H2O +0.24GeO(s) + 2 H+ + 2 e− Ge(s) + H2O +0.26UO2+ + 4 H+ + e− U4+ + 2 H2O +0. 273 [7]Re3+ + 3 e− Re(s) +0.300Bi3+ + 3 e− Bi(s) +0.32VO2+ + 2 H+ + e− V3+ + H2O +0.34Cu2+ + 2 e− Cu(s) +0.340 [2]Fe [Fe(CN)6]3− + e− [Fe(CN)6]4− +0.36O2(g) + 2 H2O + 4 e− 4 O H−(aq) +0.4 0 [9]Mo H2MoO4 + 6 H+ + 3 e− Mo3+ + 2 H2O +0.43Bi+ + e− Bi(s) +0.50C CH3OH(aq) + 2 H+ + 2 e− CH4(g) + H2O +0.50S SO2(aq) + 4 H+ + 4 e− S(s) + 2 H2 O +0.50Cu+ + e− Cu(s) +0.520 [2]C CO(g) + 2 H+ + 2 e− C(s) + H2O +0.52I2(s) + 2 e− 2 I− +0.54 [9]I3− + 2 e− 3 I− +0.53 [9]Au [AuI4]− + 3 e− Au(s) + 4 I− +0.56As H3AsO4(aq) + 2 H+ + 2 e− H3As O3(aq) + H2O +0.56Au [AuI2]− + e− Au(s) + 2 I− +0.58MnO4− + 2 H2O + 3 e− MnO2(s) + 4 OH− +0.59S2O32 −+ 6 H+ + 4 e− 2 S(s) + 3 H2 O +0.60Mo H2MoO4(aq) + 2 H+ + 2 e− MoO 2(s) + 2 H2O +0.65O2(g) + 2 H+ + 2 e− H2O2(aq) +0.70Tl3+ + 3 e− Tl(s) +0.72PtCl62− + 2 e− PtCl42− + 2 C l− +0.7 26 [7]Se H2SeO3(aq) + 4 H+ + 4 e− Se(s) + 3 H2O +0.74PtCl42− + 2 e− Pt(s) + 4 C l− +0.758 [7]Fe3+ + e− Fe2+ +0.77Ag+ + e− Ag(s) +0.7996 [5]Hg22+ + 2 e− 2 H g(l) +0.80N NO3−(aq) + 2 H+ + e− NO2(g) +H2O +0.80Au [AuBr4]− + 3 e− Au(s) + 4 B r− + 0.85Hg2+ + 2 e− Hg(l) +0.85MnO4− + H+ + e− HMnO4− +0.90Hg 2 H g2+ + 2 e− Hg22+ +0.91 [2]Pd2+ + 2 e− Pd(s) +0.915 [7]Au [AuCl4]− + 3 e− Au(s) + 4 C l− +0.93MnO2(s) + 4 H+ + e− Mn3+ + 2 H2O +0.95Au [AuBr2]− + e− Au(s) + 2 B r− +0.96Br2(l) + 2 e− 2 B r− +1.07Br2(aq) + 2 e− 2 B r− +1.09 [9]I IO3− + 5 H+ + 4 e− HIO(aq) + 2 H2 O +1.13Au [AuCl2]− + e− Au(s) + 2 C l− +1.15Se HSeO4− + 3 H+ + 2 e− H2SeO3(a q) + H2O +1.15Ag2O(s) + 2 H+ + 2 e− 2 A g(s) + H2 O +1.17ClO3− + 2 H+ + e− ClO2(g) + H2O +1.18Pt2+ + 2 e− Pt(s) +1.188 [7]ClO2(g) + H+ + e− HClO2(aq) +1.19I 2 I O3− + 12 H+ + 10 e− I2(s) + 6 H2 O +1.20ClO4− + 2 H+ + 2 e− ClO3− + H2O +1.20O2(g) + 4 H+ + 4 e− 2 H2O +1.23 [9]MnO2(s) + 4 H+ + 2 e− Mn2+ + 2H2 O +1.23Tl3+ + 2 e− Tl+ +1.25Cl2(g) + 2 e− 2 C l− +1.36 [9]Cr2O7− −+ 14 H+ + 6 e− 2 C r3+ + 7 H2O +1.33CoO2(s) + 4 H+ + e− Co3+ + 2 H2O +1.42N 2 N H3OH+ + H+ + 2 e− N2H5+ + 2 H2O +1.42 [6]I 2 H IO(aq) + 2 H+ + 2 e− I2(s) + 2 H 2O +1.44Ce4+ + e− Ce3+ +1.44BrO3− + 5 H+ + 4 e− HBrO(aq) + 2 H 2O +1.45PbO β-PbO2(s) + 4 H+ + 2 e− Pb2+ + 2 H2O +1.460 [2]PbO α-PbO2(s) + 4 H+ + 2 e− Pb2+ + 2 H2O +1.468 [2]Br 2 B rO3− + 12 H+ + 10 e− Br2(l) + 6 H2O +1.48Cl 2ClO3− + 12 H+ + 10 e− Cl2(g) + 6 H2O +1.49MnO4− + 8 H+ + 5 e− Mn2+ + 4 H2O +1.51O HO2• + H+ + e− H2O2(aq) +1.51Au3+ + 3 e− Au(s) +1.52NiO2(s) + 4 H+ + 2 e− Ni2++ 2 O H−+1.59Cl 2 H ClO(aq) + 2 H+ + 2 e− Cl2(g) + 2 H2O +1.63Ag2O3(s) + 6 H+ + 4 e− 2 A g+ + 3 H2 O +1.67Cl HClO2(aq) + 2 H+ + 2 e− HClO(aq) + H2O +1.67Pb4+ + 2 e− Pb2+ +1.69 [2]MnO4− + 4 H+ + 3 e− MnO2(s) + 2 H 2O +1.70O H2O2(aq) + 2 H+ + 2 e− 2 H2O +1.78AgO(s) + 2 H+ + e− Ag+ + H2O +1.77Co3+ + e− Co2+ +1.82Au+ + e− Au(s) +1.83 [2]BrO4− + 2 H+ + 2 e− BrO3− + H2O +1.85Ag2+ + e− Ag+ +1.98 [2]S2O82− + 2 e− 2 S O42− +2.07O3(g) + 2 H+ + 2 e− O2(g) + H2O + 2.075 [7]Mn HMnO4− + 3 H+ + 2 e− MnO2(s) + 2 H2O +2.09F2(g) + 2 e− 2 F− +2.87 [2][9]F2(g) + 2 H+ + 2 e− 2 H F(aq) +3.05 [2]。
标准电极电势

标准电极电势表标准电极电势是可逆电极在标准状态及平衡态时的电势,也就是标准态时的电极电势.标准电极电势有很大的实用价值,可用来判断氧化剂与还原剂的相对强弱,判断氧化还原反应的进行方向,计算原电池的电动势、反应自由能、平衡常数,计算其他半反应的标准电极电势,等等。
将半反应按电极电势由低到高排序,可以得到标准电极电势表,可十分简明地判断氧还反应的方向.目录电极电势的产生—双电层理论公式电极电势内容标准电极电势表电极电势的产生—双电层理论德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double layer theory)解释电极电势的产生的原因。
当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。
金属性质越活泼,这种趋势就越大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度越大,这种趋势也越大。
在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。
通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。
电极电势以符号E Mn+/ M表示, 单位为V(伏)。
如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。
电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。
公式任何温度下标准氢电极的标准电极电势值都为0,但其他电极电势值会受到温度影响。
以Ni/NiO电极为例,它可以用作高温伪参比电极,在0-400°C 时的电极电势大致符合以下公式:E°(T)=-0.0003T+0.1414,T为温度电极电势内容1 在酸性溶液中(298K)电对方程式Eq/VLi(I)-(0) Li++e-=Li -3.0401Cs(I)-(0) Cs++e-=Cs -3.026Rb(I)-(0) Rb++e-=Rb -2.98K(I)-(0) K++e-=K -2.931Ba(II)-(0) Ba2++2e-=Ba -2.912Sr(II)-(0) Sr2++2e-=Sr -2.89Ca(II)-(0) Ca2++2e-=Ca -2.868Na(I)-(0) Na++e-=Na -2.71La(III)-(0) La3++3e-=La -2.379Mg(II)-(0) Mg2++2e-=Mg -2.372Ce(III)-(0) Ce3++3e-=Ce -2.336H(0)-(-I) H2(g)+2e-=2H--2.23Al(III)-(0) AlF63-+3e-=Al+6F--2.069Th(IV)-(0) Th4++4e-=Th -1.899Be(II)-(0) Be2++2e-=Be -1.847U(III)-(0) U3++3e-=U -1.798Hf(IV)-(0) HfO2++2H++4e-=Hf+H2O -1.724 Al(III)-(0) Al3++3e-=Al -1.662Ti(II)-(0) Ti2++2e-=Ti -1.630Zr(IV)-(0) ZrO2+4H++4e-=Zr+2H2O -1.553Si(IV)-(0) [SiF6]2-+4e-=Si+6F--1.24Mn(II)-(0) Mn2++2e-=Mn -1.185Cr(II)-(0) Cr2++2e-=Cr -0.913Ti(III)-(II) Ti3++e-=Ti2+-0.9B(III)-(0) H3BO3+3H++3e-=B+3H2O -0.8698*Ti(IV)-(0) TiO2+4H++4e-=Ti+2H2O -0.86Te(0)-(-II) Te+2H++2e-=H2Te -0.793Zn(II)-(0) Zn2++2e-=Zn -0.7618Ta(V)-(0) Ta2O5+10H++10e-=2Ta+5H2O -0.750 Cr(III)-(0) Cr3++3e-=Cr -0.744Nb(V)-(0) Nb2O5+l0H++10e-=2Nb+5H2O -0.644 As(0)-(-III) As+3H++3e-=AsH3 -0.608U(IV)-(III) U4++e-=U3+-0.607Ga(III)-(0) Ga3++3e-=Ga -0.549P(I)-(0) H3PO2+H++e-=P+2H2O -0.508P(III)-(I) H3PO3+2H++2e-=H3PO2+H2O -0.499 *C(IV)-(III) 2CO2+2H++2e-=H2C2O4 -0.49Fe(II)-(0) Fe2++2e-=Fe -0.447Cr(III)-(II) Cr3++e-=Cr2+-0.407Cd(II)-(0) Cd2++2e-=Cd -0.4030Se(0)-(-II) Se+2H++2e-=H2Se(aq) -0.399Pb(II)-(0) PbI2+2e-=Pb+2I--0.365Eu(III)-(II) Eu3++e-=Eu2+-0.36Pb(II)-(0) PbSO4+2e-=Pb+SO42--0.3588In(III)-(0) In3++3e-=In -0.3382Tl(I)-(0) Tl++e-=Tl -0.336Co(II)-(0) Co2++2e-=Co -0.28P(V)-(III) H3PO4+2H++2e-=H3PO3+H2O -0.276 Pb(II)-(0) PbCl2+2e-=Pb+2Cl--0.2675Ni (II)-(0) Ni2++2e-=Ni -0.257V(III)-(II) V3++e-=V2+-0.255Ge(IV)-(0) H2GeO3+4H++4e-=Ge+3H2O -0.182 Ag(I)-(0) AgI+e-=Ag+I--0.15224Sn(II)-(0) Sn2++2e-=Sn -0.1375Pb(II)-(0) Pb2++2e-=Pb -0.1262*C(IV)-(II) CO2(g)+2H++2e-=CO+H2O -0.12P(0)-(-III) P(white)+3H++3e-=PH3(g) -0.063Hg(I)-(0) Hg2I2+2e-=2Hg+2I--0.0405Fe(III)-(0) Fe3++3e-=Fe -0.037H(I)-(0) 2H++2e-=H2 0.0000Ag(I)-(0) AgBr+e-=Ag+Br-0.07133S(II.V)-(II) S4O62-+2e-=2S2O32-0.08*Ti(IV)-(III) TiO2++2H++e-=Ti3++H2O 0.1S(0)-(-II) S+2H++2e-=H2S(aq) 0.142Sn(IV)-(II) Sn4++2e-=Sn2+0.151Sb(III)-(0) Sb2O3+6H++6e-=2Sb+3H2O 0.152Cu(II)-(I) Cu2++e-=Cu+0.153Bi(III)-(0) BiOCl+2H++3e-=Bi+Cl-+H2O 0.1583 S(VI)-(IV) SO42-+4H++2e-=H2SO3+H2O 0.172 Sb(III)-(0) SbO++2H++3e-=Sb+H2O 0.212Ag(I)-(0) AgCl+e-=Ag+Cl-0.22233As(III)-(0) HAsO2+3H++3e-=As+2H2O 0.248Hg(I)-(0) Hg2Cl2+2e-=2Hg+2Cl-(饱和KCl) 0.26808 Bi(III)-(0) BiO++2H++3e-=Bi+H2O 0.320U(VI)-(IV) UO22++4H++2e-=U4++2H2O 0.327C(IV)-(III) 2HCNO+2H++2e-=(CN)2+2H2O 0.330 V(IV)-(III) VO2++2H++e-=V3++H2O 0.337Cu(II)-(0) Cu2++2e-=Cu 0.3419Re(VII)-(0) ReO4-+8H++7e-=Re+4H2O 0.368Ag(I)-(0) Ag2CrO4+2e-=2Ag+CrO42-0.4470S(IV)-(0) H2SO3+4H++4e-=S+3H2O 0.449Cu(I)-(0) Cu++e-=Cu 0.521I(0)-(-I) I2+2e-=2I-0.5355I(0)-(-I) I3-+2e-=3I-0.536As(V)-(III) H3AsO4+2H++2e-=HAsO2+2H2O 0.560 Sb(V)-(III) Sb2O5+6H++4e-=2SbO++3H2O 0.581 Te(IV)-(0) TeO2+4H++4e-=Te+2H2O 0.593U(V)-(IV) UO2++4H++e-=U4++2H2O 0.612**Hg(II)-(I) 2HgCl2+2e-=Hg2Cl2+2Cl-0.63Pt(IV)-(II) [PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68O(0)-(-I) O2+2H++2e-=H2O2 0.695Pt(II)-(0) [PtCl4]2-+2e-=Pt+4Cl-0.755*Se(IV)-(0) H2SeO3+4H++4e-=Se+3H2O 0.74Fe(III)-(II) Fe3++e-=Fe2+0.771Hg(I)-(0) Hg22++2e-=2Hg 0.7973Ag(I)-(0) Ag++e-=Ag 0.7996Os(VIII)-(0) OsO4+8H++8e-=Os+4H2O 0.8N(V)-(IV) 2NO3-+4H++2e-=N2O4+2H2O 0.803Hg(II)-(0) Hg2++2e-=Hg 0.851Si(IV)-(0) (quartz)SiO2+4H++4e-=Si+2H2O 0.857Cu(II)-(I) Cu2++I-+e-=CuI 0.86N(III)-(I) 2HNO2+4H++4e-=H2N2O2+2H2O 0.86Hg(II)-(I) 2Hg2++2e-=Hg22+0.920N(V)-(III) NO3-+3H++2e-=HNO2+H2O 0.934Pd(II)-(0) Pd2++2e-=Pd 0.951N(V)-(II) NO3-+4H++3e-=NO+2H2O 0.957N(III)-(II) HNO2+H++e-=NO+H2O 0.983I(I)-(-I) HIO+H++2e-=I-+H2O 0.987V(V)-(IV) VO2++2H++e-=VO2++H2O 0.991V(V)-(IV) V(OH)4++2H++e-=VO2++3H2O 1.00Au(III)-(0) [AuCl4]-+3e-=Au+4Cl- 1.002Te(VI)-(IV) H6TeO6+2H++2e-=TeO2+4H2O 1.02N(IV)-(II) N2O4+4H++4e-=2NO+2H2O 1.035N(IV)-(III) N2O4+2H++2e-=2HNO2 1.065I(V)-(-I) IO3-+6H++6e-=I-+3H2O 1.085Br(0)-(-I) Br2(aq)+2e-=2Br- 1.0873Se(VI)-(IV) SeO42-+4H++2e-=H2SeO3+H2O 1.151Cl(V)-(IV) ClO3-+2H++e-=ClO2+H2O 1.152Pt(II)-(0) Pt2++2e-=Pt 1.18Cl(VII)-(V) ClO4-+2H++2e-=ClO3-+H2O 1.189I(V)-(0) 2IO3-+12H++10e-=I2+6H2O 1.195Cl(V)-(III) ClO3-+3H++2e-=HClO2+H2O 1.214Mn(IV)-(II) MnO2+4H++2e-=Mn2++2H2O 1.224O(0)-(-II) O2+4H++4e-=2H2O 1.229Tl(III)-(I) T13++2e-=Tl+ 1.252Cl(IV)-(III) ClO2+H++e-=HClO2 1.277N(III)-(I) 2HNO2+4H++4e-=N2O+3H2O 1.297**Cr(VI)-(III) Cr2O72-+14H++6e-=2Cr3++7H2O 1.33 Br(I)-(-I) HBrO+H++2e-=Br-+H2O 1.331Cr(VI)-(III) HCrO4-+7H++3e-=Cr3++4H2O 1.350Cl(0)-(-I) Cl2(g)+2e-=2Cl- 1.35827Cl(VII)-(-I) ClO4-+8H++8e-=Cl-+4H2O 1.389Cl(VII)-(0) ClO4-+8H++7e-=1/2Cl2+4H2O 1.39Au(III)-(I) Au3++2e-=Au+ 1.401Br(V)-(-I) BrO3-+6H++6e-=Br-+3H2O 1.423I(I)-(0) 2HIO+2H++2e-=I2+2H2O 1.439Cl(V)-(-I) ClO3-+6H++6e-=Cl-+3H2O 1.451Pb(IV)-(II) PbO2+4H++2e-=Pb2++2H2O 1.455Cl(V)-(0) ClO3-+6H++5e-=1/2Cl2+3H2O 1.47Cl(I)-(-I) HClO+H++2e-=Cl-+H2O 1.482Br(V)-(0) BrO3-+6H++5e-=l/2Br2+3H2O 1.482Au(III)-(0) Au3++3e-=Au 1.498Mn(VII)-(II) MnO4-+8H++5e-=Mn2++4H2O 1.507Mn(III)-(II) Mn3++e-=Mn2+ 1.5415Cl(III)-(-I) HClO2+3H++4e-=Cl-+2H2O 1.570Br(I)-(0) HBrO+H++e-=l/2Br2(aq)+H2O 1.574N(II)-(I) 2NO+2H++2e-=N2O+H2O 1.591I(VII)-(V) H5IO6+H++2e-=IO3-+3H2O 1.601Cl(I)-(0) HClO+H++e-=1/2Cl2+H2O 1.611Cl(III)-(I) HClO2+2H++2e-=HClO+H2O 1.645Ni(IV)-(II) NiO2+4H++2e-=Ni2++2H2O 1.678Mn(VII)-(IV) MnO4-+4H++3e-=MnO2+2H2O 1.679Pb(IV)-(II) PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.6913 Au(I)-(0) Au++e-=Au 1.692Ce(IV)-(III) Ce4++e-=Ce3+ 1.72N(I)-(0) N2O+2H++2e-=N2+H2O 1.766O(-I)-(-II) H2O2+2H++2e-=2H2O 1.776Co(III)-(II) Co3++e-=Co2+(2mol·L-1 H2SO4) 1.83Ag(II)-(I) Ag2++e-=Ag+ 1.980S(VII)-(VI) S2O82-+2e-=2SO42- 2.010O(0)-(-II) O3+2H++2e-=O2+H2O 2.076O(II)-(-II) F2O+2H++4e-=H2O+2F- 2.153Fe(VI)-(III) FeO42-+8H++3e-=Fe3++4H2O 2.20O(0)-(-II) O(g)+2H++2e-=H2O 2.421F(0)-(-I) F2+2e-=2F- 2.866F2+2H++2e-=2HF 3.0532 在碱性溶液中(298K)电对方程式Eq/VCa(II)-(0) Ca(OH)2+2e-=Ca+2OH--3.02Ba(II)-(0) Ba(OH)2+2e-=Ba+2OH--2.99La(III)-(0) La(OH)3+3e-=La+3OH--2.90Sr(II)-(0) Sr(OH)2·8H2O+2e-=Sr+2OH-+8H2O -2.88Mg(II)-(0) Mg(OH)2+2e-=Mg+2OH--2.690Be(II)-(0) Be2O32-+3H2O+4e-=2Be+6OH--2.63Hf(IV)-(0) HfO(OH)2+H2O+4e-=Hf+4OH--2.50Zr(IV)-(0) H2ZrO3+H2O+4e-=Zr+4OH--2.36Al(III)-(0) H2AlO3-+H2O+3e-=Al+OH--2.33P(I)-(0) H2PO2-+e-=P+2OH--1.82B(III)-(0) H2BO3-+H2O+3e-=B+4OH--1.79P(III)-(0) HPO32-+2H2O+3e-=P+5OH--1.71Si(IV)-(0) SiO32-+3H2O+4e-=Si+6OH--1.697P(III)-(I) HPO32-+2H2O+2e-=H2PO2-+3OH--1.65Mn(II)-(0) Mn(OH)2+2e-=Mn+2OH--1.56Cr(III)-(0) Cr(OH)3+3e-=Cr+3OH--1.48*Zn(II)-(0) [Zn(CN)4]2-+2e-=Zn+4CN--1.26Zn(II)-(0) Zn(OH)2+2e-=Zn+2OH--1.249Ga(III)-(0) H2GaO3-+H2O+2e-=Ga+4OH--1.219Zn(II)-(0) ZnO22-+2H2O+2e-=Zn+4OH--1.215Cr(III)-(0) CrO2-+2H2O+3e-=Cr+4OH--1.2Te(0)-(-I) Te+2e-=Te2--1.143P(V)-(III) PO43-+2H2O+2e-=HPO32-+3OH--1.05*Zn(II)-(0) [Zn(NH3)4]2++2e-=Zn+4NH3 -1.04*W(VI)-(0) WO42-+4H2O+6e-=W+8OH--1.01*Ge(IV)-(0) HGeO3-+2H2O+4e-=Ge+5OH--1.0Sn(IV)-(II) [Sn(OH)6]2-+2e-=HSnO2-+H2O+3OH--0.93 S(VI)-(IV) SO42-+H2O+2e-=SO32-+2OH--0.93Se(0)-(-II) Se+2e-=Se2--0.924Sn(II)-(0) HSnO2-+H2O+2e-=Sn+3OH--0.909P(0)-(-III) P+3H2O+3e-=PH3(g)+3OH--0.87N(V)-(IV) 2NO3-+2H2O+2e-=N2O4+4OH--0.85H(I)-(0) 2H2O+2e-=H2+2OH--0.8277Cd(II)-(0) Cd(OH)2+2e-=Cd(Hg)+2OH--0.809Co(II)-(0) Co(OH)2+2e-=Co+2OH--0.73Ni(II)-(0) Ni(OH)2+2e-=Ni+2OH--0.72As(V)-(III) AsO43-+2H2O+2e-=AsO2-+4OH--0.71Ag(I)-(0) Ag2S+2e-=2Ag+S2--0.691As(III)-(0) AsO2-+2H2O+3e-=As+4OH--0.68Sb(III)-(0) SbO2-+2H2O+3e-=Sb+4OH--0.66*Re(VII)-(IV) ReO4-+2H2O+3e-=ReO2+4OH--0.59*Sb(V)-(III) SbO3-+H2O+2e-=SbO2-+2OH--0.59Re(VII)-(0) ReO4-+4H2O+7e-=Re+8OH--0.584*S(IV)-(II) 2SO32-+3H2O+4e-=S2O32-+6OH--0.58Te(IV)-(0) TeO32-+3H2O+4e-=Te+6OH--0.57Fe(III)-(II) Fe(OH)3+e-=Fe(OH)2+OH--0.56S(0)-(-II) S+2e-=S2--0.47627Bi(III)-(0) Bi2O3+3H2O+6e-=2Bi+6OH--0.46N(III)-(II) NO2-+H2O+e-=NO+2OH--0.46*Co(II)-C(0) [Co(NH3)6]2++2e-=Co+6NH3 -0.422Se(IV)-(0) SeO32-+3H2O+4e-=Se+6OH--0.366Cu(I)-(0) Cu2O+H2O+2e-=2Cu+2OH--0.360Tl(I)-(0) Tl(OH)+e-=Tl+OH--0.34*Ag(I)-(0) [Ag(CN)2]-+e-=Ag+2CN--0.31Cu(II)-(0) Cu(OH)2+2e-=Cu+2OH--0.222Cr(VI)-(III) CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13 *Cu(I)-(0) [Cu(NH3)2]++e-=Cu+2NH3 -0.12O(0)-(-I) O2+H2O+2e-=HO2-+OH--0.076Ag(I)-(0) AgCN+e-=Ag+CN--0.017N(V)-(III) NO3-+H2O+2e-=NO2-+2OH-0.01Se(VI)-(IV) SeO42-+H2O+2e-=SeO32-+2OH-0.05 Pd(II)-(0) Pd(OH)2+2e-=Pd+2OH-0.07S(II,V)-(II) S4O62-+2e-=2S2O32-0.08Hg(II)-(0) HgO+H2O+2e-=Hg+2OH-0.0977Co(III)-(II) [Co(NH3)6]3++e-=[Co(NH3)6]2+0.108Pt(II)-(0) Pt(OH)2+2e-=Pt+2OH-0.14Co(III)-(II) Co(OH)3+e-=Co(OH)2+OH-0.17Pb(IV)-(II) PbO2+H2O+2e-=PbO+2OH-0.247I(V)-(-I) IO3-+3H2O+6e-=I-+6OH-0.26Cl(V)-(III) ClO3-+H2O+2e-=ClO2-+2OH-0.33Ag(I)-(0) Ag2O+H2O+2e-=2Ag+2OH-0.342Fe(III)-(II) [Fe(CN)6]3-+e-=[Fe(CN)6]4-0.358Cl(VII)-(V) ClO4-+H2O+2e-=ClO3-+2OH-0.36*Ag(I)-(0) [Ag(NH3)2]++e-=Ag+2NH3 0.373O(0)-(-II) O2+2H2O+4e-=4OH-0.401I(I)-(-I) IO-+H2O+2e-=I-+2OH-0.485*Ni(IV)-(II) NiO2+2H2O+2e-=Ni(OH)2+2OH-0.490Mn(VII)-(VI) MnO4-+e-=MnO42-0.558Mn(VII)-(IV) MnO4-+2H2O+3e-=MnO2+4OH-0.595 Mn(VI)-(IV) MnO42-+2H2O+2e-=MnO2+4OH-0.60 Ag(II)-(I) 2AgO+H2O+2e-=Ag2O+2OH-0.607Br(V)-(-I) BrO3-+3H2O+6e-=Br-+6OH-0.61Cl(V)-(-I) ClO3-+3H2O+6e-=Cl-+6OH-0.62Cl(III)-(I) ClO2-+H2O+2e-=ClO-+2OH-0.66I(VII)-(V) H3IO62-+2e-=IO3-+3OH-0.7Cl(III)-(-I) ClO2-+2H2O+4e-=Cl-+4OH-0.76Br(I)-(-I) BrO-+H2O+2e-=Br-+2OH-0.761Cl(I)-(-I) ClO-+H2O+2e-=Cl-+2OH-0.841*Cl(IV)-(III) ClO2(g)+e-=ClO2-0.95O(0)-(-II) O3+H2O+2e-=O2+2OH- 1.24标准电极电势表半反应E° (V) 来源& -9Zz 9N N2(g) + H+ + e− HN3(aq) -3.09 [6]Li+ + e− Li(s) -3.0401 [5]N2(g) + 4H2O + 2e− 2NH2OH(aq) + 2OH− -3.04 [6]Rb+ + e− Rb(s) -2.98 [4]K+ + e− K(s) -2.931 [5]Ba2+ + 2e− Ba(s) -2.912 [5]La(OH)3(s) + 3e− La(s) + 3OH− -2.90 [5]Sr2+ + 2e− Sr(s) -2.899 [5]Ca2+ + 2e− Ca(s) -2.868 [5]Eu2+ + 2e− Eu(s) -2.812 [5]Ra2+ + 2e− Ra(s) -2.8 [5]Na+ + e− Na(s) -2.71 [5][9]La3+ + 3e− La(s) -2.379 [5]Y3+ + 3e− Y(s) -2.372 [5]Mg2+ + 2e− Mg(s) -2.372 [5]ZrO(OH)2(s) + H2O + 4e− Zr(s) + 4OH− -2.36 [5]Al(OH)4− + 3e− Al(s) + 4OH− -2.33Al(OH)3(s) + 3e− Al(s) + 3OH− -2.31H2(g) + 2e− 2H− -2.25Ac3+ + 3e− Ac(s) -2.20Be2+ + 2e− Be(s) -1.85U3+ + 3e− U(s) -1.66 [7]Al3+ + 3e− Al(s) -1.66 [9]Ti2+ + 2e− Ti(s) -1.63 [9]ZrO2(s) + 4H+ + 4e− Zr(s) + 2H2O -1.553 [5]Zr4+ + 4e− Zr(s) -1.45 [5]Ti O(s) + 2H+ + 2e− Ti(s) + H2O -1.31Ti2O3(s) + 2H+ + 2e− 2TiO(s) + H2O -1.23Ti3+ + 3e− Ti(s) -1.21Te(s) + 2e− Te2− -1.143 [2]V2+ + 2e− V(s) -1.13 [2]Nb3+ + 3e− Nb(s) -1.099Sn(s) + 4H+ + 4e− SnH4(g) -1.07Mn2+ + 2e− Mn(s) -1.029 [9]SiO2(s) + 4H+ + 4e− Si(s) + 2H2O -0.91B(OH)3(aq) + 3H+ + 3e− B(s) + 3H2O -0.89TiO2+ + 2H+ + 4e− Ti(s) + H2O -0.86Bi(s) + 3H+ + 3e− BiH3 -0.8H2H2O + 2e− H2(g) + 2OH− -0.8277 [5]Zn2+ + 2e− Zn(Hg) -0.7628 [5]Zn2+ + 2e− Zn(s) -0.7618 [5]Ta2O5(s) + 10H+ + 10e− 2Ta(s) + 5H2O -0.75Cr3+ + 3e− Cr(s) -0.74Au[Au(CN)2]− + e− Au(s) + 2CN− -0.60Ta3+ + 3e− Ta(s) -0.6PbO(s) + H2O + 2e− Pb(s) + 2OH− -0.58Ti2TiO2(s) + 2H+ + 2e− Ti2O3(s) + H2O -0.56Ga3+ + 3e− Ga(s) -0.53U4+ + e− U3+ -0.52 [7]P H3PO2(aq) + H+ + e− P(白磷[10]) + 2H2O -0.508 [5]P H3PO3(aq) + 2H+ + 2e− H3PO2(aq) + H2O -0.499 [5] P H3PO3(aq) + 3H+ + 3e− P(红磷)[10] + 3H2O -0.454 [5]C2CO2(g) + 2H+ + 2e− HOOCCOOH(aq) -0.43Cr3+ + e− Cr2+ -0.42Cd2+ + 2e− Cd(s) -0.40 [9]GeO2(s) + 2H+ + 2e− GeO(s) + H2O -0.37Cu2O(s) + H2O + 2e− 2Cu(s) + 2OH− -0.360 [5]PbSO4(s) + 2e− Pb(s) + SO42− -0.3588 [5]PbSO4(s) + 2e− Pb(Hg) + SO42− -0.3505 [5]Eu3+ + e− Eu2+ -0.35 [7]In3+ + 3e− In(s) 0.34 [2]Tl+ + e− Tl(s) -0.34 [2]Ge(s) + 4H+ + 4e− GeH4(g) -0.29Co2+ + 2e− Co(s) -0.28 [5]P H3PO4(aq) + 2H+ + 2e− H3PO3(aq) + H2O -0.276 [5] V3+ + e− V2+ 0.26 [9]Ni2+ + 2e− Ni(s) -0.25As(s) + 3H+ + 3e− AsH3(g) -0.23 [2]MoO2(s) + 4H+ + 4e− Mo(s) + 2H2O -0.15Si(s) + 4H+ + 4e− SiH4(g) -0.14Sn2+ + 2e− Sn(s) -0.13O2(g) + H+ + e− HO2•(aq) -0.13Pb2+ + 2e− Pb(s) -0.13 [9]WO2(s) + 4H+ + 4e− W(s) + 2H2O -0.12P(红磷) + 3H+ + 3e− PH3(g) -0.111 [5]C CO2(g) + 2H+ + 2e− HCOOH(aq) -0.11Se(s) + 2H+ + 2e− H2Se(g) -0.11C CO2(g) + 2H+ + 2e− CO(g) + H2O -0.11SnO(s) + 2H+ + 2e− Sn(s) + H2O -0.10SnO2(s) + 2H+ + 2e− SnO(s) + H2O -0.09WO3(aq) + 6H+ + 6e− W(s) + 3H2O -0.09 [2]P(白磷) + 3H+ + 3e− PH3(g) -0.063 [5]C HCOOH(aq) + 2H+ + 2e− HCHO(aq) + H2O -0.03H 2H+ + 2e− H2(g) ≡ 0S4O62− + 2e− 2S2O32− +0.08Fe3O4(s) + 8H+ + 8e− 3Fe(s) + 4H2O +0.085 [8]N2(g) + 2H2O + 6H+ + 6e− 2NH4OH(aq) +0.092HgO(s) + H2O + 2e−Hg(l) + 2OH− +0.0977Cu(NH3)42+ + e− Cu(NH3)2+ + 2NH3 +0.10 [2]Ru(NH3)63+ + e− Ru(NH3)62+ +0.10 [7]N2H4(aq) + 4H2O + 2e− 2NH4+ + 4OH− +0.11 [6]Mo H2MoO4(aq) + 6H+ + 6e− Mo(s) + 4H2O +0.11Ge4+ + 4e− Ge(s) +0.12C(s) + 4H+ + 4e− CH4(g) +0.13 [2]C HCHO(aq) + 2H+ + 2e− CH3OH(aq) +0.13S(s) + 2H+ + 2e− H2S(g) +0.14Sn4+ + 2e− Sn2+ +0.15Cu2+ + e− Cu+ +0.159 [2]S HSO4− + 3H+ + 2e− SO2(aq) + 2H2O +0.16UO22+ + e− UO2+ +0.163 [7]S SO42− + 4H+ + 2e− SO2(aq) + 2H2O +0.17TiO2+ + 2H+ + e− Ti3+ + H2O +0.19Bi3+ + 2e− Bi+ +0.2SbO+ + 2H+ + 3e− Sb(s) + H2O +0.20As H3AsO3(aq) + 3H+ + 3e− As(s) + 3H2O +0.24GeO(s) + 2H+ + 2e− Ge(s) + H2O +0.26UO2+ + 4H+ + e− U4+ + 2H2O +0.273 [7]Re3+ + 3e− Re(s) +0.300Bi3+ + 3e− Bi(s) +0.32VO2+ + 2H+ + e− V3+ + H2O +0.34Cu2+ + 2e− Cu(s) +0.340 [2]Fe [Fe(CN)6]3− + e− [Fe(CN)6]4− +0.36O2(g) + 2H2O + 4e− 4OH−(aq) +0.40 [9]Mo H2MoO4 + 6H+ + 3e− Mo3+ + 2H2O +0.43Bi+ + e− Bi(s) +0.50C CH3OH(aq) + 2H+ + 2e− CH4(g) + H2O +0.50S SO2(aq) + 4H+ + 4e− S(s) + 2H2O +0.50Cu+ + e− Cu(s) +0.520 [2]C CO(g) + 2H+ + 2e− C(s) + H2O +0.52I2(s) + 2e− 2I− +0.54 [9]I3− + 2e− 3I− +0.53 [9]Au [AuI4]− + 3e− Au(s) + 4I− +0.56As H3AsO4(aq) + 2H+ + 2e− H3AsO3(aq) + H2O +0.56 Au [AuI2]− + e− Au(s) + 2I− +0.58MnO4− + 2H2O + 3e− MnO2(s) + 4OH− +0.59S2O32−+ 6H+ + 4e− 2S(s) + 3H2O +0.60Mo H2MoO4(aq) + 2H+ + 2e− MoO2(s) + 2H2O +0.65 O2(g) + 2H+ + 2e− H2O2(aq) +0.70Tl3+ + 3e− Tl(s) +0.72PtCl62− + 2e− PtCl42− + 2Cl− +0.726 [7]Se H2SeO3(aq) + 4H+ + 4e− Se(s) + 3H2O +0.74PtCl42− + 2e− Pt(s) + 4Cl− +0.758 [7]Fe3+ + e− Fe2+ +0.77Ag+ + e− Ag(s) +0.7996 [5]Hg22+ + 2e− 2Hg(l) +0.80N NO3−(aq) + 2H+ + e− NO2(g) + H2O +0.80Au [AuBr4]− + 3e− Au(s) + 4Br− +0.85Hg2+ + 2e− Hg(l) +0.85MnO4− + H+ + e− HMnO4− +0.90Hg 2Hg2+ + 2e− Hg22+ +0.91 [2]Pd2+ + 2e− Pd(s) +0.915 [7]Au [AuCl4]− + 3e− Au(s) + 4Cl− +0.93MnO2(s) + 4H+ + e− Mn3+ + 2H2O +0.95Au [AuBr2]− + e− Au(s) + 2Br− +0.96Br2(l) + 2e− 2Br− +1.07Br2(aq) + 2e− 2Br− +1.09 [9]I IO3− + 5H+ + 4e− HIO(aq) + 2H2O +1.13Au [AuCl2]− + e− Au(s) + 2Cl− +1.15Se HSeO4− + 3H+ + 2e− H2SeO3(aq) + H2O +1.15Ag2O(s) + 2H+ + 2e− 2Ag(s) + H2O +1.17ClO3− + 2H+ + e− ClO2(g) + H2O +1.18Pt2+ + 2e− Pt(s) +1.188 [7]ClO2(g) + H+ + e− HClO2(aq) +1.19I 2IO3− + 12H+ + 10e− I2(s) + 6H2O +1.20ClO4− + 2H+ + 2e− ClO3− + H2O +1.20O2(g) + 4H+ + 4e− 2H2O +1.23 [9]MnO2(s) + 4H+ + 2e− Mn2+ + 2H2O +1.23Tl3+ + 2e− Tl+ +1.25Cl2(g) + 2e− 2Cl− +1.36 [9]Cr2O7−−+ 14H+ + 6e− 2Cr3+ + 7H2O +1.33CoO2(s) + 4H+ + e− Co3+ + 2H2O +1.42N 2NH3OH+ + H+ + 2e− N2H5+ + 2H2O +1.42 [6]I 2HIO(aq) + 2H+ + 2e− I2(s) + 2H2O +1.44Ce4+ + e− Ce3+ +1.44BrO3− + 5H+ + 4e− HBrO(aq) + 2H2O +1.45PbO β-PbO2(s) + 4H+ + 2e− Pb2+ + 2H2O +1.460 [2] PbO α-PbO2(s) + 4H+ + 2e− Pb2+ + 2H2O +1.468 [2] Br 2BrO3− + 12H+ + 10e− Br2(l) + 6H2O +1.48Cl 2ClO3− + 12H+ + 10e− Cl2(g) + 6H2O +1.49 MnO4− + 8H+ + 5e− Mn2+ + 4H2O +1.51O HO2• + H+ + e− H2O2(aq) +1.51Au3+ + 3e− Au(s) +1.52NiO2(s) + 4H+ + 2e− Ni2+ + 2OH− +1.59Cl 2HClO(aq) + 2H+ + 2e− Cl2(g) + 2H2O +1.63Ag2O3(s) + 6H+ + 4e− 2Ag+ + 3H2O +1.67Cl HClO2(aq) + 2H+ + 2e− HClO(aq) + H2O +1.67 Pb4+ + 2e− Pb2+ +1.69 [2]MnO4− + 4H+ + 3e− MnO2(s) + 2H2O +1.70O H2O2(aq) + 2H+ + 2e− 2H2O +1.78AgO(s) + 2H+ + e− Ag+ + H2O +1.77Co3+ + e− Co2+ +1.82Au+ + e− Au(s) +1.83 [2]BrO4− + 2H+ + 2e− BrO3− + H2O +1.85Ag2+ + e− Ag+ +1.98 [2]S2O82− + 2e− 2SO42− +2.07O3(g) + 2H+ + 2e− O2(g) + H2O +2.075 [7]Mn HMnO4− + 3H+ + 2e− MnO2(s) + 2H2O +2.09F2(g) + 2e− 2F− +2.87 [2][9]F2(g) + 2H+ + 2e− 2HF(aq) +3.05 [2]。
铜离子的标准电极电势

铜离子的标准电极电势
标准电极电势是指在标准状态下,一个半电池中的电极半反应在零电流下与标准氢电极的电势之间的差值。
标准状态是指压强为1 atm、摩尔浓度为1 mol/L、温度为298 K的状态。
铜离子的标准电极电势表示为Cu2+/Cu的电势为0.34 V。
这个电势是由铜离子在水溶液中还原为铜金属时所释放的电势而产生的。
这个过程中,铜离子接受了电子,被还原成了铜原子,同时释放出了二价离子的电荷,形成了铜金属。
下面是铜离子还原为铜金属的半反应:
Cu2+ + 2e- → Cu
这个半反应的标准电极电势为0.34 V。
如果这个反应是一个氧化反应,电势就会变成负数。
铜离子的标准电极电势对于研究许多化学和物理过程都非常重要。
例如,在无机化学中,铜离子和其他离子的还原和氧化过程是非常常见的。
铜离子还参与了许多生物化学反应,例如铜离子存在于很多的酶中,其主要作用是在电子传递过程中扮演催化剂的角色。
铜离子的标准电极电势également 可以用于评估该离子在溶液中的相对强度以及在电池中的行为。
例如,在一个静置电池中,铜离子将被还原为铜金属,并释放出电子,而在另一个电池中,某种离子将其还原为另一种物质。
这种相对强度也可以用来预测不同氧化还原反应之间的相对可能性。
总之,铜离子的标准电极电势是评估相对溶液中离子强度和电池行为的重要参数。
它在无机化学和生物化学中发挥着重要作用,并被广泛应用于计算和预测许多氧化还原反应。
金属第二章 电极电势

2
3
6-2=+4
关键在于配平H、O元素。
反应的介质不同,配平H、O元素 的方法不同。
一、酸性介质中(不能出现OH-)
2 H H 2O 反应物少一个[O ]
反应物多一个[O ]
例2 MnO SO Mn SO
4 2 3 H 2 2 4
AsO AsO
2 4 3 4
2、 O 4 H 2O 2SO 9 H HS AsO H 2O AsO 2OH
2 4 3 4 2 4 3 3
2 4 3 4
2 4 3 3
1 HS O 4 H 2O 6e 2SO 9 H 3 AsO H 2O 2e AsO 2OH
溶解趋势金属溶液金属溶液标准氢电极表达式pth1moll电极反应2ht29815k标准氢电极待测电极直流电压表饱和甘汞电极用金属汞甘汞和氯化钾组成1moll甘汞电极01moll甘汞电极氯化银电极电极处于标准状态时
第二章 电极电势
第一节 第二节 半反应式法配平氧化还 原方程式 原电池及电极电势
第一节
3、 HS2O 3 AsO H 2O 2 SO 3 AsO 3H 10 / O17 H 3
2 4 3 3
4
3 4
第二节
一 原电池
原电池及电极电势
组成
电极反应原电池反应
表示符号 氧化还原电对 二 电极电势 产生 确定 应用 非平衡电势
一、原电池
原电池的定义:化学能转变为电能的装置。
总结
1、组成原电池的条件 ①有两种活动性不同的金属(或一种是非金 属导体)作电极; ②电极材料均插入电解质溶液中; ③两极相连形成闭合电路。
标准电极电势

任何温度下标准氢电极的标准电极电势值都为0,但其他电极电势值会受到温度影响。
以Ni/NiO电极为例,它可以用作高温伪参比电极,在0-400°C 时的电极电势大致符合以下公式:E°(T)=-0.0003T+0.1414,T为温度编辑本段电极电势内容1 在酸性溶液中 (298K)电对方程式 Eq/VLi(I)-(0) Li++e-=Li -3.0401Cs(I)-(0) Cs++e-=Cs -3.026Rb(I)-(0) Rb++e-=Rb -2.98K(I)-(0) K++e-=K -2.931Ba(II)-(0) Ba2++2e-=Ba -2.912Sr(II)-(0) Sr2++2e-=Sr -2.89Ca(II)-(0) Ca2++2e-=Ca -2.868Na(I)-(0) Na++e-=Na -2.71La(III)-(0) La3++3e-=La -2.379Mg(II)-(0) Mg2++2e-=Mg -2.372Ce(III)-(0) Ce3++3e-=Ce -2.336H(0)-(-I) H2(g)+2e-=2H--2.23Al(III)-(0) AlF63-+3e-=Al+6F--2.069Th(IV)-(0) Th4++4e-=Th -1.899Be(II)-(0) Be2++2e-=Be -1.847U(III)-(0) U3++3e-=U -1.798Hf(IV)-(0) HfO2++2H++4e-=Hf+H2O -1.724Al(III)-(0) Al3++3e-=Al -1.662Ti(II)-(0) Ti2++2e-=Ti -1.630Zr(IV)-(0) ZrO2+4H++4e-=Zr+2H2O -1.553Si(IV)-(0) [SiF6]2-+4e-=Si+6F--1.24Mn(II)-(0) Mn2++2e-=Mn -1.185Cr(II)-(0) Cr2++2e-=Cr -0.913Ti(III)-(II) Ti3++e-=Ti2+-0.9B(III)-(0) H3BO3+3H++3e-=B+3H2O -0.8698*Ti(IV)-(0) TiO2+4H++4e-=Ti+2H2O -0.86Te(0)-(-II) Te+2H++2e-=H2Te -0.793Zn(II)-(0) Zn2++2e-=Zn -0.7618Ta(V)-(0) Ta2O5+10H++10e-=2Ta+5H2O -0.750Cr(III)-(0) Cr3++3e-=Cr -0.744Nb(V)-(0) Nb2O5+l0H++10e-=2Nb+5H2O -0.644As(0)-(-III) As+3H++3e-=AsH3 -0.608U(IV)-(III) U4++e-=U3+-0.607Ga(III)-(0) Ga3++3e-=Ga -0.549P(I)-(0) H3PO2+H++e-=P+2H2O -0.508P(III)-(I) H3PO3+2H++2e-=H3PO2+H2O -0.499*C(IV)-(III) 2CO2+2H++2e-=H2C2O4 -0.49Fe(II)-(0) Fe2++2e-=Fe -0.447Cr(III)-(II) Cr3++e-=Cr2+-0.407Cd(II)-(0) Cd2++2e-=Cd -0.4030Se(0)-(-II) Se+2H++2e-=H2Se(aq) -0.399Pb(II)-(0) PbI2+2e-=Pb+2I--0.365Eu(III)-(II) Eu3++e-=Eu2+-0.36Pb(II)-(0) PbSO4+2e-=Pb+SO42--0.3588In(III)-(0) In3++3e-=In -0.3382Tl(I)-(0) Tl++e-=Tl -0.336Co(II)-(0) Co2++2e-=Co -0.28P(V)-(III) H3PO4+2H++2e-=H3PO3+H2O -0.276Pb(II)-(0) PbCl2+2e-=Pb+2Cl--0.2675Ni (II)-(0) Ni2++2e-=Ni -0.257V(III)-(II) V3++e-=V2+-0.255Ge(IV)-(0) H2GeO3+4H++4e-=Ge+3H2O -0.182Ag(I)-(0) AgI+e-=Ag+I--0.15224Sn(II)-(0) Sn2++2e-=Sn -0.1375Pb(II)-(0) Pb2++2e-=Pb -0.1262*C(IV)-(II) CO2(g)+2H++2e-=CO+H2O -0.12P(0)-(-III) P(white)+3H++3e-=PH3(g) -0.063 Hg(I)-(0) Hg2I2+2e-=2Hg+2I--0.0405Fe(III)-(0) Fe3++3e-=Fe -0.037H(I)-(0) 2H++2e-=H2 0.0000Ag(I)-(0) AgBr+e-=Ag+Br-0.07133S(II.V)-(II) S4O62-+2e-=2S2O32-0.08*Ti(IV)-(III) TiO2++2H++e-=Ti3++H2O 0.1S(0)-(-II) S+2H++2e-=H2S(aq) 0.142Sn(IV)-(II) Sn4++2e-=Sn2+ 0.151Sb(III)-(0) Sb2O3+6H++6e-=2Sb+3H2O 0.152Cu(II)-(I) Cu2++e-=Cu+0.153Bi(III)-(0) BiOCl+2H++3e-=Bi+Cl-+H2O 0.1583S(VI)-(IV) SO42-+4H++2e-=H2SO3+H2O 0.172Sb(III)-(0) SbO++2H++3e-=Sb+H2O 0.212Ag(I)-(0) AgCl+e-=Ag+Cl-0.22233As(III)-(0) HAsO2+3H++3e-=As+2H2O 0.248Hg(I)-(0) Hg2Cl2+2e-=2Hg+2Cl-(饱和KCl) 0.26808 Bi(III)-(0) BiO++2H++3e-=Bi+H2O 0.320U(VI)-(IV) UO22++4H++2e-=U4++2H2O 0.327C(IV)-(III) 2HCNO+2H++2e-=(CN)2+2H2O 0.330V(IV)-(III) VO2++2H++e-=V3++H2O 0.337Cu(II)-(0) Cu2++2e-=Cu 0.3419Re(VII)-(0) ReO4-+8H++7e-=Re+4H2O 0.368Ag(I)-(0) Ag2CrO4+2e-=2Ag+CrO42- 0.4470S(IV)-(0) H2SO3+4H++4e-=S+3H2O 0.449Cu(I)-(0) Cu++e-=Cu 0.521I(0)-(-I) I2+2e-=2I-0.5355I(0)-(-I) I3-+2e-=3I-0.536As(V)-(III) H3AsO4+2H++2e-=HAsO2+2H2O 0.560Sb(V)-(III) Sb2O5+6H++4e-=2SbO++3H2O 0.581Te(IV)-(0) TeO2+4H++4e-=Te+2H2O 0.593U(V)-(IV) UO2++4H++e-=U4++2H2O 0.612**Hg(II)-(I) 2HgCl2+2e-=Hg2Cl2+2Cl-0.63Pt(IV)-(II) [PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68 O(0)-(-I) O2+2H++2e-=H2O2 0.695Pt(II)-(0) [PtCl4]2-+2e-=Pt+4Cl-0.755*Se(IV)-(0) H2SeO3+4H++4e-=Se+3H2O 0.74Fe(III)-(II) Fe3++e-=Fe2+ 0.771Hg(I)-(0) Hg22++2e-=2Hg 0.7973Ag(I)-(0) Ag++e-=Ag 0.7996Os(VIII)-(0) OsO4+8H++8e-=Os+4H2O 0.8N(V)-(IV) 2NO3-+4H++2e-=N2O4+2H2O 0.803Hg(II)-(0) Hg2++2e-=Hg 0.851Si(IV)-(0) (quartz)SiO2+4H++4e-=Si+2H2O 0.857 Cu(II)-(I) Cu2++I-+e-=CuI 0.86N(III)-(I) 2HNO2+4H++4e-=H2N2O2+2H2O 0.86Hg(II)-(I) 2Hg2++2e-=Hg22+0.920N(V)-(III) NO3-+3H++2e-=HNO2+H2O 0.934Pd(II)-(0) Pd2++2e-=Pd 0.951N(V)-(II) NO3-+4H++3e-=NO+2H2O 0.957N(III)-(II) HNO2+H++e-=NO+H2O 0.983I(I)-(-I) HIO+H++2e-=I-+H2O 0.987V(V)-(IV) VO2++2H++e-=VO2++H2O 0.991V(V)-(IV) V(OH)4++2H++e-=VO2++3H2O 1.00Au(III)-(0) [AuCl4]-+3e-=Au+4Cl- 1.002Te(VI)-(IV) H6TeO6+2H++2e-=TeO2+4H2O 1.02N(IV)-(II) N2O4+4H++4e-=2NO+2H2O 1.035N(IV)-(III) N2O4+2H++2e-=2HNO2 1.065I(V)-(-I) IO3-+6H++6e-=I-+3H2O 1.085Br(0)-(-I) Br2(aq)+2e-=2Br- 1.0873Se(VI)-(IV) SeO42-+4H++2e-=H2SeO3+H2O 1.151Cl(V)-(IV) ClO3-+2H++e-=ClO2+H2O 1.152Pt(II)-(0) Pt2++2e-=Pt 1.18Cl(VII)-(V) ClO4-+2H++2e-=ClO3-+H2O 1.189I(V)-(0) 2IO3-+12H++10e-=I2+6H2O 1.195Cl(V)-(III) ClO3-+3H++2e-=HClO2+H2O 1.214Mn(IV)-(II) MnO2+4H++2e-=Mn2++2H2O 1.224O(0)-(-II) O2+4H++4e-=2H2O 1.229Tl(III)-(I) T13++2e-=Tl+ 1.252Cl(IV)-(III) ClO2+H++e-=HClO2 1.277N(III)-(I) 2HNO2+4H++4e-=N2O+3H2O 1.297**Cr(VI)-(III) Cr2O72-+14H++6e-=2Cr3++7H2O 1.33 Br(I)-(-I) HBrO+H++2e-=Br-+H2O 1.331Cr(VI)-(III) HCrO4-+7H++3e-=Cr3++4H2O 1.350Cl(0)-(-I) Cl2(g)+2e-=2Cl- 1.35827Cl(VII)-(-I) ClO4-+8H++8e-=Cl-+4H2O 1.389Cl(VII)-(0) ClO4-+8H++7e-=1/2Cl2+4H2O 1.39Au(III)-(I) Au3++2e-=Au+ 1.401Br(V)-(-I) BrO3-+6H++6e-=Br-+3H2O 1.423I(I)-(0) 2HIO+2H++2e-=I2+2H2O 1.439Cl(V)-(-I) ClO3-+6H++6e-=Cl-+3H2O 1.451Pb(IV)-(II) PbO2+4H++2e-=Pb2++2H2O 1.455Cl(V)-(0) ClO3-+6H++5e-=1/2Cl2+3H2O 1.47Cl(I)-(-I) HClO+H++2e-=Cl-+H2O 1.482Br(V)-(0) BrO3-+6H++5e-=l/2Br2+3H2O 1.482Au(III)-(0) Au3++3e-=Au 1.498Mn(VII)-(II) MnO4-+8H++5e-=Mn2++4H2O 1.507Mn(III)-(II) Mn3++e-=Mn2+ 1.5415Cl(III)-(-I) HClO2+3H++4e-=Cl-+2H2O 1.570Br(I)-(0) HBrO+H++e-=l/2Br2(aq)+H2O 1.574N(II)-(I) 2NO+2H++2e-=N2O+H2O 1.591I(VII)-(V) H5IO6+H++2e-=IO3-+3H2O 1.601Cl(I)-(0) HClO+H++e-=1/2Cl2+H2O 1.611Cl(III)-(I) HClO2+2H++2e-=HClO+H2O 1.645Ni(IV)-(II) NiO2+4H++2e-=Ni2++2H2O 1.678Mn(VII)-(IV) MnO4-+4H++3e-=MnO2+2H2O 1.679Pb(IV)-(II) PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.6913 Au(I)-(0) Au++e-=Au 1.692Ce(IV)-(III) Ce4++e-=Ce3+ 1.72N(I)-(0) N2O+2H++2e-=N2+H2O 1.766O(-I)-(-II) H2O2+2H++2e-=2H2O 1.776Co(III)-(II) Co3++e-=Co2+(2mol·L-1 H2SO4) 1.83Ag(II)-(I) Ag2++e-=Ag+ 1.980S(VII)-(VI) S2O82-+2e-=2SO42- 2.010O(0)-(-II) O3+2H++2e-=O2+H2O 2.076O(II)-(-II) F2O+2H++4e-=H2O+2F- 2.153Fe(VI)-(III) FeO42-+8H++3e-=Fe3++4H2O 2.20O(0)-(-II) O(g)+2H++2e-=H2O 2.421F(0)-(-I) F2+2e-=2F- 2.866F2+2H++2e-=2HF 3.0532 在碱性溶液中 (298K)电对方程式 Eq/VCa(II)-(0) Ca(OH)2+2e-=Ca+2OH--3.02Ba(II)-(0) Ba(OH)2+2e-=Ba+2OH--2.99La(III)-(0) La(OH)3+3e-=La+3OH--2.90Sr(II)-(0) Sr(OH)2·8H2O+2e-=Sr+2OH-+8H2O -2.88 Mg(II)-(0) Mg(OH)2+2e-=Mg+2OH--2.690Be(II)-(0) Be2O32-+3H2O+4e-=2Be+6OH--2.63Hf(IV)-(0) HfO(OH)2+H2O+4e-=Hf+4OH--2.50Zr(IV)-(0) H2ZrO3+H2O+4e-=Zr+4OH--2.36Al(III)-(0) H2AlO3-+H2O+3e-=Al+OH--2.33P(I)-(0) H2PO2-+e-=P+2OH--1.82B(III)-(0) H2BO3-+H2O+3e-=B+4OH--1.79P(III)-(0) HPO32-+2H2O+3e-=P+5OH--1.71Si(IV)-(0) SiO32-+3H2O+4e-=Si+6OH--1.697P(III)-(I) HPO32-+2H2O+2e-=H2PO2-+3OH--1.65Mn(II)-(0) Mn(OH)2+2e-=Mn+2OH--1.56Cr(III)-(0) Cr(OH)3+3e-=Cr+3OH--1.48*Zn(II)-(0) [Zn(CN)4]2-+2e-=Zn+4CN--1.26Zn(II)-(0) Zn(OH)2+2e-=Zn+2OH--1.249Ga(III)-(0) H2GaO3-+H2O+2e-=Ga+4OH--1.219Zn(II)-(0) ZnO22-+2H2O+2e-=Zn+4OH--1.215Cr(III)-(0) CrO2-+2H2O+3e-=Cr+4OH--1.2Te(0)-(-I) Te+2e-=Te2--1.143P(V)-(III) PO43-+2H2O+2e-=HPO32-+3OH--1.05*Zn(II)-(0) [Zn(NH3)4]2++2e-=Zn+4NH3 -1.04*W(VI)-(0) WO42-+4H2O+6e-=W+8OH--1.01*Ge(IV)-(0) HGeO3-+2H2O+4e-=Ge+5OH--1.0Sn(IV)-(II) [Sn(OH)6]2-+2e-=HSnO2-+H2O+3OH--0.93 S(VI)-(IV) SO42-+H2O+2e-=SO32-+2OH--0.93Se(0)-(-II) Se+2e-=Se2--0.924Sn(II)-(0) HSnO2-+H2O+2e-=Sn+3OH--0.909P(0)-(-III) P+3H2O+3e-=PH3(g)+3OH--0.87N(V)-(IV) 2NO3-+2H2O+2e-=N2O4+4OH--0.85H(I)-(0) 2H2O+2e-=H2+2OH--0.8277Cd(II)-(0) Cd(OH)2+2e-=Cd(Hg)+2OH--0.809Co(II)-(0) Co(OH)2+2e-=Co+2OH--0.73Ni(II)-(0) Ni(OH)2+2e-=Ni+2OH--0.72As(V)-(III) AsO43-+2H2O+2e-=AsO2-+4OH--0.71Ag(I)-(0) Ag2S+2e-=2Ag+S2--0.691As(III)-(0) AsO2-+2H2O+3e-=As+4OH--0.68Sb(III)-(0) SbO2-+2H2O+3e-=Sb+4OH--0.66*Re(VII)-(IV) ReO4-+2H2O+3e-=ReO2+4OH--0.59*Sb(V)-(III) SbO3-+H2O+2e-=SbO2-+2OH--0.59Re(VII)-(0) ReO4-+4H2O+7e-=Re+8OH--0.584*S(IV)-(II) 2SO32-+3H2O+4e-=S2O32-+6OH--0.58Te(IV)-(0) TeO32-+3H2O+4e-=Te+6OH--0.57Fe(III)-(II) Fe(OH)3+e-=Fe(OH)2+OH--0.56S(0)-(-II) S+2e-=S2--0.47627Bi(III)-(0) Bi2O3+3H2O+6e-=2Bi+6OH--0.46N(III)-(II) NO2-+H2O+e-=NO+2OH--0.46*Co(II)-C(0) [Co(NH3)6]2++2e-=Co+6NH3 -0.422Se(IV)-(0) SeO32-+3H2O+4e-=Se+6OH--0.366Cu(I)-(0) Cu2O+H2O+2e-=2Cu+2OH--0.360Tl(I)-(0) Tl(OH)+e-=Tl+OH--0.34*Ag(I)-(0) [Ag(CN)2]-+e-=Ag+2CN--0.31Cu(II)-(0) Cu(OH)2+2e-=Cu+2OH--0.222Cr(VI)-(III) CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13 *Cu(I)-(0) [Cu(NH3)2]++e-=Cu+2NH3 -0.12O(0)-(-I) O2+H2O+2e-=HO2-+OH--0.076Ag(I)-(0) AgCN+e-=Ag+CN--0.017N(V)-(III) NO3-+H2O+2e-=NO2-+2OH- 0.01Se(VI)-(IV) SeO42-+H2O+2e-=SeO32-+2OH-0.05Pd(II)-(0) Pd(OH)2+2e-=Pd+2OH- 0.07S(II,V)-(II) S4O62-+2e-=2S2O32-0.08Hg(II)-(0) HgO+H2O+2e-=Hg+2OH-0.0977Co(III)-(II) [Co(NH3)6]3++e-=[Co(NH3)6]2+0.108Pt(II)-(0) Pt(OH)2+2e-=Pt+2OH- 0.14Co(III)-(II) Co(OH)3+e-=Co(OH)2+OH-0.17Pb(IV)-(II) PbO2+H2O+2e-=PbO+2OH- 0.247I(V)-(-I) IO3-+3H2O+6e-=I-+6OH-0.26Cl(V)-(III) ClO3-+H2O+2e-=ClO2-+2OH-0.33Ag(I)-(0) Ag2O+H2O+2e-=2Ag+2OH- 0.342Fe(III)-(II) [Fe(CN)6]3-+e-=[Fe(CN)6]4-0.358Cl(VII)-(V) ClO4-+H2O+2e-=ClO3-+2OH-0.36*Ag(I)-(0) [Ag(NH3)2]++e-=Ag+2NH3 0.373O(0)-(-II) O2+2H2O+4e-=4OH-0.401I(I)-(-I) IO-+H2O+2e-=I-+2OH-0.485*Ni(IV)-(II) NiO2+2H2O+2e-=Ni(OH)2+2OH- 0.490Mn(VII)-(VI) MnO4-+e-=MnO42-0.558Mn(VII)-(IV) MnO4-+2H2O+3e-=MnO2+4OH-0.595Mn(VI)-(IV) MnO42-+2H2O+2e-=MnO2+4OH-0.60Ag(II)-(I) 2AgO+H2O+2e-=Ag2O+2OH- 0.607Br(V)-(-I) BrO3-+3H2O+6e-=Br-+6OH- 0.61Cl(V)-(-I) ClO3-+3H2O+6e-=Cl-+6OH- 0.62Cl(III)-(I) ClO2-+H2O+2e-=ClO-+2OH- 0.66I(VII)-(V) H3IO62-+2e-=IO3-+3OH- 0.7Cl(III)-(-I) ClO2-+2H2O+4e-=Cl-+4OH- 0.76Br(I)-(-I) BrO-+H2O+2e-=Br-+2OH- 0.761Cl(I)-(-I) ClO-+H2O+2e-=Cl-+2OH- 0.841*Cl(IV)-(III) ClO2(g)+e-=ClO2-0.95O(0)-(-II) O3+H2O+2e-=O2+2OH- 1.24标准电极电势表半反应E° (V) 来源& -9Zz 9N N2(g) + H+ + e− HN3(aq) -3.09 [6]Li+ + e− Li(s) -3.0401 [5]N2(g) + 4 H2O + 2 e− 2 NH2OH(aq) + 2 OH− -3.04 [6] Cs+ + e− Cs(s) -3.026 [5]Rb+ + e− Rb(s) -2.98 [4]K+ + e− K(s) -2.931 [5]Ba2+ + 2 e− Ba(s) -2.912 [5]La(OH)3(s) + 3 e− La(s) + 3OH− -2.90 [5]Sr2+ + 2 e− Sr(s) -2.899 [5]Ca2+ + 2 e− Ca(s) -2.868 [5]Eu2+ + 2 e− Eu(s) -2.812 [5]Ra2+ + 2 e− Ra(s) -2.8 [5]Na+ + e− Na(s) -2.71 [5][9]La3+ + 3 e− La(s) -2.379 [5]Y3+ + 3 e− Y(s) -2.372 [5]Mg2+ + 2 e− Mg(s) -2.372 [5]ZrO(OH)2(s) + H2O + 4 e− Zr(s) + 4OH− -2.36 [5]Al(OH)4− + 3 e− Al(s) + 4 OH− -2.33Al(OH)3(s) + 3 e− Al(s) + 3OH− -2.31H2(g) + 2 e− 2 H− -2.25Ac3+ + 3 e− Ac(s) -2.20Be2+ + 2 e− Be(s) -1.85U3+ + 3 e− U(s) -1.66 [7]Al3+ + 3 e− Al(s) -1.66 [9]Ti2+ + 2 e− Ti(s) -1.63 [9]ZrO2(s) + 4 H+ + 4 e− Zr(s) + 2 H2O -1.553 [5]Zr4+ + 4 e− Zr(s) -1.45 [5]TiO(s) + 2 H+ + 2 e− Ti(s) + H2O -1.31Ti2O3(s) + 2 H+ + 2 e− 2 TiO(s) + H2O -1.23Ti3+ + 3 e− Ti(s) -1.21Te(s) + 2 e− Te2− -1.143 [2]V2+ + 2 e− V(s) -1.13 [2]Nb3+ + 3 e− Nb(s) -1.099Sn(s) + 4 H+ + 4 e− SnH4(g) -1.07Mn2+ + 2 e− Mn(s) -1.029 [9]SiO2(s) + 4 H+ + 4 e− Si(s) + 2 H2O -0.91B(OH)3(aq) + 3 H+ + 3 e− B(s) + 3 H2O -0.89TiO2+ + 2 H+ + 4 e− Ti(s) + H2O -0.86Bi(s) + 3 H+ + 3 e− BiH3 -0.8H2 H2O + 2 e− H2(g) + 2 OH− -0.8277 [5]Zn2+ + 2 e− Zn(Hg) -0.7628 [5]Zn2+ + 2 e− Zn(s) -0.7618 [5]Ta2O5(s) + 10 H+ + 10 e− 2 Ta(s) + 5 H2O -0.75Cr3+ + 3 e− Cr(s) -0.74Au[Au(CN)2]− + e− Au(s) + 2 CN− -0.60Ta3+ + 3 e− Ta(s) -0.6PbO(s) + H2O + 2 e− Pb(s) + 2 OH− -0.58Ti2 TiO2(s) + 2 H+ + 2 e− Ti2O3(s) + H2O -0.56Ga3+ + 3 e− Ga(s) -0.53U4+ + e− U3+ -0.52 [7]P H3PO2(aq) + H+ + e− P(白磷[10]) + 2 H2O -0.508 [5]P H3PO3(aq) + 2 H+ + 2 e− H3PO2(aq) + H2O -0.499 [5]P H3PO3(aq) + 3 H+ + 3 e− P(红磷)[10] + 3H2O -0.454 [5] Fe2+ + 2 e− Fe(s) -0.44 [9]C2 CO2(g) + 2 H+ + 2 e− HOOCCOOH(aq) -0.43Cr3+ + e− Cr2+ -0.42Cd2+ + 2 e− Cd(s) -0.40 [9]GeO2(s) + 2 H+ + 2 e− GeO(s) + H2O -0.37Cu2O(s) + H2O + 2 e− 2 Cu(s) + 2 OH− -0.360 [5]PbSO4(s) + 2 e− Pb(s) + SO42− -0.3588 [5]PbSO4(s) + 2 e− Pb(Hg) + SO42− -0.3505 [5]Eu3+ + e− Eu2+ -0.35 [7]In3+ + 3 e− In(s) 0.34 [2]Tl+ + e− Tl(s) -0.34 [2]Ge(s) + 4 H+ + 4 e− GeH4(g) -0.29Co2+ + 2 e− Co(s) -0.28 [5]P H3PO4(aq) + 2 H+ + 2 e− H3PO3(aq) + H2O -0.276 [5]V3+ + e− V2+ 0.26 [9]Ni2+ + 2 e− Ni(s) -0.25As(s) + 3 H+ + 3 e− AsH3(g) -0.23 [2]MoO2(s) + 4 H+ + 4 e− Mo(s) + 2 H2O -0.15Si(s) + 4 H+ + 4 e− SiH4(g) -0.14Sn2+ + 2 e− Sn(s) -0.13O2(g) + H+ + e−HO2•(aq) -0.13Pb2+ + 2 e− Pb(s) -0.13 [9]WO2(s) + 4 H+ + 4 e− W(s) + 2 H2O -0.12P(红磷) + 3 H+ + 3 e− PH3(g) -0.111 [5]C CO2(g) + 2 H+ + 2 e− HCOOH(aq) -0.11Se(s) + 2 H+ + 2 e− H2Se(g) -0.11C CO2(g) + 2 H+ + 2 e− CO(g) + H2O -0.11SnO(s) + 2 H+ + 2 e− Sn(s) + H2O -0.10SnO2(s) + 2 H+ + 2 e− SnO(s) + H2O -0.09WO3(aq) + 6 H+ + 6 e− W(s) + 3 H2O -0.09 [2]P(白磷) + 3 H+ + 3 e− PH3(g) -0.063 [5]C HCOOH(aq) + 2 H+ + 2 e− HCHO(aq) + H2O -0.03H 2 H+ + 2 e−H2(g) ≡ 0S4O62− + 2 e− 2 S2O32− +0.08Fe3O4(s) + 8 H+ + 8 e− 3 Fe(s) + 4 H2O +0.085 [8] N2(g) + 2 H2O + 6H+ + 6 e− 2 NH4OH(aq) +0.092 HgO(s) + H2O + 2 e− Hg(l) + 2 OH− +0.0977Cu(NH3)42+ + e− Cu(NH3)2+ + 2 NH3 +0.10 [2]Ru(NH3)63+ + e− Ru(NH3)62+ +0.10 [7]N2H4(aq) + 4 H2O + 2 e− 2 NH4+ + 4 OH− +0.11 [6] Mo H2MoO4(aq) + 6 H+ + 6 e− Mo(s) + 4 H2O +0.11 Ge4+ + 4 e− Ge(s) +0.12C(s) + 4 H+ + 4 e− CH4(g) +0.13 [2]C HCHO(aq) + 2 H+ + 2 e− CH3OH(aq) +0.13S(s) + 2 H+ + 2 e− H2S(g) +0.14Sn4+ + 2 e− Sn2+ +0.15Cu2+ + e− Cu+ +0.159 [2]S HSO4− + 3 H+ + 2 e− SO2(aq) + 2 H2O +0.16UO22+ + e− UO2+ +0.163 [7]S SO42− + 4 H+ + 2 e− SO2(aq) + 2 H2O +0.17TiO2+ + 2 H+ + e− Ti3+ + H2O +0.19Bi3+ + 2e− Bi+ +0.2SbO+ + 2 H+ + 3 e− Sb(s) + H2O +0.20As H3AsO3(aq) + 3 H+ + 3 e− As(s) + 3 H2O +0.24 GeO(s) + 2 H+ + 2 e− Ge(s) + H2O +0.26UO2+ + 4 H+ + e− U4+ + 2 H2O +0.273 [7]Re3+ + 3 e− Re(s) +0.300Bi3+ + 3 e− Bi(s) +0.32VO2+ + 2 H+ + e− V3+ + H2O +0.34Cu2+ + 2 e− Cu(s) +0.340 [2]Fe [Fe(CN)6]3− + e− [Fe(CN)6]4− +0.36O2(g) + 2 H2O + 4 e− 4 OH−(aq) +0.40 [9]Mo H2MoO4 + 6 H+ + 3 e− Mo3+ + 2 H2O +0.43Bi+ + e− Bi(s) +0.50C CH3OH(aq) + 2 H+ + 2 e− CH4(g) + H2O +0.50S SO2(aq) + 4 H+ + 4 e− S(s) + 2 H2O +0.50Cu+ + e− Cu(s) +0.520 [2]C CO(g) + 2 H+ + 2 e− C(s) + H2O +0.52I2(s) + 2 e− 2 I− +0.54 [9]I3− + 2 e− 3 I− +0.53 [9]Au [AuI4]− + 3 e− Au(s) + 4 I− +0.56As H3AsO4(aq) + 2 H+ + 2 e− H3AsO3(aq) + H2O +0.56 Au [AuI2]− + e− Au(s) + 2 I− +0.58MnO4− + 2 H2O + 3 e− MnO2(s) + 4 OH− +0.59S2O32 − + 6 H+ + 4 e− 2 S(s) + 3 H2O +0.60Mo H2MoO4(aq) + 2 H+ + 2 e− MoO2(s) + 2 H2O +0.65 O2(g) + 2 H+ + 2 e− H2O2(aq) +0.70Tl3+ + 3 e− Tl(s) +0.72PtCl62− + 2 e− PtCl42− + 2 Cl− +0.726 [7]Se H2SeO3(aq) + 4 H+ + 4 e− Se(s) + 3 H2O +0.74 PtCl42− + 2 e− Pt(s) + 4 Cl− +0.758 [7]Fe3+ + e− Fe2+ +0.77Ag+ + e− Ag(s) +0.7996 [5]Hg22+ + 2 e− 2 Hg(l) +0.80N NO3−(aq) + 2 H+ + e− NO2(g) + H2O +0.80Au [AuBr4]− + 3 e− Au(s) + 4 Br− +0.85Hg2+ + 2 e− Hg(l) +0.85MnO4− + H+ + e− HMnO4− +0.90Hg 2 Hg2+ + 2 e− Hg22+ +0.91 [2]Pd2+ + 2 e− Pd(s) +0.915 [7]Au [AuCl4]− + 3 e− Au(s) + 4 Cl− +0.93MnO2(s) + 4 H+ + e− Mn3+ + 2 H2O +0.95Au [AuBr2]− + e− Au(s) + 2 Br− +0.96Br2(l) + 2 e− 2 Br− +1.07Br2(aq) + 2 e− 2 Br− +1.09 [9]I IO3− + 5 H+ + 4 e− HIO(aq) + 2 H2O +1.13Au [AuCl2]− + e− Au(s) + 2 Cl− +1.15Se HSeO4− + 3 H+ + 2 e− H2SeO3(aq) + H2O +1.15Ag2O(s) + 2 H+ + 2 e− 2 Ag(s) + H2O +1.17ClO3− + 2 H+ + e− ClO2(g) + H2O +1.18Pt2+ + 2 e− Pt(s) +1.188 [7]ClO2(g) + H+ + e− HClO2(aq) +1.19I 2 IO3− + 12 H+ + 10 e− I2(s) + 6 H2O +1.20ClO4− + 2 H+ + 2 e− ClO3− + H2O +1.20O2(g) + 4 H+ + 4 e− 2 H2O +1.23 [9]MnO2(s) + 4 H+ + 2 e− Mn2+ + 2H2O +1.23Tl3+ + 2 e− Tl+ +1.25Cl2(g) + 2 e− 2 Cl− +1.36 [9]Cr2O7− − + 14 H+ + 6 e− 2 Cr3+ + 7 H2O +1.33CoO2(s) + 4 H+ + e− Co3+ + 2 H2O +1.42N 2 NH3OH+ + H+ + 2 e− N2H5+ + 2 H2O +1.42 [6]I 2 HIO(aq) + 2 H+ + 2 e− I2(s) + 2 H2O +1.44Ce4+ + e− Ce3+ +1.44BrO3− + 5 H+ + 4 e− HBrO(aq) + 2 H2O +1.45PbO β-PbO2(s) + 4 H+ + 2 e− Pb2+ + 2 H2O +1.460 [2] PbO α-PbO2(s) + 4 H+ + 2 e− Pb2+ + 2 H2O +1.468 [2] Br 2 BrO3− + 12 H+ + 10 e− Br2(l) + 6 H2O +1.48Cl 2ClO3− + 12 H+ + 10 e− Cl2(g) + 6 H2O +1.49MnO4− + 8 H+ + 5 e− Mn2+ + 4 H2O +1.51O HO2• + H+ + e− H2O2(aq) +1.51Au3+ + 3 e− Au(s) +1.52NiO2(s) + 4 H+ + 2 e− Ni2+ + 2 OH− +1.59Cl 2 HClO(aq) + 2 H+ + 2 e− Cl2(g) + 2 H2O +1.63Ag2O3(s) + 6 H+ + 4 e− 2 Ag+ + 3 H2O +1.67Cl HClO2(aq) + 2 H+ + 2 e− HClO(aq) + H2O +1.67Pb4+ + 2 e− Pb2+ +1.69 [2]MnO4− + 4 H+ + 3 e− MnO2(s) + 2 H2O +1.70O H2O2(aq) + 2 H+ + 2 e− 2 H2O +1.78AgO(s) + 2 H+ + e− Ag+ + H2O +1.77Co3+ + e− Co2+ +1.82Au+ + e− Au(s) +1.83 [2]BrO4− + 2 H+ + 2 e− BrO3− + H2O +1.85Ag2+ + e− Ag+ +1.98 [2]S2O82− + 2 e− 2 SO42− +2.07O3(g) + 2 H+ + 2 e− O2(g) + H2O +2.075 [7]Mn HMnO4− + 3 H+ + 2 e− MnO2(s) + 2 H2O +2.09F2(g) + 2 e− 2 F− +2.87 [2][9]F2(g) + 2 H+ + 2 e− 2 HF(aq) +3.05 [2]电极电势一,电极电势(electrode potential)的产生—双电层理论德国化学家能斯特(H. Nernst) W.提出了双电层理论(electron double layer theory)解释电极电势的产生的原因.当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液.金属性质愈活泼,这种趋势就愈大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度愈大,这种趋势也愈大.在一定浓度的溶液中达到平衡后, 在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8 厘米数量级), 但却在金属和溶液之间产生了电势差.通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential), 并以此描述电极得失电子能力的相对强弱.电极电势以符号E Mn+/ M 表示, 单位为V(伏).如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示.电极电势的大小主要取决于电极的本性,并受温度,介质和离子浓度等因素的影响. 2.标准电极电势为了获得各种电极的电极电势数值, 通常以某种电极的电极电势作标准与其它各待测电极组成电池,通过测定电池的电动势, 而确定各种不同电极的相对电极电势 E 值.1953 年国际纯粹化学与应用化学联合会(IUPAC)的建议,采用标准氢电极作为标准电极,并人为地规定标准氢电极的电极电势为零.(1)标准氢电极电极符号: Pt|H2(101.3kPa)|H+(1mol.L-1) 电极反应: 2H+ + 2e = H2(g) EH+/ H2 = 0 V 右上角的符号""代表标准态.标准态要求电极处于标准压力(100kPa 或1bar)下,组成电极的固体或液体物质都是纯净物质;气体物质其分压为100kPa;组成电对的有关离子(包括参与反应的介质)的浓度为1mol.L-1(严格的概念是活度).通常测定的温度为298K.(2) 标准电极电势:用标准氢电极和待测电极在标准状态下组成电池,测得该电池的电动势值,并通过直流电压表确定电池的正负极,即可根据 E 池= E (+)- E(-)计算各种电极的标准电极电势的相对数值.例如在298k,用电位计测得标准氢电极和标准Zn 电极所组成的原电池的电动势(E 池)为0.76v,根据上式计算Zn2+/Zn 电对的标准电极为-0.76v.用同样的办法可测得Cu2+/Cu 电对的电极电势为+0.34v.电极的E为正值表示组成电极的氧化型物质,得电子的倾向大于标准氢电极中的H+,如铜电极中的Cu2+;如电极的为负值,则组成电极的氧化型物质得电子的倾向小于标准氢电极中的H+,如锌电极中的Zn2+.实际应用中,常选用一些电极电势较稳定电极如饱和甘汞电极和银-氯化银电极作为参比电极和其它待测电极构成电池,求得其它电极的电势.饱和甘汞电极的电极电势为0.24V.银-氯化银电极的电极电势为0.22V.3.标准电极电势表将不同氧化还原电对的标准电极电势数值按照由小到大的顺序排列, 得到电极反应的标准电极电势表.其特点有: (l)一般采用电极反应的还原电势,每一电极的电极反应均写成还原反应形式,即:氧化型+ ne = 还原型; (2)标准电极电势是平衡电势,每个电对E值的正负号,不随电极反应进行的方向而改变.(3)E值的大小可用以判断在标准状态下电对中氧化型物质的氧化能力和还原型物质的还原能力的相对强弱,而与参与电极反应物质的数量无关.例如: I2+2e =2I- E= +0.5355V 1/2 I2+e = I- E= +0.5355V (4)E值仅适合于标态时的水溶液时的电极反应.对于非水,高温,固相反应,则有一定局限性.而对于非标态的反应可用Nernst 方程转化.二,电极电势的应用(一),判断氧化剂和还原剂的相对强弱在标准状态下氧化剂和还原剂的相对强弱,可直接比较E值的大小.E值越小(例如Li:-3.03v)的电极其还原型物质愈易失去电子,是愈强的还原剂,对应的氧化型物质则愈难得到电子,是愈弱的氧化剂.E值愈大的电极其氧化型物质愈易得到电子,是较强的氧化剂,对应的还原型物质则愈难失去电子,是愈弱的还原剂. [例1] 在下列电对中选择出最强的氧化剂和最强的还原剂.并指出各氧化态物种的氧化能力和各还原态物种的还原能力强弱顺序. MnO4-/Mn2+,Cu2+/Cu,Fe3+ /Fe2+,I2/I-,Cl2/Cl-,Sn4+/Sn2+ (二),判断氧化还原反应的方向1.根据E值,判断标准状况下氧化还原反应进行的方向.通常条件下, 氧化还原反应总是由较强的氧化剂与还原剂向着生成较弱的氧化剂和还原剂方向进行.从电极电势的数值来看,当氧化剂电对的电势大于还原剂电对的电势时,反应才可以进行.反应以"高电势的氧化型氧化低电势的还原型"的方向进行.在判断氧化还原反应能否自发进行时,通常指的是正向反应.2.根据电池电动势E池值,判断氧化还原反应进行方向.任何一个氧化还原反应,原则上都可以设计成原电池.利用原电池的电动势可以判断氧化还原反应进行的方向.由氧化还原反应组成的原电池,在标准状态下,如果电池的标准电动势>0, 则电池反应能自发进行;如果电池的标准电动势<0, 则电池反应不能自发进行.在非标准状态下,则用该状态下的电动势来判断.从原电池的电动势与电极电势之间的关系来看,只有> 时,氧化还原反应才能自发地向正反应方向进行.也就是说,氧化剂所在电对的电极电势必须大于还原剂所在电对的电极电势,才能满足 E >0 的条件.从热力学讲电池电动势是电池反应进行的推动力.当由氧化还原反应构成的电池的电动势E池大于零时,则此氧化还原反应就能自发进行.因此,电池电动势也是判断氧化还原反应能否进行的判据.电池通过氧化还原反应产生电能,体系的自由能降低.在恒温恒压下,自由能的降低值(-△G)等于电池可能作出的最大有用电功(W 电): -△G=W 电=QE=nFE 池即△G=-nFE 池在标准状态下,上式可写成: △G = -nFE池当E 池为正值时, △G为负值, 在标准状态下氧化还原反应正向自发进行; 当E池为负值时,△G为正值,在标准状态下反应正向非自发进行,逆向反应自发进行.E 或E愈是较大的正值,氧化还原反应正向自发进行的倾向愈大.E 池或E池愈是较大的负值,逆向反应自发进行的倾向愈大. [例2] 试判断反应Br + 2Fe 2Fe +2Br 在标准状态下进行的方向.解:查表知:Fe + e Fe = +0.77V Br + 2e 2Br = +1.07V 由反应式可知:Br 是氧化剂,Fe 是还原剂.故上述电池反应的= +1.07-0.77=0.29V>0 (三).判断反应进行的限度——计算平衡常数一个化学反应的完成程度可从该反应的平衡常数大小定量地判断.因此,把标准平衡常数Kφ 和热力学吉布斯自由能联系起来.△Gφ=-2.303RTlgKφ △Gφ=-nFEφ 则: -nFEφ = 2.303RTlgKφ 标准平衡常数Kφ 和标准电动势Eφ 之间的关系式为: -nFEφ lgKφ = ————————2.303RT R 为气体常数,T 为绝对温度,n 为氧化还原反应方程中电子转移数目,F 为法拉第常数.该式表明, 在一定温度下, 氧化还原反应的平衡常数与标准电池电动势有关, 与反应物的浓度无关.Eφ 越大,平衡常数就越大,反应进行越完全.因此,可以用Eφ 值的大小来估计反应进行的程度.一般说,Eφ≥0.2~0.4V的氧化还原反应,其平衡常数均大于106( K>106 ),表明反应进行的程度已相当完全了.Kφ 值大小可以说明反应进行的程度,但不能决定反应速率.三,影响电极电势的因素影响电极电势的因素是离子的浓度,溶液的酸碱性,沉淀剂和络合剂,判断的因素是能斯特方程.能斯特方程式:标准电极电势是在标准状态下测定的.如果条件改变,则电对的电极电势也随之发生改变.电极电势的大小,首先取决于电极的本性,它是通过标准电极电势来体现的.其次,溶液中离子的浓度(或气体的分压),温度等的改变都会引起电极电势的变化.它们之间的定量关系可由能斯特方程式来表示; 四,元素电势图及其应用大多数非金属元素和过渡元素可以存在几种氧化值, 各氧化值之间都有相应的标准电极电势.可将其各种氧化值按高到低(或低到高)的顺序排列,在两种氧化值之间用直线连接起来并在直线上标明相应电极反应的标准电极电势值, 以这样的图形表示某一元素各种氧化值之间电极电势变化的关系图称为元素电势图,因是拉特默(Latimer)首创,故又称为拉特默图.根据溶液pH 值的不同, 又可以分为两大类: (A表示酸性溶液)表示溶液的pH=0; (B 表示碱性溶液)表示溶液的pH=14.书写某一元素的电势图时,既可以将全部氧化值列出, 也可以根据需要列出其中的一部分.〖例如氯的元素电势图〗.在元素电位图的最右端是还原型物质,如Cl ,最左端是氧化型物质,如ClO .中间的物质,相对于右端的物质是氧化型,相对于左端的物质是还原型, 例如Cl 相对于Cl 是氧化型,相对于ClO 是还原型.元素电势图在主要应用: 1.判断歧化反应是否能进行所谓歧化反应,就是在同一个元素中,一部分原子(或离子)被氧化,另一部分原子(或离子)被还原的反应.若在下列元素电势图中Eφ 左Eφ 右A—— B ——C 若Eφ 右>Eφ 左,其中间价态B 可自发地发生岐化反应,生成A和C.Eφ 且池越大, 标准电极电势是氧化还原反应很好的定量标度, 标准电极电势表是判断氧化还原反应方向、氧化剂还原剂的强弱, 以及书写氧化还原反应方程式的重要依据。
第10章 氧化还原及滴定习题解答

第10章氧化还原滴定习题一、判断题1、用碘量法测定二氧化锰时应选用直接碘量法。
2、对氧化还原反应来说,只要满足电势差大于等于0.35V的条件,该反应就能用于滴定分析。
3、因为氧化还原反应速度较慢,所以在氧化还原滴定中都需要加热和加催化剂。
4、标定碘液可用Na2S2O3作基准物质。
5、配制好的Na2S2O3溶液不能马上标定,是因为Na2S2O3还原性太强。
6、Fe2+样品液只能用KMnO4法测定。
7、间接碘量法不能在强酸性溶液中滴定的原因之一是Na2S2O3易分解。
8、碘量法所用的指示剂是KI的淀粉液。
9、直接碘量法间接碘量法所用的指示剂相同,终点颜色也相同。
10、KMnO4法需要在酸性条件下测定样品,是为了增强KMnO4的氧化性。
11、用碘量法测定铜盐样品时,采用的是剩余滴定法。
12、氧化还原滴定的突跃中点与化学计量点是一致的。
13、亚硝酸钠法可用于测定具有氧化性物质的含量。
14、Na2S2O3滴定液应需要前临时配制及时滴定。
15、亚硫酸钠法中,采用快速滴定法的目的是为了减小NaNO2的逸失和分解。
16、氧化还原滴定选择氧化还原指示剂的依据是电势差在突跃范围内。
17、已知 MX 是难溶盐,可推知 E( M2+ / MX ) < E( M2+ / M+ ) 。
18、在实验室中MnO2 (s) 仅与浓HCl 加热才能反应制取氯气,这是因为浓HCl仅使E ( MnO2 / Mn2+ ) 增大。
()19、E( Cl2 / Cl- ) < E( Cl2 / AgCl ) 。
..............................()20、以原电池的E来计算相应氧化还原反应的标准平衡常数,由此可以推论出,氧化还原反应的K是各物种浓度为1.0 mol·L-1 或p = p时的反应商。
()21、理论上所有氧化还原反应都能借助一定装置组成原电池;相应的电池反应也必定是氧化还原反应。
()22、已知K( AgCl ) =1.8 ⨯10-10,当c (Ag+ ) = 1.8 ⨯10-1 0 mol·L-1 时,E (Ag+ /Ag ) = E(AgCl / Ag ) 。
电解池电势高低的判断方法

电解池电势高低的判断方法电化学反应是现代化学研究的重要组成部分,电解池是电化学反应的基本装置。
电解池的电势是电解池内电化学反应的驱动力,是反应进行的重要指标。
因此,准确判断电解池的电势高低对于电化学反应研究和应用具有重要意义。
一、电解池电势的定义电解池电势是指在标准状态下,电解池中还原半反应的标准电势与氧化半反应的标准电势之差,即电化学电位差。
标准状态是指温度为298K(25℃),压强为1 atm,溶液浓度为1 mol/L,纯物质的状态。
电解池电势的单位是伏特(V)。
二、电解池电势高低的判断方法1. 比较标准电极电势标准电极电势是指电极在标准状态下,相对于标准氢电极的电势。
标准氢电极的标准电势定义为0伏特。
比较两个电解池的标准电极电势可以判断它们的电势高低。
若电解池A的标准电极电势高于电解池B的标准电极电势,则电解池A的电势高于电解池B。
2. 利用电解池电势公式计算根据电解池电势公式,可以通过计算电解池中还原半反应的标准电势与氧化半反应的标准电势之差来计算电解池电势。
若计算出的电势值为正数,则表示电解池的电势高;若计算出的电势值为负数,则表示电解池的电势低。
3. 利用电解池电势的性质电解池电势还具有一些性质,如温度、浓度、压强等对电势的影响。
在一定条件下,电解池电势的变化规律是可以预测的。
通过对电解池电势的性质进行分析,也可以判断电解池的电势高低。
三、电解池电势高低的应用电解池电势高低的判断方法可以用于电化学反应的研究与应用中。
例如,在电镀、电解制氧、电解制氢等工业生产中,需要选择电解池电势高的电解池进行反应,以提高反应效率和减少能量消耗。
在电池制造中,选择电解池电势高的电极材料可以提高电池的电压和电能储存能力。
此外,电解池电势的研究还可以应用于环境治理、生物化学等领域。
四、结论电解池电势是电化学反应的重要指标,判断电解池电势高低的方法有多种。
通过比较标准电极电势、利用电解池电势公式计算、利用电解池电势的性质等方法可以准确判断电解池的电势高低。
一些半反应的标准电极电势

一些半反应的标准电极电势附表5 一些半反应的标准电极电势(298.15K)1. 在酸性溶液中电极反应Ag2+(aq) + e- ═ Ag+(aq)AgBr(s) + e- ═ Ag(s) + Br- (aq)AgCl(s) + e- ═ Ag(s) + Cl- (aq)AgI(s) + e- ═ Ag(s) + I- (aq)Ag--2CrO4(aq) + 2e ═ 2Ag(s) + CrO24 (aq) *Al Al3+(aq) + 3e-═ Al(s)As HAsO-2(aq) + 3H+(aq) + 3e ═ As(s) + 2H2O(l)H3AsO4(aq) + 2H+(aq) + 2e- ═ HAsO2(aq) + 2H2O(l) * Au Au3+(aq) + 3e- ═ Au(s)Au3+(aq) + 2e- ═ Au+(aq)AuCl-4 (aq) + 3e- ═ Au(s) + 4Cl -(aq)Ba Ba2+(aq) + 2e- ═ Ba(s)Br Br2(l) + 2e- ═ 2Br -(aq)2BrO3- (aq) + 12H+(aq) + 10e- ═ Br2(l) + 6H2O(l)C 2CO2(g) + 2H+(aq) + 2e- ═ H2C2O4(aq)Ca Ca2+(aq) + 2e- ═ Ca(s)Cd Cd2+(aq) + 2e- ═ Cd(s)Cl Cl2(g) + 2e- ═ 2Cl -(aq)ClO3- (aq) + 6H+(aq) + 6e- ═ Cl -(aq) + 3H2O(l)2ClO3- (aq) + 12H+(aq) + 10e- ═ Cl2(g) + 6H2O(l) *ClO-4(aq) + 2H+(aq) + 2e- ═ ClO3- (aq) + H2O(l)2HClO(aq) + 2H+(aq) + 2e- ═ Cl2(g) + 2H2O(l) *Co Co2+(aq) + 2e- ═ Co(s)Co3+(aq) + e- ═ Co2+(aq) *Cr Cr2+(aq) + 2e- ═ Cr(s)Cr3+(aq) + e- ═ Cr2+(aq)Cr2O2-7(aq) + 14H+(aq) + 6e- ═ 2Cr3+(aq) + 7H2O(l)Cs Cs+(aq) + e- ═ Cs(s)Cu Cu+(aq) + e- ═ Cu(s)Cu2+(aq) + e- ═ Cu+(aq)Cu2+(aq) + 2e- ═ Cu(s)Cu2+(aq) + I -(aq) + e- ═ C uI(s)1.98 0.071 0.222 -0.152 0.447 -1.676 0.240 0.560 1.52 1.36 1.002 -2.92 1.065 1.478 -0.49 -2.84 -0.403 1.358 1.450 1.47 1.189 1.611 -0.277 1.92 -0.90 -0.424 1.33 -2.923 0.52 0.159 0.34 0.86F F2(g) + 2e- ═ 2F -(aq)OF2 (g) + 2H+(aq) + 4e- ═ H2O(l) + 2F -(aq)Fe Fe2+(aq) + 2e- ═ Fe(s)Fe3+(aq) + e- ═ Fe2+(aq)Fe(CN)3- 6(aq) + e- ═ Fe(CN)4- 6(aq)H 2H+(aq) + 2e- ═ H2(g)Hg Hg2+(aq) + 2e- ═ Hg(l)Hg2+2(aq) + 2e- ═ 2Hg(l) *2Hg2+(aq)+ 2e- ═ Hg2+2(aq) *2HgCl2(aq) + 2e- ═ Hg2Cl2(s) + 2Cl -(aq)Hg2Cl2(s) + 2e- ═ 2Hg(l) + 2Cl -(aq)I I2(s) + 2e- ═ 2I -(aq)I3- (aq) + 2e- ═ 3I -(aq)2IO3- (aq) + 12H+(aq) + 10e- ═ I2(s) + 6H2O(l)In In3+(aq) + 3e- ═ In(s)K K+(aq) + e- ═ K(s)La La3+(aq) + 3e- ═ La(s)Li Li+(aq) + e- ═ Li(s)Mg Mg2+(aq) + 2e- ═ Mg(s)Mn Mn2+(aq) + 2e- ═ Mn(s)MnO2(s) + 4H+(aq) + 2e- ═ Mn2+(aq) + 2H2O(l)MnO- 4(aq) + 8H+(aq) + 5e- ═ Mn2+(aq) + 4H2O(l)MnO4- (aq) + 4H+(aq) + 3e- ═ MnO2(s) + 2H2O(l)MnO4- (aq) + e- ═ MnO2-4 (aq)N NO3- (aq) + 4H+(aq) + 3e- ═ NO(g) + 2H2O(l) NO3- (aq) + 3H+(aq) + 2e- ═ HNO2(aq) + H2O(l) *2NO3- (aq) + 4H+(aq) + 2e- ═ N2O4(aq) + 2H2O(l) *Na Na+(aq) + e- ═ Na(s)Ni Ni2+(aq) + 2e- ═ Ni(s)O O2(g) + 2H+(aq) + 2e- ═ H2O2(aq)O2(g) + 4H+(aq) + 4e- ═ 2H2O(l)O3(g) + 2H+(aq) + 2e- ═ O2(g) + H2O(l)H2O2(aq) + 2H+(aq) + 2e- ═ 2H2O(l)P H3PO4(aq) + 2H+(aq) + 2e- ═ H3PO3(aq) + H2O(l)Pb Pb2+(aq) + 2e- ═ Pb(s)PbO2(s)+SO2-4(aq)+4H+(aq)+2e- ═ PbSO4(s)+2H2O(l)PbO2(s) + 4H+(aq) + 2e- ═ Pb2+(aq) + 2H2O(l)2.866 2.1 -0.44 0.771 0.361 0.000 0.854 0.7973 0.920 0.63 0.2676 0.5350.536 1.20 -0.338 -2.924 -2.38 -3.04 -2.356 -1.18 1.23 1.51 1.70 0.56 0.956 0.934 0.803 -2.713 -0.257 0.695 1.229 2.075 1.763 -0.276 -0.125 1.69 1.455RbSSnSrTiUVZn 44Rb+(aq) + e- ═ Rb(s) S(s) + 2H+(aq) + 2e- ═ H2S(g) H2SO3(aq) +4H+(aq) + 4e- ═ S(s) + 3H2O(l) * +-SO2-4 (a q) + 4H(aq) + 2e ═ SO2(g) +2H2O(l) +-SO2-4 (aq) + 4H(aq) + 2e ═ H2SO3(aq) + H2O(l) * -2-S2O2-8(aq) + 2e ═ 2SO4(aq) +-- S2O2-8(aq) + 2H(aq)+ 2e ═ 2HSO4(aq) * -2.924 0.144 0.449 0.17 0.172 2.01 2.123 -0.137 0.154 -2.89 -1.630 -1.66 1.00 0.337 -0.763 Sn2+(aq) + 2e- ═ Sn(s) Sn4+(aq) + 2e- ═ Sn2+(aq) Sr2+(aq) + 2e- ═ Sr(s) Ti2+(aq) + 2e- ═ Ti(s) U3+(aq) + 3e- ═ U(s) +VO2(aq) + 2H+(aq) + e- ═ VO2+(aq) + H2O(l) VO2+(aq) + 2H+(aq) + e- ═ V3+(aq) + H2O(l) Zn2+(aq) + 2e- ═ Zn(s)2. 在碱性溶液中AgAlAsBrCaClCr电极反应 2AgO(s) + H2O(l) + 2e- ═ Ag2O(s) + 2OH -(aq) Ag2O(s) + H2O(l) + 2e- ═ 2Ag(s) + 2OH -(aq) Al(OH)4- (aq) + 3e- ═ Al(s) + 4OH -(aq) -H2AlO3(aq) + H2O(l) + 3e- ═ Al(s) + 4OH -(aq) * E /V 0.604 0.342 -2.31 -2.33-1.21 -0.68 -0.67 0.766 0.584 -3.02 0.890 0.622 0.33 0.36 -1.48 As(s) + 3H2O(l) + 3e- ═ AsH3(g) + 3OH -(aq) - AsO2(aq) + 2H2O(l) + 3e- ═ As(s) + 4OH -(aq) -- -AsO3- 4(aq) + 2H2O(l) + 2e ═ AsO2(aq) + 4OH (aq) BrO-(aq) + H2O(l) + 2e-═ Br - (aq) + 2OH -(aq) - BrO3(aq) + 3H2O(l) + 6e- ═ Br - (aq) + 6OH -(aq)Ca(OH)2(s) + 2e- ═ Ca(s) + 2OH -(aq) ClO - (aq) + H2O(l) + 2e- ═ Cl - (aq) + 2OH -(aq) - ClO3(aq) + 3H2O(l) + 6e- ═ Cl -(aq) + 6OH -(aq) - - ClO3(aq) +H2O(l) + 2e- ═ ClO2(aq) + 2OH -(aq) * - ClO4-(aq) + H2O(l) + 2e- ═ ClO3(aq)+ 2OH -(aq) * Cr(OH)3(s) + 3e- ═ Cr(s) + 3OH -(aq) *CuFeHHgIMgMnNOPbSSbZn 423-0.360 -0.8914 -0.56 -0.8277 0.0977 0.485 0.42 0.26 -2.69 -1.560.595 0.60 0.01 0.401 1.246 -0.54 -0.455 -0.93 -0.571 -0.66 -1.246 Cu2O(s) +H2O(l) + 2e- ═ 2Cu(s) + 2OH -(aq) * Fe(OH)2(s) + 2e- ═ Fe(s) + 2OH - (aq)Fe(OH)3(s) + e- ═ Fe(OH)2(s) + OH -(aq) * 2H2O(l) + 2e- ═ H2(g) + 2OH -(aq) HgO(s) + H2O(l) + 2e- ═ Hg(s) + 2OH -(aq) * IO-(aq) + H2O(l) + 2e- ═ I-(aq)+ 2OH -(aq) * 2IO-(aq) + 2H2O(l) + 2e- ═ I2(s) + 4OH -(aq) - IO3(aq) + 3H2O(l) + 6e- ═ I-(aq) + 6OH -(aq) * Mg(OH)2(s) + 2e- ═ Mg(s) + 2OH -(aq) *Mn(OH)2(s) + 2e- ═ Mn(s) + 2OH -(aq) * -MnO4(aq) + 2H2O(l) + 3e- ═ MnO2(s) + 4OH -(aq) --MnO2-4 (aq) + 2H2O(l) + 2e ═ MnO2(s) + 4OH (aq) * - - NO3(aq) +H2O(l) + 2e- ═ NO2(aq) + 2OH -(aq) O2(g) + 2H2O(l) + 4e- ═ 4OH -(aq) O3(g) + H2O(l) + 2e- ═ O2(g) + 2OH -(aq) - HPbO2(aq) + H2O(l) + 2e- ═ Pb(s) + 3OH -(aq) S(s) + 2e- ═ S2-(aq) * -2--SO2-4 (aq) + H2O(l) + 2e ═ SO3(aq) + 2OH (aq) * -2--2SO2-3(aq) + 3H2O(l) + 4e ═ S2O3(aq) + 6OH (aq) * - SbO2(aq) + 2H2O(l)+ 3e- ═ Sb(s) + 4OH -(aq) * Zn(OH)2(s) + 2e- ═ Zn(s) + 2OH -(aq)数据摘自Petrucci, R. H., Harwood, W. S., Herring, F. G. general Chemistry: Principles and Modern Applications. 8 ed. 2002.* 数据摘自 CRC Handbook of Chemistry and Physics, 82 ed. 2001~2002.氢 2.1 锂 0.98 铍 1.57 硼 2.04 碳 2.55 氮 3.04 氧 3.44 氟 3.98钠 0.93 镁 1.31 铝 1.61 硅 1.90 磷 2.19 硫 2.58 氯 3.16钾 0.82 钙 1.00 锰 1.55 铁 1.83 镍 1.91 铜 1.9 锌 1.65 镓 1.81 锗 2.01 砷2.18 硒2.48 溴 2.96铷 0.82 锶 0.95 银 1.93 碘 2.66 钡 0.89 金 2.54 铅 2.33一般来说,电负性大于1.8的是非金属元素,而小于等于1.8的往往是金属元素(当然,其中也存在例外)rmmGHImLXQ8w。
cl2标准电极电势

cl2标准电极电势The standard electrode potential of Cl2, which refers to the electrode potential of a half-cell in which Cl2 gas is reduced to two chloride ions, is an essential concept in electrochemistry. It is a measure of the tendency of Cl2 gas to gain electrons and form chloride ions in a redox reaction. This standard electrode potential is typically measured against a standard hydrogen electrode, which is assigned a value of V.Cl2的标准电极电势是电化学中一个重要的概念,它是半电池中Cl2气体被还原成两个氯离子的电极电势的度量。
这个标准电极电势通常是相对于标准氢气电极来测量的,标准氢气电极的赋值为 V。
The standard electrode potential of Cl2 can be defined by the following half-reaction: Cl2(g) + 2e- → 2Cl-. This reaction shows the reduction of chlorine gas to form chloride ions by gaining two electrons. The standard electrode potential for this reaction is given a specific value depending on the conditions under which it is measured, such as temperature and concentration of the reactants.Cl2的标准电极电势可以通过下列半反应来定义:Cl2(g) + 2e- → 2Cl-。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附表5 一些半反应的标准电极电势(298.15K)1. 在酸性溶液中电极反应E/VAg2+(aq) + e-═Ag+(aq) 1.98AgBr(s) + e-═Ag(s) + Br- (aq) 0.071AgCl(s) + e-═Ag(s) + Cl- (aq) 0.222AgI(s) + e-═Ag(s) + I-(aq) -0.152Ag2CrO4(aq) + 2e-═2Ag(s) + CrO42- (aq) * 0.447 Al Al3+(aq) + 3e-═Al(s) -1.676 As HAsO2(aq) + 3H+(aq) + 3e-═As(s) + 2H2O(l) 0.240 H3AsO4(aq) + 2H+(aq) + 2e-═HAsO2(aq) + 2H2O(l) *0.560 Au Au3+(aq) + 3e-═Au(s) 1.52 Au3+(aq) + 2e-═Au+(aq) 1.36AuCl4- (aq) + 3e-═Au(s) + 4Cl -(aq) 1.002 Ba Ba2+(aq) + 2e-═Ba(s) -2.92 Br Br2(l) + 2e-═2Br -(aq) 1.065 2BrO3- (aq) + 12H+(aq) + 10e-═Br2(l) + 6H2O(l) 1.478C 2CO2(g) + 2H+(aq) + 2e-═H2C2O4(aq) -0.49Ca Ca2+(aq) + 2e-═Ca(s) -2.84 Cd Cd2+(aq) + 2e-═Cd(s) -0.403 Cl Cl2(g) + 2e-═2Cl -(aq) 1.358 ClO3- (aq) + 6H+(aq) + 6e-═Cl -(aq) + 3H2O(l) 1.4502ClO3- (aq) + 12H+(aq) + 10e-═Cl2(g) + 6H2O(l) * 1.47ClO4-(aq) + 2H+(aq) + 2e-═ClO3- (aq) + H2O(l) 1.1892HClO(aq) + 2H+(aq) + 2e-═Cl2(g) + 2H2O(l) * 1.611 Co Co2+(aq) + 2e-═Co(s) -0.277 Co3+(aq) + e-═Co2+(aq) * 1.92 Cr Cr2+(aq) + 2e-═Cr(s) -0.90 Cr3+(aq) + e-═Cr2+(aq) -0.424Cr2O72-(aq) + 14H+(aq) + 6e-═2Cr3+(aq) + 7H2O(l) 1.33 Cs Cs+(aq) + e-═Cs(s) -2.923 Cu Cu+(aq) + e-═Cu(s) 0.52 Cu2+(aq) + e-═Cu+(aq) 0.159Cu2+(aq) + 2e-═Cu(s) 0.34Cu2+(aq) + I -(aq) + e-═CuI(s) 0.86F F2(g) + 2e-═2F -(aq) 2.866OF2 (g) + 2H+(aq) + 4e-═H2O(l) + 2F -(aq) 2.1 Fe Fe2+(aq) + 2e-═Fe(s) -0.44 Fe3+(aq) + e-═Fe2+(aq) 0.771Fe(CN)63- (aq) + e-═Fe(CN)64- (aq) 0.361 H 2H+(aq) + 2e-═H2(g) 0.000 Hg Hg2+(aq) + 2e-═Hg(l) 0.854 Hg22+(aq) + 2e-═2Hg(l) * 0.79732Hg2+(aq)+ 2e-═Hg22+(aq) * 0.9202HgCl2(aq) + 2e-═Hg2Cl2(s) + 2Cl -(aq) 0.63Hg2Cl2(s) + 2e-═2Hg(l) + 2Cl -(aq) 0.2676 I I2(s) + 2e-═2I -(aq) 0.535I3- (aq) + 2e-═3I -(aq) 0.5362IO3- (aq) + 12H+(aq) + 10e-═I2(s) + 6H2O(l) 1.20 In In3+(aq) + 3e-═In(s) -0.338 K K+(aq) + e-═K(s) -2.924 La La3+(aq) + 3e-═La(s) -2.38 Li Li+(aq) + e-═Li(s) -3.04 Mg Mg2+(aq) + 2e-═Mg(s) -2.356 Mn Mn2+(aq) + 2e-═Mn(s) -1.18 MnO2(s) + 4H+(aq) + 2e-═Mn2+(aq) + 2H2O(l) 1.23MnO4- (aq) + 8H+(aq) + 5e-═Mn2+(aq) + 4H2O(l) 1.51MnO4- (aq) + 4H+(aq) + 3e-═MnO2(s) + 2H2O(l) 1.70MnO4- (aq) + e-═MnO42-(aq) 0.56 N NO3- (aq) + 4H+(aq) + 3e-═NO(g) + 2H2O(l) 0.956 NO3- (aq) + 3H+(aq) + 2e-═HNO2(aq) + H2O(l) * 0.9342NO3- (aq) + 4H+(aq) + 2e-═N2O4(aq) + 2H2O(l) * 0.803 Na Na+(aq) + e-═Na(s) -2.713 Ni Ni2+(aq) + 2e-═Ni(s) -0.257 O O2(g) + 2H+(aq) + 2e-═H2O2(aq) 0.695 O2(g) + 4H+(aq) + 4e-═2H2O(l) 1.229O3(g) + 2H+(aq) + 2e-═O2(g) + H2O(l) 2.075H2O2(aq) + 2H+(aq) + 2e-═2H2O(l) 1.763 P H3PO4(aq) + 2H+(aq) + 2e-═H3PO3(aq) + H2O(l) -0.276 Pb Pb2+(aq) + 2e-═Pb(s) -0.125 PbO2(s)+SO42-(aq)+4H+(aq)+2e- ═PbSO4(s)+2H2O(l) 1.69PbO2(s) + 4H+(aq) + 2e-═Pb2+(aq) + 2H2O(l) 1.455PbSO4(s) + 2e-═Pb(s) + SO42- (aq) -0.356 Rb Rb+(aq) + e-═Rb(s) -2.924 S S(s) + 2H+(aq) + 2e-═H2S(g) 0.144 H2SO3(aq) + 4H+(aq) + 4e-═S(s) + 3H2O(l) * 0.449SO42- (aq) + 4H+(aq) + 2e-═SO2(g) + 2H2O(l) 0.17SO42- (aq) + 4H+(aq) + 2e-═H2SO3(aq) + H2O(l) * 0.172S2O82-(aq) + 2e-═2SO42-(aq) 2.01S2O82-(aq) + 2H+(aq)+ 2e-═2HSO4- (aq) * 2.123 Sn Sn2+(aq) + 2e-═Sn(s) -0.137 Sn4+(aq) + 2e-═Sn2+(aq) 0.154 Sr Sr2+(aq) + 2e-═Sr(s) -2.89 Ti Ti2+(aq) + 2e-═Ti(s) -1.630 U U3+(aq) + 3e-═U(s) -1.66 V VO2+(aq) + 2H+(aq) + e-═VO2+(aq) + H2O(l) 1.00 VO2+(aq) + 2H+(aq) + e-═V3+(aq) + H2O(l) 0.337 Zn Zn2+(aq) + 2e-═Zn(s) -0.7632.在碱性溶液中电极反应E/V Ag 2AgO(s) + H2O(l) + 2e-═Ag2O(s) + 2OH -(aq) 0.604 Ag2O(s) + H2O(l) + 2e-═2Ag(s) + 2OH -(aq) 0.342 Al Al(OH)4- (aq) + 3e-═Al(s) + 4OH -(aq) -2.31 H2AlO3- (aq)+ H2O(l) + 3e-═Al(s) + 4OH -(aq) *-2.33 As As(s) + 3H2O(l) + 3e-═AsH3(g) + 3OH -(aq) -1.21 AsO2- (aq) + 2H2O(l) + 3e-═As(s) + 4OH -(aq) -0.68AsO43- (aq) + 2H2O(l) + 2e-═AsO2- (aq) + 4OH -(aq) -0.67 Br BrO-(aq) + H2O(l) + 2e-═Br - (aq) + 2OH -(aq) 0.766 BrO3- (aq) + 3H2O(l) + 6e-═Br - (aq) + 6OH -(aq) 0.584 Ca Ca(OH)2(s) + 2e-═Ca(s) + 2OH -(aq) -3.02 Cl ClO - (aq) + H2O(l) + 2e-═Cl - (aq) + 2OH -(aq) 0.890 ClO3- (aq) + 3H2O(l) + 6e-═Cl -(aq) + 6OH -(aq) 0.622ClO3- (aq) + H2O(l) + 2e-═ClO2- (aq) + 2OH -(aq) *0.33ClO4-(aq) + H2O(l) + 2e-═ClO3- (aq) + 2OH -(aq) *0.36 Cr Cr(OH)3(s) + 3e-═Cr(s) + 3OH -(aq) *-1.48CrO42- (aq) + 4H2O(l) + 3e-═Cr(OH)3 + 5OH -(aq) * -0.13 Cu Cu2O(s) + H2O(l) + 2e-═2Cu(s) + 2OH -(aq) *-0.360Fe Fe(OH)2(s) + 2e-═Fe(s) + 2OH - (aq) -0.8914Fe(OH)3(s) + e-═Fe(OH)2(s) + OH -(aq) *-0.56H 2H2O(l) + 2e-═H2(g) + 2OH -(aq) -0.8277Hg HgO(s) + H2O(l) + 2e-═Hg(s) + 2OH -(aq) *0.0977I IO-(aq) + H2O(l) + 2e-═I-(aq) + 2OH -(aq) *0.4852IO-(aq) + 2H2O(l) + 2e-═I2(s) + 4OH -(aq) 0.42IO3- (aq) + 3H2O(l) + 6e-═I-(aq) + 6OH -(aq) *0.26 Mg Mg(OH)2(s) + 2e-═Mg(s) + 2OH -(aq) *-2.69Mn Mn(OH)2(s) + 2e-═Mn(s) + 2OH -(aq) *-1.56MnO4-(aq) + 2H2O(l) + 3e-═MnO2(s) + 4OH -(aq) 0.595MnO42- (aq) + 2H2O(l) + 2e-═MnO2(s) + 4OH -(aq) *0.60 N NO3- (aq) + H2O(l) + 2e-═NO2- (aq) + 2OH -(aq) 0.01O O2(g) + 2H2O(l) + 4e-═4OH -(aq) 0.401O3(g) + H2O(l) + 2e-═O2(g) + 2OH -(aq) 1.246 Pb HPbO2- (aq) + H2O(l) + 2e-═Pb(s) + 3OH -(aq) -0.54S S(s) + 2e-═S2-(aq) *-0.455SO42- (aq) + H2O(l) + 2e-═SO32-(aq) + 2OH -(aq) *-0.932SO32-(aq) + 3H2O(l) + 4e-═S2O32-(aq) + 6OH -(aq) *-0.571 Sb SbO2- (aq) + 2H2O(l) + 3e-═Sb(s) + 4OH -(aq) *-0.66Zn Zn(OH)2(s) + 2e-═Zn(s) + 2OH -(aq) -1.246数据摘自Petrucci, R. H., Harwood, W. S., Herring, F. G. general Chemistry: Principlesand Modern Applications. 8 ed. 2002.* 数据摘自CRC Handbook of Chemistry and Physics, 82 ed. 2001~2002.氢 2.1 锂 0.98 铍 1.57 硼 2.04 碳 2.55 氮 3.04 氧 3.44 氟 3.98钠 0.93 镁 1.31 铝 1.61 硅 1.90 磷 2.19 硫 2.58 氯 3.16钾 0.82 钙 1.00 锰 1.55 铁 1.83 镍 1.91 铜 1.9 锌 1.65 镓 1.81 锗 2.01 砷 2.18 硒2.48 溴 2.96铷 0.82 锶 0.95 银 1.93 碘 2.66 钡 0.89 金 2.54 铅 2.33一般来说,电负性大于1.8的是非金属元素,而小于等于1.8的往往是金属元素(当然,其中也存在例外)。
