植物叶色黄化突变分子机理的研究进展-南方农业学报
BSA_联合转录组分析发掘西瓜叶片黄化候选基因

江苏农业学报(JiangsuJ.ofAgr.Sci.)ꎬ2024ꎬ40(1):165 ̄173http://jsnyxb.jaas.ac.cn张朝阳ꎬ程㊀瑞ꎬ徐兵划ꎬ等.BSA联合转录组分析发掘西瓜叶片黄化候选基因[J].江苏农业学报ꎬ2024ꎬ40(1):165 ̄173.doi:10.3969/j.issn.1000 ̄4440.2024.01.018BSA联合转录组分析发掘西瓜叶片黄化候选基因张朝阳ꎬ㊀程㊀瑞ꎬ㊀徐兵划ꎬ㊀顾㊀妍ꎬ㊀黄大跃ꎬ㊀孙玉东(江苏徐淮地区淮阴农业科学研究所/淮安市设施蔬菜重点实验室ꎬ江苏淮安223001)收稿日期:2022 ̄11 ̄28基金项目:淮安市农业科学研究院发展基金项目(HAN201714)ꎻ淮安市自然科学研究技术专项(HAB202079)ꎻ国家西甜瓜产业技术体系淮安综合试验站项目(CARS ̄25)作者简介:张朝阳(1982-)ꎬ男ꎬ江苏连云港人ꎬ硕士ꎬ副研究员ꎬ从事西甜瓜遗传育种研究ꎮ(E ̄mail)287362703@qq.comꎮ程瑞为共同第一作者ꎮ通讯作者:孙玉东ꎬ(E ̄mail)sunyudong@jaas.ac.cn㊀㊀摘要:㊀叶片是植物重要的功能器官之一ꎬ不仅是植株进行光合作用的主要场所ꎬ也可作为重要的形态标记ꎬ应用于育种中ꎮ叶片颜色作为形态标记ꎬ不仅可用于苗期杂种的清除ꎬ亦可用于种子纯度的测定ꎮ以西瓜全生育期叶片黄化突变体纯合自交系ly104为母本(P1)㊁绿叶自交系w3为父本(P2)ꎬ通过杂交创制F1代㊁F2代㊁BC1代群体ꎮ遗传分析结果表明ꎬ该突变体的叶片黄化由单隐性基因控制ꎮ采用混合分组分析(BSA)进行初定位ꎬ通过简化基因组测序(RAD)开发全基因组单核苷酸多态性(SNP)标记构建西瓜高密度遗传图谱ꎬ将西瓜叶片黄化基因定位于2号染色体13950306~15517591bp(大小约为1 57Mb)ꎮ以西瓜97103v2为参考基因组ꎬ该区间包含24个注释基因ꎮ对P1(P1Y)㊁P2(P2G)和F2代群体中黄叶(F2Y)㊁绿叶(F2G)株系进行转录组水平分析ꎬ结果表明ꎬ目标区间内基因Cla97C02G035950㊁Cla97C02G036010㊁Cla97C02G036020㊁Cla97C02G036060在黄化叶片与正常绿叶材料中的表达量差异显著ꎬ可能是西瓜叶片的黄化候选基因ꎮ研究结果可为进一步解析西瓜叶片黄化基因功能和生物学特性奠定重要基础ꎮ关键词:㊀西瓜ꎻ黄化ꎻBSAꎻ遗传图谱ꎻ基因定位中图分类号:㊀S651.01㊀㊀㊀文献标识码:㊀A㊀㊀㊀文章编号:㊀1000 ̄4440(2024)01 ̄0165 ̄09IdentificationofcandidategenesforwatermelonleafyellowingbasedonBSAandtranscriptomeanalysisZHANGChao ̄yangꎬ㊀CHENGRuiꎬ㊀XUBing ̄huaꎬ㊀GUYanꎬ㊀HUANGDa ̄yueꎬ㊀SUNYu ̄dong(HuaiyinInstituteofAgriculturalSciencesoftheXuhuaiDistrictofJiangsuProvince/HuaianKeyLaboratoryforFacilityVegetablesꎬHuaian223001ꎬChina)㊀㊀Abstract:㊀Theleafisoneoftheimportantfunctionalorgansofplants.Itisnotonlythemainplaceforphotosynthesisofplantsꎬbutalsocanbeusedasanimportantmorphologicalmarkerinbreeding.Asamorphologicalmarkerꎬleafcolorcanbeusednotonlyforremovinghybridsattheseedlingstageꎬbutalsofordeterminingseedpurity.InthisstudyꎬF1ꎬF2ꎬandBC1populationswerecreatedbyhybridizationꎬandthemutanthomozygousinbredlinely104inthewholegrowthperiodofwatermelonwasusedasthefemaleparent(P1)ꎬandthegreenleafinbredlinew3wasusedasthemaleparent(P2).Geneticanalysisshowedthatleafyellowingwascontrolledbyasinglerecessivegene.Thebulkedsegregantanalysis(BSA)wasusedforprimarymappingꎬandgenome ̄widesinglenucleotidepolymorphism(SNP)markersweredevelopedbyrestriction ̄siteassociatedDNA ̄sequencing(RAD)toconstructahigh ̄densitygeneticmapofwatermelon.Thewatermelonleafyellowinggenewaslocalizedonchromosome2at13950306 ̄15517591bp(about1.57Mb).Watermelon97103v2wasusedasthereferencegenomeandthein ̄tervalcontained24annotatedgenes.ThetranscriptomelevelsofP1(P1Y)ꎬP2(P2G)andyellowleaf(F2Y)andgreenleaf(F2G)linesinF2populationwereanalyzed.TheresultsshowedthattheexpressionlevelsofCla97C02G035950ꎬCla97C02G036010ꎬCla97C02G036020andCla97C02G036060inthetargetintervalweresignificantlydifferentbetweenetio ̄latedleavesandnormalgreenleaves.Thesegenesmightbecandidategenesforetiolationofwatermelonleaves.There ̄561sultsofthisstudycanlayanimportantfoundationforfurtheranalysisofthefunctionandbiologicalcharacteristicsofwatermelonleafyellowinggenes.Keywords:㊀watermelonꎻetiolationꎻBSAꎻgeneticmapꎻgenelocation㊀㊀叶片是植物进行光合作用最主要的器官ꎬ对植物的生存具有重要意义ꎬ叶片颜色在很大程度上决定了植物的光合效率[1]ꎮ植物叶色突变不仅是研究叶绿素相关基因功能及植物发育的重要材料[2]ꎬ也是优良的形态标记性状ꎬ在实际生产中常被用来进行品种纯度鉴定[3]ꎮ关于水稻㊁大麦㊁小麦㊁玉米㊁棉花㊁大豆㊁蚕豆㊁番茄㊁拟南芥等多种植物叶色突变的研究已有报道[4]ꎬ叶色突变类型丰富多样ꎬ包括白化㊁黄化㊁黄绿化等[5 ̄6]ꎮ植株叶色的形成不仅受到叶绿体生物合成途径㊁叶绿素降解途径㊁血红素代谢途径㊁类胡萝卜素代谢途径等与光合色素代谢途径相关基因的影响ꎬ受到与叶绿体发育相关基因的调控ꎬ还与光㊁温度㊁植物激素㊁矿物元素和金属离子等外界环境因素息息相关[6 ̄9]ꎮ目前ꎬ关于水稻㊁玉米㊁拟南芥等模式植物中叶色的研究较为深入ꎬ水稻㊁玉米中已报道的叶色突变体均超200个[10 ̄13]ꎬ对拟南芥的研究发现ꎬ叶色突变以隐性遗传为主ꎬ目前已经发现27个编码15种叶绿素生物合成酶的核基因ꎬ它们的任何异常突变都会导致叶绿素缺乏ꎬ从而产生黄色突变[14]ꎮ近年来ꎬ随着高通量测序技术的应用ꎬ关于辣椒㊁甜瓜和黄瓜等一些重要经济作物的叶色突变研究也逐渐展开[15 ̄19]ꎮ西瓜是全球十大水果之一ꎬ中国西瓜栽培面积和消费量均居世界首位ꎮ随着杂交育种的发展ꎬ西瓜育种已基本实现杂种一代化ꎬ对制种纯度提出了更大挑战ꎬ叶形㊁叶色虽是重要的形态标记性状ꎬ但尚未应用于育种中ꎮ西瓜的遗传基础狭窄ꎬ自然突变率低ꎬ目前有关西瓜叶色突变的报道有斑驳突变类型[20]㊁白化突变类型[21 ̄22]㊁不完全显性黄叶突变类型[22]㊁后绿突变类型[23]㊁黄化突变类型[24 ̄25]等ꎬ但研究主要集中于遗传规律㊁生理特性[21 ̄25]ꎮ西瓜基因组的公布和测序技术的快速发展为西瓜重要性状定位㊁关键基因功能研究奠定了重要生物学基础[26 ̄29]ꎮKidanemariam[30]发现ꎬ西瓜后绿突变体Houlv中的ClCG03G010030基因存在1个单核苷酸多态性(SNP)变异ꎬ导致该基因编码的FtsH胞外蛋白酶序列中精氨酸突变为赖氨酸ꎬFtsH蛋白主要参与叶绿体早期发育ꎬ进而影响西瓜叶片颜色ꎮZhu等[25]对叶片黄化突变西瓜材料w ̄yl进行精细定位ꎬ认为基因Cla97C02G036040㊁Cla97C02G036050和Cla97C02G036060可能是导致西瓜叶片黄化的主要基因ꎮ探索叶片颜色变异机制可为遗传改良提供理论依据ꎬ满足人们在生产㊁选种和育种等方面的需求ꎻ开发叶色形态标记ꎬ能够有效缩短育种周期ꎬ提高育种效率与制种纯度ꎮ本研究拟以全生育期叶片黄化西瓜材料ly104和绿叶西瓜材料w3为试验材料ꎬ通过混合分组分析(BSA)测序初步定位叶片黄化基因在染色体中的位置ꎬ进一步利用简化基因组(RAD)测序开发全基因组SNP分子标记ꎬ利用F2代群体构建高密度遗传图谱进行西瓜叶片黄化基因定位ꎬ结合转录组测序及基因功能注释锁定关键候选基因ꎮ本研究结果可为进一步全面解析西瓜叶片黄化基因及其生物学功能奠定重要基础ꎮ1㊀材料与方法1.1㊀试验材料2014年ꎬ利用甲基磺酸乙酯(EMS)诱变获得的稳定遗传的叶片黄化西瓜材料ꎬ经5代连续自交获得相对纯合的叶片黄化突变材料ly104ꎮ本研究以ly104为母本(P1)ꎬ以正常绿叶西瓜材料w3为父本(P2)构建F1代㊁F2代㊁BC1代群体ꎬ群体的构建与表型调查试验均于淮安市农业科学研究院科研创新基地进行ꎬ群体配制过程严格自交㊁杂交ꎬ整个生育期采取商品化管理ꎮ1.2㊀形态观察与遗传规律分析以第1张完全展开的真叶进行表型统计与分析ꎬ采用人工观察和便携式色差仪RM200QC(爱色丽X ̄Riteꎬ美国)对叶片颜色指数进行测定ꎬ测定指标为亮度值(L∗)㊁红绿值(a∗)和黄蓝值(b∗)3个颜色参数ꎮ对F1代㊁F2代㊁BC1代群体分离表型进行统计ꎬ分析西瓜叶片黄化遗传规律ꎬ并进行卡方检验ꎮ1.3㊀通过BSA测序进行叶片黄化初定位BSA测序即混合分组分析法ꎬ是一种简单快速的目标性状定位方法ꎬ已被广泛应用于多种园艺作物重要性状的基因定位[31]ꎮ本研究从F2代西瓜群体中选取黄叶㊁绿叶极端表型植株各20株ꎬ采用十六烷基三甲基溴化铵(CTAB)法[32]提取植株幼叶基661江苏农业学报㊀2024年第40卷第1期因组DNA并检测其浓度ꎬ通过等量混匀构建2个极端混池ꎬ利用亲本DNA构建亲本池进行测序分析ꎬ送至上海凌恩生物科技有限公司ꎬ利用IllunimaHiSeq4000进行测序ꎬ亲本测序深度为10ˑꎬ混池测序深度为20ˑꎬ测序读长为150bpꎮ对原始序列(Read)进行过滤ꎬ去除接头ꎬ过滤掉包含未确定碱基(N)>15%和低质量的read(质量值ɤ20的碱基数占整个Read的10%以上)ꎬ将获得的干净序列(Cleanread)用于后续分析ꎮ使用BWA软件[33]将高质量的Cleanread映射到西瓜基因组97103v2(ht ̄tp://cucurbitgenomics.org/organism/21)上ꎮ然后用GATK[34]㊁SnpEff[35]软件对突变位点进行检测和注释ꎬ用SNP ̄index算法进行关联分析ꎬ阈值为0 5ꎮ1.4㊀西瓜高密度遗传图谱的构建为了更精确地定位获得西瓜叶片黄化突变位点ꎬ本研究根据F2代群体中黄叶㊁绿叶分离比选取共100份单株ꎬ分别提取基因组DNAꎬ采用RAD建库方式构建长度范围在300~500bp的双端文库ꎮ将产物送至上海凌恩生物科技有限公司ꎬ利用IllunimaHiSeq进行测序ꎬ测序读长为150bpꎮ对原始Read采用以下标准进行质控:(1)去除Read中的接头序列ꎻ(2)修剪测序质量较低的Read末端(测序质量值小于Q20)ꎻ(3)去除含N比例达到10%的Readꎻ(4)舍弃接头及质量修剪后长度小于100bp的小片段ꎮ用BWA软件将Cleanread比对至参考基因组97103v2ꎬ并对映射结果进行统计分析ꎮ用GATK软件进行变异位点检测获得SNPꎮ对获得的SNP按以下标准进行过滤:(1)去除比对Read质量值小于20的位点ꎬ同时过滤掉缺失率大于50%的SNPꎻ(2)删除无义SNP位点ꎻ(3)用joinmap4.0软件[36]对过滤后的SNP进行卡方测验ꎬ先后过滤掉P<0 01和缺失率30%以上的标记ꎬ对于最终获得的SNPꎬ采用joinmap4.0软件进行西瓜遗传图谱构建ꎬ选用Kosamb s参数ꎮ1.5㊀转录组分析从亲本及其F2代群体中取ly04和w3单株各3份ꎬ当第1张真叶完全展开后取样进行转录组分析ꎮ用PlantRNAPurificationReagent试剂盒(购自上海凌恩生物科技有限公司)提取植物总RNAꎬ并构建转录组测序文库ꎮ送至上海凌恩生物科技有限公司采用IlluminaHiSeq进行测序ꎬRead长度为150bpꎮ测序数据经质控过滤获得Cleanreadꎬ用Hisat2软件[37]将其映射到西瓜基因组97103v2上ꎮ用每个基因在一个样本中所对应的基因转录本数(FPKM)计算基因表达水平ꎮ基于KEGG(http://www.ge ̄nome.jp/kegg/)和GO(http://www.geneontology.org/)数据库进行基因注释和功能分析ꎮ差异表达基因以差异倍数(Foldchange)ȡ1 5㊁Pɤ0 005为标准ꎮ1.6㊀候选区域功能注释与候选基因筛选结合遗传规律分析及BSAꎬ利用RAD测序开发全基因组SNP标记ꎬ加入叶色表型标记进行西瓜2号染色体图谱的构建ꎬ对西瓜叶片黄化基因进行定位ꎮ以97103v2为参考基因组对定位区间基因进行注释ꎬ通过基因序列分析及转录组测序差异表达情况分析进一步筛选并确定候选基因ꎮ2㊀结果与分析2.1㊀西瓜叶片黄化特性及遗传规律分析经EMS诱变获得叶片黄化的西瓜材料ꎬ经5代连续自交后ꎬ获得遗传稳定的叶片黄化材料ly104ꎬ该材料从子叶期至果实收获时的叶片均保持黄化状态(图1A)ꎮ通过对ly104㊁w3的叶片颜色指标进行测定ꎬ发现叶片黄化西瓜材料与绿叶西瓜材料在叶片颜色指标上存在极显著差异(图1B)ꎮ㊀㊀分析结果显示ꎬly104和w3的杂交F1代所有植株叶片均呈绿色ꎬ表明控制黄色和绿色的基因是等位基因ꎬ黄色的突变基因为隐性遗传ꎮF2代群体中有174个单株为绿叶ꎬ63个单株为黄叶(表1)ꎮ在F1代与叶片黄化亲本(P1)回交群体后代中ꎬ有73个单株为绿叶ꎬ63个单株为黄叶ꎮ卡方检验发现ꎬF2代群体的分离比符合3ʒ1的孟德尔分离比[χ2(1ꎬn=237)=0.31646ꎬP=0.5737>0 0500ꎬn为群体样本数量]ꎬBC1群体的分离模式符合1ʒ1的孟德尔分离比[χ2(1ꎬn=136)=0.73529ꎬP=0.3912>0 0500](表1)ꎬ说明西瓜叶片的黄色突变符合单基因控制的隐性遗传规律ꎬ叶片绿叶对黄色表现为显性遗传ꎮ表1㊀F2代和BC群体中叶片黄化突变型与野生型的分离比Table1㊀Segregationratioofyellow ̄leafmutantandwildtypeinF2andBCpopulations群体类型群体数量绿叶植株数量黄叶植株数量期望分离比卡方检验值(χ2)BC113673631ʒ10.74F2237174633ʒ10.32χ2检验采用0.05水平ꎮ761张朝阳等:BSA联合转录组分析发掘西瓜叶片黄化候选基因A:表型ꎻB:颜色指数ꎮL∗:亮度(阈值0~100)ꎻa∗:红绿色范围(阈值-128~+127)ꎻb∗:黄蓝色范围(阈值-128~+127)ꎻMT:突变体叶片黄化材料ꎻWT:野生型材料ꎮ∗∗表示不同材料间差异极显著(P<0 01)ꎮ图1㊀西瓜绿叶和黄叶突变体的表型及颜色指数Fig.1㊀Phenotypeandcolorindexofwatermelongreen ̄leafmutantandyellow ̄leafmutant2.2㊀西瓜叶片黄化基因的BSA初定位原始Read经质控过滤ꎬ2个混池共获得12.4Gb高质量CleanreadꎬQ30在93 0%以上ꎬ与参考基因组97103v2的平均比对率在98 0%以上ꎮ使用GATK软件进行变异检测ꎬ共获得523303个SNPꎬ经过滤后用SNP ̄Index算法对性状相关侯选区域进行选择ꎬ作图窗口大小为1Mbꎬ作图步移为10kbꎬ阈值为0 5ꎬ结果表明ꎬ西瓜叶色黄化基因定位于2号染色体8490001~26410000bp(大小约为17 92Mb)(图2A)ꎮ2.3㊀高密度西瓜遗传图谱的构建与叶片黄化基因的定位㊀㊀根据分离比ꎬ从F2代群体中选取76株绿叶㊁24株黄叶西瓜单株进行RAD测序ꎬ共获得69 17Gb高质量CleanreadꎬQ30在91 3%以上ꎬ与参考基因组的平均比对率在97 6%以上ꎮ使用GATK软件进行变异检测ꎬ共获得229704个SNPꎬ经过滤筛选ꎬ最终确定4273个SNP用于西瓜高密度遗传图谱的构建ꎮ西瓜遗传图谱总长度为1602.44cMꎬ平均遗传距离为0 39cMꎬ最大间隔为7 38cM(表2)ꎮ㊀㊀为了进一步精确定位西瓜叶片黄化基因ꎬ用RAD测序结果对西瓜2号染色体上的SNP标记进行过滤筛选ꎬ剔除检测率低于40%的样品单株和标记ꎬ最终用91份单株(68份绿叶ꎬ23份黄叶)㊁286个SNP标记进行叶片黄化基因定位ꎬ叶片颜色标记(Leafcolor)用绿叶(D)㊁黄叶(B)表示ꎬ用joinmap4进行西瓜叶片黄化基因的定位ꎮ结果显示ꎬLeafcol ̄or定位于Clas97Chr02 ̄13950306与Clas97Chr02 ̄15517591标记之间(大小约为1 567Mb)(图2B)ꎬ以西瓜97103v2为参考基因组ꎬ该区间包含24个注释基因(图2C㊁表3)ꎮ表2㊀西瓜高密度遗传图谱构建结果Table2㊀Constructionofhighdensitygeneticmapofwatermelon基因组位置标记数量遗传长度(cM)平均遗传距离(cM)标记最大间隔(cM)Lg01437161.150.372.62Lg02504185.490.372.32Lg0310960.130.553.16Lg04628278.320.443.87Lg05314114.810.372.87Lg0638095.080.252.75Lg07481186.900.392.82Lg0820572.030.352.17Lg09437147.520.342.21Lg10459121.600.262.40Lg11319179.410.567.38合计42731602.440.39-861江苏农业学报㊀2024年第40卷第1期2.4㊀西瓜黄化叶片转录组分析及候选基因的筛选RNA ̄seq共检测12个样本ꎬ其中P1㊁P2分别选取3个样本ꎬF2代群体中叶片黄化类型㊁绿叶类型分别选取3个样本ꎬ每个样本平均获得6 4Gb高质量Cleanread数据ꎬQ30在92 0%以上ꎬ平均基因组比对率为91 4%ꎮ分别以P2G(亲本绿叶)与P1Y(亲本黄叶)和F2G(F2代绿叶)与F2Y(F2代黄叶)为对比组进行独立分析ꎬ其中P2G与P1Y对比组中共检测到1356个差异表达基因ꎬ其中上调表达的基因529个ꎬ下调表达的基因827个ꎻF2G与F2Y对比组中共检测到4180个差异表达基因ꎬ其中上调表达的基因1378个ꎬ下调表达的基因2802个(图3Aꎬ图3B)ꎮP2G与P1Y对比组和F2G与F2Y对比组中均显著下调表达的基因共有327个㊁均显著上调表达的基因共有132个(图3A)ꎮ以上结果表明ꎬ亲本中黄叶和绿叶差异表达基因数量显著小于F2代群体ꎬ说明P1和P2已相对纯合ꎻGO和KEGG富集分析结果表明ꎬ差异表达基因富集通路多与光合㊁应激反应等有关ꎬ说明黄叶和绿叶西瓜植株在光合作用等方面存在较大差异ꎮ表3㊀候选区间注释基因Table3㊀Genefunctionannotationinformationincandidateinterval基因㊀㊀染色体起始位置(bp)终止位置(bp)基因方向基因功能注释㊀㊀㊀㊀㊀Cla97C02G035890染色体21395641713957327-acanthoscurrin ̄1 ̄likeCla97C02G035900染色体21402996814031110-未知的蛋白质Cla97C02G035910染色体21403120214032265-acanthoscurrin ̄1 ̄likeCla97C02G035920染色体21403358014037379-未知的蛋白质Cla97C02G035930染色体21405567614057378-含BPTI/Kunitz结构域的蛋白质2亚型X2Cla97C02G035940染色体21415712214158310+未知的蛋白质Cla97C02G035950染色体21420137314202375-与TMA7相关的翻译机制蛋白质Cla97C02G035960染色体21426731014270809-B类锌指蛋白质转录因子ꎬ包含DUF1664结构域Cla97C02G035970染色体21427090614274847+脂质结合血清糖蛋白质Cla97C02G035980染色体21427768614278904-蛋白质核融合缺陷6ꎬ叶绿体/线粒体样亚型X1Cla97C02G035990染色体21428304714283329+未知的蛋白质Cla97C02G036000染色体21437008614372002+抗坏血酸氧化酶同源物Cla97C02G036010染色体21437643914376782+未知的蛋白质Cla97C02G036020染色体21446137614464307-双组分反应调节蛋白质Cla97C02G036030染色体21449460714497114+双组分反应调节蛋白质Cla97C02G036040染色体21454976514550425+包含DUF679结构域的蛋白质Cla97C02G036050染色体21455062614551935-DNAJ同源亚家族B成员13Cla97C02G036060染色体21467069314671707+蛋白质Ycf2Cla97C02G036070染色体21483721914875277-U11/U12小核核糖核蛋白(相对分子质量65000)蛋白质亚型X2Cla97C02G036080染色体21499052014990719-未知的蛋白质Cla97C02G036090染色体21505989915063209+环型E3泛素转移酶Cla97C02G036100染色体21515520915157456+含五肽重复的家族蛋白质Cla97C02G036110染色体21516514215226986+尼曼 ̄匹克C1蛋白样亚型X2Cla97C02G036120染色体21523146015231976-锌指家族蛋白质+ 表示基因注释在染色体正链ꎻ - 表示基因注释在染色体负链ꎮ㊀㊀对西瓜2号染色体13950306~15517591bp(大小约为1 56Mb)内的24个注释基因进行功能分析和转录组表达差异分析ꎬ结果显示ꎬ24个注释基因中有17个在植株叶片中表达ꎬ仅有基因Cla97C02G036060㊁961张朝阳等:BSA联合转录组分析发掘西瓜叶片黄化候选基因A:BSA定位结果ꎮB:西瓜2号染色体遗传图谱及叶色黄化标记定位ꎮC:根据西瓜参考基因组97103v2注释候选区域的基因ꎮSNPindex:单核苷酸多态性指数ꎮ图2㊀西瓜叶片黄化基因精细定位Fig.2㊀FinemappingofleafyellowinggenesinwatermelonA:P2G与P1Y对比组及F2G与F2Y对比组上调和下调基因数量Venn图ꎻB:P2G与P1Y对比组及F2G与F2Y对比组上调和下调基因数量柱形图ꎻC:F2G与F2Y对比组差异基因火山图ꎬ标注基因为候选区间基因ꎮP1Y:亲本黄叶ꎻP2G:亲本绿叶ꎻF2G:F2代绿叶ꎻF2Y:F2代黄叶ꎮ图3㊀西瓜黄叶与绿叶转录组差异表达基因分析Fig.3㊀Analysisofdifferentiallyexpressedgenesinthetranscriptomeofwatermelonyellowleafandgreenleaf071江苏农业学报㊀2024年第40卷第1期Cla97C02G035950㊁Cla97C02G036010㊁Cla97C02G036020在叶片黄化植株与绿叶植株中的表达存在显著差异ꎬCla97C02G036060在P2G和F2G中均显著上调表达(图3C)ꎬ其注释功能为Ycf2蛋白编码基因ꎬ该编码基因为被子植物中最重要的质体基因ꎬ与植物光合作用有关ꎮ3㊀讨论与结论化学EMS诱变是人工创造突变体最常用的处理方式之一ꎬ叶片黄化是最常见的诱变表型[22]ꎮ笔者所在课题组前期通过EMS诱变西瓜种子ꎬ获得稳定遗传的西瓜叶片黄化材料ꎬ其整个生育期均可保持黄化状态ꎮ植物叶片黄化突变ꎬ又称叶绿素缺乏突变ꎬ通常是由叶绿素合成或降解途径被破坏所致[38]ꎮ目前ꎬ研究者已经在水稻[39]㊁番茄[40]㊁黄瓜[19]㊁拟南芥[41]等植物中发现了黄化突变体ꎮ有研究发现ꎬ不同类型的叶色突变的遗传规律差异较大ꎬ有些叶色突变可能是核遗传ꎬ也可能是细胞质遗传ꎬ水稻[42]㊁玉米[43]㊁小麦[44]㊁黄瓜[45]㊁番茄[46]等都由1对或2对隐性核基因控制ꎮZhang等[21]研究证实ꎬ西瓜叶片白化突变是由1对隐性等位基因(jaja)控制的ꎮProvvidenti[20]发现ꎬ西瓜叶色斑驳突变由1对隐性基因(slv)控制ꎮKidanemariam等[30ꎬ47]发现ꎬ西瓜叶色后绿突变是由1个隐性基因(dgdg)控制的ꎮZhu等[25]研究发现ꎬ西瓜黄化突变体w ̄yl由1对隐性核基因控制ꎬ与本研究结果一致ꎮ西瓜作为重要的园艺经济作物[48 ̄51]ꎬ在中国的栽培面积和产量均居世界首位ꎮ经长期人工选择ꎬ栽培西瓜遗传背景狭窄ꎬ多态性分子标记开发受限ꎬ致使西瓜分子标记辅助育种及品种改良进展缓慢ꎮ高密度遗传图谱的构建不仅是开发西瓜重要农艺性状遗传基因/QTL紧密连锁分子标记的重要手段ꎬ亦是深入挖掘和解析西瓜重要农艺性状基因的基础ꎬ通过遗传图谱构建进行基因/QTL定位研究已经在西瓜多种性状研究中得到成熟应用[52 ̄53]ꎮ本研究基于BSA定位ꎬ将西瓜叶片黄化基因定位于2号染色上ꎬ为了进一步获得可靠定位基因ꎬ本研究开发了SNP标记ꎬ用于构建高密度西瓜遗传图谱ꎬ并将西瓜叶片黄化基因定位到2号染色体13950306~15517591bp(大小约为1 56Mb)ꎬ比对西瓜参考基因组97103v2发现ꎬ在候选区段内包含24个注释基因ꎬ17个基因在叶片中表达ꎬ4个基因在黄叶与绿叶转录组分析中存在显著差异表达ꎬ其中基因Cla97C02G036060是Ycf2蛋白的编码基因ꎬYcf2/FtsH调控的烟酰胺腺嘌呤二核苷酸 ̄苹果酸脱氢酶是叶绿体或非光合质体在黑暗中产生腺嘌呤核苷三磷酸的关键酶[54]ꎬ是光合生长必需的酶[55]ꎮ目前ꎬYcf2基因已被证实是被子植物中最重要的质体基因[56]ꎬ它在高等植物中发挥着重要功能[57]ꎮ在本研究中ꎬ由于双亲重测序深度不高ꎬ候选区间注释基因编码区中未发现可靠突变ꎬ但转录组结果显示ꎬYcf2在叶片黄化西瓜材料中的表达量显著下调ꎬ说明叶片黄化西瓜材料的光合作用系统可能与正常绿叶植株光合系统存在显著差异ꎬ相关机制需要进一步研究ꎮ本研究结果可为进一步挖掘叶片黄化植株光合作用机制奠定一定科学基础ꎮ参考文献:[1]㊀陈婷婷ꎬ符卫蒙ꎬ余㊀景ꎬ等.彩色稻叶片光合特征及其与抗氧化酶活性㊁花青素含量的关系[J].中国农业科学ꎬ2022ꎬ55(3):467 ̄478. [2]㊀徐明远ꎬ何㊀鹏ꎬ赖㊀伟ꎬ等.植物叶色变异分子机制研究进展[J].分子植物育种ꎬ2021ꎬ19(10):3448 ̄3455. [3]㊀马道承ꎬ王凌晖ꎬ梁㊀机.形态标记在植物中的应用研究进展[J].江苏农业科学ꎬ2022ꎬ50(8):55 ̄62.[4]㊀杨小苗.番茄EMS突变体库的构建及叶色黄化突变体的分析[D].沈阳:沈阳农业大学ꎬ2017.[5]㊀刘忠学ꎬ张渝竣ꎬ刘㊀林ꎬ等.水稻黄绿叶突变体yellow ̄greenleaf4的表型鉴定及候选基因定位和功能分析[J].南京农业大学学报ꎬ2022ꎬ45(4):627 ̄636.[6]㊀徐薪璐ꎬ蔡㊀鸥ꎬ秦㊀敏ꎬ等.植物叶色变异研究进展[J/OL].分子植物育种:1 ̄8[2022 ̄11 ̄21].http://kns.cnki.net/kcms/de ̄tail/46.1068.S.20220517.1326.020.html.[7]㊀ZHANGHTꎬLIJJꎬYOOJHꎬetal.Ricechlorine ̄1andchlo ̄rine ̄9encodeChlDandChloIsubunitsofMg ̄chelataseꎬakeyen ̄zymeforchlorophyllsynthesisandchloroplastdevelopment[J].PlantMolecularBiologyꎬ2006ꎬ62(3):325 ̄337.[8]㊀SUGLIAMꎬABDELKEFIHꎬKEHꎬetal.AnancientbacterialsignalingpathwayregulateschloroplastfunctiontoinfluencegrowthanddevelopmentinArabidopsis[J].PlantCellꎬ2016ꎬ28:661 ̄679. [9]㊀李素贞ꎬ杨文竹ꎬ陈茹梅.水稻黄绿叶突变体研究进展[J].生物技术通报ꎬ2018ꎬ34(11):15 ̄21.[10]赵绍路ꎬ刘㊀凯ꎬ宛柏杰ꎬ等.水稻叶色突变研究进展[J].大麦与谷类科学ꎬ2018ꎬ35(6):1 ̄6.[11]张文慧ꎬ杨宜豪ꎬ陈铭蔚ꎬ等.水稻一新黄绿叶突变体ygl10 ̄2(t)的遗传分析与基因定位[J].扬州大学学报(农业与生命科学版)ꎬ2019ꎬ40(1):1 ̄7.171张朝阳等:BSA联合转录组分析发掘西瓜叶片黄化候选基因[12]陈桂华ꎬ王㊀悦ꎬ熊跃东ꎬ等.水稻叶色突变体xws的基因定位与育种利用[J].分子植物育种ꎬ2018ꎬ16(1):155 ̄162. [13]李㊀秦ꎬ杜何为.玉米叶色突变体研究进展[J].南方农业ꎬ2019ꎬ13(28):14 ̄21ꎬ27.[14]NAGATANꎬTANAKARꎬSATOHSꎬetal.Identificationofavi ̄nylreductasegeneforchlorophyllsynthesisinArabidopsisthalianaandimplicationsfortheevolutionofProchlorococcusspecies[J].PlantCellꎬ2005ꎬ17(1):233 ̄240.[15]王㊀萌ꎬ赵㊀虎ꎬ赵曾菁ꎬ等.辣椒彩色斑叶突变体叶片显微结构及超微结构研究[J].西北植物学报ꎬ2022ꎬ42(4):600 ̄608. [16]赖㊀艳ꎬ付秋实ꎬ吕建春ꎬ等.一个新的薄皮甜瓜叶色突变体的生理特性及超微结构分析[J].四川农业大学学报ꎬ2018ꎬ36(3):372 ̄379.[17]朱华玉ꎬ张凯歌ꎬ宋芃垚ꎬ等.甜瓜黄绿叶色性状的遗传分析及其初步定位[J].河南农业大学学报ꎬ2019ꎬ53(6):855 ̄860. [18]陈远良ꎬ刘新宇ꎬ李树贤.黄瓜黄绿色叶片颜色遗传规律研究[J].北方园艺ꎬ2000(5):3 ̄4.[19]XIONGLRꎬDUHꎬZHANGKYꎬetal.AmutationinCsYL2.1encodingaplastidisoformoftriosephosphateisomeraseleadstoyellowleaf2.1(yl2.1)incucumber(CucumissativusL.)[J].In ̄ternationalJournalofMolecularSciencesꎬ2020ꎬ22(1):322. [20]PROVVIDENTIR.Inheritanceofapartialchlorophylldeficiencyinwatermelonactivatedbylowtemperaturesattheseedlingstage[J].HorticultureScienceꎬ1994ꎬ29(9):1062 ̄1063.[21]ZHANGXPꎬRHODESBBꎬBAIRDWVꎬetal.Developmentofgenicmale ̄sterilewatermelonlineswithdelayed ̄greenseedlingmarker[J].HorticultureScienceꎬ1996ꎬ31(1):123 ̄126. [22]侯㊀艳ꎬ朱子成ꎬ朱娜娜ꎬ等.EMS诱变西瓜突变体库的构建及表型分析[J].西北植物学报ꎬ2016ꎬ36(12):2411 ̄2420. [23]徐㊀铭ꎬ高美玲ꎬ郭㊀宇ꎬ等.西瓜后绿突变体光合特性分析[J].西北农林科技大学学报(自然科学版)ꎬ2022ꎬ50(3):91 ̄96ꎬ106.[24]任艺慈ꎬ朱迎春ꎬ孙德玺ꎬ等.一个西瓜叶色黄化突变体的生理特性分析[J].果树学报ꎬ2020ꎬ37(4):565 ̄573.[25]ZHUYꎬYUANGꎬWANGYꎬetal.Mappingandfunctionalveri ̄ficationofleafyellowinggenesinwatermelonduringwholegrowthperiod[J].FrontiersinPlantScienceꎬ2022ꎬ13:1049114. [26]GUOSGꎬZHANGJGꎬSUNHHꎬetal.Thedraftgenomeofwa ̄termelon(Citrulluslanatus)andresequencingof20diverseacces ̄sions[J].NatureGeneticsꎬ2013ꎬ45:51 ̄58.[27]GUOSGꎬZHAOSJꎬSUNHHꎬetal.Resequencingof414cul ̄tivatedandwildwatermelonaccessionsidentifiesselectionforfruitqualitytraits[J].NatureGeneticsꎬ2019ꎬ51(11):1616 ̄1623. [28]WUSꎬWANGXꎬREDDYUꎬetal.Genomeof CharlestonGray ꎬtheprincipalAmericanwatermeloncultivarꎬandgeneticcharacterizationof1365accessionsintheU.S.NationalPlantGermplasmSystemwatermeloncollection[J].PlantBiotechnologyJournalꎬ2019ꎬ17(12):2246 ̄2258.[29]LILIMꎬQINGWꎬYANYANZꎬetal.Cucurbitaceaegenomeevo ̄lutionꎬgenefunctionꎬandmolecularbreeding[J].HorticultureResearchꎬ2022ꎬ9:uhab057.[30]KIDANEMARIAMHG.西瓜叶色后绿和植株短蔓性状的遗传与分子机制研究[D].北京:中国农业科学院ꎬ2020. [31]周雨晴ꎬ郭宇玲ꎬ伊㊀然ꎬ等.基于BSA ̄Seq的黄瓜重要园艺性状遗传定位研究进展[J/OL].分子植物育种:1 ̄12[2023 ̄10 ̄10].http://kns.cnki.net/kcms/detail/46.1068.S.20220704.0904.002.html.[32]张菊平ꎬ张长远ꎬ张树珍.苦瓜基因组DNA提取和RAPD分析[J].广东农业科学ꎬ2002(4):18 ̄20.[33]LIH.AligningsequencereadsꎬclonesequencesꎬandassemblycontigswithBWA ̄MEM[J].arXivꎬ2013ꎬ1303.3997v2[q ̄bio.GN].DOI:10.48550/ARXIV.1303.3997.[34]VANDERAUWERAGAꎬCARNEIROMOꎬHARTLCꎬetal.FromFastQdatatohigh ̄confidencevariantcalls:thegenomeanal ̄ysistoolkitbestpracticespipeline[J].CurrentProtocolsinBioin ̄formaticsꎬ2013ꎬ43(1110):1 ̄33.[35]CINGOLANIPꎬPLATTSAꎬWANGLLꎬetal.Aprogramforan ̄notatingandpredictingtheeffectsofsinglenucleotidepolymor ̄phismsꎬSnpEff:SNPsinthegenomeofDrosophilamelanogasterstrainw1118ꎻiso ̄2ꎻiso ̄3[J].Flyꎬ2012ꎬ6(2):80 ̄92. [36]STAMP.Constructionofintegratedgeneticlinkagemapsusinganewcomputerpackage:JoinMap[J].ThePlantJournalꎬ1993ꎬ3(5):739 ̄744.[37]KIMDꎬPAGGIJMꎬPARKCꎬetal.Graph ̄basedgenomealign ̄mentandgenotypingwithHISAT2andHISAT ̄genotype[J].Na ̄tureBiotechnologyꎬ2019ꎬ37(8):907 ̄915.[38]崔慧琳ꎬ李志远ꎬ方智远ꎬ等.结球甘蓝自交系YL ̄1的高效遗传转化体系的建立及应用[J].园艺学报ꎬ2019ꎬ46(2):345 ̄355.[39]张天雨ꎬ周春雷ꎬ刘㊀喜ꎬ等.一个水稻温敏黄化突变体的表型分析和基因定位[J].作物学报ꎬ2017ꎬ43(10):1426 ̄1433. [40]姚建刚ꎬ张贺ꎬ许向阳ꎬ等.番茄叶色突变体的弱光耐受性研究[J].中国蔬菜ꎬ2010(4):31 ̄35.[41]SUNJLꎬTIANYYꎬLIANQCꎬetal.MutationofDELAYEDGREENINGimpairschloroplastRNAeditingatelevatedambienttemperatureinArabidopsis[J].JournalofGeneticsandGenomicsꎬ2020ꎬ47(4):201 ̄212.[42]孙立亭ꎬ林添资ꎬ王云龙ꎬ等.水稻白条纹突变体st13的表型分析及基因定位[J].中国水稻科学ꎬ2017ꎬ31(4):355 ̄363. [43]王㊀飞ꎬ段世名ꎬ李㊀彤ꎬ等.玉米叶色突变体遗传分析及基因定位[J].植物遗传资源学报ꎬ2018ꎬ19(6):1205 ̄1209. [44]蒋宏宝.小麦叶绿素缺失突变体B23的鉴定及基因定位[D].杨凌:西北农林科技大学ꎬ2018.[45]GAOMLꎬHULLꎬLIYHꎬetal.Thechlorophyll ̄deficientgoldenleafmutationincucumberisduetoasinglenucleotidesub ̄stitutioninCsChlIforthemagnesiumchelataseIsubunit[J].The ̄oreticalandAppliedGeneticsꎬ2016ꎬ129(10):1961 ̄1973. [46]郭丽杰.番茄杂色叶基因vg的遗传定位分析[D].武汉:华中农业大学ꎬ2017.[47]RHODESBB.Genesaffectingfoliagecolorinwatermelon[J].271江苏农业学报㊀2024年第40卷第1期JournalofHeredityꎬ1986ꎬ77(2):134 ̄135.[48]秦㊀涛ꎬ刘新社.氮钾肥配施对土壤微生物与西瓜形态建成㊁品质㊁产量的影响[J].江苏农业科学ꎬ2022ꎬ50(16):154 ̄161. [49]杨㊀柳ꎬ况佳颖ꎬ任春梅ꎬ等.江苏省主要葫芦科作物病毒种类及分布[J].江苏农业学报ꎬ2022ꎬ38(1):65 ̄72.[50]胡晨曦ꎬ张㊀甜ꎬ陈㊀刚ꎬ等.不同嫁接方式对西瓜幼苗生长和生理的影响[J].江苏农业科学ꎬ2022ꎬ50(1):139 ̄143. [51]何㊀毅ꎬ解华云ꎬ陈东奎ꎬ等.设施与露地兼用型优质西瓜新品种桂玲的选育[J].南方农业学报ꎬ2023ꎬ54(4):1216 ̄1223. [52]高美玲ꎬ刘小松ꎬ刘秀杰ꎬ等.基于GBS高密度遗传图谱初步定位西瓜种皮斑块基因[J].分子植物育种ꎬ2022ꎬ20(1):186 ̄192.[53]李兵兵ꎬ刘文革ꎬ路绪强ꎬ等.基于全基因组重测序构建西瓜高密度遗传图谱和果实相关性状的基因定位[J].中国瓜菜ꎬ2019ꎬ32(8):164 ̄165.[54]KIKUCHISꎬASAKURAYꎬIMAIMꎬetal.AYcf2 ̄FtsHihetero ̄mericAAA ̄ATPasecomplexisrequiredforchloroplastproteinim ̄port[J].PlantCellꎬ2018ꎬ30(11):2677 ̄2703.[55]PARKERNꎬWANGYXꎬMEINKED.AnalysisofArabidopsisaccessionshypersensitivetoalossofchloroplasttranslation[J].PlantPhysiologyꎬ2016ꎬ172(3):1862 ̄1875.[56]HUANGJLꎬSUNGLꎬZHANGDM.Molecularevolutionandphylogenyoftheangiospermycf2gene[J].JournalofSystematicsandEvolutionꎬ2020ꎬ48(4):240 ̄248.[57]DRESCHERAꎬRUFSꎬJRCALSATꎬetal.Thetwolargestchlo ̄roplastgenome ̄encodedopenreadingframesofhigherplantsareessentialgenes[J].PlantJournalꎬ2000ꎬ22(2):97 ̄104.(责任编辑:徐㊀艳)371张朝阳等:BSA联合转录组分析发掘西瓜叶片黄化候选基因。
植物叶色突变体

植物生理学通讯 第 42 卷 第ຫໍສະໝຸດ 1 期,2006 年 2月3
图1 被子植物叶绿素生物合成途径(Beale 2005) 标有数字的箭头涉及表 1 中所列的酶;根据有效底物发生反应 1 2 或 1 3 ;反应 1 4 可利用 2 种底物。
1995)等关键酶在叶绿素合成过程中的功能。 4.2 血红素→光敏色素生色团生物途径中基因突变 叶绿素生物合成和血红素生物合成是四吡咯生物 合成途径的两个分支,原卟啉 IX 与 Mg 2+ 螯合产 生镁原卟啉 I X ,与 F e 2 + 螯合形成血红素,血红 素经一系列反应最终形成光敏色素生色团(图 2)。 叶绿素合成速率受细胞内血红素含量影响,若血 红素→光敏色素生色团途径受阻、细胞内血红素含 量上升,过剩的血红素将反馈抑制叶绿素合成, 引起突变体叶色变异(Terry和Kendrick 1999)。
基因沉默引起的叶色突变体主要用于分析特 定基因功能。目前仅从烟草(Monde 等 2000)、拟 南芥(Kumar和Soll 2000)等少数植物中分离出基因 沉默叶色突变体。 3 叶色突变体的遗传方式
叶色变异种类繁多,不同突变体的遗传规律 相差很大。叶色突变可能是数量性状,也可能是 质量性状;可能是细胞核遗传,也可能是细胞质 遗传。例如,芽黄突变体多数受单隐性核基因控 制,少数受两对核基因控制(肖松华等 1995),在 大豆中还发现了细胞质遗传芽黄突变体(马国荣等 1994)。与细胞核遗传叶色突变体相比,已发现的 细胞质突变体较少,仅在小麦(王保莉等 1996)、 大豆(马国荣等 1994)、烟草(Monde 等 2000; Barak 等 2000)等作物中有少量报道。这可能与植物细胞 中含有多个细胞器(叶绿体、线粒体) DNA 分子有 关。 4 叶色突变的分子机制
黄化处理对植物扦插生根的影响研究进展

南方农业South China Agriculture第17卷第13期Vol.17No.132023年7月Jul.2023扦插是一种传统的植物无性繁殖方法,被广泛应用于林业和花卉种苗生产中。
当前国内外对扦插繁殖的研究主要集中在技术层面,对黄化处理促进扦插生根的综合评述较少。
基于此,本文就黄化处理的历史、方法、促进生根的原理和效果及应用情况进行总结。
1黄化处理的历史黄化处理是将整个植株或植株的一部分置于遮阴或完全黑暗的条件下,对生长发育期的母本进行扦插前预处理的过程。
黄化处理在植物无性繁殖中历史悠久。
根据文献记载,最早可以追溯到1537年[1]。
堆土压条、空中压条等都是黄化处理的具体操作。
1.1国外国外研究人员早在1537年就通过试验表明:对母株进行黄化处理,有利于插穗生根[1]。
20世纪20年代,黄化处理在众多木本植物中得到了广泛应用。
1937年,Gardner 在苹果扦插过程中发现,黄化枝条更易生根[2]。
试验人员在1970年通过黄化或弱光照处理,发现生长素和茶多酚具有协同作用[3]。
1978年,Nelson 报道黄化枝条中中柱鞘的形成减少[4]。
1982年,Herman 和Hess 报道,黄化枝条细胞分裂少,黄化作用可增加木槿和菜豆枝条中生长素协同物质的含量[5]。
近年来研究表明,黄化枝条生根率提高与形态学、生理学和分子的改变有关系。
1.2国内在我国,黄化处理对扦插生根的影响研究相对起步较晚。
最早有文献记载的是,周汉忠等于1966年在茶树扦插过程中,发现对母株黄化处理可以使插穗提前发根[6]。
20世纪90年代后,马锋旺证明了对枝条进行黄化处理可以明显提高生根率[7]。
此后,科技工作者对黄化枝条生理特性进行了深入研究。
卢楠等在对1年生四倍体刺槐硬枝的黄化处理中,测定了扦插后不同时间插穗的3种氧化酶活性和4种内源激素的质量分数,试验表明与未进行黄化处理的枝条相比,经过黄化处理的枝条生根质量明显提高;进一步证明,通过生长素和黄化插穗的结合,确实可以促进插穗形成不定根[8]。
洋葱黄色条纹突变体叶绿体基因组测序及嵌合体验证

惠林冲,陈 微,张仕林,等.洋葱黄色条纹突变体叶绿体基因组测序及嵌合体验证[J].江苏农业科学,2023,51(20):43-49.doi:10.15889/j.issn.1002-1302.2023.20.007洋葱黄色条纹突变体叶绿体基因组测序及嵌合体验证惠林冲,陈 微,张仕林,李威亚,何林玉,杨海峰,潘美红(连云港市农业科学院,江苏连云港222000) 摘要:为鉴定洋葱黄条纹突变体中叶绿体基因组基因突变,利用洋葱黄色条纹突变体进行黄色组织叶绿体基因组测序及差异位点验证分析,对突变体种子果夹表型特征与出苗后表型进行对比分析,并利用ABP1-1、KMOX-1和MYB-2分子标记对4份黄条纹黄化程度在50%以上的植株绿色和黄色组织DNA进行分子标记多态性检测。
结果表明,测序获得突变体叶绿体基因组153585bp,与洋葱叶绿体参考基因组比对筛选出5个差异位点,PCR扩增及测序分析发现叶绿体基因组碱基的突变、插入并不导致黄条纹突变;突变果夹黄化程度与母株上种子出苗后黄化程度成正比,果夹越黄,种子出苗叶片越黄,3个分子标记对同一株黄色和绿色组织进行PCR验证,发现绿色与黄色组织扩增条带不一致。
综上所述,洋葱叶片黄色条纹突变是一种嵌合体突变。
关键词:洋葱;黄条纹;叶绿体;嵌合体;基因组测序 中图分类号:S633.201 文献标志码:A 文章编号:1002-1302(2023)20-0043-06收稿日期:2022-11-30基金项目:江苏省连云港市财政专项(编号:QNJJ2206);连云港市第六期“521工程”科研项目(编号:LYG06521202134)。
作者简介:惠林冲(1988—),男,江苏灌南人,硕士,助理研究员,从事蔬菜育种、栽培及分子生物学研究。
E-mail:huilinchong@yeah.net。
通信作者:潘美红,硕士,副研究员,从事蔬菜育种、栽培及利用研究。
E-mail:7991454@163.com。
水稻叶色突变体的光合和生理生化特性研究的开题报告

水稻叶色突变体的光合和生理生化特性研究的开题报告
一、研究背景及意义
水稻是我国重要的粮食作物之一,近年来随着对水稻产量和品质要求的不断提高,新品种的选育变得越来越关键。
而叶色突变体则是一类变异营养性的重要材料,其在
光合、生长发育和逆境适应等方面均存在显著的生理和生化差异,因此对其进行深入
的研究有助于了解水稻的生长发育机制,提高育种效率,提高作物产量和品质,实现
粮食安全和农业可持续发展。
二、研究内容及方法
本研究选取数种水稻叶色突变体为研究对象,包括绿叶、黄叶和红叶等类型,比较其与普通绿色叶子水稻在光合和生理生化方面的差异,探究其叶色突变的遗传基础
和生理机制。
具体研究内容和方法如下:
1.测定叶片光合参数
选取变异营养性较为明显的突变体,测定其叶片的光合速率、净光合速率、气孔导度、胞间CO2浓度等参数,比较各类型水稻叶片的光合特性,并探究其差异的生理生化基础。
2.测定叶片生理生化参数
测定各类型水稻叶片的叶绿素含量、类胡萝卜素含量、蛋白质含量、可溶性糖含量、丙二醛含量等生理生化参数,比较其差异,并分析其在叶色突变机制中的作用。
3.基因定位和生物信息学分析
对发现的叶色突变基因进行基因定位,比较其DNA序列、蛋白质结构、功能等
差异,并利用生物信息学工具预测蛋白质功能和相互作用网络,解析其遗传基础和分
子机制。
三、研究预期成果
通过上述研究内容和方法,本研究预期能够深入了解水稻叶色突变体的光合和生理生化特性,并探究其差异的生理生化基础和分子机制,揭示其叶色突变的遗传基础
和生理机制,为水稻育种提供理论支持和实际应用价值。
水稻叶色突变分子机制的研究进展

_1 1 l
、
O C 2 表 1。 sA0 i等( “ )
不正 常的 白化 、 黄化 、 浅绿 、 白、 绿 白翠 、 黄绿 、 黄和条 绿 纹等 [ 3 1 。突变基 因直接或间接影响 叶绿素 的合成和降
解 , 变叶绿 素含量 , 以大部分叶色 突变体 同时也是 改 所
5 氨基 乙酰丙 酸( L 的合 成是植物 四吡咯物质 一 A A) 合成途径 的关键 步骤 ,也是 整个叶绿素合成途径 中的
( 中国水稻研究所 国家水 稻改良中心 水稻生物学 国家重点实验室 , 浙江 杭州 30 0 ;通讯作者 , - a :qag 2 . m) 10 6 E m i stn@16 o l c 摘 要: 叶色突变表型明显 、 易于鉴别 , 在高等植物叶绿素代谢 、 叶绿体结构 、 功能和发育机理等基础研究 中具有
限速步骤 。谷 氨酰一R A还原酶 ( l R) A A合成 tN Gu 是 L T
叶绿 素突变体 。叶色突变通常在苗期表达 , 与其 他突 变体相 比具有表 型明显 、 易于鉴别 、 图位克 隆周期短等 特点 。 目前 在水 稻中 已经定位约 8 叶色突变 位点 , 0个
过程 中第一个 关键酶 , H M 由 E A基 因家族编码 。拟南 芥 中已经鉴定 出三个 H MA基 因-, E l 水稻 谷氨 酰一R 2 1 t— N A还原酶基 因 O Gu s 已经被克隆 , sl 也 R 其突变体表现 为叶片 黄化 , 呈现温 度特异性 , 并 株高 降低 , 抽穗 期推
二步 由 A A形成 原卟啉 I L X;第三步为原 卟啉 I x在镁 离子螯合酶 、叶绿 素合 成酶 以及叶绿素 a 氧化酶 的作 用下 最终合成 叶绿 素 a 叶绿素 b 和 。双子 叶模式植 物
2025年高考生物复习之小题狂练300题(解答题):植物生命活动的调节(10题)

2025年高考生物复习之小题狂练300题(解答题):植物生命活动的调节(10题)一.解答题(共10小题)1.水杨酸是一种小分子酚类化合物,为探究水杨酸对植物根生长的影响,科研人员取适量品质均一的油菜种子,播到含不同浓度的水杨酸的培养基上培养,种子发芽13d后对油菜幼根的侧根数目和主根长度分别进行计数,结果如下表。
测定项目水杨酸浓度/(μmol•L﹣1)00.080.40 2.0010.00侧根数目(条)15.7016.7021.3016.6210.33主根长度13.6512.6911.719.017.48(cm)回答下列问题:(1)植物激素作为参与调节植物的生命活动。
基于以上信息,还需确认,可初步判断水杨酸也属于植物激素。
(2)据表分析可得:①水杨酸对油菜侧根发生的影响为;②主根处理组中出现,表明一定浓度范围内,水杨酸对主根伸长的抑制作用随浓度增加而增强。
(3)有研究发现,水杨酸对主根伸长的抑制作用会随着主根生长时间的延长而减弱。
在上述实验基础上设计实验进行验证,实验思路是,预期实验结果是。
(4)植物根的生长还受等环境因素的调节(至少答出2点)。
2.光敏色素是一类能接受光信号的分子,主要吸收红光和远红光,具有非活化态(Pr)和活化态(Pfr)两种类型。
农田中玉米—大豆间作时,高位作物(玉米)对低位作物(大豆)具有遮阴作用,严重时引发“荫蔽胁迫”,此时,低位植物体内的光敏色素及多种激素共同响应荫蔽胁迫。
请回答下列问题。
(1)光敏色素是一类(化学本质)。
在不同的光照条件下,光敏色素接受光信号后,会经过信息传递系统传导至细胞核内,影响,从而表现出生物学效应。
(2)自然光被植物滤过后,其中红光(R)/远红光(FR)的值会下降,原因是。
发生荫蔽胁迫时,低位植物体内的光敏色素主要以形式存在。
此形式的光敏色素可(选填“减弱”或“增强”)对光敏色素互作因子(PIFs)的抑制作用,有利于多种激素共同响应荫蔽胁迫。
番茄叶色黄化突变体的遗传分析及SSR分子标记[1]
![番茄叶色黄化突变体的遗传分析及SSR分子标记[1]](https://img.taocdn.com/s3/m/5fb1e3dc50e2524de5187eb0.png)
中国蔬菜 2010(14):31-35CHINA VEGETABLES番茄叶色黄化突变体的遗传分析及SSR分子标记郭 明 张 贺 李景富*(东北农业大学园艺学院,黑龙江哈尔滨 150030)摘 要:在番茄普通栽培品种中蔬4号06884中发现能稳定遗传的叶色黄化突变体06883,该突变体新出叶最初为绿色,四叶一心时第一片真叶开始转黄,果实转色慢,硬度大耐贮藏。
通过该突变体和栽培品种中蔬4号的正反交试验的遗传分析证明,该突变材料的叶片黄化性状由1对隐性主效核基因控制,该性状可以用来作为指示性状鉴定杂种纯度。
应用SSR分子标记技术对该突变基因进行初步定位,经连锁分析表明,该基因与LEaat006、LEtat002和Tom196-197连锁,与它们的连锁距离分别为8.9、16.3和18.7 cM。
关键词:番茄;叶色黄化突变;SSR;基因定位中图分类号:S634 文献标识码:A 文章编号:1000-6346(2010)14-0031-05 Genetic Analysis and SSR Molecule Marker on Tomato Yellow Leaf MutantGUO Ming, ZHANG He, LI Jing-fu*(College of Horticulture, Northeast Agricultural University, Harbin 150030, Heilongjiang, China) Abstract:A natural yellow leaf mutant named 06883, found in tomato(Lycopersicon esculentum Mill.)variety‘Zhongshu No.4’, can be inherited stably. Originally the leaves were green, but the first true leaf color turned into yellow during the period of four leave and one shoot. The fruits turned to red slowly, and became hard which is good for storage. The mutant was reciprocally crossed with tomato variety ‘Zhongshu No.4’, and the genetic analysis indicated that the mutant is nucleolus inheritance and controlled by one recessive gene. It can be used as a phonotypical marker to identify purity of F1 hybrids. We roughly mapped the mutant gene using SSR molecular markers. Three SSR markers LEaat006, LEtat002 and Tom196-197 were linked to the mutant gene. They were 8.9 cM, 16.3 cM and 18.7 cM apart from the mutant gene, respectively.Key words:Tomato; Yellow leaf mutant; Simple sequence repeat(SSR)marker; Molecular mapping叶色突变是自然界比较常见的一种突变,由于突变基因往往是直接或间接影响叶绿素的合成和降解,改变叶绿素含量,所以叶色突变体也称为叶绿素突变体(何冰 等,2006)。
一个新的黄瓜叶色黄化突变体的生理特性分析

一个新的黄瓜叶色黄化突变体的生理特性分析李万青;高波;杨俊;陈鹏;李玉红【摘要】叶色黄化突变体是开展光合系统的结构和功能、叶绿素生物合成及其调控机制研究的理想材料.以叶色黄化突变体(C528)及其野生型(CCMC)为材料,对其光合色素质量分数、光合作用指标和抗氧化酶活性进行研究,并初步调查突变体的农艺性状.结果表明,突变株C528从子叶期开始表现出叶片黄化,叶片的黄化性状不随发育而转变,其株高、茎粗等显著小于野生型;光合色素质量分数及净光合效率(Pn)显著低于野生型;通过对保护酶活性及丙二醛质量摩尔浓度等指标的测定,结果表明,SOD、POD和CAT活性及丙二醛(MDA)质量摩尔浓度均高于野生型.此研究结果可为阐明黄瓜叶色黄化突变机理及图位克隆突变基因提供基础资料.【期刊名称】《西北农业学报》【年(卷),期】2015(024)007【总页数】6页(P98-103)【关键词】黄瓜;叶色黄化突变体;光合特性;抗氧化酶活性;丙二醛质量摩尔浓度【作者】李万青;高波;杨俊;陈鹏;李玉红【作者单位】西北农林科技大学园艺学院,陕西杨凌712100;西北农林科技大学园艺学院,陕西杨凌712100;西北农林科技大学园艺学院,陕西杨凌712100;西北农林科技大学生命科学学院,陕西杨凌712100;西北农林科技大学园艺学院,陕西杨凌712100【正文语种】中文【中图分类】S642.2植物叶色变异是一种常见的突变性状,而叶色突变基因常常直接或间接影响叶绿素的合成与降解,从而改变叶绿素质量分数,所以植物叶色突变体有时也称为叶绿素突变体。
在育种工作中,叶绿素突变体可作为标记性状,在苗期剔除影响种子纯度的植株,不但能简化良种繁育过程也能够提高种子纯度;利用叶色突变体可选育优良的种质资源[1]。
在基础研究中,叶色突变体是开展植物光合作用机制、光形态建成、叶绿体结构功能与遗传发育调控机理等研究的理想材料[2-5],利用突变体对分析鉴定基因功能,了解基因间互作、基因表达调控等机制均具有重要理论意义。
两个水稻叶色突变体的鉴定和基因定位的开题报告

两个水稻叶色突变体的鉴定和基因定位的开题报告一、研究背景:水稻(Oryza sativa L.)是我国重要粮食作物之一,是我国主要的食品作物之一,也是世界上最重要的粮食作物之一。
随着人口的增加和生活水平的提高,对水稻的需求也在不断增加。
因此,提高水稻产量和品质,以满足人们需求,已成为目前水稻育种的主要研究方向之一。
水稻的叶色是水稻生长发育过程中的一个重要指标,也是水稻叶绿素合成和代谢的反应之一。
然而在育种过程中,有时会出现水稻叶色发生突变的情况,这可能对水稻的生长发育和产量产生负面影响。
因此,对水稻的叶色突变体进行鉴定和基因定位,对于深入了解水稻的叶色形成机理,提高水稻品质和产量具有重要意义。
二、研究目的:本研究旨在对两个水稻叶色突变体进行鉴定和基因定位,以研究其叶色形成机理和对水稻生长发育和产量的影响,为水稻育种提供理论依据和实践经验。
三、研究内容:1. 对两个水稻叶色突变体进行外观观察和鉴定,分析其叶绿素合成和代谢的差异;2. 利用基因组学、遗传学、生物化学等方法对这两个突变体的基因进行定位和功能鉴定,探究其叶色形成机理;3. 对比分析这两个突变体与野生型水稻在形态、植株生长和发育、生理生化特性、农艺性状等方面的异同;4. 在不同生态条件下对这两个突变体的生长发育和产量进行场试,验证其对水稻生长发育和产量的影响;5. 对这两个突变体的遗传育种利用进行探讨,为水稻育种提供理论依据和实践经验。
四、研究意义:1. 探究水稻叶色形成的机理,对水稻育种具有重要意义;2. 鉴定和基因定位水稻叶色突变体,可以为深入了解水稻叶色形成机理提供新的思路和方法;3. 研究水稻叶色突变体对水稻生长发育和产量的影响,可以为水稻育种提供理论基础和实践经验;4. 在育种过程中利用这两个突变体,可以加速水稻优异品种的选育和培育。
水稻叶色突变体研究进展

控 和分子机理等方 面系统综述 了水稻 叶色突变体 的研究进 展 , 并对 叶色突变体的应用前景 做 了进一 步分析 ,
旨在 为 深 入 研 究 水 稻 叶 色 突 变 体 提 供 参 考 。 关 键 词 : 稻 叶 色 突 变 体 ; 究 进 展 ; 用 前 景 水 研 应 中 图分 类 号 :S5 1 1 文 献标 志 码 :A
类很 多 , 主要 有 E 、 MS 乙烯亚 胺 、 亚硝 基 乙基 尿烷 等 烷化 剂 , 5一溴 一尿 嘧 啶 、 溴 去 氧 尿核 苷 、 5一 2一氨 基 一 嘌 呤等碱 基类 似 物及 有关 的化 合 物 , 重氮 丝氨 酸 、 丝裂 霉 素 c、 霉 黑 素等抗 生 素和 亚硝 酸 、 链 丫啶等其 他 种
第 1卷 第 3期 21 0 0年 9月
热 带 生 物 学 报
J oURNAL oF TRoP CAL oRGANI M S I S
V0 . . 1 1 No 3 Sp 2 0 e . 01
文 章 编 号 :6 4—75 (0 0 0 17 0 4 2 1 )3—0 6 2 9一l 3
20 7
热 带 生 物 学 报
21 0 0钲
素合成 途径 密切相 关 的解 藕联 突变 体 gn1gn2 gn3 gn4及 gn5 u ,u ,u ,u u 。 物理 、 化学 诱变 虽然 可 以快 速获 得较 广 的 突变谱 及 稳 定 的遗 传 与 多 位 点 的变 异 , 表 型 与基 因存 在 其 的相关性 也可通 过后 代杂 交试验 获 得 , 在 分 离基 因的过 程 中需 要 进 行 突变 体 遗 传 作 图 、 分 离 的 限制 但 共 性 片段多 态性分 析 , 以在 获得全 基 因组测 序信息 的基 础上进 行基 因功 能 的研 究 j 难 。
悬铃木黄化病的发生与防治

CATALOGUE 目录•悬铃木黄化病概述•悬铃木黄化病的病理特征•悬铃木黄化病的危害与影响•悬铃木黄化病的防治措施•悬铃木黄化病的防治效果与展望悬铃木黄化病概述悬铃木黄化病,又称悬铃木缺绿病、悬铃木萎黄病,是由病毒引起的叶片黄化、落叶的病害。
定义叶片出现黄色或黄白色斑驳,严重时叶片变褐、脱落,甚至导致植株死亡。
症状定义与症状悬铃木黄化病在世界各地均有分布,特别是在城市中的悬铃木栽培区,如欧洲、亚洲和北美洲等。
严重影响悬铃木的生长和观赏价值,对城市绿化和生态环境造成不利影响。
分布与危害危害分布悬铃木黄化病的病因目前尚不完全清楚,但研究显示可能与病毒有关。
病因可能与土壤贫瘠、缺乏营养、空气污染、水分失调等因素有关。
此外,植株密度过大、修剪不当等栽培管理措施也可能导致该病害的发生。
诱因病因与诱因征病原菌种类悬铃木黄化病的病原菌被鉴定为类菌原体(mycoplasma-like organism,MLO)。
病原菌特性这种病原菌是一种无细胞壁的微生物,具有与细菌相似的革兰氏染色阴性反应,但它们不属于细菌,而是属于一种被称为支原体(mycoplasma)的原核生物。
病原菌传播悬铃木黄化病病原菌主要通过嫁接、修剪等园艺操作进行传播。
病原菌鉴定叶片开始发黄,出现黄色斑点,树冠上部的新梢停止生长。
发病初期发病中期发病后期叶片黄化现象逐渐加重,叶片边缘开始萎缩,树冠下部和中部的新梢也开始萎缩。
整棵树都出现黄化现象,叶片萎缩严重,树冠生长停滞,最终导致树木死亡。
030201病理变化过程流行与传播悬铃木黄化病在欧洲、北美和亚洲的一些地区都有发生,通常在嫁接后的3-5年内出现症状,发病率和严重程度随着树龄的增加而增加。
传播途径悬铃木黄化病的病原菌主要通过嫁接、修剪等园艺操作进行传播。
此外,带病苗木的调运和灌溉水也是重要的传播途径。
影响黄化病会导致悬铃木的生长发育受阻,影响其正常生长速度和形态。
生长发育受阻黄化病使悬铃木对逆境条件的适应能力下降,如耐寒、耐旱等能力。
不同发育阶段红枫叶片呈色机制

黑龙江农业科学2024(5):63-69H e i l o n g j i a n g A gr i c u l t u r a l S c i e n c e s h t t p ://h l j n y k x .h a a s e p.c n D O I :10.11942/j.i s s n 1002-2767.2024.05.0063冯英辉,俞金礼,刘金文.不同发育阶段红枫叶片呈色机制[J ].黑龙江农业科学,2024(5):63-69.不同发育阶段红枫叶片呈色机制冯英辉,俞金礼,刘金文(温州大学生命与环境科学学院,浙江温州325035)摘要:为了探究红枫叶色变化的生理和分子机制,以不同发育阶段叶色差异显著的3种叶片为材料,利用生物化学和转录组学方法对叶色变化相关的生理指标和差异基因进行检测和分析㊂结果表明,不同发育阶段红枫叶片由红色发育为绿色过程中,叶片中的叶绿素含量㊁叶绿素合成前体A L A 与P B G 含量和类胡萝卜素含量呈上升趋势,而花色素苷含量㊁总酚和类黄酮含量显著下降;转录组数据显示不同发育阶段的红枫叶片存在6931个差异表达基因,花青素和类黄酮生物合成途径关键酶的编码基因C H S ㊁A N S ㊁C H I ㊁HHT ㊁F 3'H ㊁F L S ㊁A R T 在红色叶片中上调表达,两个MY B 转录因子基因(M Y B 2和M Y B 113)和两个蛋白激酶基因(T MK 1和R U L 1)在红色叶片中上调表达㊂本研究初步阐明了不同发育阶段红枫叶色差异的生理特征,鉴定了花青素合成途径相关的结构基因和调控基因,为进一步研究红枫叶色变化的分子机制提供了丰富的遗传信息㊂关键词:红枫;花色素苷;转录组;叶色收稿日期:2023-12-18基金项目:浙江省自然科学基金(L Y 20C 160010)㊂第一作者:冯英辉(1998-),男,硕士研究生,从事植物分子遗传学研究㊂E -m a i l :2374120701@w z u .e d u .c n ㊂通信作者:刘金文(1977-),男,博士,硕导,从事植物分子遗传学研究㊂E -m a i l :l jw@w z u .e d u .c n ㊂ 红枫(A c e r p a l m a t u m A t r o p u r p u r e u m )是槭树科槭属鸡爪槭的一个品种,是一种重要的园林绿化树种,具有丰富多彩的叶色和较高的观赏价值,国内主要分布在东北㊁西北和华南等地区㊂红枫叶片在不同发育阶段呈现红色㊁紫色和绿色等多彩的叶色变化,因其具有抗逆性㊁适应性和较高的观赏价值,被广泛用作园林绿化彩叶树种[1]㊂叶色是观赏植物最重要的特征之一,植物的叶色多态性是由多种色素含量的不同组合决定的,如叶绿素㊁类胡萝卜素和花青素等协同决定植物组织颜色[2]㊂已有研究人员对叶片的色素种类㊁色素含量和比例㊁色素关键酶活性等生理指标进行了测定和分析,证明了彩叶植物的叶色变化与这些指标密切相关[3-6]㊂近年来,高通量基因组测序技术已被广泛用于研究各种植物叶片颜色变化的分子机制[7-8]㊂花青素在植物叶片着色中起到关键作用,花青素生物合成途径是苯丙烷类生物合成的重要途径之一㊂已有研究证实,苯丙烷类生物合成的许多结构基因如C H S ㊁A N S ㊁A N R ㊁F 3'H ㊁C H I ㊁F 3H 等和一些调控基因如M Y B ㊁b H L H 和WD 40等协同调控植物的叶色多彩表型[9]㊂目前,已有一些槭树科的植物叶色变化的生理机制和决定叶色变化的基因被报道[10-13]㊂但槭树属红枫等彩叶植物叶色变化的生理特征和控制花青素生物合成的关键基因尚不清楚㊂因此,本研究以不同发育阶段的红枫叶片为研究对象,分析不同颜色叶片的叶绿素㊁类胡萝卜素㊁花色素苷㊁总酚㊁类黄酮含量㊁色素合成前体胆色素原(P B G )和5-氨基酮戊氨酸(A L A )含量,同时利用转录组学(R N A -s e q )技术鉴定不同颜色叶片参与调控叶色变化的差异表达基因(D E G ),以期初步理解不同发育阶段红枫叶色变化的生理机制和筛选调控叶色变化的关键基因,以期为红枫等彩叶植物的基因工程育种奠定理论基础㊂1 材料与方法1.1 试验地概况试验用红枫取自浙江省温州市瓯海区茶山高教园区温州大学校园内(27ʎ55'26ᵡN ,120ʎ41'30ᵡE)㊂1.2 材料供试材料取自2022年4月8日发育初期红色叶片(A p -R )㊁6月10日发育中期红绿混色叶片(A p -M )和8月18日成熟期绿色叶片(A p-G ),3个时期叶片取样3次重复,液氮速冻后保存于-80ħ冰箱备用㊂1.3 方法1.3.1 叶绿素和类胡萝卜素含量提取测定 称取0.025g 叶片,剪碎后利用无水乙醇和80%丙36黑 龙 江 农 业 科 学5期酮1ʒ1混合液溶解提取,放置于30ħ恒温箱中震摇至叶片无色,离心取上清待测㊂利用分光光度计测定440,645和663n m 吸光度(D )㊂每个处理3次重复㊂计算叶绿素和类胡萝卜素含量,公式参考陈继卫等[4]的方法㊂1.3.2 P B G 和A L A 含量测定 根据试剂盒(Z K -7843和Z K -7842,上海臻科)使用说明操作,称取0.1g 叶片,在900μL 的1ˑP B S 溶液中冰上研磨匀浆,4ħ下3000g 离心20m i n ,取上清待测㊂加样反应,测定450n m 的吸光度(D ),标准曲线计算分析P B G 和A L A 含量㊂每个处理3次重复㊂1.3.3 花色素苷、总酚与类黄酮含量测定 称取0.025g 叶片,加入5m L 0.1%的0.1m o l ㊃L-1盐酸,32ħ摇床震荡提取,12000r ㊃m i n -1,离心10m i n,取上清测530,320和280n m 的吸光度,利用公式计算花色素苷㊁总酚和类黄酮含量㊂每个处理3次重复㊂计算花色素苷㊁类黄酮和总酚含量,公式参考罗安才等[10]的方法㊂1.3.4 转录组学检测及差异基因的定量分析 提取叶片组织总R N A ,反转录后利用I l l u m i n aH i s c qT M4000进行测序㊂以漾濞槭(A c e r y a n gb i e n s e )为参考转录组[14],使用F P KM 法计算基因的表达量㊂采用D E S e q2进行差异基因分析,筛选阈值为p a d j <0.05且|l o g 2Fo l d C h a n g e |>1的差异基因(D E G )进行分析㊂差异基因的半定量和荧光定量分析采用L i u 等[15]方法㊂试验结果统计采用相对定量方法,用2-ΔΔC t 方法对q P C R 的结果进行分析㊂1.3.5 统计分析 采用S P S S 20软件统计分析,数据以平均值ʃ标准偏差(M e a n ʃS D )表示,P <0.05为差异显著㊂2 结果与分析2.1 不同发育阶段红枫叶色表型和光合色素含量变化红枫在不同发育阶段叶片呈现不同颜色,发育初期的叶片(A p -R )为红色㊁发育中期的(A p-M )叶片为红绿混合色㊁成熟期的叶片(A p-G )为绿色(图1A )㊂分析3种叶片的叶绿素和类胡萝卜素含量变化,发现在红枫叶色由红转绿过程中,总叶绿素㊁叶绿素a ㊁叶绿素b 和类胡萝卜素含量呈现逐渐显著上升的趋势,绿色叶片的总叶绿素含量和类胡萝卜素含量分别是红色叶片含量的4.1倍和3.3倍,符合表型变化特征(图1B ㊁C )㊂A.不同发育阶段红枫叶色;A p -R.发育初期的红色叶片;A p-M.发育中期混色叶片;A p-G.成熟期绿色叶片;B .不同发育阶段叶绿素含量;C .不同发育阶段类胡萝卜素含量㊂图1 不同发育阶段红枫叶片叶色与光合色素含量变化注:图中不同小写字母表示处理间在P <0.05水平差异显著㊂下同㊂465期 冯英辉等:不同发育阶段红枫叶片呈色机制2.2 不同发育阶段红枫叶片花色素苷㊁总酚以及类黄酮含量变化由图2可知,不同发育阶段红枫3种叶片花色素苷㊁总酚和类黄酮含量均在红色叶片(A p-R )中含量最高,分别为1.928m g ㊃g -1㊁7.784m g ㊃g -1和9.768m g ㊃g -1,在绿色叶片(A p-G )中含量最低,分别为0.192m g ㊃g -1㊁1.844m g ㊃g -1和3.976m g ㊃g -1,且红色显著高于绿色㊂图2 不同发育阶段红枫叶片花色素苷(A )㊁总酚(B )和类黄酮(C )含量变化2.3 不同发育阶段红枫叶片色素合成前体含量变化 由图3A 可知,3种叶片中色素合成前体A L A 的含量在红枫叶色由红转绿过程中,呈现上升趋势,红色叶片(A p-R )中的含量最低,为0.806μg ㊃g -1,绿色叶片(A p-G )中含量最高,达到了0.951μg ㊃g -1,且两者差异显著㊂内源P B G 含量也随叶片由红转绿呈现逐渐上升的趋势,红色叶片中的含量为1.319μg ㊃g -1,绿色叶片中含量达到了1.866μg ㊃g -1,两者差异显著(图3B )㊂图3 不同发育阶段红枫叶片A L A (A )和P B G (B )含量变化2.4 不同发育阶段红枫叶片花青素生物合成途径结构基因的差异表达分析为了从全基因组水平研究不同发育阶段红枫叶片叶色变化的分子基础,采用R N A -S e q 技术分析了三类叶片的基因组,共获得59.21G b 数据,采用D E S e q 2进行差异表达基因(D E G )分析发现A p -R 与A p -G 存在5804个差异基因,A p -R 与A p -M 存在6350个差异基因,3种颜色叶片共存在6931个差异基因㊂为了进一步发掘和鉴定影响红枫叶色变化的关键基因,从转录组差异表达基因筛选出代表性的花青素生物合成途径基因和类黄酮合成相关的关键基因(表1):查尔酮合成酶(C H S )㊁查尔酮异构酶(C H I )㊁类黄酮3'-羟化酶(F 3'H )㊁花青素合成酶(A N S )㊁黄烷酮3-羟56黑 龙 江 农 业 科 学5期化酶(F L S )㊁花青素鼠李糖基转移酶(A R T )和ω-羟基酸-羟基肉桂酰转移酶(HHT )进行了半定量和荧光定量P C R 分析,结果如图4所示,不同发育阶段红枫叶片叶色变化过程中,红枫发育初期红色叶片(A p-R )中的这些与花青素/类黄酮合成相关的关键基因表达量显著高于成熟期的绿色叶片(A p-G ),半定量结果(图4A )和荧光定量结果(图4B )均与转录组结果一致㊂表不同发育阶段红枫叶片花青素和类黄酮合成途径基因图4 不同发育阶段红枫叶片花青素和类黄酮关键基因的表达变化2.5 不同发育阶段红枫叶片叶色变化调控基因的表达分析不同发育阶段红枫叶片的转录组分析发现了两个MY B 转录因子,M Y B 2㊁M Y B 113在红枫发育初期红色叶片高表达㊂另外,不同发育阶段红枫叶片的转录组也鉴定到了两个蛋白激酶基因,植物类受体蛋白激酶基因(TMK 1)和富含亮氨酸重复序列的类受体激酶基因(R U L 1),在红枫发育初期红色叶片有较高表达㊂采用半定量和荧光定量方法分析这4个调控基因在不同发育阶段红枫叶片的表达情况,结果如图5所示,4个基因的表达情况与转录组分析的结果一致,均在发育初期红色叶片高表达,表明鉴定到的两个M Y B 转录因子和两个激酶可能参与红枫叶色变化的调控㊂图5 不同发育阶段红枫叶片叶色调控基因的表达变化665期 冯英辉等:不同发育阶段红枫叶片呈色机制3 讨论3.1 不同发育阶段红枫叶色变化的生理特征叶色是园林植物育种的重要性状,是遗传和环境共同作用的结果[16]㊂植物叶片中的色素含量㊁组分及分布的变化是叶色差异的重要原因,叶绿素㊁类胡萝卜素以及花青素这三大植物色素共同作用使得植物叶片呈现出多种色彩[5]㊂叶绿素是植物和藻类进行光合作用的重要物质,也是植物绿色表型的主要决定因素[17]㊂一般情况下,彩叶植物叶片的叶绿素含量往往低于绿色叶片㊂如金陵黄枫黄色叶片的叶绿素含量远低于鸡爪槭[18];细叶鸡爪槭的叶绿素总含量在不同月份的总是高于紫红叶鸡爪槭[10];黄绿叶㊁浅绿叶㊁深绿叶和紫绿叶胡萝卜突变体的总叶绿素含量极显著高于黄叶和紫叶胡萝卜突变体[19]㊂本研究结果表明,不同发育阶段的红枫随着叶色逐渐变绿,叶绿素含量亦逐渐升高,达到显著差异水平(P <0.05)㊂已知植物内源性A L A 和P B G 是叶绿素合成的前体和中间体[10],在15种酶的作用下经过多个催化途径形成叶绿素,途径中的前体物质和中间物含量的变化会影响叶绿素的积累[16]㊂本研究测定了不同发育阶段红枫叶片叶绿素合成前体物质A L A 和中间体P B G ,发现两者的含量与红枫叶片叶绿素的含量呈正相关,A L A 和P B G 含量越高,叶片越绿,这与前人的结果一致[10]㊂植物中的类胡萝卜素决定黄色到红色的变化,花青素决定红色到紫色的变化,两者与叶绿素协同调节植物组织的颜色[20]㊂如银杏黄叶突变体的类胡萝卜素含量高于绿色叶片[21];金陵丹枫红色叶片的类胡萝卜素含量高于金陵黄枫[11];紫薯的块根积累的花青素含量大于红薯块根[22];紫叶胡萝卜突变体的花色素苷含量显著高于野生型绿色胡萝卜叶片[19]㊂本研究结果也显示,红枫发育初期的红色嫩叶的类胡萝卜素和花色素苷含量均显著高于成熟期的绿色叶片,与前人研究结果相同㊂已有研究报道,胡萝卜和银杏存在的酚类物质㊁类黄酮和花色素苷等植物次生代谢产物,这些物质与叶色发育相关[19,23]㊂另外,花色素苷可以在多酚氧化酶的作用下降解成酚类物质,总酚㊁类黄酮的含量对叶色的影响与花色素苷含量对叶色的影响具有一致性[24]㊂本研究结果表明,在不同发育阶段红枫的叶色变化过程中,类黄酮和总酚的含量与花青素的含量具有正相关性,均在红枫发育初期红色叶片中含量最高㊂3.2 不同发育阶段红枫叶色变化的分子特征转录组测序技术已被用于研究植物叶色的形成[9]㊁蔬菜与花的颜色变化[25-26]和果实的发育[27]等代谢和发育过程㊂最近,槭属植物漾濞槭的基因组解析,为分子水平研究槭属的其他物种奠定了坚实的遗传学信息基础[14]㊂花青素/类黄酮是决定植物器官颜色的最重要的植物色素之一,植物花青素含量被证明与花青素生物合成途径中编码结构酶的关键基因的差异表达有关[7-9]㊂已有研究证实,植物体内广泛存在的一些转录因子如MY B ㊁b H L H 和WD 40等调控叶色的变化[28]㊂如花青素生物合成中的一些关键结构基因如P A L ㊁C H S ㊁C H I ㊁F 3'H ㊁D F R ㊁A N S ㊁F L S 和U F G T 已经在茶树㊁枣和瓜叶菊等植物中被鉴定[29-31]㊂C H S 负责催化4-香豆酰辅酶A 产生柚配基查尔酮,之后在C H I 的作用下产生黄烷酮,在F L S 催化下形成黄酮醇[19]㊂F 3'H 催化二氢山奈酚生成二氢槲皮素,然后在A N S 催化下生成有色花青素[32]㊂本研究的转录组分析鉴定了不同发育阶段3种颜色差异的红枫叶片共存在6931个差异基因,R N A -S e q 数据发现花青素生物合成途径的两个C H S ㊁两个C H I 以及F 3'H ㊁A N S 和F L S 共7个基因在红色叶片中上调表达,荧光定量P C R 结果也揭示了同样的表达趋势,这与牡丹(P a e o n i a qi u i )花色变化的研究结果一致[33]㊂已有研究显示花青素生物合成途径中产物的糖基化修饰可以增强花青素的稳定性和水溶性[34]㊂本研究的转录组分析鉴定到了一个花青素鼠李糖基转移酶(A R T )在红色叶片高表达,表明糖基化修饰可能参与不同发育阶段红枫叶片的颜色变化㊂另外,有研究显示HHT 是苯丙烷生物合成的关键酶,其可能在砂梨果实的褐色/绿色性状的形成中起作用[35],本研究也鉴定到了一个在红色叶片高表达的HHT 基因,其可能是影响叶色变化的关键基因㊂花青素/类黄酮的生物合成除了与结构基因的变化相关,还受到多种转录因子的调节,如MY B ㊁b H L H ㊁WD 40和WR K Y [16]㊂MY B 是植物花青素生物合成的核心转录因子,能与b H L H 和WD 40相互作用,形成MY B -b H L H -WD 40调控复合体,以进一步诱导花青素在植物中的生物合成和积累[36]㊂在本研究中,红枫的M Y B 2和M Y B 113在红色嫩叶中高表达,它们可能是红枫发育初期红色叶中花青素积累的关键调节因子,76黑 龙 江 农 业 科 学5期正向调控花青素合成基因的表达㊂磷酸化是蛋白质翻译后修饰中最为常见的类型之一,已有一些报道证实磷酸化调控植物花色素苷的生物合成㊂如拟南芥(A r a b i d o ps i s t h a l i a n a )的M P K 4介导MY B 75的磷酸化影响花青素的积累[37],苹果(M a l u s p u m i l a M i l l .)的M d M P K 4响应光诱导被激活,磷酸化修饰苹果M d MY B 1以增加其稳定性,从而促进果实花青素的积累[38]㊂本研究在不同发育阶段的红枫叶片转录组中鉴定了两个激酶基因TMK 1和R U L 1,可能参与叶片花青素的变化㊂然而,蛋白质磷酸化在红枫叶片花青素积累中的作用机制仍需进一步通过遗传学手段证实㊂4 结论不同发育阶段红枫叶片由红色发育为绿色过程中,叶片中的叶绿素含量㊁叶绿素合成前体A L A 与P B G 含量和类胡萝卜素含量呈上升趋势,而花色素苷含量㊁总酚和类黄酮含量显著下降;转录组数据显示不同发育阶段的红枫叶片存在6931个差异表达基因,花青素和类黄酮生物合成途径关键酶的7个编码基因C H S ㊁A N S ㊁C H I ㊁HHT ㊁F 3'H ㊁F L S ㊁A R T 在红色叶片中上调表达㊂同时发现两个M Y B 转录因子基因(M Y B 2和M Y B 113)和两个蛋白激酶基因(TMK 1和R U L 1)在红色叶片中上调表达㊂说明,不同发育阶段红枫叶片颜色的变化由植物色素如叶绿素㊁花色素苷和类胡萝卜素与植物次生代谢产物酚类物质共同决定,关键的色素合成前体物质A L A 和P B G 参与叶片颜色的转变㊂花青素/类黄酮生物合成途径基因和可能调控该途径的相关转录因子及可能的蛋白质翻译后修饰协同在分子水平调控相关色素的含量,进而使叶片呈现不同的颜色㊂参考文献:[1] 丁婷,方志慧,唐婧婧,等.红枫栽培技术及园林实践分析[J ].现代园艺,2020,43(23):109-110.[2] L IX ,L IY ,Z HA O M H ,e t a l .M o l e c u l a r a n dm e t a b o l i c i n s i g h t s i n t o a n t h o c y a n i nb i o s y n t h e s i s f o r l e a f c o l o r c h a n ge i n c h o k e c h e r r y (P a d u s v i r gi n i a n a )[J ].I n t e r n a t i o n a l J o u r n a l o f M o l e c u l a r S c i e n c e s ,2021,22(19):10697.[3] MA R I ËN B ,B A L Z A R O L O M ,D O XI ,e ta l .D e t e c t i n gt h eo n s e to fa u t u m nl e a fs e n e s c e n c ei n d e c i d u o u sf o r e s tt r e e so ft h et e m p e r a t ez o n e [J ].T h e N e w P h y t o l o gi s t ,2019,224(1):166-176.[4] 陈继卫,沈朝栋,贾玉芳,等.红枫秋冬转色期叶色变化的生理特性[J ].浙江大学学报(农业与生命科学版),2010,36(2):181-186.[5] 徐明远,何鹏,赖伟,等.植物叶色变异分子机制研究进展[J ].分子植物育种,2021,19(10):3448-3455.[6] 李利霞.鸡爪槭叶色变化机制的研究[D ].重庆:重庆师范大学,2015.[7] 王玉书,王欢,范震宇,等.基于转录组测序的羽衣甘蓝叶色相关基因分析[J ].基因组学与应用生物学,2020,39(1):200-206.[8] J I A N G Y ,WA N G Q ,S H E N Q Q ,e ta l .T r a n s c r i pt o m e a n a l y s i s r e v e a l s g e n e s a s s o c i a t e dw i t h l e a f c o l o rm u t a n t s i n C y m b i d i u ml o n gi b r a c t e a t u m [J ].T r e e G e n e t i c s &G e n o m e s ,2020,16(3):44.[9] G A OYF ,Z H A ODH ,Z H A N G JQ ,e t a l .D e n o v o t r a n s c r i pt o m e s e q u e n c i n g a n da n t h o c y a n i nm e t a b o l i t e a n a l ys i s r e v e a l s l e a f c o l o r o f A c e r p s e u d o s i e b o l d i a n u m i n a u t u m n [J ].B M CG e n o m i c s ,2021,22(1):383.[10] 罗安才,阎晓灵,李利霞,等.鸡爪槭叶色变化机制研究[J ].江苏农业科学,2018,46(22):118-122.[11] 朱璐,闻婧,马秋月,等.鸡爪槭金陵丹枫和金陵黄枫叶片呈色分析[J ].江苏农业学报,2022,38(2):521-527.[12] 梁俊林,张晓蓉,唐实玉,等.光照强度对鸡爪槭叶色变化生理的影响[J ].应用与环境生物学报,2020,26(3):597-602.[13] 楚爱香,张要战,王萌萌.四种槭树属(A c e r )植物秋色叶变化与色素含量和可溶性糖的关系[J ].江西农业大学学报,2013,35(1):108-111,137.[14] Y A N GJ ,W A R I S S H M ,T A O LD ,e t a l .D en o v o g e n o m ea s s e mb l y o f t h ee n d a n g e r e d Ac e r y a n g b i e n s e ,a p l a n ts p e c i e s w i t h e x t r e m e l y s m a l l p o pu l a t i o n s e n d e m i c t o Y u n n a n P r o v i n c e ,C h i n a [J ].G i g a S c i e n c e ,2019,8(7):gi z 085.[15] L I UJ W ,Z H O U W B ,L I U G F ,e t a l .T h ec o n s e r v e de n d o r i b o n u c l e a s e Y b e Y i sr e q u i r e df o rc h l o r o p l a s tr i b o s o m a l R N A p r o c e s s i ng i n A r a b i d o p s i s [J ].P l a n tPh y si o l o g y ,2015,168(1):205-221.[16] 张磊,曹德美,胡建军.植物叶色形成调控机制研究进展[J ].植物遗传资源学报,2021,22(2):293-303.[17] 赵宇璇,刘真真,常双锋,等.胡萝卜叶色突变体叶色参数和色素含量及其相关性分析[J ].江苏农业科学,2022,50(4):100-104.[18] 刘伟,王俊燚,李萌,等.基于转录组测序的银杏类黄酮生物合成关键基因表达分析[J ].中草药,2018,49(23):5633-5639.[19] C H E NZ ,L U X Y ,X U A N Y ,e t a l .T r a n s c r i p t o m ea n a l ys i s b a s e do nac o m b i n a t i o no fs e q u e n c i n gpl a t f o r m s p r o v i d e s i n s i g h t s i n t o l e a f p i g m e n t a t i o n i n A c e r r u b r u m [J ].B M C P l a n tB i o l o g y,2019,19(1):240.[20] Z HA N G Q ,WA N GLL ,L I UZG ,e t a l .T r a n s c r i pt o m e a n dm e t a b o l o m e p r o f i l i n g u n v e i l t h e m e c h a n i s m so f Z i z i ph u s j u ju b a M i l l .p e e l c o l o r a t i o n [J ].F o o dC h e m i s t r y ,2020,312:125903.[21] L IW X ,Y A N GSB ,L UZG ,e t a l .C y t o l o g i c a l ,p h y s i o l o gi c a l ,a n dt r a n s c r i p t o m i ca n a l y s e so f g o l d e nl e a fc o l o r a t i o ni n G i n k g o b i l o b a L .[J ].H o r t i c u l t u r eR e s e a r c h ,2018,5:12.[22] MA N O H ,O G A S AWA R A F ,S A T O K ,e t a l .I s o l a t i o no f ar e g u l a t o r yg e n eo fa n t h o c y a n i nb i o s yn t h e s i si nt u b e r o u s 865期 冯英辉等:不同发育阶段红枫叶片呈色机制r o o t so f p u r p l e -f l e s h e ds w e e t p o t a t o [J ].P l a n tP h y s i o l o g y ,2007,143(3):1252-1268.[23] MA S U D A T ,F U J I T A Y.R e gu l a t i o na n de v o l u t i o n o f c h l o r o p h yl lm e t a b o l i s m [J ].P h o t o c h e m i c a l &P h o t o b i o -l o g i c a l S c i e n c e s :O f f i c i a l J o u r n a lo f t h eE u r o p e a nP h o t o -c h e m i s t r y A s s o c i a t i o n a n d t h e E u r o p e a n S o c i e t y f o r P h o t o -b i o l o g y,2008,7(10):1131-1149.[24] 崔舜,邱国金,吴茜,等.彩叶紫薇新品种红火球与仑山1号的叶色及生理变化特性[J ].贵州农业科学,2020,48(9):16-21.[25] K O D A M A M ,B R I N C H -P E D E R S E N H ,S H A R M AS ,e t a l .I d e n t i f i c a t i o n o ft r a n s c r i p t i o n f a c t o r g e n e si n v o l v e d i n a n t h o c y a n i nb i o s y n t h e s i s i nc a r r o t (D a u c u s c a r o t a L .)u s i n gR N A -S e q [J ].B M CG e n o m i c s ,2018,19(1):811.[26] Q U Y ,O UZ ,Y A N GFS ,e t a l .T h e s t u d y o f t r a n s c r i pt o m e s e q u e n c i n g f o r f l o w e r c o l o r a t i o n i nd i f f e r e n t a n t h e s i s s t a ge s of a l p i n eo r n a m e n t a lh e r b (M e c o n o p s i s L i ngh o l m )[J ].G e n e ,2019,689:220-226.[27] S H I LY ,C H E NX ,C H E N W ,e t a l .C o m p a r a t i v e t r a n s c r i pt o m i c a n a l y s i s o f w h i t e a n d r e d C h i n e s e b a y b e r r y (M y r i c a r u b r a )f r u i t s r e v e a l s f l a v o n o i db i o s y n t h e s i s r e g u l a t i o n [J ].S c i e n t i aH o r t i c u l t u r a e ,2018,235:9-20.[28] L I SS ,L IQZ ,T A N GL ,e t a l .P i g m e n t c o m pa r i s o n a n d e x p r e s s i o no f c h l o r o p h y l lm e t ab o l i s m g e n e s i n y e l l o wa n d gr e e n A c e r p a l m a t u m l e a v e s [J ].C a n a d i a n J o u r n a lo f P l a n t S c i e n c e ,2017:C J P S -2016-0307.[29] 蒋会兵,夏丽飞,田易萍,等.基于转录组测序的紫芽茶树花青素合成相关基因分析[J ].植物遗传资源学报,2018,19(5):967-978.[30] L I SP ,D E N GBL ,T I A NS ,e t a l .M e t a b o l i c a n d t r a n s -c r i p t o m i c a n a l y s e s r e v e a ld i f fe r e n tm e t a b o l i t eb i o s yn t h e s i s p r o f i l e s b e t w e e n l e a fb u d sa n d m a t u r e l e a v e s i n Z i z i ph u s j u j u b a M i l l [J ].F o o dC h e m i s t r y ,2021,347:129005.[31] L UCF ,L IYJ ,C U IY M ,e t a l .I s o l a t i o n a n d f u n c t i o n a la n a l y s i so f g e n e si n v o l v e di n p o l y a c y l a t e d a n t h o c y a n i nb i o s yn t h e s i s i n b l u e S e n e c i o c r u e n t u s [J ].F r o n t i e r s i nP l a n t S c i e n c e ,2021,12:640746.[32] WA NLY ,L E IY ,Y A NL Y ,e t a l .T r a n s c r i pt o m e a n d m e t a b o l o m er e v e a lr e d i r e c t i o n o ff l a v o n o i d si n a w h i t et e s t a p e a n u t m u t a n t [J ].B M C P l a n tB i o l o g y ,2020,20(1):161.[33] L U OJR ,D U A N JJ ,HU O D ,e ta l .T r a n s c r i pt o m i c a n a l y s i s r e v e a l s t r a n s c r i p t i o n f a c t o r s r e l a t e d t o l e a f a n t h o c y a n i n b i o s y n t h e s i si n P a e o n i a q i u i [J ].M o l e c u l e s ,2017,22(12):2186.[34] 闫雅如,齐博文,莫婷,等.鼠李糖基转移酶研究进展[J ].有机化学,2018,38(9):2281-2295.[35] 吕照清,任丹丹,周贺,等. 黄花 梨及其芽变 绿黄花 梨HHT 基因克隆与表达分析[J ].西北植物学报,2016,36(6):1105-1109.[36] B E A L ES I .G r e e n g e n e s g l e a n e d [J ].T r e n d s i nP l a n t S c i e n c e ,2005,10(7):309-312.[37] L I SN ,W A N G W Y ,G A OJ L ,e t a l .M Y B 75p h o s p h o r yl a t i o n b y M P K 4i s r e q u i r e d f o r l i g h t -i n d u c e d a n t h o c ya n i n a c c u m u l a t i o n i n A r ab i d o p s i s [J ].T h e P l a n t C e l l ,2016,28(11):2866-2883.[38] Y A N G T ,MA H Y ,L IY ,e t a l .A p pl eM P K 4m e d i a t e s p h o s p h o r y l a t i o no fMY B 1t oe n h a n c e l i gh t -i n d u c e da n t h o -c ya n i na c c u m u l a t i o n [J ].T h eP l a n t J o u r n a l :f o rC e l l a n d M o l e c u l a rB i o l o g y,2021,106(6):1728-1745.M e c h a n i s mo fL e a fC o l o rC h a n ge i n R e dM a p l e a tD if f e r e n tD e v e l o p m e n t S t a ge s F E N GY i n gh u i ,Y UJ i n l i ,L I UJ i n w e n (C o l l e g e o fL i f e a n dE n v i r o n m e n t a l S c i e n c e ,W e n z h o uU n i v e r s i t y,W e n z h o u325035,C h i n a )A b s t r a c t :I no r d e r t oe x p l o r et h e p h y s i o l o g i c a l a n d m o l e c u l a rm e c h a n i s m so f l e a fc o l o rc h a n g e i nr e d m a pl e ,t h r e e c o l o r t y p e so f l e a v e sw i t hs i g n i f i c a n td i f f e r e n c e sa td i f f e r e n td e v e l o p m e n t a l s t a g e sw e r eu s e da se x p e r i m e n t a l m a t e r i a l s a n db i o c h e m i c a l a n d t r a n s c r i p t o m e s e q u e n c i n g a n a l y s i sw e r e c a r r i e d o u t t o c l a r i f y a n d a n a l y z e p h y s i o l o gi c a l c h a r a c t e r i s t i c s a n dd i f f e r e n t i a l g e n e s r e l a t e d t o l e a f c o l o r c h a n g e s .T h e r e s u l t s s h o w e d t h a t t h e c h l o r o p h y l l c o n t e n t ,c h l o r o p h y l l s y n t h e s i s p r e c u r s o r A L A a n d P B G c o n t e n t ,a n dc a r o t e n o i dc o n t e n ts i g n i f i c a n t l y in c r e a s e da n d a n t h o c y a n i nc o n t e n t ,t o t a l p h e n o la n d f l a v o n o i d c o n t e n ts i g n i f i c a n t l y d e c r e a s e d .T r a n s c r i p t o m e a n a l y s i s s h o w e d t h a t t h e r ew e r e 6931d i f f e r e n t i a l l y e x p r e s s e d g e n e s i n r e dm a p l e l e a v e s a t d i f f e r e n t d e v e l o p m e n t a l s t a ge s .T h e s t r u c t u r a l g e n e s C H S ,A N S ,C H I ,HHT ,F 3'H ,F L S ,a n d A R T ,w h i c h w e r ek e y e n z ym e s i nt h e a n t h o c y a n i nb i o s y n t h e s i s p a t h w a y ,w e r eh i g h l y e x p r e s s e d i nt h e r e d l e a v e s .T w o g e n so fMY Bt r a n s c r i pt i o n f a c t o r s (M Y B 2a n d M Y B 113)a n d t w o g e n so f p r o t e i nk i n a s e s (T MK 1a n d R U L 1)w e r eh i g h l y e x p r e s s e d i n t h e r e d l e a v e s .T h e s t u d yp r e l i m i n a r i l y e l u c i d a t e d t h e p h y s i o l o g i c a l c h a r a c t e r i s t i c s o f l e a f c o l o r d i f f e r e n c e s a n d i d e n t i f i e d s t r u c t u r a l a n d r e g u l a t o r yg e n e s r e l a t e dt oa n t h o c y a n i ns y n t h e s i s p a t h w a y s i nr e d m a pl ea td i f f e r e n t d e v e l o p m e n t a l s t a ge s ,w h i c hw i l l p r o v i d e r i c h g e n e t i c i nf o r m a t i o n f o r f u r t h e r r e s e a r c ho n t h em o l e c u l a rm e c h a n i s m s o f l e a f c o l o r c h a ng e s i n r e dm a pl e .K e yw o r d s :A c e r p a l m a t u m A t r o p u r p u r e u m ;a n t h o c y a n i n s ;t r a n s c r i p t o m e ;l e a f c o l o r 96。
菊花黄化突变体初步研究

菊花黄化突变体初步研究卢珍红;莫锡君;蒋亚莲;余蓉培;周旭红;田敏;杨晓;桂敏【摘要】The photosynthetic pigment content and de novo RNA-Seq were investigated in leaf-color mutant and normal plant of Dendranthema morifolium'Xiaguang Feiyue'.The results showed that the photosynthetic pigment content had decreased greatly of mutant plants,only about 18 percent of normal plants,but the Chl a/b observably increased in mutant plant.We generated 4.75 Gb and 4.96 Gb clean datum from the mutant and normal plant leaves using transcriptome sequencing,respectively.De novo assembly yielded 105 456 unigenes with 15 493 of length greater than 1 kb,1 556 bp of N50.For unigenes expression analysis,we got 3 762 differentially expressed genes (DEGs),and obtained 2 741 annotations by functional annotation of the ing GO and KEGG enrichment analyses,and qPCR verification,results indicated that forming reason of the chlorina mutant of D.morifolium 'Xiaguang Feiyue'may be expressed at low level of dmGLK2 and dmGLK1 not expressed cause chloroplast development and division blocked,chloroplast number is greatly reduced in leaf cells,thus the content of chlorophyll is overall declined.And the study will supply meaning information to the future studies on leaf-color mutants and directional breeding of D.morifolium.%以菊花‘霞光飞跃’叶色突变体和正常植株为试验材料,对其叶绿素含量进行测定,并进行无参转录组测序分析.结果表明:突变体与正常植株相比,叶绿素含量有较大幅度的下降,仅为正常植株的18%左右,叶绿素a/b比值(Chl a/b)显著升高.利用转录组测序技术分别从突变体与正常植株叶片中获得4.75 Gb和4.96 Gb有效数据(Clean Data),de novo组装后得到105 456条通用基因(Unigenes),其中长度大于1 kb的有15 493条,N50为1556 bp.对Unigenes表达分析,共获得3 762条差异表达基因(DEGs).对得到的DEGs进行生物学功能性注释,获得总注释信息为2741.通过对注释信息进行GO和KEGG富集分析,结合定量PCR验证表明,菊花‘霞光飞跃’叶色突变体形成的原因可能是dmGLK2低水平表达和dmGLK1不表达导致叶绿体合成和分裂受阻,叶片细胞内叶绿体数量大大降低,进而叶绿素含量下降.【期刊名称】《西南林业大学学报》【年(卷),期】2017(037)002【总页数】9页(P60-68)【关键词】菊花;突变体;无参转录组测序;差异基因【作者】卢珍红;莫锡君;蒋亚莲;余蓉培;周旭红;田敏;杨晓;桂敏【作者单位】云南省农业科学院花卉研究所,云南昆明650100;云南省农业科学院花卉研究所,云南昆明650100;云南省农业科学院花卉研究所,云南昆明650100;云南省农业科学院花卉研究所,云南昆明650100;云南省农业科学院花卉研究所,云南昆明650100;云南省农业科学院花卉研究所,云南昆明650100;云南丰岛花卉有限公司,云南昆明650100;云南省农业科学院花卉研究所,云南昆明650100【正文语种】中文【中图分类】S722.3叶色变异是高等植物中常见的可以自然发生的性状变异,普遍存在于各种植物中,运用理化诱变和组织培养等方式更易诱发叶色变异,获得叶色突变体[1]。
2020年中国植物科学若干领域重要研究进展
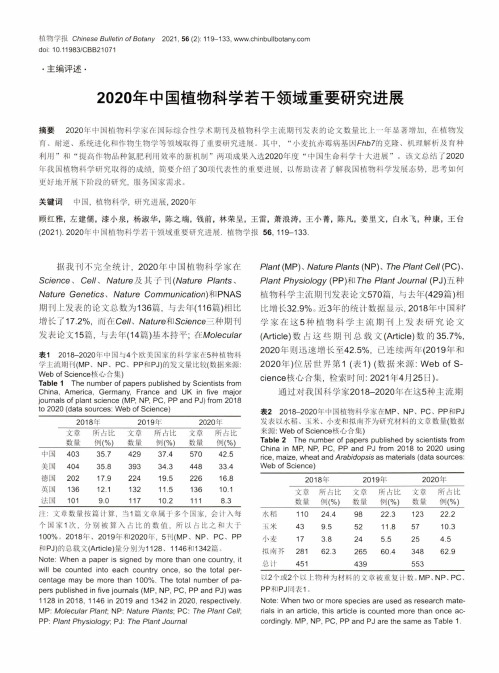
植物学报C/7/nese 8t7//e f/>7 ofBofany 2021, 56 (2): 119-133, doi: 10.11983/CBB21071.主编评述.2020年中国植物科学若干领域重要研究进展摘要 2020年中国植物科学家在国际综合性学术期刊及植物科学主流期刊发表的论文数量比上一年显著增加,在植物发 育、耐逆、系统进化和作物生物学等领域取得了重要研究进展。
其中,“小麦抗赤霉病基因F/757的克隆、机理解析及育种 利用”和“提高作物品种氮肥利用效率的新机制”两项成果入选2020年度“中国生命科学十大进展”。
该文总结了2020 年我国植物科学研究取得的成绩,简要介绍了 30项代表性的重要进展,以帮助读者了解我国植物科学发展态势,思考如何 更好地开展下阶段的研究,服务国家需求。
关键词中国,植物科学,研究进展,2020年顾红雅,左建儒,漆小泉,杨淑华,陈之端,钱前,林荣呈,王雷,萧浪涛,王小菁,陈凡,姜里文,白永飞,种康,王台(2021). 2020年中国植物科学若干领域重要研究进展.植物学报56, 119-133.据我刊不完全统计,2020年中国植物科学家在Science、Cel/、Nature及其子刊(Nature Plants、Nature Genetics、Nature Communication)和PNAS期刊上发表的论文总数为136篇,与去年(116篇)相比增长了 17.2%,而在Ce//、/Vafi/re和Sc/ence三种期刊发表论文15篇,与去年(14篇)基本持平;在Mo/eci//ar表12018-2020年中国与4个欧美国家的科学家在5种植物科学主流期刊(MP、NP、PC、PP和PJ)的发文量比较(数据来源:Web of Science核心合集)Table 1The number of papers published by Scientists fromChina, America, Germany, France and UK in five majorjournals of plant science (MP, NP, PC, PP and PJ) from 2018to 2020 (data sources: Web of Science)2018 年2019 年2020年文章数量所占比例(%)文章数量所占比例(%)文章数量所占比例(%)中国40335.742937.457042.5美国40435.839334.344833.4德国20217.922419.522616.8英国13612.113211.513610.1法国1019.011710.21118.3注:文章数量按篇计算,当1篇文章属于多个国家,会计入每 个国家1次,分别被算入占比的数值,所以占比之和大于 100%。
一个水稻苗期黄化叶突变体基因的定位

一个水稻苗期黄化叶突变体基因的定位项显波;吴晶;丁沃娜;朱世华【摘要】Leaf color mutants are useful resource for rice genomics research and development of rice cultivars with high photosynthetic efficiency. In this research, a rice yellow leaf mutant is isolated from an EMS (ethyl methane sulfonate)-generated rice mutant library of Kasalath background, and Oryza sativa yellow leaf 1(Osyl1) is thus obtained. The Osyl1 shows a yellow leaf phenotype before the second leaf stage and later leaves gradually turn back to green similar to the wild type. Genetic analysis suggests that the phenotype of Osyl1 is controlled by a single recessive nuclear gene. By map-based cloning, the OsYL1 is mapped to a 483 kb region between the markers S5362 and S5845 on chromosome 3. No report on yellow leaf related gene has been found in this region. The result of this study is expected to provide useful reference for cloning and characterizing OsYL1.%通过筛选甲基磺酸乙酯(Ethyl Methane Sulfonate, EMS)诱变的籼稻Kasalath突变体库,得到一个黄化叶突变体Osyl1(Oryza sativa yellow leaf 1),在二叶期前该突变体叶色黄化,后期突变体叶色逐渐恢复到野生型水平。
植物响应低温的分子机制研究进展

植物响应低温的分子机制研究进展张瑶;王傲雪【摘要】低温寒害(cold injury)是全球性的自然灾害之一,不仅限制农作物的地理分布,还会影响植物的生长发育,最终导致农作物减产甚至死亡.因此,研究植物响应低温胁迫的分子机制具有重要的理论意义和应用前景.本文从植物对低温的应答、植物对低温的感知和低温信号转导途径三个方面综述了植物是如何响应低温的,着重分析了CBF介导的低温调控网络,并对植物响应抗冷分子机制的研究进展进行概述,以期为进一步阐明植物抗冷机制提供理论基础和信息.这对提高农作物抗冷性具有重要的理论意义.【期刊名称】《黑龙江大学自然科学学报》【年(卷),期】2018(035)005【总页数】10页(P566-575)【关键词】植物;低温胁迫;信号转导;分子机制【作者】张瑶;王傲雪【作者单位】东北农业大学生命科学学院,哈尔滨150030;东北农业大学生命科学学院,哈尔滨150030;东北农业大学园艺园林学院,哈尔滨150030【正文语种】中文0 引言植物在生长过程中会不可避免地遭受各种逆境胁迫,包括生物胁迫 (Biotic stress)和非生物胁迫 (Abiotic stress)。
细菌、真菌、病原菌以及昆虫等造成的伤害叫作生物胁迫,而低温、高温、干旱、高盐等因素对植物造成的伤害叫作非生物胁迫。
由于固着生长的特性,植物必须发展自己的防御系统来应对各种胁迫。
低温寒害是全球性的自然灾害之一,不仅限制农作物的地理分布还会影响植物的生长发育,最终导致农作物减产甚至死亡。
近些年,极端气候尤其是低温寒害,使得大面积农作物减产,对世界粮食安全造成重大威胁。
因此,研究植物如何感受外界温度的变化以及响应低温的分子机制具有重要的科学意义和应用价值。
长久以来,科学家通过分子生物学、生理学、生物化学和细胞生物学等手段对植物响应低温的分子机制进行了广泛和深入的研究。
1 植物对低温的应答1.1 低温逆境的分类为了更好地研究低温对植物造成的影响,将低温对植物的伤害分为冷害 (Chilling injury) 和冻害 (Freezing injury) 两种形式。
植物突变体库的构建及突变体检测研究进展_郭建秋

收稿日期:2009-12-11基金项目:国家重点基础研究发展计划(973计划)项目(2009CB118400)作者简介:郭建秋(1972-),男,河南新安人,助理研究员,主要从事大豆品质改良利用研究。
E-ma il:guojianqiu.2008@植物突变体库的构建及突变体检测研究进展郭建秋,雷全奎,杨小兰,马 雯,张向召(洛阳市农业科学研究院,河南洛阳471022)摘要:突变体是研究基因功能的重要材料,为此,介绍了创造突变体的方法,特别是理化诱变方法以及突变体的检测方法等方面的研究进展。
关键词:植物突变体;构建;检测方法中图分类号:Q319 文献标识码:A 文章编号:1004-3268(2010)06-0150-06 随着大量基因序列和EST 资料的积累,后基因组时代诞生了。
功能基因组学是后基因组时代的重点研究内容,主要研究生物有机体内各种基因的生物学功能,进而了解所有基因如何协调发挥作用,完成一系列的生长发育过程。
要精确了解每个基因的功能及基因间的相互作用,必须分析单个基因和多个基因的突变表型以及它们的时空表达剖面。
随着新技术新方法的不断创新开发,分析鉴定基因功能的方法越来越多,并逐渐形成功能基因组学的分支学科。
目前已经发展了多种分析鉴定基因功能的方法,其中最直接最有效的方法是构建饱和的基因突变体库,通过突变体分析鉴定基因功能。
因此,突变体库的构建是功能基因组学的基础。
为此,综述了创造突变体的方法以及突变体的检测筛选方法等方面的研究进展。
1 创造突变体的方法突变体库有不同的分类方法[1]。
按照产生突变体的方法大致可分为自发突变体库、体细胞无性系变异突变体库、理化诱变突变体库和插入突变体库4类。
1.1 自发突变自发突变是指自然条件下发生的突变,是生物变异的重要来源,是自然进化的基础。
自发突变为人类提供了极有价值的研究材料。
李玮等[2]在芥菜型油菜品系L638-g 中发现了几株无致死效应的天然叶片黄化突变体,并研究揭示了该突变体的黄化机理及生物学特性。
水稻短根白化突变体sra1生理生化分析及基因定位

作物学报 ACTA AGRONOMICA SINICA 2019, 45(4): 556 567/ISSN 0496-3490; CN 11-1809/S; CODEN TSHPA9E-mail: zwxb301@本研究由国家自然科学基金项目(31771750)和重庆市基础研究与前沿探索项目(cstc2018jcyjAX0424)资助。
This study was supported by the National Natural Science Foundation of China (31771750) and the Basic Research and Frontier Exploration Projects of Chongqing City (cstc2018jcyjAX0424).*通信作者(Corresponding author): 王楠, E-mail: wangnan_xndx@第一作者联系方式: E-mail: 985959967@Received(收稿日期): 2018-07-29; Accepted(接受日期): 2018-12-24; Published online(网络出版日期): 2019-01-07. URL: /kcms/detail/11.1809.s.20190103.0929.007.htmlDOI: 10.3724/SP.J.1006.2019.82041水稻短根白化突变体sra1生理生化分析及基因定位张莉莎 米胜南 王 玲 委 刚 郑尧杰 周 恺 尚丽娜 朱美丹 王 楠*西南大学水稻研究所 / 西南大学农业科学研究院, 重庆 400715摘 要: 叶色突变体是研究光合作用及叶绿素合成与降解途径的理想材料, 有助于了解高等植物叶绿体发育和光合作用的调控机制。
利用甲基磺酸乙酯(EMS)处理西农1B, 获得一个短根白化突变体sra1 (short radicle and albino 1), 从出芽至第三叶期叶片始终为白色, 胚根较同时期野生型明显变短。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0引言植物叶色突变是植物在生长过程中叶色发生变化的现象,由叶绿素合成受阻或降解加快所引起。
植物叶色突变的种类较多,性状较明显,通过观察叶片颜色即可鉴别。
根据叶色表型可将其分为白化、条纹、黄化、淡黄绿、淡绿、常绿、斑叶、紫叶、类病斑、白黄和白绿等类型(Manjaya ,2009;Vairam et al.,2014)。
1933年,Killough 和Horlacher 发现了陆地棉(Gossypium hirsutum )芽黄突变体,但由于叶色突变会造成作物减产甚至死亡,故被认为是有害突变,在当时未引起重视。
自1948年Granick 利用小球藻(Chlorella vulgaris )失绿突变体W 5验证原卟啉9是叶收稿日期:2017-03-27基金项目:国家重点研发计划项目(2016YFD0600605);江西省林业科技创新专项项目(201406);广西农业科学院基本科研业务专项项目(2017YT47)。
作者简介:*为通讯作者,章挺(1981-),副研究员,主要从事林木栽培及育种研究工作,E-mail :zhangtycx@ 。
刘新亮(1986-),博士,主要从事观赏植物选育及栽培研究工作,E-mail :liuxinliang1988@植物叶色黄化突变分子机理的研究进展刘新亮1,李先民2,何小三1,邱凤英1,章挺1*(1江西省林业科学院,南昌330032;2广西农业科学院花卉研究所,南宁530007)摘要:植物叶色黄化突变具有突变频率高、易鉴别等特点,不仅是基础研究的理想材料,在品种选育和改良中也有重要的利用价值。
文章从叶绿素生物合成、血红素代谢、叶绿体发育及叶绿体蛋白代谢等方面,对植物叶色突变相关基因的功能和作用机理进行综述,发现目前对叶色突变分子机理的研究主要集中在叶色突变相关基因功能方面,针对质核信号转导、转录因子及调控元件的研究较少,因此,今后在相关研究中可利用叶色突变体这一理想材料分析鉴定相关基因功能及其互作关系,从对单一基因的研究转向对多个基因甚至功能基因组的系统研究,尤其加强对质核信号转导、转录因子及调控元件的研究;叶色突变体作为作物品种改良的一类特殊种质资源,可通过人工诱导方式增加植物突变频率,在较短时间内获得大量叶色突变体,应用于基因功能及基因间的互作关系等研究,为黄叶植株的选育和遗传改良提供参考。
关键词:叶色黄化突变;叶绿素合成;叶绿体发育;叶绿体蛋白代谢中图分类号:S311文献标志码:A文章编号:2095-1191(2017)08-1358-09A review:Molecular mechanism of plant yellow leaf mutationLIU Xin-liang 1,LI Xian-min 2,HE Xiao-san 1,QIU Feng-ying 1,ZHANG Ting 1*(1Jiangxi Academy of Forestry ,Nanchang 330032,China ;2Flowers Research Institute ,Guangxi Academy ofAgricultural Sciences ,Nanning 530007,China)Abstract :Yellow leaf mutation are ideal materials for basic research with high mutation frequency and easily identi-fied in nature.They also have important value in variety breeding and improvement.Functions and mechanisms of genesrelated to leaf color mutation were reviewed from perspectives of chlorophyll synthesis ,heme metabolism ,chloroplast development and chloroplast protein metabolism.The current researches on mechanism of leaf mutants focused on the functions of genes related to leaf color mutation ,but nucleoplasm signal transduction ,transcription factor and regulatory element were only studied by a few.Therefore ,in the future ,leaf mutants ,which is ideal materials ,can be used to study the function of the related genes and their interactions ,and switch the research from single gene to multiple genes or even functional genomes ,especially strengthen the study in nucleoplasm signal transduction ,transcription factor and regulato-ry element.As a special germplasm resource ,leaf mutants can increase plant mutation frequency through artificial induc-tion ,obtain large amount of leaf mutants within short period of time and apply them into the study in interactions between gene functions and genes ,and proude reference for yellow leaf plants breeding and gentic improvement.Key words :yellow leaf mutation ;chlorophyll synthesis ;chloroplast development ;chloroplast protein metabolism8期·1359·绿素合成前体以来,叶色突变体研究逐渐受到关注,尤其是叶绿素合成途径研究(Beale and Appleman,1971)。
近年来,叶色突变体被广泛应用于遗传模式、色素合成、光合作用、细胞结构与发育等基础研究,已成为分子生物学和发育生物学的热点之一(Wang et al.,2014;Wu et al.,2014;Zhu et al.,2014;Brestic et al.,2016)。
在园林植物中,叶色黄化突变较为常见,将叶片呈现不同程度黄色的植物称金叶植物,品种名常冠以Aurea(种培芳和杨江山,2013)。
金叶植物色彩明亮、观赏周期长、易形成大色块景观,在淡花季节起到以叶代花的作用,具有较高的观赏价值和特殊园林用途。
因此,叶色黄化突变植物已成为园林造景和道路绿化的首选物种,如金叶女贞(Ligustrum vicaryi)、金叶榆(Ulmuspumila cv.jinye)、金叶国槐(Sophora japonica)、金边黄杨(Euonymus japonicus cv.Aureo-ma)等。
叶色突变体呈色是遗传因素和环境因素共同作用的结果,突变基因自发或受外界环境影响可直接或间接干扰叶绿素合成及其稳定性,从而影响色素的含量及比例,最终导致叶片颜色异常。
因此,遗传因素是叶色变异的根本原因。
目前,叶色突变体调控基因研究主要集中在少数模式植物和蔬菜作物上,其中对拟南芥(Arabidopsis thaliana)和水稻(Oryza sativa)的研究较透彻。
本文拟从叶绿素合成、血红素代谢、叶绿体发育及叶绿体蛋白代谢等方面,对叶色突变相关基因的功能进行综述,并剖析植物叶色黄化突变的分子机理,提出今后的研究方向,以期为黄叶植株的选育和遗传改良提供参考。
1叶绿素生物合成途径叶绿素普遍存在于植物的绿色组织中,是绿色植物中含量最多的色素,在叶片中常结合在叶绿体的类囊体膜上(Kobayashi et al.,2014)。
叶绿素合成与降解的主要场所是叶绿体,其代谢途径中任何基因突变均可能会影响叶绿素的正常代谢,改变叶绿体中色素比例,引起植物叶色变异。
高等植物叶绿素的合成以谷氨酸为前体,最终合成叶绿素a和叶绿素b,共经过20步反应,由30多个基因编码的18种关键酶参与(图1)(Tanaka and Tanaka,2006;Harpaz-Saad et al.,2007;Tanaka et al.,2011)。
Hu等(1998)、Williams等(2006)研究发现,尿卟啉Ш脱羧酶(UROD)基因突变使玉米(Zea mays)叶片呈病斑表型,而粪卟啉原氧化酶(HEMF)基因突变导致苗期玉米呈黄化坏死表型。
Tsang等(2003)研究发现,谷氨酰-1-半醛转氨酶(GSA-AT)催化谷氨酸-1-半醛生成5-氨基酮戊酸(ALA),其反义转基因能降低油菜(Brassica napus)叶绿素含量。
Kim等(2005)诱导烟草(Nicoti-ana tabacum)谷氨酰-tRNA合成酶(GluRS)基因沉默,从而导致叶片呈严重的黄化表型,表明其表达量降低导致叶绿素含量降低。
Kumar和Söll(2000)、Hedtke等(2007)研究发现,谷氨酰-tRNA还原酶(HEMA)基因沉默会导致拟南芥叶绿素和血红素含量降低,抑制HEMA1基因表达从而降低ALA和叶绿素含量。
Ayliffe等(2009)在大麦(Hordeum vulgare)突变体70a3中发现,尿卟啉Ш合酶(UROS)基因突变受发育调控,成熟叶呈坏死表型。
Tanaka等(2011)研究发现,5-氨基酮戊酸脱水酶(ALAD1)基因突变明显降低拟南芥植株中叶绿素含量,导致叶片呈淡绿色。
镁螯合酶(MgCh)是由ChlI、ChlD和ChlH3个亚基组成的蛋白复合体,催化Mg2+与原卟啉IX形成镁原卟啉IX,是叶绿素生物合成的另一个重要调控位点,在叶绿素合成和叶绿体发育中起重要作用。
