年产10万吨硫酸的生产工艺模拟设计综述
年产10万吨硫酸铝车间工艺设计

从生产设备及其配置,工艺流程,控制系统,安全防护,环境保护等进行设计,但不包括技术参数,请根据您的需求,参照下面模板,补充完整。
一、生产设备及其配置
1.原料预处理设备:
转换反应炉、球磨机、凝固剂发生器、振动筒等
2.硫酸铝车间主要设备:
结晶罐、离心机、蒸发器、制氢塔、真空泵等
3.后处理设备:
搅拌机、滤液机、离心机、真空灌装机等
二、工艺流程
1.原料预处理
①将硫酸铝原料进行碳化及渣化处理;
②用进料计量泵把经过碳化和渣化处理后的原料送入转换反应炉中,反应物以其中一特定比例a:b进行混合;
③将混合物放入球磨机进行研磨,把粉末细化;
④用凝固剂发生器将凝固剂加入到细化后的粉末中,使粉末湿度达到一定值,使其具备团聚成块的能力;
⑤将凝固剂和粉末混合物放入振动筒中,进行混合,使得凝固剂均匀地涂覆在细化后的粉末表面,待粉末湿度达到一定的值后,使其形成块状物料;
⑥将形成的块状物料放入结晶罐中进行固液分离,硫酸铝晶体和悬浊液分离;
2.离心机精制。
《高效年产10.6万吨硫酸生产工艺设计研究》

温馨小提示:本文主要介绍的是关于《高效年产10.6万吨硫酸生产工艺设计研究》的文章,文章是由本店铺通过查阅资料,经过精心整理撰写而成。
文章的内容不一定符合大家的期望需求,还请各位根据自己的需求进行下载。
本文档下载后可以根据自己的实际情况进行任意改写,从而已达到各位的需求。
愿本篇《高效年产10.6万吨硫酸生产工艺设计研究》能真实确切的帮助各位。
本店铺将会继续努力、改进、创新,给大家提供更加优质符合大家需求的文档。
感谢支持!(Thank you for downloading and checking it out!)《高效年产10.6万吨硫酸生产工艺设计研究》一、研究背景与意义硫酸工业的发展概况硫酸是一种重要的无机酸,广泛应用于化工、冶金、制药、环保等领域。
随着我国经济的快速发展,硫酸的需求量逐年增长。
根据统计数据显示,我国硫酸产量已连续多年位居世界首位。
然而,传统的硫酸生产工艺存在能耗高、污染重、效率低等问题,已难以满足现代工业生产的需求。
因此,研究高效年产万吨硫酸生产工艺具有重要的现实意义。
高效年产万吨硫酸生产工艺的需求随着我国工业化的推进,硫酸市场需求持续增长。
为了满足这一需求,提高硫酸生产效率和降低生产成本成为硫酸工业的重要课题。
高效年产万吨硫酸生产工艺的研究旨在探索一种节能、环保、高效的生产方法,以提高硫酸的产量和质量,满足市场需求。
此外,高效年产万吨硫酸生产工艺的研究对于推动我国硫酸工业的技术进步、提升国际竞争力具有重要意义。
通过研究,可以促进我国硫酸工业的可持续发展,为我国经济的持续发展贡献力量。
研究目的与意义本研究旨在针对现有硫酸生产工艺的不足,探索一种高效年产万吨硫酸的生产工艺。
研究内容主要包括:优化硫酸生产流程,提高生产效率;降低能耗和污染,实现绿色生产;提高硫酸质量,满足不同领域的要求。
研究高效年产万吨硫酸生产工艺具有重要的意义。
首先,可以提高硫酸生产效率,降低生产成本,提高企业的经济效益。
年产10万吨硫酸生产厂建设项目可行性研究报告

【项目背景】硫酸是一种重要的化工原料,在化工、冶金、电力等领域具有广泛的应用。
随着社会经济的不断发展,硫酸需求量逐年增加,市场前景广阔。
为满足市场需求,拟建设年产10万吨硫酸的生产厂。
【项目优势】1.市场需求大:随着市场对硫酸需求的不断增加,建设产能可满足市场需求,保证产品销售。
2.原材料供应充足:该项目选址在附近地区,硫矿石供应便利,有利于原材料的稳定供应。
3.技术水平领先:引进先进的硫酸生产工艺和技术装备,提高生产效率和产品质量,降低生产成本。
【项目内容】1.项目规模:年产10万吨硫酸的生产厂。
2.生产工艺:采用硫矿石浸出和干燥煅烧工艺,生产出高纯度的硫酸。
3.工艺装备:引进国内外先进的硫酸生产自动化设备和环保设备,确保生产安全和环境保护。
4.建设周期:预计建设周期为18个月,其中包括前期准备、土地平整、基础设施建设等。
5.项目投资:预计总投资为5000万元,其中包括设备购置、土地使用权、建设工程费用等。
【项目收益分析】1.销售收入:以每吨硫酸售价3000元计算,年销售收入可达3亿元。
2.成本支出:包括原材料采购、人工费用、能源消耗、设备维护等,预计年总成本为2.5亿元。
3.年利润:扣除总成本后,预计年利润为5000万元。
4.投资回报周期:预计投资回报周期为10年。
【项目风险分析】1.市场风险:需求量波动、价格波动等可能对项目投资收益产生不利影响。
2.环保风险:硫酸生产会产生大量废气和废水,需要建设相应的环保设施和处理工艺,确保项目符合环保要求。
3.技术风险:硫酸生产涉及高温高压工艺,需要保证设备安全运行和操作人员的安全培训。
4.政策风险:相关政策和法规的变化可能对项目产生不利影响。
【项目建议】1.加强市场调研,确保项目投资与市场需求相匹配。
2.引进并落实先进的环保技术,确保项目符合环保要求。
3.优化生产工艺和工艺装备,提高生产效率和产品质量。
4.多渠道筹措资金,降低项目融资成本。
【结语】本可行性研究报告对年产10万吨硫酸生产厂建设项目进行了全面的分析和评估。
年产10万吨硫酸生产工艺

硫酸废热锅炉设计说明书一、废热锅炉也叫余热锅炉,就是利用各种装置产生的高温废气来加热水,产生蒸汽或产生热水(即蒸汽余热锅炉、热水余热锅炉),再利用所产生的蒸汽或热水,达到余热再利用的目的。
废热锅炉属于节能环保项目,它降低了废物的排放量,大大减轻了环境污染,同时对热量进行了一定的回收。
硫酸废热锅炉在我国,实际上也是硫铁矿制酸废热锅炉的简称。
硫酸废热锅炉串接于工艺流程之中,它既是用来回收废热,生产蒸汽的锅炉设备,同时也是完成特定工艺过程(如:降温,除尘,均匀气流颁等)所必不可少的化工设备。
因此废热锅炉是硫酸生产中最重要的设备之一。
其设计和研究,已经受到化工行业的极大重视。
在硫酸生产中,废热锅炉的性能对于整个装置的产品产量、质量、生产能力和消耗定额,以及三废处理和环境保护等各个方面,都有非常重大的影响。
同时,其操作弹性的好坏也直接关系到硫酸企业的经济效益。
二十一世纪伊始,随着国内硫酸工业的持续发展和对环境保护要求的提高,硫磺制酸以其工艺简单,污染轻,热能回收率等特点得到迅猛发展,装置规模也日益大型化。
装置的大型化提高了规模经济效益,降低了生产成本,使企业在市场竞争中具有更大的优势。
因此对于早已成熟的硫酸生产工艺中的废热锅炉性能的改进的提升具有极其重要的意义。
二、项目的动态我国硫酸废热锅炉的设计应用始于五十年代末期,三十多年的实践和发展过程,从某种意义上说,也就是逐步掌握工艺特性,将制酸工艺理论与锅炉原理相结合的过程。
与国外相仿,废热锅炉设计一般都由承担制酸工艺设计的单位完成,由专业锅炉制造厂或有资格的化工机械制造厂制造。
这也是废热锅炉不同于一般锅炉的地方现有的硫铁制酸废热锅炉属于烟道式水管锅炉,按炉气流向方向分为立式多烟道锅炉和水平通道式两大类。
国外从60年代中期开始广泛采用水平通道式,使锅炉出口直接与电除尘相连。
硫磺制酸废热锅炉有水管和火管两大类,国外普遍采用火管锅炉。
最近国内新建的几套400-800kt/a等大型化硫磺制酸装置,然而大型废热锅炉的锅壳,受到制造,运输等条件的约束,在与装置保持同步大型化方面有一定的难度。
10万吨年硫酸生产工艺设计(硫磺制酸熔硫工序毕业设计

本科毕业设计10万吨/年硫酸生产工艺设计(硫磺制酸熔硫工序)学院化工与药学院专业化学工程与工艺年级班别 2011级01班学号 2011402010107学生姓名指导教师危想平2015 年 5 月17 日目录前言 (1)1 文献综述 (1)1.1硫磺、硫化物及硫酸的性质 (2)1.1.1 化学性质 (2)1.1.2 物理性质 (3)1.2 硫酸的生产方法 (3)1.2.1 硝化法制造硫酸 (3)1.2.2 接触法制造硫酸 (4)1.3 硫酸生产工艺流程叙述 (5)气体的制取 (5)1.3.1 SO21.3.2 炉气的净化 (6)气体的转化 (6)1.3.3 SO2气体的吸收 (6)1.3.4SO31.3.5尾气的处理 (7)1.4 硫酸的用途 (7)1.4.1 硫酸的工业用途 (7)1.4.2 硫酸的农业用途 (8)2 物料平衡计算 (8)2.1 设计要求 (9)2.2 熔硫部分的物料衡算 (9)2.3熔硫工段的能量衡算 (9)3 主要设备 (10)3.1熔硫釜 (11)3.2焚硫炉 (11)3.3 转化器 (13)3.4 干吸塔 (14)3.5 空气鼓风机 (14)3.6 循环吸泵 (15)3.7 废热锅炉 (15)3.8 过热器和省煤器 (16)4 硫酸的安全生产 (16)4.1 硫酸工业中催化剂的重要作用 (17)4.2 硫酸生产中可能存在的危害 (17)4.3 我国硫酸工业技术概况 (18)4.4安全防护措施及防护用具 (18)4.5环境保护与治理建议 (18)设计小结 (19)参考文献 (20)致谢 (21)10万吨/年硫酸生产工艺设计(硫磺制酸熔硫工序)摘要硫酸作为工业之母,至今还发挥着重要作用。
采用硫磺制硫酸有利于保护环境建清洁文明工厂,且装置上投资为原来的50%,具有很大的经济效益。
硫酸生产工艺主要由五部分组成,包括二氧化硫气体的制取,炉气的净化,二氧化硫气体的转化,三氧化硫气体的吸收以及尾气的处理。
年产10万吨硫酸生产厂建设项目可行性研究报告

1.项目概述
本项目旨在建设年产10万吨硫酸生产厂,以满足市场上对硫酸的日益增长的需求,推动相关产业的发展。
硫酸是重要的无机酸之一,具有广泛的用途,用于化工原料、洗涤剂、实验试剂等行业,需求量大,市场前景广阔。
2.市场分析
在全球范围内,硫酸市场旺盛,需求量大。
特别是在化肥、石化、冶炼等行业、硫酸需求均逐年增加。
因此,投资建设一家年产10万吨硫酸生产厂是完全有市场基础的。
3.技术路线
本项目主要采用接触法生产硫酸。
这种方法未经过风险评估,已被证实是一种安全、高效、环保的生产方法。
我们将引进先进的生产设备和技术,确保硫酸的产品质量和生产效率。
4.投资预算和融资计划
预计投资总额为XXX亿元,其中设备投资为XXX亿元,建设费用为XXX亿元,流动资金为XXX亿元。
计划通过股权投资、债权投资和政府补助等方式筹集资金。
同时,我们也将寻找合作伙伴进行联合投资,分散风险,提高项目的经济效益。
5.建设期及回报预计
预计建设期为两年。
项目投产后,年销售收入可达XXX亿元,投资回收期为XXX年,具有良好的经济效益。
6.环境影响及应对措施
在硫酸生产过程中,会产生一定的环境污染,我们将采取若干环保措施,包括进行高效的硫酸气体处理,防止硫酸尘的排放,建立完善的污水处理设施,确保污水不直接排入环境中等。
7.风险评估及对策
8.结论
综上所述,投资建设年产10万吨硫酸生产厂是可行的,具有良好的经济和社会效益。
我们相信,本项目能够推动硫酸产业的发展,提供更多的就业机会,并向投资者带来满意的回报。
年产10万吨硫酸的生产工艺模拟设计综述

年产10万吨硫酸的生产工艺模拟设计综述硫酸生产工艺流程的综述前言硫酸是一种重要的基本化工原料,广泛应用于各大工业领域。
主要用于生产涂料、合成纤维、洗涤剂、制冷剂、化学肥料、饲料添加剂和石油的精炼、有色金属的冶炼,以及钢铁、医药和化学工业。
随着社会的不断发展和人们生活水平的不断提高,硫酸在科学技术和人们日常生活中所发挥的作用也越来越大。
硫酸跨领域、涉及性广等一系列特点对各个领域产生了重要的影响,而且各个领域对硫酸的重视也促进了硫酸自身的发展和硫酸工业的进步,因此,研究硫酸的生产工艺不仅可以提高硫酸的生产水平,还可以带动其他行业的发展。
1硫酸工业的现状及发展趋势1.1国内硫酸发展现状及发展趋势我国的硫酸工业起始于19世纪70年代,当时产量很少。
早期的硫酸工业是与军工联系在一起的。
最早建设的7个硫酸厂其中就有6个在军工厂内。
抗日战争和解放战争时期,解放区的硫酸企业也是为军工服务的。
新中国建立后,硫酸工业获得了快速地发展。
20世纪50年代以后逐步推广接触法,取代铅室法和塔式法,20世纪80年代以后全部采用接触法。
根据1999年底的不完全统计,我国现有硫酸生产厂家632家,生产能力为32 500 kt/a。
[1]1995年的产量为17.16Mt,仅次于美国,世界排名第二。
近年来我国硫酸产量如下(Mt):[2]年份 1991 1992 1993 1994 1995 1996 1997产量,Mt 13.32 14.07 13.46 15.30 17.16 17.56 19.462000—2009年是我国硫酸工业发展最快的阶段 ,硫酸产量年均增长率为10.4% 。
2004年我国硫酸产量达到39950kt ,首次超过美国位世界第一位 ,占到当年世界硫酸总产量184990kt的21.6% 。
2009年硫酸产量创历史新高 ,达59686kt, 占到世界硫酸产量的32.2% ,连续6年位居世界第一位。
2000-2009年以来 ,硫磺制酸发展最快,产量年均增长率为18.0% , 2009年产量达到27958kt;有色金属工业的发展也直接带动了冶炼烟气制酸的发展 ,产量年均增长率为11.2%,近5年的年均增长率更是达到15.6%,2009年冶炼烟气制酸产量达到17785kt ;受低价进口硫磺和有色金属发展的影响 ,硫铁矿制酸发较为平缓 ,产量年均增长率3% ,2009年产量为13846kt。
年产10万吨硫酸工艺毕业(课程)设计

Output is100,000 Tons Per Year
A
The sulfuric acid can be baked by the sulphur iron mine to burn born sulphur dioxide, The further catalyst which passes sulphur dioxide oxidizes born three oxidize sulphur, Finally absorb with the oil of vitriol three oxidize sulphur system sulfuric acid. This design is the year produces 100,000 ton sulfuric acid factory of design.It include the main equipment computation and the shaping in the technical process, entire factory floor-plan, s various workshops elevation and horizontal plan.
2.2
(1)遵守国家的政策规定;
(2)符合城市规划和工业布局;
(3)利于生产,便于生活;
(4)对环境不会造成威胁;
(5)合理利用资源;
(6)节约投资,留有余地。
2.3
厂址选择工作组(又设计部门与工业局主管组成)依据省市委指示,经过多方磋商,考虑到地势、交通、协作等问题,作为大型的化工原料生产基地,厂址定在陕西镇安。
1.1.2
硫酸是重要的化工产品,用途十分广泛。硫酸用于生产磷肥(过磷酸钙)和氮肥(硫酸铵),其消耗量几乎占硫酸产量一半以上;在有机化工、纤维、塑料、染料以及农药的生产中都需要硫酸;无机化工,如磷酸、氟氢酸、硼酸等无机酸及硫酸盐、磷酸盐、铬酸盐等无机盐的生产,也用硫酸;在国防和原子能工业,硫酸用于制造各种无烟炸药、从铀矿中提取铀;冶金工业的金属精炼、石油工业的产品精制等。
硫酸生产工艺工作总结

硫酸生产工艺工作总结
硫酸是一种重要的化工产品,广泛应用于冶金、电镀、化肥、医药等领域。
硫
酸的生产工艺是一个复杂的过程,需要严格控制各个环节,以确保产品质量和生产效率。
在硫酸生产工艺中,主要包括硫磺燃烧、吸收、转化和结晶等环节。
首先,硫磺燃烧是硫酸生产的第一步。
硫磺燃烧产生的二氧化硫气体通过冷却
和净化后,进入吸收塔进行吸收。
在吸收塔中,二氧化硫气体与稀硫酸溶液接触,发生化学反应生成浓硫酸。
吸收过程需要控制吸收塔的温度、压力和流速,以确保吸收效果和产品质量。
接下来是硫酸的转化过程。
吸收后的浓硫酸溶液经过蒸馏、氧化等工艺步骤,
转化成浓硫酸。
在转化过程中,需要严格控制反应温度、压力和反应时间,以保证反应的完全和产品的纯度。
最后是硫酸的结晶过程。
浓硫酸溶液经过结晶器结晶,生成硫酸晶体。
结晶过
程需要控制结晶温度、搅拌速度和结晶时间,以确保产品的结晶度和颗粒大小。
在硫酸生产工艺中,需要严格遵守操作规程,严格控制生产过程中的各项参数,确保产品质量和生产安全。
同时,还需要加强设备维护和管理,确保设备的正常运行和生产效率。
通过不断优化工艺流程和技术手段,提高生产效率和产品质量,降低生产成本,实现可持续发展。
总之,硫酸生产工艺是一个复杂的过程,需要严格控制各个环节,确保产品质
量和生产效率。
通过不断优化工艺流程和技术手段,提高生产效率和产品质量,降低生产成本,实现可持续发展。
年产万吨硫酸生产车间工艺设计

年产万吨硫酸生产车间工艺设计1. 引言硫酸是一种重要的化工原料,在工业生产中有广泛的应用。
本文将对年产万吨硫酸的生产车间工艺设计进行详细阐述。
2. 工艺流程本工艺设计采用传统的硫磺氧化工艺,包括硫磺熔化、氧化反应和吸收、浓缩和脱水等步骤。
2.1 硫磺熔化硫磺熔化是将固态硫磺通过加热转化为液态硫磺的过程。
该步骤可以采用熔化炉进行,熔化炉内部设有加热装置,可以将硫磺加热至其熔点以上,使其熔化成液态。
2.2 氧化反应和吸收液态硫磺经过熔化后,将进入氧化反应器进行氧化反应。
反应器内部设有适当的制冷装置和氧化剂供应装置,使硫磺氧化为二氧化硫。
氧化反应后的气体会与进入反应器的过量空气一起进入吸收塔,利用浓硫酸对二氧化硫进行吸收,生成含有硫酸的吸收液。
2.3 浓缩和脱水吸收液中的硫酸含量不高,需经过浓缩和脱水过程进行提纯。
浓缩器将吸收液中的水分通过加热汽提的方式蒸发出去,得到浓缩后的硫酸液。
脱水器通过加热硫酸液,使其内部的水分蒸发,然后通过冷凝器冷凝回收。
经过多级浓缩和脱水处理后,得到浓度达到要求的硫酸。
3. 工艺设备3.1 硫磺熔化炉硫磺熔化炉是将固态硫磺转化为液态的关键设备。
熔化炉通常由不锈钢制成,炉内设有加热装置和熔化槽。
加热装置可以采用电加热或燃气加热的方式,确保熔化槽内的硫磺能够达到熔点以上的温度。
3.2 氧化反应器氧化反应器是将液态硫磺氧化为二氧化硫的设备。
反应器通常为立式容器,内设有搅拌装置、冷却器和氧化剂供应装置。
搅拌装置可确保硫磺充分与氧化剂接触,提高反应效率。
冷却器可控制反应器内的温度,防止反应过热。
3.3 吸收塔吸收塔是用于将氧化反应产生的二氧化硫气体吸收至浓硫酸中的设备。
吸收塔内设有填料,以增加接触面积,提高吸收效果。
在吸收塔中,氧化产生的二氧化硫气体通过底部进入,与从顶部流入的浓硫酸进行接触和反应,最终得到含有硫酸的吸收液。
3.4 浓缩器和脱水器浓缩器和脱水器是对吸收液进行浓缩和脱水的设备。
化工设计年产10万吨硫酸铝

硫酸铝的生产过程主要分为以下几个步骤:1.硫化铝矿石的破碎:将原料硫化铝矿石进行破碎,使其达到一定的颗粒度。
2.浸出:将破碎后的硫化铝矿石进行浸出处理。
首先,将颗粒度合适的矿石与稀硫酸进行反应,产生硫酸铝的溶液。
然后,将反应后的混合物进入浸取槽,并对其进行搅拌和加热。
此时,浸取槽内的硫酸溶液与硫化铝矿石中的铝进行反应,生成硫酸铝溶液。
3.氧化:将浸取槽中得到的硫酸铝溶液进行氧化。
在氧化过程中,将氧气引入反应器中,与硫酸铝溶液中的硫化铝反应,生成硫酸铝和水。
4.还原:将氧化后的硫酸铝进行还原处理。
将硫酸铝溶液加入还原槽中,并加入适量的还原剂。
在还原槽中,将硫酸铝溶液与还原剂进行反应,将硫酸铝还原为硫酸铝溶液中的二价铝。
5.结晶:将还原后的硫酸铝溶液进行结晶处理。
通过调整溶液中的温度和浓度,使其中的硫酸铝结晶析出。
随后,将溶液中的固体和液体进行分离,得到硫酸铝结晶体。
6.过滤和干燥:将硫酸铝结晶体进行过滤和干燥。
首先,将硫酸铝结晶体与溶剂进行混合,形成悬浮液。
然后,将悬浮液进行过滤,将固体的硫酸铝分离出来。
最后,将过滤得到的固体进行干燥,得到干燥的硫酸铝产品。
7.包装和储存:将干燥后的硫酸铝产品进行包装,以便于运输和储存。
根据市场需求,将硫酸铝产品装入适当的包装容器中,并对其进行标识和封装。
以上是一种较为常见的化工设计方案,可以达到年产10万吨硫酸铝的要求。
但需要注意的是,具体的设计和生产方案还需要根据实际情况和要求进行调整和优化。
年产10万吨硫酸生产车间工艺设计

第一章综述1.1概述聚丙烯(PP)具有相对硬度大,密度小,抗拉伸性能好,透明度高,抗应力开裂和耐化学性能好,耐高温,并具有极好的注塑性能,可以与其他材料共混改性等优点,因此PP的应用范围越来越广,而且在2003年中国已经超过美国成为世界上最大的PP 市场。
PP主要用于生产纤维编织,注塑制品,薄膜,片材,板材,电缆及护套料,吹塑制品以及管材等,具有广泛的应用前景。
1.2聚丙烯成核剂工业的概述聚丙烯(PP)是合成树脂中的相当重要的品种,发展前景十分广阔。
聚丙烯(PP)具有机械性能好,无毒,密度小,耐高温,耐化学品,加工成型方便等优点,并且价格便宜,能通过加工改性赋予其突出的物理机械性能,在取代工程塑料时可优先考虑聚丙烯,PP的用量占全球通用合成树脂的41左右,是五大通用合成树脂中用量增速最快新品种研究最活跃的品种。
PP具有无毒、耐热、耐化学药品、相对密度低、容易加工、成型力学性能好等特性,而且丙烯原料丰富,且性价比高,被广泛地在建筑、化纤、化工、轻工等领域。
1954年意大利的Natta教授合成具有高度立体规整性的聚丙烯,然后PP在1957年由意大利的iMontecatin公司实现工业化以来,已经成为通用合成树脂中发展最快、品种最多的品种。
1.3我国聚丙烯成核剂工业的现状随着近些年来工业的快速发展和人民生活水平的提高,我国的成核剂市场发展很快,很多科研机构和企业都在进行成核剂的相关研究。
兰州石化研究院在国内率先开发出第一代DBS成核透明剂,然后继续开发了第二和第三代DBS成核剂。
此后还有许多企业进行了成核剂的相关研究,并使技术不断进步。
但与国外相比,我国科学研究基础薄弱,现阶段国内企业从事生产的时候还是借鉴国外的专利技术,主要是因为国内的研究机构对成核剂的成核机理没有完全摸清楚,虽然在努力追赶的过程中,但生产出来的产品与国外产品质量还是有差距,导致我国生产的成核剂产品在出口方面情况不容乐观。
所以说我们要力争上游,在成核剂对聚丙烯结晶形态,性能和加工工艺等方面进行更加深入详细的研究,尽快形成自己的专利技术,使自己的成核剂产品的性能能够媲美国外产品。
硫酸生产工艺

1设计任务书 (2)1.1项目 (2)1.2设计内容 (2)1.3设计规模 (2)1.4设计依据 (2)1.5产品组成、性质及用途 (2)1.6产品质量规格 (5)1.7原料方案 (6)原料:硫铁矿 (6)1.8工艺技术指标 (6)1.9生产方式 (8)2工艺线路及流程设计 (8)2.1硫酸的工艺基础 (8)2.2工艺路线选择 (10)2.3流程的设计 (10)2.4工艺操作设计 (10)3物料横算 (13)3.1转化—吸收系统的物料衡算 (13)4发烟硫酸吸收塔的设计 (15)4.1发烟硫酸吸收塔的计算 (15)4.2发烟硫酸吸收塔的设计结构图 (16)5设备一览表 (17)6车间防护 (18)6.1 有毒害性物质的防护 (18)6.2 泄漏应急处理 (18)6.3 急救措施 (18)6.4 噪声的防护 (19)6.5生产要求 (19)7经济评估 (20)7.1经济投资 (20)7.2经济分析 (20)8人员配置 (21)9三废处理 (21)9.1三废处理的意义 (21)9.2三废处理 (21)致谢: (23)参考文献: (24)年产10万吨硫酸的工艺设计1设计任务书1.1项目硫酸生产的工艺设计1.2设计内容1.2.1生产工艺设计1.2.2设计转化吸收塔1.3设计规模1.3.1 年产:10万吨1.3.2 年生产日:300天1.3.3日生产能力:10/300=333吨/天1.4设计依据该设计说明书是依据湖北远大富驰医药化工股份有限公司的生产技术资料的基础上,并结合设计任务书的内容年产10万吨硫酸技术要求。
1.5产品组成、性质及用途1.5.1硫酸组成【1】硫酸(英文名:Sulphuric acid for industrial use),H2SO4或SO3·H2O,相对分子质量98.078,是指SO3与H2O摩尔比等于1的化合物,或指100%H2SO4,外观为无色透明油状液体,密度(20℃)为1.8305g/㎝³。
硫酸生产毕业设计硫酸生产工艺主

摘要硫酸生产工艺主要由五部分组成,包括二氧化硫气体的制取,炉气的净化,二氧化硫气体的转化,三氧化硫气体的吸收以及尾气的处理。
主要包括工艺流程的选定,工艺过程计算,主要设备工艺计算及选型,以及绘制部分设备的平面布置。
本设计采用二塔二电流程,以年产11万吨硫酸车间净化工段工艺设计,设计中对主要工序进了物料衡算,热量衡算,并以此绘制物料平衡表和热量平衡表。
然后以净化工段为重点,对相关设备进行了计算。
关键词:硫酸;二塔二电;物料衡算;热量衡算;工艺设计AbstractSulfuric acid production process is mainly composed of five parts, including the preparation of sulfur dioxide gas, the furnace gas purification , the transformation of sulfur dioxide gas, the absorption of sulfur trioxide gas and the treatment of exhaust gas processes. The design mainly describes about the process of sulfuric acid production with the annual production capacity of 110,000 tons, including the flow process design, the calculation and selection of the main equipment, the layout of some equipment. Used pyrite as the raw material in the design. The design mainly calculated the mass balance and heat balance,and drew material balance table and heat balance in mainly production process. And then,use the depuration segment as the emphasis ,calculated The relevant Model Selection of the Related devices.Finally, the process description, security memorandum, memorandum of technical risk, the proposal of environmental protection and management were complete.Key words:Sulfuric acid;two towers and two Electric precipitators; mass balance;heat balance目录第一章文献综述 ----------------------------------------------------------------------------------------------------------------- 11.1硫酸的性质-------------------------------------------------------------------------------------------------------------- 11.1.1硫酸的物理性质 ----------------------------------------------------------------------------------------------- 11.1.2硫酸的化学性质 ----------------------------------------------------------------------------------------------- 21.2硫酸的生产方法-------------------------------------------------------------------------------------------------------- 31.2.1硝化法制造硫酸 ----------------------------------------------------------------------------------------------- 31.2.2接触法制造硫酸 ----------------------------------------------------------------------------------------------- 41.3硫酸的安全生产-------------------------------------------------------------------------------------------------------- 41.3.1硫酸工业中催化剂的重要作用 ---------------------------------------------------------------------------- 41.3.2硫酸生产中可能存在的危害 ------------------------------------------------------------------------------- 51.3.3我国硫酸工业技术概况-------------------------------------------------------------------------------------- 61.3.4环境保护与治理建议----------------------------------------------------------------------------------------- 61.3.5安全防护措施及防护用具----------------------------------------------------------------------------------- 71.4硫酸生产工艺流程流程叙述 ---------------------------------------------------------------------------------------- 81.4.1SO2气体的制取------------------------------------------------------------------------------------------------ 81.4.2炉气的净化 ----------------------------------------------------------------------------------------------------- 81.4.3SO3气体的吸收------------------------------------------------------------------------------------------------ 91.4.4尾气的处理 ----------------------------------------------------------------------------------------------------- 9 第二章酸洗净化工段计算依据 --------------------------------------------------------------------------------------------- 122.1净化流程---------------------------------------------------------------------------------------------------------- 122.2设计能力---------------------------------------------------------------------------------------------------------- 122.3课题条件---------------------------------------------------------------------------------------------------------- 122.4工艺指标及条件 ------------------------------------------------------------------------------------------------ 122.5净化工段各设备除雾比率的分配--------------------------------------------------------------------------- 132.6各塔循环酸浓度 ------------------------------------------------------------------------------------------------ 132.7气象条件---------------------------------------------------------------------------------------------------------- 13 第三章物料平衡计算---------------------------------------------------------------------------------------------------------- 143.1净化工段总平衡------------------------------------------------------------------------------------------------------- 143.1.1硫平衡----------------------------------------------------------------------------------------------------------- 143.1.2水平衡----------------------------------------------------------------------------------------------------------- 153.1.3冷却塔出口炉气温度的计算 ------------------------------------------------------------------------------ 153.2冷却塔循环系统物料平衡 ------------------------------------------------------------------------------------------ 163.2.1出冷却塔酸的组成------------------------------------------------------------------------------------------- 173.2.2混合后酸的组成: --------------------------------------------------------------------------------------------- 173.3洗涤塔循环系统物料平衡 ------------------------------------------------------------------------------------------ 173.3.1出洗涤塔酸的组成------------------------------------------------------------------------------------------- 173.3.2出洗涤塔的酸混合后的组成 ------------------------------------------------------------------------------ 183.4净化工段物料流程图 ------------------------------------------------------------------------------------------------ 19 第四章热量平衡计算---------------------------------------------------------------------------------------------------------- 204.1冷却塔热量横算------------------------------------------------------------------------------------------------------- 204.1.1炉气带入的热量 ---------------------------------------------------------------------------------------------- 204.1.2三氧化硫冷凝器 ---------------------------------------------------------------------------------------------- 204.1.3反应热----------------------------------------------------------------------------------------------------------- 204.1.4稀释热----------------------------------------------------------------------------------------------------------- 204.1.5冷却塔内水蒸发吸收热------------------------------------------------------------------------------------- 214.1.6炉气带出的热量 ---------------------------------------------------------------------------------------------- 214.1.7传递给循环酸的热量及出塔酸温 ------------------------------------------------------------------------ 224.1.8酸冷却器和冷却水用量------------------------------------------------------------------------------------- 224.2洗涤塔热量衡算------------------------------------------------------------------------------------------------------- 244.2.1炉气进洗涤塔带入热---------------------------------------------------------------------------------------- 244.2.2冷凝热和稀释热 ---------------------------------------------------------------------------------------------- 244.2.3炉气带出热量 ------------------------------------------------------------------------------------------------- 254.2.4传递给循环酸的热量及出塔酸温 ------------------------------------------------------------------------ 254.2.5酸冷却器和冷却水用量------------------------------------------------------------------------------------- 25 第五章设备计算 ---------------------------------------------------------------------------------------------------------------- 285.1酸冷却器 ---------------------------------------------------------------------------------------------------------------- 285.2冷却塔 ------------------------------------------------------------------------------------------------------------------- 285.2.1冷却塔所需的容积及空速---------------------------------------------------------------------------------- 285.2.2塔中喷头数量 ------------------------------------------------------------------------------------------------- 295.3洗涤塔 ------------------------------------------------------------------------------------------------------------------- 295.3.1表面传热系数的计算---------------------------------------------------------------------------------------- 295.3.2洗涤塔填料面积的计算------------------------------------------------------------------------------------- 325.4电除雾器 ---------------------------------------------------------------------------------------------------------------- 32 设计小结 --------------------------------------------------------------------------------------------------------------------------- 34 参考文献 --------------------------------------------------------------------------------------------------------------------------- 38 致谢 --------------------------------------------------------------------------------------------------------------------------------- 39第一章文献综述前言硫酸工业是一项比较古老的工业,我国很早就有人用蒸馏绿矾制硫酸。
年产10万吨硫酸铝车间工艺设计

本文由zb628AA贡献doc文档可能在WAP端浏览体验不佳。
建议您优先选择TXT,或下载源文件到本机查看。
海南大学毕业论文(设计)题学专姓学目:年产 10 万吨硫酸铝车间工艺设计院:材料与化工学院业:04 化学工程与工艺名:XXXX 号:XXXXX指导教师:指导教师:XXXX完成日期:完成日期:XXXX目录中文摘要.................................................................................5 英文摘要.................................................................................7 前言.......................................................................................9 1 总论....................................................................................10 1.1 设计的目的和意义...............................................................10 1.2 设计依据...........................................................................11 1.3 设计指导思想.....................................................................12 1.4 设计的主要内容..................................................................12 1.5 设计原则...........................................................................12 1.6 设计重点...........................................................................13 2.硫酸铝概论...........................................................................13 2.1 我国硫酸铝的工业生产现状...................................................13 2.2 发展前景...........................................................................14 2.3 存在问题...........................................................................14 2.4 发展建议...........................................................................15 3.生产技术和工艺.....................................................................16 3.1 原料.................................................................................16 3.2 生产工艺...........................................................................16 3.3 工艺选择...........................................................................23 4 工艺计算..............................................................................23 4.1 生产流程 (23)4.2 物料衡算……………………………………………………………………25 4.3 能量衡算…………………………………………………………………295.设备选型……………………………………………………………………32 5.1 反应釜……………………………………………………………………32 5.2 颚式破碎机…………………………………………………………………38 5.3 雷蒙磨……………………………………………………………………39 5.4 板式过滤机…………………………………………………………………41 5.5 浓缩结晶锅………………………………………………………………42 5.6 主要设备列表……………………………………………………………436.三废处理及副产品的综合利用……………………………………………457.厂房安排……………………………………………………………………45 7.1 厂房层数…………………………………………………………………45 7.2 厂房布置…………………………………………………………………468.技术经济分析........................................................................48 8.1 劳动定员...........................................................................48 8.2 固定资产的投资..................................................................49 8.3 原料动力费........................................................................50 8.4 固定资产折旧费和年维修费...................................................51 8.5 人工费..............................................................................51 8.6 化验分析费用.....................................................................51 8.7 三废治理费用.....................................................................51 9.设计评析 (52)致谢……………………………………………………………………………55 参考文献………………………………………………………………………56 附工程图纸 1、带控点的工艺流程图 2、厂房平面布局图 3、厂房立面布局图 4、反应釜装配图 5、结晶机装配图摘要我国硫酸铝的生产现状,年产量万吨以上的企业已达 29 个,3000t 至 10000t 的企业达 85 个。
硫酸生产工艺图
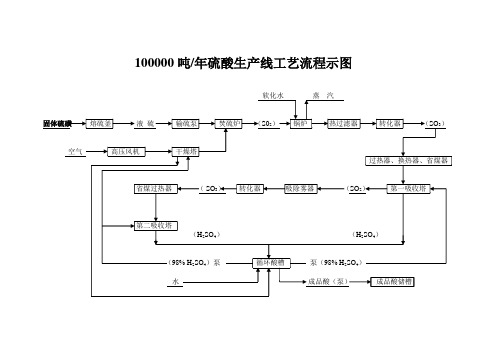
SO2(0.00285 T)排空
SO3(0.00055T)
尾气吸收
CaSO3(0.054T)
CaSO4(0.0126T)吸收液
100000吨/年硫酸生产线水平衡图
说明:1、硫酸产量:100000吨/年
2、年工作日:300天
工业上水
每天补充水量(6M3)日挥发量(6M3)
水成品酸(泵)成品酸储槽
100000吨/年硫酸生产线硫(S)平衡图
说明:1、硫酸产量:100000吨/年
2、年工作日:300天
3、每天消耗硫磺:110吨/天
4、计算图中的量均以每天的S计
吸收后生成H2SO4(109.93T)
转化为SO3(109.95T)
S(110T)SO2(110T)未被吸收的SO3(0.02T)
循环水池(600M3)泵板式换热器冷却塔
工艺补充水(7M3/天)循环酸罐
卫生冲地水(10M3/天)泵污水处理站
蒸汽(350T/天)
来自锅炉房的软化水(360T/天)废热锅炉
排污(10T/天)
100000吨/年硫酸生产线工艺流程示图
软化水蒸汽
固体硫磺熔硫釜液硫输硫泵焚硫炉(S02)锅炉热过滤器转化器(SO3)
空气高压风机干燥塔
过热器、换热器、省煤器
省煤过热器(SO3)转化器吸除雾器(SO2)第一吸收塔
第二吸收塔
(H2SO4)(H2SO4)
(98% H2SO4)泵循环酸槽泵(98% H2SO4)
年产15万吨硫酸工艺设计毕业设计

硫酸工艺设计是一个重要的工程项目,旨在设计一个能够生产年产15万吨硫酸的工艺。
本文将详细介绍硫酸工艺设计的流程,包括原料选择、生产工艺、设备选型以及环保措施等方面。
首先,我们需要选择适合生产硫酸的原料。
硫酸的主要原料是硫矿石(如黄铁矿)和炼硫废气。
硫矿石是一种含有硫铁矿的矿石,其中的硫可以通过熔炼和氧化反应转化为硫酸。
炼硫废气是炼油厂等生产过程中产生的含有硫化氢的废气,通过硫酸工艺可以将硫化氢转化为硫酸。
在生产工艺方面,硫酸的主要生产工艺是湿法氧化工艺。
该工艺利用浸泡在硫酸中的硫矿石,将其中的硫氧化为硫酸。
该反应需要满足一定的温度和催化剂存在,一般使用铜作为催化剂。
经过氧化反应后,得到的硫酸溶液会通过蒸发器进行浓缩,最终得到所需的浓硫酸。
在设备选型方面,硫酸工艺设计需要选用适合的设备进行硫酸的浸提、氧化和浓缩。
其中,浸提反应器需要选用能够承受高温和高压的材料,同时具备良好的耐腐蚀性能。
氧化塔需要选用具有良好传质性能和催化性能的填料材料,以提高反应效果。
浓缩塔则需要选用能够适应高温和高浓度硫酸的设备。
此外,硫酸工艺设计需要重视环保措施。
硫酸生产过程中会产生大量的烟尘和废气,其中含有二氧化硫等有害气体。
为了减少对环境的影响,可以使用烟气脱硫技术对废气进行处理,将二氧化硫转化为可利用的硫酸。
同时,对于产生的废水也应进行处理,以避免对周围水体的污染。
总结起来,年产15万吨硫酸的工艺设计需要经过原料选择、生产工艺、设备选型和环保措施等方面的考虑。
通过科学合理的设计,可以实现高效、环保的硫酸生产,为工业生产提供稳定可靠的硫酸供应。
年产10万吨硫酸生产工艺流程

年产10万吨硫酸生产工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!硫酸是一种广泛应用的化学物品,主要用于肥料、化工、制药、冶炼等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
年产10万吨硫酸的生产工艺模拟设计综述硫酸生产工艺流程的综述前言硫酸是一种重要的基本化工原料,广泛应用于各大工业领域。
主要用于生产涂料、合成纤维、洗涤剂、制冷剂、化学肥料、饲料添加剂和石油的精炼、有色金属的冶炼,以及钢铁、医药和化学工业。
随着社会的不断发展和人们生活水平的不断提高,硫酸在科学技术和人们日常生活中所发挥的作用也越来越大。
硫酸跨领域、涉及性广等一系列特点对各个领域产生了重要的影响,而且各个领域对硫酸的重视也促进了硫酸自身的发展和硫酸工业的进步,因此,研究硫酸的生产工艺不仅可以提高硫酸的生产水平,还可以带动其他行业的发展。
1硫酸工业的现状及发展趋势1.1国内硫酸发展现状及发展趋势我国的硫酸工业起始于19世纪70年代,当时产量很少。
早期的硫酸工业是与军工联系在一起的。
最早建设的7个硫酸厂其中就有6个在军工厂内。
抗日战争和解放战争时期,解放区的硫酸企业也是为军工服务的。
新中国建立后,硫酸工业获得了快速地发展。
20世纪50年代以后逐步推广接触法,取代铅室法和塔式法,20世纪80年代以后全部采用接触法。
根据1999年底的不完全统计,我国现有硫酸生产厂家632家,生产能力为32 500 kt/a。
[1]1995年的产量为17.16Mt,仅次于美国,世界排名第二。
近年来我国硫酸产量如下(Mt):[2]年份 1991 1992 1993 1994 1995 1996 1997产量,Mt 13.32 14.07 13.46 15.30 17.16 17.56 19.462000—2009年是我国硫酸工业发展最快的阶段 ,硫酸产量年均增长率为10.4% 。
2004年我国硫酸产量达到39950kt ,首次超过美国位世界第一位 ,占到当年世界硫酸总产量184990kt的21.6% 。
2009年硫酸产量创历史新高 ,达59686kt, 占到世界硫酸产量的32.2% ,连续6年位居世界第一位。
2000-2009年以来 ,硫磺制酸发展最快,产量年均增长率为18.0% , 2009年产量达到27958kt;有色金属工业的发展也直接带动了冶炼烟气制酸的发展 ,产量年均增长率为11.2%,近5年的年均增长率更是达到15.6%,2009年冶炼烟气制酸产量达到17785kt ;受低价进口硫磺和有色金属发展的影响 ,硫铁矿制酸发较为平缓 ,产量年均增长率3% ,2009年产量为13846kt。
[3]随着我国硫酸工业的迅猛发展 ,硫酸生产原料格局也发生了巨大变化 ,从硫铁矿占统治地位 ,逐步形成了“硫磺一冶炼烟气一硫铁矿”三大原料制酸三足鼎立的格局 ,并且硫磺和冶炼烟气制酸所占比例越来越大。
硫磺制酸产量占硫酸总产量的比例由2000年的25.2%提高到2009年的46.8%,冶炼烟气制酸产量占总产量比例由2000年的27.3%提高到2009年的29.8%;硫铁矿制酸产量占总产量比例则由2000 0年的45.7%下降到2009年的23.2%。
[3-4] 经过最近25 年的发展 ,我国的硫酸工业产能、产量大幅度增加 ,技术装备水平持续提高 ,既满足了化肥生产的需求 ,为保证我国的粮食安全做出了巨大贡献 ,又满足了石化、化工、纺织、轻工、有色冶金、钢铁等行业的需求,为国民经济的高速发展提供了重要的保障。
1.2国外硫酸发展现状及发展趋势世界硫酸工业生产始于18世纪中叶。
1746年建立了第一个铅室法硫酸厂,月产浓度33.4%的硫酸334Kg,用于漂白亚麻。
20世纪初,塔式法硫酸生产出现,塔式法的设备生产强度为铅室法的6-10倍,并将成品酸的浓度提高到了75%以上,前苏联对塔式法生产硫酸进行了深入的研究,大大降低了建设硫酸厂的投资并提高了塔的生产强度。
1900年美国建立了第一个一硫铁矿为生产原料的接触法硫酸厂,用铂做催化剂。
1915年,开始使用钒催化剂,由于钒催化剂价格低廉,对一些有毒害物质的抵抗力较高,昂贵的的铂催化剂和低活性的铁催化剂便渐渐被取代。
接触法生产的硫酸浓度高,杂质含量低,用途广,还可以生产发烟硫酸和液体三氧化硫,没有氮氧化物对大气的污染,50年代以来已成为世界硫酸生产的主要方法。
1998 年世界硫酸生产量约 15 511 万 t〔w( H2SO4) 100 %硫酸〕,比 1997 年增长 2. 2 %, 详见表 1 , 其中约有 64 %是以元素硫为原料生产的,24 %是冶炼烟气制酸 , 12 %以硫铁矿为原料。
[5]2硫酸的性质2.1硫酸的物理性质纯硫酸一般为无色油状液体,沸点337℃,密度1.84 g/cm³,硫酸的熔点是10.371℃,加水或加三氧化硫均会使凝固点下降,可以与水以任意比例互溶,同时放出大量的热,使水沸腾。
加热至290℃时开始释放出三氧化硫气体,最终变成98.54%的水溶液,在317℃时沸腾形成共沸混合物。
因硫酸分子内部的氢键较强导致硫酸的沸点及粘度较高。
由于硫酸的介电常数较高,因此它是电解质的良好溶剂,而作为非电解质的溶剂则不太理想。
2.2硫酸的化学性质硫酸具有腐蚀性,脱水性和强氧化性。
1、可与多数金属(比铜活泼)和绝大多数金属氧化物反应,2、可与所含酸根离子对应酸酸性比硫酸根离子弱的盐反应,3、可与碱反应生成相应的硫酸盐和水;4、可与氢前金属在一定条件下反应,5、加热条件下可催化蛋白质、二糖和多糖的水解;6、能与指示剂作用,使紫色石蕊试液变红,使无色酚酞试液不变色。
7、能与指示剂作用,使紫色石蕊试液变红,使无色酚酞试液不变色。
2.3硫酸的储存方法储存于阴凉、通风的库房。
库温不超过35℃,相对湿度不超过85%。
保持容器密封。
远离火种、热源,工作场所严禁吸烟。
远离易燃、可燃物。
防止蒸气泄漏到工作场所空气中。
避免与还原剂、碱类、碱金属接触。
搬运时要轻装轻卸,防止包装及容器损坏。
配备相应品种和数量的消防器材及泄漏应急处理设备。
倒空的容器可能残留有害物。
稀释或制备溶液时,应把酸加入水中,避免沸腾和飞溅伤及人员。
2.4工业风险虽然硫酸并不是易燃,但当与金属发生反应后会释出易燃的氢气,有机会导致爆炸,而作为强氧化剂的浓硫酸与金属进行氧化还原反应时会释出有毒的二氧化硫,威胁工作人员的健康。
另外,长时间暴露在带有硫酸成分的浮质中(特别是高浓度),会使呼吸管道受到严重的刺激,更可导致肺水肿。
但风险会因暴露时间的缩短而减少。
在美国,硫酸的最多可接触分量(PEL)被定为 1 mg/m ³,此数字在其他国家相若。
误服硫酸有机会导致维生素B12缺乏症,其中,脊椎是最易受影响的部位。
2.5急救措施硫酸与皮肤接触需要用大量水冲洗,再涂上3%~5%碳酸氢钠溶液冲,迅速就医。
溅入眼睛后应立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
迅速就医。
吸入蒸气后应迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
迅速就医。
误服后应用水漱口,给饮牛奶或蛋清,迅速就医。
3硫酸的工艺生产流程3.1硫酸生产的生产方法硫酸是三氧化硫与水的等摩尔化合物,因此硫酸的生产首先是以各种含硫物质为原料生产二氧化硫,将二氧化硫氧化成三氧化硫,最后加工制成硫酸,工业上主要采用接触法和硝化法。
硝化法的主要反应为:[6]NO SO H O H NO SO 42222+→++由于硝化法生产硫酸的过程中会消耗大量硝酸或硝酸盐,经济不划算;而且浓度低,仅有75%左右,使其的用途受到了大量的限制,因此该法主要在新中国成立前几20世纪50年代时采用,以后便被淘汰。
目前,工业上硫酸生产方法主要为接触法硫酸生产工艺。
接触法是通过催化剂的催化作用,将二氧化硫和空气中的氧化合而成三氧化硫,再将三氧化硫吸收而成硫酸。
由于接触法生产的硫酸产品浓度高,含杂质少,生产设备强度大,所以现在世界上生产硫酸皆采用此法,不过在20世纪60年代以前,接触法硫酸装置都采用一次转化及一次吸收(简称“一转一吸”)流程,其缺点是总转化率较低,60年代初联邦德国拜耳(Bayer )公司开发了两次转化及两次吸收的“两转两吸”流程并首先建成500t/d 的硫酸装置二获得成功,此后这一技术即推广至世界各国。
[7]根据生产原料的不同,硫酸的生产方法有以下几种:硫磺制酸、硫铁矿制酸、冶炼烟气制酸和硫酸盐(磷石膏、硫酸亚铁)制酸等类型。
在接触法硫酸工艺生产过程中,有三个基本的化学反应和与之相联系的工序:制取SO 2气体;SO 2转化为SO 3;SO 3的吸收。
下面主要介绍硫铁矿制酸的主要原理及流程:自然界中的硫铁矿根据其成分中的硫铁比的不同分为普通硫铁矿和磁硫铁矿。
普通硫铁矿又称黄铁矿,分子式为FeS 2。
磁硫铁矿又称磁黄硫铁矿,分子22NO O 21NO →+式为Fe n S n+1,其制酸过程与硫铁矿基本相同。
硫铁矿制酸的主要工序主要有原料矿的预处理,硫铁矿的焙烧,炉气的净化,二氧化硫的转化以及炉气的干燥和三氧化硫的吸收等五个工序。
矿山开采的硫铁矿呈块状,必须经过一定的预处理,使含硫,水分、粒度以及杂质达到一定要求后才可以作为沸腾炉焙烧的原料。
进厂的块矿一般要求在200mm 以下,在进行破碎和过筛,一般粒度小于3mm 才能作为成品硫铁矿进入焙烧工序。
对于粉矿进厂,水分应控制在10%以下。
硫铁矿焙烧的化学反应是二硫化铁的燃烧反应,主要可用以下两个化学方程式表示[8]:由于硫铁矿的焙烧反应是放热反应,因此除少数含硫量低的硫铁矿以外,一般都可维持焙烧的热平衡。
硫铁矿的焙烧曲线[9]3413kJ8SO O 2Fe 11O FeS 23222++→+42437kJ6SO O Fe 8O 3FeS 24322++→+硫铁矿的焙烧反应过程,由一系列依次进行的阶段所组成。
依次为FeS2的分解、氧向硫铁矿表面的扩散、氧与硫化亚铁的反应生成SO2由表面向气流中扩散。
在表面上除了FeS与O2的反应外,还进行着硫磺蒸气向外扩散和氧与硫的反应等。
炉气的净化就是将出沸腾炉的SO2气体中所含有的某些气态或固态有害杂质通过专门的设备将它们清除。
SO2的转化2SO2+O2=2SO3+Q该反应是接触法硫酸生产工艺的核心,它是一个可逆放热反应,在V2O5催化剂的存在下,高于起燃温度时,反应得以进行。
然而,随着反应的进行,气体温度升高,平衡向反应式左移,即阻止生成SO3。
为了提高SO2转化为SO3的总转化率,必需使经过部分反应的气体通过数段催化剂床层,并且在气体从上一段床层流向下一段时进行中间冷却。
SO3的吸收SO3+H2O→H2SO4+Q。
转化工序生成的SO3,在填料吸收塔中被循环的浓硫酸(98.5%)吸收,从气体中除去。
硫铁矿制酸的工艺流程图[9]硫铁矿原料经过原料工段处理过的,送入焙烧工序进行硫铁矿的沸腾焙烧,气体经废热锅炉回收热量再经旋风除尘器和电除尘器送入气体净化工序,经净化工序的气体进入干燥塔对气体进行干燥后送入转化工段,进行S O2的催化氧化,反应生成的SO3气体送吸收塔吸收产出硫酸。
