常用有机溶剂性能表
有机溶剂溶解能力排序

有机溶剂的溶解能力排序可以根据其极性和官能团进行分类。
一般来说,极性溶剂(如水)易溶解极性物质(如离子晶体、分子晶体中的极性物质如强酸等),而非极性溶剂(如苯、汽油、四氯化碳、酒精等)能溶解非极性物质(如大多数有机物、Br2、I2等)。
在常用的有机溶剂中,其极性从大到小的顺序为:水> 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮> 二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 醋酸乙酯> 乙醚> 异丙醚> 二氯甲烷> 氯仿> 溴乙烷> 苯> 氯丙烷> 甲苯> 四氯化碳> 二硫化碳> 环己烷> 己烷> 庚烷> 煤油。
以上排序仅供参考,实际溶解能力还会受到其他因素的影响,如溶剂和溶质之间的相互作用力、溶剂的分子结构等。
因此,在实际应用中,需要根据具体的需求和条件选择合适的溶剂。
常用溶剂的性能介绍及挥发速度

常用溶剂的挥发速度名称 --------------沸点℃ ----比挥发速度二氯甲烷 ---------40---------2750四氯化碳 --------76.8---------1280醋酸甲酯 ---------57.2---------1180丙酮 -------------56.2---------1120正己烷 ---------65 ~69 ---------1000二氯乙烷 ---------84-----------750环已烷 ---------80.8------------720醋酸乙酯 --------77.1 ---------615丁酮 ------------79.6----------572四氢呋喃 ---------66----------501苯 ---------------80 ----------500正庚烷 ---------98.0----------386甲醇 -----------64.5-----------370甲苯 ----------111.0---------240异丙醇 ---------82.5---------205乙醇 -----------78.1---------203醋酸丁酯 --------26.5 ---------100二甲苯 ---------135 ~145--------68甲基溶纤剂 ------124.5---------55丁醇 ------------ 117.1--------- 45环已酮 ---------155~ 156 -------25三氯乙烯 ---------86~88---------快二氧六环 ---------101~102-------中二甲基甲酰胺 ----153-------------慢醋酸戊酯 ---------130~150 -------慢有机溶剂主要种类及性能介绍有机溶剂主要种类及性能一、烃类溶剂1.烃只含有碳氢两种元素的有机化合物叫烃。
常用有机溶剂

常用有机溶解甲醇【中文名】甲醇【英文名】Methanol【CA登录号】67-56-1【分子式】CH4O【分子量】32.04【化学结构式】CH3OH【外观】无色液体。
【物化常数】沸点64.7℃,熔点-97.8℃,蒸气压92 mmHg/20℃,蒸气压127 mmHg/25℃,相对密度0.8100/0℃/4℃,蒸气相对密度1.11,辛醇/水分配系数log Kow= -0.77,与水、乙醇、醚、苯及多数有机溶剂及酮等互溶。
嗅阈值141ppm。
【毒性】慢性反复接触甲醇蒸气会导致结膜炎、头痛、眼花、失眠、视觉模糊、失明。
类似乙醇的中枢神经系统抑制。
代谢可形成甲酸而引起酸毒症。
严重时可因呼吸停止而死亡。
约4mL 甲醇可导致失明,致死量约80~150mL。
急性中毒一般在开始的12~18小时内,主要是有醉意、随后是头痛、厌食、虚弱、疲乏、脚痛、眩晕、恶心、呕吐、腹泻、剧烈的腹痛,接着是冷漠、极度兴奋,并很快昏迷,瞳孔对光不敏感,并失明。
呼吸加快并浅薄,心动过速,并在昏迷状态下因呼吸衰竭而死亡。
如经抢救而苏复,但失明是永久性的。
最小致死剂量约为0.3 and 1 g/kg,LD50 大鼠经口5628 mg/kg,静脉注射2131 mg/kg,小鼠经口7300 mg/kg,腹腔注射10765 mg/kg,皮下9800 mg/kg,静脉注射4710 mg/kg,LC50 大鼠吸入64000ppm/4hr。
【安全性质】爆炸极限 6.0~36%,自燃点464℃,闪点12℃,闭杯。
【环境数据】COD 1.5 g/g BOD 0.77g/g,在大气中,甲醇仅以气态的形式存在,可以与光化学所诱发的羟基游离反应,其相应的半衰期为17.8天,可以通过下雨而被淋洗而从大气中去除。
在土壤中,它可以进行生物降解,并可以在土壤中进行渗析,并可以从干的土壤表面经挥发转移至大气中去。
在模拟河流及湖泊中的挥发半衰期分别为4.8天及51.7天。
不易发生直接光解。
丙二醇水溶液粘度对照表

丙二醇水溶液粘度对照表丙二醇是一种常用的有机化合物,也是一种重要的溶剂和反应物。
它的水溶液在工业生产和实验室中广泛应用。
丙二醇水溶液的粘度是衡量其流动性能的一个重要指标。
下面是一份丙二醇水溶液粘度对照表,帮助大家了解不同浓度下丙二醇水溶液的粘度情况。
1. 丙二醇浓度:10%(质量分数)粘度:3.2毫帕·秒在这个浓度下,丙二醇水溶液的粘度较低,流动性较好。
适用于一些需要较快流动的应用场合。
2. 丙二醇浓度:20%(质量分数)粘度:4.8毫帕·秒增加了丙二醇的浓度后,水溶液的粘度也相应增加。
这种浓度的丙二醇水溶液适用于一些需要中等流动性的场合。
3. 丙二醇浓度:30%(质量分数)粘度:6.5毫帕·秒当丙二醇的浓度达到30%时,水溶液的粘度进一步增加。
这种浓度的丙二醇水溶液适用于一些需要较高流动性的场合。
4. 丙二醇浓度:40%(质量分数)粘度:8.3毫帕·秒40%浓度的丙二醇水溶液的粘度较高,流动性较差。
这种浓度的丙二醇水溶液适用于一些需要粘稠流动性的场合。
5. 丙二醇浓度:50%(质量分数)粘度:10.2毫帕·秒当丙二醇的浓度达到50%时,水溶液的粘度进一步增加。
这种浓度的丙二醇水溶液适用于一些需要非常高粘度的场合。
通过以上对照表可以看出,丙二醇水溶液的粘度随着丙二醇浓度的增加而增加。
不同浓度的丙二醇水溶液适用于不同的应用场合。
丙二醇水溶液粘度的变化与其浓度的关系主要受到溶质浓度和分子间作用力的影响。
当丙二醇浓度增加时,溶质与溶剂之间的分子间作用力增强,导致水溶液粘度增加。
这是因为丙二醇分子可以与水分子形成氢键,增加了水溶液的粘度。
温度也会对丙二醇水溶液的粘度产生影响。
一般情况下,温度升高会使水溶液的粘度降低,因为温度升高可以破坏分子间作用力,增加了分子的热运动,使水溶液更加流动。
因此,在实际应用中,我们还需要考虑温度对丙二醇水溶液粘度的影响。
总结起来,丙二醇水溶液的粘度随着丙二醇浓度的增加而增加,不同浓度的丙二醇水溶液适用于不同的应用场合。
有机溶剂甲醇介绍

甲醇介绍甲醇(Methanol)又称羟基甲烷,是一种有机化合物,是结构最为简单的饱和一元醇,其化学式为CH3OH/CH4O,其中CH3OH是结构简式,能突出甲醇的羟基,CAS号为67-56-1,分子量为32.04,沸点为64.7℃。
因在干馏木材中首次发现,故又称“木醇”或“木精”。
人口服中毒最低剂量约为100mg/kg体重,经口摄入0.3~1g/kg可致死。
用于制造甲醛和农药等,并用作有机物的萃取剂和酒精的变性剂等。
中文名:甲醇外文名:methanol别名:羟基甲烷、木醇、木精化学式:结构简式CH3OH;分子式CH4O分子量:32.04CAS登录号:67-56-1EINECS登录号:200-659-6熔点:-97.8 ℃沸点:64.8 ℃密度:0.791 g/cm³外观:无色液体闪点:11.11℃应用:用于制造甲醛和农药等安全性描述:S7;S16;S36/37;S45危险性符号:F危险性描述:R11;R39/23/24/25UN危险货物编号:1230溶解性:溶于水,可混溶于醇类、乙醚等多数有机溶剂折射率:1.33066SMILES:CORTECS:PC1400000黏度:0.55 mPa·s,25℃偶极矩:1.69 D(气态)主要危害:含有甲醇的酒可引起失明、肝病自燃点:473 ℃理化性质物理性质1.性状:无色透明液体,有刺激性气味。
2.熔点(℃):-97.83.沸点(℃):64.74.相对密度(水=1):0.795.相对蒸气密度(空气=1):1.16.饱和蒸气压(kPa):12.3(20℃)7.燃烧热(kJ/mol):7238.临界温度(℃):2409.临界压力(MPa):7.9510.辛醇/水分配系数:-0.82~-0.7711.闪点(℃):8(CC);12.2(OC)12.自燃温度(℃):43613.爆炸上限(%):36.514.爆炸下限(%):615.溶解性:与水互溶,可混溶于醇类、乙醚等多数有机溶剂。
干法聚氨酯合成革生产工艺

评论:2 条查看:532 次xiangyuan发表于 2021-04-07 07:14聚氨酯人造革主要分为干法聚氨酯人造革和湿法聚氨酯人造革。
所谓干法聚氨酯人造革,是指将溶剂型聚氨酯树脂中的溶剂挥发掉后,得到的多层薄膜加上底布而构成的多层结构体。
而湿法聚氨酯人造革,是将溶剂型聚氨酯,采用水中成膜法而得到的具有透气性和透湿性,又同时具有连续多孔层的多层结构体。
一、干法聚氨酯人造革〔一〕生产工艺流程注:1、离型纸发送 2、离型纸贮存装置 3、第一涂料台 4、10M左右枯燥箱 5、第一组冷却辊 6、第二涂料台 7、15—20M枯燥箱 8、第二组冷却箱 9、第三涂料台 10、基布发送台 11、贴合装置 12、20—25M枯燥箱 13、第三组冷却辊 14、剥离装置 15、人造革卷取 16、离型纸卷取离型纸法聚氨酯人造革生产原理是将不同性能的面、底层配合液利用刮刀涂覆在离型纸上,面料经过枯燥、冷却工艺后,再涂覆上粘合层底料,利用基布发送贴合装置将基材与底料复合,经过枯燥、冷却后,利用剥离装置将成品人造革与离型纸分别成卷。
〔二〕、主要原料1、离型纸A、离型纸分类:按用途分:①聚氯乙烯人造革用纸②聚氨酯人造革用纸按花纹分:①平面纸②压纹纸按光泽度分:①高光型②光亮型③半光亮型④半消光型⑤消光型⑥超消光型按材质分:①硅系纸〔外表涂敷有机硅聚合物,耐温≤190℃〕②非硅系纸〔外表涂敷丙烯聚合物,耐温≤150℃〕③特殊用纸〔PVC用〕B、性能要求:①强度:由于在涂布后,进入烘箱枯燥,温度较高,在屡次使用中必须有足够的强度,最重要的撕裂强度。
②外表均匀性:必须保持一定的离型均匀度及光泽,平面纸的平滑度及厚度要保持一致。
③耐溶剂性:在生产中,常用到多种溶剂,要做到既不溶解也不溶胀。
④适宜的剥离强度:离型纸要有适当的剥离强度,如果剥离太困难会影响到纸的重复使用次数,如果剥离太容易,在涂布及复合时易引起预剥离,而影响产品质量。
增大硫酸钙溶解度的有机溶剂

增大硫酸钙溶解度的有机溶剂引言:硫酸钙是一种常见的无机盐,其溶解度对于许多实验和工业应用都具有重要意义。
然而,硫酸钙的溶解度较低,这给其溶解和应用带来了一定的困难。
为了解决这个问题,科学家们不断研究和探索,发现了一些可以增大硫酸钙溶解度的有机溶剂。
本文将介绍一些常见的有机溶剂,并探讨它们如何增大硫酸钙的溶解度。
一、丙酮(Acetone)丙酮是一种常见的有机溶剂,具有良好的溶解性能。
研究表明,丙酮可以显著增大硫酸钙的溶解度。
这是因为丙酮分子中含有氧原子,可以与硫酸钙中的阳离子结合形成络合物,从而增加硫酸钙在丙酮中的溶解度。
二、甲醇(Methanol)甲醇是一种常用的极性有机溶剂,具有较好的溶解性能。
研究表明,甲醇可以有效地增大硫酸钙的溶解度。
这是因为甲醇分子中含有羟基(OH),可以与硫酸钙中的阳离子结合形成络合物,从而提高硫酸钙在甲醇中的溶解度。
三、乙醇(Ethanol)乙醇是一种常用的有机溶剂,也是一种常见的饮用酒精。
研究表明,乙醇可以显著增大硫酸钙的溶解度。
这是因为乙醇分子中含有羟基(OH),可以与硫酸钙中的阳离子结合形成络合物,从而增加硫酸钙在乙醇中的溶解度。
四、乙酸乙酯(Ethyl acetate)乙酸乙酯是一种常见的酯类有机溶剂,具有良好的溶解性能。
研究表明,乙酸乙酯可以有效地增大硫酸钙的溶解度。
这是因为乙酸乙酯分子中含有酯基,可以与硫酸钙中的阳离子结合形成络合物,从而提高硫酸钙在乙酸乙酯中的溶解度。
五、二甲基亚砜(Dimethyl sulfoxide)二甲基亚砜是一种常用的有机溶剂,具有较强的极性和良好的溶解性。
研究表明,二甲基亚砜可以显著增大硫酸钙的溶解度。
这是因为二甲基亚砜分子中含有硫原子,可以与硫酸钙中的阳离子结合形成络合物,从而增加硫酸钙在二甲基亚砜中的溶解度。
六、对甲苯(p-Xylene)对甲苯是一种常用的有机溶剂,具有较好的溶解性能。
研究表明,对甲苯可以有效地增大硫酸钙的溶解度。
沸点表

沸点表、化学性能(国际标准)沸点表(℃,l标准大气压)1、液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性2、液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒3、甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃4、二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性5、石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似6、乙醚34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性7、戊烷36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性8、二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强9、二硫化碳46.23 微溶与水,与多种有机溶剂混溶麻醉性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大10、丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大11、1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性12、甲醇64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性,13、四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒14、己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
麻醉性,刺激性15、三氟代乙酸71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物16、1,1,1-三氯乙烷74.0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂17、四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强18、乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性19、乙醇78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性20、丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮21、苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性22、环己烷80.72 与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用23、乙睛81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒24、异丙醇82.40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇25、1,2-二氯乙烷83.48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌26、乙二醇二甲醚85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
有机溶剂之主要用途

定義 一、
(6)
溶解力:
(一)苯胺點Aniline Point (二)K-B值(Kauri-Butanol Value)
蒸發速度:
溶劑之乾燥蒸發速度關係到表層膜面的 平滑度,故需以溶劑之蒸發乾燥速度為 基準來選用合適之溶劑。
SH...等),使該物質轉變為具較大極 性而無活性之新陳代謝產物,順利排 出體外。
毒性物質之轉化(2)
第二型酵素轉換反應
(Phase II enzyme reaction) 係指經Phase I reaction 後之代謝產物 ,仍為不具水溶性之物質,故再與體 內之有機物( glucuronic acid, sulfuric acid, acetic acid, amino acid…)結合, 使之轉化為具水溶性後隨尿液排出。
有機溶劑之用途(7)
(三)第三種有機溶劑:
1.汽油
Gasoline (C6-C12)
2.煤焦油精 Coal tar naphtha
3.石油醚 Petroleum ether (C6-C8)
4.石油精 Petroleum naphtha (C7-C10)
5.輕油精 Petroleum benzin (C6-C7)
定義 一、
(4)
有機溶劑: 指正常溫度或氣壓下 為揮發性之液體,且 具有溶解其他物質特 性之有機化合物。
定義 一、
(5)
混合溶劑:二種以上溶劑混合物,且仍具溶劑 性 能者。
溶解作用:溶劑之分子滲入溶質,使溶質分子間 之內力減少而分離、擴散。
同性互溶:溶劑與溶質之化學親和力相似性愈大 或化學組成相同者,其相互溶解度愈 大。包括極性溶劑與非極性溶劑。
乙醇相对挥发度表

乙醇相对挥发度表1. 介绍乙醇是一种常见的有机溶剂,具有较高的挥发性。
相对挥发度是一种描述物质挥发性能的指标,是指物质在一定条件下与标准物质的挥发速率的比值。
乙醇相对挥发度表是根据实验测得的乙醇与其他物质相对挥发速率的数据整理而成,可以用于评估乙醇与其他物质的挥发性能。
2. 实验原理相对挥发度的测量需要使用到标准物质,常用的标准物质是丁酮(假定其挥发速率为100)。
测量时,将乙醇和丁酮分别置于密封容器中,在一定温度下测量两者的挥发速率。
乙醇相对挥发度可以通过下述公式计算得出:相对挥发度 = 乙醇挥发速率 / 丁酮挥发速率× 1003. 实验步骤1.准备实验设备和试剂。
需要准备密封容器、恒温水浴器、测量乙醇和丁酮挥发速率的仪器等。
2.将乙醇和丁酮分别置于密封容器中。
3.将两个容器放入恒温水浴器中,设定合适的温度,保持恒温条件。
4.在一定时间间隔内,分别测量乙醇和丁酮的挥发速率,并记录数据。
5.计算乙醇的相对挥发度。
6.重复实验,获取多组数据以提高精确度。
7.通过统计处理实验数据,得到乙醇相对挥发度表。
4. 拟合与推导根据实验得到的数据,可以进行拟合与推导,得到乙醇相对挥发度与温度、浓度等因素的关系。
拟合后的乙醇相对挥发度表可以更准确地预测乙醇在不同条件下的挥发性能。
5. 乙醇相对挥发度表以下是根据实验数据整理得到的乙醇相对挥发度表(以丁酮挥发速率为100):温度(摄氏度) 乙醇相对挥发度20 82.325 87.630 92.135 96.440 101.245 105.750 110.355 115.860 121.76. 应用与意义乙醇是一种广泛应用于工业和日常生活中的溶剂,在多个领域具有重要的应用价值。
乙醇相对挥发度表可以帮助科研人员、生产人员等更好地了解乙醇在不同条件下的挥发性能,为相关领域的工艺设计、质量控制等提供参考依据。
乙醇相对挥发度表的编制还有助于对乙醇与其他物质的挥发性能进行比较研究,提高对混合溶液挥发性能的预测能力。
苯的比热容与温度对照表

苯的比热容与温度对照表苯是一种常见的有机溶剂,常用于工业用途,广泛应用于化学溶剂、染料、润滑剂、工业树脂等工业产品的制造。
它的比热容的大小取决于温度。
多种实验研究表明,在苯的温度范围内,它的比热容随温度的变化而变化。
比热容可以用来衡量物质能量的升降、储存和发射。
因此,苯的比热容对于温度测量和分析物质能量变化非常重要。
近年来,随着工业研究领域的发展,许多研究者开始研究苯的比热容和温度之间的关系。
在温度范围内,它的比热容可以通过测量不同温度的苯样本的比热容来测定。
通过实验,可以得出苯的比热容与温度的对照表。
根据苯的比热容与温度对照表,在低温下,苯的比热容比空气和水低,其值为2.45-2.62J/g/K,当温度到达100℃时,苯的比热容值为2.99J/g/K,当温度到达常温时,苯的比热容值为3.92J/g/K。
随着温度的升高,苯的比热容值也会变大,一直增长到温度超过500℃时,苯的比热容值为4.75J/g/K,然后在继续增长至高温时,就会保持恒定的值。
研究苯的比热容与温度之间的关系比较复杂,因此,研究者使用多种方法来测量温度与比热容之间的关系,并根据测量结果,建立了一个完整的苯的比热容和温度关系对照表。
从苯的比热容对照表中可以得出,一般情况下,在苯的温度范围内,比热容大小取决于温度,并且随着温度的增加而增加,并且在高温情况下比热容会保持恒定。
在苯的工业应用中,研究者可以利用这种比热容的变化特点,实施温度控制,以保护苯的物理性质。
苯的比热容和温度之间的关系是一个复杂的问题,它的比热容的大小随温度的变化有很大的不同。
因此,有必要根据实验测量结果,建立一个完整的苯的比热容和温度对照表,以便在苯的应用中更好地掌握它们之间的关系,进行恰当的温度控制,以保护苯的性能。
丙二醇水溶液粘度对照表

丙二醇水溶液粘度对照表一、引言丙二醇(Propylene Glycol)是一种无色、无味、无毒的有机化合物,常用于制药、食品、化妆品等行业中。
其水溶液的粘度是一个重要的参数,对于生产过程和产品性能都有着重要的影响。
本文将根据丙二醇水溶液的浓度,列出一份丙二醇水溶液粘度对照表,并对表中数据进行解读。
二、丙二醇水溶液粘度对照表以下是一份丙二醇水溶液粘度对照表:浓度(%)粘度(mPa·s)5 4.510 6.820 10.230 15.340 21.650 30.560 41.370 56.280 75.890 102.3100 140.0三、对照表数据解读1. 从对照表中可以看出,丙二醇水溶液的粘度随着浓度的增加而增加。
这是因为在水中溶解的丙二醇分子间发生了相互作用,导致流动阻力增大,从而使溶液的粘度增加。
2. 在低浓度范围内,丙二醇水溶液的粘度增加较为缓慢。
但当浓度超过50%时,粘度的增加速度明显加快。
这是因为高浓度下,丙二醇分子间的相互作用更加密集,导致分子间空间受限,流动阻力增大。
3. 丙二醇水溶液的粘度随着温度的升高而下降。
在实际生产中,可以通过调节温度来控制丙二醇水溶液的粘度,以满足不同工艺要求。
4. 丙二醇水溶液的粘度对于某些应用来说非常重要。
例如,在制药行业中,药物的输送速度和稳定性与丙二醇水溶液的粘度密切相关。
因此,通过调节丙二醇水溶液的浓度,可以实现对药物输送速度的控制。
5. 在食品行业中,丙二醇被用作食品添加剂,主要作为保湿剂和溶剂。
丙二醇水溶液的粘度对于食品的质感和口感有一定影响。
通过调节丙二醇水溶液的浓度,可以实现对食品口感的调控。
四、结论本文通过列出丙二醇水溶液粘度对照表,并对表中数据进行解读,得出了以下结论:1. 丙二醇水溶液的粘度随着浓度的增加而增加。
2. 在低浓度范围内,丙二醇水溶液的粘度增加较为缓慢,但当浓度超过50%时,粘度的增加速度明显加快。
3. 丙二醇水溶液的粘度随着温度的升高而下降。
附录1常用有机溶剂在水中的溶解度

附录附录1:常用有机溶剂在水中的溶解度附录2:关于有毒化学药品的知识1、高毒性固体很少量就能使人迅速中毒甚至致死。
2、毒性危险气体3、毒性危险液体和刺激性物质长期少量接触可能引起慢性中毒,其中许多物质的蒸气对眼睛和呼吸道有强刺激性。
4.其他有害物质(1)许多溴代烷和氯代烷,以及甲烷和乙烷的多卤衍生物,特别是下列化合物:(2)芳胺和脂肪族胺类的低级脂肪族胺的蒸气有毒。
全部芳胺,包括它们的烷氧基、卤素、硝基取代物都有毒性。
下面是一些代表性例子:(3)酚和芳香族硝基化合物5、致癌物质下面列举一些已知的危险致癌物质:(1)芳胺及其衍生物联苯胺(及某些衍生物) β-萘胺二甲氨基偶氯苯α-萘胺(2)N-亚硝基化合物N-甲基-N-亚硝基苯胺N-亚硝基二甲胺N-甲基-N-亚硝基脲N-亚硝基氢化吡啶(3)烷基化剂双(氯甲基)醚硫酸二甲脂氯甲基甲醚碘甲烷重氮甲烷β-羟基丙酸内酯(4)稠环芳烃苯并[a]芘二苯并[c,g]咔唑二苯并[a,h]蒽7,12-二甲基苯并[a]蒽(5)含硫化合物硫代乙酸胺(thioacetamide) 硫脲(6)石棉粉尘6、具有长期积累效应的毒物这些物质进入人体不易排出,在人体内累积,引起慢性中毒。
这类物质主要有:(1)苯。
(2)铅化合物,特别是有机铅化合物。
(3)汞和汞化合物,特别是二价汞盐和液态的有机汞化合物。
在使用以上各类有毒化学药品时,都应采取妥善的防护措施。
避免吸入其蒸气和粉尘,不要使它们接触皮肤。
有毒气体和挥发性的有毒液体必须在效率良好的通风橱中操作。
汞的表面应该用水掩盖,不可直接暴露在空气中。
装盛汞的仪器应放在一个搪瓷盘上以防溅出的汞流失。
溅洒汞的地方迅速撒上硫磺石灰糊。
附录3:常用法定计量单位[注][注](1)本表选自1984.2.27国务院“关于在我国统一实行法定计量单位的命令”。
表中量的名称是国家标准GB3102规定的。
(2)*为我国选定的非国际单位制的单位;**为已习惯使用应废除的单位,其余为SI单位。
溶解无机盐的有机溶剂_概述说明以及解释

溶解无机盐的有机溶剂概述说明以及解释1. 引言1.1 概述:溶解无机盐的有机溶剂是化学领域中一个重要的研究方向。
有机溶剂作为一类具有较高的溶解能力和较大的容量的溶质,对于将无机盐溶解在其中起到了关键的作用。
本文旨在概述并说明有机溶剂对无机盐溶解性能的影响因素、实验方法以及应用案例分析。
1.2 文章结构:本文分为五个章节进行探讨和阐述。
引言部分进行整体介绍,正文部分包含有机溶剂定义与特性、无机盐溶解基本原理以及常见有机溶剂对无机盐溶解性能影响因素等内容。
接下来是实验方法总结章节,涵盖传统实验方法介绍与比较、现代实验方法技术进展概述以及实验参数对结果的影响及数据分析方法讨论等内容。
第四章为应用案例分析,主要包括金属离子在有机溶剂中的配位化学反应研究进展综述、有机电解质在催化反应中的作用探讨,以及应用于材料科学领域的无机盐-有机溶剂体系研究现状。
最后一章为结论与展望,对未来研究方向进行展望并总结全文。
1.3 目的:本文的目的在于对溶解无机盐的有机溶剂进行全面而深入的探讨,旨在揭示有机溶剂对无机盐溶解性能的影响因素、实验方法以及应用案例分析。
通过该篇文章,读者将更好地理解有机溶剂对无机盐溶解行为的作用,从而为相关领域的研究提供一定的理论基础和实践指导。
同时,通过展望未来研究方向和潜力,在工业和实际应用中发现更多可能性,并进一步推动该领域的发展。
以上就是引言部分内容,请根据需要添加细节或修改句子以满足您的要求。
2. 正文:2.1 有机溶剂的定义与特性有机溶剂是由碳和氢构成的化合物,具有较好的溶解性能和挥发性。
这些溶剂通常是液体,可以在常温下存在,并且能够与无机盐发生相互作用。
有机溶剂具有多种不同的特性,包括极性、蒸汽压、沸点和介电常数等。
这些特性将会对其与无机盐之间的相互作用产生重要影响。
2.2 溶解无机盐的基本原理溶解无机盐的基本原理可以归纳为两个方面:离子-离子相互作用和离子-溶剂相互作用。
在离子-离子相互作用中,正负电荷之间的吸引力使得无机盐分子逐步进入溶液中并分散开来。
橡胶材质的耐腐蚀性
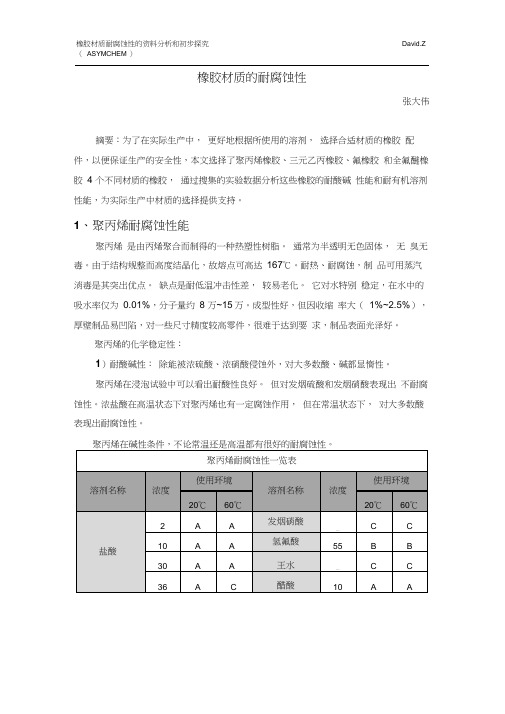
橡胶材质的耐腐蚀性张大伟摘要:为了在实际生产中,更好地根据所使用的溶剂,选择合适材质的橡胶配件,以便保证生产的安全性,本文选择了聚丙烯橡胶、三元乙丙橡胶、氟橡胶和全氟醚橡胶4 个不同材质的橡胶,通过搜集的实验数据分析这些橡胶的耐酸碱性能和耐有机溶剂性能,为实际生产中材质的选择提供支持。
1、聚丙烯耐腐蚀性能聚丙烯是由丙烯聚合而制得的一种热塑性树脂。
通常为半透明无色固体,无臭无毒。
由于结构规整而高度结晶化,故熔点可高达167℃。
耐热、耐腐蚀,制品可用蒸汽消毒是其突出优点。
缺点是耐低温冲击性差,较易老化。
它对水特别稳定,在水中的吸水率仅为0.01%,分子量约8 万~15万。
成型性好,但因收缩率大(1%~2.5%),厚壁制品易凹陷,对一些尺寸精度较高零件,很难于达到要求,制品表面光泽好。
聚丙烯的化学稳定性:1)耐酸碱性:除能被浓硫酸、浓硝酸侵蚀外,对大多数酸、碱都显惰性。
聚丙烯在浸泡试验中可以看出耐酸性良好。
但对发烟硫酸和发烟硝酸表现出不耐腐蚀性。
浓盐酸在高温状态下对聚丙烯也有一定腐蚀作用,但在常温状态下,对大多数酸表现出耐腐蚀性。
聚丙烯在碱性条件,不论常温还是高温都有很好的耐腐蚀性。
6A:几乎不受影响 B :有轻微变色及重量变化,无延展性变化C:受到变色等肉眼可见的影响,有某种程度的尺寸及重量变化D:有时会脆化、膨胀,外观、重量、延展性变化明显2)耐有机溶剂腐蚀性聚丙烯的化学稳定性很好,对其它各种化学试剂都比较稳定,但低分子量的脂肪烃、芳香烃和氯化烃等能使聚丙烯软化和溶胀。
室温下还没有一种溶剂能使聚丙烯溶解,只是低分子量的脂肪烃、芳香烃和氯化烃对它有软化或溶胀作用,不能溶解。
聚丙烯非极性聚合物,对极性溶剂十分稳定(如醇、酚、醛、酮和大多数羧酸),在部分非极性有机溶剂中容易溶解或溶胀。
根据相似相溶原理,甲苯、苯、二甲苯、二氯甲烷、正己烷、环己烷、直链烷烃类、卤代烷类、石油醚等这些有机溶剂会对聚丙烯产生腐蚀。
天然产物化学第二章

甲份
乙份
验
EtOH溶解
流 程
HCl溶液
不溶物
(检测生物碱)
EtOAc溶解
EtOAC溶液
醇溶液
图
(检查鞣质、酚类、有机酸、 2-1 黄酮、蒽醌、甾体、三萜等)
5%NaOH溶液振摇
EtOH溶解
碱水液
EtOAC液
浓缩物(检查萜类、内酯、强心甘)
(检查有机酸、酚类)
定性试验可初步验证有无上述各类物质
生物碱 常用碘化铋钾(Dragendorff试剂),显棕黄
一般先采用极性低的、与水不相混溶的有机溶剂,如石油醚、苯、氯 仿、乙醚等;这些溶剂的选择性能强,但有些有毒,易燃(氯仿除 外),价格昂贵,对浸入植物组织的能力较弱;
再用能与水相溶的有机溶剂,如丙酮、乙醇、甲醇等,最后用水提取。 目前常用的两种系统为A、己烷——乙醚——甲醇——水;B、己烷—
—二氯甲烷——甲醇——水。在室温下一次提取,这样可使植物中非 极性与极性化合物得到初步分离。
a
16
(一)溶剂法
D. 酸性、碱性有机溶剂
如果有效成分是酸性或碱性化合物,常可加入适当的酸或碱,再 用有机溶剂提取。 例如生物碱在植物体中一般与酸结合成盐存 在,在生药中加入适量的碱液,拌匀,使生物碱游离出来,再用 有机溶剂(如苯、氯仿)提取。同样,有机酸可加酸使其游离, 然后用有机溶剂提取。
最常用铅盐法——中性乙酸铅或碱式乙酸铅,在水或 稀醇溶液中能与许多物质生成难溶性的铅盐或 鉻盐沉淀。
脱铅方法通常用硫化氢气体,使分解并转为不溶性硫 化铅沉淀而除去。 通入空气或CO2让气泡带出多余的硫化氢气体
a
24
脱铅的方法也可使用硫酸、磷酸、硫酸钠等物 质,但生成的硫酸铅及磷酸铅在水中有一定的 溶解度,所以脱铅不彻底;
dmf在有机反应中的作用

DMF在有机反应中的作用1. 简介N,N-二甲基甲酰胺(DMF)是一种常用的有机溶剂,具有广泛的应用领域。
在有机反应中,DMF不仅作为溶剂发挥着溶解和传质的作用,还可以参与反应,并对反应过程起到催化、促进、控制等作用。
2. DMF的物理性质DMF是一种无色透明液体,在室温下具有较高的沸点和闪点。
它具有较强的极性,可溶于水和大多数有机溶剂。
由于其极性较大,DMF能够与许多不易溶解的有机物形成稳定的溶液。
3. DMF在催化反应中的作用3.1 催化剂载体DMF可以作为催化剂载体,在某些催化反应中起到稳定催化剂、提高活性、改善选择性等效果。
例如,将金属配合物或酸碱催化剂负载在DMF上,可增加其表面积、改善分散度,并提高催化效果。
3.2 活化试剂DMF可以作为活化试剂,将某些反应物激活,增加其反应性。
例如,在亲核取代反应中,DMF可以与卤代烷发生亲核取代反应,生成活化的亲核试剂。
这种活化作用可以促进反应的进行,并提高产率。
3.3 溶剂效应DMF作为有机溶剂,可以改变反应体系的溶解度、极性和分子间相互作用力等因素,从而影响反应速率、平衡常数和产物分布等。
例如,在S_N2取代反应中,DMF可作为溶剂调节离子间距离、稳定过渡态,并降低亲核试剂与溶剂分子的竞争。
4. DMF在促进反应中的作用4.1 极性助催化剂由于DMF具有较高的极性和良好的溶解性能,它可以促进许多不易发生的有机反应。
例如,在氧化还原反应中,DMF可提供良好的电子传递介质,促进电子转移过程,并增加反应速率。
4.2 活泼质子源DMF具有较强的酸性,在一些酸催化反应中可作为活泼质子源。
例如,在酯化反应中,DMF可与醇反应生成活性酯化剂,促进酯的形成。
4.3 环境调节剂DMF可以调节反应体系的环境条件,使得反应在温和的条件下进行。
例如,在氢化反应中,DMF作为溶剂和氢源参与反应,可以在较低的温度下实现高效催化。
5. DMF在控制反应中的作用5.1 反应中间体稳定剂由于DMF具有较强的极性和配位能力,它可以与某些不稳定的反应中间体形成稳定络合物。
常用溶剂的挥发速度

常用溶剂的挥发速度名称------沸点C ----比挥发速度二氯甲烷------- 40 ------- 2750四氯化碳------- 76.8 ------- 1280醋酸甲酯------- 57.2 ------- 1180丙酮 --------- 56.2 -------- 1120正己烷------- 65 〜69 --------- 1000二氯乙烷-------- 84 --------- 750环已烷-------- 80.8 --------- 720醋酸乙酯------- 77.1 ------- 615丁酮 ---------- 79.6 --------- 572四氢呋喃-------- 66 --------- 501苯----------- 80 --------- 500正庚烷-------- 98.0 --------- 386甲醇 ------- 64.5 ---------- 370甲苯-------- 111.0 --------- 240异丙醇------- 82.5 -------- 205乙醇 ------- 78.1 ---------- 203醋酸丁酯------- 26.5 ------- 100二甲苯------- 135 〜145 ------ 68甲基溶纤剂 ---- 124.5 -------- 55丁醇 --------- 1 17.1 -------- 45环已酮------- 155 〜156 ---- 25三氯乙烯------- 86 〜88 ------------ 快二氧六环------- 101 〜102 ------ 中二甲基甲酰胺---- 153 ------------ 慢醋酸戊酯------- 130 〜150 ------ 慢溶剂挥发速度[质量/ (面积邓寸间)]通常以醋酸正丁酯的挥发速度为基准,醋酸正丁酯的RER 定义为100 ,则其它纯溶剂的R i 值为与其为基准的相对挥发速度( RER )。
甲醇42度的导热系数对照表

甲醇42度的导热系数对照表甲醇是一种常见的有机溶剂,具有较好的导热性能。
导热系数是衡量物质导热性能的重要指标之一。
本文将以甲醇42度的导热系数对照表为标题,探讨甲醇导热系数的相关知识。
一、什么是导热系数?导热系数是指物质在单位温度梯度下单位时间内传导热量的能力。
它反映了物质导热性能的好坏,导热系数越大,物质的导热性能越好。
二、甲醇的导热系数根据甲醇42度的导热系数对照表,我们可以得到不同温度下甲醇的导热系数数据。
导热系数随温度的变化而变化,不同温度下的导热系数也会有所差异。
通过对照表中的数据,我们可以了解甲醇在不同温度下的导热性能。
三、甲醇导热性能的影响因素甲醇的导热性能受到多种因素的影响,主要包括以下几个方面:1. 温度:温度是影响导热性能的重要因素之一。
一般来说,温度越高,物质的导热系数越大。
2. 纯度:纯度也会对甲醇的导热性能产生影响。
纯度较高的甲醇通常具有更好的导热性能。
3. 含水量:甲醇中的含水量也会对导热性能产生影响。
含水量高的甲醇导热性能较差。
四、甲醇导热系数的应用领域甲醇作为一种常用的有机溶剂,在工业生产和科学研究中有着广泛的应用。
其导热性能决定了其在传热过程中的表现。
甲醇的导热系数对于热交换设备的设计和工艺参数的确定具有重要意义。
在化工、制药、石油等行业,甲醇的导热性能也被广泛应用于热传导材料的选择和设计。
五、甲醇导热性能的优化方法为了提高甲醇的导热性能,可以采取以下措施:1. 提高甲醇的纯度,减少杂质对导热性能的影响。
2. 降低甲醇中的含水量,避免水分对导热性能的影响。
3. 调整温度,选择合适的温度范围以提高甲醇的导热性能。
六、甲醇导热性能的研究进展随着科学技术的不断进步,人们对甲醇导热性能的研究也在不断深入。
研究人员通过实验和理论模拟等手段,探究甲醇导热性能的机理和影响因素,以期能够更好地应用于实际生产和科研领域。
七、结语甲醇作为一种常见的有机溶剂,具有较好的导热性能。
导热系数是评价物质导热性能的重要指标之一,而甲醇42度的导热系数对照表提供了有关甲醇导热性能的重要数据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
N,N- 6.4 155 二甲 基甲 酰胺
0.92 100
与水混溶,可混溶于多数 急性中毒 有机溶剂
二甲 7.2 189 2.00 100 基亚
砜
与水、甲醇、乙醇、乙二 微毒,对眼有刺激 醇、甘油、乙醛、丙酮乙 性 酸乙酯吡啶、芳烃混溶
4.4 77 乙酸 乙酯
0.45 8.7
与醇、醚、氯仿、丙酮、 低毒,麻醉性 苯等大多数有机溶剂溶 解,能溶解某些金属盐
与水混溶,很好的溶解乙 吸入微毒,经口低 醇、乙醚、脂肪烃、芳香 毒 烃、氯化烃
2.4 111 0.59 0.051 溶于水,与甲醇、乙醇、 有毒,麻醉作用
甲苯
氯仿、丙酮、乙醚、冰醋来自酸、苯等有机溶剂混溶水 9.0 100 1.00 100
生命之源
2.5 139 0.61 0.018 与乙醇、氯仿或乙醚能任 二 甲 苯 对 眼 及 上
1.00 0.01
不溶于水,溶于乙醇、乙 对 眼 和 上 呼 吸 道
醚、苯、丙酮等多数有机 有轻度刺激作用。
溶剂
持续吸入可引起
头晕、恶心、倦睡
和其他一些麻醉
症状
二氯 3.5 84 乙烷
0.79 0.81 与乙醇、氯仿、乙醚混溶 属微毒类
二氯 3.1 41 甲烷
0.44 1.6
与醇、醚、氯仿、苯、二 低毒,麻醉性强 硫化碳等有机溶剂混溶
二甲 苯
意混合
呼吸道有刺激作 用,高浓度时,对 中枢系统有麻醉
作用
正丁 4.0 125 0.73 0.43 微溶于水,溶于乙醇、醚等多 低毒
醇
数有机溶剂
四氯 1.6 77 化碳
0.97 0.08 微溶于水,易溶于多数有机溶
剂
4.1 61 氯仿
0.57 0.815 与乙醇、乙醚、石油醚、 中等毒性,强麻醉 卤代烃、四氯化碳、二硫 性 化碳等混溶
0.2 81
环已 烷
醇不互溶
5.1 65 甲醇
0.60 100
与水、乙醚、醇、酯、卤 中等毒性,麻醉性 代烃、苯、酮混溶
3.9 82
异丙 醇
2.30 100
与醇、醚、氯仿和水混溶,微毒类 能溶解生物碱、橡胶、虫 胶、松香、合成树脂等多 种有机物和某些无机物, 与水形成共沸物,不溶于 盐溶液
4.0 65 四氢 呋喃
0.55 100
5.2 78 乙醇
1.20 100
与水、乙醚、氯仿、酯、 微毒类,麻醉性 烃类衍生物等有机溶剂混 溶
2.8 35 乙醚
0.32 6.89 微溶于水,易溶与盐酸.与 麻醉性 醇、醚、石油醚、苯、氯 仿等多数有机溶剂混溶
正已 0.0 69 0.33 0.001 不溶于水,可与乙醚、氯 低毒
烷
仿混溶,溶于丙酮,与甲
常用有机溶剂性能
溶剂
极 性 指 数
沸 点 (℃)
黏 度
水中 溶解 度
溶解性
毒性
6.2 118 1.26 100 与水、乙醇、乙醚、四氯 低毒,浓溶液毒性
乙酸
化碳混溶,不溶于二硫化 强
碳及 C12 以上高级脂肪烃
丙酮 5.1 56 0.32 100 与水、醇、醚、烃混溶 低毒
5.8 82 乙腈
0.37 100
与水、甲醇、乙酸甲酯、 中等毒性,大量吸 乙酸乙酯、丙酮、醚、氯 入蒸气,引起急性 仿、四氯化碳、氯乙烯及 中毒 各种不饱和烃混溶,但是 不与饱和烃混溶
2.7 80 苯
0.65 0.18
难溶于水,与甘油、乙二 剧毒 醇、乙醇、氯仿、乙醚、 四氯化碳、二硫化碳、丙 酮、甲苯、二甲苯、冰醋 酸、脂肪烃等大多有机物 混溶
