高三化学常用的物理量精选课件PPT
合集下载
鲁科版化学必修1《化学中常用的物理量-物质的量》课件

02 物质的量简介
物质的量的定义
物质的量
表示一定数目粒子的集合体,符号为n, 是国际单位制中7个基本物理量之一。
物质的量的计算公式为
n=N/NA,其中N表示微粒数目,NA 表示阿伏伽德罗常数。
物质的量的单位
01
摩尔是物质的量的单位,符号为 mol,用于表示物质所含有的微粒 数目。
02
1摩尔的任何物质所包含的该物质 的微粒个数都是相同的,这个数 目被称为阿伏伽德罗常数。
1 2
计算所需物质的质量
通过已知的摩尔质量和所需的物质的量,计算所 需物质的质量。
计算反应物和生成物的物质的量
通过已知的反应方程式和所需的物质的量,计算 反应物和生成物的物质的量。
3
计算反应速率
通过已知的反应时间和反应物的物质的量变化, 计算反应速率。
化学实验中如何计算反应物和生成物的物质的量
根据反应方程式计算
阿伏伽德罗定律是化学中的重要定律之一,它指出在同温、同压下,相同体积的任何气体都含有相同数目的分子。
详细描述
阿伏伽德罗定律是气体化学中的基本定律,它指出在同温、同压下,相同体积的任何气体都含有相同数目的分子, 而不是原子或离子。这个定律是由意大利化学家阿伏伽德罗在19世纪初提出的,因此得名。根据阿伏伽德罗定律, 气体的物质的量、体积和分子数目之间存在一定的关系。
应用,与日常生活息息相关。
物质的量与其他物理量的关系
03
物质的量与其他物理量如质量、体积、浓度等有密切的联系,
是化学计算的基础。
学习目标
01
02
03
04
理解物质的量的概念及其单位 。
掌握物质的量与质量、体积、 浓度等物理量的换算关系。
鲁科版高中化学必修一《化学中常用的物理量——物质的量》认识化学科学PPT(第二课时物质的量浓度)

3.注意事项 (1)进行有关物质的量浓度的计算时要注意 V 表示的是溶液的
体积,不是溶剂的体积,其常用单位为 L,计算时经常需要 与 mL 相互转化。 (2)从一定物质的量浓度的溶液中取出任意体积的溶液,其浓 度不变,但所含溶质的量因体积不同而不同。 (3)结晶水合物溶于水时,结晶水作为溶剂。例如,CuSO4·5H2O 溶于水时,其中的 CuSO4 作为溶质,结晶水与其他蒸馏水 均作为溶剂。
学的重要作用。 2.能运用物质的量、物质的量浓度之间的相互关系进行简
单计算。
第二页,共五十三页。
第三页,共五十三页。
ቤተ መጻሕፍቲ ባይዱ
[自学新教材] 阅读教材,回答下列问题: 如图所示,图 1 为实验室分析纯盐酸试剂瓶上的标签,图 2 为医院某患者血液化验单的一部分。
第四页,共五十三页。
(1)图 1 盐酸标签中“含量(HCl)——35.38%”表示 _1_0_0_g_盐__酸__中__含__有__3_5_._3_8_g__H_C__l _。 (2)图 2 化验单中表示 K、Na 含量的物理量是物_质__的__量__浓__度___,该 物 理 量 表 示单__位__体__积__溶__液__中__所__含__溶__质__B__的__物__质__的__量_______ , 符 号:__c_B__,常用单位有__m_o_l_·L__-_1、__m__o_l_·m__-_3、__m__m__o_l·_L_-_1___。
第十页,共五十三页。
2.下列关于 1 mol·L-1 K2SO4 溶液的说法正确的是
()
A.溶液中含有 1 mol K2SO4 B.1 mol K2SO4 溶于 1 L 水中 C.溶液中 c(K+ )=2 mol·L-1
D.1 L 溶液中含 2 mol K+、2 mol SO24-
【高中化学】化学中常用的物理量PPT课件

模型,尽可能多地列举出解决一定质量或体积 的宏观物质中所含粒子数的方法或途径。
序号
1 2 一个一个地数
方法或途径
先称量出1个微观粒子的质量,然后再用宏观物质的 质量除以1个微观粒子的质量,计算出微观粒子个数 先称量出由某一数目的微观粒子所组成的微粒集体 的质量,然后再用宏观物质的质量除以微粒集体的 质量,再乘以微粒集体所含有的微粒数,计算出碳原 子个数。 先测量出1个微观粒子的体积,然后再用宏观物质的 体积除以1个微观粒子的体积,计算出微观粒子个数 先数出1cm3宏观物质所含有的微观粒子个数,然后 再根据宏观物质的总体积,计算出微观粒子个数
可以利用相对原子质量
先测量出1个微观粒子的体积,然后再用宏观物质的体 积除以1个微观粒子的体积,计算出微观粒子个数
先数出1cm3宏观物质所含有的微观粒子个数,然后再根 据宏观物质的总体积,计算出微观粒子个数
×
×
建立模型
根据方法3,我们把这一微观粒子集体所含 微粒数目暂定为NA个,建立下列数学模型:
问题
结论
相对分子质量,单位为克
1mol物质的质量在数值 数值上等于其相对原子质量或 上有什么特点? 相同的温度、压强下, 固体、液体物质体积无明显规 1mol的不同物质的体积 在数值上有什么特点? 律,气体物质体积基本相同
小结:摩尔质量
1mol物质(即单位物质的量的物质)的质量叫摩 尔质量(单位:g/mol),符号为M。
3 4
5
分析评价
序号
1 2 一个一个地数
先称量出1个微观粒子的质量,然后再用宏观物质的质 量除以1个微观粒子的质量,计算出微观粒子个数
×
方法或途径
×
3 4 5
先称量出由某一数目的微观粒子所组成的微粒集体的质 量,然后再用宏观物质的质量除以微粒集体的质量,再 乘以微粒集体所含有的微粒数,计算出碳原子个数。
序号
1 2 一个一个地数
方法或途径
先称量出1个微观粒子的质量,然后再用宏观物质的 质量除以1个微观粒子的质量,计算出微观粒子个数 先称量出由某一数目的微观粒子所组成的微粒集体 的质量,然后再用宏观物质的质量除以微粒集体的 质量,再乘以微粒集体所含有的微粒数,计算出碳原 子个数。 先测量出1个微观粒子的体积,然后再用宏观物质的 体积除以1个微观粒子的体积,计算出微观粒子个数 先数出1cm3宏观物质所含有的微观粒子个数,然后 再根据宏观物质的总体积,计算出微观粒子个数
可以利用相对原子质量
先测量出1个微观粒子的体积,然后再用宏观物质的体 积除以1个微观粒子的体积,计算出微观粒子个数
先数出1cm3宏观物质所含有的微观粒子个数,然后再根 据宏观物质的总体积,计算出微观粒子个数
×
×
建立模型
根据方法3,我们把这一微观粒子集体所含 微粒数目暂定为NA个,建立下列数学模型:
问题
结论
相对分子质量,单位为克
1mol物质的质量在数值 数值上等于其相对原子质量或 上有什么特点? 相同的温度、压强下, 固体、液体物质体积无明显规 1mol的不同物质的体积 在数值上有什么特点? 律,气体物质体积基本相同
小结:摩尔质量
1mol物质(即单位物质的量的物质)的质量叫摩 尔质量(单位:g/mol),符号为M。
3 4
5
分析评价
序号
1 2 一个一个地数
先称量出1个微观粒子的质量,然后再用宏观物质的质 量除以1个微观粒子的质量,计算出微观粒子个数
×
方法或途径
×
3 4 5
先称量出由某一数目的微观粒子所组成的微粒集体的质 量,然后再用宏观物质的质量除以微粒集体的质量,再 乘以微粒集体所含有的微粒数,计算出碳原子个数。
化学课件《化学中常用的物理量——物质的量》优秀ppt13鲁科版

√ ⑤标准状况下1mol氧气与氮气的混合气体体积约为22.4L (
)
标准状况下,1mol任何气体的体积约是22.4L
气体摩尔体积
【练习二】N、n、V之间的关系 在标准状况下: 1、44.8L氧气的物质的量是多少? 2mol
2、0.5mol氧气的体积是多少?11.2L
3、33.6L的氮气中含有多少个氮气分子?9.03×1023
在相Fe同的条固件体下,5不6g同固体7.8、6g液/cm体3 的体积7.1不cm3
相N等aCl 固体 58.5g 2.167g/cm3 27.0cm3
H2O 液体 18OH 液体 46g
0.789g/ml
58.3ml
物质
状态
质量
密度 (0℃,101KPa)
体积
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
)
标准状况下,1mol任何气体的体积约是22.4L
气体摩尔体积
【练习二】N、n、V之间的关系 在标准状况下: 1、44.8L氧气的物质的量是多少? 2mol
2、0.5mol氧气的体积是多少?11.2L
3、33.6L的氮气中含有多少个氮气分子?9.03×1023
在相Fe同的条固件体下,5不6g同固体7.8、6g液/cm体3 的体积7.1不cm3
相N等aCl 固体 58.5g 2.167g/cm3 27.0cm3
H2O 液体 18OH 液体 46g
0.789g/ml
58.3ml
物质
状态
质量
密度 (0℃,101KPa)
体积
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
化学中常用计量PPT优秀

2.固体和液体的体积主要取决于: (1)物质所含微粒数的多少 (2)物质微粒本身的大小(粒子间距小,可忽略)
3.气体的体积主要取决于: (1)物质所含微粒数的多少 (2)物质微粒间距的大小(气体分子相对较小,可忽略)
气体摩尔体积:(Vm)
1、定义:单位物质的量气体所占的体积
2、物质的量与气体体积的关系: 例:己知a g某气体中含有b个分子,则cg该气体在标准状况下所占的体积为多少?
╳6、1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA; ╳7、常温常压下,1mol氦气含有的原子数为2NA;
Hale Waihona Puke 摩尔质量1、摩尔质量: (M)
定义:单位物质的量的物质所具有的质量。 单位:克/摩,表示为“g/mol”。
2、摩尔质量与物质式量的关系:
以克为单位,摩尔质量在数值上等于该微粒的式量 (即相对分子质量或相对原子质量)
来表示的溶液组成的物理量。单位为 mol/L
2、浓度的计算关系:
(1) cB =
nB V
(2) cB =1000M•ρ• w
• 3.溶液的稀释与混合
• (1)溶液的稀释定律
• 由溶质质量稀释前后不变有:
• m =m ×m % =m ×m % B 浓 浓 稀 稀 0023mol,所以其物质的量浓度为0.
在不考虑体积改变的情况下,第二小题可以采用逆向思维来回答,若加入的碳酸钾溶液的体积为V毫升,则有:(100+V) × 10-
• 由溶质稀释后物质的量不变有: 3L×0.
规格:50mL、100mL、250mL、500mL和1000mL
mB =m浓×m浓 % =m稀×m稀%
• n =C ×V =C ×V 由即溶M=质m稀/n释后物质B的量不变有浓:
3.气体的体积主要取决于: (1)物质所含微粒数的多少 (2)物质微粒间距的大小(气体分子相对较小,可忽略)
气体摩尔体积:(Vm)
1、定义:单位物质的量气体所占的体积
2、物质的量与气体体积的关系: 例:己知a g某气体中含有b个分子,则cg该气体在标准状况下所占的体积为多少?
╳6、1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA; ╳7、常温常压下,1mol氦气含有的原子数为2NA;
Hale Waihona Puke 摩尔质量1、摩尔质量: (M)
定义:单位物质的量的物质所具有的质量。 单位:克/摩,表示为“g/mol”。
2、摩尔质量与物质式量的关系:
以克为单位,摩尔质量在数值上等于该微粒的式量 (即相对分子质量或相对原子质量)
来表示的溶液组成的物理量。单位为 mol/L
2、浓度的计算关系:
(1) cB =
nB V
(2) cB =1000M•ρ• w
• 3.溶液的稀释与混合
• (1)溶液的稀释定律
• 由溶质质量稀释前后不变有:
• m =m ×m % =m ×m % B 浓 浓 稀 稀 0023mol,所以其物质的量浓度为0.
在不考虑体积改变的情况下,第二小题可以采用逆向思维来回答,若加入的碳酸钾溶液的体积为V毫升,则有:(100+V) × 10-
• 由溶质稀释后物质的量不变有: 3L×0.
规格:50mL、100mL、250mL、500mL和1000mL
mB =m浓×m浓 % =m稀×m稀%
• n =C ×V =C ×V 由即溶M=质m稀/n释后物质B的量不变有浓:
海南省华东师范大学第二附属中学乐东黄流中学高三化学复习:化学中常用的物理量课件(共16张PPT)

完成下列关系图
微粒数( )氢原子
氧原子( )微粒数
6.02×1023个水分子
1 mol H2O
物质的量( )H
物质的量( )O
问题:1 molD2O中含有质子和中子的数目?
物质的量是把宏观与微观联系起来的物理量
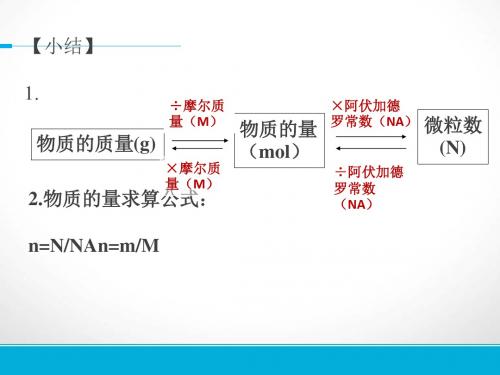
n m V N C.V M Vm NA
高频考点
一、有 n = 公式的应用
1.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA
2、利用太阳能分解制氢,若光解0.0V 2
L(标准情况)
Vm
mol水,.可生成H2的体积为
3、2 mol 气体的体积约为 44.8L,请判断是否正确并说出原因?
二、粒子数的计算
判断下列说法是否正确 1、18 g的D2O中含有的质子数为10NA( ) 2、18gD2O和18gH2O中含有的质子数均为10NA( )
1、常温常压下,124 g P4中所含P—P键数目为4NA 2、1mol 二氧化硅中含有2 NA个Si-O键,是否正确?
12 g金刚石中含有化学键的数目为4NA
二、物质的量浓度(C) 1:定义(必修一P25)
2:计算公式 C=n/V
3:浓度的配制
问题1:配制一定浓度所需要的 玻璃仪器有哪些?
问题2:如何配制100mL 1mol/L NaC l溶液
4、误差分析 总复习P23 误差分析思维导图
5、溶液的稀释
练习:将30ml 0.5 mol/L NaOH 溶液加水稀释到500 mL, 稀释后溶液中NaOH的物质的量溶度为多少?
3、22.4 L(标准状况)氨气含有的质子数为18NA () 4、2L 0.5mol/L亚硫酸溶液中含有的H+个数为2NA( )
《化学中常用的物理量——物质的量》认识化学科学PPT教学课件

p1/p2=n1/n2
③ 同温同压下,任何气体
ρ1/ρ2=M1/M2=d(相对)
④ 同温同压下,等质量的任何气体 V1/V2=M2/M1
六GR、ADU概AT括ION整合
DEFENSE
N(微观粒子数)
÷NA ×NA
×M ÷M
m(质量)
n(物质的量)
×Vm
÷Vm
V(标况下气体体积)
宏观 GRADUATION
2.在一定的温度和压强下,气体摩尔体积是一个定值
3.气体摩尔体积是随着条件的变化而不断变化的
化学式
1mol物质的体积 0℃,101kPa 20℃,101kPa 0℃,202kPa
H222.4L来自24.0L11.2L
02
22.4L
24.0L
11.2L
CO2
22.4L
24.0L
11.2L
四GR、AD气UA体TIO摩N 尔体积(Vm)
微粒数目
微粒大小
决定
微粒间距
温度、压强
固体
液体
气体
重GR点ADU强AT调ION:计算中使用“22.4L/mol”的注意事项
1D.使EF用EN条SE件:标准状况
2.使用对象:必须是气态物质,可以是单一气体也可以是混合气体(注:H2O、HF、SO3、乙醇、
苯标况下不是气体)
练习
某气态氧化物的化学式为RO2,在标况下,1.28g该氧化物的体积为448ml,则该氧化物的摩尔质 量为?R的相对原子质量为?
五GR、ADU阿AT伏ION伽德罗定律
DEFENSE
1.内容:同温同压下,相同体积的任何气体都含有相同数目的分子
“三同”
“一同”
同温
同压
化学中常用的物理量物质的量全四个课时126张PPT

物质的量浓度的应用
在化学实验中,物质的量浓度可以用来配制标准溶液、滴定分析、化学反应速率计算等。 在工业生产中,物质的量浓度可以用来控制产品质量、反应过程和生产效率等。
在生物医学领域,物质的量浓度可以用来研究药物作用机制、生理过程和疾病诊断等。
谢谢
THANKS
化学中常用的物理量-物质的量 全四个课时126张
目录
CONTENTS
• 第一课时:物质的量简介 • 第二课时:阿伏伽德罗常数 • 第三课时:气体摩尔体积 • 第四课时:物质的量浓度
01 第一课时:物质的量简介
CHAPTER
物质的量的定义
物质的量是一个描述物质微观 粒子数量的物理量,用符号"n" 表示。它表示物质所含粒子的 数目,单位是摩尔(mol)。
摩尔是国际单位制中的基本单位 之一,用于描述物质的量,是化 学中常用的物理量。
物质的量的计算公式
物质的量的计算公式为
n = m/M,其中m表示物质的质量,M表示物质的摩尔质量。
另一个常用的计算公式是
n = V/Vm,其中V表示气体的体积,Vm表示气体摩尔体积。这个公式用于计 算气体物质的量。
02 第二课时:阿伏伽德罗常数
物质的量是国际单位制中的基 本物理量之一,用于描述微观 粒子数量的多少。
物质的量的计算公式为:n = N/NA,其中N表示微观粒子数 目,NA表示阿伏伽德罗常数。
物质的量的单位
01
物质的量的单位是摩尔(mol),1摩 尔表示含有6.022×10^23个基本 单位(阿伏伽德罗常数)的物质微 粒。
02
计算公式为:V(m) = n(m) × V(m),其中V(m)为气体摩尔体积,n(m) 为物质的量,V(m)为气体体积。
《化学中常用的物理量——物质的量》认识化学科学(第1课时物质的量及其单位摩尔质量)-必修一PPT课件

栏目 导引
2.阿伏加德罗常数
第1章 认识化学科学
(1)阿伏加德罗常数是□5 _0_._01__2_k_g__12_C__所__含__的__碳__原__子__的__个__数__。
(2)符号:□6 ___N__A___。
(3) 阿 伏 加 德 罗 常 数 的 数 值 是 □7 _6_._0_2_×__1_0_2_3 , 单 位 是 □8 __m__o_l-_1__。
栏目 导引
第1章 认识化学科学
4.用化学符号表示下列说法。 (1)2 个氢原子:________________。 (2)2 个氢气分子:______________。 (3)10 个钠离子:_________________。 (4)1 mol 水分子:________________。 (5)NA 个臭氧分子:______________。 (6)1 mol 硫酸分子:______________。 答案:(1)2H (2)2H2 (3)10Na+ (4)1 mol H2O (5)NA O3 (6)1 mol H2SO4
栏目 导引
第1章 认识化学科学
5.(1)1 mol CH4 中含有________mol H,含有________个 H。 (2)1 mol NH3 中含有________mol H,含有________个 H。 (3)1 mol CH4 与________mol NH3 所含氢原子个数相等。 答案:(1)4 4NA(或 2.408×1024) (2)3 3NA(或 1.806×1024) (3)4/3
栏目 导引
第1章 认识化学科学
几个概念及其相互之间的关系
物质 “物质的量”四个字是一个整体,不能添字、漏字或
的量 换字,如不能说成“物质量”“物质的质量”“物质的 (n) 数量”等
第三节化学中常用的物理量物质的量ppt课件

相对原子质量或 相对分子质量 56 58.5 18 46 2 32 44
质量
56g 58.5g 18g 46g
2g 32g 44g
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
微粒集体、不可称量的反应微粒与 可称量的宏观物质的桥梁。
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
1.物质的量是用0.012 kg 12C中所含的原子数目作为标 准来衡量其他微粒集体所含微粒数目多少的物理量, 符号是n。 物质的量的单位是摩尔 ,简称摩,符号为mol。
【课堂练习】
1mol O 1mol H2O 1mol H+ 1mole-
含有 含有 含有 含有
6.02×1023 个O; 6.02×1023 个H2O; 6.02×1023 个H+ ; 6.02×1023 个e- ;
6.02×1023个12C的物质的量为 1 mol;
6.02×1023个CO的物质的量为 1 mol;
2. 0.012 kg 12C所含的碳原子数为6.02×1023, 3. 6.02×1023 mol-1称为阿伏加德罗常数,符号为 NA。
与0.012 kg 12C所含的碳原子数相同的任何微粒,它的 物质的量为1mol。 4. 表示物质的量时,必须用化学式指明微粒的种类, 可以是分子、原子、离子或电子等。 5. n = N /NA 、 N = n×NA
【判断正误】
× • 由于Na的相对原子质量为23,所以1molNa的质量为23。 √ • 1molCO的质量为28g,是因为CO的相对分子质量为28。 × • 由于Na的相对原子质量为23,所以Na的摩尔质量也为23。 √ • H2SO4的相对分子质量为98,所以H2SO4的摩尔质量为98 g·mol-1 。 √ • 23gNa的物质的量为1mol。 √ • 1molNa+的质量为23g。 √ • SO42-的摩尔质量为96 g·mol-1,1molSO42-的质量为96g 。
化学课件《化学中常用的物理量——物质的量》优秀ppt12 鲁科版
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
定律的扩展与延伸
• 1.同温同压下,体积之比等于物质的量之比 • (将第一个公式代入) • 2.同温同压下,密度之比等于摩尔质量之比 • (将密度公式与第二个公式代入可得到)
Thanks 谢谢您的观看!
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
一、决定物质体积的主要因素 1摩尔固体或液体体积 主要决定于
总结感悟 微粒的大小
1摩尔物质的体积
决定于
微粒的多少
1摩尔气体的体积 主要决定于
微粒间
温 度的距离Fra bibliotek压强
同温同压下: 1、分子数目相同
1mol气体 2、分子本身体积忽略 3、分子间距离相等
结论:同温同压下1mol气体的体积约相等
特例:标准状况下1mol气体的体积约为22.4L
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
定律的扩展与延伸
• 1.同温同压下,体积之比等于物质的量之比 • (将第一个公式代入) • 2.同温同压下,密度之比等于摩尔质量之比 • (将密度公式与第二个公式代入可得到)
Thanks 谢谢您的观看!
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
一、决定物质体积的主要因素 1摩尔固体或液体体积 主要决定于
总结感悟 微粒的大小
1摩尔物质的体积
决定于
微粒的多少
1摩尔气体的体积 主要决定于
微粒间
温 度的距离Fra bibliotek压强
同温同压下: 1、分子数目相同
1mol气体 2、分子本身体积忽略 3、分子间距离相等
结论:同温同压下1mol气体的体积约相等
特例:标准状况下1mol气体的体积约为22.4L
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
【高中化学】化学中常用的物理量——物质的量PPT课件15(8份)4

小结
1.计算的基本步骤 (1)写出化学方程式。 (2)写出已知、未知量 (3)列出比例式求解x。 (4)写出答案。 2.弄清应注意的问题 (1)化学方程式所表示的是纯净物质之间的量的关系。
(2)单位问题:上下一致,左右相当。
(3)如果是离子反应,可以根据离子方程式进行计算。 如果是氧化还原反应,也可以利用电子转移关系进行有关计算。
祝身体健康,学习进步。
解: 设需要的NaOH物质的量为n。 NaOH + HCl == NaCl + H2O
1mol 1mol V(NaOH) n(NaOH) = n 0.5 mol V(HCl) n(HCl) n= 0.5 mol NaOH的摩尔质量为40 g/mol 因为 所以 m(NaOH)= 0.5mol×40g/mol=20g
ν的单位: 一
(通常被省略)
0.01mol 0.02mol 0.01mol
0.73g 1.36g
0.01mol
在化学方程式中,用同一物理量表示物质的 数量时,这些量之间有何关系?
交 流 与 研 讨
2Na + 2 H2O = 2 NaOH + H2↑ 物质的量比 2mol 2mol 2mol 1mol
第1章 认识化学科学
第3节 化学中常用的物理量——物质的量 第4课时 物质的量浓度的有关计算
一:化学方程式中化学计量数(ν)的意义
2H2 + O2 == 2H2O
2 1 2 意义1:表示反应中各物质的粒子数之比 意义2:表示反应中各物质的物质的量之比 意义3:表示反应中各气态物质间的体积之比 表示方法:νB (B物质的化学计量数)
1、不要做刺猬,能不与人结仇就不与人结仇,谁也不跟谁一辈子,有些事情没必要记在心上。 2、相遇总是猝不及防,而离别多是蓄谋已久,总有一些人会慢慢淡出你的生活,你要学会接受而不是怀念。 3、其实每个人都很清楚自己想要什么,但并不是谁都有勇气表达出来。渐渐才知道,心口如一,是一种何等的强大! 4、有些路看起来很近,可是走下去却很远的,缺少耐心的人永远走不到头。人生,一半是现实,一半是梦想。 5、你心里最崇拜谁,不必变成那个人,而是用那个人的精神和方法,去变成你自己。 6、过去的事情就让它过去,一定要放下。学会狠心,学会独立,学会微笑,学会丢弃不值得的感情。 7、成功不是让周围的人都羡慕你,称赞你,而是让周围的人都需要你,离不开你。 8、生活本来很不易,不必事事渴求别人的理解和认同,静静的过自己的生活。心若不动,风又奈何。你若不伤,岁月无恙。 9、命运要你成长的时候,总会安排一些让你不顺心的人或事刺激你。 10、你迷茫的原因往往只有一个,那就是在本该拼命去努力的年纪,想得太多,做得太少。 11、有一些人的出现,就是来给我们开眼的。所以,你一定要禁得起假话,受得住敷衍,忍得住欺骗,忘得了承诺,放得下一切。 12、不要像个落难者,告诉别人你的不幸。逢人只说三分话,不可全抛一片心。 13、人生的路,靠的是自己一步步去走,真正能保护你的,是你自己的选择。而真正能伤害你的,也是一样,自己的选择。 14、不要那么敏感,也不要那么心软,太敏感和太心软的人,肯定过得不快乐,别人随便的一句话,你都要胡思乱想一整天。 15、不要轻易去依赖一个人,它会成为你的习惯,当分别来临,你失去的不是某个人,而是你精神的支柱;无论何时何地,都要学会独立行走 ,它会让你走得更坦然些。 16、在不违背原则的情况下,对别人要宽容,能帮就帮,千万不要把人逼绝了,给人留条后路,懂得从内心欣赏别人,虽然这很多时候很难 。 17、做不了决定的时候,让时间帮你决定。如果还是无法决定,做了再说。宁愿犯错,不留遗憾! 18、不要太高估自己在集体中的力量,因为当你选择离开时,就会发现即使没有你,太阳照常升起。 19、时间不仅让你看透别人,也让你认清自己。很多时候,就是在跌跌拌拌中,我们学会了生活。 20、与其等着别人来爱你,不如自己努力爱自己,对自己好点,因为一辈子不长,对身边的人好点,因为下辈子不一定能够遇见。
化学课件《化学中常用的物理量——物质的量》优秀ppt10 鲁科版

(4)1mol氢 错误。没有指出是分子、原子或离子
1、说出下列符号的意义: ①2H 、②2molH 、 ③2molH+ 、 ④2molH2 、⑤4molFe3+ 、⑥a molSO3 、 2、用符号表示: 2摩尔水分子 、5摩尔硫酸根离子 、 n 摩尔氧原子 、1摩尔碳酸氢根离子 、 10摩尔亚铁离子 、3摩尔氯化氢分子 、
课时(物质的 量与微料数之 间的关系)
思考
老师一口水喝了多 少个水分子,你知 道吗?
物质的量是把微观粒子和宏观 物质联系起来的 一见、难称量)
宏观物质
(可见、可称量)
一、物质的量的单位 —— 摩尔 是国际单位制七个基本物理量之一,符号为n 。
物质的量是表示含有一定数目微观粒子的集合体。
94.对一个适度工作的人而言,快乐来自于工作,有如花朵结果前拥有彩色的花瓣。――[约翰·拉斯金] 95.没有比时间更容易浪费的,同时没有比时间更珍贵的了,因为没有时间我们几乎无法做任何事。――[威廉·班] 96.人生真正的欢欣,就是在于你自认正在为一个伟大目标运用自己;而不是源于独自发光.自私渺小的忧烦躯壳,只知抱怨世界无法带给你快乐。――[萧伯纳]
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
1、说出下列符号的意义: ①2H 、②2molH 、 ③2molH+ 、 ④2molH2 、⑤4molFe3+ 、⑥a molSO3 、 2、用符号表示: 2摩尔水分子 、5摩尔硫酸根离子 、 n 摩尔氧原子 、1摩尔碳酸氢根离子 、 10摩尔亚铁离子 、3摩尔氯化氢分子 、
课时(物质的 量与微料数之 间的关系)
思考
老师一口水喝了多 少个水分子,你知 道吗?
物质的量是把微观粒子和宏观 物质联系起来的 一见、难称量)
宏观物质
(可见、可称量)
一、物质的量的单位 —— 摩尔 是国际单位制七个基本物理量之一,符号为n 。
物质的量是表示含有一定数目微观粒子的集合体。
94.对一个适度工作的人而言,快乐来自于工作,有如花朵结果前拥有彩色的花瓣。――[约翰·拉斯金] 95.没有比时间更容易浪费的,同时没有比时间更珍贵的了,因为没有时间我们几乎无法做任何事。――[威廉·班] 96.人生真正的欢欣,就是在于你自认正在为一个伟大目标运用自己;而不是源于独自发光.自私渺小的忧烦躯壳,只知抱怨世界无法带给你快乐。――[萧伯纳]
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
计量(银行常用)
…… ……
模型总结
模型一:直接计量 (方法一) 模型二:引入中间物理量换算
(方法二~方法八)
第三节 化学中常用的物理量――物质的量 一、物质的量、阿伏伽德罗常数、摩尔、摩 尔质量
C
+
O2 ==
宏观上: 12克
32克
微观上: 1个C原子 一个O2分子
CO2 44克 一个CO2分子
[联想质疑]
(5)两规个定变:式1(m1ol)任N=何n粒•N子A的粒子数叫做阿佛加德罗常数。(2) NhomakorabeaN
(6)近似值:6.0N2A=1023n (7)物质的量、阿佛加德罗常数与粒子数
(符号为N)之间的关系:
N n= NA 物质的量
粒子数 阿佛加德罗常数
思考:
已知:一个碳原子的质量为 1.993 × 10-23g
1、物质的量 概念:是用来解决宏观物 质和微观粒子之间关系问题的表示含有一定 数目粒子的集体的物理量。
a、是七个国际基本物理量之一
b、是一个专有名词,由固定字数组成,不能分 割、不能增减。
c、符号为“n”
d、微粒是指:分子、原子、离子、中子、电子 等
2、摩尔
阿伏加德罗常数(教材)
(1)概念:是物质的量的单位,简称摩。
课堂练习:
1、0.5molNa2SO4含有 1 mol Na+; 0.5 molSO42-;含1.204 × 1024个O。
2含、有0.21.m40o8lN×H41+0中23含个有H.6.02 × 1022 个N,
1mol物质的质量到底有多大?
粒子符 号 C
Fe
每个粒子的质 1摩物质含有 1摩物质质
如何建立起宏观物质的质量、体积和其所 含微观粒子数之间的联系呢?
宏观物质质量、体积
微粒个数
序号
方法或途径
方法一 ▼一个一个地数
方法二 ▼先称量出1个微观粒子的质量,然后再用宏观物质的质量除以1
个微观粒子的质量,计算出微观粒子个数。
方法三 ▼先称量出由某一数目的微观粒子所组成的微粒集体的质量,
然后再用宏观物质的质量除以微粒集体的质量,再乘以微粒
集体所含有的微粒数,计算出碳原子个数。
方法四 ▼先测量出1个微观粒子的体积,然后再用宏观物质的体积除以
1个微观粒子的体积,计算出微观粒子个数。
方法五 ▼先数出1cm3宏观物质所含有的微观粒子个数,然后再根据宏
观物质的总体积,计算出微观粒子个数。
...... ......
(一)、物质的量的单位——摩尔
求: 12g 碳-12 中所含的碳原子数? 解:
12g
碳原子数 =
≈ 6.02×1023
1.993 × 10-23g
思考:
判断下列说法是否正确
(A)1 摩尔氧 错误,必须指明微粒的种类,是氧
原子、氧分子还是氧离子 (B)1 摩尔氧原子 正确 1mol O
(C)2 摩尔分子氢 错误,2mol H2 (D)3 摩尔 水 正确 3mol H2O (E)0.5 摩 二氧化碳 正确 0.5mol CO2
第一章 认识化学科学
第3节 化学中常用的物理量-物质的量
(第一课时)
[交流、研讨] 智力游戏
序号
方法或途径
方法一 直接数数
方法二 先称量出一个硬币的质量,再用硬币的总质量除以一个硬币的质量
方法三 先称量出100个硬币的质量,用硬币的总质量除以100个硬币的质量,
再乘以100
方法四 先测量出一个硬币的体积,再用硬币的总体积除以一个硬币的体积
方法五 先称量出100个硬币的体积,用硬币的总体积除以100个硬币的体积,
再乘以100
方法六 先测量出一个硬币的厚度,再将硬币垒起来,用硬币的总厚度除以
一个硬币的厚度
方法七 先测量出100个硬币的厚度,再将硬币垒起来,用硬币的总厚度除以
100个硬币的厚度,然后乘以100
方法八 用模具(比如一木板上刻有许多凹槽,每一凹槽中正好卡入10个硬币)
填空:
课堂练习:
(1)1molCu质量是 64 克
(2)1molO2质量是 32
克
(3) 1molCO2质量是 44
克
(4) 1molCl-质量是 35.5 克
(5) 1molNa+质量是 23
克
(6) 1molNaCl质量 58.5 克
(二)、摩尔质量
(1)定义:单位物质的量的物质所具有的质 量叫做摩尔质量。
物式质量的 量(g/个) 的粒子数(个) 量(g)
12
1.993X10-23
NA
12
56
9.032X10-23
NA
56
H2SO4
98
1.628X10-22
NA
98
H2O
18
2.990X10-23
NA
18
Na+
23
3.821X10-23
NA
23
OH-
17
2.824X10-23
NA
17
3、分析以上计算结果可得出什么规律?
(2)符号:mol
(3)基准:每摩尔物质中含有6.02×1023个微 粒
阿伏加德罗常数(原意):以12g 12C中 所含的原子数目为标准的,也就是说,如
果在一定量的粒子集体中所含有的粒子数 与12g 12C中所含的碳原子数目相同,则 它的物质的量为1mol,而这个数值(粒子 数)就叫阿伏加德罗常数
(4)数值:阿佛加德罗常数,用NA表示。
(1)1mol任何原子的质量(以克为单位) 在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位) 在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位) 在数值上等于这种离子的式量。
结论:1mol任何微粒或物质的质量以克 为单位时,在数值上等于该微粒的相对 原子质量或相对分子质量。
(2)符号:M
(3)单位:g/mol或kg/mol
(4)数值:等于物质或粒子的式量
(5)物质的量(n)、物质的质量(m)和摩尔质 量(M)之间的关系:
m(g)
n(mol)=
M(g/mol)
思考:
1、1molH2O中多少mol的H,多少mol 的O?
1个水分子中有2个氢原子和1个氧原子,当同时扩大 阿佛加德罗常数倍之后,有如下关系:
H2O——2H——O 1 21
即H2O——2H——O 1mol 2mol 1mol
NA 2 NA NA
2、1molC中约含有6.02 × 1个023碳原子 3、0.3 mol H2SO4含有0.3× 6.02 × 1023 个硫酸分子 4、1molNa2CO3中约含有___2__molNa+、 ___1___molCO32-离子,共含有离子的个数为 __3_×__6_.0_2_×__1_0_2_3_个。
