毛细管电泳电化学检测测定阿司匹林水解反应速率常数
阿魏酸转化反应速率常数的毛细管电泳 测定方法研究

分析测试学报 FENXI CESHI XUEBAO(Journal of Instrumental Analysis)
Vol . 24 No. 1 8~11
阿魏酸转化反应速率常数的毛细管电泳 测定方法研究
付绍平 , 李秀玲 , 张 峰 , 徐 青 , 肖红斌 , 梁鑫淼
第 1期
付绍平等 : 阿魏酸转化反应速率常数的毛细管电泳测定方法研究
9
d (ρ0 - ρ) / d t = k 1ρ- k1ρe (ρ0 - ρ) / (ρ0 - ρe) = k1ρ0(ρ- ρe) / (ρ0 - ρe)
(1)
或
k1 = [ (ρ0 - ρe) /ρ0 t ]ln[ (ρ0 - ρe) / (ρ- ρe) ]
药理研究表明阿魏酸具有抗氧化 、抑制血栓的形成 、增加冠脉流量 、改善心肌缺血 、抑制胶原和 ADP 诱导的血小板聚集作用 [ 1 ]。 目前阿魏酸已成为临床使用的活血祛淤药物之一 [ 2 ]。
但在实际应用中 , 发现阿魏酸水溶液放置一段时间之后 , 在阿魏酸色谱峰旁出现一小峰 , 这已有文 献报道过 [ 3 ,4 ]。 而且在血清和脑匀浆的色谱图中也发现这两个峰总是相伴出现[ 5 ] , 另一个很可能是阿魏 酸的转化产物 。 而且随着时间的延长 , 转化产物的量越来越大 , 直至最后达到平衡 。
度 , 由 (3) 式可以得到平衡常数 K, 而根据不同时间的阿魏酸浓度 , 由 (2) 式可以算出每个时间反应速率
常数 k1 , 然后取其平均值即为正向反应速率常数 。 由 K、k1 和 (3) 式 , 容易求得逆向反应速率常数 k - 1。
2 实验部分
2. 1 仪器装置
P/ ACE MDQ 型高效毛细管电泳系统 (Beckman 公司 , 美国) , 配有二极管阵列检测器 (DAD) 及仪器操 作和数据采集软件 ( P/ ACE System MDQ 软件) 。 未涂敷熔融石英毛细管 , 内径 75μm , 柱长 49. 2 cm , 有 效柱长 39. 0 cm( 河北永年光导纤维厂) 。 Orion 868802 型酸度计 (Orion 公司 , 美国) , 超声波振荡器 (BRANSON SB3200- T, 上海) 。
阿司匹林水解实验报告

一、实验目的1. 了解阿司匹林水解反应的原理和过程。
2. 掌握阿司匹林水解实验的操作方法。
3. 通过实验验证阿司匹林在特定条件下水解生成水杨酸和乙酸的化学反应。
二、实验原理阿司匹林(乙酰水杨酸)在酸性或碱性条件下,可以发生水解反应,生成水杨酸和乙酸。
实验中,我们采用酸性条件,使阿司匹林在加热条件下发生水解反应。
水解反应的化学方程式如下:C9H8O4 + H2O → C7H6O3 + CH3COOH三、实验仪器与试剂1. 仪器:恒温水浴锅、烧杯、玻璃棒、锥形瓶、量筒、滴定管、滴定架、移液管、漏斗、滤纸等。
2. 试剂:阿司匹林、盐酸溶液(1mol/L)、氢氧化钠溶液(1mol/L)、酚酞指示剂、硫酸溶液(1mol/L)、硫酸铜溶液(0.1mol/L)、碘化钾溶液(0.1mol/L)、淀粉溶液(0.5%)、硫酸锌溶液(0.1mol/L)、氯仿等。
四、实验步骤1. 准备阿司匹林溶液:称取0.5g阿司匹林,溶解于10mL蒸馏水中,配制成0.05g/mL的阿司匹林溶液。
2. 水解反应:取50mL锥形瓶,加入5mL阿司匹林溶液,滴加1滴酚酞指示剂,然后加入2mL盐酸溶液(1mol/L),混匀。
将锥形瓶放入恒温水浴锅中,加热至60℃,维持反应30分钟。
3. 中和反应:待水解反应完成后,取出锥形瓶,加入5mL氢氧化钠溶液(1mol/L),中和过量的盐酸。
用硫酸铜溶液(0.1mol/L)滴定至溶液呈蓝色为止,记录消耗的氢氧化钠溶液体积。
4. 计算阿司匹林水解率:根据硫酸铜溶液的消耗量,计算出阿司匹林水解生成水杨酸和乙酸的摩尔数,进而计算出阿司匹林的水解率。
五、实验数据与结果1. 实验数据:阿司匹林溶液浓度:0.05g/mL盐酸溶液浓度:1mol/L氢氧化钠溶液浓度:1mol/L实验温度:60℃反应时间:30分钟2. 结果分析:通过实验,我们得到阿司匹林的水解率为(以阿司匹林初始质量为基准):水解率 = (水解生成的乙酰水杨酸质量 / 阿司匹林初始质量)× 100%六、实验讨论1. 阿司匹林水解反应在酸性条件下进行,加热有助于提高水解速率。
药物分析中的毛细管电泳法测定药物含量

药物分析中的毛细管电泳法测定药物含量毛细管电泳法(Capillary Electrophoresis,CE)是一种常用于药物分析的高效分离技术。
它基于药物在电场中的电荷迁移速率不同,通过毛细管内的电场驱动,实现对药物的定量分析。
本文将详细介绍药物分析中的毛细管电泳法测定药物含量的原理、方法和应用,以及该技术在药物分析中的优势。
一、原理毛细管电泳法测定药物含量,是利用毛细管的微小通道对药物进行分离和测量的一种分析技术。
它利用药物分子在电场作用下受到电荷的影响,从而在毛细管内发生电泳迁移,实现对药物的分离和定量测定。
其原理主要包括三个方面:1. 药物分子的电荷特性:药物分子可以分为带正电荷、带负电荷和无电荷的三类。
根据药物的电荷特性,调整毛细管内的电荷环境,使药物分子在电场中按照不同的电荷迁移速率进行分离。
2. 毛细管的表面电荷:毛细管内壁会带有一定的电荷,称为表面电荷。
表面电荷与药物分子的电荷有相互作用,影响药物在毛细管内的迁移速率。
3. 毛细管内的电场:在毛细管内施加电场,通过电泳迁移,使药物分子按照不同速率进行分离。
二、方法毛细管电泳测定药物含量的方法主要包括前处理、样品准备、色谱条件设置、电泳分离和定量测定等步骤。
下面将简要介绍这些步骤的具体操作:1. 前处理:对于复杂的样品,如血液、尿液等,需要进行前处理。
常用的前处理方法包括样品提取、样品净化等。
2. 样品准备:将提取的药物样品溶解于适宜的溶剂中,得到适宜的药物浓度。
3. 色谱条件设置:选择合适的色谱柱、毛细管和分离液,调整电泳分析的条件,如缓冲液的浓度、pH值等。
4. 电泳分离:将样品注入毛细管中,施加电场,使药物分子在毛细管内发生电泳迁移,实现对药物的分离。
5. 定量测定:通过荧光检测、紫外吸收等方法,测定药物的峰面积或峰高,从而确定药物的含量。
三、应用毛细管电泳法作为一种高效的药物分析技术,广泛应用于药物研发、生产和质量控制等领域。
高效毛细管电泳-安培检测法用于芦丁水解常数的研究

高效毛细管电泳-安培检测法用于芦丁水解常数的研究张兰;陈强;陈国南;方禹之【期刊名称】《分析化学》【年(卷),期】2003(031)007【摘要】用高分辨率、高灵敏度的毛细管电泳-安培检测法对芦丁水解的速率常数进行了研究,建立了芦丁及其水解产物槲皮素的定量分析方法.在优化电泳条件下,该方法能同时检测芦丁和槲皮素的峰电流随水解反应的进行而发生的变化.根据芦丁随着水解时间的不同而发生的浓度变化,计算求得水解的速率常数,并总结了温度对速率常数影响的规律.将方法用于芦丁和槲皮素的检测,芦丁与槲皮素的检测限分别为0.6 g/L和6.2 mg/L;RSD(n=7)分别为2.36%和3.12%.用于槐米中芦丁检测的回收率为97.6%.分析结果表明,此法用于测定芦丁水解常数简便、直观,用于芦丁和槲皮素的检测可靠性和重现性均很好.【总页数】6页(P779-784)【作者】张兰;陈强;陈国南;方禹之【作者单位】福州大学化学系,福州,350002;华东师范大学化学系,上海,200062;福州大学化学系,福州,350002;福州大学化学系,福州,350002;华东师范大学化学系,上海,200062【正文语种】中文【中图分类】O65【相关文献】1.毛细管电泳-柱端安培检测法用于抗癌药物2-氨基-6-巯基嘌呤和8-氮杂鸟嘌呤的研究 [J], 童萍;何聿;张兰2.高效毛细管电泳-安培检测研究核苷酸水解反应 [J], 宋立楠;方荣美;方禹之3.毛细管电泳-安培检测法用于7-甲基鸟苷与丝裂霉素C分离检测的研究 [J], 张兰;何聿;陈毅挺;童萍;陈国南4.毛细管电泳-电化学检测法用于生物碱电离常数线性模型的研究 [J], 张兰;陈国南;方禹之5.毛细管电泳—安培检测法用于芦丁水解常数测定的研究 [J], 张兰;陈强;等因版权原因,仅展示原文概要,查看原文内容请购买。
毛细管电泳法

此外,还有一类基于芯片的二维分离系统主要应用于蛋白质酶解物的分离分析。
除上述分离模式外,芯片自由流电泳也是芯片电泳分离蛋白质的重要方法。芯片自由流电泳是指在芯片中通 过外加电场使样品随缓冲液连续流动的同时沿电场方向进行电迁移,从而按照电泳淌度不同实现分离的电泳分离 模式。Raymond等采用芯片自由流电泳模式分离了人血清蛋白、缓激肽和核糖核酸酶A,其分离长度为3.1 cm,流 出时间为62 S。Kobayashi等采用自由流电泳的分离模式在一个体积为56.5 mm×35 mm×30 mm的微分离室 (60uL)中实现了持续的蛋白质分离,并用羟丙基甲基纤维素涂覆来抑制蛋白质吸附,在25 min内有效分离了细胞 色素C和肌红蛋白。最近,Kohl.heyer等H 3。制作了一种自由流等电聚焦分离蛋白质的玻璃芯片,成功地将人 血清白蛋白(pI=4.4)与等电聚焦标记物(pH 3和9)分离。
仪器要求
所用的仪器为毛细管电泳仪。正文中凡采用毛细管电泳法测定的品种,其所规定的测定参数,除分析模式、 检测方法(如紫外光吸收或荧光检测器的波长、电化学检测器的外加电位等)应按照该品种项下的规定外,其他参 数如毛细管内径、长度、缓冲液的pH值、浓度、改性剂添加量、运行电压或电流的大小、运行的时间长短、毛细 管的温度等,均可参考该品种项下规定的数据,根据所用仪器的条件和预试验的结果,进行必要的调整。
检测方法
毛细管电泳通常用到的检测方法有吸收光谱,荧光光谱,热镜,拉曼光谱,质谱和电化学方法。
阿司匹林的含量测定实验报告

阿司匹林的含量测定实验报告阿司匹林的含量测定实验报告引言:阿司匹林是一种常见的非处方药,被广泛用于缓解头痛、发热和炎症等症状。
然而,药物的质量和含量控制对于确保其有效性和安全性至关重要。
因此,本实验旨在利用化学分析方法测定阿司匹林中的有效成分含量。
实验材料与方法:实验所需材料包括阿司匹林样品、硫酸、氢氧化钠、氯仿、氯化铁等。
首先,我们准备了一系列不同浓度的阿司匹林标准溶液,用于制作标准曲线。
然后,取一定量的阿司匹林样品,加入硫酸和氢氧化钠溶液,进行水浴加热,使其水解反应进行。
接着,用氯仿萃取阿司匹林的游离酸,并用氯化铁试剂进行比色反应。
最后,通过比色计测定溶液的吸光度,利用标准曲线计算出阿司匹林样品中有效成分的含量。
实验结果与讨论:通过实验测定,我们得到了阿司匹林样品的含量为X mg/g。
根据制备的标准曲线,我们可以确定该样品中阿司匹林的含量。
然而,我们需要注意的是,实验结果可能受到一些因素的影响,例如实验操作的准确性、试剂的质量和保存条件等。
因此,在进行药物含量测定时,我们应该采取严格的操作规范,确保实验结果的准确性和可靠性。
此外,我们还可以通过其他方法来验证实验结果的准确性。
例如,可以使用高效液相色谱法(HPLC)进行阿司匹林含量的测定。
HPLC是一种常用的药物分析方法,具有高灵敏度和高分辨率的特点。
通过与实验结果进行对比,可以进一步验证阿司匹林含量的准确性。
结论:本实验通过化学分析方法测定了阿司匹林样品中有效成分的含量为X mg/g。
实验结果对于确保药物的质量和安全性具有重要意义。
然而,我们需要注意实验操作的准确性和试剂的质量,以确保实验结果的准确性。
此外,可以通过其他分析方法进行验证,进一步提高测定结果的可靠性。
总结:阿司匹林的含量测定是一项重要的实验,对于药物质量的控制具有重要意义。
通过本实验,我们了解到了化学分析方法在药物含量测定中的应用,并掌握了一种常用的测定方法。
在今后的实验中,我们可以进一步拓展和应用这些方法,为药物研发和质量控制提供有力支持。
阿司匹林原料药的质量检

实验阿司匹林原料药的质量检测一、实验目的1.掌握阿司匹林原料药质量检测的原理与方法。
二、实验原理1。
阿司匹林为解镇痛药,用于治疗伤风、感冒、头痛、发烧、神经痛、关节痛及风湿病等。
近年来,又证明它具有抑制血小板凝聚的作用,其治疗范围又进一步扩大到预防血栓形成,治疗心血管疾病。
2。
阿司匹林化学名为2—乙酰氧基苯甲酸,化学结构式为3。
阿司匹林为白色结晶或结晶性粉末;无臭或微带醋酸臭;遇湿气即缓缓水解。
本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;呈弱酸性,pKa3.49,可溶解于氢氧化钠或碳酸钠溶液中,但同时分解;水解生成物水杨酸的分子中酚羟基易被氧化成醌型有色物质遇空气逐渐变为淡黄、红棕甚至深棕色其水溶液变化更快;本品水溶液与三氯化铁溶液显紫堇色;本品碳酸钠溶液加稀硫酸生成白色沉淀和醋酸臭气。
4. 合成路线如下:5. 阿司匹林中的“有关物质”系指除“游离水杨酸”外的合成原料药苯酚及其他合成副产物,如醋酸苯酯、水杨酸苯酯、水杨酸水杨酸、水杨酸酐、乙酰水杨酸苯酯、等杂质。
三、实验内容1。
鉴别(1)阿司匹林与三氯化铁的显色反应一、测定原理:本品生成的水杨酸在中性或弱酸性条件下,与三氯化铁试液生成配位化合物,在中性时呈红色,弱酸性时呈紫色。
反应式如下:二、仪器和试剂:托盘天平、烧杯(50ml)、电热套、蒸馏水、三氯化铁试液三、测定步骤:取本品约0.1g与烧杯中,加水10ml,置于电热套中煮沸至完全水解,冷却至室温,滴加三氯化铁试液一滴,显紫红色。
(2)阿司匹林的水解反应一、测定原理:本品加碳酸钠试液煮沸,水解生成水杨酸和醋酸钠。
冷却,加过量的稀硫酸,析出白色的水杨酸沉淀,并产生醋酸的臭气,反应式如下:二、仪器和试剂:天平、烧杯(50ml)、洗瓶、电热套、蒸馏水、碳酸钠试液、稀硫酸三、测定步骤 :取本品约0。
5g于烧杯中,加入碘酸钠试液10ml,在电热套上煮沸2min,冷却至室温,加入过量的稀硫酸,即有白色沉淀析出,并产生醋酸的臭气。
毛细管电泳电化学检测测定阿司匹林水解反应速率常数

收稿日期:2002-12-05 通讯联系人:曹玉华第20卷第2期Vol .20 N o .2分析科学学报JOU RNA L OF ANA LY T ICA L SCIENCE 2004年4月A pr . 2004文章编号:1006-6144(2004)02-0187-03毛细管电泳电化学检测测定阿司匹林水解反应速率常数曹玉华,汪 云(江南大学化学与材料工程学院,江苏无锡214036)摘 要:本文利用毛细管电泳-电化学检测方法研究了阿司匹林水解产物水杨酸的浓度随反应时间变化的规律。
在pH 7.4的中性条件下,在不同温度下对阿司匹林水解反应速率进行了测定,并分别求得反应活化能E a 为786.8kJ /mol 。
关键词:毛细管电泳;电化学检测;阿司匹林;反应速率常数;水解中图分类号:O657.8;R917 文献标识码:A阿司匹林为最常用的解热镇痛抗炎药,解热、镇痛作用温和,抗炎和抗风湿作用较强,并有促进尿酸排泄作用。
但是,阿司匹林容易水解,其水解产物水杨酸对胃肠道有刺激作用,可出现恶心、呕吐等现象,严重时导致胃肠道出血[1]。
所以研究阿司匹林的水解反应速率及相关动力学常数有重要的意义。
阿司匹林水解反应为二级反应[2],如果保持溶液的pH 值恒定,可以认为阿司匹林水解反应是准一级反应。
目前已有一些研究阿司匹林水解反应的报道[3-5],但尚未见毛细管电泳法用于测定该药物的水解反应速率常数的研究。
目前,毛细管电泳-电化学检测(CE -ED )的应用主要用于定量分析领域,而将它运用于物理化学常数的测定还不多[6,7]。
将毛细管电泳引入到蔗糖、乳糖、麦芽糖水解的反应速率常数的测定中,取得了较为满意的结果[8,9]。
本文以碳圆盘电极为工作电极,用CE -ED 技术对阿司匹林水解反应速率常数及相关的反应活化能进行了测定,该法能直观地监测反应产物———水杨酸的电泳峰高随着水解反应的进程而发生的变化,方法直观、可靠,结果令人满意。
毛细管电泳法测定阿司匹林中乙酰水杨酸的含量

毛细管电泳法测定阿司匹林中乙酰水杨酸的含量
刘海兴;刘凤芹;于爱民;孙效正;李丽敏
【期刊名称】《潍坊学院学报》
【年(卷),期】2006(006)004
【摘要】本文建立了毛细管电泳测定阿司匹林中乙酰水杨酸含量的新方法.确定的优化缓冲溶液是30 mmol/L硼砂溶液,pH为9.02.电泳电压为20 kV,紫外检测波长为214 nm.在此条件下水杨酸和乙酰水杨酸分离度较好,并测得了阿司匹林中乙酰水杨酸的含量.本法简便、快速.
【总页数】2页(P76-77)
【作者】刘海兴;刘凤芹;于爱民;孙效正;李丽敏
【作者单位】潍坊学院,山东,潍坊,261061;秦皇岛外国语职业学院,河北,秦皇岛,066301;吉林大学,吉林,长春,130023;潍坊学院,山东,潍坊,261061;潍坊学院,山东,潍坊,261061
【正文语种】中文
【中图分类】O6
【相关文献】
1.分光光度法测定阿司匹林片剂中乙酰水杨酸含量的不确定度评定 [J], 龚时琼
2.返滴定阿司匹林片剂中乙酰水杨酸含量的实验改进 [J], 孟哲;张冬亭;王力川
3.分光光度法测定阿司匹林药片中乙酰水杨酸的含量 [J], 刘博静;孟祥国;马聪聪;马奋强;陈伟当
4.间接法测定复方乙酰水杨酸片剂中的乙酰水杨酸含量 [J], 杨志孝;邓文;陶如;张
莉
5.反向高效毛细管电泳法测定乙酰水杨酸制剂含量 [J], 林梅;范国荣;冯敏;张正行;安登魁
因版权原因,仅展示原文概要,查看原文内容请购买。
毛细管电泳法

毛细管电泳法分离水杨酸、苯甲酸及阿司匹林中的含量测定毛细管电泳法分离水杨酸、苯甲酸及阿司匹林中的含量测定毛细管电泳又称高效毛细管电泳( High Performance Capillary Electrophoresis, HPCE) 是一种仪器分析方法。
通过施加10-40kV 的高电压于充有缓冲液的极细毛细管,对液体中离子或荷电粒子进行高效、快速的分离。
现在,HPCE 已广泛应用于氨基酸、蛋白质、多肽、低聚核苷酸、DNA 等生物分子分离分析,药物分析,临床分析,无机离子分析,有机分子分析,糖和低聚糖分析及高聚物和粒子的分离分析。
人类基因组工程中DNA 的分离是用毛细管电泳仪进行的。
毛细管电泳较高效液相色谱有较多的优点。
其中之一是仪器结构 简单(见图1)。
它包括一个高电压源,一根毛细管,紫外检测器及计算机处理数据装置。
另有两个供毛细管两端插入而又可和电源相连的缓冲液池。
high-v oltagepower supply BufferV ialBuffer V ial Detector Recording dev icecapillaryElectrode Electrode图1 CE 仪器组成示意图毛细管中的带电粒子在电场的作用下,一方面发生定向移动的电泳迁移,另一方面,由于电泳过程伴随电渗现象,粒子的运动速度还明显受到溶液电渗流速度的影响。
粒子的实际流速 V 是电泳流速度 Vep 和渗流速度 Veo 的矢量和。
即:V = Vep + Veo (1)电渗流是一种液体相对于带电的管壁移动的现象。
溶液的这一运动是由硅/水表面的Zeta 势引起的。
CE 通常采用的石英毛细管柱表面一般情况下(pH>3)带负电。
当它和溶液接触时,双电层中产生了过剩的阳离子。
高电压下这些水合阳离子向阴极迁移形成一个扁平的塞子流,如图2。
毛细管管壁的带电状态可以进行修饰,管壁吸附阴离子表面活性剂增加电渗流, 管壁吸附阳离子表面活性剂减少电渗流甚至改变电渗流的方向。
毛细管电泳法测定乙醇酸二聚物的水解反应速率常数

毛细管电泳法测定乙醇酸二聚物的水解反应速率常数彭振磊;张育红;王川【摘要】The concentration of oligo(glycolic acid)2 (OGA-2)and its hydrolysis product glycolic acid (GA) were monitored by capillary electrophoresis with UV detection.A new mathematical model was used to build the relationship between the reaction conversion and peak areas of OGA-2 and GA,and then calculate the reaction rate constants of diglycollic acid hydrolysis in 50 mmol·L-1 phosphate buffer at varied temperatures.At 343,353, 363 K,the measured rate constants o f diglycollic acid were 4.8 × 10-3 ,9.6 × 10-3 ,1.85 × 10-2 min-1 , respectively.The apprarent activation energy of the hydrolysis was calculated to be 69.8 kJ·mol-1 .%利用毛细管电泳-紫外吸收法测定乙醇酸二聚物及其水解产物乙醇酸的浓度随时间变化的规律,建立新的数学模型,将水解反应转化率与乙醇酸二聚物及乙醇酸峰面积直接关联,进而计算乙醇酸二聚物在50 mmol·L-1磷酸盐缓冲溶液中,不同温度时的水解反应速率常数。
阿司匹林含量测定综述

阿司匹林原料药及制剂的含量测定方法摘要:本文对阿司匹林原料药及制剂常见的含量测定方法的原理、步骤、计算公式以及各方法的优缺点进行了介绍和综述。
关键词:阿司匹林;原料药;制剂;含量检测1.前言:阿司匹林,化学名为2-(乙酰氧基)苯甲酸,作为解热镇痛抗炎药临床上用于治疗感冒发烧,牙痛、肌肉痛及神经痛等慢性疼痛,急、慢性风湿病及类风湿病等,还是各种心血管疾病的预防、治疗药物。
另外,在近年的流行病学研究结果显示,阿司匹林与许多疾病的有相关性,因此阿司匹林在历经百余年的使用仍焕发出新的活力。
为了避免阿司匹林的胃肠道副作用,随着现代药学技术的发展,目前已有片剂、肠溶剂、泡腾片、栓剂和散剂等多种剂型,测定方法也各不相同。
由于阿司匹林的药效受剂量影响较大,因此方便而准确的含量测定方法是阿司匹林的临床研究及应用有着至关重要的因素。
因此,本文试图对其作一综述。
2. 阿司匹林原料药的含量检测方法2.1酸碱滴定法2.1.1直接滴定法阿司匹林结构中具有羧基,显酸性,利用酸碱反应反应测定其含量。
①原理:②测定方法:取本品约0.4g,精密称定,加中性乙醇(对酚酞指示液显中性)20mL溶解后,加酚酞指示液3滴,用氢氧化钠滴定液(0.1mol/L)滴定。
每1mL的氢氧化钠滴定液(0.1 mol/L)相当于18.02mg的C9H8O4。
③计算公式:NaOH滴定度T=0.1×180.16×(1/1)=18.02(mg/ml)F=M(实际)/M(规定)含量(%)=(V×T×F)/W×100%(V为滴定液体积(ml); T为氢氧化钠的滴定度,W为供试品称样量(g); F为滴定液浓度校正因子(F=滴定液实际浓度/滴定液规定浓度))④讨论:本法专属性较差,易受阿司匹林的水解及其产物、有机酸类稳定剂的干扰,使用时应注意规范操作,避免水解引起的偏差。
2.1.2水解后剩余量滴定法阿司匹林酯结构在碱性溶液中易于水解的特性,直接滴定易引起偏差,则加入定量过量的氢氧化钠滴定液,加热使酯键水解后,再用硫酸滴定液回滴定剩余的氢氧化钠滴定液。
实验一 APC片中阿司匹林溶出速率的测定

实验一APC片中阿司匹林溶出速率的测定一、实验内容及目的:APC片中阿司匹林为弱酸性溶解度较小的药物,本实验采用释放仪来测定APC片剂中阿司匹林(乙酰水杨酸)再人工胃液中的溶出速率。
并将实验所得的数据进行计算绘图,求出溶出速率常数Kr,并从威布尔分布概率纸上,求出T50、Tα、m三个参数。
实验目的:了解片剂溶出速率测定的意义,掌握片剂释放仪的使用。
二、实验仪器、试剂及样品:(一)仪器1、片剂释放仪(转篮式、循环式)2、分析天平3、721型分光光度计4、吸量管、容量瓶、试管、烧杯、漏斗、滤纸、电炉、温度计等(二)试剂:APC片(两个厂家的)、0.5N NaOH溶液、人工胃液(1:100HCl)、0.5N HCl 溶液、5%硝酸铁试液、pH(1-14)试纸三、测定方法:(一)测出平均片重(W)的E值取样品20片精密测定,计算出平均片重(W),将称定的片子研细,再精密称取相当于W的量,置于1000ml容量瓶中,加1:100HCl适量,摇匀,以37℃水浴加热1小时使溶,冷至室温,加1:100HCl至刻度,摇匀,精密吸取5ml,过滤,吸取1ml滤液置10ml容量瓶中,加蒸馏水5ml,用0.5NNaOH溶液调pH 至9-10(约加6滴),置沸水浴煮沸5分钟,放冷,用0.5NHCl调pH至3-5(约加1滴),加5%硝酸铁试液5滴,用蒸馏水加至刻度,摇匀,最后于721型分光光度计波长540nm处测读E值。
(二)溶出实验操作量取1000ml人工胃液(1:100HCl)作为释放介质,加热至37℃(并在操作过程中保持恒温(37±0.5℃)装置好释放仪调节转速150rpm(转篮式)或流量150ml/min(循环式)。
再接入已精密称定的一片药片时,同时开动电机和秒表,然后氨5、10、15、20、30、40、60分钟定时取样(取样位置应固定距杯壁1cm 处),取样可直接通过滤器吸取(即在吸量管下系一尼龙袋),每次取样1ml ,同时补入释放介质(人工胃液)1ml 。
毛细管电泳电化学检测法测定胡黄连中香草酸和阿魏酸的含量

收稿日期:2002-12-12;修回日期:2003-09-13作者简介:曹玉华(1964-),女,江苏通州人,副教授,博士.毛细管电泳电化学检测法测定胡黄连中香草酸和阿魏酸的含量曹玉华,汪云(江南大学化学与材料工程学院,江苏无锡214036)摘要:采用毛细管电泳电化学检测法测定了胡黄连中香草酸和阿魏酸的含量;研究了电极电位、运行缓冲液的浓度和酸度、电泳电压及进样时间等对电泳的影响,得到了最优化的测定条件;以直径为300μm 的碳圆盘电极为检测电极,工作电极电位为0.8V (v s .SCE ),在50mm ol/L 硼砂(p H 8.4)运行缓冲液中,上述两组分在8m in 内完全分离;香草酸和阿魏酸线性范围分别为5×10-4~1×10-6m ol/L 和1×10-3~1×10-6m ol/L ,检出限分别为4.2×10-7和3.0×10-7m ol/L ;7次平行进样的相对标准偏差(RS D )为2.2%和2.8%,回收率(n =3)分别为99%和103%,该法灵敏可靠,结果令人满意。
关键词:毛细管电泳;电化学检测;胡黄连;香草酸;阿魏酸中图分类号:O657.8;Q949.777.8文献标识码:A文章编号:1004-4957(2003)06-0095-03胡黄连为玄参科植物胡黄连的根茎[1],具有清热凉血、燥湿消疳的作用[2],用于治疗肝脏、肺部疾病,也可治疗慢性痢疾[3]。
主要含胡黄连素、胡黄连醇、D -甘露醇、香草酸、三棕榈酸甘油脂、类倍半萜挥发油及少量的阿魏酸等芳香酸。
1995年版的《中国药典》是以香草酸为胡黄连的质量检测依据。
已有薄层扫描[4]、高效液相色谱[5,6]、毛细管电泳-紫外检测[7]用于胡黄连中的酚酸、胡黄连甙的分析。
毛细管电泳(CE )具有分离效率高,消耗样品少,无需昂贵的色谱柱与复杂的前处理等诸多优点,且电化学检测(ED )对于电活性物质不仅具有较高的灵敏度,且具有选择性,对于复杂的中药测定体系,CE -ED 法极具潜力。
毛细管电泳法测定阿司匹林中的水杨酸(精)

毛细管电泳法测定阿司匹林中的水杨酸一、实验目的1 进一步理解毛细管电泳的基本原理;2 熟悉毛细管电泳仪器的构成;3 了解影响毛细管电泳分离的主要操作参数。
二、实验原理:毛细管电泳又称高效毛细管电泳( High Performance Capillary Electrophoresis, HPCE) 是一种仪器分析方法。
通过施加10-40kV 的高电压于充有缓冲液的极细毛细管,对液体中离子或荷电粒子进行高效、快速的分离。
现在,HPCE 已广泛应用于氨基酸、蛋白质、多肽、低聚核苷酸、DNA 等生物分子分离分析,药物分析,临床分析,无机离子分析,有机分子分析,糖和低聚糖分析及高聚物和粒子的分离分析。
人类基因组工程中DNA 的分离是用毛细管电泳仪进行的。
1.仪器结构毛细管电泳较高效液相色谱有较多的优点。
其中之一是仪器结构简单(见图1)。
它包括一个高电压源,一根毛细管,紫外检测器及计算机处理数据装置。
另有两个供毛细管两端插入而又可和电源相连的缓冲液池。
high-v oltagepower supply BufferV ialBuffer V ial Detector Recording dev icecapillaryElectrode Electrode2.分离原理毛细管中的带电粒子在电场的作用下,一方面发生定向移动的电泳迁移,另一方面,由于电泳过程伴随电渗现象,粒子的运动速度还明显受到溶液电渗流速度的影响。
粒子的实际流速 V 是泳流速度 Vep 和渗流速度 Veo 的矢量和。
即:V = V ep + Veo (1)电渗是一种液体相对于带电的管壁移动的现象。
溶液的这一运动是由硅/水表面的Zeta 势引起的。
CE 通常采用的石英毛细管柱表面一般情况下(pH>3)带负电。
当它和溶液接触时,双电层中产生了过剩的阳离子。
高电压下这些水合阳离子向阴极迁移形成一个扁平的塞子流,如图2。
毛细管管壁的带电状态可以进行修饰,管壁吸附阴离子表面活性剂增加电渗流,管壁吸附阳离子表面活性剂减少电渗流甚至改变电渗流的方向。
毛细管电泳法测定阿司匹林中乙酰水杨酸的含量
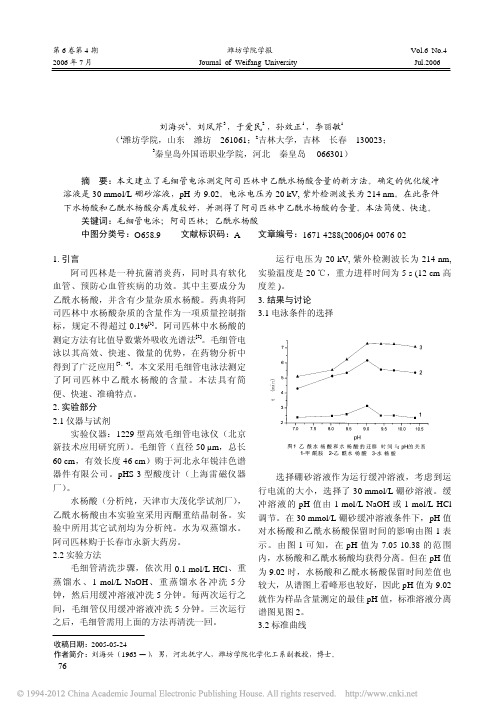
分别称取不同厂家生产的阿司匹林片剂,在 60 ℃左右水浴上,用定量甲酰胺使其溶解,过滤 后即为样品溶液。在优化的电泳条件下分别进行 测定。典型样品溶液分离谱图如图 3 所示。测得 了样品中乙酰水杨酸的含量。结果(n=3)山西桂 龙 医 药 ( 20010309 )、 石 家 庄 康 威 药 业 (00111521)、中外合资河北东龙药业(010805) 样 品 中 乙 酰 水 杨 酸 含 量 分 别 为 0.388 mg/mg, 0.484 mg/mg,0.987 mg/mg;RSD 分别为 3.58%, 4.17%,5.84%。 3.5 回收率
was 20 kV. The UV detection wavelength was 214 nm. The linear range of the method was 1.60~10.3 mg/mL
for acetylsalicylic acid. This method was simple, rapid and accurate. It had been successfully used for the
determination of acetylsalicylic acid in aspirin.
Keywords:capillary zone electrophoresis, aspirin, acetylsalicylic acid
(责任编辑:刘乃生)
- 77 -
毛细管清洗步骤,依次用 0.1 mol/L HCl、重 蒸 馏 水 、 1 mol/L NaOH、 重 蒸 馏 水 各 冲 洗 5 分 钟,然后用缓冲溶液冲洗 5 分钟。每两次运行之 间,毛细管仅用缓冲溶液冲洗 5 分钟。三次运行 之后,毛细管需用上面的方法再清洗一回。
阿司匹林的水解实验报告(3篇)

第1篇一、实验目的1. 了解阿司匹林的水解反应原理。
2. 掌握阿司匹林水解实验的操作方法。
3. 学习通过观察水解反应产物的颜色变化来判断水解反应的进行。
4. 了解水解反应的速率及其影响因素。
二、实验原理阿司匹林(乙酰水杨酸)是一种常用的解热镇痛药,在体内或加热条件下,会发生水解反应,生成水杨酸和乙酸。
水杨酸在空气中容易被氧化,颜色由白色变为淡黄色,甚至红棕色。
本实验通过观察阿司匹林水解后溶液的颜色变化,判断水解反应的进行。
三、实验材料与仪器1. 实验材料:- 阿司匹林片剂- 稀盐酸- 水杨酸标准溶液- 碘化钾淀粉试纸- 乙醇- 碳酸钠溶液- 氢氧化钠溶液2. 实验仪器:- 电子天平- 烧杯- 滴定管- 试管- 恒温水浴锅- 紫外可见分光光度计四、实验步骤1. 称量阿司匹林片剂:准确称取一定量的阿司匹林片剂,记录其质量。
2. 制备水解液:将称取的阿司匹林片剂溶解于稀盐酸中,转移至烧杯中,加入适量的水,搅拌均匀。
3. 水解反应:将烧杯放入恒温水浴锅中,加热至70℃,保持30分钟,使阿司匹林充分水解。
4. 冷却:将水解液冷却至室温。
5. 检测水解反应:- 取少量水解液,滴加碘化钾淀粉试纸,观察颜色变化。
- 另取少量水解液,滴加碳酸钠溶液,观察是否有气泡产生。
- 另取少量水解液,滴加氢氧化钠溶液,观察颜色变化。
6. 数据处理:记录实验数据,分析水解反应的速率及其影响因素。
五、实验结果与分析1. 碘化钾淀粉试纸检测:水解液滴加碘化钾淀粉试纸后,试纸未发生颜色变化,说明水解液中未产生游离的碘。
2. 碳酸钠溶液检测:水解液滴加碳酸钠溶液后,观察到有气泡产生,说明水解液中含有酸性物质,可能是乙酸。
3. 氢氧化钠溶液检测:水解液滴加氢氧化钠溶液后,观察到溶液颜色由无色变为蓝色,说明水解液中含有水杨酸。
4. 水解反应速率:根据实验结果,阿司匹林水解反应的速率受温度、酸碱度等因素的影响。
六、实验结论1. 阿司匹林在加热条件下会发生水解反应,生成水杨酸和乙酸。
阿司匹林含量测定综述

目录1 阿司匹林在体内的含量测定方法 (2)1.1阿司匹林原料药体内含量测定 (2)1.1.1反相高效波相色谱法(RP-HPLC)[1] (2)1.1.2高效液相色谱-质谱联用法(HPLC—MS/MS法)[2] (3)1.2 阿司匹林制剂体内含量测定 (3)1.2.1气相色谱-质谱联用法(GC-MS)[3] (3)1.2.2高效液相色谱法 (4)1.2.2.1高效液相色谱-荧光检测法(HPLC—FLU法) (4)1.2.2.2高效液相色谱-质谱联用法(HPLC—MS)[5] (5)2阿司匹林在体外的含量测定方法 (6)2.1 阿司匹林原料药体外含量测定 (6)2.1.1酸碱滴定法 (6)2.1.1.1直接滴定法[6] (6)2.1.1.2水解后剩余量滴定法[7] (6)2.1.2反相高效液相色谱法 (7)2.1.3动力学光度法 (7)2.2司匹林制剂体外含量测定 (8)2.2.1酸碱滴定法 (8)2.2.1.1两步滴定法[10] (8)2.2.2 光谱法 (9)2.2.2.1 比色法 (9)2.2.2.2 双波长紫外分光光度法 (10)2.2.2.3 双波比值光谱法 (10)2.2.2.4同步扫描荧光法 (14)2.2.2.5萃取-火焰原子吸收光谱法 (14)2.2.3色谱法 (15)2.2.3.1高效液相色谱法(HPLC) (16)2.2.3.2反相高效液相色谱法(RP-HPLC) (16)2.2.3.3大口毛细管气相色谱法[20] (17)2.2.3.4薄层色谱法[21] (17)2.2.3.5胶束薄层色谱法[22] (17)2.2.4毛细管电泳法 (18)2.2.4.1反相高效毛细管电泳法[23] (18)2.2.4.2非水毛细管电泳法[24] (18)2.2.5电极法 (20)2.2.6线性伏安法[26] (22)参考文献: (23)阿司匹林含量测定方法综述陈明静 药学0902 ********摘要:阿司匹林阿司匹林(aspirin ),又名乙酰水杨酸(acetulsalicylic acid ),为较温和的解热镇痛药,在临床上有广泛的应用。
阿司匹林的质量检测手段和含量测定方法

阿司匹林的质量检测手段和含量测定方法作者:梅文君陈晓文顾方来源:《上海医药》2011年第09期中图分类号:R927 文献标识码:A 文章编号:1006-1533(2011)09-0453-02阿司匹林,化学名为2-(乙酰氧基)苯甲酸,作为主要的解热镇痛抗炎药收载于《中国药典》 (2010年版)二部,临床上主要用于治疗感冒发烧,牙痛、肌肉痛及神经痛等慢性疼痛,急、慢性风湿病及类风湿病等,是风湿、类风湿关节炎治疗的常用药物。
本品主要的副作用是引起幽门痉挛及刺激胃黏膜的胃肠道反应,长期服用导致胃肠出血。
随着现代药学技术的发展,目前已有片剂、肠溶片、肠溶胶囊、泡腾片和栓剂等多种剂型,以阿司匹林为主药的复方制剂也层出不穷,形成了阿司匹林含量测定方法的各异性。
随着科学技术的进步,各种仪器设备、新方法也应用到了阿司匹林的质量检测中,本文对其作一综述。
1国内外药典中阿司匹林原料药的质量检测1.1鉴别1) 《中国药典》 (2010年版)二部采用阿司匹林加水煮沸、水解生成的水杨酸能与三氯化铁试液生成紫堇色络合物进行鉴别。
美、英、日药典也用类似方法鉴别。
2) 《中国药典》 (2010年版)二部采用阿司匹林加碳酸钠试液煮沸、水解生成水杨酸钠。
放冷后,加过量的稀硫酸析出水杨酸的白色沉淀并释放醋酸。
BP(1993年)用氢氧化钠代替碳酸钠,按上述操作生成的水杨酸经水洗、干燥后测定熔点。
JP规定在滤除水杨酸沉淀后,再加乙醇和硫酸,加热产生乙酸乙酯的香味。
3)红外光谱法鉴别。
1.2检查《中国药典》 (2010年版)二部规定阿司匹林应检查溶液的澄清度、游离水杨酸、易炭化物、炽灼残渣和重金属。
水杨酸是从原料带来的杂质或水解产生的杂质,加稀硫酸铁铵指示液显色后,用比色法检查,《中国药典》规定其限量为0.1%。
BP(1993年)规定水杨酸的限量为0.05%。
除上述检查项目外,BP(1993年)还检查有关物质,以控制酚类杂质的限量。
酚类是可能存在于水杨酸中的杂质。
毛细管电泳用于S4O6^2-碱性水解反应动力学研究

物有 s 2 0 ; 一 、 S 3 0 : 一 和s 0 ; 一 。水 解速率强烈依赖于反 应的 p H 值, 通过计算得到水解反应在 p H 值1 o . 5 ~ l 2 . 0 之间 对于两 种反应物的
反应级数均为 1 , 平均反应速率常数为0 . 1 1 5 M s ~。不同于前人的研究结果, 本研究中发现 s 2 o ; 一对 S 4 0 ; 一的水解反应并未产生明
3 .S c h o o l o f C h e mi c a l E n g i n e e r i n g a n d T e c h n o l o y , g C h i n a U n i v e r s i t y o f Mi n i n g a n d T e c h n o l o y, g X u z h o u 2 2 1 1 1 6 , C h i n a )
2 2 1 1 1 6 ; 3 . 中国矿业 大学 化 工学 院 , 江苏 徐州
摘要: 连四硫酸根离子 S 0 : 一是硫代硫酸根离子 S 2 0 i 一氧化过程中的中间产物, 常存在于湿法浸金溶液中或废弃定影剂中。S 0 i 一在 碱性环境中, 会发生自身的碱性水解, 生成 s 2 0 ; 一 、 s 2 O i 一 、 S 3 O ; 一和 S 5 0 ; 一等, 反应过程十分复杂。本研究应用毛细管电泳方法对水解 反应过程中的硫氧化合物进行实时定性与定量监测, 该反应计量方程为4 s 4 0 : 一+ 8 0 H一 — s 2 0 j 一+ S 3 0 : 一+ s 0 i 一+ 4 H 2 0 , 反应的终产
2 .C e n t e r f o r Mo d e m An a l y s i s a n d C o mp u t a t i o n ,C h i n a Un i v e r s i t y o f Mi n i n g a n d Te c h n o l o g y,Xu z h o u 2 2 1 1 1 6, C h i n a;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
收稿日期:2002-12-05 通讯联系人:曹玉华第20卷第2期Vol .20 N o .2分析科学学报JOU RNA L OF ANA LY T ICA L SCIENCE 2004年4月A pr . 2004文章编号:1006-6144(2004)02-0187-03毛细管电泳电化学检测测定阿司匹林水解反应速率常数曹玉华,汪 云(江南大学化学与材料工程学院,江苏无锡214036)摘 要:本文利用毛细管电泳-电化学检测方法研究了阿司匹林水解产物水杨酸的浓度随反应时间变化的规律。
在pH 7.4的中性条件下,在不同温度下对阿司匹林水解反应速率进行了测定,并分别求得反应活化能E a 为786.8kJ /mol 。
关键词:毛细管电泳;电化学检测;阿司匹林;反应速率常数;水解中图分类号:O657.8;R917 文献标识码:A阿司匹林为最常用的解热镇痛抗炎药,解热、镇痛作用温和,抗炎和抗风湿作用较强,并有促进尿酸排泄作用。
但是,阿司匹林容易水解,其水解产物水杨酸对胃肠道有刺激作用,可出现恶心、呕吐等现象,严重时导致胃肠道出血[1]。
所以研究阿司匹林的水解反应速率及相关动力学常数有重要的意义。
阿司匹林水解反应为二级反应[2],如果保持溶液的pH 值恒定,可以认为阿司匹林水解反应是准一级反应。
目前已有一些研究阿司匹林水解反应的报道[3-5],但尚未见毛细管电泳法用于测定该药物的水解反应速率常数的研究。
目前,毛细管电泳-电化学检测(CE -ED )的应用主要用于定量分析领域,而将它运用于物理化学常数的测定还不多[6,7]。
将毛细管电泳引入到蔗糖、乳糖、麦芽糖水解的反应速率常数的测定中,取得了较为满意的结果[8,9]。
本文以碳圆盘电极为工作电极,用CE -ED 技术对阿司匹林水解反应速率常数及相关的反应活化能进行了测定,该法能直观地监测反应产物———水杨酸的电泳峰高随着水解反应的进程而发生的变化,方法直观、可靠,结果令人满意。
1 实验部分1.1 仪器装置与试剂自组装毛细管电泳-柱端射壁安培法电化学检测系统[10],三电极工作系统(300μm 碳圆盘工作电极,铂对电极,饱和甘汞参比电极);超级恒温水浴(重庆实验仪器厂)。
阿司匹林(Sigma ,USA ),水杨酸(分析纯,上海试剂公司),0.2mol /L 的NaH 2PO 4-Na 2HPO 4缓冲溶液(pH 7.4)。
1.2 实验方法实验前先用金相砂纸对碳圆盘工作电极抛光,在超声波下清洗2min ,用三维定位调节器使工作电极与毛细管成一直线,并靠近毛细管端口。
在长45cm 的毛细管两端加高压电源,微电流经LC -3D 型安培检测器放大后由记录仪记录毛细管电泳图。
在22kV 下电迁移进样8s 。
1.3 水解反应步骤在10mL 容量瓶中加入9.5mL 0.2mol /L 磷酸盐缓冲液(pH 7.4),在超级恒温槽中加热至所需水解温度(分别为55、60、65和70℃);将0.5m L 已恒温的0.1000mol /L 阿司匹林乙醇溶液迅速加入到容量瓶中,在注入一半时记下反应起始时间,然后每隔15min 移取100μL 水解溶液,迅速加入到0.9m L pH 1877.4的20mmol /L 磷酸盐缓冲溶液中,立即进样进行电泳分析。
2 结果与讨论2.1 阿司匹林水解反应速率常数测定原理低于50℃时,阿司匹林在中性缓冲溶液中水解非常缓慢,温度升高后,阿司匹林水解为水杨酸和乙酸。
阿司匹林水解反应速率不仅与阿司匹林的浓度有关,也受溶液pH 值影响,所以阿司匹林的水解应该是二级反应,其动力学方程式为:-d c /d t =kc [OH ]。
c 0为水解时间t 时的阿司匹林的浓度,k 为反应速率常数。
假如采用缓冲溶液保持水解反应过程中pH 值不变,则[OH ]是一定值,反应速率仅随着阿司匹林的浓度变化而变化,阿司匹林的水解可以认为是准一级反应,其动力学方程式为:-d c /d t =k app c k app =k [OH ] ln c =-k app t +ln c 0式中c 0为反应物的起始浓度,c =1/2c 0,t 1/2=ln2/k app =0.693/k app 。
以ln c 对t 作图可得一直线,由直线斜率可求得水解反应速率常数k app 。
2.2 水解反应速率常数的测定2.2.1 电泳条件的确定 阿司匹林的水解产物水杨酸有一个酚羟基,可以在碳电极上氧化。
当氧化电位低于0.80V 时水杨酸不发生氧化,无氧化电流产生。
随着氧化电位的增加,电流也随之升高。
氧化电位大于1.10V 后,电流增加缓慢,但噪音增加显著,采用1.10V 作为检测电位。
电泳运行液的pH 值、浓度直接影响物质的分离、分析灵敏度、分析速度和体系的稳定性。
由于反应体系中,仅水杨酸在碳电极上有Fig .1 Electropherogram for the standard 响应,分离很容易,但分析速度、pH 值直接影响阿司匹林的稳定性,进而影响实验结果的准确性。
低浓度的运行液有利于提高分析速度,减小阿司匹林的水解。
pH 值大于7.4时,水杨酸的检测灵敏度虽然有所提高,但是阿司匹林的水解速度增加;pH值小于7.4时,阿司匹林水解得到遏制,但电渗流减小,迁移时间大大增加,水杨酸灵敏度也减小。
综合考虑,采用pH 7.4的20m mol /L 磷酸盐运行液,在此体系中,常温下阿司匹林水解可以忽略。
分离电压和进样时间影响样品的进样量,采用22kV /8s 进样。
图1为水杨酸标样在最优化条件下的毛细管电泳图谱。
在上述最优化条件下,得到水杨酸的线性回归方程为:y =6.59×10-4x -0.01,y 为水杨酸峰电流(nA ),x 为水杨酸的浓度(mol /L )。
线性范围为1×10-3~5×10-6mol /L 。
检出限为9×10-7mol /L 。
对水杨酸标样进行7次进样,电流峰高平均相对偏差为1.1%。
2.2.2 水杨酸水解的毛细管电泳 图2为70℃时在pH 7.4的0.2mol /L 磷酸盐缓冲溶液中,阿司匹林在水解反应了15、45、75min 3个不同阶段的毛细管电泳图。
与标准谱图比较可知,其水解产物为水杨酸。
很明显,随着水解反应的进行,生成物(水杨酸)的峰高不断升高,直观的显示了阿司匹林的水解历程。
2.2.3 阿司匹林水解反应速率常数的确定 不同温度下的阿司匹林浓度的对数ln c 对相应的水解时间t 作图,可获得斜率为-k app 的直线,从而可求得阿司匹林在不同温度下的水解反应速率常数k app 。
由图3可知,不同温度下所对应的曲线均有良好的线性,其线性相关系数分别为:0.9984(55℃)、0.9953(60℃)、0.9950(65℃)和0.9985(70℃)。
表1列出了温度对阿司匹林水解反应速率常数的影响。
由所列数据可知,随着温度的升高,水解速率常数明显增大。
Table 1 Effect of temperature on rate constant of aspirin hydrolysisTemperature (K )Rate constant of aspirin hy drolysis kapp (10-4/min )328.23.35333.24.85338.26.22343.28.16188第2期曹玉华等:毛细管电泳电化学检测测定阿司匹林水解反应速率常数第20卷Fig .2 Electropherograms of aspirin hydrolysis in three stages Fig .3 Plot of ln c vs .hydrolysis time of aspirin at the different temperaturesWorking potential :1.1V (vs .SCE );other conditionsas in Fig .1根据阿仑尼乌斯方程k =A ·ex p (-ΔE a /R T ),以ln k 对1/T 作图,可得一直线,线性系数为0.9968,从直线斜率可算出反应的活化能E a 为786.8kJ /mol 。
参考文献:[1] 中华人民共和国卫生部药典委员会.中华人民共和国药典(二部)[M ].北京:化学工业出版社,2000:330.[2] Lo nda L ,Edw ard Barry .J .Chemical Education [J ],2000,77(3):354.[3] Spancake C W ,M itra A K and Kildsig D O .International Journal of Pharmaceutics [J ],1991,75:231.[4] Choudhury S ,and M itra A K .Pharmaceutical Research [J ],2000,10(1):156.[5] M atsumoto K ,N akai Y ,Yonemo chi E ,Oguchi T and Yamamoto K .Drug Stability [J ],1996,1:92.[6] Rhim J W ,N unes R V ,Jones V A .J .Food Science [J ],1989,54(1):222.[7] Ye J N ,Z hao X W ,Sun Q Y .M ikrochimica Acta [J ],1998,128(1-2):119.[8] 叶建农,金 薇,赵学伟.高等学校化学学报[J ],1998,19(1):31.[9] 张 欣,丁祥欢,朱雪焱,叶 建.分析测试学报[J ],2001,20(1):16.[10]Fang X M ,Ye J N ,Fang Y Z .Anal .Chem .Acta [J ],1996,329:49.Determination of Reaction Rate Constant of AspirinHydrolysis by Capillary Electrophoresis withElectrochemical DetectionCAO Yu -hua *,WANG Yun(Sc hool of Chemic al and Material Engineering ,Southe rn Yangze University ,Wuxi ,Jiangsu 214036)A bstract :The concentration of salicy lic acid produced by aspirin hydrolysis w as monito red by capillary electrophoresis -electrochemical detection .The rate constants of aspirin hydrolysis at different temperature in pH 7.4of 0.2mol /L phosphate buffer were obtained from the concentration change of salicylic acid during the process of hy drolysis .At 55℃,60℃,65℃and 70℃,the measured rate constants of aspirin hydroly sis w ere 3.35×10-4min -1,4.85×10-4min -1,6.22×10-4min -1and 8.16×10-4min -1,respectively ,from w hich the E a value of 786.8kJ /mol w as derived .Keywords :Capillary electropho resis ;Electrochemical detection ;Aspirin ;Rate constant ;Hydrolysis reaction 189第2期分析科学学报第20卷。
