标准电极电位表
标准电极电势表的作用

标准电极电势表的作用标准电极电势表是一种用于测量电解质中电位的专用仪器,它可以应用于实验中,用于准确测定溶液中电位,并判断溶液性质。
标准电极电势表具有良好的精度和可靠性,可用于重要的实验应用和测量溶液中任何物质的离子活度。
标准电极电势表的使用主要有两个方面:第一,用于研究和理解电解质系统中电势的变化;第二,用于测量诸如溶液离子活度等实际正负数值。
在电解质实验中,可以使用标准电极电势表来确保溶液的离子活度达到一定的精确度,这对理解电解质的变化和控制它们的有效用途具有重要意义。
首先,标准电极电势表可以用来测量电解质系统中的电势,指示实验中介质的性质或电解质的品质,并得出规律的变化。
它可以将电势数据以图表的形式永久记录存档,为此类研究科学家提供有力的数据支持。
此外,标准电极电势还可以用来测量溶液中不同物质的离子活度,从而判断该溶液的电离程度和性质。
从实际应用涉及的实验测试来看,如果使用标准电极电势表,这将有助于更准确的判断出不同离子的离子活度数据和对应的数值,并且可以较好地控制结果的准确度。
据此,可以总结出标准电极电势表的主要优势:精准性强。
首先,由于标准电极电势表是特定构造的仪器,因此可以精确地测量溶液中特定物质的离子活度范围,这种精准性有助于更好地控制研究变量,以及更准确分析实验结果,因此使用标准电极电势表在理解实验变量和分析实验结果上具有增强作用。
另外,标准电极的多种可用性也使其具有显著优势。
标准电极电势表可以使用单种电极,也可以使用多种电极,这取决于研究者的需求,这也使得它可以应用于多种不同类型的实验应用。
此外,标准电极电势表也具有安装简单易用的优势,可以轻松安装在实验室设备上,其易用性也极大地降低了实验的难度,有助于减少调试时间。
综上所述,标准电极电势表是一款重要的仪器,用于测量溶液中的电势和离子活度,在理解和研究电解质的变化方面具有无可替代的重要作用,具有极高的精准性和安装简单易用的特点。
常用金属的电极电位

标准电极电位的概念标准电极电位是以标准氢原子作为参比电极,即氢的标准电极电位值定为0,与氢标准电极比较,电位较高的为正,电位较低者为负。
如氢的标准电极电位H2←→H+ 为0.000 一般标准电极电位以298K(即25摄氏度)常见金属的标准电极电位:石墨的标准电极电位为 + 3.700 V一价金Au+ +e = Au原子价标准电极电位为 + 1.692 V三价金Au3+ + 3e=Au原子价标准电极电位为 + 1.498 V钯Pd2+2e=Pd的标准电极电位为 + 0.830 V三价铑 Rh3+ + 3e=Rh 的标准电极电位为 + 0.800 V银 Ag+ +e=Ag的标准电极电位为 + 0.799 V钌Rh3+ + 3e = Rh的标准电极电位为 + 0.790 V汞Hg2/2+ + 2e 的标准电极电位为 + 0. 789 V铜 Cu2+ + 2e 的标准电极电位为 + 0.337 V氯化银的标准电极电位为 + 0. 222 V氢2H+ + 2e = H2的标准电极电位为 0.000 V铁Fe3++3e=Fe的标准电极电位为- 0.037 V 铅 Pb2+ + 2e=Pb 的标准电极电位为- 0.126 V锡 Sn2+ + 2e=Sn 的标准电极电位为- 0.136 V 钼 Mo3+ + 3e=Mo 的标准电极电位为-0.220 V 镍 Ni2+ + 2e=Ni 的标准电极电位为-0.250 V 钴 Co2+ + 2e=Co 的标准电极电位为-0.277 V 铟 In3+ + 3e=In 的标准电极电位为-0.342 V 镉 Cd2+ + 2e 的标准电极电位为-0.403 V 铁 Fe2+ + 2e=Fe的标准电极电位为- 0.440 V 镍硼Ni-B镀层的自腐蚀电位为-0.5V,比Ni-B-PTFE的自腐蚀电位要高,而Ni-B-PTFE复合镀层的自腐蚀电位为-0.63V左右铬 Cr3+ + 3e = Cr 的标准电极电位为-0. 74 V 锌Zn2+ + 2e 的标准电极电位为- 0. 763 V 钨 W 的标准电极电位为- 1. 05 V 锰 Mn2+ + 2e 的标准电极电位为- 1.179 V 钛 Ti2+ + 2e 的标准电极电位为- 1.630 V铝 Al3+ + 3e 的标准电极电位为- 1.663 V 镁 Mg2+ + 2e 的标准电极电位为- 2.363 V 钕 Nd 是一种活性极强的金属,标准平衡电位为- 2.431 V1氢 H 3锂Li 4铍Be 5硼 B 6碳 C8 氧 O 9 氟 F 11纳Na 12镁Mg 13铝Al 14硅Si 15 磷 P 16硫 S 17 氯Cl 19钾K 22钛Ti 24铬Cr 25锰Mn 27钴Co 33砷As 42钼Mo 44钌Ru 46钯Pd 51 锑Sb 52 碲Te 60 钕Nd 73 钽Ta 74钨 W 76锇Os 77铱Ir 78铂Pt 80汞Hg 82铅Pb。
铜电极的标准电极电位

铜电极的标准电极电位
标准电极电位是以标准氢原子作为参比电极,即氢的标准电极电位值定为0,与氢标准电极比较,电位较高的为正,电位较低者为负。
如氢的标准电极电位H2←→H+ 为0.000V,锌标准电极电位Zn ←→Zn2+ 为-0.762V,铜的标准电极电位Cu ←→
Cu2+为+0.342V。
金属浸在只含有该金属盐的电解溶液中,达到平衡时所具有的电极电位,叫做该金属的平衡电极电位。
当温度为25℃,金属离子的有效浓度为1mol/L(即活度为1)时测得的平衡电位,叫做标准电极电位,标准电极电位是这样定义的:
电极电位是表示某种离子或原子获得电子而被还原的趋势。
如将某一金属放入它的溶液中(规定溶液中金属离子的浓度为1 M),在25℃时,金属电极与标准氢电极(电极电位指定为零)之间的电位差,叫做该金属的标准电极电位。
二〇二四年九月二十日。
标准电极电势一览表

标准电极电势一览表
1.标准氢电极,0 V.
2.标准锂电极,-
3.04 V.
3.标准钠电极,-2.71 V.
4.标准镁电极,-2.37 V.
5.标准铝电极,-1.66 V.
6.标准锌电极,-0.76 V.
7.标准铁电极,-0.44 V.
8.标准铜电极,0.34 V.
9.标准银电极,0.80 V.
10.标准铂电极,0.00 V.
这些数值代表了相对于标准氢电极的标准电极电势。
负值表示相应的金属离子更倾向于接受电子,正值表示金属离子更倾向于失去电子。
这些数值对于理解电化学反应、电池工作原理以及腐蚀等过程都具有重要意义。
需要注意的是,这些数值是在特定条件下测得的,并且在实际应用中可能会受到其他因素的影响。
电极电位表
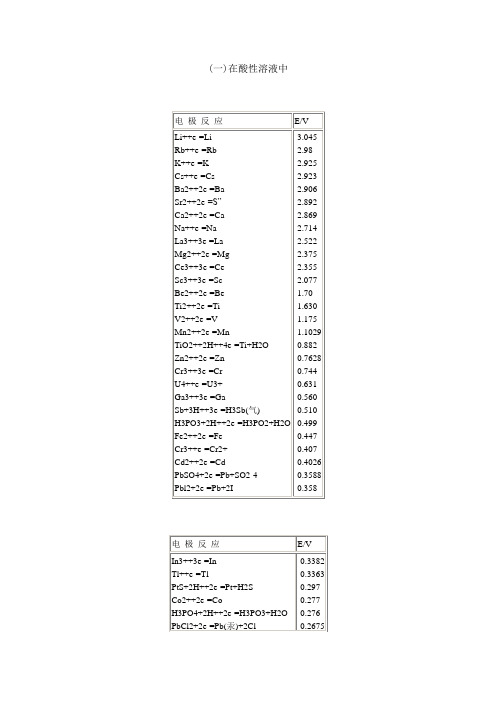
SO2-4+H2O+2e-=SO2-3+2OH-
Fe(OH)2+2e-=Fe+2OH-
SnS+2e-=Sn+S2-
Cd(OH)2+2e-=Cd+2OH-
2H2O+2e-=H2+2OH-
NiS+2e-=Ni+S2-
FeCO3+2e-=Fe+CO2-3
Co(OH)2+2e-=Co+2OH-
-0.877
-0.87
-0.869
-0.828
-0.814
-0.756
-0.73
-0.72
-0.715
-0.66
-0.597
-0.56
-0.509
-0.476
-0.46
-0.45
-0.429
-0.37
-0.358
电极反应
E/V
Cu(CNS)+e-=Cu+CNS-
CrO2-4+4H2O+3e-=Cr(OH)3+5OH-
Al3++3e-=Al(0.1MNaOH)
Mn(OH)2+2e-=Mn+2OH-
Cr(OH)3+3e-=Cr+3OH-
ZnS+2e-=Zn+S2-
Zn(OH)2+2e-=Zn+2OH-
CrO-2+2H2O+3e-=Cr+4OH-
Zn(NH3)2+4+2e-=Zn+4NH3
FeS+2e-=Fe+S2-
[要诀]标准电极电位表
![[要诀]标准电极电位表](https://img.taocdn.com/s3/m/62f3d6e8b04e852458fb770bf78a6529647d350f.png)
[要诀]标准电极电位表标准电极电位表000半反应 E(伏) 半反应 E(伏) 半反应 E(伏)++––F(气) + 2H + 2e = 2HF 3.06 HClO + H + 2e = Cl + HO 1.49 Br(水) + 2e = 2Br 1.087 222+–++O + 2H + 2e = O + 2HO 2.07 ClO + 6H + 5e = 1/2 Cl + 3HO 1.47 NO + H + e = HNO 1.07 32232222+2+ –2–2––SO + 2e = 2SO 2.01 PbO(固) + 4H + 2e = Pb + 2HO 1.455Br + 2e = 3Br 1.05 284223+++HO + 2H + 2e = 2HO 1.77 HIO + H + e = 1/2 I + HO 1.45 HNO + H + e = NO(气) + HO 1.00 2222222++–+2+––+MnO + 4H + 3e = MnO(固) + 2HO 1.695 ClO + 6H + 6e = Cl + 3HO 1.45 VO + 2H + e = VO + HO 1.00 42232222–+–+–+–PbO(固) + SO + 4H + 2e = PbSO(固) + 2HO 1.685 BrO + 6H + 6e =Br + 3HO 1.44 HIO + H + 2e = I + HO 0.99 2442322++–HClO + H + e = HClO + HO 1.64 Au(III) + 2e = Au(I) 1.41 NO + 3H+ 2e = HNO + HO 0.94 22322+–––HClO + H + e = 1/2 Cl + HO 1.63 Cl(气) + 2e = 2Cl 1.3595 ClO+ HO + 2e = Cl + 2OH 0.89 22224+3++––Ce + e = Ce 1.61 ClO + 8H + 7e =1/2 Cl + 4HO 1.34 HO + 2e = 2OH 0.88 42222+–2–+3+2+–HIO + H + 2e = IO + 3HO 1.60 CrO + 14H + 6e =2Cr + 7HO 1.33 Cu + I + e = CuI(固) 0.86 5632272++2+2+HBrO + H + e = 1/2 Br + HO 1.59 MnO(固) + 4H + 2e = Mn + 2HO 1.23 Hg + 2e = Hg 0.845 2222–++–+BrO + 6H + 5e = 1/2 Br + 3HO 1.52 O(气) + 4H + 4e = 2HO 1.229 NO + 2H + e = NO + HO 0.80 32222322+2+++––MnO + 8H + 5e = Mn + 4HO 1.51 IO + 6H + 5e = 1/2 I + 3HO 1.20 Ag + e = Ag 0.7995 42322–+–2+Au(III) + 3e = Au 1.50 ClO + 2H + 2e = ClO + HO 1.19 Hg + 2e = 2Hg 0.793 43223+2++2–2–2–Fe + e = Fe 0.771 2SO(水) + 2H + 4e = SO + HO 0.40 SO + 2e = 2SO 0.08 22324623–––3–4––BrO + HO + 2e = Br + 2OH 0.76 Fe(CN) + e = Fe(CN) 0.36 AgBr(固) + e = Ag + Br 0.071 266 +2++O(气) + 2H + 2e = HO 0.682 Cu + 2e = Cu 0.337 2H + 2e = H 0.000 2222–2++3+–––AsO + 2HO + 3e = As + 4OH 0.68 VO + 2H + 2e = V + HO 0.337 O + HO + 2e = HO + OH ,0.067 822222–++++––2HgCl + 2e = HgCl(固) + 2Cl 0.63 BiO + 2H + 3e = Bi + HO 0.32 TiOCl + 2H + 3Cl + e = TiCl + HO ,0.09 222242000半反应 E(伏) 半反应 E(伏) 半反应 E(伏)–2+2–HgSO(固) + 2e = 2Hg + SO 0.6151 HgCI(固)+ 2e = 2Hg + 2Cl0.2676 Pb + 2e = Pb ,0.126 24422–+2+–MnO + 2HO + 3e = MnO + 4OH 0.588 HAsO + 3H + 3e = As + 2HO 0.248 Sn + 2e = Sn ,0.136 42222–2–––MnO + e = MnO 0.564 AgCI(固)+ e = Ag + Cl 0.2223 AgI(固) + e = Ag + I ,0.152 44+++2+HAsO + 2H + 2e = HAsO + 2HO 0.559 SbO + 2H + 3e = Sb + HO 0.212 Ni + 2e = Ni ,0.246 34222––2–++I + 2e = 3I 0.545 SO + 4H + 2e = SO(水) + HO 0.17 HPO + 2H + 2e = HPO + HO ,0.276 342234332–2+–2+I(固) + 2e = 2I 0.5345 Cu + e = Cu 0.519 Co + 2e = Co ,0.277 24+2++Mo(VI) + e = Mo(V) 0.53 Sn + 2e = Sn 0.154 Tl + e = Tl ,0.336 ++3+Cu + e = Cu 0.52 S + 2H + 2e = HS(气) 0.141 In + 3e = In ,0.345 2 + –2–2–4SO(水) + 4H + 6e = SO + 2HO 0.51 HgBr + 2e = 2Hg + 2Br 0.1395 PbSO(固) + 2e = Pb + SO 0.3553 24622244–2++3+–2–2–HgCI + 2e = Hg + 4Cl 0.48 TiO + 2H + e = Ti + HO 0.1 SeO + 3HO + 4e = Se + 6OH ,0.366 4232+2–2+As + 3H + 3e = AsH ,0.38 AgS(固) + 2e = 2Ag + S ,0.69 Sr + 2e = Sr ,2.89 32+2+2+Se + 2H + 2e = HSe ,0.40 Zn + 2e = Zn ,0.763 Ba + 2e = Ba ,2.90 22+–+Cd + 2e = Cd ,0.403 2HO + 2e = H + 2OH ,8.28 K + e = K ,2.925 223+2+2++Cr + e = Cr ,>0.41 Cr + 2e = Cr ,0.91 Li + e = Li ,3.042 2+–––Fe + 2e = Fe ,0.440 HSnO + HO + 2e = Sn + 3OH ,>0.91 22 2–2–S + 2e = S ,0.48 Se + 2e = Se ,0.92+–2––2CO + 2H + 2e = HCO ,0.49 Sn(OH) + 2e = HSnO + HO +3OH ,0.93 2224622+–––HPO + 2H + 2e = HPO + HO ,0.50 CNO + HO + 2e = Cn + 2OH ,0.97 333222+2+Sb + 3H + 3e = SbH ,0.51 Mn + 2e = Mn ,1.182 3––2––HPbO + HO + 2e = Pb + 3OH ,0.54 ZnO + 2HO + 2e = Zn +4OH ,1.216 22223+3+Ga + 3e = Ga ,0.56 Al + 3e = Al ,1.66000半反应 E(伏) 半反应 E(伏) 半反应 E(伏)––2––TeO + 3HO + 4e = Te + 6OH ,0.57 HAlO + HO + 3e = Al +4OH ,2.35 32232–2+2–2–2SO + 3HO + 4e = SO + 6OH ,0.58 Mg + 2e = Mg ,2.37 3223 2––+SO + 3HO + 4e = S + 6OH ,0.66 Na + e = Na ,2.71 32–2+3––AsO + 2HO + 2e = AsO + 4OH ,0.67 Ca + 2e = Ca ,2.87 422。
标准电极电位符号

标准电极电位符号标准电极电位(Standard electrode potential)是指在标准状态下,电极与溶液中其中一种参考物质的电势差。
它用于描述电化学反应中电极的功能和反应性质,可以用来判断电极在化学反应中的红ox性质。
所以,标准电极电位可以表示为:E(电极)=E(电极)-E(H)1.Ag/AgCl/Cl2(氯化银电极):这是一种常用的参考电极,它以饱和甘汞电极为参考电极,电势为+0.222V。
2.SCE(饱和甘汞/水电极):这是另一种常用的参考电极,它以标准氢电极为参考电极,电势为+0.242V。
3.SHE(标准氢电极):这是最常用的参考电极,以它作为标准,所有其他电极的电势都是相对于它来测量的,它的电势被定义为0V。
标准氢电极包括一个可透气的铂电极,被浓硫酸溶液(1MH2SO4)饱和,氧气在氢气上方逸出,其半反应为:2H⁺+2e⁻→H₂(g)4.SHE的简化形式:为了简化实验操作,有时会使用以Ag/AgCl/Cl-电极或SCE作为标准氢电极的近似电势值。
5.Pt(铂电极):铂电极是一种惰性电极,它的电势与SHE电极接近并在许多体系中用作纯电导度电极。
6.Hg/Hg2SO4(饱和甘汞电极):这是一种标准参比电极,它的电势为+0.7995V。
7.Fe/Fe^2+/Fe^3+(铁/二价铁/三价铁电极):这是用来测量铁离子浓度的电极,在酸性条件下,Fe^2+电势为+0.77V,Fe^3+电势为+0.77V。
8.Cu^2+/Cu(铜离子/铜电极):在酸性条件下,Cu^2+电势为+0.34V,Cu电势为+0.34V。
9.Zn^2+/Zn(锌离子/锌电极):在酸性条件下,Zn^2+电势为-0.76V,锌电势为-0.76V。
10.Ag^+/Ag(银离子/银电极):在酸性条件下,Ag^+电势为+0.80V,银电势为+0.80V。
需要注意的是,标准电极电位是在标准状况下测量的,包括溶液的标准浓度(通常为1 mol/L)和温度(通常为25°C)。
标准电极电位 (298.15K)

1.49
Au3+/Au
Au3++3e-⇌Au
1.50
BrO3-/Br2
2BrO3-+12H++10e-⇌Br2+6H2O
1.5
MnO4-/Mn2+
MnO4-+8H++5e-⇌Mn2++4H2O
1.51
HBrO/Br2
2HBrO+2H++2e-⇌Br2+2H2O
1.6
H2+e-⇌H-
Sc3++3e-⇌Sc
Th4++4e-⇌Th
-2.25
-2.1
-1,9
Be+/Be
Be2++2e-⇌Be
-1.85
U3+/U
U3++3e-⇌U
-1.80
Al3+/Al
Al3++3e-⇌Al
-1.66
Ti2+/Ti
Ti2++2e-⇌Ti
-1.63
ZrO2/Zr
ZrO2+4H++4e-⇌Zr+H2O
Mn(OH)2+2e-⇌Mn+20H-
[Zn(CN)4]2-+2e-⇌Zn+4CN-
ZnO22-+2H2O+2e-⇌Zn+4OH-
2SO32-+2H2O+2e-⇌S2O42-+4OH-
[Zn(NH3)4]2++2e-⇌Zn+4NH3
[Sn(OH)6]2-+2e-⇌HSnO2-+30H-+H2O
SO42-+H2O+2e-⇌SO32-+20H-
1.8
S2O82-/ SO42-
S2O82-+2e-⇌2SO42-
2.0
O3/O2
XeF2/Xe
F2/F-
H4XeO6/XeO3
电极电位表

电极电位表电极电位表是一种记录不同金属电极在标准条件下的电位差的参考资料,它是电化学研究和工程应用中的重要工具。
电极电位表的编制涉及到大量的实验测定和数据整理,旨在提供电极电位研究和电化学反应设计的参考依据。
电极电位是指在一定条件下,电极表面与溶液中参考电极之间的电势差。
电极电位表中的数据是通过比较各种金属电极与参考电极的电位得出的。
常用的参考电极有标准氢电极、标准银-银离子电极和标准铂电极等。
以下是电极电位表的相关参考内容:1. 电极:列出不同金属电极的名称和符号,如铁电极(Fe|Fe2+)、锌电极(Zn|Zn2+)等。
同时,表中还可以包括非金属电极,如氧电极(O2|H2O)等。
2. 单位:标注电极电位的单位,一般使用伏特(V),也可以使用标准电极电位(E0),单位是伏。
3. 温度:标明实验测定电极电位所使用的温度,一般是25摄氏度(℃),因为电位与温度有关。
4. 电位值:列出各个电极的电位值,以及电位的正负号。
电位值一般为标准电极电位(E0),其中正电位表示电极的氧化能力强,负电位表示电极的还原能力强。
电位值的大小可以按照从正到负的顺序排列,方便查找和比较。
5. 备注:可在表格中添加备注信息,包括电极的特性、使用条件、适用范围等。
例如,电极电位的测量方法、测量误差、实验条件等。
编制电极电位表需要大量的实验数据和文献资料的整理和归纳。
在编制过程中,需要考虑实验条件的标准化和一致性,以确保数据的可靠性和可比较性。
同时,需要选择合适的参考电极和实验方法,确保测量结果准确。
电极电位表的应用非常广泛。
在电池研究中,电极电位表可以用于确定不同金属的电池电位差,预测电池的电动势。
在腐蚀研究中,电极电位表可以用于评估金属的腐蚀倾向和耐腐蚀性能。
在电化学反应设计中,可以根据电极电位表选择合适的电极材料和条件,以实现所需的反应。
总之,电极电位表是电化学研究和工程应用中重要的参考资料。
通过电极电位表,可以了解不同金属电极的电位特性,预测电池和电化学反应的性质和行为,为相关研究和应用提供参考依据。
标准电极电位表

标准电极电位表标准电极电位表是化学中常用的一种参考表,它记录了不同物质在标准状态下的电极电位数值。
通过这个表,我们可以了解物质在电化学反应中的电位变化,从而更好地理解和预测化学反应的进行和方向。
本文将对标准电极电位表的基本概念、应用和相关知识进行介绍。
首先,标准电极电位表是以标准氢电极为参照的。
标准氢电极被定义为在标准状态下(25摄氏度,1大气压),氢离子的活度为1的电极。
它的电极电位被规定为0V,作为其他物质电极电位的参照。
标准电极电位表中的物质电极电位数值,都是相对于标准氢电极的电位值。
标准电极电位表中的电极电位数值是通过实验测量得到的。
在实验中,将待测物质的电极与标准氢电极连接,通过电位计测量它们之间的电位差,从而得到待测物质的电极电位数值。
这些数值反映了物质在标准状态下的氧化还原性质,对于研究物质的化学性质和电化学反应具有重要意义。
标准电极电位表的应用非常广泛。
首先,它可以用于预测化学反应的进行方向。
根据标准电极电位表中物质的电极电位数值,我们可以判断出不同物质之间的氧化还原反应是进行还是不进行的。
一般来说,电极电位较正的物质更容易发生还原反应,而电极电位较负的物质更容易发生氧化反应。
其次,标准电极电位表也可以用于电化学电池的设计和优化。
根据不同物质的电极电位数值,可以选择合适的阳极和阴极材料,设计出性能更好的电化学电池。
除此之外,标准电极电位表还可以用于研究物质的化学性质和电化学行为。
通过比较不同物质的电极电位数值,可以了解它们的氧化还原特性,为物质的合成和应用提供重要参考。
同时,标准电极电位表也被广泛应用于环境监测、能源开发、材料研究等领域。
总之,标准电极电位表是化学中一项重要的参考工具,它记录了不同物质在标准状态下的电极电位数值,具有重要的理论和应用价值。
通过对标准电极电位表的研究和应用,我们可以更好地理解和预测化学反应的进行和方向,为材料设计、环境保护、能源开发等领域提供重要支持。
无机化学-标准电极电位表的应用

⑤判断氧化还原反应进行的次序
θ I2 /I-
0.535 V
θ Br2 /Br
θ Cl2 /Cl
1.07 V0.29 1.36 V
0.82 V
V
即:一种氧化剂可以氧化几种还原剂时,首先氧化最强的还 原剂. 同理,还原剂首先还原最强的氧化剂.注意:上述判断 只有在有关的氧化还原反应速率足够大的情况下才正确.
但只代表热力学倾向的大小!
③ 同一物质在某一电对中是氧化型,在另一电对中也可以 是还原型。
Fe 2 2e Fe Fe2+是氧化型
Fe3 e Fe 2 Fe2+是还原型
④ 只与物质的本质有关,与反应式中的系数无关。
Cl2 (g) 2e 2Cl (aq) , θ 1.36V
1 2
Cl2
Zn
0.763V
Cr 3
Cr
-0.74V
Fe2Байду номын сангаас
Fe
-0.440V
Co 2
Co
-0.277V
Ni 2
Ni
-0.246V
Pb2
Pb
-0.126V
由以上数据可知,活动性顺序为: Mn > Zn > Cr > Fe > Co > Ni > Pb
②判断氧化剂和还原剂的相对强弱
氧化态 + ne- = 还原态 /v
(g)
e
Cl (aq) , θ
1.36V
⑤ 对角线相互反应方向 右上方还原型物质与左下方氧化型物资能相互反应,反 之则不能
Fe 2 2e Fe , θ -0.44V 2H 2e H 2 , θ 0V Cu 2 2e Cu, θ +0.34V ⑥ 该表为25℃时的标准电极电势。但由于电极电势随温度 的变化不大,所以在室温下一般均可用该值表示。
