常见的吸放热反应_吸热反应
四种基本反应类型与放热反应和吸热反应的关系以及反应防热或吸热的判断

一、四种基本反应类型与放热反应和吸热反应的关系(一)、化合反应中的放热反应和吸热反应绝大多数的化合反应是放热反应,少数化合反应是吸热反应。
1、化合反应中常见的放热反应:(1)氢化物的生成反应是放热反应的实例①氢气与氟气黑暗处就爆炸放热:H2 +F2 =2HF②氢气在氯气中燃烧放热:H2 + Cl2点燃2HCl③氢气和氯气的混合光照爆炸放热:H2 + Cl2光照2HCl④氢气在氧气或空气中燃烧放热:2H2 +O2点燃2H2O⑤氮气和氢气合成氨气是体积缩小的放热反应:N2 +3H2高温高压催化剂2NH3(2)氧化物的生成是放热反应的实例①木炭在空气或氧气中燃烧放热:C+O2点燃CO2②一氧化碳在空气或氧气中燃烧放热:2CO+O2点燃2CO2③氨气催化氧化生成一氧化氮和水放热:4NH3 +5O2催化剂加热4NO+6H2O④硫在空气或氧气中燃烧放热:S+O2点燃SO2⑤二氧化硫与氧气催化氧化反应放热2SO2 +O2催化剂加热2SO3(3)含氧酸的生成反应是放热的实例①三氧化硫溶于水生成硫酸是放热反应:SO3 +H2O=H2SO4(4)强碱的生成反应是放热反应的实例①氧化钠与水反应生成氢氧化钠放热:Na2O+H2O=2NaOH②过氧化钠与水反应生成氢氧化钠和氧气放热:2Na2O2+2H2O=4NaOH+O2↑③生石灰氧化钙和水放应生成氢氧化钙放热:CaO+H2O=Ca(OH)2(5)活泼金属的含氧酸盐的生成是放热反应的实例①氧化钠与二氧化碳生成碳酸钠放热:Na2O+CO2=Na2CO3②生石灰氧化钙与二氧化碳生成碳酸钙放热:CaO+CO2=CaCO32、化合反应中常见的少数吸热反应(1)氢化物的生成反应是吸热反应的实例①氢气与碘持续加热生成碘化氢吸热:H2 +I2加热2HI②氢气和硫蒸气加热反应生成硫化氢吸热:2H2 +S 点燃2H2S(2)氧化物的生成是放热反应的实例①铜在空气中加热生成氧化铜吸热:2Cu+O2点燃2CuO②二氧化碳与碳加热生成一氧化碳吸热:CO2+C 加热2CO(二)、分解反应中的放热反应和吸热反应分解反应少数是放热反应,大多数是吸热反应。
四种基本反应类型与放热反应和吸热反应的关系以及反应防热或吸热的判断

一、四种基本反应类型与放热反应和吸热反应的关系(一)、化合反应中的放热反应和吸热反应绝大多数的化合反应是放热反应,少数化合反应是吸热反应。
1、化合反应中常见的放热反应:(1)氢化物的生成反应是放热反应的实例①氢气与氟气黑暗处就爆炸放热:H2 +F2 =2HF②氢气在氯气中燃烧放热:H2 + Cl2点燃2HCl③氢气和氯气的混合光照爆炸放热:H2 + Cl2光照2HCl④氢气在氧气或空气中燃烧放热:2H2 +O2点燃2H2O⑤氮气和氢气合成氨气是体积缩小的放热反应:N2 +3H2高温高压催化剂2NH3(2)氧化物的生成是放热反应的实例①木炭在空气或氧气中燃烧放热:C+O2点燃CO2②一氧化碳在空气或氧气中燃烧放热:2CO+O2点燃2CO2③氨气催化氧化生成一氧化氮和水放热:4NH3 +5O2催化剂加热4NO+6H2O④硫在空气或氧气中燃烧放热:S+O2点燃SO2⑤二氧化硫与氧气催化氧化反应放热2SO2 +O2催化剂加热2SO3(3)含氧酸的生成反应是放热的实例①三氧化硫溶于水生成硫酸是放热反应:SO3 +H2O=H2SO4(4)强碱的生成反应是放热反应的实例①氧化钠与水反应生成氢氧化钠放热:Na2O+H2O=2NaOH②过氧化钠与水反应生成氢氧化钠和氧气放热:2Na2O2+2H2O=4NaOH+O2↑③生石灰氧化钙和水放应生成氢氧化钙放热:CaO+H2O=Ca(OH)2(5)活泼金属的含氧酸盐的生成是放热反应的实例①氧化钠与二氧化碳生成碳酸钠放热:Na2O+CO2=Na2CO3②生石灰氧化钙与二氧化碳生成碳酸钙放热:CaO+CO2=CaCO32、化合反应中常见的少数吸热反应(1)氢化物的生成反应是吸热反应的实例①氢气与碘持续加热生成碘化氢吸热:H2 +I2加热2HI②氢气和硫蒸气加热反应生成硫化氢吸热:2H2 +S 点燃2H2S(2)氧化物的生成是放热反应的实例①铜在空气中加热生成氧化铜吸热:2Cu+O2点燃2CuO②二氧化碳与碳加热生成一氧化碳吸热:CO2+C 加热2CO(二)、分解反应中的放热反应和吸热反应分解反应少数是放热反应,大多数是放热反应。
《化学反应原理》知识点大全

《化学反应原理》知识点大全第一章、化学反应与能量考点1:吸热反应与放热反应1、吸热反应与放热反应的区别特别注意:反应是吸热还是放热与反应的条件没有必然的联系,而决定于反应物和生成物具有的总能量(或焓)的相对大小。
2、常见的放热反应①一切燃烧反应;②活泼金属与酸或水的反应;③酸碱中和反应;④铝热反应;⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
3、常见的吸热反应①Ba(OH)2·8H2O与NH4Cl反应;②大多数分解反应是吸热反应③等也是吸热反应;④水解反应考点2:反应热计算的依据1.根据热化学方程式计算反应热与反应物各物质的物质的量成正比。
2.根据反应物和生成物的总能量计算ΔH=E生成物-E反应物。
3.根据键能计算ΔH=反应物的键能总和-生成物的键能总和。
4.根据盖斯定律计算化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。
即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
温馨提示:①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学计算。
5.根据物质燃烧放热数值计算:Q(放)=n(可燃物)×|ΔH|。
第二章、化学反应速率与化学平衡考点1:化学反应速率1、化学反应速率的表示方法___________。
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。
表达式:___________ 。
其常用的单位是__________ 、或__________ 。
2、影响化学反应速率的因素1)内因(主要因素)反应物本身的性质。
2)外因(其他条件不变,只改变一个条件)3、理论解释——有效碰撞理论(1)活化分子、活化能、有效碰撞①活化分子:能够发生有效碰撞的分子。
②活化能:如图图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。
常见的吸热和放热反应

常见的吸热和放热反应
分解反应是吸热。
分解反应是化学反应的常见的四大基本反应类型之一,是指由一种
物质反应生成两种或两种以上新物质的反应,可以简单理解为“一变多”。
其中部分反应
为氧化还原反应,部分为非氧化还原反应。
按照不同的分类标准,分解反应可以被分为不
同的类别。
此外,只有化合物才能发生分解反应。
放热反应:
在化学反应中,反应物总能量大于生成物总能量的反应叫作放热反应。
包含冷却、中和、金属水解、铝热反应、较开朗的金属与酸反应、由不能平衡物质变成平衡物质的反应。
吸热反应:
吸热反应就是所指在过程中稀释热量的化学反应。
例如赤热的炭和水蒸气促进作用分
解成水煤气的反应。
化学反应只有少数就是放热的。
稀释冷在热化学方程式中用负号(一)则表示。
回流reflux在精馏过程中由塔顶蒸气凝缩而得的液体中再由塔顶回入塔内的部分。
可以补充易挥发组分,使得精馏操作能连续进行。
化学中常见的吸热反应和放热反应

化学中常见的吸热反应和放热反应化学中常见的吸热反应和放热反应协议一、协议方信息1、甲方:____________________________2、乙方:____________________________二、吸热反应1、大多数分解反应11 碳酸钙高温分解:CaCO₃=高温= CaO + CO₂↑12 氢氧化铜受热分解:Cu(OH)₂=△= CuO + H₂O13 氯化铵受热分解:NH₄Cl =△= NH₃↑ +HCl↑2、碳和二氧化碳的反应21 C + CO₂=高温= 2CO3、以 C、H₂、CO 为还原剂的氧化还原反应31 碳还原氧化铜:C + 2CuO =高温= 2Cu + CO₂↑32 氢气还原氧化铜:H₂+ CuO =△= Cu + H₂O33 一氧化碳还原氧化铜:CO + CuO =△= Cu + CO₂三、放热反应1、所有的燃烧反应11 甲烷燃烧:CH₄+ 2O₂=点燃= CO₂+ 2H₂O12 乙醇燃烧:C₂H₅OH + 3O₂=点燃= 2CO₂+ 3H₂O2、酸碱中和反应21 盐酸和氢氧化钠反应:HCl + NaOH == NaCl + H₂O22 硫酸和氢氧化钾反应:H₂SO₄+ 2KOH == K₂SO₄+ 2H₂O3、金属与酸的反应31 锌和稀硫酸反应:Zn + H₂SO₄== ZnSO₄+ H₂↑32 铁和稀盐酸反应:Fe + 2HCl == FeCl₂+ H₂↑四、吸热反应和放热反应的影响因素1、反应物和生成物的能量差11 当反应物的总能量低于生成物的总能量时,反应为吸热反应。
12 当反应物的总能量高于生成物的总能量时,反应为放热反应。
2、化学键的断裂和形成21 化学键的断裂需要吸收能量,化学键的形成会释放能量。
22 吸热反应中,化学键断裂吸收的能量大于形成新化学键释放的能量。
23 放热反应中,化学键断裂吸收的能量小于形成新化学键释放的能量。
五、吸热反应和放热反应在实际生活中的应用1、吸热反应的应用11 制冷剂:某些吸热反应可以用于制冷,如氯化铵和氢氧化钡的反应。
常见的放热反应和吸热反应

常见的放热反应和吸热反应⑴常见的放热反应①燃烧反应。
如C、CO、C2H5OH等到的燃烧②酸碱中和反应。
如2KOH+H2SO4=K2SO4+2H2O③活泼金属与水或酸的反应。
如2Al+6HCl=2AlCl3+3H2↑④多数化合反应。
如Na2O+H2O =2NaOH,SO3+H2O=H2SO4⑵常见的吸热反应①多数分解反应,如CaCO3 CaO+CO2↑②铵盐与碱的反应,如:2NH4Cl(s)+Ba(OH)2·8H2O (s)=BaCl2+2NH3↑+10H2O③C(s)+H2O(g) CO+H2④CO2+C 2CO测定反应热Q= - C(T2 -T1)=- C0m(T2-T1)中和反应的反应热:酸碱中和反应所放出的热量中和热:在稀溶液中,酸和碱发生中和反应生成1mol水时的放出的热量中和热数值大小与反应物量多少无关焓:物质本身所具有的能量用焓来表示符号:H焓变△H=H 生成物-H反应物∆H<0时,为放热反应∆H>0时,为吸热反应影响焓及焓变大小的因素1、不同物质,H不同,△H也不同2、同一物质,物质的量越大,H也越大,△H也越大3、同一物质,H(气)> H(液)> H(固)焓变与反应热的不同:△H大小要看符号,Q的大小不看符号书写热化学方程式,注意以下几点:(1)热化学方程式要标明物质的状态:固体—s,液体—l,气体—g;水溶液中的溶质用aq表示(2) △H后要注明反应的温度,对于298K时进行的反应可以不注明温度;(3) △H单位是J·mol-1或KJ ·mol-1(4)若方程式中各物质系数加倍,则△H数值也加倍,若反应逆向进行,则符号也要变盖斯定律对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的,这一规律称为盖斯定律。
电解池与原电池有哪些异同(续)装置 原电池 电解池电子离子 流向电子流向: 负极 →导线→正极 离子流向: 阳离子→正极 阴离子→负极电子流向: 电源负极→电解池阴极电解池阳极→电源正极 离子流向: 阴离子→阳极 阳离子→阴极电解池与原电池①两电极接直流电源 ②电解质溶液 ③形成闭合回路①活泼性不同的两电极 ②电解质溶液③形成闭合回路形成条件 将电能转变成化学能的装置 将化学能转变成电能的装置 定义装置 实例电解池原电池装置电解池与原电池有哪些异同(续)电镀①电极: 阳极——镀层金属 阴极——待镀金属制品 ②电镀液:含有镀层金属离子的电解质溶液。
初中常见的吸热反应和放热反应

初中常见的吸热反应和放热反应嘿,小伙伴们!今天咱们来聊聊初中化学里那些超有趣的吸热反应和放热反应,就像探索魔法世界一样好玩呢!先来说说放热反应吧。
燃烧反应那可是放热反应中的“大火球”!就像一个超级热情的舞者在舞台上尽情释放能量。
比如说木炭燃烧,那木炭一点着,“轰”的一下,热量就呼呼地往外冒,就好像木炭在说:“我体内的热情藏不住啦,都给你们吧!”感觉周围的空气都被它的热情点燃了,温度蹭蹭往上升。
还有中和反应,这就像是两个小冤家突然和解了,然后一起释放出巨大的“和平能量”。
酸和碱一混合,那热量就悄悄地跑出来了。
就好比两个一直吵架的小伙伴,突然握手言和,然后周围就充满了一种和谐又温暖的氛围,这种温暖就是热量啦。
金属和酸的反应也很有趣哦。
金属就像一个个勇敢的小战士,一头扎进酸的“海洋”里,然后就开始噼里啪啦地放出热量。
比如镁条放入稀盐酸中,镁条就像个小鞭炮似的,“滋滋”地冒着气泡,同时还散发出大量的热,感觉它在向全世界宣告:“我和酸的战斗可激烈了,这热量就是我的战绩!”再来说说吸热反应吧。
碳和二氧化碳反应生成一氧化碳这个反应,就像是一个“小吝啬鬼”反应。
二氧化碳紧紧抱住碳,还从周围吸收热量,就好像在说:“我还不够强大,我要吸收热量让自己变身。
”这个反应偷偷摸摸地从周围环境把热量拿走,让周围感觉凉飕飕的,就像有个小冷风吹过一样。
氢氧化钡晶体和氯化铵晶体的反应,那简直是吸热反应中的“大冰窖”。
这俩晶体一混合,周围的热量就像被它们大口大口地吞掉了一样。
就好比两个超级大胃王,只不过它们吃的不是食物,而是热量。
周围的温度急剧下降,感觉像是突然进入了寒冬腊月。
还有碳酸钙高温分解,这个反应就像是石头在做“高温瑜伽”。
碳酸钙在高温下,慢慢分解,它需要吸收大量的热量来完成这个“高难度动作”。
就像一个人在很努力地吸收能量来突破自己,周围的热量都被它吸走了,只为了自己能变成氧化钙和二氧化碳这两个“新形态”。
硝酸铵溶于水的反应也很奇特。
常见放热反应和吸热反应

3.白磷与氧气可发生如下反应 4+5O2=P4O10。已知 白磷与氧气可发生如下反应:P 白磷与氧气可发生如下反应 断裂下列化学键需要吸收的能量分别为: 断裂下列化学键需要吸收的能量分别为 P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、 O=O dkJ·mol-1。根据图示的分子结构和有关数据 估算该反应的△H,其中正确的是 ,其中正确的是( A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d)kJ·mol-1 C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1 A )
能 量
活化分子的最低能量E 活化分子的最低能量E 能量E 的
H
分子 能量E 能量E
A
2.下列关于热化学反应的描述中正确的是( 2.下列关于热化学反应的描述中正确的是( 下列关于热化学反应的描述中正确的是
B )
反应的中和热 57.3kJ/mol, A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则 HCl和NaOH反应的中和热△ =-57.3kJ/mol 反应的中和热△ H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol B.CO(g)的燃烧热是283.0kJ/mol,则 CO(g)的燃烧热是283.0kJ/mol, 的燃烧热是283.0kJ/mol 2CO2(g)===2CO(g)+O2(g)反应的△H=2×283.0kJ/mol (g)===2CO(g)+ (g)反应的 反应的△ C.需要加热才能发生的反应一定是吸热反应 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量 D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量 是甲烷的燃烧热
高一化学第六章化学反应与能量知识点和题总结
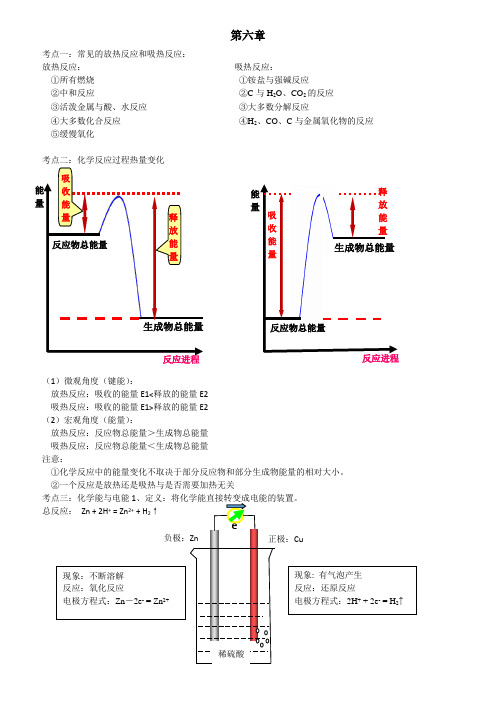
第六章考点一:常见的放热反应和吸热反应:放热反应: 吸热反应:①所有燃烧 ①铵盐与强碱反应②中和反应 ②C 与H 2O 、CO 2的反应 ③活泼金属与酸、水反应 ③大多数分解反应④大多数化合反应 ④H 2、CO 、C 与金属氧化物的反应 ⑤缓慢氧化考点二:化学反应过程热量变化(1)微观角度(键能):放热反应:吸收的能量E1<释放的能量E2 吸热反应:吸收的能量E1>释放的能量E2 (2)宏观角度(能量):放热反应:反应物总能量>生成物总能量 吸热反应:反应物总能量<生成物总能量 注意:①化学反应中的能量变化不取决于部分反应物和部分生成物能量的相对大小。
②一个反应是放热还是吸热与是否需要加热无关总反应: Zn + 2H + = Zn 2+ + H 2↑e - 反应物总能量生成物总能量 能量 反应进程 吸收能量 能量释放能量反应进程反应物总能量生成物总能量吸收能量释放能量稀硫酸负极:Zn 正极:Cu 现象:不断溶解 反应:氧化反应 电极方程式:Zn -2e - = Zn 2+ 现象: 有气泡产生 反应:还原反应 电极方程式:2H + + 2e - = H 2↑外电路:电子由负极经导线流向正极内电路:阳离子→正极;阴离子→负极2.形成原电池的条件(两极一液一回路):①两个活泼性不同的电极(金属与金属或金属与碳棒)②电解质溶液③形成闭合回路,自发进行的氧化还原反应3.氢氧燃料电池:(1)酸性燃料电池:负极:2H2-4e-= 4H+ 正极:O2 +4e- + 4H+= 2H2O(2)碱性燃料电池:负极:2H2 + 4OH- - 4e- = 4H2O 正极:O2 + 2H2O + 4e- = 4OH-总反应:2H2 + O2 =2H2O4.甲烷燃料电池:(电解质为KOH)负极:CH4+10OH--8e-=CO32-+7H2O 正极:2O2+4H2O+8e-=8OH-总反应:CH4+2O2+2KOH=K2CO3+3H2O练习:1.下列关于能量变化的说法,正确的是()A.等质量的红磷和白磷完全燃烧生成P2O5(s)放出的热量相同B.2Na+2H2O===2NaOH+H2,该反应生成物的总能量高于反应物的总能量C.放热反应中,反应物的总能量大于生成物的总能量D.有化学键断裂的是吸热过程,并且一定发生了化学变化2.下列反应既属于氧化还原反应,又是放热反应的是()A.铝与盐酸反应B.NaOH和HCl反应C.Ba(OH)2·8H2O与NH4Cl的反应D.CaCO3受热分解为CaO和CO23.下列变化过程,属于放热反应的是:()①NaOH固体溶于水②炸药爆炸③食物因氧化而腐败④铝热反应⑤酸碱中和反应⑥煅烧石灰石制生石灰⑦盐酸溶液中插入打磨过的铝片A.②③④⑤⑦B.①②④⑤C.②③④⑤D.①②③⑥⑦4.已知拆开1mol H–H键,1mol N≡N键分别需要吸收的能量为436kJ 、946kJ;形成1mol N–H键,会放出能量391kJ,在反应N2 + 3H22NH3中,每生成2mol NH3,()A.放出92 kJ热量B.吸收92 kJ热量C.放出209kJ热量D.吸收209kJ热量5.反应M+Z→Q(ΔH>0)分两步进行:①M+Z→X(ΔH<0),②X→Q(ΔH>0)。
常见的吸放热反应方程式

常见的吸放热反应方程式
1. 水的蒸发,H2O(l) → H2O(g) ΔH = +44 kJ/mol.
这是一个吸热反应,因为液态水变成气态水需要吸收热量。
2. 水的凝固,H2O(g) → H2O(l) ΔH = -44 kJ/mol.
这是一个放热反应,因为气态水变成液态水释放热量。
3. 燃烧反应,C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g) ΔH = -2220 kJ/mol.
燃烧反应通常是放热反应,因为在燃烧过程中化学能转化为热能。
4. 溶解反应,NH4Cl(s) + H2O(l) → NH4Cl(aq) ΔH = +14.8 kJ/mol.
溶解固体NH4Cl需要吸热,所以这是一个吸热反应。
5. 硫酸与水的反应,H2SO4(l) + H2O(l) → H2SO4(aq) ΔH = -69.9 kJ/mol.
硫酸与水的反应释放热量,因此是一个放热反应。
这些是一些常见的吸放热反应方程式。
化学反应的热效应对于理解反应的能量变化和热力学性质非常重要。
希望这些例子能够帮助你理解吸放热反应方程式的基本原理。
放热反应和吸热反应

吸热反应与放热反应1、化合反应中常见的放热反应:①氢气与氟气黑暗处就爆炸放热:H2 +F2 =2HF②氢气在氯气中燃烧放热:H2 + Cl2点燃2HCl③氢气和氯气的混合光照爆炸放热:H2 + Cl2光照2HCl④氢气在氧气或空气中燃烧放热:2H2 +O2点燃2H2O⑤氮气和氢气合成氨气是体积缩小的放热反应:N2 +3H2高温高压催化剂2NH3①木炭在空气或氧气中燃烧放热:C+O2点燃CO2②一氧化碳在空气或氧气中燃烧放热:2CO+O2点燃2CO2③氨气催化氧化生成一氧化氮和水放热:4NH3 +5O2催化剂加热4NO+6H2O④硫在空气或氧气中燃烧放热:S+O2点燃SO2⑤二氧化硫与氧气催化氧化反应放热2SO2 +O2催化剂加热2SO3①三氧化硫溶于水生成硫酸是放热反应:SO3 +H2O=H2SO4①氧化钠与水反应生成氢氧化钠放热:Na2O+H2O=2NaOH②过氧化钠与水反应生成氢氧化钠和氧气放热:2Na2O2+2H2O=4NaOH+O2↑③生石灰氧化钙和水放应生成氢氧化钙放热:CaO+H2O=Ca(OH)2①氧化钠与二氧化碳生成碳酸钠放热:Na2O+CO2=Na2CO3②生石灰氧化钙与二氧化碳生成碳酸钙放热:CaO+CO2=CaCO32、化合反应中常见的少数吸热反应(1)氢化物的生成反应是吸热反应的实例①氢气与碘持续加热生成碘化氢吸热:H2 +I2加热2HI②氢气和硫蒸气加热反应生成硫化氢吸热:2H2 +S 点燃2H2S(2)氧化物的生成是放热反应的实例①铜在空气中加热生成氧化铜吸热:2Cu+O2点燃2CuO②二氧化碳与碳加热生成一氧化碳吸热:CO2+C 加热2CO2、分解反应中多数是吸热反应①氧化铜受热分解生成氧化亚铜和氧气时吸热:4CuO高温2Cu2O+O2↑②氧化汞受热分解产生汞和氧气时吸热:2HgO 加热2Hg+O2 ↑(3)氧化性酸受热分解时吸热的实例:4HNO3(浓)加热4NO2↑+O2↑+2H2O①氢氧化镁受热分解产生氧化镁和水时吸热:Mg(OH)2加热MgO+H2O②氢氧化铝受热分解产生三氧化二铝和水时吸热:2Al(OH)3加热Al2O3+3H2O③氢氧化铁受热分解产生三氧化二铁和水时吸热:2Fe(OH)3加热Fe2O3+3H2O④氢氧化铜受热分解产生氧化铜和水时吸热:Cu(OH)2加热CuO+H2O⑤氨水受热分解产生氨气和水时吸热:NH3 ·H2O加热NH3↑+H2O①碳酸氢铵受热分解产生氨气、水和二氧化碳时吸热:NH4HCO3加热NH3↑+CO2↑+H2O②碳酸氢钠受热分解产生碳酸钠、二氧化碳和水时吸热:2NaHCO3加热Na2CO3 +CO2↑+H2O③碳酸钙高温分解产生氧化钙和二氧化碳时吸热:CaCO3高温CaO+CO2↑①硝酸钾受热分解生成亚硝酸钾和氧气时吸热:2KNO3加热2KNO2 + O2↑②硝酸镁受热分解生成氧化镁、二氧化氮和氧气时吸热:2Mg(NO3)2加热2MgO+4NO2↑+ O2↑③硝酸银受热分解生成银、二氧化氮和氧气时吸热:2AgNO3加热2Ag+2NO2↑+ O2↑(7)铵盐受热分解时吸热的实例①氯化铵受热分解产生氨气和氯化氢时吸热:NH4Cl 加热NH3↑+HCl↑②碳酸铵受热分解产生氨气、二氧化碳和水时吸热:(NH4)2CO3加热2NH3↑+CO2↑+H2O (三)、置换反应中的反热反应和吸热反应1、大多数置换反应是放热反应(1)活泼金属与水发生置换反应放热的实例①钠与水发生置换反应时放热:2Na+2H2O=2NaOH+H2↑②钾与水发生置换反应时放热:2K+2H2O=2KOH+H2↑(2)活泼非金属与水发生置换反应放热的实例①氟气与水发生置换反应时放热:2F2+2H2O=4HF+O2↑②氯气与水发生岐化反应时放热:Cl2+H2O=HCl+HClO(3)单质铝与某些金属氧化物发生的铝热反应放热的实例①在高温条件下铝粉与四氧化三铁发生置换反应时放热:8Al+3Fe3O4高温4Al2O3 +9Fe②在高温条件下铝粉与三氧化二铬发生置换反应时放热:2Al+Cr2O3高温Al2O3 + 2Cr③在高温条件下铝粉与二氧化锰发生置换反应时放热:4Al+3MnO2高温2Al2O3 + 3Mn(4)活泼金属与酸发生的置换反应放热的实例①金属钠与盐酸发生置换反应时放热:2Na+2HCl=2NaCl+H2↑②金属镁与盐酸发生置换反应时放热:Mg+2HCl=MgCl2+H2↑③金属铝与盐酸发生置换反应时放热:2Al+6HCl=2AlCl3+3H2↑2、少数置换反应是吸热放应(1)中等活泼金属与水蒸汽高温条件下反应时吸热的实例①在高温条件下铁与水蒸汽发生置换反应时吸热:3Fe+4H2O(g) 高温Fe3O4+4H2②在高温条件下铅与水蒸汽发生置换反应时吸热:3Pb+4H2O(g) 高温Pb3O4+4H2(2)还原性非金属单质碳与水蒸汽高温条件下发生置换反应时吸热的实例①在高温条件下红热炭与水蒸汽发生置换反应时吸热:C+H2O(g) 高温CO+H21、酸碱中和反应是放热反应(1)盐酸和氢氧化钠溶液反应是放热反应:HCl+NaOH=NaCl+H2O2、强碱和铵盐的复分解反应是吸热反应(1)氯化铵和熟石灰发生复分解反应时吸热:2NH4Cl+Ca(OH)2加热CaCl2 +2NH3↑+2H2O(2)氯化铵和八水合氢氧化钡发生复分解反应时吸热:2NH4Cl+Ba(OH)2·8H2O加热BaCl2 +2NH3↑+10H2O1、在相同温度和压强下,将32克硫分别在纯氧和空气中完全燃烧,设前者放热为Q1,后者放热为Q2,则关于Q1和Q2的相对大小正确的是( A )A. Q1=Q2B. Q1>Q2C. Q1<Q2D.无法判断2. 下列说法中正确的是 ( CD )A 需要加热才能发生的反应一定是吸热反应B 任何放热反应在常温条件下一定能发生反应C反应物和生成物所具有的总能量决定了放热还是吸热 D 吸热反应在一定条件下(如常温、加热等)也能发生反应3.下列反应既是氧化还原反应,又是吸收能量的化学反应的是( C )A铝片与稀盐酸的反应 B Ba(OH)2·8H2O与NH4Cl的反应 C 灼热的炭与CO2反应 D甲烷在氧气中的燃烧反应4.已知化学反应2C(s)+O2(g)点燃2CO(g),2CO(g)+O2(g)点燃2CO2都是放热反应。
常见的吸放热反应-吸热反应

常见的吸放热反应吸热反应放热反应:①活泼金属置换水或酸中氢的反应,如:2Na+2H2O=2NaOH+H2↑2Al+6HCl=2AlCl3+3H2↑②酸碱中和反应。
如:NaOH+HCl=NaCl+H2O 2KOH+H2SO4=K2SO4+2H2O③含碳燃料燃烧的反应,如:2CO+O2=2CO2 CH3CH2OH+3O2=2CO2+3H2O④易爆物质的爆炸反应。
⑤多数的化合反应,如:Na2O+H2O=2NaOH CaO+H2O=Ca(OH)2⑥一些物质的溶解,如浓硫酸的稀释、氢氧化钠的溶解、氧化钙的溶解等。
吸热反应:①几个常见的反应,如:2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O C+H2O(g)=CO+H2②多数的分解反应,如:CaCO3=CaO+CO2↑ CuSO4·5H2O=CuSO4+5H2O③一些物质的溶解,如硝酸铵溶解等。
常见的放热反应:1.一切燃烧,以及部分氧化(如氨气氧化)2.中和、沉淀(不全是)3.多数化和,如SO3+H2O,NH3+HCl(但H2+I2,合成NH3吸热)4.特别剧烈的反应,如电石和水常见的吸热反应:1.高温下碳还原金属氧化物2.电离,水解3.多数化和,如KClO3,KMnO4,CaCO34.必须持续加热的反应,如石油裂化常见的放热反应:所有的燃烧反应(O2,Cl2中进行)酸碱中和反应金属与酸H+(H2O)铝热反应合成氨硫酸工业(接触室)2SO2+O2=(可逆)2SO3 硝酸工业制NO 4NH3+502=4NO+6H2O 常见的吸热溶解吸热NH4NO3 Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3+10H2O大多数的分解反应C+H2O=CO+HC(制水煤气法)C+CO2=2CO(制煤气)N2+O2=2NO。
常见放热反应和吸热反应PPT课件

常见的放热反应
燃烧、酸碱中和、活泼金属与水或酸反应、铝热反应、 多数化合反应、原子结合为分子等
2NO2
N2O4
△H <0
催化剂
2SO2+O2 ∆ 2SO3
催化剂
N2+3H2 高温高压 2NH3
△H <0 △H <0
4NH3+5O2=催=化∆=剂=4NO+6H2O △H <0
.
常见的吸热反应
多数分解反应、盐类的水解反应、金属的冶炼(铝热除 外)、分子拆成原子等。
_体___—____,_固l _体__—____,__溶_s液__— ____)____a_q_____________.
(3)化学方程式中各物质前的化学计量数只表示 物质,的因量此, 在必要时可用简单的分数表示;
(4) 要标明热量变化: 用表示 △。H若为放热反应,ΔH为 “ ”;—若为吸热反应,ΔH为“ ”。ΔH+的单位一般
高温
C+CO2 2CO
高温
C+H2O(g)
CO+H2
放电
N2+O2
2NO
Ba(OH)2·8H2O+2NH4Cl BaCl2+2NH3↑+10H2O
.
1.反应热与焓变 反应热:在化学反应过程中,当反应物和生成物具 有相同温度时,所放出或吸收的热量
焓变:在恒温恒压的条件下,化学反应过程中所放 出或吸收的热量
符号: △H
单位: kJ·mol-1
.
反应过程中能量变化曲线图:
能
量
生成物
吸收
热量
能 量 反应物
放出
热量
反应物
常见的放热和吸热反应

常见的放热和吸热反应常见的放热反应和吸热反应一、引言化学反应中,放热反应和吸热反应是非常常见的两种类型。
放热反应是指在反应过程中释放出热量,使周围环境温度升高;而吸热反应则是在反应过程中吸收热量,使周围环境温度降低。
本文将就这两种反应进行详细介绍,帮助读者更好地理解和区分这两种反应。
二、放热反应放热反应是指在反应过程中放出热量的化学反应。
这种反应往往是从高能量状态到低能量状态的转变。
在放热反应中,反应物的能量高于产物的能量,因此反应过程中释放出的热量使周围环境温度升高。
常见的放热反应有燃烧反应、酸碱中和反应等。
例如,燃烧反应是一种放热反应,当物质与氧气发生燃烧时,会放出大量的热量。
例如,燃烧木材时,木材中的碳和氢与氧气反应生成二氧化碳和水,反应过程中释放出的热量使我们感受到火焰的温暖。
酸碱中和反应也是一种常见的放热反应。
当酸和碱反应时,产生的盐和水会释放出热量。
例如,氢氧化钠与盐酸反应生成氯化钠和水,反应过程中放出的热量使容器温度升高。
三、吸热反应吸热反应是指在反应过程中吸收热量的化学反应。
这种反应往往是从低能量状态到高能量状态的转变。
在吸热反应中,反应物的能量低于产物的能量,因此反应过程中需要从周围环境吸收热量,导致周围环境温度降低。
常见的吸热反应有溶解反应、融化反应等。
例如,物质溶解在水中时,通常会吸收热量使周围环境变冷。
这是因为溶解反应涉及到分子间的相互作用,需要克服分子间的相互吸引力,从而吸收热量。
例如,将硫酸铵溶解在水中时,会吸收大量的热量,使容器表面感觉凉爽。
融化反应也是一种常见的吸热反应。
当物质从固态转变为液态时,常常需要吸收热量。
例如,将冰块加热至0°C以上时,冰块会融化成水,这个过程中需要吸收大量的热量,使冰块周围的环境变凉。
四、放热反应和吸热反应的应用放热反应和吸热反应在日常生活和工业生产中有着广泛的应用。
放热反应常常被用于加热和燃烧。
例如,我们使用火炉或火柴进行加热时,都是利用放热反应释放的热量来加热物体。
常见的吸热反应和放热反应

常见的吸热反应和放热反应
放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化等。
吸热反应:①大多数分解反应;②盐的水解和弱电解质的电离;③Ba(OH)2.8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应等。
化学反应和物理反应的区别
1、反应的原理不同。
化学反应就是两种或者是两种以上的物质在一起反应以后产生了新的物质,这就叫化学变化,物理变化就是各种物质在一起的时候不产生新的变化。
2、分子种类不同。
化学反应不会改变元素的数目,反应前后的元素数目及种类是一样,不过分子(即原子组合)发生改变而已,而物理变化一般都是物质的状态改变,不改变分子种类的。
3、反应的状态范围大小不同。
化学反应必有物理反应,化学反应实际上就是一些电场作用下的电力学问题而已。
例如,不同的物质的溶解就发生不同的变化。
蔗糖溶解在水里时,它的分子均匀地分散在水分子之间,形成均一状态混合物,属于物理变化。
食盐溶解在水里时,它的晶体受极性的水分子的吸引而分散,Na+和Cl-在水里的分散属于物理变化,而Na+和Cl-跟水分子结合成水合离子的过程,则属于化学变化。
但食盐的基本化学性质没有变,物理变化居主导地位。
四种基本反应类型与放热反应和吸热反应

一、四种基本反应类型与放热反应和吸热反应的关系(一)、化合反应中的放热反应和吸热反应绝大多数的化合反应是放热反应,少数化合反应是吸热反应。
1、化合反应中常见的放热反应:(1)氢化物的生成反应是放热反应的实例①氢气与氟气黑暗处就爆炸放热:H2 +F2 =2HF②氢气在氯气中燃烧放热:H2 + Cl2点燃2HCl③氢气和氯气的混合光照爆炸放热:H2 + Cl2光照2HCl④氢气在氧气或空气中燃烧放热:2H2 +O2点燃 2H2O⑤氮气和氢气合成氨气是体积缩小的放热反应:N2 +3H2高温高压催化剂 2NH3(2)氧化物的生成是放热反应的实例①木炭在空气或氧气中燃烧放热:C+O2点燃 CO2②一氧化碳在空气或氧气中燃烧放热:2CO+O2点燃 2CO2③氨气催化氧化生成一氧化氮和水放热:4NH3 +5O2催化剂加热 4NO+6H2O④硫在空气或氧气中燃烧放热:S+O2点燃 SO2⑤二氧化硫与氧气催化氧化反应放热2SO2 +O2催化剂加热 2SO3(3)含氧酸的生成反应是放热的实例①三氧化硫溶于水生成硫酸是放热反应:SO3 +H2O=H2SO4(4)强碱的生成反应是放热反应的实例①氧化钠与水反应生成氢氧化钠放热:Na2O+H2O=2NaOH②过氧化钠与水反应生成氢氧化钠和氧气放热:2Na2O2+2H2O=4NaOH+O2↑③生石灰氧化钙和水放应生成氢氧化钙放热:CaO+H2O=Ca(OH)2(5)活泼金属的含氧酸盐的生成是放热反应的实例①氧化钠与二氧化碳生成碳酸钠放热:Na2O+CO2=Na2CO3②生石灰氧化钙与二氧化碳生成碳酸钙放热:CaO+CO2=CaCO32、化合反应中常见的少数吸热反应(1)氢化物的生成反应是吸热反应的实例①氢气与碘持续加热生成碘化氢吸热:H2 +I2加热2HI②氢气和硫蒸气加热反应生成硫化氢吸热:2H2 +S 点燃 2H2S(2)氧化物的生成是放热反应的实例①铜在空气中加热生成氧化铜吸热:2Cu+O2点燃 2CuO②二氧化碳与碳加热生成一氧化碳吸热:CO2+C 加热 2CO(二)、分解反应中的放热反应和吸热反应分解反应少数是放热反应,大多数是放热反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见的吸放热反应吸热反应
放热反应:
①活泼金属置换水或酸中氢的反应,如:
2Na+2H2O=2N aOH+H2↑
2Al+6HCl=2AlCl3+3H2↑
②酸碱中和反应。
如:
NaOH+HCl=NaCl+H2O
2KOH+H2SO4=K2SO4+2H2O
③含碳燃料燃烧的反应,如:
2CO+O2=2CO2
CH3CH2OH+3O2=2CO2+3H2O
④易爆物质的爆炸反应。
⑤多数的化合反应,如:
Na2O+H2O=2NaOH
CaO+H2O=Ca(OH)2
⑥一些物质的溶解,如浓硫酸的稀释、氢氧化钠的溶解、氧化钙的溶解等。
吸热反应:
①几个常见的反应,如:
2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
C+H2O(g)=CO+H2
②多数的分解反应,如:
CaCO3=Ca O+CO2↑
CuSO4·5H2O=CuSO4+5H2O
③一些物质的溶解,如硝酸铵溶解等。
常见的放热反应:
1.一切燃烧,以及部分氧化(如氨气氧化)
2.中和、沉淀(不全是)
3.多数化和,如SO3+H2O,NH3+HCl(但H2+I2,合成NH3吸热)
4.特别剧烈的反应,如电石和水
常见的吸热反应:
1.高温下碳还原金属氧化物
2.电离,水解
3.多数化和,如KClO3,KMnO4,CaCO3
4.必须持续加热的反应,如石油裂化
常见的放热反应:
所有的燃烧反应(O2,Cl2中进行)
酸碱中和反应
金属与酸H+(H2O)
铝热反应
合成氨
硫酸工业(接触室)2SO2+O2=(可逆)2SO3硝酸工业制NO 4NH3+502=4NO+6H2O
常见的吸热
溶解吸热NH4NO3
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3+10H2O
大多数的分解反应
C+H2O=CO+HC(制水煤气法)
C+CO2=2CO(制煤气)
N2+O2=2NO
1、高温下碳或H2还原金属氧化物,如:
C + 2CuO=高温=2Cu+ CO2↑
2Fe2O3+3C=高温=4Fe+ 3CO2↑
Fe3O4+2C=高温=3Fe + 2CO2↑
CuO + H2 =△=Cu + H2O
Fe2O3+3H2=△=2Fe+3H2O
Fe3O4+4H2=△=3Fe+4H2O
WO3+3H2=△=W +3H2O
MoO3+3H2=△=Mo +3H2O
2、电离反应
3、盐类的水解
4、CO2+C=高温=2CO C+H2O(气)=高温=CO+H2
5、CuO +CO=△=Cu + CO2↑
6、氢氧化钡晶体与氯化铵晶体的反应
(此文档部分内容来源于网络,如有侵权请告知删除,文档可自行编辑修改内容,供参考,感谢您的配合和支持)。
