氨基酸、蛋白质的测定方法
食品分析课件6.蛋白质及氨基酸的测定

对连续测定结果进行趋势分析,了解变化趋势。
数据可靠性评估
1 2
重复性检验
通过多次重复测定,评估测定方法的重复性。
准确性检验
通过与其他已知准确度高的方法进行比较,评估 测定方法的准确性。
3
检出限和精密度
根据方法检出限和精密度,评估数据可靠性。
06
实际应用与案例分析
食品营养标签的制定
蛋白质含量
在食品生产过程中,蛋白质含量的均匀度是评价产品质量的重要指标之一。通过 测定不同批次或不同部位食品中的蛋白质含量,可以了解产品的均匀度,从而控 制产品质量。
氨基酸比例
氨基酸比例是评价食品质量的重要参考指标。不同食品中的氨基酸比例有所不同 ,通过测定食品中的氨基酸比例,可以了解产品的质量,为质量控制提供依据。
05
数据分析与解读
数据处理方法
平均值计算
对多次测定结果取平均值,以减少误差。
异常值剔除
根据统计学原理,将偏离平均值过大的数据剔除。
数据标准化
将不同来源的数据进行标准化处理,以便于比较。
结果解读与比较
正常范围判断
将测定结果与标准值或参考值进行比较,判断是否在正常范围内。
差异分析
对不同样品或不同处理条件下的结果进行差异分析,找出显著性差 异。
操作规范
严格遵守操作规程,避免操作 不当导致实验失败或安全事故
。
数据记录
及时记录实验数据,避免丢失 数据或误差。
安全须知
穿戴防护服
实验过程中需穿戴实验 服和化学防护眼镜等个
人防护用品。
保持通风
保持实验室通风良好, 避免有害气体积累。
废弃物处理
急救措施
按照实验室规定正确处 理废弃物,防止环境污
第3章 蛋白质和主要必需氨基酸的测定

(三)同类种子中蛋白质的测定(双缩脲法) 2 操作步骤
(2)标准回归方程的测定。分别称取0.050 0~0.120 0g待测定谷物样品20--30个(也 可用蛋白质含量差异大的样品30个左 右),先用开氏法测出具蛋白质的含量, 然后按上法显色并测定吸收值A,作出标 准回归方程。
(三)同类种子中蛋白质的测定(双缩脲法) 3 备注
(三)同类种子中蛋白质的测定(双缩脲法) 2. 方法特点及应用范围
本法须用开氏法作标准回归方程。本法灵 敏度较低但经试验其与开氏法的相关性较 好,操作简单快速,适用样品广泛,在生物 化学领域中测定蛋白质含量时常用此法。本 法亦适用于豆类、油料、米谷等作物种子及 肉类等样品测定,尤适用于大批品种选择用。
(一)籽粒中粗蛋白质的测定
H2SO4一K2SO4一CuSO4一Se消煮法 2 操作步骤 (2)氮的测定。用移液管吸取澄清待测液5.00或 10.00mL放入半微量定氮仪中进行定氮。同时作空 白试验。
(一)籽粒中粗蛋白质的测定
H2SO4一K2SO4一CuSO4一Se消煮法 3 说明
(1)本法测定的结果为粗蛋白质的含量。如要测 定纯蛋白质的含量,则样品应先用蛋白质沉淀剂 碱性硫酸铜、碱性醋酸铅、200g·L-1 - 250g·L-1单 宁或100g·L-1三氯乙酸等处理,将蛋白质从水溶 液中沉淀出来,再测定此沉淀的全氮量,乘以蛋 白质的换算系数即可得:“纯蛋白质”量。
该法为美国谷物化学协会(AACC)测定谷物蛋白质的正式 方法,且已有据此法原理为基础的快速测定蛋白质的自动 分析仪。 一般的生化分析中采用的双缩脲试剂是碱性硫酸铜水溶 液,不适用于种子蛋白质的分析,因为它不稳定,而且会 浸出有色物质、脂肪及一些淀粉物质,干扰比色测定。而 异丙醇双缩脲试剂,可以减少这些物质的溶解,排除干扰。 本法对温度及时间的要求严格,否则再现性不高。采用室 温20-25℃,须于120~190min内比色;40℃为15-70min显 色稳定;而在60℃连续振荡条件下显色,则反应时间缩短 为5min。 离心须用6 000r·min-1,10min可得澄清液,小于4000r·min-1 的效果不佳。
蛋白质与氨基酸测定

人体可以自行合成,不必从食物中摄取的氨基酸,如丙氨酸、精氨酸、天冬氨 酸、谷氨酸等。
氨基酸的功能
合成蛋白质
合成其他生物活性物质
氨基酸是构成蛋白质的基本单位,通 过脱水缩合形成肽链,进而形成蛋白 质。
氨基酸可以作为合成其他生物活性物 质的原料,如嘌呤、嘧啶等。
代谢调节
氨基酸参与多种代谢反应,如糖代谢、 脂肪代谢和氮代谢等,对维持人体正 常生理功能具有重要作用。
生物能源研究
蛋白质和氨基酸在生物能源领域也有应用,如通过测定蛋 白质的分解产物来评估生物燃料的生产效率和可持续性。
THANKS FOR WATCHING
感谢您的观看
蛋白质含量。
分光光度法
利用特定波长下的吸光度来测 定蛋白质含量,如双缩脲法、 酚试剂法等。
色谱法
利用色谱技术分离蛋白质,通 过测定各组分的含量来计算蛋 白质含量。
质谱法
通过测定蛋白质的质荷比来鉴 定蛋白质,常用于蛋白质组学
研究。
02
氨基酸测定
氨基酸的种类
必需氨基酸
人体无法自行合成,必须从食物中摄取的氨基酸,包括亮氨酸、异亮氨酸、缬 氨酸、赖氨酸、蛋氨酸、苯丙氨酸、苏氨酸、色氨酸和组氨酸。
蛋白质在生物体内可以水解成氨基酸, 氨基酸通过合成反应形成蛋白质。
蛋白质与氨基酸在生物体内的代谢过程
蛋白质的合成与分解
在生物体内,蛋白质的合成和分解是 一个动态平衡的过程。合成主要发生 在细胞内的核糖体上,而分解则通过 蛋白酶的催化作用进行。
氨基酸的代谢
氨基酸在生物体内经过一系列的代谢 反应,可以转化为其他有机物质,如 葡萄糖、脂肪等。同时,氨基酸也可 以作为合成核苷酸、激素等物质的原 料。
食品中蛋白质和氨基酸的测定(精)

2.合成色素的提取
聚酰胺吸附色素
3.定性分析 14. 定量分析 5 .薄层层析法、高效液相色谱法测定的基本要 求
三、甜味剂的测定
糖精钠的测定:糖精是应用较为广泛的人工甜味 剂 其学名为邻—磺酰苯甲酰亚胺其结构式为:
1.HPLC法 2.酚磺酞比色法 [原理] 样品中的糖精钠在酸性条件下用乙醚提 取分离后,与酚和硫酸在175 ℃作用,生成酚 磺酞,再与氢氧化钠反应产生红色溶液,与标 准系列比较定量。 [说明] ①本法受温度影响较大,要使糖精充分与 酚在硫酸作用下生成酚磺酞,应严格控制在 175士2℃温度下反应 2小时。②苯甲酸等有机 物对测定有干扰,故要通过碱性氧化铝层析柱 以排除干扰。 3. 紫外分光光度法
二、蛋白质和氨基酸的分类
三、蛋白质的一般性质
1. 物理性质
2 .化学性质
第二节 蛋白质的测定
蛋白质的测定方法分两大类:一类是利用蛋白质 的共性即含氮量、肽键和折射率等测定蛋白质 含量;另一类是利用蛋白质中的氨基酸残基、 酸性和碱性基因以及芳香基团等测定蛋白质含 量 。 具体测定方法:凯氏定氮法是最常用的,国内 外应用普遍;双缩脲反应、染料结合反应、酚 试剂法; 国外:红外分析仪
④ 样品中若含脂肪较多时,消化过程中易产生大 量泡沫,为防止泡沫溢出瓶外,在开始消化时 应用小火加热,并时时摇动;或者加入少量辛 醇或液体石蜡或硅油消泡剂,并同时注意控制 热源强度。 ⑤ 当样品消化液不易澄清透明时,可将凯氏烧 瓶冷却,加入30%过氧化氢 2—3 m1 后再继 续加热消化。 ⑥ 若取样量较大,如干试样超过5 g 可按每克 试样5 m1的比例增加硫酸用量。
[步骤] 整个过程分三步:消化、蒸馏、吸收与 滴 定 1.消化 总反应式: 2NH2(CH2)2COOH+13H2SO4= (NH42SO4+6CO2+12SO2+16H2O
蛋白质和氨基酸测定方法

第十章 蛋白质和氨基酸的测定第一节 概述蛋白质是生命的物质基础,是构成生物体细胞组织的重要成分,是生物体发育及修补组织的原料。
一切有生命的活体都含有不同类型的蛋白质。
人体内的酸、碱及水分平衡,遗传信息的传递,物质代谢及转运都与蛋白质有关。
人及动物只能从食物中得到蛋白质及其分解产物,来构成自身的蛋白质,故蛋白质是人体重要的营养物质,也是食品中重要的营养成分。
蛋白质在食品中含量的变化范围很宽。
动物来源和豆类食品是优良的蛋白质资源。
部分种类食品的蛋白质含量见表10-1表10-1 部分食品的蛋白质含量蛋白质是复杂的含氮有机化合物,摩尔质量大,大部分高达数万~数百万,分子的长轴则长达1nm ~100nm ,它们由20种氨基酸通过酰胺键以一定的方式结合起来,并具有一定的空间结构,所含的主要化学元素为C 、H 、O 、N ,在某些蛋白质中还含有微量的P 、Cu 、Fe 、I 等元素,但含氮则是蛋白质区别于其它有机化合物的主要标志。
不同的蛋白质其氨基酸构成比例及方式不同,故各种不同的蛋白质其含氮量也不同。
一般蛋白质含氮量为16%,即1份氮相当于6.25份蛋白质,此数值(6.25)称为蛋白质系食 品 种 类 蛋白质的质量分数(以湿基计)/% 食 品 种 类 蛋白质的质量分数(以湿基计)/%谷类和面食大米(糙米、长粒、生) 7.9大米(白米、长粒、生、强化) 7.1小麦粉(整粒) 13.7玉米粉(整粒、黄色) 6.9意大利面条(干、强化) 12.8玉米淀粉 0.3乳制品牛乳(全脂、液体) 3.3牛乳(脱脂、干) 36.2切达干酪 24.9酸奶(普通的、低脂) 5.3水果和蔬菜苹果(生、带皮) 0.2芦笋(生) 2.3草莓(生) 0.6莴苣(冰、生) 1.0土豆(整粒、肉和皮) 2.1 豆类 大豆(成熟的种子、生) 36.5 豆(腰子状、所有品种、 23.6 成熟的种子、生) 豆腐(生、坚硬) 15.6 豆腐(生、普通) 8.1 肉、家禽、鱼 牛肉(颈肉、烤前腿) 18.5 牛肉(腌制、干牛肉) 29.1 鸡(可供煎炸的鸡胸肉、 23.1 生) 火腿(切片、普通的) 17.6 鸡蛋(生、全蛋) 12.5 鱼(太平洋鳕鱼、生) 17.9 鱼(金枪鱼、白色、罐 26.5 装、油浸、滴干的固体)数。
检测蛋白质中氨基酸的含量的各种方法及优劣讨论

蛋白质中氨基酸的含量测定组成蛋白质的基本单位是氨基酸,氨基酸通过脱水缩合形成肽链。
蛋白质是由一条或多条多肽链组成的生物大分子,其含量测定是生化药品研究中最常用、最基本的分析方法之一。
目前其常用的测定方法有凯氏定氮法、福林酚法、双缩脲法、BcA法、考马斯亮蓝法、紫外分光光度法及荧光法。
1凯氏定氮法1.1方法本法系依据蛋白质为含氮的有机化合物,当与硫酸和硫酸铜、硫酸钾一同加热消化时使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。
然后碱化蒸馏使氨游离,用硼酸液吸收后以硫酸滴定液滴定,根据酸的消耗量乘以氮转化为蛋白质的换算系数,即为蛋白质的含量。
本法各国药典收载的方法一致。
故参照《中国药典》2005年版三部[41附录方法,按纯蛋白类供试品及添加无机含氮物质及有机非蛋白质含氮物质的供试品分别拟定各测定方法。
1.2讨论1.2.1凯氏定氮法虽耗时较长,但它是蛋白质测定方法中最经典的测定方法,本法所测的结果为蛋白质绝对浓度而非相对浓度,可用于标准蛋白质含量的准确测定。
1.2.2本法灵敏度较低,适用于O.2~2.o mg氮的测定,干扰少。
1.2.3蛋白质是复杂的含氮有机化合物,一般蛋白质的含氮量为16%,故含氮量转化为蛋白质的系数为6.25。
但由于不同蛋白质的结构差异,其换算系数会稍有区别,如乳制品为6.38,动物胶为5。
65等,因此一些特殊蛋白质应在各论中相应说吩其转化系数。
1.2.4在本法附注中起草了非蛋白氮供试品溶液制备的两种常用方法用于非氮的测定,一般采用钨酸沉淀法,但当供试品中含有氨基酸(精氨酸)时,由于其会影响蛋白质的沉淀,故建议采用三氯醋酸沉淀法方法(1)与方法(3)的线性相关系数均能达到0.999以上,较理想;方法(1)试剂配制繁琐且整个实验费时长,而方法(3)操作更简便快速。
第九章 蛋白质和氨基酸的测定

4.结果计算
式中
w——氨基酸态氮的质量分数;
C——氢氧化钠标准溶液的浓度,mol/L;
V1——用中性红作指示剂滴定消耗氢氧化钠标 准溶液的体积,ml;
V2——用百里酚酞作指示剂滴定消耗氢氧化钠 标准溶液的体积,ml; 0.014——氮的毫摩尔质量,g/mmol
m—— 测定用样品溶液相当于样品的质量,g。
思考题:
1.为什么说用凯氏定氮法测定出食品中的蛋白质含量 为粗蛋白含量?
2.在消化过程中加入的硫酸铜试剂有哪些作用?
3.样品消化过程中内容物的颜色发生什么变化?为什 么?
4.样品经消化进行蒸馏之前为什么要加入氢氧化钠? 这时溶液的颜色会发生什么变化?为什么?如果没有变 化,说明了什么问题?须采取什么措施? 5.蛋白质蒸馏装置的水蒸气发生器中的水为何要用硫 酸调成酸性? 6.蛋白质测定的结果计算为什么要乘上蛋白质系数?
(5) 混合指示剂
甲基红—溴甲酚绿混合指示剂: 5份2g/L溴甲酚绿95%乙醇溶液与1份2g/L甲基红乙 醇溶液混合均匀。终点为灰红色。 或甲基红—亚甲蓝混合指示剂:
一体积的亚甲蓝(0.05%酒精溶液)和二体积的甲 基红指示剂(0.05%酒精溶液)的混合物。终点为紫色。
(6) 饱和硼酸溶液(40g/L): 称取20g硼酸溶解于500mL热水中,摇匀备用。 (7) 0.1N盐酸标准溶液
第九章 蛋白质和氨基酸的测定
第一节 概述 第二节 蛋白质的测定方法 第三节 氨基酸态氮的测定
第一节 概述
一、pro组成与蛋白质系数 1.组成 pro是由两性氨基酸通过肽键结合在一起的大 分子化合物。
元素组成百分比:
元素 C H O N S P
百分比 50 7 23
16
食品理化检验分析 第九章 蛋白质和氨基酸的测定

二、 自动凯氏定氮法 1、原理及适用范围同前 2、特点:
(1)消化装置用优质玻璃制成的凯氏消化瓶,红 外线加热的消化炉。 (2)快速:一次可同时消化8个样品,30分钟可消 化完毕。 (3)自动:自动加碱蒸馏,自动吸收和滴定,自 动数字显示装置。可计算总氮百分含量并记录,12 分钟完成1个样。
5.计算: 氨基酸态氮=〔 c×(V2-V1)×0.014×100 ) 〕/W×100 V1——用中性红为指示剂时,碱液所消耗 的体积 V2——用百里酚酞乙醇液为指示剂时标液 消耗量
0.014——氮的毫摩尔质量,g/mmol。
(二)茚三酮的比色法
原理:氨基酸在一定条件下与茚三酮起反应,生 成蓝紫色化合物,可比色定量。(570nm)
一.双缩脲法 1.原理 脲(尿素)NH2—CO—NH2 加热至150~160℃时 ,两分子缩和成双缩脲。 NH2—CO—NH2 + NH2—CO—NH2 NH2—CO—NH—CO—NH2 + NH3 双缩脲能和硫酸铜的碱性溶液生成紫红色络和 物,此反应叫双缩脲反应。(缩二脲反应) 蛋白质分子中含有肽键( —CO—NH—),与双缩 脲结构相似。在同样条件下也有呈色反应,在一定 条件下,其颜色深浅与蛋白质含量成正比,可用分 光光度计来测其吸光度,确定含量。(560nm)
3.双指示剂:
① 40%中性甲醛溶液:以百里酚酞作指示剂,用 氢氧化钠将40%甲醛中和至淡蓝色。
② 0.1%百里酚酞乙醇溶液,(9.4~10.6)
③ 0.1%中性红 50%乙醇溶液,(6.8~8.0) ④ 0.1 mol/L 氢氧化钠标准溶液。
4.操作:
取相同两份样品20~30mg→分别于250ml三角瓶→各 加50ml蒸馏水 一份加中性红3滴→用0.1mol/L NaOH 滴定终点(由红变琥珀色),记录用量,另一份加百里酚 酞乙醇液3滴加中性甲醛20ml→摇匀→用0.1mol/L NaOH 滴至淡兰色。分别记录两次所消耗的碱液ml数。
食品分析与检验蛋白质与氨基酸的测定

食品分析与检验蛋白质与氨基酸的测定蛋白质与氨基酸的测定在食品分析与检验领域中具有重要意义。
蛋白质是食品中重要的营养组分,而氨基酸是构成蛋白质的基本单元,对于评价食品的品质和安全性具有重要意义。
本文将介绍蛋白质与氨基酸的测定方法及其在食品分析与检验中的应用。
蛋白质的测定方法主要有几种:生物测定法、光谱法和色谱法。
其中,生物测定法主要是通过测定食品中的氮元素含量来间接测定蛋白质含量。
常用的方法有凯氏氮法、造浆法和改良Kjeldahl法等。
光谱法主要是通过根据蛋白质的特征光吸收谱测定其含量。
常用的方法有紫外-可见光谱法、荧光光谱法和红外光谱法等。
色谱法是通过分离和检测蛋白质的各种成分来测定其含量。
常用的方法有凝胶过滤层析法、液相色谱法和气相色谱法等。
氨基酸是构成蛋白质的基本单元,对于评价蛋白质的营养价值和品质具有重要作用。
氨基酸的测定方法主要有色谱法和生物传感器方法。
其中,色谱法是目前最主要的氨基酸定量方法,其主要包括高效液相色谱法和气相色谱法。
高效液相色谱法常用于氨基酸的定性和定量分析,具有灵敏度高、选择性好和分析速度快的特点;气相色谱法通常用于氨基酸的定性分析,具有高分离能力和分析速度快的优势。
生物传感器方法是一种新兴的氨基酸测定方法,通过利用生物传感器对氨基酸的选择性响应来测定其含量。
生物传感器方法具有灵敏度高、反应快和操作简便等特点。
在食品分析与检验中,蛋白质与氨基酸的测定具有广泛的应用。
首先,蛋白质含量是评价食品营养价值的重要指标之一、通过测定食品中蛋白质的含量,可以评估其蛋白质营养价值和食品质量。
其次,氨基酸是判定食品蛋白质种类和品质的重要指标。
通过测定食品中各种氨基酸的含量,可以评价蛋白质的品质和营养价值。
此外,蛋白质与氨基酸的测定还可以用于食品的伪标问题的检验,如检验食品中是否含有非法添加的蛋白质或氨基酸衍生物。
综上所述,蛋白质与氨基酸的测定在食品分析与检验中具有重要意义。
通过选择合适的测定方法,可以准确、快速地测定食品中的蛋白质含量和氨基酸组成,从而评价食品的品质、安全性和营养价值。
蛋白质氨基酸测定

三聚氰胺(melamine)
是一种有机含氮杂环化合物,学名1,3,5-三嗪-2,4,6-三胺, 或称为2,4,6-三氨基-1,3,5-三嗪,简称三胺、蜜胺、氰尿 酰胺,是一种重要的化工原料,主要用途是与醛缩合,生 成三聚氰胺-甲醛树脂,生产塑料,这种塑料不易着火,耐 水、耐热、耐老化、耐电弧、耐化学腐蚀,有良好的绝缘 性能和机械强度,是木材、涂料、造纸、纺织、皮革、电 器等不可缺少的原料。它还可以用来做胶水和阻燃剂,部 分亚洲国家,也被用来制造化肥。
①样品消化 : 准确称取一定量的样品至干燥洁净的 500mL凯氏烧瓶中,加入硫酸铜0.5g(1g)、硫酸钾10g (3g)和浓硫酸20mL、玻璃珠数粒→轻轻摇匀,以45º斜 支于石棉网上→用电炉以小火加热(或先烧瓶放在距电 炉较远处),待内容物全部炭化、泡沫停止产生后→加 大火力(或将烧瓶放在电炉上),保持瓶内液体微沸→至 液体变蓝绿色透明后→继续加热微沸30min→关闭电炉, 取下烧瓶、冷却→转移至100mL容量瓶中,加水定容。
❖ 加入硫酸铜的作用 催化作用:加速有机物的氧化分解 C+ 2CuSO4 → Cu2SO4 + SO2↑+ CO2↑ Cu2SO4 + 2H2SO4 → 2CuSO4 + 2H2O + SO2↑ 此反应不断进行,待有机物被消化完后,不再有硫 酸亚铜(褐色)生成,溶液呈现清澈的蓝绿色。
消化完全指示:蓝绿色;
三聚氰胺的最大的特点是含氮量很高(66 %),加之其生产工艺简单、成本很低, 给了掺假、造假者极大地利益驱动,有人 估算在植物蛋白粉和饲料中使蛋白质增加 一个百分点,用三聚氰胺的花费只有真实 蛋白原料的1/5。所以“增加”产品的表观 蛋白质含量是添加三聚氰胺的主要原因, 三聚氰胺作为一种白色结晶粉末,没有什 么气味和味道,掺杂后不易被发现等也成 了掺假、造假者心存侥幸的辅助原因。
食品中氨基酸及蛋白质的测定(实验报告)
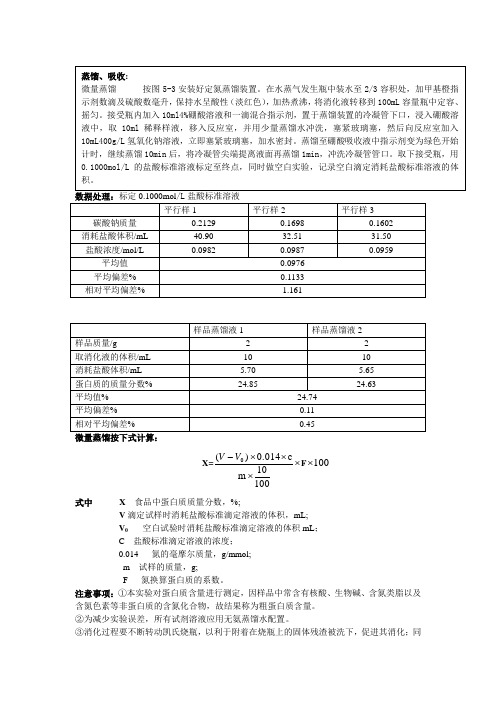
测定食品中的蛋白质---2013.3.25组员:***实验目的:(1)会测定食品中粗蛋白的含量。
(2)明确常见的食品蛋白质含量,以及测定原理。
实验原理:将被检样品加入浓硫酸,以硫酸铜,硫酸钾为催化剂共同加热消化食品中蛋白质分解为氨,并与硫酸结合成硫酸铵,通过碱化蒸馏,使氨分离出来,用硼酸吸收形成硼酸按后,再用盐酸标准溶液滴定,根据消耗的标准盐酸的体积,通过换算系数,可测定食品中蛋白质的含量。
实验仪器:凯氏烧瓶、可调式电炉、定氮蒸馏装置试剂:①硫酸铜CuSO4.5H2O ②硫酸钾③硫酸(密度为1.8149g/L)④40g/L 硼酸溶液⑤混合试剂;1g/L甲基红乙醇溶液与1g/L亚甲基蓝乙醇溶液,用时按2:1的比例混合。
实验步骤:数据处理:标定0.1000mol /L 盐酸标准溶液微量蒸馏按下式计算:X=⨯⨯⨯⨯-10010m c0.014)(0V V F 100⨯式中 X 食品中蛋白质质量分数,%;V 滴定试样时消耗盐酸标准滴定溶液的体积,mL;V 0 空白试验时消耗盐酸标准滴定溶液的体积mL ;C 盐酸标准滴定溶液的浓度; 0.014 氮的毫摩尔质量,g/mmol; m 试样的质量,g;F 氮换算蛋白质的系数。
注意事项:①本实验对蛋白质含量进行测定,因样品中常含有核酸、生物碱、含氮类脂以及含氮色素等非蛋白质的含氮化合物,故结果称为粗蛋白质含量。
②为减少实验误差,所有试剂溶液应用无氨蒸馏水配置。
③消化过程要不断转动凯氏烧瓶,以利于附着在烧瓶上的固体残渣被洗下,促进其消化;同时为防止造成氮损失,不要用强火,应保持缓和沸腾。
④样品中含脂肪或糖较多,消化过程中易产生大量泡沫,为防止泡沫外溢,在消化开始时用小火加热,并时时摇动,并可以加入少量辛醇、液体石蜡或硅油消泡剂,并控制热源强度。
⑤一般消化至呈透明后,继续消化30min即可,但对于含有特别难以氨化的氮化合物的样品,如含赖氨酸、组氨酸、色氨酸、酪氨酸或脯氨酸等时,呈较深绿色。
蛋白质和氨基酸的测定

缬氨酸
丝氨酸
Pro的基本组成单位是氨基酸 几种常见的氨基酸
那什么是 氨基酸呢?
几种常见的氨基酸
这些氨基酸 结构上有什 么共同点?
羧基和氨基 连接在同一 个碳原子上
蛋白质的基石物质:α-氨基酸
氨基酸的缩合
二肽、多肽等
肽键
三、什蛋问么:白样蛋质的白性质的质具性呢有?质
1. 盐析 2. 变性
1. 误食重金属盐,可 以喝大量牛奶进 行紧急处理 ,WHY?
a) 凯氏烧瓶500 mL或250 mL b) 龙科A—凯氏定氮仪 c) 扭力天平 d) 分析天平 e) 5mL移液管 f) 温度可以控制的电炉 g) 小漏斗 h) 滴定管 i) 250 mL锥形瓶 j) 玻璃珠
②仪器
③ 试剂
〔GB/T 5009.5-2003《食品中蛋白质的测定》第一法〕
a) 硫酸铜 <CuSO4·5H2O> b) 硫酸钾 c) 硫酸 <密度为1.8419g/L> d) 硼酸溶液 <20g/L> e) 氢氧化钠溶液 <400g/L> f) 盐酸标准滴定溶液[c<HCl>=0.0500 mol/L] 或硫酸标准滴定溶 液[c<1/2H2SO4>=0.0500 mol/L] g) 混合指示液:1份甲基红乙醇溶液 <1g/L> 与5份溴甲酚绿乙醇 溶液<1g/L> ,临用时混合.<也可用2份甲基红乙醇溶液<1g/L>与1 份次甲基蓝乙醇溶液<1g/L>临用时混合>.
36.2
切达干酪
24.9
酸奶(普通的、低脂) 5.3
水果和蔬菜
苹果(生、带皮)
0.2
蛋白质氨基酸测序

蛋白质氨基酸测序一、什么是蛋白质氨基酸测序?蛋白质是由氨基酸组成的长链状分子,而氨基酸序列则决定了蛋白质的结构和功能。
因此,确定蛋白质的氨基酸序列对于研究蛋白质的结构和功能具有重要意义。
蛋白质氨基酸测序就是通过一系列化学和生物学方法来确定蛋白质中每个氨基酸的种类和排列顺序。
二、蛋白质氨基酸测序的方法1.肽段法肽段法是最早被发明并广泛应用的一种测序方法。
它将整个蛋白质分解成一系列较小的肽段,然后对每个肽段进行测序。
这种方法适用于小分子量(<50kDa)且不含二硫键的蛋白质。
2.直接测定法直接测定法通过将整个蛋白质直接降解为单个氨基酸,然后逐个测定每个氨基酸的种类和数量来确定其氨基酸序列。
这种方法需要使用高分辨率的仪器,如质谱仪。
3.克隆法克隆法是通过将蛋白质编码基因克隆到表达载体中,然后在细胞中大量表达蛋白质,并从中纯化出目标蛋白质进行测序。
这种方法适用于大分子量的蛋白质和含有多个亚基的复合物。
三、蛋白质氨基酸测序的应用1.研究蛋白质结构和功能确定蛋白质的氨基酸序列可以帮助研究者了解其结构和功能。
例如,确定酶的氨基酸序列可以揭示其催化机制;确定抗体的氨基酸序列可以帮助开发新的药物;确定毒素的氨基酸序列可以帮助研究其毒性机制。
2.诊断遗传性疾病一些遗传性疾病是由于某些特定基因中存在突变导致的。
通过测定患者血液或组织样本中特定蛋白质的氨基酸序列,可以确定是否存在该突变,并帮助诊断疾病。
3.开发新药物确定蛋白质的氨基酸序列可以帮助开发新的药物。
例如,确定受体的氨基酸序列可以帮助开发特异性较高的药物;确定酶的氨基酸序列可以帮助开发抑制剂。
四、蛋白质氨基酸测序存在的问题和挑战1.技术复杂性蛋白质氨基酸测序需要使用多种化学和生物学方法,且每个方法都有其特定条件和限制。
因此,该技术需要具有相应的专业知识和技能。
2.样本来源限制蛋白质氨基酸测序需要使用纯度较高的蛋白质样本。
对于某些复合物或大分子量蛋白质,其纯度难以达到要求,因此需要采用更加复杂的样品处理方法。
蛋白质与氨基酸的测定

蛋白质与氨基酸的测定
蛋白质测定可以采用以下方法:
1. 比色法:常用的比色剂有布鲁姆甘蓝G、伯胺蓝、硫酸铜-法明斯试剂等。
比色法的原理是蛋白质与比色剂形成复合物,复合物的颜色与蛋白质的含量成正比。
2. 生物学方法:通过测定蛋白质在生物体中所起的生物学作用,如酶活性、免疫反应等来定量测定蛋白质的含量。
3. 尿素-二元酸法:通过加入细胞膜清洗液中的尿素和二元酸,并利用这两种化合物对蛋白质的溶解性,然后根据其溶解度定量测定蛋白质的含量。
氨基酸的测定可以采用以下方法:
1. 比色法:在酸性条件下,氨基酸与2,4-二硝基苯肼、2,4-二硝基苯胺等发生磺酰化反应,形成淡棕色的产物,比色法根据产物的吸光度来定量测定氨基酸的含量。
2. 二级结构破坏法:通过加热和高浓度酸的处理,使蛋白质的二级结构破坏,进而测定其中的氨基酸含量。
3. 比重法:在油水分离流程中,用比重法分离出有机相,然后加入酸性溶液,
氨基酸与酸反应,形成有颜色的产物,根据产物的吸光度来定量测定氨基酸的含量。
蛋白质和氨基酸的测定

2. 蛋白质快速测定法有哪些? ⑿H3BO3吸收液的温度不应超过40℃,否则对NH3的吸收作用减弱而造成损失。
⑿H3BO3吸收液的温度不应超过40℃,否则对NH3的吸收作用减弱而造成损失。
〔Nessler试剂,K2(HgI4)〕 检验NH4+离子,析出黄色或红 棕色沉淀。
同时用4%硼酸吸收
3. 滴定
用HCl滴定 用混合指示剂(甲基红+溴甲酚绿或亚甲基兰+甲基红)
终点:蓝色→微红色
计算:
蛋 白 质 ( % ) C ( V V 0 ) 0 .0 1 4 0 1 F 1 0 0 m
① 用H3BO3吸收后再以标准HCl滴定或H2SO4溶液滴定 。根据标准酸消耗量可以计算出蛋白质的含量。
② 也可以用过量的标准H2SO4或标准HCl溶液吸收后再 以标准NaOH滴定过量的酸。
为什么?
凯氏定氮法原理(方程式)
催化剂
1、消化:NCOC + 浓H2SO4 煮沸 (NH4)2SO4 + CO2 + SO2 + H2O
测定意义: ✓评价食品的营养价值。
✓为合理开发利用食物资源,提高产品质量, 优化食品配方及生产过程控制提供依据。
蛋白质的测定方法: 分两大类 一类是利用蛋白质的共性即含氮量、肽键和折射率
等测定蛋白质含量;
另一类是利用蛋白质中的氨基酸残基(酸性和碱性
基团、芳香基团等)测定蛋白质含量。
其中: 凯氏定氮法——最常用的,国内外应用普遍。 双缩脲反应、染料结合反应、酚试剂法等——多用于生 产单位质量控制分析。 国外:红外分析仪 在一般的常规检验中多进行氨基酸总量的测定,通常采 用酸碱滴定法来完成。 各种氨基酸的分离与定量——色谱技术。 有多种氨基酸分析仪。
蛋白质与氨基酸测定概述

蛋白质与氨基酸测定概述pro是食品的重要组成之一,也是重要的营养物质,一个食品的营养高低,主要看蛋白质的高低。
pro除了保证食品的营养价值外,在决定食品的色、香、味及结构等特征上也起着重要的作用。
一、pro组成与分类1组成Compositionpro是复杂的含氮有机化合物,它的溶液是典型的胶体分散体系,由两性氨基酸通过肽键结合在一起的大分子化合物,它主要含的元素是C、H、O、N、S、P另外还有一些微量元素Fe、Zn、I、Cu、Mn。
对于不同的pro,它的组成和结构不同,但从分析数据可以得到近似的pro的元素组成百分比。
元素组成百分比:元素 C H O N S P百分比50 7 23 16 0-3 0-3一般来说,pro的平均含氮量为100/160,所以在用凯氏定氮法定量pro时,将测得的总氮%乘上pro的换称参数K=6.25即为该物质的pro含量。
但是我们必须要知道,当测定的样品其含氮的系数与上面100/16相差较大时,采用6.25将会引起显著的偏差。
2氨基酸的组成上面我们已讲了pro是由氨基酸组成的高分子化合物,目前各种氨基酸已达175种以上,但是构成pro的氨基酸主要是其中的20种,氨基酸是由脂肪酸碳链上的氢原子(NH2)所置换而得到的。
三pro变性pro受热或其它处理时,它的物理和化学性质会发生变化,这个过程称为变性作用,pro发生变性作用后,pro的许多性质发生了变化,溶解度降低,发生凝结,形成不可逆凝胶,-SH暴露在外面,引起pro变性的因素主要是热、酸和碱,化学试剂、重金属盐等。
例如:最常见的pro变性现象,蛋清在加热时凝固,瘦肉在烹调时收缩变硬等都是由pro的热变性作用引起的,另外pro变性后-SH暴露在分子表面上,又例如,煮热的牛奶和鸡蛋具有特殊的气味即与此有关。
在我们日常生活中,白衬衣穿脏后,在洗涤时,不能用热水洗涤,因为人体排出的汗水里含有pro,如果用烫水洗涤,pro受热后变性,衣服就由白变黄了,所以应该先用冷水浸泡,再用热水洗涤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氨基酸、蛋白质的测定方法一、粗蛋白的测定玉米6.25凯氏定氮分为凯氏(kjeldahl)定氮法大麦5.83常量法5-20%蛋白质的平均含氮量16% 小麦5.70微量法大米5.95总氮与蛋白质之间的平均换算系数:100,16=6.25高梁5.830.05mg(一)原理大豆5.711.消化CuSOCuSO44(C(CHHOO))+H+HSOSO((浓浓) 6xC+5xH)6xC+5xHOO66101055xx224422 C+2HC+2HSOSO2H2HO+COO+CO+2SO+2SO224 4 222 2 22SOSOHH 2244蛋白质蛋白质RCH(NH2)COOHRCH(NH2)COOHNHNH-CH-CH-COOH+3H-COOH+3HSOSO2CO2CO+3SO+3SO+NH+NH+4H+4HOO2222224 4 2 2 2 2 3322HHSOSO((过量)过量)+2NH+2NH(NH(NH))SOSO22443 3 442244常用催化剂:硫酸铜硫酸钾的作用:提高沸点 KKSOSO+H+HSOSO2KHSO2KHSO22442244442KHSO2KHSOKKSOSO+H+H0+SO0+SO纯硫酸的沸点:330 ?,添加硫酸钾后沸点400 4 4 22442233硫酸铜的作用: C+2CuSOC+2CuSOCuCuSOSO+SO+SO+CO+CO4422442222加速碳的氧化还是一个指示剂。
CuCuSOSO+2H+2HSOSO2CuSO2CuSO+SO+SO+2H+2HOO22442244442 2 22 (NH(NH))SOSO+2NaOH Na+2NaOH NaSOSO+2H+2HO+2NHO+2NH2.蒸馏可采用水蒸气蒸馏44224422442233 3.吸收和滴定,1,用硼酸吸收指示剂:溴甲酚绿-甲基红2NH2NH+4H+4HBOBO(NH(NH))BBOO+5H+5HOO3333334422447722变色点pH5.1(NH(NH))BBOO+HCl+5H+HCl+5HO 2NHO 2NHCl+4HCl+4HBOBO4422447722443333(2)HSO吸收法24二、啤酒中蛋白质的区分 2NH+HSO(NH)SO3244241.原理过量的硫酸用标准氢氧化钠滴定蛋白质降解产物 HSO+2NaOH NaSO2424蛋白质---蛋白月示---蛋白胨---多肽---二肽---氨基酸,104 5 ×1032×103 1000-500 200 100lundin’s method:以单宁和磷钼酸两种沉淀剂将蛋白质降解为3个区: A区:高分子量蛋白质,易为单宁所沉淀B区:中分子量含氮物质,用单宁和磷钼酸的沉淀物之差C区:低分子量含氮物质-N-NNN总总BCBC测定××100%100%A=A= NN1.测总氮总总 2.用单宁沉淀后测含氮量,N,BCN-N-NNBC BC CC ××100%100%3.用磷钼酸沉淀后测含氮量,N,B=B=CNN 总总A区= N-N总BCNN CCB区=N-NBCC××100%100%C=C= NNC区=N总总C 注意事项:1.温度对沉淀的影响 2.啤酒除气教你如何用WORD文档 (2012-06-27 192246)转载?标签: 杂谈1. 问:WORD 里边怎样设置每页不同的页眉,如何使不同的章节显示的页眉不同,答:分节,每节可以设置不同的页眉。
文件――页面设置――版式――页眉和页脚――首页不同。
2. 问:请问word 中怎样让每一章用不同的页眉,怎么我现在只能用一个页眉,一改就全部改了,答:在插入分隔符里,选插入分节符,可以选连续的那个,然后下一页改页眉前,按一下“同前”钮,再做的改动就不影响前面的了。
简言之,分节符使得它们独立了。
这个工具栏上的“同前”按钮就显示在工具栏上,不过是图标的形式,把光标移到上面就显示出”同前“两个字来。
3. 问:如何合并两个WORD 文档,不同的页眉需要先写两个文件,然后合并,如何做,答:页眉设置中,选择奇偶页不同与前不同等选项。
4. 问:WORD 编辑页眉设置,如何实现奇偶页不同比如:单页浙江大学学位论文,这一个容易设;双页:(每章标题),这一个有什么技巧啊,答:插入节分隔符,与前节设置相同去掉,再设置奇偶页不同。
5. 问:怎样使WORD 文档只有第一页没有页眉,页脚,答:页面设置,页眉和页脚,选首页不同,然后选中首页页眉中的小箭头,格式,边框和底纹,选择无,这个只要在“视图”――“页眉页脚”,其中的页面设置里,不要整个文档,就可以看到一个“同前”的标志,不选,前后的设置情况就不同了。
6. 问:如何从第三页起设置页眉,答:在第二页末插入分节符,在第三页的页眉格式中去掉同前节,如果第一、二页还有页眉,把它设置成正文就可以了?在新建文档中,菜单―视图―页脚―插入页码―页码格式―起始页码为0,确定;?菜单―文件―页面设置―版式―首页不同,确定;?将光标放到第一页末,菜单―文件―页面设置―版式―首页不同―应用于插入点之后,确定。
第2 步与第三步差别在于第2 步应用于整篇文档,第3 步应用于插入点之后。
这样,做两次首页不同以后,页码从第三页开始从1 编号,完成。
7. 问:WORD 页眉自动出现一根直线,请问怎么处理,答:格式从“页眉”改为“清除格式”,就在“格式”快捷工具栏最左边;选中页眉文字和箭头,格式,边框和底纹,设置选无。
8. 问:页眉一般是---------,上面写上题目或者其它,想做的是把这根线变为双线,WORD 中修改页眉的那根线怎么改成双线的答:按以下步骤操作去做:?选中页眉的文字,包括最后面的箭头?格式,边框和底纹?选线性为双线的?在预览里,点击左下小方块,预览的图形会出现双线?确定?上面和下面自己可以设置,点击在预览周围的四个小方块,页眉线就可以在不同的位置。
9. 问:Word 中的脚注如何删除,把正文相应的符号删除,内容可以删除,但最后那个格式还在,应该怎么办,答:步骤如下:1、切换到普通视图,菜单中“视图”――“脚注”,这时最下方出现了尾注的编辑栏。
2、在尾注的下拉菜单中选择“尾注分隔符”,这时那条短横线出现了,选中它,删除。
3、再在下拉菜单中选择“尾注延续分隔符”,这是那条长横线出现了,选中它,删除。
4、切换回到页面视图。
尾注和脚注应该都是一样的。
10. 问:Word 里面有没有自动断词得功能常常有得单词太长了,如果能设置下自动断词就好了答:在工具―语言―断字―自动断字,勾上,word 还是很强大的。
11. 问:如何将word 文档里的繁体字改为简化字,答:工具―语言―中文简繁转换。
12. 问:怎样微调WORD 表格线,WORD 表格上下竖线不能对齐,用鼠标拖动其中一条线,可是一拖就跑老远,想微调表格竖线让上下对齐,请问该怎么办, 答:选定上下两个单元格,然后指定其宽度就可以对齐了,再怎么拉都行pressAlt,打开绘图,其中有个调整坐标线,单击,将其中水平间距与垂直间距都调到最小值即可。
打开绘图,然后在左下脚的绘图网格里设置,把水平和垂直间距设置得最小。
13. 问:怎样微调word 表格线,我的word 表格上下竖线不能对齐,用鼠标拖动其中一条线,可是一拖就跑老远,我想微调表格竖线让上下对齐,请问该怎么办,答:可以如下操作:?按住ctl 键还是shift,你have a try?double click the line, try it )?打开绘图,设置一下网格(在左下角)。
使水平和垂直都为最小,试一把~,?press Alt14. 问:怎么把word 文档里已经有的分页符去掉,答:先在工具―― 选项―― 视图―― 格式标记,选中全部,然后就能够看到分页符,delete 就ok了。
15. 问:Word 中下标的大小可以改的吗答:格式―字体16. 问:Word 里怎么自动生成目录啊答:用“格式样式和格式”编辑文章中的小标题,然后插入-索引和目录17. 问:Word 的文档结构图能否整个复制论文要写目录了,不想再照着文档结构图输入一遍,有办法复制粘贴过来吗,答:可以自动生成的,插入索引目录。
18. 问:做目录的时候有什么办法时右边的页码对齐,比如:1.1 标题..........11.2 标题 (2)答:画表格,然后把页码都放到一个格子里靠右或居中,然后让表格的线条消隐就可以了,打印出来就很整齐。
19. 问:怎样在word 中将所有大写字母转为小写,比如一句全大写的转为全小写的答:格式-更改大小写-小写20. 问:在存盘的时候,出现了问题,症状如下:磁盘已满或打开文件过多,不能保存,另开新窗口重存也不管用。
如何解决,答:把word 文档全选,然后复制,然后关掉word,电脑提示你粘贴板上有东西,要不要用于别的程序,选是,然后,再重新打开word,然后粘贴,然后,保存。
21. 问:WORD 中的表格一复制粘贴到PPT 中就散掉了,怎么把WORD 里面的表格原样粘贴到PPT 中,答:1)比较好的方法是:先把表格单独存为一WORD 文件,然后插入,,对象,选由文件创建,然后选中上面的WORD 文件,确定;2)还可以先把表格copy 到excel 中,然后copy 到PPT 中,这个也是比较好的办法;3)可以先做成文本框,再粘贴过去;4)复制粘贴,但是在PPT 中不能粘在文本框里面;5)拷屏,做成图片,再弄到PPT 里面。
22. 问:有没有办法将PPT 的文字拷入WORD 里面,答:另存就可以了。
只要以.rtf 格式另存即可23. 问:word 中图片的分栏如何处理,假如有:1 2 图3 4 这样的结构,我想实现:1 3 图(要横跨两栏)2 4 但是,试了半天总是:1 2 图3 4 怎么办呀,help~答:设置图片格式――版式――高级――文字环绕――环绕方式选上下型――图片位置――对齐方式选居中――度量依据选页面,要先改文字环绕,然后才能改图片位置24. 问:用word 写东西时字距老是变动,有时候自动隔得很开,有时候进入下一行的时侯,上一行的字距又自动变大了,这是为什么,怎么纠正啊, 答:是因为自动对齐的功能,格式――段落――对齐方式可以选。
还有允许断字的功能如果check 上,就不会出现你说的情况了。
25. 问:在使用WORD 的样式之后,如标题1、标题2 之类的,在这些样式前面总会出现一个黑黑的方块,虽然打印的时候看不到,但看着总是不舒服,有没有办法让它不要显示呢, 答:“视图”,,“显示段落标志”,把前面的勾去掉。
其实这个很有用,可以便于知道哪个是标题段落26. 问:文章第一页下面要写作者联系方式等。
