(完整)物质的量知识点总结,推荐文档
高中化学必修一1.2物质的量-知识点
小初高个性化辅导,助你提升学习力! 1 高中化学必修一1.2物质的量-知识点
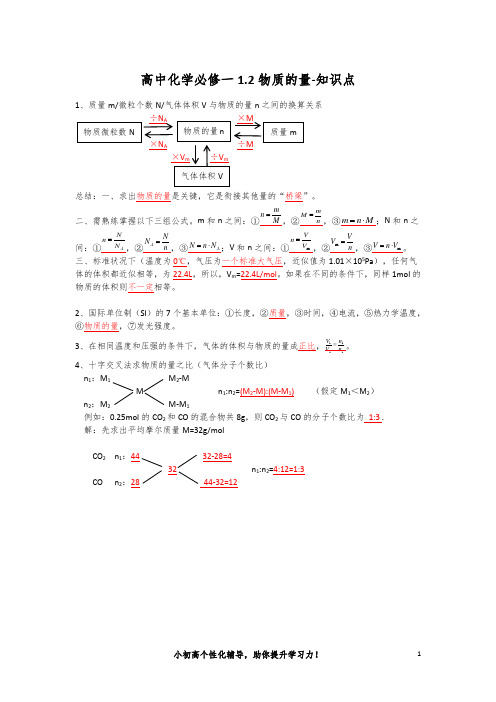
1、质量m/微粒个数N/气体体积V 与物质的量n 之间的换算关系
×N A ÷M
总结:一、求出物质的量是关键,它是衔接其他量的“桥梁”。
二、需熟练掌握以下三组公式。
m 和n 之间:①
M m n =,②n m M =,③M n m ⋅=;N 和n 之间:①A N N n =,②n N N A =,③A N n N ⋅=;V 和n 之间:①m V V n =,②n V V =m ,③m V n V ⋅=。
三、标准状况下(温度为0℃,气压为一个标准大气压,近似值为1.01×105Pa ),任何气体的体积都近似相等,为22.4L ,所以,V m =22.4L/mol 。
如果在不同的条件下,同样1mol 的物质的体积则不一定相等。
2、国际单位制(SI )的7个基本单位:①长度,②质量,③时间,④电流,⑤热力学温度,⑥物质的量,⑦发光强度。
3、在相同温度和压强的条件下,气体的体积与物质的量成正比,21
21n n V V =。
4、十字交叉法求物质的量之比(气体分子个数比)
n 1:M 1 M 2-M
M n 1:n 2=(M 2-M):(M-M 1) (假定M 1<M 2)
n 2:M 2 M-M 1
例如:0.25mol 的CO 2和CO 的混合物共8g ,则CO 2与CO 的分子个数比为 1:3 .
解:先求出平均摩尔质量M=32g/mol
CO 2 n 1 32-28=4
n 1:n 2=4:12=1:3
CO n 2:28 44-32=12。
(完整word版)高中化学必修一物质的量

高中化学物质的量难点解析一、物质的量(n)1.定义: 它是一个描述宏观物质中所含有的微粒数目的多少的一个物理量。
2、单位:摩尔, 简称摩, 符号是mol。
3、阿伏伽德罗常数(NA): 0.012kg 12C所含的碳原子数目叫做阿伏伽德罗常数。
1mol任何微粒所含的微粒数均为N A个。
N A =6.02×1023 mol-14.公式: n = N :微粒数。
二、摩尔质量(M)1.定义: 单位物质的量的物质所具有的质量叫做摩尔质量。
1mol的任何物质的质量, 以g为单位时, 它在数值上等于该物质的相对原子质量或相对分子质量。
2.单位: g· mol-1(g/mol)或kg· mol-1(kg/mol)。
3、公式: n =三、摩尔体积(V m)1.定义: 一定温度和压强下, 单位物质的量的气体所占的体积叫做气体的摩尔体积。
2.单位: L· mol-1(L/mol)或m3· mol-1(m3/mol)3、标准状况下, 气体摩尔体积约为22.4 L· mol-1。
标准状况:指温度为0℃、压强为101kPa的状况, 简称STP。
4、公式: n =5.书写规律:①在相同条件下, 1mol气体所占的体积比1mol固体或液体所占的体积大得多。
②在相同条件下, 1mol固体或液体的体积不同, 而1mol气体的体积却几乎完全相同。
③在相同条件下, 决定物质的体积的微观因素:气体体积大小 1.粒子数目固、液体体积大小的主要因素 2.粒子(半径)大小的主要因素3.粒子间的平均距离阿伏伽德罗定律:在同温同压下, 相同体积的任何气体都含有相同数目的分子。
p V=n RT四、物质的量浓度(c B)1.定义: 单位体积溶液中所含溶质的物质的量。
2.单位: mol· L-1(mol/L)或mol· m-3(mol/m-3)。
3.公式: n B=c B×V4.一定物质的量浓度溶液的配置:(1)主要仪器: 容量瓶、烧杯、胶头滴管、玻璃棒、托盘天平(砝码)、药匙、量筒。
物质的量粒子个数摩尔质量知识点

物质的量粒子个数摩尔质量知识点一、物质的量(mol)概念1. 定义:物质的量是物质的基本性质之一,用国际单位制中的单位mol来表示。
物质的量表示的是物质包含的粒子个数。
2. Avogadro常数:Avogadro常数是一个量级非常大的常数,约为6.022 × 10^23 mol^-1、它表示1mol物质中所含有的粒子个数。
3.莱布尼茨定律:根据莱布尼茨定律,对于一个理想气体,单位摩尔数量的物质在相同条件下占有相同的体积。
二、物质的量和粒子个数之间的关系1. 物质的量与粒子个数之间的关系是一个比例关系。
1mol物质中的粒子个数等于Avogadro常数,即6.022 × 10^232.利用物质的量与粒子个数之间的比例关系,可以通过已知的物质的量计算出相应的粒子个数,或者通过已知的粒子个数计算出物质的量。
三、摩尔质量(molar mass)概念1. 定义:摩尔质量是指1mol物质的质量,用国际单位制中的单位g/mol来表示。
2. 摩尔质量的计算方法:摩尔质量可以通过元素的相对原子质量(atomic mass)进行计算。
3. 相对原子质量(atomic mass):相对原子质量是指一个原子相对于碳-12同位素的质量比,它是一个相对值,没有单位。
四、物质的量和质量之间的关系1.物质的量与质量之间的关系是一个比例关系。
物质的量等于质量除以摩尔质量。
物质的量=质量/摩尔质量2.利用物质的量和质量之间的比例关系,可以通过已知的物质的量计算出相应的质量,或者通过已知的质量计算出物质的量。
五、物质的量在化学计算中的应用1.质量计算:通过已知的物质的量和摩尔质量可以计算出物质的质量,或者通过已知的质量和摩尔质量计算出物质的量。
2.反应计算:根据化学方程式中的化学计量比,可以用物质的量来计算反应物质的量和生成物质的量。
3. 溶液浓度计算:摩尔浓度(mol/L)可以通过溶液中物质的量和溶液体积的比值计算得到。
高一化学物质的量知识点

高一化学物质的量知识点一、引言在高中化学教学中,物质的量是一个基础且重要的概念。
它不仅帮助学生理解化学反应的本质,还是进行实验和计算的基础。
本文旨在概述高一化学物质的量的核心知识点,为学生提供一个清晰的学习指南。
二、物质的量的定义物质的量(n)是一个物理量,用来衡量物质所含基本单位(如原子、分子、离子等)的数量。
其单位是摩尔(mol),定义为与0.012千克(或12克)碳-12中原子数相同的任何物质的量。
三、摩尔的概念1. 摩尔的定义:摩尔是物质的量的单位,表示为mol。
2. 摩尔的质量:一个摩尔的任何物质的质量(以克为单位)等于该物质的相对分子质量(或相对原子质量)。
3. 摩尔的体积:在标准状况下(0°C,1大气压),一个摩尔的任何气体的体积约为22.4升。
四、物质的量的计算1. 质量与物质的量的关系:物质的量(n)= 质量(m)/ 摩尔质量(M)。
2. 体积与物质的量的关系:在标准状况下,n = 体积(V)/ 22.4L/mol。
3. 反应物和生成物的物质的量关系:在化学反应中,反应物和生成物的物质的量之比等于它们的化学计量数之比。
五、化学反应的计量1. 化学方程式:化学方程式表示反应物和生成物的种类及其物质的量比例。
2. 化学计量数:化学计量数表示在化学方程式中,每种物质前面系数的数值,用于确保反应物和生成物的物质的量守恒。
3. 守恒定律:在化学反应中,质量守恒、电荷守恒和能量守恒是必须遵守的基本原则。
六、溶液的浓度1. 摩尔浓度:溶液中溶质的物质的量除以溶液的体积(通常以升为单位),得到的是溶液的摩尔浓度(c),单位为mol/L。
2. 质量分数:溶液中溶质的质量与溶液总质量的比值,称为质量分数(w)。
3. 体积分数:溶液中溶质的体积与溶液总体积的比值,称为体积分数(φ)。
七、物质的量在实验中的应用1. 制备溶液:通过准确计算物质的量,可以制备特定浓度的溶液。
2. 滴定实验:通过测量滴定过程中消耗的标准溶液的物质的量,可以确定待测溶液的浓度。
高一物质的量知识点总结

高一物质的量知识点总结物质的量是化学中的一个重要概念,它指的是物质中包含的粒子数。
在高一的学习中,我们接触了很多与物质的量有关的知识点,掌握这些知识对我们理解化学世界起着关键作用。
本文将对高一物质的量相关的知识进行总结。
一、物质的量单位物质的量的国际单位是摩尔(mol),摩尔的定义是:一个摩尔物质包含着6.02214×10^23个粒子。
这个粒子可以是分子、原子、离子等。
二、摩尔质量摩尔质量指的是一个物质的质量与其物质的量的比值。
用化学符号表示,摩尔质量(M)等于物质的质量(m)除以物质的量(n)。
摩尔质量的单位是克/摩尔(g/mol)。
三、摩尔体积摩尔体积指的是一个物质的体积与其物质的量的比值。
用化学符号表示,摩尔体积(Vm)等于物质的体积(V)除以物质的量(n)。
在理想气体状态下,一个摩尔气体的体积为22.4升(L)。
四、摩尔浓度摩尔浓度指的是溶液中溶质物质的摩尔量与其溶液体积的比值。
用化学符号表示,摩尔浓度(C)等于溶质物质的物质的量(n)除以溶液的体积(V)。
摩尔浓度的单位是摩尔/升(mol/L)。
五、摩尔方程式摩尔方程式是用摩尔的数量关系来表示化学方程的表示方法。
在化学方程式中,化学物种的系数表示的是它们相互之间的摩尔比。
摩尔方程式使得化学反应的量关系更加清晰明了,方便了研究和计算。
六、物质的量与化学计算物质的量在化学计算中起着重要作用。
通过物质的量关系,我们可以计算出化学反应中反应物和生成物的摩尔比,从而推算出各个物质的物质的量或质量。
这些计算不仅在化学实验室中有重要应用,也常常运用在工业生产和日常生活中。
七、摩尔比摩尔比指的是化学反应中各物质的物质的量之间的比值。
通过摩尔比,我们可以知道反应中的限量试剂和过量试剂,从而判断反应的产物。
八、摩尔比的应用摩尔比的应用非常广泛。
在化学分析中,通过摩尔比可以帮助我们确定未知物质的物质的量。
在质量分析中,我们可以利用摩尔比将质量转化为物质的量,便于进行计算。
化学总结物质的量知识点

化学总结物质的量知识点一、物质的量的基本概念1.1 物质的量的概念物质的量是描述物质数量的物理量,用符号n表示,其单位是摩尔(mol)。
1摩尔物质的数量等于6.022×10^23个粒子,这个数值被称为阿伏伽德罗常数,记作N_A,通常用来表示粒子的数量。
1.2 摩尔质量摩尔质量是1摩尔物质的质量,记作M。
对于元素来说,它等于该元素的相对原子质量;对于化合物来说,它等于化合物的相对分子质量。
1.3 摩尔体积摩尔体积是1摩尔气体在标准状态下的体积,记作V_M。
对于理想气体来说,其摩尔体积为22.4升/mol。
1.4 摩尔浓度摩尔浓度是指溶液中物质的摩尔数与溶液体积的比值,记作c,单位是mol/L。
二、物质的量的表示2.1 物质的量的计算物质的量与粒子数、质量和体积之间有一定的关系,可以通过以下公式进行计算:n = N/N_An = M/Mn = V/V_M其中,n表示物质的量,N表示粒子数,M表示质量,V表示体积,N_A表示阿伏伽德罗常数,V_M表示摩尔体积。
2.2 物质的量在化学方程式中的应用在化学方程式中,反应物和生成物的物质的量比例是通过平衡系数来表示的,这种比例关系称为摩尔比。
根据平衡系数,可以确定反应物和生成物之间的摩尔比,方便计算物质的量的变化。
2.3 用摩尔表示物质的量在进行计算时,通常使用摩尔来表示物质的量,这样可以简化计算过程,方便进行化学反应和物质变化的研究。
三、摩尔计算3.1 摩尔质量的计算摩尔质量可以通过元素或化合物的化学式中各元素的相对原子质量进行计算,然后将各元素的相对原子质量相加即可得到。
3.2 摩尔浓度的计算摩尔浓度可以通过溶液中物质的摩尔数和溶液的体积进行计算,根据摩尔浓度的定义公式进行计算即可。
3.3 摩尔体积的计算摩尔体积可以通过理想气体定律及标准状态下的体积得到,根据摩尔体积的定义公式进行计算即可。
3.4 反应物的量与生成物的量的计算通过化学方程式中的平衡系数,可以确定反应物和生成物之间的摩尔比,从而可以计算出反应物的量和生成物的量。
中考化学物质的量知识点汇总

中考化学物质的量知识点汇总在中考化学中,物质的量是一个非常重要的概念,它将微观粒子的数量与宏观可测量的物理量联系起来,为化学计算和定量分析提供了有力的工具。
下面我们就来详细汇总一下这部分的知识点。
一、物质的量的定义物质的量是表示含有一定数目粒子的集合体的物理量,符号为“n”。
它的单位是摩尔(mol)。
我们可以这样来理解,物质的量就好比是一个“大箱子”,把一定数目的微观粒子装在一起,这个“大箱子”就是物质的量。
二、阿伏加德罗常数1 摩尔任何粒子所含的粒子数均为阿伏加德罗常数个,通常用符号“NA”表示,其数值约为 602×10²³。
打个比方,如果把 602×10²³个乒乓球堆在一起,这一堆乒乓球的“物质的量”就是 1 摩尔。
三、物质的量(n)、阿伏加德罗常数(NA)与粒子数(N)的关系它们三者之间的关系可以用公式表示:n = N / NA这就好比,如果知道了一堆粒子的总数(N),又知道 1 摩尔粒子的个数(NA),那么就能算出这堆粒子的物质的量(n)。
例如,有 1204×10²⁴个氧原子,那么氧原子的物质的量就是:n = 1204×10²⁴÷ 602×10²³= 2 mol四、摩尔质量1、定义:单位物质的量的物质所具有的质量叫做摩尔质量,符号为“M”,单位是 g/mol。
2、数值:以 g/mol 为单位时,摩尔质量在数值上等于该粒子的相对原子质量或相对分子质量。
比如,氧气(O₂)的相对分子质量约为 32,那么氧气的摩尔质量就是 32 g/mol 。
3、物质的量(n)、质量(m)和摩尔质量(M)的关系公式:n = m / M假如我们知道了一种物质的质量(m)和它的摩尔质量(M),就能算出这种物质的物质的量(n)。
例如,有 16 g 氧气,氧气的摩尔质量是 32 g/mol ,那么氧气的物质的量为:n = 16 g ÷ 32 g/mol = 05 mol五、气体摩尔体积1、定义:单位物质的量的气体所占的体积叫做气体摩尔体积,符号为“Vm”,单位是 L/mol 。
物质的量实验知识点总结

物质的量实验知识点总结一、物质的量的概念1.物质的量的定义物质的量是衡量一个物质中含有多少个粒子的数量。
在国际单位制中,物质的量的单位是摩尔(mol),一个摩尔的物质含有6.022×10^23个粒子。
2.物质的量的计算物质的量可以通过物质的质量和摩尔质量的关系来计算,摩尔质量是指一个物质中含有一个摩尔的质量。
物质的量=质量/摩尔质量。
3.物质的量与物质的质量的关系物质的量和物质的质量是两个不同的概念,物质的量是指物质中所含有的粒子数量,而物质的质量是物质所含有的质量。
两者之间的关系可以用公式n=m/M来表示,其中n表示物质的量,m表示物质的质量,M表示摩尔质量。
二、物质的量的实验方法1.化学平衡实验化学平衡实验是通过观察化学反应前后反应物和生成物的质量变化来确定化学反应的摩尔比。
在平衡实验中,首先要准确称量反应物的质量,然后进行反应,最后通过计算生成物的质量和反应物的质量变化来确定摩尔比。
2.气体体积实验气体体积实验是通过观察气体在一定的条件下的体积变化来确定气体的物质的量。
通过气体体积实验,我们可以确定气体的摩尔体积,从而计算气体的物质的量。
3.溶解度实验溶解度实验是通过观察溶质在溶剂中的溶解程度来确定物质的量。
在溶解度实验中,我们可以通过测量溶质溶解后的溶液的体积和浓度来计算溶质的物质的量。
4.电化学实验电化学实验是通过观察电解质在电场中的电解程度和电极电位的变化来确定物质的量。
在电化学实验中,我们可以通过测量电解质的电导率和电极的电位来计算物质的量。
三、物质的量的应用1.化学方程式的平衡化学平衡实验可以帮助我们确定化学方程式中的摩尔比,从而正确地平衡化学方程式。
2.摩尔比的计算通过观察反应物和生成物的质量变化,我们可以确定摩尔比,从而计算反应物和生成物的物质的量。
3.反应物的计量通过物质的量实验,我们可以确定反应物的量,从而进行反应物的计量。
4.生成物的计量通过物质的量实验,我们可以确定生成物的量,从而进行生成物的计量。
【最新文档】高一化学必修一物质的量知识点总结-范文word版 (8页)

本文部分内容来自网络整理,本司不为其真实性负责,如有异议或侵权请及时联系,本司将立即删除!== 本文为word格式,下载后可方便编辑和修改! ==高一化学必修一物质的量知识点总结高一的学生在学习必修一的化学课本时,会碰见很多理论性的知识概念,你知道物质的量是什么吗? 关于物质的量这个内容我们需要掌握哪些知识点呢?下面是小编为大家整理的高一化学必修一知识点,希望对大家有用!必修一化学物质的量知识一、物质的量的单位――摩尔1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA5.摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g..mol-1(3)数值:等于该粒子的相对原子质量或相对分子质量.6.物质的量=物质的质量/摩尔质量 ( n = m/M )二、气体摩尔体积1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下, Vm = 22.4 L/mol三、物质的量在化学实验中的应用1.物质的量浓度.(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V2.一定物质的量浓度的配制(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.(2)主要操作a.检验是否漏水.b.配制溶液 1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.(3)注意事项A 选用与欲配制溶液体积相同的容量瓶.B 使用前必须检查是否漏水.C 不能在容量瓶内直接溶解.D 溶解完的溶液等冷却至室温时再转移.E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.3.溶液稀释:C(浓溶液)/V(浓溶液) =C(稀溶液)/V(稀溶液)高一化学基础知识胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。
化学物质的量知识点总结

化学物质的量知识点总结化学,即使是考试也只占一小部分。
但无论如何,我们都应该学好它。
下面是关于化学物质的量知识点总结,希望可以帮助大家!1、质量守恒定律(mass conservation law):在化学反应中,反应前后原子的种类和数目没有改变,原子的质量也没有改变。
2、溶液中的离子:在溶液中,带电的微粒(如离子)不仅原来所带的电荷数目不变,而且还带着等量的其他正负电荷。
3、物质的量:物质的量用符号Q表示,单位是摩尔,简称摩,符号是mol。
物质的量浓度等于物质的量的浓度乘以物质的量。
浓度是物质的量的单位。
4、摩尔质量:物质的质量以克为单位时,物质的摩尔质量为M=ρQ/n,其中:ρ是物质的密度; m是物质的质量; n是阿佛加德罗常数; Q是物质的量。
一摩尔任何物质所含微粒数的多少,叫做该物质的摩尔数。
所含微粒数与摩尔质量的乘积叫做这种物质的摩尔质量。
5、阿伏伽德罗常数:一摩尔任何物质所含微粒的物质的量n,与这种物质所带的电荷量q的比值叫做这种物质的阿伏伽德罗常数。
它是一个常数,通常用下面的近似式表示: s=c/n6、酸碱度:能在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸;全部是氢氧根离子的化合物叫做碱。
7、酸碱指示剂:在溶液中能显示出酸碱性质的物质。
如食醋里含有氢离子,在紫色石蕊试液中就显红色。
8、酸碱中和反应:一种酸(或碱)和一种盐(或碱)中和生成另一种盐(或碱),而使酸碱质量都减少的反应。
酸碱中和反应的化学方程式为:H2SO4+NaOH=H2NaCl+H2O。
中和反应前后,各元素的原子的种类和个数没有发生改变,只是原子的结合方式和核电荷数改变了。
在反应前后,同种元素的原子由于电子的得失,在数目上有增有减。
9、 pH:溶液中氢离子活度的负对数。
如1份碳酸钠溶液中含有1个氢离子,因此pH=1。
10、离子反应:凡是两种离子参加的反应叫做离子反应。
离子反应必须具备的三个条件是:反应物中必须有离子,离子必须参加反应,生成物中必须有离子。
化学物质的量知识点

化学物质的量知识点在化学中,物质的量是一个重要的概念。
它是指物质的数量,也被称为摩尔数或物质的摩尔。
1. 摩尔和摩尔质量:摩尔是指包含六百多亿亿个粒子的物质的数量。
摩尔的单位是mol。
摩尔质量是指摩尔数为1的物质的质量。
摩尔质量的单位是g/mol。
例如,氧气(O2)的摩尔质量为32g/mol,表示一个摩尔的氧气中有32克的质量。
2. 原子量和分子量:原子量是指一个单一原子的相对质量。
相对原子质量的单位是原子质量单位(u)。
例如,氢原子的相对原子质量为1.008u。
分子量是指一个分子中各个原子相对原子质量的和。
例如,水(H2O)的分子量为18.015u。
3. 摩尔质量和相对分子质量:摩尔质量和相对分子质量是指具有相同物质的摩尔数和质量比。
例如,相对分子质量为18.015的水的摩尔质量为18.015g/mol。
4. 摩尔体积:摩尔体积是指在给定条件下,一个摩尔物质所占据的体积。
在相同条件下,不同物质的摩尔体积是相等的。
例如,在标准状态下(273.15K和1 atm压力),一个摩尔的任何气体的摩尔体积都是22.414L。
5. 摩尔浓度:摩尔浓度是指单位体积溶液中所含物质的摩尔数。
它可以用来表示溶液中溶质的浓度。
摩尔浓度的单位是mol/L,也可以用M表示。
例如,一个浓度为0.1mol/L的盐水溶液表示在每升溶液中有0.1摩尔的盐。
6. 摩尔比和化学计量比:摩尔比是指在化学反应中,各个物质的摩尔数之间的比例关系。
它可以用来描述化学反应的化学方程式。
例如,对于反应2H2 + O2 →2H2O,两个氢分子和一个氧分子的摩尔比为2:1。
化学计量比是指在化学反应中各个物质的摩尔比与化学方程式中的系数之间的关系。
它能够用来确定每种物质的化学量。
例如,对于上述反应,氢和氧的化学计量比为2:1。
在化学中,了解和运用物质的量概念是非常重要的。
它能够帮助我们计算和理解化学反应中的物质转化和组成。
同时,熟练掌握这些知识可以提高我们在实验室操作和计量物质时的准确性和效率。
高中化学总结知识点1物质的量

知识点1 物质的量
一、物质的量
1.概念:一种物理量,表示含有一定数目粒子的集合体,符号为n 。
2.单位:摩尔,简称摩,符号为mol 。
3.阿伏加德罗常数
1 mol 任何粒子的粒子数叫做阿伏加德罗常数,符号为N A ,约为6.02×1023 mol -
1。
4.关系式:
A N N n =
二、摩尔质量 1.定义:单位物质的量的物质所具有的质量叫作摩尔质量(M )。
2.单位:g·mol -1或kg·mol -1。
3.任何物质的摩尔质量以g·mol
-1为单位时,数值上都等于它的相对原子质量或相对
分子质量。
4.表达式:n m M =
三、气体摩尔体积
1.定义:一定温度和压强下,单位物质的量的气体所占有的体积叫做气体摩尔体积(V m )。
2.单位:L·mol -1或m 3·mol -1
3.标准状况(STP ,指0 ℃、101 kPa )下,气体摩尔体积约为22.4 L·mol -1。
4.表达式:n V
V m =
四、物质的量浓度
1.定义:单位体积溶液中所含溶质B 的物质的量叫作溶质B 的物质的量浓度(c B )。
2.单位:mol·L -1或mol·m -
3 3.表达式:V
n c B B = 4.配制一定物质的量浓度的溶液(以配制0.1L 1 mol/L NaCl 溶液为例)
(1)仪器:天平、药匙、烧杯、玻璃棒、100mL 容量瓶、胶头滴管
(2)步骤:计算→称量→溶解→转移→洗涤→定容→摇匀。
物质的量知识点总结

物质的量知识点总结物质的量是化学中一个非常重要的概念,它是描述物质数量的基本单位。
在化学反应和计量方面起着至关重要的作用。
本文将对物质的量相关的知识点进行总结,包括物质的量的定义、计量单位、摩尔质量和摩尔计算等内容。
物质的量是描述物质数量的概念,通常用符号n表示,其单位是摩尔(mol)。
摩尔的定义是物质的量,其数值等于该物质中的粒子数与阿伏伽德罗常数之积。
阿伏伽德罗常数是一个实验测定的物理常数,其数值约为6.022×10^23,表示1摩尔物质中包含的粒子数。
因此,1摩尔物质中包含约6.022×10^23个分子或原子。
在化学计量中,摩尔是非常重要的计量单位。
通过摩尔的概念,可以方便地进行物质的计量和化学方程式的平衡。
在化学方程式中,反应物和生成物的摩尔比可以直接用来推导反应物的质量、体积等物理量。
因此,摩尔的概念在化学计量中起着至关重要的作用。
摩尔质量是指1摩尔物质的质量,通常用符号M表示,其单位是克/摩尔(g/mol)。
摩尔质量可以通过化学元素的相对原子质量或相对分子质量来计算。
例如,氧气(O2)的摩尔质量约为32g/mol,这意味着1摩尔的氧气分子质量约为32克。
在化学计算中,摩尔质量是一个非常重要的概念。
通过摩尔质量,可以方便地将物质的质量和摩尔数进行转换。
例如,已知某化合物的质量,可以通过其摩尔质量计算出其中包含的摩尔数;反之,已知某化合物的摩尔数,也可以通过其摩尔质量计算出其质量。
这种转换在化学实验和工业生产中都有着广泛的应用。
摩尔计算是化学中常见的一种计算方法,它主要用于计算化学反应中的物质的质量、体积等物理量。
摩尔计算可以通过化学方程式和摩尔质量来实现。
例如,已知反应物的摩尔数和化学方程式,可以通过摩尔比来推导生成物的摩尔数;反之,已知生成物的摩尔数,也可以通过摩尔比来推导反应物的摩尔数。
通过摩尔计算,可以方便地进行化学反应的计量和平衡。
总之,物质的量是化学中一个非常重要的概念,它通过摩尔的概念来描述物质数量,并通过摩尔质量和摩尔计算来进行物质的计量和化学方程式的平衡。
化学必修一物质的量的计算知识点复习总结

有关物质的量的计算知识点总结1.物质的量(1)定义:物质的量是量度一定量粒子的集合体中所含粒子数量的物理量。
符号为n,它是把微观粒子与宏观可称量物质联系起来的一种物理量。
是国际单位制中规定的7个基本物理量之一。
说明:物质的量是描述物质属性的一个物理量,与质量长度等一样。
(2)物质的量的单位:摩尔,简称摩,符号为mol适用对象:“摩尔”这个单位不适用于宏观物理,只适用于微观粒子,如,分子、原子、离子、质子、中子、电子等以及他们的特定组合(缔合分子、原子团、官能团等)说明:使用摩尔量度微观粒子时,一定要指明微粒的种类,一般加化学式或微粒符号。
如1molS是正确的,但1mol氢是错误的。
好多学生不理解物质的量的概念,在授课过程中要注意语言简洁,不用冗余的语言去解释它的概念。
2.阿伏加德罗常数(1)定义:国际上规定1mol任何粒子集合体所含的粒子数,称为阿伏加德罗常数,其准确数值与0.012kg12C中所含原子数相同,约为6.02×1023。
(2)表示:用符号N A来表示,同上使用6.02×1023mol-1这个近似值表示,单位mol-1。
(3)物质的量(n)与粒子数(N)、阿伏加德罗常数(N A)之间的关系:3.摩尔质量(1)定义:单位物质的量的物质所具有的质量,符号M,常用单位g/mol或g.mol-1,具体物质的物质的量为常数,不随物质的量的多少而改变。
说明:表示某物质的摩尔质量时,要指明具体粒子种类。
如,氮分子(原子)的摩尔质量是正确的,但氮的摩尔质量是错误的。
(2)任何微粒的摩尔质量若以“g/mol”为单位时,在数值上等于其相对原子(分子)质量,但二者单位不同。
(3)摩尔质量与物质的量之间的关系物质的质量(m)、物质的量(n)、摩尔质量(M)之间的关系:4.气体摩尔体积(1)定义:单位物质的量的气体所占的体积叫作气体摩尔体积。
符号为V m ,常用的单位有 L/mol (或L · mol -1)和 m 3/mol (或m 3· mol -1)(2)特例:在标准状况下(0℃、101kPa ),气体摩尔体积约为22.4L/mol 。
物质的量知识点总结

物质的量知识点小结有关概念:1、物质的量(n)①物质的量是国际单位制中七个基本物理量之一。
②用物质的量可以衡量组成该物质的基本单元(即微观粒子群)的数目的多少,它的单位是摩尔,即一个微观粒子群为1摩尔。
③摩尔是物质的量的单位。
摩尔是国际单位制中七个基本单位之一,它的符号是mol。
④“物质的量”是以摩尔为单位来计量物质所含结构微粒数的物理量。
⑤摩尔的量度对象是构成物质的基本微粒(如分子、原子、离子、质子、中子、电子等)或它们的特定组合。
如1molCaCl2可以说含1molCa2+,2molCl-或3mol阴阳离子,或含54mol 质子,54mol电子。
摩尔不能量度宏观物质,如果说“1mol氢”就违反了使用准则,因为氢是元素名称,不是微粒名称,也不是微粒的符号或化学式。
⑥使用摩尔时必须指明物质微粒的名称或符号或化学式或符号的特定组合。
2.阿伏加德罗常数(N A):①定义值(标准):以0.012kg(即12克)碳-12原子的数目为标准;1摩任何物质的指定微粒所含的指定微粒数目都是阿伏加德罗常数个。
②近似值(测定值):经过科学测定,阿伏加德罗常数的近似值一般取 6.02×1023,单位是mol-1,用符号N A表示。
3.摩尔质量(M):①定义:1mol某微粒的质量②定义公式:,③摩尔质量的单位:克/摩。
④数值:某物质的摩尔质量在数值上等于该物质的原子量、分子量或化学式式量。
⑤注意:摩尔质量有单位,是克/摩,而原子量、分子量或化学式的式量无单位。
4.气体摩尔体积(V m)①定义:在标准状况下(0℃,101kPa时),1摩尔气体所占的体积叫做气体摩尔体积。
②定义公式为:③数值:气体的摩尔体积约为22.4升/摩(L/mol)。
④注意:对于气体摩尔体积,在使用时一定注意如下几个方面:一个条件(标准状况,符号SPT),一个对象(只限于气体,不管是纯净气体还是混合气体都可),两个数据(“1摩”、“约22.4升”)。
高一化学《物质的量》知识点详解

第一节物质的量新课指南1. 理解物质的量及其单位——摩尔的含义;认识引入物质的量及其单位——摩尔的重要性和必需性;懂得阿伏加德罗常数的含义 .2. 理解摩尔质量的观点及摩尔质量与相对原子质量、相对分子质量之间的互相关系.3. 掌握物质的量、微观粒子数以及物质质量之间的相交换算.4. 培育学生演绎推理、概括推理的能力.本节要点:物质的量及其单位、阿伏加德罗常数、有关物质的量的计算.本节难点:物质的量及其单位;摩尔质量与相对原子质量、相对分子质量之间的关系.教材解读精髓要义有关链接1.原子和相对原子质量原子是化学变化中的最小微粒 .原子是一种微观粒子,它拥有一些不一样于一般宏观颗粒的特色. 如:在化学变化的范围以内原子是不行切割的;原子拥有必定的质量,但该质量却特别小,如12C 原子的质量仅有 1.993 × 10-26 kg.国际上规定,以12C 原子的质量的 1/12 作标准,其余原子的质量跟它比较所得的比,就是这类原子的相对原子质量 . 如12C 原子的质量为 1.993 ×10-26 kg,某氧原子的质量为 2.657 ×10-26 kg,这类氧原子的相对原子质量为:2。
65710 26 kg16.00 .1.99310 26kg122.化学式和式量用元素符号表示物质构成的式子叫做化学式. 如 O2、 H2 O、 CO2、MgO、NaCl 分别表示了氧气、水、二氧化碳、氧化镁、氯化钠的构成,有的化学式仅能表示有关物质的构成,如NaCl;也有的化学式不单能表示这类物质的构成,同时也能表示这类物质的分子构成,这类化学式也叫做分子式,如H2 O 既是水的化学式,也是水的分子式 .化学式中各原子的相对原子质量的总和就是式量. 若化学式同时又是分子式,则式量也叫做相对分子质量. 知识详解知识点 1 摩尔Ⅰ物质的量 ( 要点、难点 )我们都知道,构成物质的基本粒子是分子、原子、离子以及质子、中子、电子等. 这些单个粒子既不可以用肉眼看到,又难于称量;但是由这些粒子构成的宏观物质既看得见,又可称量,那么在微观的粒子数目与可称量的宏观物质之间存在着哪些必定的联系呢?原子是化学变化中的最小粒子,在化学反响中其数目和质量是不变的. 所以,在化学反响中原子、离子、分子等粒子之间是按着必定简单整数比互相反响的. 比如,豆粒般大小的金属钠中含有多少个钠原子(Na)? 它们在空气中焚烧可生成多少个过氧化钠(Na 2O2)? 为了探究微观粒子数目与宏观物质的可称量性之间的内在联系,科学上采纳“物质的量”这个物理量把必定数目的原子、分子或离子等微观粒子与可称量的物质联系起来( 如图 3-1 所示 ).[ 说明 ] 在定量表示物质的某些物理性质时,常常要使用物理量,如质量、长度、时间等,都是常用的基本物理量. 与质量、长度、时间等同样,“物质的量”也是一种基本物理量.①物质的量是有关的国际科学特意机构,为了适应研究和学习的需要,而规定的基本物理量,它是当今国际上通用的七个基本物理量之一,这七个基本物理量的名称和代号见下表.名称长度质量时间电流热力学温度代号L 或 L M t I T 发光强度I物质的n②从物质的量建立的目的来看,物质的量实质上表示含有必定数目粒子的集体. 这个集体的构成者是粒子,这种集体有大有小,也就是集体内的粒子数目有多有少;所以,物质的量是特意用于计量粒子数目的物理量.③“物质的量”四个字好像电流强度、发光强度、热力学温度等名称同样,是一个固定的词组,由固定的字数构成,在读、写、用时,不可以任意地简化或增加任何字,更不可以按字面意义把物质的量当成表示物质数目或质量多少的量.④任何一个物理量都有相应的单位,如质量的单位有千克、长度的单位有米、时间的单位有秒等. 同理,物质的量也是有单位的.Ⅱ摩尔 (mol)( 要点、难点 )1971 年,在由41 个国家参加的第十四届国际计量大会上决定用”摩尔”作为计量原子、分子或离子等微观粒子的“物质的量”的单位,摩尔又简称摩,符号为mol.[ 说明 ] ①质量和千克是两个既有亲密联系又有不一样内涵的观点,质量属于物理量,千克是质量的单位. 同理,物质的量和摩尔也是两个既有亲密联系又有不一样内涵的观点,物质的量属于物理量,摩尔是物质的量的单位 . 七种基本物理量都有相应的单位,详细内容见下表.物理量单位名称单位符号长度米M质量千克Kg时间秒S电流安(培) A 热力学温度开(尔文)K物质的量摩(尔)Mol发光强度坎(德拉)Cd②“微观粒子”是指构成物质的基本单位,这一基本单位能够是分子、原子、离子、质子、中子和电子等微粒,也能够是它们的特定组合. 即凡是能够使用化学式表示的微观粒子或它们的特定组合,都能够使用摩 ( 尔)来量度,如NaCl、 NH4NO3等,而不是指米粒、西瓜、苹果、汽车、人等宏观物体.③物质的量这个物理量只合用于微观粒子,使用摩尔作单位表示物质的量时,应当用化学式指明粒子的种类,禁止指代不明确,如:能够表示 1 mol H 2、 1 mol H 、 1 mol H +,但不可以够表示 1 mol 氢、 1 mol 氧等;还应明确微粒的内在联系,如 1 mol Al 2 (SO4 ) 3中含 2 mol Al 3+、 3 mol SO 2-4; 1 mol Na +中含 11 mol 质子、 10 mol 电子等 .①每一个基本物理量的单位都有它的标准,如质量的单位——千克的标准是国际千克原器,即国际千克原器的质量就是1千克“. 摩尔”的标准是:假如在必定量的粒子集体中所含有的粒子数与0.012kg12 C 中所含有的碳原子数同样,该粒子的物质的量就是 1 mol ,元素相对原子质量的定义,是以12C原子的实质质量的 1/12 作为规定标准,因为两个标准的一致性,就将绝对证量和相对证量一致起来,进而将可称量的宏观物质同微观粒子的数目联系起来.质量度物理的量粒子数kg1 molC 约含有6.0223 个12C原子0.012 10由摩尔的标准可知, 1 mol 任何粒子的粒子数与0.012kg 12C 中所含有的碳原子数都相等 .⑤碳元素的原子有多种。
(完整版)物质的量知识要点归纳.doc

化学计量在试验中的应用一、基本理论概念 1. 物质的量( 1)概念:表示物质所含微粒数目多少的物理量 ( 2)符号: n( 3)单位: mol 2. 摩尔( 1)概念:摩尔是物质的量的单位,每1mol 物质含有阿伏加德罗常数个结构微粒。
( 2)符号: mol(3)说明:①必须指明物质微粒的名称,不能是宏观物质名称,例:不能说 1 摩氢、 1 摩氧,因这样说指哪种微粒不明确。
②常见的微观粒子有:分子、原子、离子、电子、质子、中子或它们特定的组 合③当有些物质的微观粒子只有一种时,可以省略其名称3. 阿伏加德罗常数( 1)含义:实验测定 12g 12C 中碳原子的个数 ( 2)符号: N A ( 3)单位:个 /mol ( 4)说明:① N A 的基准是 12g 碳-12 中的原子个数② 12C 不仅是摩尔的基准对象,而且还是相对原子质量的基准A6.02 ×1023作计算③ N 是一个实验值,现阶段常取④要注意A 与 6.02 × 1023 的区别m 、n 、N 之间的计算关系N*. 物质粒子数、物质的量与阿伏伽德罗常数之间的关系:N≈Nn =6.02 1023N A4. 摩尔质量(1)概念:单位物质的量的物质的质量 (2)符号: M(3)单位: g · mol -1(4)说明:①使用范围: A. 任何一种微观粒子B.无论是否纯净 C.无论物质的状态②与式量的比较:式量无单位 ③与 1mol 物质的质量的比较:m *. 物质的质量、物质的量与摩尔质量之间的计算关系:nM5. 气体摩尔体积( 1)概念:单位物质的量的气体的体积 ( 2)符号: V m ( 3)单位: L · mol -1( 4)标准状况下的气体摩尔体积①标准状况: 0℃、 1atm 即 1.01 × 105Pa②理想气体: A. 不计大小但计质量B.不计分子间的相互作用-1③标准状况下的气体摩尔体积:约 22.4L · mol①构成物质的微粒的大小(物质的本性)②结构微粒之间距离的大小(温度与压强来共同决定)③结构微粒的多少(物质的量的大小)*. 气体的体积、物质的量与气体摩尔体积之间的计算关系:6.物质的量浓度n V = N ≈V V m N A 22.4(1)概念:用单位体积的溶液中溶解溶质的物质的量的多少来表示溶液的浓度(2)符号:c(3)单位: mol· L-1(4)说明:①物质的量浓度是溶液的体积浓度②溶液中的溶质既可以为纯净物又可以为混合物,还可以是指某种离子或分子*. 物质的量浓度、溶液的体积、物质的量之间的计算关系:n=CV7.相互关系:n= N=m=V=CVN A M V m二、有关计算关系1.m、n、N之间的计算关系(1)计算关系:m N n =M N A(2)使用范围:只要物质的组成不变,无论是何状态都可以使用2.V、n、N之间的计算关系V N V(1)计算关系:n==(2)使用范围:①适用于所有的气体,无论是纯净气体还是混合气体②当气体摩尔体积用 22.4L · mol-1时必须是标准状况3.c、m、V、 N之间的计算关系(1)计算关系: cn m NV MV N A V(2)使用范围:①以上计算关系必须是在溶液中使用②微粒数目是指某种溶质③若溶液是由气体溶解于水形成的,要特别注意以下几点:A. 必须根据定义表达式进行计算B. 氨水中的溶质主要是 NH 3· H 2O ,但要以 NH 3 为准计算C. 溶液的体积不能直接用气体的体积或水的体积或气体与水的体积之和,而必须是通过m 计算得到V4. c 、 %、ρ 之间的计算关系 (1)计算关系:c1000%M( 2)使用范围:同一种溶液的质量分数与物质的量浓度之间的换算( 3)推断方法:①根据物质的量浓度的定义表达式②溶质的物质的量用nmV ?计算MM③注意溶液体积的单位5. 混合气体的平均分子量的有关计算( 1)计算依据: ①1mol 任何物质的质量(以 g 为单位)在数值上与其式量相等② 1mol 任何气体的体积(以L 为单位)在数值上与气体摩尔体积(以L · mol -1 为单位)相等—m( 2)基本计算关系: M—n(3)变换计算关系:①=n i %M i M—V i %M i② M =( 4)使用说明: ①(2) 的计算式适用于所有的混合物的计算② (3) 中的计算式只适用与混合气体的有关计算③(3) 中的两个计算式之间应用了阿伏加德罗定律6. 密度与相对密度(1)密度①计算表达式:mV②使用说明: A. 适用于所有的物质,不受物质状态的限制,也适用于所有的混合物B.所有物质: MV m ,标准状况下气体 M 22.4(2)相对密度①计算表达式:D12MM12②使用说明:A. 相对密度是在同温同压下两种气体的密度之比B. 既可以用于纯净气体之间的计算,也可以用于混合气体之间三、气态方程: PV = nR④阿伏加德罗定律重要公式—气态方程:PV = nRTV 1 n 1 推论 1:同温同压下,气体的体积之比等于其物质的量之比,即V 2 n 2 。
知识清单 必修一 物质的量

高中化学知识点梳理必修一第二单元物质的量知识点一、物质的量的单位――摩尔1.物质的量(符号)是。
2.物质的量的单位--摩尔(符号):把计量为1摩尔。
3.阿伏加德罗常数:把叫作阿伏加德罗常数。
即:N A =。
4.物质的量与物质所含微粒数目的关系。
5.注意事项:(1)物质的量是基本,四个字是一个整体,不得拆开理解,也不能压缩为“物质量”等。
(2)物质的量这个物理量是以计量对象。
(3)使用摩尔表示物质的量时,所指粒子必须明确和准确,且粒子种类要能用表示。
知识点二、摩尔质量(符号)1.定义:叫摩尔质量。
2.单位:。
3.数值:等于。
(或等于N A 个粒子质量)4.物质的量与摩尔质量的关系:。
5.摩尔质量的三种计算方法:①;②;③。
例题:1.3.01×1023个氯气分子的物质的量是____________;其质量是____________。
2.49gH 2SO 4的摩尔质量为________________,40gSO 3中含O 个数为________________。
3.用N A 表示阿伏加德罗常数,判断下列说法是否正确。
(1)标准状况下,18g H 2O 所含的原子数目为3N A ___________。
(2)常温常压下,1mol CO 2与SO 2的混合气体中含氧原子数为2N A ___________。
(3)常温常压下,14g 由N 2与CO 组成的混合物气体含有的原子数目为N A ___________。
4.(1)147gH 2SO 4的物质的量是_______;0.5molH 2SO 4的质量是_______g;(2)氧化铜在高温下发生分解反应:4CuO高温2Cu 2O+O 2↑,若反应过程中生成1molO 2分子,则转移电子数为____。
5.(1)0.2molAl 2(SO 4)3中含有Al 3+______________mol,2-4SO ________________g;(2)8g 氧气为________mol,0.1mol 氧气共有__________mol 电子;(3)在60g 碳中,所有碳原子的最外层电子数共为________个,质子的总数为_______________个。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的量知识点小结
有关概念:
1、物质的量(n)
①物质的量是国际单位制中七个基本物理量之一。
②用物质的量可以衡量组成该物质的基本单元(即微观粒子群)的数目的多少,它的单位是摩尔,即一个微观粒子群为1摩尔。
③摩尔是物质的量的单位。
摩尔是国际单位制中七个基本单位之一,它的符号是mol。
④ “物质的量”是以摩尔为单位来计量物质所含结构微粒数的物理量。
⑤摩尔的量度对象是构成物质的基本微粒(如分子、原子、离子、质子、中子、电子等)或它们的特定组合。
如1molCaCl2可以说含1molCa2+,2molCl-或3mol阴阳离子,或含
54mol质子,54mol电子。
摩尔不能量度宏观物质,如果说“1mol氢”就违反了使用准则,
因为氢是元素名称,不是微粒名称,也不是微粒的符号或化学式。
⑥使用摩尔时必须指明物质微粒的名称或符号或化学式或符号的特定组合。
2.阿伏加德罗常数(N A):
①定义值(标准):以0.012kg(即12克)碳-12原子的数目为标准;1摩任何物质的指定微粒所含的指定微粒数目都是阿伏加德罗常数个。
②近似值(测定值):经过科学测定,阿伏加德罗常数的近似值一般取6.02×1023,单位是mol-1,用符号N A表示。
3.摩尔质量(M):
①定义:1mol某微粒的质量
②定义公式:,
③摩尔质量的单位:克/摩。
④数值:某物质的摩尔质量在数值上等于该物质的原子量、分子量或化学式式量。
⑤注意:摩尔质量有单位,是克/摩,而原子量、分子量或化学式的式量无单位。
4.气体摩尔体积(V m)
①定义:在标准状况下(0℃,101kPa时),1摩尔气体所占的体积叫做气体摩尔体积。
②定义公式为:
③数值:气体的摩尔体积约为22.4升/摩(L/mol)。
④注意:对于气体摩尔体积,在使用时一定注意如下几个方面:一个条件(标准状况,符号SPT),一个对象(只限于气体,不管是纯净气体还是混合气体都可),两个数据(“1摩”、“约22.4升”)。
如“1mol氧气为22.4升”、“标准状况下1摩水的体积约为22.4升”、“标准状况下NO2的体积约为22.4升”都是不正确的。
⑤理解:我们可以认为22.4升/摩是特定温度和压强(0℃,101kPa)下的气体摩尔体积。
当温度和压强发生变化时,气体摩尔体积的数值一般也会发生相应的变化,如273℃,
101kPa时,气体的摩尔体积为44.8升/摩。
5.阿伏加德罗定律
阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
阿伏加德罗定律及推论适用的前提和对象:可适用于同温、同压的任何气体。
6.阿伏加德罗定律的有关推论:
(其中V、n 、p、ρ、M分别代表气体的体积、物质的量、压强、密度和摩尔质量。
)
同温同压下:;
7.标准状况下气体密度的计算
根据初中所学知识,密度=质量÷体积,下面我们取标准状况下1mol某气体,则该气
体的质量在数值上等于摩尔质量,体积在数值上等于摩尔体积,所以可得如下计算公式:标况下气体的密度(g·L-1)=气体的摩尔质量(g·mol-1)÷标况下气体的摩尔体积(L·mol-1)。
8.物质的量浓度
浓度是指一定温度、压强下,一定量溶液中所含溶质的量的多少。
常见的浓度有溶液中溶质的质量分数,溶液中溶质的体积分数,以及物质的量浓度。
①定义:物质的量浓度是以单位体积(1升)溶液里所含溶质B的物质的量来表示溶液组成的物理量。
②定义公式为:
③单位:常用mol/L
④注意:溶液体积的计算及单位
9.溶液的物质的量浓度与溶液中溶质质量分数ω及溶液密度ρ(g·cm-3)之间的关系:
10.易混淆的概念辨析
①物质的量与摩尔:“物质的量”是用来计量物质所含结构微粒数的物理量;摩尔是物质的
量的单位。
②摩尔质量与相对分子质量或相对原子质量:
摩尔质量是指单位物质的量的物质所具有的质量,它是一个有单位的量,单位为
g·mol-1;相对原子质量或相对分子质量是一个相对质量,没有单位。
摩尔质量与其相对原子质量或相对分子质量数值相同。
③质量与摩尔质量:质量是国际单位制中7个基本物理量之一,其单位是kg;摩尔质量是1摩尔物质的质量,其单位是g·mol-1;二者可通过物质的量建立联系。
二、物质的量的有关计算
1、关于物质的量浓度的计算。
计算时运用的基本公式是:
溶质的质量分数与物质的量浓度两浓度基本公式的换算关系:
溶质的质量分数物质的量浓度
定义
用溶质的质量占溶液质量的百分比表示的浓度以单位体积溶液里所含溶质B
的物质的量来表示溶液组成的物理量,叫做溶质B 的物质的量浓度。
表达式特点溶液的质量相同,溶质的质量分数也相同的任何溶液里,含有溶质的质量都相同,但
是溶质的物质的量不相同。
溶液体积相同,物质的量浓度也相同的任何溶液里,含有
溶质的物质的量都相同,但是溶质的质量不同。
实例
某溶液的浓度为10%,指在
100g 溶液中,含有溶质10g 。
某溶液物质的量浓度为10mol/L ,指在1L 溶液中,含有
溶质10mol 。
换算
关系
3、一定物质的量浓度的稀释计算。
浓、稀溶液运算的基本公式是:
4.以物质的量为核心的换算关系
(1)N A 、M 、V m 、C 四个定义式的含义及相互换算关系:
(2)与物质的量有关的物理量知识总结。
