2020年全国高中化学竞赛(安徽赛区)初赛试题 精品
2020年全国高中化学竞赛(安徽赛区)初赛试题

XX年全国高中化学竞赛(安徽赛区)初赛试题一、本题包括25小题,每小题2分,共50分。
每小题有1个或2个选项符合题意。
若该题只有1个选项合题意,多选或错选均不得分。
若该题有2个选项合题意,选对1个得1分,选对2个得2分;选错1个,该题不得分。
1•我国有些煤矿的坑道中具有丰富的可燃性气体。
目前已建成利用坑道气的发电厂,这样既充分利用了能源,又保证了煤矿的安全生产,坑道中的可燃性气体是A. H 2B.COC.CH 4D. CH 4 和CO 的混合气体2. A是烷烃,B是单烯烃,B分子中的碳原子数比A分子中多。
常温下1L该混合气体充分燃烧可得到同温同压下的二氧化碳气体 2.5L,则原混合气体中A和B的组合方式可能有A. 2和B.3和C.4和D.5和3•某种混合气体,可能含有N2、HCl、CO。
把混合气体依次通过足量的NaHCO3溶液和灼热的CuO ,气体体积都没有变化;再通过足量的Na2O2固体,气体体积减小;最后通过灼热的铜丝,经充分反应后气体体积又减小,但还有气体剩余。
以下对混合气体组分的判断中,正确是A. 一定有N2、HCl,没有COB. 一定有N2, CO和HCI中至少有一种C.一定有N2、CO和HClD. 一定没有N2, CO和HCI中至少有一种4•设硫酸为二元强酸,现有0.01mol/LH 2SO4溶液滴定0.01mol/L NaOH 溶液,中和后加至100mL。
若滴定终点判断有误差:①多加了1滴H2SO4溶液;②少加了1滴H2SO4溶液(1滴溶液的体积约为0.05mL ),则①和②两种情况下溶液中[H +]之比的值是A. 10B.50C.5 X 103D. 1045.下列电子排布式中,属于第121号元素的是A. [118]5g 18s2B.[118]8s 28p1C.[118]7d 18s2D.[118]6f 18s26•在呈强酸性的无色溶液中,能大量共存的离子组是A.Al 3+、Cu2+、SO42-、Cl-B.Na +、K+、CO32-、NO3-C.NH 4+、Mg 2+、SO 42-、Cl -D.Ag +、Ca 2+、Cl -、NO 3- 7•已知在 pH 值为4左右的环境中,Ca 2+、Fe 2+几乎不水解,而Fe 3 +几乎完全水解。
安徽省高中化学竞赛初赛试题及答案

2004年全国中学生化学竞赛(安徽赛区)初赛试题一、本题包括25小题,每小题2分,共50分。
每小题有1个或2个选项符合题意。
若该题只有1个选项符合题意,多选或错选均不得分。
若该题有2个选项符合题意,选对1个得1分,选对2个得2分;选错1个,该题不得分。
1.下列卤素互化物中,最不稳定的是(A)ClI3(B)ClF3(C)BrF3(D)ICl32.下列各结构式中,最有可能的N2OLewis结构式为(A)N=N=O —O (C)N—(D)N=O=N3.下列各金属碳化物中,与水反应能生成C3H4的是(A)Be2C (B)Na2C3(C)Mg2C3(D)A14C34.在一定温度下,某浓度的硝酸与金属锌反应,生成NO2和NO的物质的量之比为1:3 则要使1摩金属锌完全反应,需要HNO3的物质的量为(A)0.8 (B)2.4 (C)2.6 (D)2.85.在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个带有理想活塞(即无质量、无摩擦力的刚性活塞)的体积可变的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g) A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡。
下列说法中正确的是(A)平均反应速度:乙>甲(B)平衡时nc(甲)>nc(乙)(C)平衡时C的转化率:乙>甲(D)平衡时A的物质的量甲>乙6.对手由CrO42—转化为Cr2O72—的下列各叙述中,正确的是(A)这是Lewis酸碱反应(B)这是氧化还原反应(C)加酸,该反应向右移动(D)加酸,该反应向左移动7.在水溶液中,KHSO3(aq)的电荷平衡式为(A)[H3O+]十[K+]=[OH—]+[HSO3—]+[SO32—](B) [H3O+]十[K+]=[OH—]+[HSO3—]+2[SO32—](C) [H3O+]十[K+]=[OH—]+[HSO3—]+1/2[SO32—](D) [H3O+]十2[K+]=[OH—]+[HSO3—]+2[SO32—]8.下列各组离子中,能在强碱性溶液中共存,且在滴加盐酸过程中会生成气体和沉淀的是(A)Na+、CrO2—、SO42—、CO32—(B)NH4+、A1O2—、SO42—、CO32—(C)K+、A1O2—、SO42—、HCO3—(D)K+、ZnO2—·、SO42—、CO32—9.已知Al和Ga是同族元素,且都是两性元素,并知A1(OH)3的碱性比Ga(OH)3大。
2020全国高中生化学竞赛(初赛)真题试卷及答案

全国高中学生化学竞赛(省级赛区)试卷第1题(7分)1-1 向硫酸锌水溶液中滴加适当浓度的氨水至过量,发生两步主要反应。
简述实验现象并写出两步主要反应的离子方程式。
无色溶液产生白色沉淀,后逐渐溶解(1分,如只写白色沉淀溶解不扣分,未表明白色,扣0.5分)(1)Zn2++2NH3+2H2O=Zn(OH)2↓+2NH4+(1分)写成如下形式均给分:Zn2++2NH3·H2O=Zn(OH)2↓+2NH4+[Zn(H2O)6]2++2NH3·H2O=Zn(OH)2↓+2NH4+ +6H2O[Zn(H2O)6]2++2NH3=Zn(OH)2↓+2NH4+ +2H2O (2)Zn(OH)2 + 2NH4+ +2NH3 = [Zn(NH3)4]2+ +2H2O如写成Zn(OH)2+4NH3= [Zn(NH3)4]2++2OH—也对,如产物写成[Zn(NH3)6]2+扣0.5分,因主要产物是[Zn(NH3)4]2+1-2 化合物[Cu(Pydc)(amp)] ·3H2O]的组成为C11H14CuN4O7,热重分析曲线表明,该化合物受热分解发生两步失重,第一个失重峰在200~250℃,失重的质量分数为15.2%。
第二个失重峰在400~500℃,失重后的固态残渣质量为原化合物质量的20.0%。
Pydc 和amp是含有芳环的有机配体。
通过计算回答:(1)第一步失重失去的组分。
水分子或H2O 3个水分子或3H2O C11H14CuN4O7的式量约377.8,失去3个水分子,失重质量分数理论值为14.3%。
1分(2)第二步失重后的固态残渣是什么,解释理由。
CuO或Cu2O的混合物(2分)理由:CuO、Cu2O及C11H14CuN4O7的式量分别为79.55、143.1和377.8。
若残渣为CuO,则失重质量分数为79.55/377.8=21.1%;若残渣为Cu2O,则质量分数为143.1/(377.8×2)=18.9%,实验值为20%介于两者之间,故残渣是两者的混合物。
2020年第34届全国中学生化学竞赛初赛试题及答案
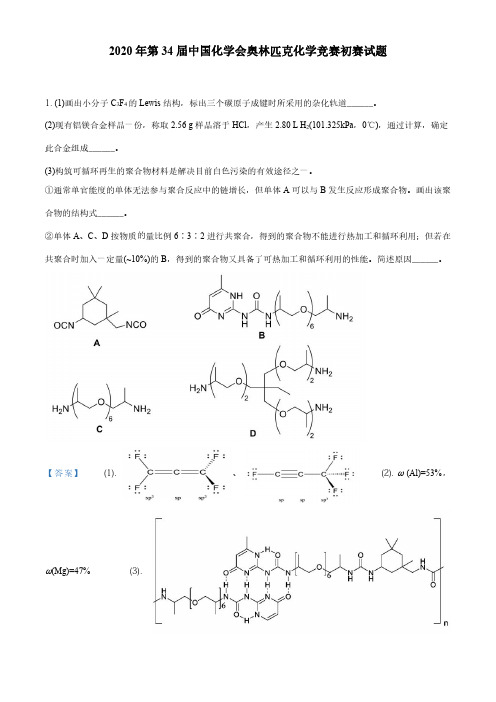
2020年第34届中国化学会奥林匹克化学竞赛初赛试题1.(1)画出小分子C3F4的Lewis结构,标出三个碳原子成键时所采用的杂化轨道______。
(2)现有铝镁合金样品一份,称取2.56g样品溶于HCl,产生2.80L H2(101.325kPa,0℃),通过计算,确定此合金组成______。
(3)构筑可循环再生的聚合物材料是解决目前白色污染的有效途径之一。
①通常单官能度的单体无法参与聚合反应中的链增长,但单体A可以与B发生反应形成聚合物。
画出该聚合物的结构式______。
②单体A、C、D按物质的量比例6∶3∶2进行共聚合,得到的聚合物不能进行热加工和循环利用;但若在共聚合时加入一定量(~10%)的B,得到的聚合物又具备了可热加工和循环利用的性能。
简述原因______。
【答案】(1).、(2).ω(Al)=53%,ω(Mg)=47%(3).(4).ACD 以题目比例聚合时,亲电基团与亲核基团比例为12:12,反应完全为稳定的结构,同时分子链之间有较强的氢键;加入少量的B 后,亲核基团氨基数目过剩,加热后可以发生酰胺交换反应,释放出D 中氨基,破坏原先的体状结构变为链状结构,B 的加入也使得链状分子内部的氢键数目增加,减少链间氢键作用,因此有热加工性能,高温下氢键断裂解除交联,以达到回收利用目的2.书写反应方程式(提示:要求系数为最简整数比;(1)和(2)中自然条件复杂,合理选择即可)。
(1)关于地球的演化,目前主要的观点是,原始地球上没有氧气,在无氧或氧气含量很低时,原核生物可利用自然存在的有机质(用CH 2O 表示)和某些无机物反应获得能量。
例如,24SO -和MnO 2可分别作为上述过程的氧化剂,前者生成黄色浑浊物,二者均放出无色无味气体。
①写出24SO -参与的释能反应的离子方程式______。
②写出MnO 2参与的释能反应的离子方程式______。
(2)约27亿年前光合作用开始发生,随着这一过程的进行,地球上氧气不断积累,经过漫长的演变终达到如今的含量。
全国高中化学竞赛初赛试题.docx

全国高中化学竞赛初赛试题(考试时间 3 小时,满分150 分)H元素周期表He 1.008 4.003 Li Be B C N O F Ne 6.9419.01210.8112.0114.0116.0019.008 Na Mg Al Si P S Cl Ar 22.9924.3126.9828.0930.9732.0735.4539.95 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.1040.0844.9647.8850.9452.0054.9455.8558.9358.6963.5565.3969.7272.6174.9278.9679.9083.80 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.4787.6288.9191.2292.9195.94[98]101.1102.9106.4107.9112.4114.8118.7121.8127.6126.9131.3Cs BaLa- Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn132.9137.3178.5180.9183.8186.2190.2192.2195.1197.06420[210][210][222] Fr Ra Ac - La[223][226]注意:答案必须写在答题卷上,写在试题卷上无效。
......................一、本题包括25 小题,每小题 2 分,共50 分。
每小题有 1 个或 2 个选项符合题意。
若该题只有 1 个选项合题意,多选或错选均不得分。
若该题有 2 个选项合题意,选对 1 个得 1 分,选对 2 个得 2 分;选错 1 个,该题不得分。
⒈我国有些煤矿的坑道中具有丰富的可燃性气体。
目前已建成利用坑道气的发电厂,这样既充分利用了能源,又保证了煤矿的安全生产,坑道中的可燃性气体是A.H 2B.COC.CH 4D. CH 4和 CO 的混合气体⒉ A 是烷烃, B 是单烯烃, B 分子中的碳原子数比 A 分子中多。
年全国中学生化学竞赛初赛试题

年全国中学生化学竞赛(安徽赛区)初赛试卷一、本题包括小题,每小题分,共分。
每小题有个或个选项符合题意。
若该题只有个选项符合题意,多选或错选均不得分。
若该题有个选项符合题意,选对个得分,选对个得分;选错个,该题不得分。
.下列卤素互化物中,最不稳定的是() () () ().下列各结构式中,最有可能的结构式为() ()().下列各金属碳化物中,与水反应能生成的是() () () ().在一定温度下,某浓度的硝酸与金属锌反应,生成和的物质的量之比为则要使摩金属锌完全反应,需要的物质的量为() () () ().在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个带有理想活塞(即无质量、无摩擦力的刚性活塞)的体积可变的密闭容器,两容器起始状态完全相同,都充有气体,若发生可逆反应() ()(),经一段时间后,甲、乙两容器反应都达到平衡。
下列说法中正确的是()平均反应速度:乙>甲()平衡时(甲)>(乙)()平衡时的转化率:乙>甲()平衡时的物质的量甲>乙.对手由—转化为—的下列各叙述中,正确的是()这是酸碱反应()这是氧化还原反应()加酸,该反应向右移动()加酸,该反应向左移动.在水溶液中,()的电荷平衡式为()[]十[][—][—][—]() []十[][—][—][—]() []十[][—][—][—]() []十[][—][—][—].下列各组离子中,能在强碱性溶液中共存,且在滴加盐酸过程中会生成气体和沉淀的是()、—、—、—()、—、—、—()、—、—、—()、—·、—、—.已知和是同族元素,且都是两性元素,并知()的碱性比()大。
若将等物质的量的的和溶于溶液中,然后再通入,则()()先沉淀()()和()同时沉淀出来()()先沉淀()无法判断两种沉淀的先后次序.在抢救大出血的病危病人时,常需静脉点滴.%氯化钠溶液(从俗称“生理盐水’’),是由于人体血液的“矿化度”(即无机盐的含量)为.%。
2020年高中学生化学竞赛试题及答案

2020年高中学生化学竞赛试题及答案2020年高中化学竞赛试题及答案一、选择题(本题包括9小题,每小题3分,共27分。
每小题只有一个选项符合题意。
)1.XXX成功进行了由地沟油生产的生物航空燃油的验证飞行。
区分地沟油和矿物油的方法是加入足量氢氧化钠溶液共热,不分层的是地沟油。
2.化学在工业生产和日常生活中有着重要的应用。
下列说法正确的是CO2、NO2和SO2都是酸性氧化物,都是大气污染物。
3.下列操作能够实现实验目的的是:向饱和氯化钠溶液中滴加一滴酚酞指示剂,再滴加盐酸至红色消失。
4.下列关于有机物的说法中,正确的一组是:①淀粉、油脂、蛋白质在一定条件下都能发生水解反应;②除去乙酸乙酯中残留的乙酸,可加入过量饱和碳酸钠溶液,振荡后静置分液;③淀粉遇碘酒能变蓝色,葡萄糖能与新制氢氧化铜悬浊液反应。
5.NA为阿伏加德罗常数,下列各项叙述中正确的是:0.2 XXX完全分解转移的电子数为0.4NA。
6.25℃时,对于浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②NaOH溶液、③CH3COONa溶液,下列说法错误的是:②和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
删除无关或重复的段落。
改写如下:1.XXX成功进行了由地沟油生产的生物航空燃油的验证飞行。
区分地沟油和矿物油的方法是加入足量氢氧化钠溶液共热,不分层的是地沟油。
2.化学在工业生产和日常生活中有着重要的应用。
下列说法正确的是CO2、NO2和SO2都是酸性氧化物,都是大气污染物。
4.下列关于有机物的说法中,正确的一组是:①淀粉、油脂、蛋白质在一定条件下都能发生水解反应;②除去乙酸乙酯中残留的乙酸,可加入过量饱和碳酸钠溶液,振荡后静置分液;③淀粉遇碘酒能变蓝色,葡萄糖能与新制氢氧化铜悬浊液反应。
5.NA为阿伏加德罗常数,下列各项叙述中正确的是:0.2 XXX完全分解转移的电子数为0.4NA。
6.25℃时,对于浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②NaOH溶液、③CH3COONa溶液,下列说法错误的是:②和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
2020年全国高中学生化学竞赛(初赛)试卷

2020年全国高中学生化学竞赛(初赛)试卷第一题次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物A。
经鉴定:反应后的溶液是磷酸和硫酸的混合物;X射线衍射证实A是一种六方晶体,结构类同于纤维锌矿(ZnS), 组成稳定;A的主要化学性质如下:(1)温度超过60℃,分解成金属铜和一种气体;(2)在氯气中着火;(3)与盐酸应放出气体。
1)写出A的化学式。
2)写出A的生成反应方程式。
3)写出A与氯气反应的化学方程式。
4)写出A与盐酸反应的化学方程式。
第二题PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3g/L, 极性为零,P—Cl键长为204pm和211pm两种。
继续加热到250℃时测得压力为计算值的两倍。
PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P—Cl的键长为198pm 和206pm两种。
(P、Cl相对原子质量为31.0、35.5)(1) 180℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
(2) 在250℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
(3) P Cl5熔体为什么能导电?用最简洁的方式作出解释。
(4) PBr5气态分子结构与PCl5相似,它的熔体也能导电,但经测定其中只存在一种P-Br键长。
PBr5熔体为什么导电?用最简洁的形式作出解释。
第三题用黄铜矿炼铜按反应物和生成物可将总反应可以写成:CuFeS2 + SiO2 + O2→Cu + FeSiO3 + SO2事实上冶炼反应是分步进行的。
(1)黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;(2)硫化亚铁在氧气作用下生成氧化亚铁,并与二氧化硅反应生成矿渣;(3)硫化亚铜与氧气反应生成氧化亚铜;(4)硫化亚铜与氧化亚铜反应生成铜。
1)写出上述各个分步反应的化学方程式。
(1)(2)(3)(4)2)给出总反应方程式的系数。
2021―2021年全国高中化学竞赛(安徽赛区)初赛试题及答案

2021―2021年全国高中化学竞赛(安徽赛区)初赛试题及答案2021年全国中学生化学竞赛(安徽赛区)初赛试题注意:考试时间2.5小时,满分150分。
请在答题卡上答题,允许使用非编程计算器。
一、本题包括15小题,每小题2分,共30分。
每小题仅有1个选项符合题意。
1.下列生活常识与化学原理有关,正确的选项是①福尔马林具有防腐杀菌的作用,是因为甲醛可以使蛋白质变性②人体血液pH保持弱碱性(7.35-7.45),主要是血液中存在H2CO3―HCO3缓冲体系③硫酸亚铁补铁剂应与维生素C同服,是因为维生素C可以防止Fe2+被氧化④油炸食品容易产生“哈喇”味而不能食用,是因为被氧化产生过氧化物和醛类 A.①②③④B.①②③C.②③④D.①③④-2.缺铁性贫血是世界上最普遍的营养性问题,一个简单的解决办法是生产铁强化酱油,即在酱油中加入易吸收的铁添加剂――Na2FeY,其中Y4-是乙二胺四乙酸(H4Y)的酸根形式,H4Y结构如下左图。
生产铁强化酱油产生的废水可用绿色消毒剂X(如下右图)来杀菌。
下列有关说法正确的是A.从酸碱质子理论来说,H4Y只有酸性 B.X能够杀菌的原因是其水解可产生次氯酸C.H4Y和X在一定条件下均能发生水解反应 D.可用萃取法从铁强化酱油中分离出Na2FeY3.某未知溶液可能含Cl、CO32-、Na+、SO42-、Al3+等离子中的一种或多种。
将溶液滴在蓝色石蕊试-纸上.试纸变红。
取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。
下列判断不合理的是...A.一定有Cl B.一定有SO42- 4.下列有关实验操作中错误的是..-C.一定有Al3+D.一定没有CO32-A.萃取分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出B.检查容量瓶是否漏水的方法是:往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180°,再倒过来,看是否漏水2021-2021年化学竞赛(安徽赛区)初赛试题第1页共26页C.为加速固体物质的溶解常采取搅拌、加热等措施D.酸式滴定管装入标准溶液前,必须用蒸馏水润洗三次,不得用标准溶液润洗5.“酸化”是实验中经常采用的方法,下列酸化过程正确的是 A.增强高锰酸钾的氧化能力,用浓盐酸酸化 B.抑制Fe2+的水解,用稀硝酸酸化C.检验卤代烃中的卤元素,加碱溶液并加热后,用稀硫酸酸化,再检验 D.确认溶液中含有SO42-时,用盐酸酸化,再检验6.近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2001年全国高中化学竞赛(安徽赛区)初赛试题(考试时间3小时,满分150分)注意:⒈本试卷分试题卷和答题卷两部分,所有的答案必须写在答题卷上,写在试题卷...................上无效...。
⒉考生开始答题前,请先将答题卷上密封线内的项目填写完整。
⒊有关计算中,请遵循近似数计算法则。
一、本题包括5小题,每小题1分,共5分。
每小题只有一个选项符合题意。
⒈下列各组离子中,能大量共存的是A.H+、Cl-、HPO42-、K+B.OH-、Zn2+、Al3+、Mn2+C.OH-、HPO42-、Na+、SO42-D.OH-、CO32-、AlO2-、Na+⒉现有X、Y、Z、W四种主族元素。
若X的阳离子与Y的阴离子具有相同的电子层结构,W的阳离子的氧化性大于等电荷的X的阳离子的氧化性,Z的阴离子半径大于等电荷的Y的阴离子半径,四种元素的原子序数由大到小的顺序正确的是A.Z>X>Y>WB.W>X>Y>ZC.X>Z>Y>WD. Z>Y>X>W⒊下列离子方程式中,正确的是A.2Fe3++Cu=2F2++Cu2+B.H2S+Pb2++2Ac-=PbS↓+2HAcC.MnO4-+3H2O2+6H+=2Mn2++2O2+6H2O(H2O2只作还原剂)D.4F2++ O2+ 2H2O=4Fe3++4OH-⒋从元素周期表中每一周期最后一个元素的原子序数为2、10、18、36、54……,推测第十周期最后一个元素的原子序数为A.200B.770C.290D.292⒌下列各高氯酸盐中,受热或剧烈撞击能发生强烈爆炸的是A.NaClO4B.Mg(ClO4) 2C.Fe(ClO4) 2D.NH4ClO4二、本题包括15小题,每小题3分,共45分。
每小题有1个或2个选项符合题意。
若该题只有1个选项合题意,多选、少选或错选均不得分。
若该题有2个选项合题意,选对1个得1分,选对2个得3分;选错1个,该题不得分。
⒍固体NH4I放入真空的密闭容器中,加热至一定温度后恒温,发生下列反应:NH 4I(s) NH 3(g)+HI(g) 2HI(g)H 2(g)+ I 2 (g)平衡时,测得总压为5.00kPa ,其中H 2的分压为0.50kPa 。
则下列说法中正确的是A.固体NH 4I 一定全部分解B.若开始放入固体NH 4I 的量增大一倍,则平衡时总压也会增大一倍C.平衡时HI 的分解率为20%D. 平衡时氨的分压为2.50kPa⒎现有一种镁、铝、硅合金,已知等质量的合金与过量的盐酸溶液或过量的氢氧化钠溶液反应,所得的氢气质量相等,则此合金中Mg 、Al 、Si 的物质的量之比为A.2:3:1B.2:1:1C.2:2:1D.2:x:1(x ≥0)⒏6.54g 锌被0.025mol 稀HNO 3恰好完全氧化,则的HNO 3还原产物是A.N 2B.N 2OC. N 2H 5NO 3D. NH 4NO 3⒐在25℃时,纯水的电离度为α1,pH=3的醋酸中水的电离度为α2,pH=11的氢氧化钠溶液中水的电离度为α3。
若将上述醋酸溶液和氢氧化钠溶液等体积混合,所得溶液中水的电离度为α4,则下列关系正确的是A.α1<α3<α2<α4B.α3<α2<α1<α4C.α2=α3<α1<α4D.α2=α3<α4<α1⒑在配平的N 2H 4+ MnO 4-+H +→N 2+ Mn 2++H 2O 的方程式中,H 2O 分子前面的系数为A.6B.10C.12D.16⒒在碘化钠存在下,环己烯与溴反应的产物是A.1,2-二溴环己烷B. 1,2-二溴环己烷和1,3-二溴环己烷C. 1-溴-2-碘环己烷和1,2-二溴环己烷D. 碘代环己烷和1,2-二溴环己烷 ⒓在相同温度下,等体积、等物质的量浓度的下列溶液①Na 2SO 4②H 2SO 3③NaHSO 3④Na 2S 中,所含带电微粒数由多到少的顺序为A.④>①>③>②B.①>④>③>②C.①=④>②=③D.④=①>③>② ⒔下列每组中各有三对化合物,其中都能用分液漏斗进行分离的是A.乙酸乙酯和水、甲醇和水、乙醚和水B. 1,2-二溴乙烷和水、溴苯和水、硝基苯和水C.甘油和水、乙醛和水、乙酸和乙醇D.四氯化碳和水、甲苯和水、己烷和水 ⒕下列各组物质中,必须用其它试剂才能鉴别出来的是A.CuSO 4、CaCl 2、KAl(SO 4)2、Na 2CO 3B.CuSO 4、CaCl 2、KAl(SO 4)2、NaClC.CuSO 4、Cu(NO 3)2、KAl(SO 4) 2、CaCl 2D.CuSO 4、MgSO 4、NaCl 、NaNO 3 ⒖设计一种高效新灭鼠剂3-氯-1,2-丙二醇的合成路线,除需用原料H 2O 、Cl 2外,还需要A.ClCH 2 CH 2 CH 2OHB. CH 2=CH -CH 2OHC. CH 2CH CH 2OH D. CH 2CH Cl OH HO CH 2⒗将硫酸钾、硫酸铬(Ⅲ)和铬矾三种盐溶液于硫酸酸化的水中,测得[K +]=0.025mol ·dm -3,[Cr 3+]=0.015mol ·dm -3,溶液的pH=1。
假设溶液中硫酸完全电离成H +离子和SO 42-离子,则[SO 42-]为A. 0.035mol ·dm -3B. 0.070mol ·dm -3C. 0.085mol ·dm -3D. 0.140mol ·dm -3 N HSO 3-⒘环己基氨基磺酸钙[ ]2Ca2+约比蔗糖甜30倍,曾广泛用于食品中,但近年来发现它能致癌而禁止使用。
下列溶剂中不能溶解该化合物的是A.H2OB.CH3OHC.CHCl3D. CH3 CH2 CH2 CH2 CH2 CH3⒙医学专家提出人体中细胞膜内的葡萄糖和细胞膜外的富氧液体与细胞膜构成了微型的生物原电池,有关该原电池的下列说法中,正确的是A.正极的电极反应可能是O2+4e→2O2-,且正极附近溶液的pH值升高。
B.正极的电极反应可能是O2+2H2O +4e→4OH-,且正极附近溶液的pH值降低。
C.负极反应主要是C6H12O6-12e→6CO+12H+,且负极附近溶液的pH值降低。
D.负极反应主要是C6H12O6+12OH--12e→6CO2+6H2O,且负极附近溶液pH值降低。
⒚无机苯B3N3H6(B、N原子在环中交替排列)的三氯取代物的几何异构体数目为A.4B.6C.8D.10⒛用硝酸银溶液和碘化钠溶液来制备AgI溶胶,根据反应物的用量不同,AgI胶粒可以带正电荷,也可以带负电荷。
当100mL、0.10mol·dm-3的硝酸银溶液和120mL、0.10mol·dm-3的碘化钠溶液反应制备的AgI溶胶中,加入下列同体积、同物质的量浓度的电解质溶液,使溶胶聚沉最快的是A.NaClB.MgCl2C.Al2(SO4)3D.Na2SO4三、本题包括5小题,每小题3分,共15分。
每小题有1个或2个选项符合题意。
若该题只有1个选项合题意,多选、少选或错选均不得分。
若该题有2个选项合题意,选对1个得1分,选对2个得3分;选错1个,该题不得分。
21. 美国加州爱德华空军研究实验室研究高能物质的化学家Christe及同事,合成了一个多世纪以来第一个可以分离的量的包含N5+阳离子的新全氮类化合物。
下列有关N5+阳离子性质的叙述中,正确的是A. N5+阳离子的氧化性比O2+阳离子的氧化性更强B. N5+阳离子的盐可以在有机溶剂中制得C. N5+阳离子的盐可以在液态氟化氢溶剂中制得D.在N5+阳离子中氮是靠分子间作用力连接的22. 1999年诺贝尔奖获得者艾哈迈德·泽维尔研究了氰化碘的分解反应2ICN=I2+(CN)2,他发现此反应在200飞秒(1飞秒=10-15秒)内完成,氰气称为类卤素,则下列有关ICN的叙述正确的是A. ICN晶体是原子晶体B. ICN能与NaOH溶液反应C. ICN是共价化合物D. ICN在常温常压下一定是气体23. 在0.100mol·dm-3Na(NH4)2PO4溶液中,正确的关系式为A.[Na+]+[ NH4+]+[ NH3]=[H3PO4]+[H2PO4-]+[HPO42-]+[PO43-]B. [H+]+[Na+]+[ NH4+]=[OH-]+[H2PO4-]+[HPO42-]+[PO43-]C. [H+]+3[H3PO4]+2 [H2PO4-]+[HPO42-]=[OH-]+[ NH4+]D. [H3PO4]+[H2PO4-]+2[HPO42-]+3[PO43-]=0.100mol·dm-324. S8分子的空间几何构型呈皇冠型(。
下列分子中,与S8分子具有相同的几何构型的是A.Se n S8-nB.(SNH)4C. (NSH)4D.S4N425. 下列关于化合物CH3-CH=CH-C≡C-CH3说法中,正确的是A.6个碳原子都在一条直线上B. 6个碳原子不可能都在一条直线上C.6个碳原子都在同一平面上D. 6个碳原子不可能在同一平面上四、本题包括6小题,共39分。
26.(11分)当前对饮用水进行消毒的一种较好消毒剂为ClO2。
制备它的一种方法是电解NaCl溶液,用电解产物制成NaClO3,然后用草酸还原NaClO3制得ClO2。
⑴写出NaCl溶液电解反应的化学方程式。
⑵写出制备NaClO3的化学反应方程式并注明反应条件。
⑶写出NaClO3与草酸反应的离子方程式。
⑷若电流强度为1000安培,电解8.0小时,能制备多少千克ClO2?(需计算过程)⑸如何分离ClO2?反应后剩余溶液能否再利用?27.(4分)将24.51gKClO3加热后冷却,发现固体生成物的质量和元素组成比均与反应前的KClO3相同。
把生成物加水溶解后,滴入过量硝酸银溶液,生成7.168g白色沉淀。
⑴写出KClO3受热反应的化学方程式。
⑵在生成物的溶液中,为什么滴加过量硝酸银溶液,只能得到7.168g白色沉淀?28.(5分)柠檬果汁中含有维生素C(C6H8O6,简写成V c)是个还原剂,它能被I2氧化生成C6H6O6。
当前市场上测定柠檬果汁中V c含量的方法是取10.00mL果汁,用醋酸酸化,再加入20.00mL 0.02500 mol·dm-3标准碘溶液,然后以淀粉溶液作指示剂,最后用0.01000 mol·dm-3Na2S2O3标准溶液滴定过量的I2,消耗Na2S2O3溶液10.00mL。
