第2章 气体、溶液和胶体
1.气体、溶液和胶体

N2 12dm3 3MPa
P(O2) =3MPa,P(N2) =2MPa; V(O2) =10.8dm3,V(N2) =7.2dm3
Department of Chemistry, College of Science, HAU
练习
1.在298K 10.0L的容器中含有1.00mol N2和3.00mol H2,设气体为理想气体, 试求容器中的总压和两气体的分压。
解:(1)设血红素的摩尔质量为M。
mRT mRT π= ,M = MV πV 1.00g × 8.314kPa ⋅ L ⋅ K −1 ⋅ mol −1 × 293K M= −3 0.366KPa ×100 ×10 K 4 −1 = 6.66 × 10 g ⋅ mol
Department of Chemistry, College of Science, HAU
胶粒运动时的滑动面 B
- - - - - -
电 势
φ
ξ
M A 扩散层C 吸附层 距离 胶粒与介质之间的双电层及电势差
Department of Chemistry, College of Science, HAU
(2)溶胶的聚沉 ①电解质对溶胶的聚沉作用 ②溶胶的相互聚沉 ③温度对溶胶稳定性的影响 ④溶胶浓度的影响
Department of Chemistry, College of Science, HAU
三、稀溶液的依数性
1.溶液的蒸气压下降 △P=P* -P , P=P*·xA △P=P= K·b(B) 2.溶液的沸点升高 △Tb=Tb-Tb* , △Tb=Kb·b(B) 3.溶液的凝固点下降 △Tf=Tf* -Tf, △Tf=Kf·b(B) 4.溶液的渗透压 πV=nRT,π=cRT, π=b(B)RT
第2章溶液与胶体1

MB
2020/5/28
上一页
下一页
10
本章目录
【例】:已知浓硫酸的密度ρ为1.84g/ml, 其质量分数为95.6%,一升浓硫酸中含有的 n(H2SO4)、n(1/2H2SO4)、c(H2SO4)、c(1/2 H2SO4)各为多少?
解: n(H2SO4) = 1.84×1000×0.956/98.08
xi
ni n
【例】:将10克NaOH溶于90克水中,求此溶液的物质 的量分数浓度。
解: n(NaOH) =10/40 = 0.25 (mol) n(H2O) = 90/18 = 5(mol) x (NaOH) = 0.25 /(0.25+5) = 0.048
2020/5/28
上一页
下一页
12
本章目录
5、质量浓度 ρB = mB / V
6、质量摩尔浓度
定义:指1 kg 溶剂中所含溶质的物质的量表示为 质量摩尔浓度,符号b(B) ,单位为:mol/kg
bB = nB/mA= mB / (MB ·mA)
【例】:250克溶液中含有40克NaCl,计算此溶液的 质量摩尔浓度。
解: 水的质量=250-40 = 210(克)
2020/5/28
上一页
下一页
14
本章目录
2.3 稀溶液的依数性
2020/5/28
上一页
下一页
15
本章目录
溶液的性质 ①与溶质本性有关,如酸碱性、导电性、颜色等。 ②与溶质本性无关,只与溶质的数量有关。
依数性:只与溶质粒子的数目有关而与溶质本性无关
的性质称为溶液的依数性。溶液的依数性只有在溶液的 浓度很稀时才有规律,而且溶液越稀,其依数性的规律 性越强。
第二章 胶体溶液(2011.9)

丁达尔现象(Tyndall)——一束波长大于溶胶分散相粒子 尺寸的入射光照射到溶胶系统,可发生散射现象
光源 透镜
溶胶 丁达尔效应
丁达尔现象
丁达尔现象的产生与胶粒大小和入射光波长 有关。
产生原因:胶粒直径小于可见光波长 (400nm~700nm),当可见光照射在胶粒上 时产生的散射作用。
丁铎尔现象
乳状液的类型主要取决于乳化剂 一般来说,亲水性较强的乳化剂易形成O/W型乳状液
亲油性较强的乳化剂易形成W/O型乳状液
水
油
油
水
O/W型乳状液
W/O型乳状液
乳化作用在医学上的意义
乳状液和乳化作用在医学上有重要的意 义。
油脂在体内的消化吸收过程中,依赖于 胆汁中胆汁酸盐的乳化作用。医药学中乳状 液称为乳剂。药用油类常需乳化后才能作为 内服药,如鱼肝油乳剂。此外,消毒和杀菌 用的药剂也常制成乳剂,如煤酚皂溶液。
++ +
++
+++
++ +
+
++
–
+++
电泳
(2)电渗-在外电场作用下,限制胶粒不能移动, 而液体介质发生定向移动的现象。
+– +– +– +– +– +– +– +– +– +– +– +– +– +– +–
–+ –+ –+ –+ –+ –+ –+ –+ –+ –+ –+ –+ –+ –+ –+
(完整版)第二章化学物质及其变化必背知识点

第二章化学物质及其变化知识清单一、物质的分类1. 元素的存在形式有两种,分别是什么?游离态(单质)、化合态(化合物)2.从熔沸点角度看,纯净物和混合物有何差别?纯净物有固定的熔沸点,混合物没有3.只含一种元素的物质一定是纯净物吗?不一定;如氧气与臭氧、石墨与金刚石组成的都是混合物4.从与酸或碱反应的情况看,氧化物是如何分类的。
酸性氧化物:与碱反应生成盐和水的氧化物(如CO2、SO2、SO3、P2O5)碱性氧化物:与酸反应生成盐和水的氧化物(如Na2O、CaO)不成盐氧化物:既不与酸反应,也不与碱反应的氧化物(如CO、NO)5.酸性氧化物一定是非金属氧化物吗?不一定,如Mn2O7非金属氧化物一定是酸性氧化物吗?不一定,如CO、NO碱性氧化物一定是金属氧化物吗?是金属氧化物一定是碱性氧化物吗?不一定,如Al2O3、Mn2O76.酸碱盐是如何定义和再分类的?酸的定义:在水溶液中电离出的阳离子都是H+的化合物。
酸可以分为强酸与弱酸;或含氧酸与无氧酸;或一元酸与多元酸;或氧化性酸与非氧化性酸等;碱的定义:在水溶液中电离出的阴离子全是OH-的化合物。
碱可以分为强碱与弱碱;或一元碱与多元碱等。
盐的定义:由金属阳离子(或铵根离子)与酸根离子组成的化合物盐可以分为正盐与酸式盐;或可溶性盐与难容性盐等盐的溶解性:钾钠硝铵全都溶,盐酸不溶银亚汞;硫酸难容钡和铅,碳酸只溶钾钠铵;钙银硫酸盐微溶;亚硫酸盐似碳酸。
7. 常见物质俗名和化学式生石灰:CaO 熟石灰:Ca(OH)2 石灰石:CaCO3碱石灰:CaO+NaOH烧碱(苛性钠):NaOH 纯碱(苏打):Na2CO3小苏打:NaHCO38.分散系如何分类的?分类的标准是什么?分散系分为溶液、胶体和浊液;分类的标准是分散质粒子的直径大小:其中小于1-100nm属于溶液,1-100nm之间的属于胶体,大于100nm的属于浊液。
9.常见的胶体有哪些?云、烟、雾、牛奶、豆浆、河水、血液、有色玻璃等10.胶体有哪些性质?丁达尔效应、聚沉、电泳、渗析使胶体聚沉的方法有哪些?加热、搅拌、加入电解质溶液、加入胶粒带相反电荷的胶体。
大一化学溶液与胶体知识点

大一化学溶液与胶体知识点在大一的化学学习中,溶液与胶体是两个重要的概念。
本文将详细介绍溶液和胶体的定义、特点、分类以及相关的知识点。
一、溶液的定义和特点溶液是由溶质和溶剂组成的一种均匀混合物。
其中,溶质是指能够被溶解的物质,溶剂是指能够溶解其他物质的介质。
溶液具有以下特点:1. 透明度:溶液通常呈透明状态,能够使光线通过。
2. 溶解度:溶液中溶质的溶解度是指单位溶剂中最多能溶解多少溶质。
不同的溶质在不同的溶剂中具有不同的溶解度。
3. 浓度:溶液的浓度是指单位溶液中溶质的量。
常用的浓度单位包括摩尔浓度和质量浓度等。
二、溶液的分类根据溶剂的性质,溶液可以分为以下几种类型:1. 水溶液:以水作为溶剂的溶液称为水溶液。
例如,盐水和糖水都属于水溶液。
2. 非水溶液:以非水溶剂作为介质的溶液称为非水溶液。
例如,乙醇溶液和二氧化碳溶液都属于非水溶液。
3. 气溶液:气体在液体中的溶液称为气溶液。
例如,碳酸氢钠溶液中的二氧化碳就是气体在水中的溶液。
三、胶体的定义和特点胶体是介于溶液与悬浊液之间的一种混合态物质。
在胶体中,溶质以极微小颗粒的形式分散在溶剂中,且能够长时间保持均匀分散状态。
胶体的特点包括:1. 稳定性:胶体具有较好的稳定性,即能够长时间保持分散状态,不易发生沉淀。
2. 散射性:胶体溶液能够散射光线,呈现浑浊的外观。
3. 过滤性:胶体溶液不能通过常规的过滤器进行过滤,只能通过特殊的方法进行分离。
四、胶体的分类根据溶剂与溶质的相态、形状和粒径大小等,胶体可以分为以下几种类型:1. 溶胶:溶剂为液体,溶质为固体的胶体称为溶胶。
例如,颜料溶液就是一种溶胶。
2. 凝胶:在溶胶基础上,加入适量的胶态剂后形成的胶体称为凝胶。
凝胶具有较高的黏稠度和凝固性质,可以保持形状。
3. 乳胶:溶剂为液体,溶质为固体或液体的胶体称为乳胶。
例如,牛奶是由水、脂肪、蛋白质等组成的乳胶。
4. 气溶胶:溶剂为气体,溶质为固体或液体的胶体称为气溶胶。
第2章 物质的聚集状态

第2章物质的聚集状态(3学时)2.1 概述2.2 理想气体2.3 溶液2.4 固体—晶体物质的聚集状态:气体、液体、固体以及超临界液体等物质的聚集状态物质由分子组成,在通常情况下,物质呈固态、液态和气态。
固体:有一定的体积和一定的形状液体:有一定的体积气体:没有固定的体积和形状。
组成物质的分子是不停地运动的,并且分子间存在着相互作用力(引力和斥力)。
固体内部粒子的相互作用力最强,液体次之,气体最弱。
2.1 概述1. 相态(phase):是物质的状态(或简称相,也叫物态)指一个宏观物理系统所具有的一组状态。
一个态中的物质拥有单纯的化学组成和物理特性(如密度、晶体结构、折射率等)。
2.相图表达一系列温度压力下的相平衡关系右图区:液相区,固相区,气相区和超临界区线:两相平衡区,S-L线(BD),S-G线(AB),L-G线(BC)点:三相共存点:B点,临界点:C点,Tc:临界温度,Pc:临界压力✧三相点:273.16K,610.75Pa ✧临界点:647.29K, 22.09MPa水的相图临界点与超临界态✧在临界点以下,气态和液态之间具有显著区别✧在临界点以上,这种区别将不复存在✧这种状态称为:超临界流体(supercritical fluid,简称SCF)如:水的临界点为T= 374.3℃,P c = 22.09MPa,c在此临界点以上,就处于超临界状态,该状态的水就称为超临界水。
超临界流体特点:具有液体和气体的优点,密度大,粘稠度低,表面张力小,有很强的溶解能力。
CO2:临界温度较低(Tc=364.2K),临界压力也不高(Pc=73.8MPa),无毒,无臭,不污染环境,实际工作中使用较多的事超临界流体。
如:用超临界CO:2从咖啡豆中除去咖啡因从烟草中脱除尼古丁大豆或玉米胚芽中分离甘油酯轻易穿过细菌的细胞壁,在其内部引起剧烈氧化反应,杀死细菌。
超临界流体在绿色化工工艺的开发研究中具有重要的价值。
其他聚集态当温度足够高时,外界提供的能量足以破坏分子中的原子核和电子的结合,气体就电离成自由电子和正离子,即形成物质的第四态——等离子态(plasma),电离气体。
高中化学 (大纲版)第三册 第二单元 胶体的性质及其应用 第二节胶体的性质及其应用(备课资料)

高中化学(大纲版)第三册第二单元胶体的性质及其应用第二节胶体的性质及其应用(备课资料)●备课资料一、胶体与溶液、浊液之间最本质的区别是什么?胶体与溶液、浊液之间最本质的区别是分散质粒子的大小不同。
溶液分散质直径<10-9 m,浊液分散质的直径是>10-7 m,而胶体的分散质直径介于二者之间。
溶液、胶体和浊液由于分散质粒子大小不同,而在性质上、外观上也有许多不同。
比较如下:二、胶体化学的研究历史人们在古代就接触和利用过很多种胶体。
例如,生活中遇到的面团、乳汁、油漆、土壤等,都属胶体范围。
1663年,卡西厄斯(Cassius)用氯化亚锡还原金盐溶液,制得了紫色的金溶胶。
从十九世纪初,人们开始了对胶体的科学研究。
1809年,列伊斯使用一支U型管,管底中部放一粘土塞子,盛水后通电。
他观察到粘土的悬浮粒子向阳极移动,而阴极一臂中的水位则上升。
这个实验证明了粘土粒和水两个相,带有相反的电荷,这种现象叫做“电泳”。
1827年,英国植物学家R·布朗(R·Brown,1773~1858)用显微镜观察水中悬浮的藤黄粒子,发现粒子不停顿地在运动着,后来人们就把胶体粒子所呈现的这个重要现象称作“布朗运动”。
1838年,阿歇森(Ascherson,德)在鸡蛋白的水溶液中加入一些橄榄油,使之呈悬浮的微滴。
他在研究这种油滴的行为时,看到鸡蛋白在油滴与水(介质)的界面上,形成了一层膜。
这一实验表明,在这种情况下蛋白质形成了几分子厚度的一层薄膜,而变得不能溶于水了,这种现象叫做“变性”作用,他同时还发现油滴在蛋白质的“保护”下也不能“聚结”了。
1845~1850年间,塞尔米(F·Selmi,意)对无机胶体作了系统的研究,包括AgCl溶胶的生成条件以及盐类对它的凝聚作用。
1857年,法拉第曾做试验,他使一束光线通过一个玫瑰红色的金溶胶。
这个溶胶原来也像普通的溶液一样是清澈的,但当光线射过时,从侧面可以看到在此溶胶中呈现出一条光路。
高一化学溶液和胶体知识点

高一化学溶液和胶体知识点化学是一门研究物质构成、性质和变化的科学,其中溶液和胶体是常见的物质形态。
在高一化学学习中,了解溶液和胶体的基本概念和特性非常重要。
一、溶液的组成和特性溶液是由溶质和溶剂组成的,溶质是少量被溶解物质,溶剂是大量溶解物质。
在溶液中,溶质和溶剂通过相互作用力相互结合。
溶液的特性包括:1. 浓度:指单位体积内溶质的含量。
常用的浓度单位有质量浓度、体积浓度等。
2. 饱和度:指在一定温度下,溶液中溶质的最大溶解度。
当溶质的溶解度达到最大值时,溶液为饱和溶液。
3. 溶解度:指溶质在一定温度下在溶剂中能够溶解的最大量。
溶解度与温度有关,一般来说,温度升高,溶解度会增大。
4. 溶解过程:溶质在溶剂中溶解的过程包括溶质分子离开晶体、溶质分子与溶剂分子相互作用和溶质分子在溶剂中均匀分布等。
二、溶液的分类和应用溶液可以按溶质和溶剂的性质进行分类。
1. 按溶质的性质分类:溶液可分为电解质溶液和非电解质溶液。
电解质溶液中溶质是能够导电的,如酸、碱、盐等;非电解质溶液中溶质不能导电,如糖水等。
2. 按溶剂的性质分类:溶液可分为水溶液和非水溶液。
水溶液中溶液以水为溶剂,非水溶液中以非水溶剂为溶剂,如乙醇溶液等。
溶液的应用非常广泛。
例如,生活中常用的酒精、盐水和果汁都是溶液,药品、染料等也常以溶液形式存在。
三、胶体的组成和特性胶体是溶质以分散相形式分布在溶剂中的混合物。
在胶体中,溶质颗粒的大小通常在1纳米到1000纳米之间,比溶液中的分子要大得多。
胶体的组成和特性包括:1. 分散相:胶体溶液中,分散相指的是溶质分子或颗粒。
分散相可以是固体、液体或气体。
2. 分散介质:分散相所分布的溶质。
分散介质可以是液体、固体或气体。
3. 胶体稳定性:胶体稳定性是指胶体保持均匀分散状态的能力。
胶体稳定性受到分散相相互作用力的影响。
4. 胶体的应用:胶体在许多领域中都有重要应用。
例如,胶体可以用作涂料、油墨、颜料等工业原料;胶体在医药领域具有重要的应用,如制备药物、人工器官等。
兰叶青 无机化学专业课考研复习第2章 溶液和胶体

p
pA* xB
p* A
nB nA nB
pA*
nB nA
Δp =
p A*·xB
=
pA*
nB=
nA
= pA*
nB mA / M A
pA*·bB·MA = K·bB
第二节
第二章
据此,拉乌尔定律又可表述为:一定温度下,难挥发 非电解质稀溶液的蒸气压下降与溶质的质量摩尔浓度 成正比。
若组成溶液的两组分间不产生相互作用,即在任
wB
mB m
第二节
第二章
2、物质的量浓度
物质的量浓度是指每升溶液中所含溶质B的物质
的量。物质的量浓度用符号cB或c(B)表示:
3、质量摩尔浓度
cB
nB V
1 kg 溶剂A中所含溶质B的物质的量,称为溶质 的质量摩尔浓度。溶b质B B的mnBA质量摩尔浓度用bB表示:
第二节
第二章
对于稀溶液,且要求不严格时,可用物质的量浓度近 似地代替质量摩尔浓度。
MB
Kb
mB mATb
MB
2.53
2.69 0.100 0.531
128
g·mol-1
第二节
第二章
3、凝固点下降
凝固点是指在一定的外压下,该物质的液相和固相 达到平衡共存时的温度。从蒸气压的角度而言,某物 质的凝固点就是固相蒸气压和液相蒸气压相等时的温 度。
△T f = K f ·b(B)
剂低的常凝数Tf是,固溶单点液位,的为Tf凝为K·固溶kg点液·m下的o降l凝–1,值固它,点与T;f 溶K=f是剂Tf溶的- T剂性f 的质,T有凝f 关固为点,纯降溶与 溶质的性质无关。
【例2-5】 有一蛋白质的饱和水溶液,每升含有蛋白 质5.18 g。已知在293.15 K时,溶液的渗透压为0.413 kPa。求算此蛋白质的摩尔质量。
第2章 溶液和胶体溶液

乳剂中常加入稳定剂且一般不宜久贮。
单位:
mB B = V
即:
SI单位为kg/m3,化学上常用g/L 或mg/L。
注意:
质量浓度与密度(ρ= m/V)的区别。
2017年6月 8
(三) 质量分数 • 符号:
• 物质B的质量分数为ωB
• 定义:
• 物质B的质量除以溶液的质量。 即: m
• 注意:
B =
B
m
• 质量分数的量值可用小数或百分数表示。但是溶 质和溶液的质量单位必须相同。 • 市售的硫酸、盐酸、硝酸、氨水等都用此种方法 来表示含量。
乳浊液
胶体分散系 溶胶
液体微粒
浑浊、不透明不 均匀、不稳定、 容易聚沉
由多分子聚集 透明度不一、不 成的胶粒 均匀、有相对稳 定性、不易聚沉 高分子 单个高分子 透明、均匀、稳 溶液 定、不聚沉 离子或分子 真溶液 低分子或离子 透明、均匀、稳 分散系 定、不聚沉 30 2017年6月
三、悬浊液和乳浊液在医学上的应用
一般实验室中用的比例浓度是溶质比溶剂。
2017年6月 13
(六)质量摩尔浓度
• 符号:
• 物质B的质量摩尔浓度为bB
• 定义:
• 溶液中物质B的物质的量除以溶剂的质量。即:
nB bB = • 单位:mol/kg。 m溶剂
2017年6月 14
(七)摩尔分数(物质的量分数)
符号:
物质B的摩尔分数为XB
(二)溶液的稀释
举例:现有φ B = 0.85和φ B = 0.05的酒精,怎样配制 0.75的酒精500 mL ? 解:根据十字交叉法:
配制方法:取φ B = 0.85酒精70 mL与φ B = 0.05酒精 10 mL,混合,得到80 mL φ B = 0.75 酒精,或者把φ B = 0.85与 φ B = 0.05的两种浓度的酒精按70:10(即 7: )的比例混合得到φ B = 0.75的酒精。 23 2017 年61 月
溶液与胶体知识点总结

溶液与胶体知识点总结一、溶液的概念及特点1. 溶液是两种或两种以上的物质均匀地混合在一起所形成的一种新物质。
其中,溶解于溶剂中的物质称为溶质,用来溶解其他物质的溶液称为溶剂。
溶质和溶剂共同组成的溶液称为多组分溶液。
2. 溶液的特点(1)均匀性:溶质在溶剂中均匀分布,形成均匀的溶液。
(2)透明性:溶液是透明的,因为溶质和溶剂的颗粒大小相仿,不能散射可见光。
(3)不能析出:溶液在一定条件下是稳定的,不会因物理条件的改变而析出溶质。
(4)不可过滤:溶质颗粒尺寸小,不能通过常规的过滤器进行分离。
3. 溶解度溶解度是指单位质量的溶剂在一定温度下能溶解最大量溶质,通常用溶质在100g溶剂中的溶解质量来表示。
溶解度随温度的变化而变化,温度升高,通常溶解度增大;温度降低,溶解度减小。
溶解度常常用曲线表示。
二、溶液的分类1. 按溶质的溶解度分为饱和溶液、过饱和溶液和不饱和溶液。
(1)饱和溶液:在一定温度下,加入的溶质全部溶解在溶剂中所得到的溶液。
(2)过饱和溶液:在一定温度下,加入的溶质全部溶解,待溶液冷却后,溶液中不能溶解的溶质再原料形成颗粒,导致溶液过饱和。
(3)不饱和溶液:在一定温度下,加入的溶质不能全部溶解在溶剂中所得到的溶液。
2. 按溶剂的性质分为气体溶液和固体溶液。
气体溶液:溶质与溶剂之间的相互作用力弱,不稳定,易溢出和失去溶质。
如二氧化碳溶于水;固体溶液:溶质与溶剂之间有较强的相互作用力,如常见的金银二十合金等。
三、溶液的制备方法1. 固体溶解于液体中:将固体溶质加入至液体溶剂中,搅拌并加热或者冷却,待溶质溶解于液体中形成溶液。
2. 液体溶解于液体中:两种液体混合后形成的一种新的液体。
3. 气体溶解于液体中:气体呈溶解状态,如二氧化碳溶解于水。
4. 溶液的浓度和稀释:溶液的浓度常用质量分数、摩尔浓度、体积分数等表示,可以通过加入溶剂或溶质来改变溶液的浓度。
四、胶体的概念及特点1. 胶体是介于溶液和悬浮液之间的一种新形态的分散系统,是由微粒或宏观大分子均匀地分散在另一种物质中所得到的一种新物质。
高中化学 第二章 物质变化及其分类 重难点2 溶液、胶体和浊液三种分散系的比较(含解析)新人教版必修1
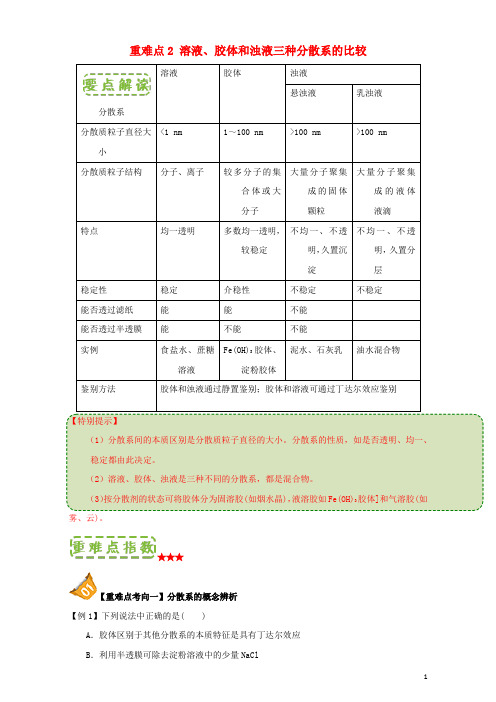
重难点2 溶液、胶体和浊液三种分散系的比较分散系溶液胶体浊液悬浊液乳浊液分散质粒子直径大小<1 nm 1~100 nm >100 nm >100 nm分散质粒子结构分子、离子较多分子的集合体或大分子大量分子聚集成的固体颗粒大量分子聚集成的液体液滴特点均一透明多数均一透明,较稳定不均一、不透明,久置沉淀不均一、不透明,久置分层稳定性稳定介稳性不稳定不稳定能否透过滤纸能能不能能否透过半透膜能不能不能实例食盐水、蔗糖溶液Fe(OH)3胶体、淀粉胶体泥水、石灰乳油水混合物鉴别方法胶体和浊液通过静置鉴别;胶体和溶液可通过丁达尔效应鉴别【特别提示】(1)分散系间的本质区别是分散质粒子直径的大小。
分散系的性质,如是否透明、均一、稳定都由此决定。
(2)溶液、胶体、浊液是三种不同的分散系,都是混合物。
(3)按分散剂的状态可将胶体分为固溶胶(如烟水晶),液溶胶如Fe(OH)3胶体]和气溶胶(如雾、云)。
★★★【重难点考向一】分散系的概念辨析【例1】下列说法中正确的是( )A.胶体区别于其他分散系的本质特征是具有丁达尔效应B.利用半透膜可除去淀粉溶液中的少量NaClC.溶液是电中性的,胶体是带电的D.纳米材料粒子直径一般在10-9~10-7 m之间,因此纳米材料属于胶体【答案】B【解析】胶体与其他分散系的本质区别是分散质粒子的直径大小,丁达尔效应是胶体的一种性质,A项错误;半透膜能允许直径在1 nm以下的小分子或离子透过,1 nm以上的胶体粒子不透过,因此可以用半透膜除去淀粉溶液中的NaCl,B项正确;胶体中的胶粒带正电荷,但整个胶体不带电,呈电中性,C项错误;胶体是分散系,属于混合物,直径在1~100 nm 之间的纳米材料不一定是分散系,若是纯净物,则不属于胶体,D项错误。
【重难点点睛】(1)胶体是分散系,由分散质和分散剂组成,属混合物。
(2)胶体呈电中性,胶体微粒一般带同种电荷,有的胶体微粒如淀粉胶体微粒不带电荷。
高一化学第2章 第1节 第2课时 一种重要的混合物—胶体

[解析] A项,溶液和胶体均呈电中性;B项,若溶液中 溶质是分子,如蔗糖,通电时溶质粒子不发生移动;C项,溶 液和胶体都是有的有色,有的无色;D项,溶液无丁达尔现 象,胶体有丁达尔现象。
[答案] D
(1)溶液、浊液和胶体的本质区别是分散质微粒直径大小 不同,常利用丁达尔现象鉴别胶体和溶液。
(2)部分胶体的分散质微粒带电荷,有的分散质微粒带正 电荷,有的带负电荷,但胶体是电中性的。
3.胶体的性质: (1)均一、稳定、透明;(2)丁达尔现 象; (3)电泳;(4)聚沉。
4.分离、提纯胶体的方法——渗析。
1.什么是溶液?它是怎样组成的? 提示:(1)定义:一种或几种物质分散到另一种物质中, 形成均一、稳定的混合物。 (2)组成:溶质和溶剂。溶液的质量=溶质的质量+溶 剂的质量。
()
解析:A项,为分馏装置;B项,为渗析装置;C项,为过滤 装置;D项,配制一定物质的量浓度溶液的装置。 答案:D
[课堂双基落实]
1.悬浊液、乳浊液、溶液和胶体都是
()
A.稳定的液体
B.透明的液体
C.混合物
D.化合物
解析:浊液、溶液、胶体均属于分散系,都是混合物。
答案:C
2.鉴别胶体和溶液可以采取的最好方法是
>100 nm
较均一、透 明
不均一、不透明
分子集合体、 大量分子或离子的集
高分子
合体,呈固态或液态
分散系
溶液
能否透过滤纸
能
能否透过半透膜
能
稳定性
稳定
实例
食盐水、 碘酒
胶体 能
不能 较稳定 氢氧化铁胶体、淀 粉溶液
浊液 不能 不能 不稳定
泥水
[例1] 下列关于溶液和胶体的叙述,正确的是 ( ) A.溶液是电中性的,胶体是带电的 B.通电时,溶液中的溶质粒子分别向两极移动,胶体中 的分散质粒子向某一极移动 C.溶液是无色的,胶体是有色的 D.一束光线分别通过溶液和胶体时,后者会出现明显的 光路,前者则没有
无机及分析化学教案
6、郭文录等编.无机与分析化学,哈尔滨工业大学出版社, 2004年版
6.郭文录等编.无机与分析化学,哈尔滨工业大学出版社,2004年版
6、郭文录等编.无机与分析化学,哈尔滨工业大学出版社,2004年版
(第7次课)
章节
名称
第3章化学热力学初步
8
9
10
作业
单元练习题1的相关内容
参考
资料
1.浙江大学编.无机及分析化学,高等教育出版社, 2003年版
2.南京大学编.无机及分析化学,高等教育出版社, 1998年版
3.陈虹锦等编.无机与分析化学,科学出版社, 2002年版
4、钟国清等编.无机及分析化学学习指导,科学出版社, 2007年版
5、董元彦主编.无机及分析化学,科学出版社,2006年版
2
2
气体, 理想气体状态方程
3
3
分压力, 分压定律
10
4
溶液, 分散系, 分散质与分散剂, 分散系分类
5
5
物质的量及其单位
9
6
溶液的组成量度, 质量分数与体积分数, 摩尔分数, 质量浓度, 物质的量浓度, 质量摩尔浓度, 它们之间的有关换算
30
7
等物质的量规则及其应用
8
8
稀溶液的通性, 溶液的蒸气压下降
2.熟悉溶液的组成量度。
2、熟悉溶液的组成量度。
重点、难点
重点:溶液组成量度的表示方法(物质的量浓度,质量摩尔浓度,量分数,质量分数及相互换算),稀溶液的依数性(蒸汽压下降、沸点升高)。
难点:稀溶液的依数性
难点:稀溶液的依数性
教学方法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
最稳定
电子显微镜也 不可见 能透过半透膜 单相体系
很稳定
稳定
不稳定
一般显微镜 可见 不能透过 紧密滤纸
超显微镜可观察其存在
能透过滤纸, 不能透过半透膜
多相体系
无机及分析化学
6
二、物质的量及其单位
1. 物质的量(n)
物质的量nB是以摩尔为计量单位来表示物质组成
的物理量。摩尔是一系统物质的量,该系统中所包含
nB bB mA
无机及分析化学
12
例1 已知浓硫酸的密度为1.84 g· mL-1,硫酸的质量分数 为96.0%,试计算c(H2SO4)及c(½H2SO4)。 解:
w(H 2 SO 4 ) 0.961.84 1 c(H 2 SO 4 ) 18 . 0 ( mol L ) 3 M (H 2 SO 4 ) 98.0 10
按分散质粒子的大小,常把分散系分为三类 无机及分析化学
5
分子离子分散系
胶体分散系
(d粒子=1~100nm)
粗分散系
(d粒子<1nm)
(d粒子>100nm)
高分子溶液 胶体溶液 浊液 低分子物质溶液 (分散质是 (分散质是分子 (分散质是分子 (分散质是小分子) 大分子) 的小集合体) 的大集合体)
c(NaOH) V(NaOH) 1 c ( H2SO 4 ) 2 V(H SO )
2 4
0.100 25 10 20 10 3
3
0.125(mol L1 )
无机及分析化学
17
问 题
1、由3H2 + N2 ⇌ 2NH3化学反应方程式确定的氢 的基本单元是( )。 A. H2 B. 3H2 C. 3/2H2 D. 氢
无机及分析化学
22
例4 2.60g尿素溶于50.0g水中,试计算此溶液的凝固 点和沸点。已知[CO(NH2)2]的摩尔质量为60.0 g· mol-1。
解:质量摩尔浓度
2.60 1000 -1 bB 0.866(mol kg ) 50.0 60.0
得 则沸点为 △Tb = Kb· bB = 0.52 × 0.866 = 0.45 (K) Tb = 373.15 + 0.45 = 373.60 (K)
* A A
* A B
* A
在一定温度下,难挥发非电解质稀溶液的蒸气压下降与 溶质的质量摩尔浓度成正比,而与溶质的本性无关。
无机及分析化学
20
二、溶液的沸点升高和凝固点降低
沸点是指液体的饱和蒸气压等于外界大气压时的温度。
一定外压下,某物质固态的蒸气压和液态的蒸气压相 等,则液固两相平衡共存,这时的温度叫做该物质的凝 固点
1 M ( H 2 SO 4 ) = 0.049kg mol -1 2
当选择不同基本单元时,有 MaB = a MB
无机及分析化学
9
3. 物质的量的计算 物质的量nB与物质的质量m(kg)、物质的摩尔质量MB 之间的定量关系如下:
m nB MB
当基本单元选择不同时,有
n aB
1 nB a
的基本单元数与0.012kg 12C的原子数目相同。
基本单元可以是分子、离子、原子、电子、光子及 其它粒子或这些粒子的特定组合,使用摩尔时必须在 其单位符号(mol)或量符号(n)后用元素符号或化学式 指明其基本单元,而不能用文字。
无机及分析化学
7
例如: 1mol(H2)或n(H2) = 1mol表示基本单元是H2的物质 的量是1mol,即6.02×1023个H2; 1mol (H)或n(H) = 1mol表示基本单元是H的物质 的量是1mol,即6.02×1023个H。 1mol (2NaOH + H2SO4 = Na2SO4 + 2H2O)
1mol ( NaOH + 1/2H2SO4 = 1/2Na2SO4 + 2H2O)
无机及分析化学
8
2. 物质的摩尔质量
1摩尔物质所具有的质量称为摩尔质量(M),其单位为
kg· mol-1, 常用g· mol-1。若某物质B的质量为m, 物质的
量为nB, 则其摩尔质量MB为:
m MB nB
例如:M(H2SO4) = 0.098kg· mol-1;
无机及分析化学
4
§2-2 溶液
一、分散系
一种(或多种)物质分散于另一种物质之中的形式存在, 这种存在形式称为分散系。在分散系中,被分散的物质称 为分散质,而容纳分散质的物质称为分散剂。 体系:被划分出来作为我们的研究对象; 环境:除体系以外的其他部分。 相:体系中物理性质和化学性质完全相同的均匀部 分。 相与相之间有明显的界面。同一物质可以出现几个相, 含有两相及其以上的体系称为多相体系。
无机及分析化学
24
产生渗透压的条件: A.半透膜; B. 浓度差 Van’t Hoff渗透压公式: π = cBRT 对于稀溶液来说,物质的量浓度约等于质量摩尔 浓度,故上式又可表示为: π = cBRT ≈ bBRT
无机及分析化学
25
例 5 有一蛋白质的饱和水溶液,每升含有蛋白质 5.18g,已知在 298.15K时,溶液的渗透压为 413Pa,
√
2、基本单元的下列叙述错误的是( B.它可以是上述粒子的组合与分割
)。
A.它可以是分子、原子、离子、电子及其他粒子 C.它可以是一个反应式,如3H2 + N2 ⇌ 2NH3
√D.它必须是客观存在的粒子
无机及分析化学
18
§2-3 稀溶液的通性
对于难挥发的非电解质稀溶液,它们的蒸气压、 沸点、凝固点和渗透压表现出一定的共同性和规
15
正确使用等物质的量规则的关键是基本单元的确定, 而基本单元是根据反应方程式确定的。 酸碱反应中,一般选择得失一个质子(H+)对应的粒 子组合或化学式为基本单元,如碳酸钠常选
(½Na2CO3)、硫酸常选(½H2SO4)作基本单元; 氧化还原反应中常选得失一个电子的微粒组合或化 学式为基本单元,如1mol K2Cr2O7还原为Cr3+得到6
30.3/46 x(C2 H5OH) 0.670 30.3/46 + 50.0/154
30.3/46 b(C2 H5OH) 13.2(mol kg 1 ) 50.0/1000
0.377 1.28 1 c(C2 H5OH) 10.5(mol L ) 3 46 10
一、高分子溶液 二、乳浊液
§2-3 稀溶液的通性
一、溶液的蒸汽压下降 二、溶液的沸点升高和凝固点降低 三、溶液的渗透压
无机及分析化学
1
学习要求:
1.熟悉道尔顿分压定律;
2.熟悉溶液的组成量度及等物质的量规则;
3.理解稀溶液的依数性及其应用; 4.了解胶体溶液的性质、胶团的结构、溶胶 的稳定性与聚沉。
1 w(H 2SO4 ) 0.96 1.84 1 c( H 2SO4) 36.0 ( mol L ) 3 1 98.0 10 2 M( H 2SO4) 2 2
无机及分析化学
13
例2:把30.3g乙醇(C2H5OH)溶于50.0g CCl4所配成溶 液的密度为1.28g· cm-3。计算: (1) 乙醇的质量分数; (2) 乙醇的摩尔分数; (3) 乙醇的质量摩尔浓度; (4) 乙醇的物质的量浓度。 w(C2H5OH) 30.3/(30.3 + 50.0) 37.7% 解:
无机及分析化学
14
四、等物质的量规则及其应用
在化学反应中,各反应物都是按等物质的量进行反 应的。因此,对于任意反应: aA + bB = cC + dD 若各物质的基本单元分别为aA、bB、cC、dD,则
n(aA) = n(bB) = n(cC) = n(dD)
这个关系式称为等物质的量规则
无机及分析化学
律性,这一性质称为稀溶液的通性或依数性。
无机及分析化学
19
一、溶液的蒸气压下降
液体和它的蒸汽处于平衡状态时蒸 汽所具有的压力(压强)叫该液体的 饱和蒸汽压,简称 蒸汽压 。 一定温度下,纯液体都有一定的饱 和蒸汽压。液体的蒸汽压随温度的升 高而增大。 拉乌尔(Raoult)定律:
p p x ;p p x ; p p p KbB
mol电子,故选(1/6K2Cr2O7)作基本单元,酸性介质中 高锰酸钾常选(1/5KMnO4)作基本单元。
无机及分析化学
16
例3 有一种未知浓度的H2SO4溶液20mL,如用浓度为 c(NaOH)= 0.100mol· L-1的溶液25mL恰好中和完全,求 c(½H2SO4)为多少? 解: H2SO4 + 2NaOH = Na2SO4 + 2H2O c (½ H2SO4) ·V (H2SO4) = c (NaOH) ·V (NaOH)
稀溶液的沸点升高、凝固点下降
无机及分析化学
21
溶液的沸点上升和溶液凝固点下降是由于溶液蒸 气压下降的必然结果。
Tb Tb Tb K b bB
Tf Tf Tf K f bB
难挥发非电解质稀溶液的沸点上升、凝固点下降 仅与溶质的质量摩尔浓度bB成正比,与溶质本性无 关。
无机及分析化学
2
§2-1 气体
一、理想气体状态方程
pV = nRT
二、 Dalton 气体分压定律 分压力:恒温下混合气体中每一种气体单独占有整个 混合气体的容积时所呈现的压力。 分压定律:混合气体的总压力等于各组分气体的分压 之和:
p总 p1 p2 p3 pi pi
bB Tb / Kb 0.28/ 0.52 0.54 (mol kg1) Tf Kf bB 1.86 0.54 1.00(K)
