高中化学选修四第四章化学电源知识点
人教版高中化学选修四 化学电源 PPT课件

燃料电池汽车
四、燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能 直接转换成电能的化学电池。(氢气、烃、肼、甲 醇、氨、煤气燃料电池……)
1、氢氧燃料电池
中性 负极: 2H2-4e-==4H+ 正极: O2+2H2O+4e-==4OH总反应: 2H2+O2==2H2O
负极 4Al-12e-=4Al3+ 正极 3O2+6H2O+12e-=12OH总反应式: 4Al+3O2+6H2O=4Al(OH)3
练习6: 碱性电池具有容量大、放电电流大的特点,因而 得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液, 电流总反应式为:
Zns+2MnO2s+H2Ol=ZnOH2s+Mn2O3s
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4
放电 充电
2PbSO4+2H2O
优点: 可重复使用、电压稳定、使用方便、安全可靠、 价格低廉 缺点: 比能量低、笨重、废弃电池污染环境
➢其它二次电池
镍镉电池、镍氢电池、银锌电池、锂离子电 池……
2、银锌蓄电池
正极壳填充Ag2O和石墨,负极盖填充锌汞 合金,电解质溶液KOH溶液。反应式为: 2Ag+Zn(OH充)放2 电电 Zn+Ag2O+H2O 写出放电时的电极反应式。
Zn + 2MnO2 + 2NH4+ = Zn2++Mn2O3 + 2NH3 + H2O
优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
2、碱性锌-锰干电池
电池反应: Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2 负极:(Zn)
化学选修四第四章 化学电源知识点

第二节化学电源1、定义:化学电源是将化学能变成电能的装置。
包括一次电源、二次电源和燃料电池等几大类。
2、一次电池:(1)碱性锌锰干电池:负极材料:Zn电极反应:Zn+2OH--2e-===Zn(OH)2正极材料:MnO2电极反应:2MnO2+2H2O+2e-===2MnOOH+2OH-总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2(2)银锌纽扣电池:负极材料:Zn电极反应:Zn-2e-+2OH-===Zn(OH)2正极材料:Ag2O电极反应:Ag2O+2e-+H2O===2Ag+2OH-总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag3、二次电池(1)铅蓄电池:负极材料:Pb,正极材料:电解质溶液为30%H2SO4溶液○1放电时的反应:4===PbSO4负极反应:Pb-2e-+SO2-4+4H+===PbSO4+2H2O正极反应:PbO2+2e-+SO2-总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O○2充电时的反应:4阴极反应:PbSO4+2e-===Pb+SO2-4阳极反应:PbSO4+2H2O-2e-===PbO2+4H++SO2-总反应:2PbSO4+2H2O===Pb+PbO2+2H2SO4(2)锂电池:负极材料:锂,正极材料:石墨,电解质:LiAlCl4、SOCl2,放电时的反应:负极反应:8Li-8e-===8Li+正极反应:3SOCl2+8e-===SO2-3+2S+6Cl-总反应:8Li+3SOCl2===6LiCl+Li2SO3+2S4、燃料电池:(1)氢氧燃料电池①氢氧燃料电池是目前最成熟的燃料电池。
②燃料电池的电极本身不参与反应,燃料和氧化剂连续地由外部供给(2)铝—空气—海水电池:负极材料:铝片,正极材料:铂片,电解质溶液:海水,负极反应:4Al-12e-===4Al3+正极反应:3O2+12e-+6H2O===12OH-总反应:4Al+3O2+6H2O===4Al(OH)35、化学电源电极反应式的书写书写电极反应式时,首先要根据原电池的工作原理准确判断正、负极,然后结合电解质溶液的环境确定电极产物,最后再根据得失守恒、质量守恒和电荷守恒写出反应。
选修四 第四章电化学基础 知识点总结

电解质和水同时被电解型
A 、放氢生碱型:活泼金属的无氧酸盐(如NaCl 、MgBr2)溶液的电解
B 、放氧生酸型:不活泼金属的含氧酸盐(如CuSO4、AgNO3)溶液的电解
相互关系:往往同时发生,电化腐蚀要比化
第三单元 金属的腐蚀与防护
1、金属防护的几种重要方法
①改变金属内部的组织结构,制成合金。
②在金属表面覆盖保护层。
如油漆、油脂等,电镀Zn,Cr 等易氧化形成致密的氧化物薄膜作
保护层。
原理:隔绝金属与外界空气、电解质溶液的接触。
③电化学保护法,即将金属作为原电池的正极或电解池的阴极而受到保护。
2、牺牲阳极的阴极保护法:
原理 :形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
3、外加电源的阴极保护法:
将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。
此法主要用于防止土壤、海水及水中金属设备的腐蚀。
金属(或合金)跟周围接触到的气体 (或液体)反应而腐蚀损耗的过程。
【人教版】高中化学选修4知识点总结:第四章电化学基础

第四章电化学根底一、原电池课标要求1、把握原电池的工作原理2、娴熟书写电极反响式和电池反响方程式要点精讲1、原电池的工作原理(1)原电池概念:化学能转化为电能的装置,叫做原电池。
假设化学反响的过程中有电子转移,我们就可以把这个过程中的电子转移设计成定向的移动,即形成电流。
只有氧化复原反响中的能量变化才能被转化成电能;非氧化复原反响的能量变化不能设计成电池的形式被人类利用,但可以以光能、热能等其他形式的能量被人类应用。
(2)原电池装置的构成①有两种活动性不同的金属〔或一种是非金属导体〕作电极。
②电极材料均插入电解质溶液中。
③两极相连形成闭合电路。
(3)原电池的工作原理原电池是将一个能自发进展的氧化复原反响的氧化反响和复原反响分别在原电池的负极和正极上发生,从而在外电路中产生电流。
负极发生氧化反响,正极发生复原反响,简易记法:负失氧,正得还。
2、原电池原理的应用〔1〕依据原电池原理比较金属活动性强弱①电子由负极流向正极,由活泼金属流向不活泼金属,而电流方向是由正极流向负极,二者是相反的。
②在原电池中,活泼金属作负极,发生氧化反响;不活泼金属作正极,发生复原反响。
③原电池的正极通常有气体生成,或质量增加;负极通常不断溶解,质量削减。
〔2〕原电池中离子移动的方向①构成原电池后,原电池溶液中的阳离子向原电池的正极移动,溶液中的阴离子向原电池的负极移动;②原电池的外电路电子从负极流向正极,电流从正极流向负极。
注:外电路:电子由负极流向正极,电流由正极流向负极;内电路:阳离子移向正极,阴离子移向负极。
H 3、原电池正、 负极的推断方法:(1) 由组成原电池的两极材料推断一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
(2) 依据电流方向或电子流淌方向推断。
电流由正极流向负极;电子由负极流向正极。
(3) 依据原电池里电解质溶液内离子的流淌方向推断在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
高中化学人教版选修 4 期末复习第四章 电化学基础知识归纳

2 2 第四章 电化学基础知识归纳一.原电池:化学能转化为电能的装置叫做原电池组成条件:①两个活泼性不同的电极 ②电解质溶液 ③电极用导线相连并插入电解液构成闭合回路 电子流向:外电路:负极——导线——正极内电路:盐桥中阴离子移向负极的电解质溶液,盐桥中阳离子移向正极的电解质溶液。
电极反应:以锌铜原电池为例:负极:氧化反应:Zn -2e -=Zn 2+ (较活泼金属) 正极:还原反应:2H ++2e -=H ↑ (较不活泼金属) 总反应式:Zn+2H +=Zn 2++H ↑ 正、负极的判断:(1)从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。
(2)从电子的流动方向 负极流入正极 (3)从电流方向 正极流入负极(4)根据电解质溶液内离子的移动方向 阳离子流向正极,阴离子流向负极 (5)根据实验现象①溶解的一极为负极 ②增重或有气泡一极为正极二.化学电池 1、电池的分类:化学电池、太阳能电池、原子能电池2、化学电池:借助于化学能直接转变为电能的装置3、化学电池的分类:一次电池、二次电池、燃料电池 常见一次电池:碱性锌锰电池、锌银电池、锂电池等二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。
以氢氧燃料电池为例,铂为正、负极,介质分为酸性、碱性和中性。
1.当电解质溶液呈酸性时: 2.当电解质溶液呈碱性时:负极:2H -4e =4H-+2 正极:O +4 e +4H =2H O-+2 2 负极:2H +4OH --4e -=4H O 正极:O +2H O +4 e -=4OH -2 2 2 2 另一种燃料电池是用金属铂片插入 KOH 溶液作电极,又在两极上分别通甲烷燃料和氧气氧化剂。
电极反应式为:负极:CH +10OH --8e -=CO 2- +7H O ; 正极:4H O +2O +8e -=8OH -。
4 3 2 2 2 电池总反应式为:CH 4+2O 2+2KOH =K 2CO 3+3H 2O 阳氧目前已开发出新型蓄电池:银锌电池、镉镍电池、氢镍电池、锂离子电池、聚合物锂离子电池 燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池 电极反应:一般燃料电池发生的电化学反应的最终产物与燃烧产物相同,可根据燃烧反应写出总的电 池反应,但不注明反应的条件。
人教版高中化学选修四第四章第二节知识点
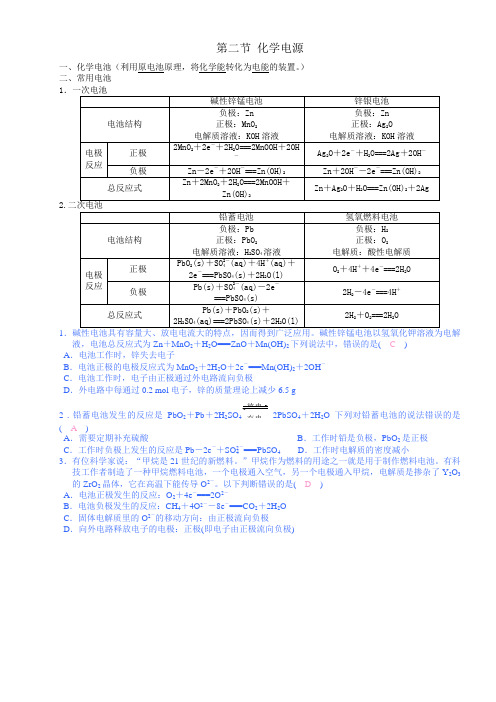
第二节 化学电源 一、化学电池(利用原电池原理,将化学能转化为电能的装置。
)
二、常用电池
1
2.
1液,电池总反应式为Zn +MnO 2+H 2O===ZnO +Mn(OH)2下列说法中,错误的是( C )
A .电池工作时,锌失去电子
B .电池正极的电极反应式为MnO 2+2H 2O +2e -===Mn(OH)2+2OH -
C .电池工作时,电子由正极通过外电路流向负极
D .外电路中每通过0.2 mol 电子,锌的质量理论上减少6.5 g
2.铅蓄电池发生的反应是PbO 2+Pb +2H 2SO 4 2PbSO 4+2H 2O 下列对铅蓄电池的说法错误的是( A )
A .需要定期补充硫酸
B .工作时铅是负极,PbO 2是正极
C .工作时负极上发生的反应是Pb -2e -+SO 2-4===PbSO 4
D .工作时电解质的密度减小
3.有位科学家说:“甲烷是21世纪的新燃料。
”甲烷作为燃料的用途之一就是用于制作燃料电池。
有科技工作者制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y 2O 3
的ZrO 2晶体,它在高温下能传导O 2-。
以下判断错误的是( D )
A .电池正极发生的反应:O 2+4e -===2O 2-
B .电池负极发生的反应:CH 4+4O 2--8e -===CO 2+2H 2O
C .固体电解质里的O 2-的移动方向:由正极流向负极
D .向外电路释放电子的电极:正极(即电子由正极流向负极)
放电
充电。
选修4第四章4.2化学电源全解

熔融盐燃料电池是一种高温燃料电池。其工 作原理是在负极通入燃料,在正极通入氧气, 使用高温熔融盐作为电解质。某燃料电池使 用碳酸钾作为熔融盐电解质,在一极通入一 氧化碳,在另一极通入二氧化碳和氧气的混 合气,已知该电池的一个电极反应式为:CO +CO32--2e-=2CO2,请根据原电池的工作 原理,写出另一电极反应的电极反应式和总 反应方程式。
怎样书写燃料电池的电极反应式和总反应式? 书写步骤: 1、写出燃烧反应; 2、根据电解液改写燃料电池总反应; 3、写出正极的电极反应式(一般较简单); 正极反应一般为: ①酸性介质 O2+4H++4e-=2H2O ②碱性介质 O2+2H2O+4e-=4OH- 4、由燃料电池总反应减去正极的电极反应式 得负极的电极反应式。
镉有致癌作用,有被镍氢电池取代的趋势。
MH+NiOOH
放电
充电
Ni(OH)2+M 。
废旧电池的回收利用
电池中含有大量的重金 属如锌、铅、镉、汞、锰等。 据专家测试,一节纽扣电池 能污染60万升水;一节一 号电池烂在地里,能使一平 方米的土地失去利用价值。 若将废旧电池混入生活垃圾 一起填埋,渗出的重金属物 质就会渗透土壤、污染地下 水,进而进入鱼类、农作物 等,破坏人类的生存环境, 间接威胁到人类的健康,有 的还能致癌。所以我们不要 乱扔电池,要及时回收。
用途:氢氧燃料电池目前已应用于航天、军事通讯、 电视中继站等领域
【燃料电池】 介质 电池反应: 2H2 +O2 = 2H2O 负极 正极 负极 正极
2H2 - 4e- = 4H+ O2 + 4H+ + 4e-= 2H2O 2H2 - 4e- = 4H+ O2 + 2H2O + 4e-= 4OH2H2 +4OH-- 4e- = 4H2O O2 + 2H2O + 4e-= 4OH-
人教版化学选修四第四章 第二节 化学电源

•
3.通过分角色朗读和讲述故事,感受 小蝌蚪 主动探 索的精 神,增 强阅读 科学童 话的兴 趣
•
4.能正确、流利地朗读课文,练习用 “象脚 鼓”等词 语,描 述周总 理和傣 族人民 一起过 泼水节 的情景 ,体会 周总理 和傣族 人民心 连心的 深厚情 意。
•
5.能积累描写周总理样子的句子,感 受总理 的平易 近人。
酸性介质(H2SO4)中
负极
负极
2H2 - 4e- = 4H+
负失氧,正得还 正极
O2 + 4H+ + 4e- = 4H2O
总反应式: 2H2 +O2 = 2H2O
正极
负极 - 化合价升高 - 失去电子 - 氧化反应 - 还原剂 正极 - 化合价降低 - 得到电子 - 还原反应 - 氧化剂
化合价降低 化合价升高
失去电子 得到电子 还原反应 氧化反应 氧化剂 还原剂
氢氧燃料电池的化学反应实质:
碱性介质(KOH)中 负极 2H2 +4OH-- 4e- = 4H2O 正极 O2 + 2H2O + 4e- =4OH-
总反应式: 2H2 +O2 = 2H2O
中性介质(Na2SO4)中 负极 2H2-4e- = 4H+ 正极 O2+2H2O+4e- = 4OH-
•
通过本课学习让学生对数量词产生兴 趣,培 养学生 能留心 观察周 围事物 、尝试 用数量 词表达 熟悉的 事物的 好习惯 。感受 数量词 儿歌的 语言美 。
•
6、借助图片、多媒体演示,采用自由 朗读、 指名朗 读,小 组读, 全班读 ,动作 演示、 创设情 景读等 不同的 方式正 确流利 的朗读 课文, 读出水 的神奇 。
高中化学选修4之知识讲解_化学电源_基础-

化学电源【学习目标】1、了解常见电池的分类及优点;2、了解一次电池、二次电池、燃料电池的基本构造、反应原理及应用。
【要点梳理】知识点一、化学电池1、定义化学电池是将化学能转变成电能的装置。
【化学电源#化学电池的分类】2、分类3、化学电池的优点①化学电池的能量转换效率较高,供能稳定可靠。
②可以制成各种形状和大小、不同容量和电压的电池及电池组。
③使用方便,易于维护,并可在各种环境下工作。
4、判断电池优劣的主要标准①比能量:即单位质量或单位体积所能输出电能的多少,单位(W·h)/k或(W·h)/L。
②比功率:即单位质量或单位体积所能输出功率的大小,单位W/kg或W/L。
③电池的可储存时间的长短。
【化学电源#常见的化学电池】知识点二、常见的化学电池放电2PbSO充电2NiO(OH)+H2放电知识点四、化学电池电极反应式的书写1、根据装置书写电极反应式①先分析题目给定的图示装置,确定原电池正负极上的反应物质,并标出电子得失的数目。
②电极反应式的书写a.负极:活泼金属或H2失去电子生成阳离子;若电解质溶液中的阴离子与生成的阳离子不共存,则该阴离子应写入负极反应式。
如铅蓄电池,负极:Pb+SO42--2e-=PbSO4。
b.正极:阳离子得到电子生成单质或O2得到电子,若反应物是O2,则有以下规律:电解质溶液是碱性或中性:O2+2H2O+4e-=4OH-电解质溶液是酸性;O2+4H++4e-=2H2O③正负电极反应式相加得到电池反应的总反应方程式。
2、给出总反应式,写电极反应式如果题目给定的是总反应式,可分析此反应中的氧化反应或还原反应(即分析有关元素的化合价变化情况),选择一个简单的变化去写电极反应式,另一极的电极反应式可直接写或将各反应式看作数学中的代数式,用总反应式减去已写出的电极反应式,即得结果。
以2H2+O2=2H2O为例,当电解质溶液为KOH溶液时的电极反应式的书写步骤如下。
①根据总反应方程式分析有关元素化合价的变化情况,确定2 mol H2失掉4 mol电子,初步确定负极反应为:2H2-4e-=4H+。
最新【人教版】高中化学选修4知识点总结:第四章电化学基础

第四章电化学基础一、原电池课标要求1、掌握原电池的工作原理2、熟练书写电极反应式和电池反应方程式要点精讲1、原电池的工作原理(1)原电池概念:化学能转化为电能的装置,叫做原电池。
若化学反应的过程中有电子转移,我们就可以把这个过程中的电子转移设计成定向的移动,即形成电流。
只有氧化还原反应中的能量变化才能被转化成电能;非氧化还原反应的能量变化不能设计成电池的形式被人类利用,但可以以光能、热能等其他形式的能量被人类应用。
(2)原电池装置的构成①有两种活动性不同的金属(或一种是非金属导体)作电极。
②电极材料均插入电解质溶液中。
③两极相连形成闭合电路。
(3)原电池的工作原理原电池是将一个能自发进行的氧化还原反应的氧化反应和还原反应分别在原电池的负极和正极上发生,从而在外电路中产生电流。
负极发生氧化反应,正极发生还原反应,简易记法:负失氧,正得还。
2、原电池原理的应用(1)依据原电池原理比较金属活动性强弱①电子由负极流向正极,由活泼金属流向不活泼金属,而电流方向是由正极流向负极,二者是相反的。
②在原电池中,活泼金属作负极,发生氧化反应;不活泼金属作正极,发生还原反应。
③原电池的正极通常有气体生成,或质量增加;负极通常不断溶解,质量减少。
(2)原电池中离子移动的方向①构成原电池后,原电池溶液中的阳离子向原电池的正极移动,溶液中的阴离子向原电池的负极移动;②原电池的外电路电子从负极流向正极,电流从正极流向负极。
注:外电路:电子由负极流向正极,电流由正极流向负极;内电路:阳离子移向正极,阴离子移向负极。
3、原电池正、负极的判断方法:(1)由组成原电池的两极材料判断一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向判断。
电流由正极流向负极;电子由负极流向正极。
(3)根据原电池里电解质溶液内离子的流动方向判断在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的变化来判断原电池的负极失电子发生氧化反应,其正极得电子发生还原反应。
人教版选修4第四章第二节化学电源

电极 反应 以及 电池 总反 应 特点
负极(Zn):Zn-2e-=Zn2+ 负极(Zn):Zn + 2OH--2e-
正极(C):
=Zn(OH)2
22e-NH4+ + 2MnO2 + 总=H2反2ON应H:Z3n++2MMnn2OO23 + +2NH4+ =Zn2++2NH3 + Mn2O3+H2O
正极(C):
正极反应:
Li1-xMO2+xLi++xe-===LiMO2
总反应:
Li1-xMO2+LixCn======nC+LiMO2或Li1-xMO2 +xLi=====LiMO2。
三、二次电池
1、二次电池又称充电电池,放电时进行的氧化还原
反应在充电时可以逆向进行。优点:可以重复使用。
放电—原电池—化学能转化为电能 充电—电解池—电能转化为化学能
镉有致癌作用,有被镍氢电池取代的趋势。
四、燃料电池(重点)
与其它电池区别:反应 物不是储存在电池内。
1、优点
①高效、环境友好(产物无污染)。
② 燃料电池的电极本身不参与化学 反应,只是一个催化转化元件。
燃料电池工作时燃料与氧化剂由外部持 续供给。
小型高性能燃料电池
④燃料电池中电解质溶液酸碱性不同时, 化学反应也不相同。
练习:肼(N2H4)空气燃料电池
电解质为碱性时 负极: N2H4+4OH- -4e-=N2 +4H2O 正极: O2+4e-+2H2O=4OH-
总反应方程式为:N2H4+O2=N2+2H2O
电解质为酸性时 负极:N2H4- 4e-+=N2+4H+ 正极:O2+4e-+4H+=2H2O 总反应方程式为:N2H4+O2=N2+2H2O
高中化学选修四第四章原电池知识点

第一节原电池一、工作原理1、概念:化学能转化为电能的装置叫做原电池。
(还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应)2、形成条件:①两个活泼性不同的电极②电解质溶液③电极用导线相连并插入电解液构成闭合回路○4发生的反应是自发的氧化还原反应3、电子流向:外电路:负极——导线——正极内电路:盐桥中阴离子移向负极的电解质溶液,盐桥中阳离子移向正极的电解质溶液。
4、正、负极的判断:(1)从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。
(2)从电子的流动方向负极流入正极(3)从电流方向正极流入负极(4)根据电解质溶液内离子的移动方向阳离子流向正极,阴离子流向负极(5)根据实验现象溶解的一极为负极增重或有气泡一极为正极5、常见电极:○1活泼性不同的金属:如锌铜原电池,锌作负极,铜作正极;○2金属和非金属(非金属必须能导电):如锌锰干电池,锌作负极,石墨作正极;○3金属与化合物如:铅蓄电池,铅板作负极,二氧化铅作正极;○4惰性电极如:氢氧燃料电池,电极均为铂。
【习题一】(2018•曲靖一模)下列有关电池的说法不正确的是()A.手机上用的锂离子电池属于二次电池B.锌锰干电池中,锌电极是负极C.甲醇燃料电池可把化学能转化为电能D.铜锌原电池电子沿外电路从铜电极流向锌电极【考点】原电池和电解池的工作原理.【专题】电化学专题.【分析】A.锂离子电池能充放电,属于二次电池;B.锌锰干电池中,锌作负极、二氧化锰作正极;C.甲醇燃料电池属于原电池;D.铜锌原电池中,电子从负极沿导线流向正极.【解答】解:A.锂离子电池能充放电,属于二次电池,放电时是将化学能转化为电能,充电时是将电能转化为化学能,故A正确;B.锌锰干电池中,锌易失电子发生氧化反应而作负极、二氧化锰得电子发生还原反应而作正极,故B正确;C.甲醇燃料电池属于原电池,是将化学能转化为电能的装置,故C正确;D.铜锌原电池中,锌作负极、Cu作极,电子从负极锌沿导线流向正极铜,故D 错误;故选:D。
高中化学选修4第四章知识归纳

高中化学选修4第四章知识归纳一、图解原电池正、负极的判断方法原电池中电极的判断角度如下所示:特别提示判断一个原电池中的正、负极,最根本的方法是失电子(发生氧化反应)的一极是负极,得电子(发生还原反应)的一极是正极。
如果给出一个化学方程式判断正、负极,可以直接根据化合价的升降来判断,化合价升高、发生氧化反应的一极为负极,化合价降低、发生还原反应的一极为正极。
二、原电池电极反应式的书写规律和方法1.根据装置书写电极反应式(1)先分析题目给定的图示装置,确定原电池正、负极上的反应物,并标出相同数目电子的得失。
(2)负极反应式的书写(3)正极反应式的书写①首先判断在正极发生反应的物质:当负极材料与电解质溶液能自发的发生化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种微粒;当负极材料与电解质溶液不能自发的发生化学反应时,在正极上发生反应的物质是溶解在电解质溶液中的O2。
②然后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若参与反应也要书写叠加式。
③燃料电池的正极反应式电解质是碱性或中性溶液:O2+2H2O+4e-===4OH-,电解质是酸性溶液:O2+4H++4e-===2H2O。
(4)正、负电极反应式相加得到电池反应的总反应方程式。
2.根据总反应式书写电极反应式:如果题目给定的是总反应式,可分析此反应中的氧化反应或还原反应(即分析有关元素的化合价变化情况),再选择一个简单变化情况写电极反应式,另一极的电极反应式可直接写或将各反应式看作数学中的代数式,用总反应式减去已写出的电极反应式即得结果。
以2H2+O2===2H2O为例,当电解质溶液为KOH溶液时的电极反应式的书写步骤如下:(1)根据总反应方程式分析有关元素化合价的变化情况,确定2 mol H2失掉4 mol电子,初步确定负极反应式为2H2-4e-===4H+。
(2)根据电解质溶液为碱性,与H+不能大量共存,反应生成水,推出OH-应写入负极反应式中,故负极反应式为2H2+4OH--4e-===4H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节化学电源
一、电池分类及工作原理
1、化学电池定义:是指能将化学能转变为电能的装置。
2、电池的分类:化学电池、太阳能电池、原子能电池。
3、化学电池的分类:一次电池、二次电池、燃料电池。
4、一次电池:
常见一次电池:碱性锌锰电池、锌银电池、锂电池等.
5、二次电池:放电后可以再充电使活性物质再获得再生,可以多次重复使用,
又叫充电电池或蓄电池。
电极反应:铅蓄电池
放电:负极(铅): Pb+SO42- =PbSO4↓
正极(氧化铅):PbO2+4H++2e-=PbSO4↓+2H2O
充电:阴极:PbSO4+2H2O-2e-=PbO2+4H+
阳极:PbSO4+2e-=Pb+
放电
两式可以写成一个可逆反应: PbO2+Pb+↓+2H2O 6、燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池。
电极反应:一般燃料电池发生的电化学反应的最终产物与燃烧产物相同,可
根据燃烧反应写出总的电池反应,但不注明反应的条件。
,负极发生氧化反
应,正极发生还原反应,不过要注意一般电解质溶液要参与电极反应。
以氢
氧燃料电池为例,铂为正、负极,介质分为酸性、碱性和中性。
当电解质溶液呈酸性时:
负极:2H2-4e- =4H+ 正极:O2+4 e- +4H+ =2H2O
当电解质溶液呈碱性时:
负极:2H2+4OH--4e-=4H2O 正极:O2+2H2O+4 e-=4OH-
另一种燃料电池是用金属铂片插入KOH溶液作电极,又在两极上分别通甲烷燃料和氧气氧化剂。
电极反应式为:
负极:CH4+10OH--8e-=+7H2O;
正极:4H2O+2º2+8e-=8OH-。
电池总反应式为:CH4+2O2+2KOH=K2CO3+3H2O
【习题一】
(2016•宜春校级一模)如图是日常生活中电动自行车的主要部件铅蓄电池结构示意图.有关说法不正确的是( )
A .铅蓄电池属于二次电池
B .实际使用过程中可以无限次充放电
C .使用过程中负极发生氧化反应
D .铅蓄电池体积大有污染还不是最理想的电池
【考点】常见化学电源的种类及其工作原理.
【分析】A .铅蓄电池可以反复充电、放电;
B .理论上可以无限次充放电;
C .负极失电子发生氧化反应;
D .铅离子于重金属离子会污染环境.
【解答】解:A .铅蓄电池可以反复充电、放电,属于二次电池,故A 正确;
B .铅蓄电池理论上可以无限次充放电,但是实际上是有使用寿命的,故B 错误;
C .铅蓄电池中负极上金属铅失电子发生氧化反应生成硫酸铅,故C 正确;
D .铅离子属于重金属离子会污染环境,而且铅蓄电池体积大,所以铅蓄电池不是最理想的电池,故D 正确。
故选:B 。
【习题二】
(2017•毕节市模拟)镍一镉电池是一种可充电的“干电池”,使用寿命长达10-15年.镍一镉电池的总反应为:
(OH )+2HO 2Ni (OH )2+Cd
(OH )2.下列说法不正确的是( )
A .该充电电池的阳极为Ni (OH )2
B .放电时,负极发生了氧化反应,反应为Cd+2OH--2e-═Cd (OH )2
放电
C .充电时,阳极反应为Ni (OH )2(s )+OH-(aq )═NiOOH (s )+H2O (I )+e-
D .电池工作时,负极区pH 增大,正极区pH 减小
【考点】常见化学电源的种类及其工作原理.
【专】电化学专题. 【分析】镍镉电池放电时的总反应为Cd+2NiO (OH )+2H2O 2Ni (OH )
2+d (OH )2,放电时Cd 失电子,作负极,反应式为:Cd+2OH--2e-═Cd (OH )2,NiO (OH )得电子作正极,反应式为:NiOOH (s )+H2O+e-=Ni (OH )2(s )+OH-,充电时阴阳极反应与负极、正极反应刚好相反,据此分析解答.
【解答】解:A 镍镉电池放电时的总反为Cd+2NiO (OH )+2H2O 2Ni (OH )2+Cd (OH )2,所以该充电Ni (OH )2失电子为电池的阳极,故A 正确;
B .放电时,负极上Cd 失电子发生了氧化反应,反应为Cd+2OH--2e-═Cd (OH )2,故B 正确;
C .放电时正极反应为:NiOOH (s )+H2O+e-=Ni (OH )2(s )+OH-,充电时阳极反应与正极反应相反,所以极反应为Ni (OH )2(s )+OH-(aq )═NiOOH (s )+H2O (I )+e-,故C 正确;
D .放电时Cd 失电子,作负极,反应式为:Cd+2OH--2e-═Cd (OH )2,NiO (OH )得电子作正极,反应式为:NiOOH (s )+H2O+e-=Ni (OH )2(s )+OH-,所以负极区pH 减小,正极区pH 增大,故D 错误。
故选:D 。
【习题三】
(2017春•眉山期末)铅蓄电池是最常见的二次电池,电池总反应式为:Pb+PbO2+4H++2SO 2PbSO4+2H2O ,下列说法错误的是( )
A .充电时,阴极反应式为:SO42-+4H++PbO2+2e-═PbSO4+2H2O
B .充电时,两个电极的质量均减轻
C .电池放电时,电解质溶液的pH 增大
D .电池放电时,负极可能会发生副反应:Pb+H2SO4═PbSO4+H2↑
【考点】常见化学电源的种类及其工作原理.
【专题】电化学专题.
放电
充电 放电
放电
【分析】放电时,负极上Pb失电子发生氧化反应,电极反应式为Pb-2e-
+SO42-═PbSO4,正极上二氧化铅得电子发生还原反应,电极反应式为
PbO2+SO42-+4H++2e-=PbSO4+2H2O,充电时,阳极、阴极上电极反应式与正极、负极反应式相反,据此分析解答.
【解答】解:A.充电时,阴极电极反应式与原电池负极反应式相反,所以阴极反应式为PbSO4+2e-═Pb+SO42-,故A错误;
B.充电时,阴极电极反应式与原电池负极反应式相反,所以阴极反应式为PbSO4+2e-═Pb+SO42-,阳极电极反应式与原电池正极反应式相反,所以阳极反应式为PbSO4-2e-+2H2O═PbO2+SO42-+4H+,电极质量均减轻,故B正确;C.放电时,负极上Pb失电子发生氧化反应,电极反应式为Pb-2e-+SO42-═PbSO4,正极上二氧化铅得电子发生还原反应,电极反应式为PbO2+SO42-
+4H++2e-=PbSO4+2H2O,电解质溶液的pH增大,故C正确;
D.铅和稀硫酸能发生反应,负极可能会发生副反应:Pb+H2SO4═PbSO4+H2↑,故D正确;
故选:A。
二、新型化学电池
1、特点:(1)具有能量转化率高等很多优点;
(2)其输出电压低,需要串联起来用;
(3)要连续不断地供给反应物,排除生成物,附属设备较多。
2、碱性氢氧燃料电池:
电池反应:负极:2H++4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
总反应:2H2+O2=2H2O
【习题四】
(2017秋•惠州期末)一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为C2H6+18OH--14e-═2CO32-+12H2O.有关此电池的推断不正确的是()
A.通入氧气的电极为正极
B.参加反应的O2与C2H6的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.放电一段时间后,正极区附近溶液的pH减小
【考点】化学电源新型电池.
【专题】电化学专题.
【分析】乙烷燃料原电池中,负极发生氧化反应,C2H6+18OH--14e-═2CO32-+12H2O,正极发生还原反应,2H2O+O2+4e-=4OH-,根据电极反应式判断电解质溶液的变化以及参加反应物的物质的量之间的关系解答即可.
【解答】解:A.燃料乙烷失电子发生氧化反应,是负极,通入氧气的电极为正极,故A正确;
B.原电池中两极上转移的电子相等,当有28mol电子转移时,正极上消耗
7molO2,负极上消耗2molC2H6,正极与负极上参加反应的气体的物质的量之比为7:2,故B正确;
C.电池工作过程中,电池总反应为2C2H6+8OH-+7O2=4CO32-+10H2O,反应消耗OH-离子,溶液的pH值逐渐减小,故C正确;
D.放电时,正极发生还原反应,2H2O+O2+4e-=4OH-,正极区附近溶液的pH增大,故D错误;
故选:D。
【素材积累】
1、冬天是纯洁的。
冬天一来,世界变得雪白一片,白得毫无瑕疵,白雪松软软地铺摘大地上,好似为大地铺上了一层银色的地毯。
松树上压着厚厚的白雪,宛如慈爱的妈妈温柔地抱着自己的孩子。
白雪下的松枝还露出一点绿色,为这白茫茫的世界增添了一点不一样的色彩。
2、张家界的山真美啊!影影绰绰的群山像是一个睡意未醒的仙女,披着蝉翼般的薄纱,脉脉含情,凝眸不语,摘一座碧如翡翠的山上,还点缀着几朵淡紫、金黄、艳红、清兰的小花儿,把这山装扮得婀娜多姿。
这时,这山好似一位恬静羞涩的少女,随手扯过一片白云当纱巾,遮住了她那美丽的脸庞。
