实验中和热的测定 PPT课件
合集下载
中和热的测定演示课件PPT人教版

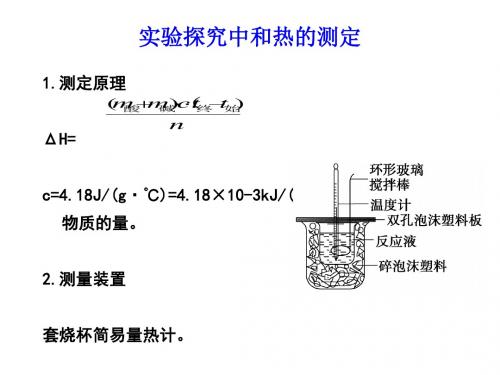
【实验原理】 取一定量酸与碱使之完全反应,根据液体的比热容计算反应放出的 热量,进而计算出中和热。 ΔH=-m酸+m碱n·c·t终-t始 c=4.18 J·g-1·℃-1=4.18×10-3 kJ·g-1·℃-1; n 为生成 H2O 的物质的量。
中和热的测定
计算公式: ΔH=-0.4108.0t225-t1 kJ/mol, t1——起始温度,t2——终止温度。 注意事项: ① 泡沫塑料板和碎泡沫塑料(或纸条)的作用是 ____保__温__隔__热__,___减__少__实__验__过__程__中__热__量__损___失___。 ②为保证酸完全中和,采取的措施是 碱稍微过量 。
实验:中和热的测定
注意: (1)必须是强酸和强碱的稀溶液反应。 (2)产物是 1 mol H2O(l)。
练习 【
】下列关于热化学反应的描述正确的是( )
A.HCl 和 NaOH 反应的中和热 ΔH=-57.3 kJ·mol-1。 则 H2SO4 和 Ca(OH)2 反 应 的 中 和 热 ΔH = 2×( - 57.3)kJ·mol-1 B . CO(g) 的 燃 烧 热 是 283.0 kJ·mol - 1 , 则 2CO2(g)===2CO(g) + O2(g) 反 应 的 ΔH = + (2×283.0)kJ·mol-1 C.1 mol 甲烷燃烧生成气态水和二氧化碳所放出的热量 是甲烷的燃烧热 D.稀醋酸与稀 NaOH 溶液反应生成 1 mol 水,放出 57.3 kJ 热量
【练习】根据中和反应反应热测定的实验,使盐酸与NaOH溶液 混合均匀的正确操作是_____D___(填序号)。 A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
中和反应反应热的测定课件

他物质生成,这部分反应热也不在中和热内。
(4)强酸与强碱反应的中和热的表示:
H+(aq)+OH-(aq)== H2O(l) ΔH=-57.3 kJ·mol-1
(5)中和热是以生成1 mol H2O所放出的热量来定义的,因此在书
写中和热的热化学方程式时,就以生成1 mol H2O为标准来配平其
余物质的化学计量数。如:
也能达到目的。
4.用环形玻璃搅拌棒轻轻搅动溶液的目的是什么?
答案:用环形玻璃搅拌棒轻轻搅动溶液,让NaOH和盐酸尽可能地
完全反应并且使反应产生的热量均匀传递,保证测量的温度准确。
【例2】 实验室用50 mL 0.5 mol·L-1盐酸、50 mL 0.55 mol·L-1
NaOH溶液和如下图所示装置进行测定中和热的实验,得到下表中
中和反应反应热的测定
1.中和反应
(1)定义:酸和碱生成盐和水的反应。
(2)实质:酸电离产生的H+和碱电离产生的OH-反应生成H2O。强
酸和强碱生成可溶性盐和水的离子反应方程式为H++OH-==H2O。
2.中和热
(1)定义:在稀溶液中,酸跟碱发生中和反应而生成1 mol H2O时所
释放的能量叫中和热。
的数据:
实验次数
1
23Βιβλιοθήκη 起始温度 t1/℃盐酸
NaOH 溶液
20.2
20.3
20.3
20.5
21.5
21.6
终止温度 t2/℃
23.7
23.8
24.9
完成下列问题:
(1)实验时用环形玻璃搅拌棒搅拌溶液的方法是
,
不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是
(4)强酸与强碱反应的中和热的表示:
H+(aq)+OH-(aq)== H2O(l) ΔH=-57.3 kJ·mol-1
(5)中和热是以生成1 mol H2O所放出的热量来定义的,因此在书
写中和热的热化学方程式时,就以生成1 mol H2O为标准来配平其
余物质的化学计量数。如:
也能达到目的。
4.用环形玻璃搅拌棒轻轻搅动溶液的目的是什么?
答案:用环形玻璃搅拌棒轻轻搅动溶液,让NaOH和盐酸尽可能地
完全反应并且使反应产生的热量均匀传递,保证测量的温度准确。
【例2】 实验室用50 mL 0.5 mol·L-1盐酸、50 mL 0.55 mol·L-1
NaOH溶液和如下图所示装置进行测定中和热的实验,得到下表中
中和反应反应热的测定
1.中和反应
(1)定义:酸和碱生成盐和水的反应。
(2)实质:酸电离产生的H+和碱电离产生的OH-反应生成H2O。强
酸和强碱生成可溶性盐和水的离子反应方程式为H++OH-==H2O。
2.中和热
(1)定义:在稀溶液中,酸跟碱发生中和反应而生成1 mol H2O时所
释放的能量叫中和热。
的数据:
实验次数
1
23Βιβλιοθήκη 起始温度 t1/℃盐酸
NaOH 溶液
20.2
20.3
20.3
20.5
21.5
21.6
终止温度 t2/℃
23.7
23.8
24.9
完成下列问题:
(1)实验时用环形玻璃搅拌棒搅拌溶液的方法是
,
不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是
中和热测定PPT课件

1.中和反应
中和反应即酸和碱相互作用生成盐和水的反 应,其实质是酸电离产生的 OH- 和碱电离产生 的 H 结合生成难电离的水。强酸、强碱之
+
间的中和反应一般都可用离子方程式H++OH- =H2O表示。
.
1
在稀溶液中,酸跟碱发生中和反应生成1 mol水时 的反应热叫做中和热
1.反应原理: H+(aq) + OH-(aq)=H2O(l);△H=-57.3kJ/mol
NaOH (aq) +HCl (aq) = NaCl (aq) + H2O (l);
57.3kJ/mol
ΔH=
-
⑵ 1L 1mol/L稀硝酸 + 1L 1mol/L氢氧化钾
KOH (aq) +HNO3(aq) = KNO3(aq) + H2O (l); KOH (aq) +1/2H2SO4(aq) = 1/2KΔ2HSO=4(aq) -+ H527O.3k(lJ)/; mol
kJ/mol
0.025
.
0.418 × 3.25
=-
kJ/mol
0.025
14
讨论下列问题:
1.实验所用HCl和NaOH的体积和浓度是否 相等?为什么?
为了保证0.50 mol/L的盐酸完全被NaOH中 和,采用0.55 mol/L NaOH溶液,使碱稍 稍过量。若使盐酸过量,亦可。
.
15
2.为什么在大、小烧杯之间填满泡沫塑料?
不数⑶值同相的1L同强1m酸o、l/强L稀碱硫之酸间+发. 2生L中1m和o反l/应L氢,57氧中.3化和kΔ钾J热/Hm=的o-l4
二、中和热
强酸和强碱反应,实质都是 H+(aq) + OH-(aq) = H2O(l) ΔH= -57.3kJ/mol
中和反应即酸和碱相互作用生成盐和水的反 应,其实质是酸电离产生的 OH- 和碱电离产生 的 H 结合生成难电离的水。强酸、强碱之
+
间的中和反应一般都可用离子方程式H++OH- =H2O表示。
.
1
在稀溶液中,酸跟碱发生中和反应生成1 mol水时 的反应热叫做中和热
1.反应原理: H+(aq) + OH-(aq)=H2O(l);△H=-57.3kJ/mol
NaOH (aq) +HCl (aq) = NaCl (aq) + H2O (l);
57.3kJ/mol
ΔH=
-
⑵ 1L 1mol/L稀硝酸 + 1L 1mol/L氢氧化钾
KOH (aq) +HNO3(aq) = KNO3(aq) + H2O (l); KOH (aq) +1/2H2SO4(aq) = 1/2KΔ2HSO=4(aq) -+ H527O.3k(lJ)/; mol
kJ/mol
0.025
.
0.418 × 3.25
=-
kJ/mol
0.025
14
讨论下列问题:
1.实验所用HCl和NaOH的体积和浓度是否 相等?为什么?
为了保证0.50 mol/L的盐酸完全被NaOH中 和,采用0.55 mol/L NaOH溶液,使碱稍 稍过量。若使盐酸过量,亦可。
.
15
2.为什么在大、小烧杯之间填满泡沫塑料?
不数⑶值同相的1L同强1m酸o、l/强L稀碱硫之酸间+发. 2生L中1m和o反l/应L氢,57氧中.3化和kΔ钾J热/Hm=的o-l4
二、中和热
强酸和强碱反应,实质都是 H+(aq) + OH-(aq) = H2O(l) ΔH= -57.3kJ/mol
中和热的测定 ppt课件

0.025
1、大、小烧杯放置时,为何要使两杯口相平? 填碎纸条的作用是什么?对此装置,你有何更 好的建议?
使杯口盖严,减少热量损失; 填碎纸条达到保温隔热、减少实验热量损失 换用隔热、密封性更好的装置(如保温杯)
当堂检测
1 2 3 4 56
1.已知中和热为57.3 kJ·mol-1,下列关于中和热的说法正 确的是( ) A.中和热指的是酸碱发生中和反应放出的热量 B.HCl和NaOH反应的热化学方程式为
H+(aq)+OH- (aq) === H2O(l) ΔH=-57.3 kJ·mol-1
C.将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合, 放出的热量等于57.3 kJ
(3)终止温度(t2) 把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯的 盐酸 中, 并把量筒中的 NaOH溶液 一次倒入小烧杯中,盖好盖板。用 环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的
最高温度 ,记录为终止温度t2
(4)重复实验操作三次,记录三次的实验数据,取其平均值作 为计算依据。(相差大得数据,应舍去)
2.实验装置 (1)将下列实验装置中各仪器(或物品)的名称填在横线上。
温度计 泡沫塑料盖板
碎泡沫塑料
环形玻璃搅拌棒
100mL小烧杯 500mL大烧杯
(2)实验过程中,还需要的其他仪器有 50 mL量筒(2个)。
3.实验测量数据 (1)组装绝热装置 (2)初始温度(t1) 用一 量筒 量取50 mL 0.50 mol·L-1盐酸,倒入 小烧杯 中并 测量其 温度 ;用另一量筒 量取50 mL 0.55 mol·L-1 NaOH 溶液并测量其 温度 ,取两温度平均值为t1。
中和反应的反应热及其测定
1、大、小烧杯放置时,为何要使两杯口相平? 填碎纸条的作用是什么?对此装置,你有何更 好的建议?
使杯口盖严,减少热量损失; 填碎纸条达到保温隔热、减少实验热量损失 换用隔热、密封性更好的装置(如保温杯)
当堂检测
1 2 3 4 56
1.已知中和热为57.3 kJ·mol-1,下列关于中和热的说法正 确的是( ) A.中和热指的是酸碱发生中和反应放出的热量 B.HCl和NaOH反应的热化学方程式为
H+(aq)+OH- (aq) === H2O(l) ΔH=-57.3 kJ·mol-1
C.将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合, 放出的热量等于57.3 kJ
(3)终止温度(t2) 把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯的 盐酸 中, 并把量筒中的 NaOH溶液 一次倒入小烧杯中,盖好盖板。用 环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的
最高温度 ,记录为终止温度t2
(4)重复实验操作三次,记录三次的实验数据,取其平均值作 为计算依据。(相差大得数据,应舍去)
2.实验装置 (1)将下列实验装置中各仪器(或物品)的名称填在横线上。
温度计 泡沫塑料盖板
碎泡沫塑料
环形玻璃搅拌棒
100mL小烧杯 500mL大烧杯
(2)实验过程中,还需要的其他仪器有 50 mL量筒(2个)。
3.实验测量数据 (1)组装绝热装置 (2)初始温度(t1) 用一 量筒 量取50 mL 0.50 mol·L-1盐酸,倒入 小烧杯 中并 测量其 温度 ;用另一量筒 量取50 mL 0.55 mol·L-1 NaOH 溶液并测量其 温度 ,取两温度平均值为t1。
中和反应的反应热及其测定
化学课件《中和热的测定》优秀ppt1 人教课标版
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
(5)根据实验数据计算:
t始=
tHCltNaOH(若实验过程中保证盐酸与NaOH溶液温 2
度相同,则无需用该公式计算)
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
(5)根据实验数据计算:
t始=
tHCltNaOH(若实验过程中保证盐酸与NaOH溶液温 2
度相同,则无需用该公式计算)
人教版高中化学选修4第一节中和热的测定(实验课)上学期-PPT文档资料

本节课,我们取一定量的盐酸和氢氧化钠溶 液发生中和反应,哪些数据可以帮助我们测 出它们的反应热呢?请大家讨论回答。
Q =m c Δt
Q:中和反应放出的热量。 m:反应混合液的质量。 c:反应混合液的比热容。 Δt:反应前后溶液温度的差值。
①
m的质量为所用酸、碱的质量和,测出参加反应 的酸、碱质量相加即可;c 需要查阅,Δt可用温 度计测出反应前后的温度相减得到。中
和热)呢? 2.中和热与反应热是否相同?它们之间有什么区别和联系?
不同;它们都是指化学反应放出的能量,但中和 热仅指在稀溶液中,酸跟碱发生中和反应而生成 1 mol水时的反应热。任何一个化学反应发生所放出 的热量都叫反应热,但却不一定是中和热。
第 一 章
实践活动 中和反应 反应热的测定
实验名称 中和反应 反应热的测定 实验原理: Q=mcΔt ① Q:中和反应放出的热量。 m:反应混合液的质量。 c:反应混合液的比热容。 Δt:反应前后溶液温度的差值。 Q=(V酸ρ酸+V碱ρ碱)· c· (t2-t1)② V酸=V碱=50 mL。 c酸=0.50 mol/L c碱=0.55 mol/L ρ酸=ρ碱=1 g/cm3 c=4.18 J/(g· ℃) Q=0.418(t2-t1)kJ ③ 实验步骤 误差分析
0.418 (t2-t1) 0.025
kJ/mol
实验步骤:
1.在大烧杯底部垫泡沫塑料(或纸条),使放 入的小烧杯杯口与大烧杯杯口相平。然后再在 大、小烧杯之间填满碎泡沫塑料(或纸条), 大烧杯上用泡沫塑料板(或硬纸板)作盖板, 在板中间开两个小孔,正好使温度计和环形玻 璃搅拌棒通过,如下图所示。
已知 V酸=V碱=50 mL。 c酸=0.50 mol/L c碱=0.55 mol/L。 ρ酸=ρ碱=1 g/cm3 c=4.18 J/(g· ℃) 请把以上数据代入式②,得出Q的表示式。其中热量的单 位用kJ。 得出结果。
中和热的测量 PPT 通用

•
20、生活不会按你想要的方式进行,它会给你一段时间,让你孤独、迷茫又沉默忧郁。但如果靠这段时间跟自己独处,多看一本书,去做可以做的事,放下过去的人,等你度过低潮,那些独处的时光必定能照亮你的路,也是这些不堪陪你成熟。所以,现在没那么糟,看似生活对你的亏欠 ,其实都是祝愿。
•
5、心情就像衣服,脏了就拿去洗洗,晒晒,阳光自然就会蔓延开来。阳光那么好,何必自寻烦恼,过好每一个当下,一万个美丽的未来抵不过一个温暖的现在。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L
NaOH溶液进行反应,与上述实验相比,所放出的热量 不等
(填“相等”“不相等”),所求中和热相等
(填“相
等(5”)“用不相相同等浓”度)和,体简积H述因2的O为理所氨中由放和水出:热代的是能替指量酸N,跟a与O碱酸发H碱溶生的中液用和进量反无行应关生上。成述1 m实o验l ,
本实验中,我们所用一元酸、一元碱的体积均 为
50 mL, 它 们的浓度分别为0.50 mol/L和0.50 mol/L。
由于是稀溶液,且为了计算简便,我们近似地认为,所
用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液
的比热容为 4.18 J/(g·℃)
已知 V酸=V碱=50 mL。 c酸=0.50 mol/L c碱=0.50 mol/L。
.酸、碱混合时,为何要把量筒中的NaOH溶液一次倒 入小烧杯而不能缓缓倒入? . 因为本实验的关键是测反应的反应热,若动作迟 缓,将会使热量损失而使误差增大。
4.把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中, 并把量筒中的NaOH溶液一次倒入小烧杯(注意不要 洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并 准确读取混合溶液的最高H=
中和反应反应热的测定 课件

三、实验误差的分析
实验测定的结果普遍偏低,主要原因是反应过程中 的热量的损失,所以在反应中要采取较好的绝热措施以 减小实验误差。
2.实验室进行中和热的测定的实验时除需要大烧杯(500 mL)、小烧
杯(100 mL)外,其他所用的仪器和试剂均正确的一组是( D )
A.0.50 mol/L 盐酸,0.50 mol/L NaOH 溶液,100 mL 量筒 1 个 B.0.50 mol/L 盐酸,0.55 mol/L NaOH 溶液,100 mL 量筒 2 个 C.0.50 mol/L 盐酸,0.55 mol/L NaOH 溶液,50 mL 量筒 1 个 D.0.50 mol/L 盐酸,0.55 mol/L NaOH 溶液,50 mL 量筒 2 个
3、在 800 mL 的大烧杯中放入碎纸屑,把盛有 50 mL 0.50 mol·L-1 盐酸的 200 mL 烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫塑 料板做成大烧杯盖,通过盖子插入一根玻璃搅拌棒(末端呈半圆环的玻 璃棒)和一只温度计,测定溶液的温度。迅速往盐酸溶液中加入 50 mL 0.55 mol·L-1 烧碱溶液,盖好,搅拌溶液,观察温度的变化。当温 度保持稳定时,记录读数,取出装反应液的烧杯,倒出溶液,清洗干 净,保持内外杯壁干燥。重复进行三次实验。用这一实验可以粗略测 定中和热。
答案: (1)不能,因为金属易导热,会造成热量损失,增大实验误差。 (2)保证 0.50 mol/L 的盐酸全部反应,提高实验的精确度。
2、含有 11.2 g KOH 的稀溶液与 1 L 0.1 mol/L 的 H2SO4 溶液反应,放出
11.46 kJ 的热量,表示该反应中和热的化学方程式为( D )
ΔH=+114.6 kJ/mol ΔH=-114.6 kJ/mol ΔH=-57.3 kJ/mol
中和热测定PPT课件

5
• 燃烧热和中和热的区别与联系Leabharlann 相同点能量变化 △H
燃烧热
中和热
放热反应
△H<0
反应物的量 1mol(可燃物)
不同点
生成物的量
反应热的含 义
H2O是1mol
1mol反应物完全 燃烧时放出的热 量;不同反应物, 燃烧热不同。
生成1mol H2O时 放出的热量;不 同反应物的中和 热大致相同,均 约为57.3kJ/mol
Q =(V酸ρ酸+V碱ρ碱)·c·(t2-t1) ②
.
9
Q =(V酸ρ酸+V碱ρ碱)·c·(t2-t1) ②
药品
50mL 0.50 mol/L 盐酸 50mL 0.55 mol/L NaOH溶液
已知 V酸=V碱=50 mL。 ρ酸=ρ碱=1 g/cm3 c=4.18×10-3 kJ/(g·℃)
请把以上数据代入式②,得出Q的表示式:
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,
各溶液密度为1g/cm3,生成溶液的比热容C=
4.18J/(g·℃)实验起始温度为22.0℃,终止温度为
25.4℃。试求中和热△H=________-___________。
56.8kJ/m
.
ol
19
[练习]50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L
(2)ΔH = - [100 g×4.18×10 - 3 kJ·(g·℃) -
1×3.4 ℃]÷0.025 mol=-56.8 kJ·mol-1。
(3)因弱电解质的电离过程是吸热的,将 NaOH溶液改为相同体积、相同浓度的氨水反应
后放出的热量少,所以ΔH1>ΔH。
.
35
中和热的测定PPT教学课件

学方程式为:
。
解析 考查学生对中和热测定的实验能力、对出现问题 的分析和理解能力,热化学方程式的书写、误差分析等。 由于本实验的关键是如何防止热量的损失,所以填充大 量泡沫、使用玻璃搅拌器、稍过量的氢氧化钠等; (3)中由于参加反应的盐酸(60 mL 0.50 mol/L)与氢 氧化钠(50 mL 0.55 mol/L)完全反应后生成的水的物质 的量(50 mL×0.55 mol/L)比原先(50 mL×0.50 mol/L) 多,所以放出的热量多,但中和热不变。
(4)偏小
返回
Unit 9 Do you want to go to a movie?
Section A Period 1
Let’s go to a movie!
猫和老鼠
Do you know what kind of movie is this?
cartoon
action movie
comedy
(1)本实验中用稍过量的NaOH的原因教材中说是为保证 盐酸完全被中和。试问:盐酸在反应中若因为有放热现 象,而造成少量盐酸在反应中挥发,则测得的中和热
(填“偏大”、“偏小”或“不变”)。 (2)该实验小组做了三次实验,每次取溶液各50 mL, 并记录如下原始数据。
实验 序号
起始温度t1/℃
盐酸
Yes, I do. /No, I don’t. ➢Does he want to go to a movie?
Yes, he does./ No, he doesn’t. ➢Does she want to go to a movie?
Yes, she does./ No, she doesn’t.
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL
中和热的测定课件-高二化学人教版(2019)选择性必修1

(4)操作步骤
①酸溶液温度的测量:用量筒量取50ml 0.5mol/l 盐酸,打开杯盖,倒入量热计的内
筒,盖上杯盖插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,
擦干备用。
②碱溶液温度的测量:用另一个量筒量取50ml 0.55mol/lNaOH溶液,用温度计测量
并记录NaOH溶液的温度。
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
比较数值大小即可!
C.做本实验的当天,室温较高
D.将50 mL 0.55 mol·L-1的氢氧化钠溶液换成了50 mL 0.55 mol·L-1的氨水
E.在量取盐酸时仰视读数
F. 大烧杯的盖板中间小孔太大
燃烧热 中和热
[特别提醒]ΔH 表示反应已完成的热量变化,与反应是否可逆无关。
(
B
)
C
[2020·浙江7月选考,27] . ⋅ − 溶液与 . 锌粉在量热
计中充分反应。测得反应前温度为 . ∘ ,反应后最高温度为 . ∘ 。
已知:反应前后,溶液的比热容均近似为 . ⋅
∘
−
⋅
− 、溶液的密度均近似为
【实验探究】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在
如上图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是
保温隔热、减少实验过程中的热量损失。;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?______(填“能”或“不能”),
. 分多次把 溶液倒入盛有硫酸的小烧杯中
. 用温度计测定 溶液起始温度后直接测定 溶液的温度
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ρ酸=ρ碱=1 g/cm3
c=4.18 J/(g·℃)
Q=0.418(t2-t1)kJ
③
实验步骤
误差分析
2020/7/11
14
[练习]50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L -
1NaOH溶液在图示的装置中进行中和反应。通过测定反应过
程中所放出的热量可计算中和热。回答下列问题:
温度计上的酸为何要用水冲洗干净?冲洗后的溶
液能否倒入小烧杯?为什么?
因为该温度计还要用来测碱液的温度,若不冲洗,
温度计上的酸会和碱发生中和反应而使热量散失,
故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若
倒入,会使总溶液的质量增加,而导致实验结果误
差。 2020/7/11
10
3.用另一个量筒量取50 mL 0.55 mol/L NaOH溶液, 并用温度计测量NaOH溶液的温度,记入下表。
ρ酸=ρ碱=1 g/cm3 c=4.18 J/(g·℃)
请把以上数据代入式②,得出Q的表示式。其中热量的单
位用kJ。 得出结果。
思考Q:③= 式0表.41示8的(是t2不-是t1该)反kJ应的反应③热?
是中和热吗?为什么?
2020/7/11
7
③式不是该反应的反应热,因为反应热是有正负的, 中和反应放热,故其ΔH为“-”。中和热是稀的酸、 碱中和生成 1 mol水的反应热,而50 mL 0.50 mol/L 的盐酸与50 mL 0.55 mol/L 氢氧化钠反应后生成的水 只有0.025 mol,故③式表示的也不是中和热。
测得的中和热的△H会
偏;大用50 mL 0.50mol/L NaOH
溶液进行上述实验,测得的中和热的△H会
。
(均偏填大“偏大”“偏小”“无影响”)
2020/7/11
15
有关“中和热”的练习
1、在做中和热的测定实验中,使用下列 用品不是为了减少实验误差的是( D )
A.碎泡沫塑料 B.环行玻璃棒 C.底部垫纸条 D. 两个量筒
大、小烧杯放置时,为
何要使两杯口相平?填
碎纸条的作用是什么?
对此装置,你有何更好
的建议?
2020/7/11
中和热的测定 9
答案:.两杯口相平,可使盖板把杯口尽量盖严,从 而减少热量损失;填碎纸条的作用是为了达到保温 隔热、减少实验过程中热量损失的目的。若换用隔 热、密封性能更好的装置(如保温杯)会使实验结 果更准确。 2.用一个量筒最取50 mL 0.50 mol/L盐酸,倒入小 烧杯中,并用温度计测量盐酸的温度,记入下表。 然后把温度计上的酸用水冲洗干净。
答案:1.会有所变化。因为醋酸为弱电解质,其电
离时要吸热,故将使测得结果偏小。
2.否。因中和热是指酸与碱发生中和反应生成1
mol H2O时放出的热量,其数值与反应物的量的 多少无关,故所测结果应基本和本次实验结果相
同(若所有操作都准确无误,且无热量损失,则
二者结果相同)。
2020/7/11
17
2、 50mLo.5moL.L-1盐酸与50mLo.55moL.L-1NaOH
的热量都叫反应热,但却不一定是中和热。
本节课,我们取一定量的盐酸和氢氧化钠溶
液发生中和反应,哪些数据可以帮助我们测
出它们的反应热呢?请大家讨论回答。
2020/7/11
5
Q =m c Δt
①
Q:中和反应放出的热量。
m:反应混合液的质量。
c:反应混合液的比热容。
Δt:反应前后溶液温度的差值。
我们如何得到上述数据呢?
本实验中,我们所用一元酸、一元碱的体积均 为
50 mL, 它 们的浓度分别为0.50 mol/L和0.55 mol/L。
由于是稀溶液,且为了计算简便,我们近似地认为,所
用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液
的比热容为 4.18 J/(g·℃)
已知 V酸=V碱=50 mL。 c酸=0.50 mol/L c碱=0.55 mol/L。
.酸、碱混合时,为何要把量筒中的NaOH溶液一次倒 入小烧杯而不能缓缓倒入? . 因为本实验的关键是测反应的反应热,若动作迟 缓,将会使热量损失而使误差增大。
4.把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中, 并把量筒中的NaOH溶液一次倒入小烧杯(注意不要 洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并 准确读取混合溶液的最高温度,记为终止温度,记 入下表。
实验二 中和热的测定
2020/7/11
1
(8分) 中和热测定实验的关键是要比较准确地配制一 定的物质的量浓度的溶液,量热器要尽量做到绝热; 在量热的过程中要尽量避免热量的散失,比较准确地 测量出反应前后溶液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器 有:__________:
• (3)偏少
• (4)不等
相等
• 因为中和热是指酸跟碱发生中和反应生成 所放出的热量,与酸碱的用量无关
• (5)、偏少
偏少
2020/7/11
21
• (1)烧杯、温度计、量筒、环形玻璃搅拌棒
(2)保证盐酸完全被中和:散热太快
2020/7/11
22
m的质量为所用酸、碱的质量和,测出参加反应 的酸、碱质量相加即可;c 需要查阅,Δt可用温 度计测出反应前后的温度相减得到。
[问]酸、碱反应时,我们用的是它的稀溶液,它们的 质量应怎样得到?
量出它们的体积,再乘以它们的密度即可。
2020/7/11
6
Q =(V酸ρ酸+V碱ρ碱)·c·(t2-t1) ②
2020/7/11
13
实验目的: 测定强酸、强碱反应的中和热。
实验原理: Q=mcΔt
①
Q:中和反应放出的热量。
m:反应混合液的质量。
c:反应混合液的比热容。
Δt:反应前后溶液温度的差值。
Q=(V酸ρ酸+V碱ρ碱)·c·(t2-t1)② V酸=V碱=50 mL。
c酸=0.50 mol/L c碱=0.55 mol/L
2020/7/11
4
[问题]1.我们利用什么原理来测定酸、碱反应的中和热呢?
实验原理: Q=mcΔt
ΔH= -
Q
n
kJ/mol
2.中和热与反应热是否相同?它们之间有什么区别和联系?
不同;它们都是指化学反应放出的能量,但中和
热仅指在稀溶液中,酸跟碱发生中和反应而生成1
mol水时的反应热。任何一个化学反应发生所放出
2020/7/11
12
[议一议]你所测得的数据是否为57.3 kJ/mol,
若不是,分析产生误差的原因。
可能的原因有: 1.量取溶液的体积有误差(测量结果是按50 mL的酸、碱进 行计算,若实际量取时,多于50 mL或小于50 mL都会造成 误差) 2.温度计的读数有误。 3.实验过程中有液体洒在外面。 4.混合酸、碱溶液时,动作缓慢,导致实验误差。 5.隔热操作不到位,致使实验过程中热量损失而导致误差。 6.测了酸后的温度计未用水清洗而便立即去测碱的温度,致 使热量损失而引起误差。
(1)从实验装置上看,图中尚缺少的一种玻璃用品
是 环形玻璃搅拌。棒
减少实验过程中的
(2)烧杯间填满碎纸条的作用是 热量损失
。
(3)大烧杯上如不盖硬纸板,求得的中和热△H 偏大 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L
NaOH溶液进行反应,与上述实验相比,所放出的热量 不等 (填“相等”“不相等”),所求中和热相等△H (填“相 等(5”)“用不相相同等浓”度)和,体简积H述因2的O为理所氨中由放和水出:热代的是能替指量酸N,跟a与O碱酸发H碱溶生的中液用和进量反无行应关生上。成述1 m实o验l ,
实验中所用HCl和NaOH的物质的量比为何不 是1∶1而是NaOH过量?若用HCl过量行吗?
2020/7/11
11
为了保证0.50 mol/L的盐酸完全被NaOH中和, 采用0.55 mol/L NaOH溶液,使碱稍稍过量。若使 盐酸过量,亦可。
5.重复实验两次,取测量所得数据的平均值作为 计算依据。
3
●实验目的
测定强酸、强碱反应的中和热
●学习重点
中和热的测定原理和方法。
●实验用品
大烧杯(500 mL)、小烧杯(100 mL) 温度计、量筒(50 mL)两个、泡沫塑料 或纸条、泡沫塑料板或硬纸板(中心有两个 小孔)、环形玻璃搅拌棒。 0.50 mol/L 盐酸、0.55 mol/L NaOH溶液
(3)、大烧杯上如不盖硬纸扳,求得的中和热数值--------(填“偏小”“偏大”“无影响”)
2020/7/11
18
2020/7/11
19
(4)、实验中改用60mLo.55moL.L-1盐酸与
65mLo.55moL.L-1NaOH溶液进行反应,与
上述实验相比,所放出的热量-------------------(填“相等”“不相等”),所求中和热------------------ (填“相等”“不相等”)简述理 由:————————————————————————— ———。
C=4.18J/(g·℃),则该中和反应放出热量为 ________kJ(填表达式),
ΔH _________ kJ/mol(填表达式)。
2020/7/11
2
中和热:
中和热:酸和碱发生中和反应生成1mol水时释 放的热量称为中和热。
在常温常压下, ΔH= -57.3kJ/mol
2020/7/11
[问题]该反应的中和热应怎样表示呢?
ΔH= -
0.418 (t2-t1) kJ/mol
