高效液相色谱法的主要类型及其分离原理
高效液相色谱的原理

高效液相色谱的原理高效液相色谱(High Performance Liquid Chromatography,HPLC)是一种基于分子间相互作用力进行化合物分离和分析的方法。
它主要由四个部分组成:流动相,固定相,色谱柱和检测器。
其原理如下:1. 流动相:液相在常温下以高压泵的作用下通过色谱柱,它可以是有机溶剂、水或其他特定的溶剂组合。
流动相在整个过程中起到带动样品运动以及分离化合物的作用。
2. 固定相:为了实现分离,需要使用一种高表面积的固相材料将样品担持在流动相中进行分离。
固定相通常以粉末或颗粒的形式填充在色谱柱中,常见的固定相材料有硅胶、高性能液相色谱柱(如C18)等。
固定相的选择取决于目标分析化合物的特性。
3. 色谱柱:色谱柱是将固定相填充在其中的管状包层,它是高效液相色谱分离的关键部分。
色谱柱的长度、内径和填充粒径等参数会对分离效果产生影响。
较长、较细的柱内填充材料可以提高分离效率,但也会增加分析时间。
4. 检测器:在色谱柱出口处使用检测器来检测化合物的浓度。
常用的检测器包括紫外-可见吸收检测器(UV-Vis)、荧光检测器、电化学检测器等。
检测器将检测到的信号转化为可见的色谱图谱,用以分析和定量目标化合物。
在高效液相色谱分离过程中,样品溶液被注入到进样器中,经由高压泵送入色谱柱。
在色谱柱中,化合物会与固定相发生不同程度的相互作用,并在流动相的作用下逐渐分离。
分离出的化合物会依次出现在检测器中,通过检测器的信号输出,我们可以获得色谱图,并通过峰面积或峰高等参数对化合物进行定量和定性分析。
高效液相色谱的优点包括分离效率高、分析速度快、样品制备简单等,因此被广泛应用于生物医药、农药残留、环境监测等领域的化学分析。
高效液相色谱法

2.高效液相色谱法与气相色谱法的比较
(l)气相色谱法:分析对象仅占有机物总数的20%。 高效液相色谱法:分离和分析占有机物总数近80%的那些 高沸点、热稳定性差、离子型化合物及摩尔质量大的物质。
(2)气相色谱:流动相与组分不产生相互作用力,仅起运 载作用。 高效液相色谱法:流动相对组分可产生一定亲和力,并参与 固定相对组分作用的剧烈竞争,流动相对分离起很大作用, 相当于增加了一个控制和改进分离条件的参数;
高压输液泵应符合下列要求:密封性好,输出 流量恒定,压力平稳,可调范围宽,便于迅速 更换溶剂及耐腐蚀。
高压输液泵
常用的输液泵分为恒流泵和恒压泵两种。 恒流泵特点是在一定操作条件下,输出流量保持恒定而与色谱 柱引起阻力变化无关; 恒压泵是指能保持输出压力恒定,但其流量则随色谱系统阻力 而变化,故保留时间的重视性差。 目前主要使用恒流泵,又称机械泵,它又分机械注射泵和机械 往复泵两种,应用最多的是机械往复泵。
(四)检测系统
两种基本类型的检测器: 溶质型检测器:它仅对被分离组分的物理或化学特性有响应, 属于这类检测器的有紫外、荧光、安培检测器等。 总体检测器:它对试样和洗脱液总的物理或化学性质有响应, 属于这类检测器的有示差折光,电导检测器等。 (l)紫外检测器 (2)荧光检测器 (3)示差折光率检测器 (4)电化学检测器
高效液相色谱法
High Performance Liquid Chromatography,HPLC
§1
概 述
Introduction
一、高效液相色谱法概述
高效液相色谱法(HPLC)吸取了气相色谱与经典液相色谱优 点,并用现代化手段加以改进。
引入了气相色谱的理论;
在技术上采用了高压泵、高效固定相和高灵敏度检测器; 具备速度快、效率高、灵敏度高、操作自动化的特点;
高效液相色谱法的分离原理

高效液相色谱法的分离原理(原创版)目录一、高效液相色谱法的基本概念二、高效液相色谱法的分离原理1.流动相与固定相的相互作用2.溶质在两相间的分配3.平衡时的计算公式三、高效液相色谱法的应用领域四、高效液相色谱法的常见故障及其排除方法正文高效液相色谱法(High Performance Liquid Chromatography,HPLC)是一种以液体为流动相的色谱分析方法,广泛应用于医药卫生、食品安全、环境化学等各个领域。
其分离原理主要基于溶质在固定相和流动相之间的分配,达到平衡时,服从于高效液相色谱计算公式。
在高效液相色谱法中,流动相与固定相之间应互不相溶,且具有明显的分界面。
当试样进入色谱柱后,溶质会在两相间进行分配。
在达到平衡时,溶质在固定相和流动相中的浓度会达到一定的比例关系。
通过计算公式,我们可以得到溶质在固定相和流动相中的浓度。
高效液相色谱法的应用领域十分广泛,包括但不限于医药卫生、食品安全、环境化学等各个领域。
在医药卫生领域,高效液相色谱法可以用于药物分析、药物研发和药品质量控制等;在食品安全领域,可以用于食品成分分析、添加剂检测和农药残留检测等;在环境化学领域,可以用于水质分析、土壤污染检测和空气污染监测等。
在使用高效液相色谱法过程中,可能会遇到一些常见故障,如流动相泄漏、检测器信号不稳定、色谱柱分离效果差等。
对于这些故障,我们可以采取相应的排除和解决方法。
例如,对于流动相泄漏,可以检查流动相输送管路是否破损、接头是否松动等;对于检测器信号不稳定,可以检查检测器是否受到外界干扰、信号线是否接触良好等;对于色谱柱分离效果差,可以检查色谱柱是否损坏、固定相是否流失等。
综上所述,高效液相色谱法是一种分离效果高、速度快、应用广泛的色谱分析方法。
第1页共1页。
高效液相色谱的工作原理及操作注意事项

高效液相色谱的工作原理及操作注意事项高效液相色谱的工作原理及操作注意事项一、高效液相色谱的工作原理高效液相色谱(HPLC)是一种常用的分离和分析技术,主要应用于化学、生物、医药等领域。
其工作原理是利用不同物质在固定相和移动相之间的分配平衡,实现对待测组分的高效分离。
以下是高效液相色谱的工作原理:1.流动相:高效液相色谱中的流动相也称为溶剂或载体,是携带待测组分通过色谱柱的介质。
流动相的选择应根据样品的性质、检测器的类型以及分离效果等因素进行选择。
2.固定相:高效液相色谱中的固定相是色谱柱中的填料,通常是涂布在硅胶或氧化铝等载体上的高分子聚合物。
不同物质根据其在固定相和流动相之间的分配系数进行分离。
3.洗脱过程:在高效液相色谱中,待测组分随流动相通过色谱柱,经过固定相和流动相之间的分配平衡实现分离。
分离后的组分会按照其在固定相和流动相之间的分配系数依次流出色谱柱,进入检测器进行检测。
4.检测器:高效液相色谱中使用的检测器根据待测组分的性质和检测要求进行选择,常见的有紫外-可见光检测器、荧光检测器、电导检测器等。
检测器的作用是将组分的浓度转化为可测量的电信号,以便进行记录和分析。
二、高效液相色谱的操作注意事项在使用高效液相色谱进行实验操作时,需要注意以下事项:1.样品准备:在进行高效液相色谱分析前,需要对样品进行必要的处理和制备。
应尽可能避免样品中的杂质和干扰物质对分离和分析的影响。
同时,样品的浓度应适中,以避免色谱柱过载或检测器过载。
2.流动相选择:流动相的选择对高效液相色谱的分离效果和分析结果至关重要。
应根据样品的性质、实验要求以及分离效果等因素选择合适的流动相。
同时,应注意流动相的纯度和稳定性,以保证实验结果的可靠性。
3.色谱柱选择:高效液相色谱中使用的色谱柱是分离和分析的关键元件。
应根据样品的性质、待测组分的类型以及分离要求等因素选择合适的色谱柱。
同时,应注意色谱柱的粒径、孔径和填料性质等参数,以确保达到最佳的分离效果。
论述高效液相色谱中常用的分离模式及工作原理

论述高效液相色谱中常用的分离模式及工作原理高效液相色谱(High Performance Liquid Chromatography, HPLC)是一种广泛应用于物质分离、纯化和定量分析的分析技术。
其高效性能主要得益于其独特的分离模式和工作原理。
在高效液相色谱中,常用的分离模式包括反相色谱、离子交换色谱、凝胶过滤色谱、亲和色谱等。
本文将逐步解释这些分离模式的工作原理。
首先,我们来介绍反相色谱(RPLC)。
反相色谱是HPLC中最常见的分离模式。
在反相色谱中,固定相是由疏水性的支持物表面进行修饰而得到的。
样品溶液在流动相的推动下,通过与固定相之间的亲疏水相互作用来分离。
疏水性物质在反相色谱中相对亲疏水性中亲水性物质在反相色谱中相对疏水性物质分离的速度更快。
因此,反相色谱可以广泛应用于酚类化合物、脂肪酸、药物和多肽等的分离。
接下来是离子交换色谱(IEC)。
离子交换色谱是基于固定相上的阴、阳离子交换基团与样品中的离子进行离子交换作用来分离的。
在离子交换色谱中,固定相通常是一种离子交换树脂,它具有具体的功能基团,如硫酸基团、胺基团等。
在离子交换色谱中,样品溶液与离子交换树脂之间发生的离子交换反应决定着样品的分离效果。
离子交换色谱广泛应用于离子、氨基酸、蛋白质和核酸等的分离。
第三种常见的分离模式是凝胶过滤色谱(GFC)。
凝胶过滤色谱是基于样品中分子的分子大小来实现分离的。
在凝胶过滤色谱中,固定相是由合适的多孔性材料构成。
较大的分子无法穿过固定相的孔隙,因而会在流动相的推动下被留下,而较小的分子则可以穿过固定相的孔隙并进行解析。
凝胶过滤色谱常用于蛋白质、多肽、寡核苷酸和碳水化合物等的分离。
最后是亲和色谱(AFC)。
亲和色谱是基于样品分离物与固定相之间特定的亲和反应进行分离的。
在亲和色谱中,固定相常常是由一种具有亲和性和特异性的配体进行修饰得到的。
这种配体可以选择性地与目标分析物结合,而其他的干扰物则被保留下来。
高效液相色谱法的分类及原理

高效液相色谱法的分类及其分离原理高效液相色谱法分为:液-固色谱法、液-液色谱法、离子交换色谱法、凝胶色谱法。
1.液-固色谱法(液-固吸附色谱法)固定相是固体吸附剂,它是根据物质在固定相上的吸附作用不同来进行分配的。
①液-固色谱法的作用机制吸附剂:一些多孔的固体颗粒物质,其表面常存在分散的吸附中心点。
流动相中的溶质分子X(液相)被流动相S带入色谱柱后,在随载液流动的过程中,发生如下交换反应:X(液相)+nS(吸附)<==>X(吸附)+nS(液相)其作用机制是溶质分子X(液相)和溶剂分子S(液相)对吸附剂活性表面的竞争吸附。
吸附反应的平衡常数K为:K值较小:溶剂分子吸附力很强,被吸附的溶质分子很少,先流出色谱柱。
K值较大:表示该组分分子的吸附能力较强,后流出色谱柱。
发生在吸附剂表面上的吸附-解吸平衡,就是液-固色谱分离的基础。
②液-固色谱法的吸附剂和流动相常用的液-固色谱吸附剂:薄膜型硅胶、全多孔型硅胶、薄膜型氧化铝、全多孔型氧化铝、分子筛、聚酰胺等。
一般规律:对于固定相而言,非极性分子与极性吸附剂(如硅胶、氧化铜)之间的作用力很弱,分配比k较小,保留时间较短;但极性分子与极性吸附剂之间的作用力很强,分配比k大,保留时间长。
对流动相的基本要求:试样要能够溶于流动相中流动相粘度较小流动相不能影响试样的检测常用的流动相:甲醇、乙醚、苯、乙腈、乙酸乙酯、吡啶等。
③液-固色谱法的应用常用于分离极性不同的化合物、含有不同类型或不;数量官能团的有机化合物,以及有机化合物的不同的异构体;但液-固色谱法不宜用于分离同系物,因为液-固色谱对不同相对分子质量的同系物选择性不高。
2.液-液色谱法(液-液分配色谱法)将液体固定液涂渍在担体上作为固定相。
①液-液色谱法的作用机制溶质在两相间进行分配时,在固定液中溶解度较小的组分较难进入固定液,在色谱柱中向前迁移速度较快;在固定液中溶解度较大的组分容易进入固定液,在色谱柱中向前迁移速度较慢,从而达到分离的目的。
第二节 高效液相色谱的分离原理及主要类型

凝胶色谱特点和应用范围
★ 特点: a. 峰形窄,利于检测; b. 固定相和流动相选择简便; c. 适用范围广; d. 不能用来分离大小相似,相对分子质量接近的分子。
★ 适用范围:不能分离复杂的化合物;主要用来获得聚合 物的相对分子质量分布情况。
定 相
非极性固定相
多孔微粒活性炭
全多孔球形硅胶
多孔石墨化碳黑
苯乙烯-二乙烯基苯共聚物多孔微球
碳多孔微球
流 洗脱液的选择:相似相溶 动 极性大的组份用极性强的洗脱剂,极性弱的 相 组份用极性弱的洗脱剂
吸附色谱的优势:异构体分离
三、离子交换色谱法
分离机理:基于离子交换树脂上可电离的离子和流 动相中具有相同电荷的溶质离子进行可逆交换, 依据这些离子对交换剂具有不同的亲和力而分离。
一般离子交换色谱
谱
离子色谱
凝胶渗透色谱 凝胶色谱
凝胶过滤色谱 亲合色谱,手性色谱,毛细管电泳,假相色谱
一、液-液色谱法
与载体 结合方式
特点
使用程度
涂渍固定相
键合固定相
涂渍
键合
固定液易于流失 柱寿命短
分离的重现性差
稳定耐热 不易流失 柱寿命长 重现性和分离效果好
很少使用
发展方向
正相色谱和反相色谱比较
二、液-固色谱法
• 分离机理:基于各组分在固体收附剂表面吸附能力 的不同;组分分子和流动相分子在吸附剂表面活性 中心发生竞争吸附。
• 适用对象:对具有不同官能团的化合物和异构体有 较高的选择性。
液-固吸附色谱固定相和流动相
固定相
氧化铝和氧化镁
极性固定相 硅酸镁分子筛等
无定形硅胶
高效液相色谱原理
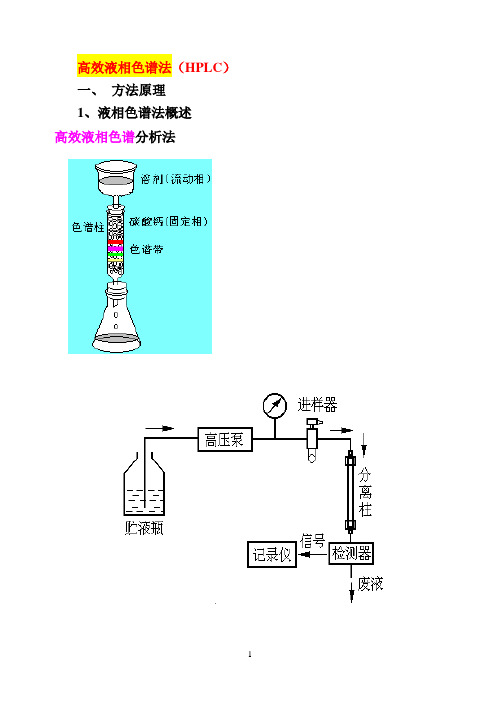
高效液相色谱法(HPLC)一、方法原理1、液相色谱法概述高效液相色谱分析法其工作流程为:高压输液泵将贮液器中的流动相以稳定的流速(或压力)输送至分析体系,在色谱柱之前通过进样器将样品导人,流动相将样品依次带入预柱、色谱柱,在色谱柱中各组分被分离,并依次随流动相流至检测器,检测到的信号送至数据处理系统记录、处理和保存。
HPLC仪器的基本结构2、高效液相色谱法的特点(HPLC)与经典柱色谱原理相同,是由液体流动相将被分离混合物带入色谱柱中,根据各组分在固定相及流动相中吸附能力、分配系数、离子交换作用或分子尺寸大小的差异来进行分离。
由于高压输液泵、高灵敏度检测器和高效固定相的使用,提高了柱效率,降低了检出限,缩短了分析时间。
特点是选择性高、分离效能高、分析速度快的特点。
高沸点有机物的分析、离子型化合物、高分子化合物、热稳定性差的化合物以及具有生物活性的物质,弥补了气相色谱法的不足。
高效液相色谱法与气相色谱法相比,各有所长,互相补充。
如果能用气相色谱法分析的样品,一般不用液相色谱法,因为气相色谱法分析速度更快、更方便、成本更低。
3、高效液相色谱法的固定相和流动相(1)固定相表面多孔型和全多孔型两大类。
(2)流动相(淋洗液)流动相的选择对改善分离效果产生重要的辅助效应。
从实用,选用的流动相具有廉价、易购的特点外,还应满足下列要求:①与固定相互不相溶,并能保持色谱柱的稳定性。
②高纯度,以防所含微量杂质在柱中积累,引起柱性能的改变。
③与所用的检测器相匹配。
④应对样品有足够的溶解能力,以提高测定的灵敏度。
⑤具有低的黏度(可减少溶质的传质阻力,提高柱效)和适当低的沸点。
⑥应避免使用具有显著毒性的溶剂,以保证工作人员的安全。
液相色谱法中常用的流动相有正己烷、正庚烷、甲醇、乙腈等。
4、高效液相色谱法的主要类型(1)液—固吸附色谱法①分离原理:基于各组分吸附能力的差异来进行混合物分离的。
②固定相:极性和非极性两种。
极性固定相:硅胶、氧化镁。
HPLC法

High performance liquid chromatography; HPLC
药学院药物分析教研室:柯发敏
1
高效液相色谱法(High performance Liquid Chromatography,HPLC)是在经典液相色谱法 的基础上,于60年代后期引入了气相色谱理论而
35
柱的使用和维护注意事项:
高效液相色谱仪
①避免压力和温度的急剧变化及任何机械震动
②应逐渐改变溶剂的组成,特别是反相色谱中,不 应直接从有机溶剂改变为全部是水,反之亦然。
③一般说来色谱柱不能反冲,只有生产者指明该柱 可以反冲时,才可以反冲除去留在柱头的杂质。 否则反冲会迅速降低柱效。
④选择使用适宜的流动相(尤其是pH),以避免固 定相被破坏
不稳
恒流泵:在一定操作条件下,输出流量保持恒定而与
色谱柱引起阻力变化无关,常用
30
泵的使用和维护注意事项
高效液相色谱仪
①防止任何固体微粒进入泵体,因为尘埃或其它任何 杂质微粒都会磨损柱塞、密封环、缸体和单向阀, 因此应预先除去流动相中的任何固体微粒 (流动相 和样品必须过滤膜)
②流动相不应含有任何腐蚀性物质,含有缓冲液的流 动相不应保留在泵内,尤其是在停泵过夜或更长时 间的情况下 ③泵工作时要留心防止溶剂瓶内的流动相被用完,否 则空泵运转也会磨损柱塞、缸体或密封环,最终产 生漏液
11
3 .离子交换色谱法(ion exchange chromatography)
以离子交换树脂作为固定相,树脂上具有固定离子基 团及可交换的离子基团。当流动相带着组分电离生成 的离子通过固定相时,组分离子与树脂上可交换的离
子基团进行可逆变换。根据组分离子对树脂亲合力不
高效液相色谱法原理

高效液相色谱法原理高效液相色谱法(HPLC)是一种广泛应用于化学、生物化学、药学等领域的分析技术。
它通过将待测物溶解在流动相中,在固定填料上进行分离和测定,具有分离效率高、分析速度快、分析灵敏度高等优点。
下面我们将详细介绍高效液相色谱法的原理。
首先,高效液相色谱法的原理是基于样品在流动相和固定相之间的分配行为。
流动相是一种溶剂,它可以将待测物溶解并带动其在固定填料上移动。
而固定填料则是一种多孔的固体颗粒,通常是以硅胶或聚合物为基础材料制成。
当样品溶液通过固定填料时,不同成分会因为在流动相和固定相之间的分配系数不同而发生分离。
其次,高效液相色谱法的分离原理主要包括吸附、分配、离子交换、排阻等几种机制。
其中,吸附是最常见的分离机制,它是指待测物与固定填料表面之间的相互作用。
分配则是指待测物在流动相和固定相之间的分配行为,不同成分的分配系数不同,因此会导致它们在固定填料上的停留时间不同而发生分离。
离子交换是指待测物中带电离子与固定填料表面带相反电荷的基团之间的吸附作用。
排阻则是指待测物在固定填料孔隙中的分布行为,分子尺寸较大的成分会在孔隙中停留的时间较长,而分子尺寸较小的成分则会较快地通过孔隙而分离。
最后,高效液相色谱法的检测原理是利用检测器对分离后的成分进行检测和定量。
常见的检测器包括紫外-可见光谱检测器、荧光检测器、电化学检测器等。
这些检测器能够根据不同成分的特性进行检测,并将检测信号转化为电信号输出,从而实现对待测物的定量分析。
在实际应用中,高效液相色谱法具有操作简便、分析速度快、分离效率高、灵敏度好等优点,因此被广泛应用于食品安全、环境监测、药物分析等领域。
同时,随着仪器技术的不断发展和完善,高效液相色谱法在分析领域的应用范围也在不断扩大,为科学研究和工业生产提供了强大的分析手段。
总之,高效液相色谱法的原理是基于样品在流动相和固定相之间的分配行为,通过不同成分之间的分配系数不同而实现分离。
同时,检测器对分离后的成分进行检测和定量,从而实现对待测物的分析。
高效液相色谱法分离原理

高效液相色谱法分离原理高效液相色谱法按分离机制的不同分为液固吸附色谱法、液液分配色谱法(正相与反相)、离子交换色谱法、离子对色谱法及分子排阻色谱法。
1(液固色谱法使用固体吸附剂,被分离组分在色谱柱上分离原理是根据固定相对组分吸附力大小不同而分离。
分离过程是一个吸附,解吸附的平衡过程。
常用的吸附剂为硅胶或氧化铝,粒度5~10μm。
适用于分离分子量200~1000的组分,大多数用于非离子型化合物,离子型化合物易产生拖尾。
常用于分离同分异构体。
2(液液色谱法使用将特定的液态物质涂于担体表面,或化学键合于担体表面而形成的固定相,分离原理是根据被分离的组分在流动相和固定相中溶解度不同而分离。
分离过程是一个分配平衡过程。
涂布式固定相应具有良好的惰性;流动相必须预先用固定相饱和,以减少固定相从担体表面流失;温度的变化和不同批号流动相的区别常引起柱子的变化;另外在流动相中存在的固定相也使样品的分离和收集复杂化。
由于涂布式固定相很难避免固定液流失,现在已很少采用。
现在多采用的是化学键合固定相,如C18、C8、氨基柱、氰基柱和苯基柱。
液液色谱法按固定相和流动相的极性不同可分为正相色谱法(NPC)和反相色谱法(RPC)。
正相色谱法采用极性固定相(如聚乙二醇、氨基与腈基键合相);流动相为相对非极性的疏水性溶剂(烷烃类如正已烷、环已烷),常加入乙醇、异丙醇、四氢呋喃、三氯甲烷等以调节组分的保留时间。
常用于分离中等极性和极性较强的化合物(如酚类、胺类、羰基类及氨基酸类等)。
反相色谱法一般用非极性固定相(如C18、C8);流动相为水或缓冲液,常加入甲醇、乙腈、异丙醇、丙酮、四氢呋喃等与水互溶的有机溶剂以调节保留时间。
适用于分离非极性和极性较弱的化合物。
RPC在现代液相色谱中应用最为广泛,据统计,它占整个HPLC应用的80%左右。
随着柱填料的快速发展,反相色谱法的应用范围逐渐扩大,现已应用于某些无机样品或易解离样品的分析。
为控制样品在分析过程的解离,常用缓冲液控制流动相的pH值。
第五章高效液相色谱法

9
基本理论
热力学理论:塔板理论——平衡理论 热力学理论:塔板理论——平衡理论 动力学理论:速率理论—— 范第姆特 动力学理论:速率理论 ——范第姆特 方程 色谱图的基本参数:与气相色谱法类 似
10
各类高效液相色谱法的分离原理及选 择
液-固吸附色谱 液-液分配色谱 离子交换色谱 体积排阻色谱 亲和色谱
3
高效液相色谱法的类型
根据固定相的不同 液-固色谱 液-液色谱 根据分离机理的不同 分配色谱 吸附色谱 离子交换色谱 体积排阻色谱 亲和色谱
4
分配色谱:分离组分在两相中的分配系数不 同 吸附色谱:固定相对分离组分的吸附能力不 同 离子交换色谱:不同离子与固定相上的相反 电荷离子间作用力大小不同 体积排阻色谱:根据样品分子尺寸的不同按 分子大小分开 亲和色谱:不同基体上键合多种不同特性的 配位体作固定相,用具有不同pH的缓冲溶液 做流动相,依据生物分子与基体上键联的配 位体之间存在的特异性亲和作用力不同
30
流动相
1. 流动相特性
(1)液相色谱的流动相又称为:淋洗液,洗脱剂 液相色谱的流动相又称为:淋洗液, 液相色谱的流动相又称为 。流动相组成改变,极性改变,可显著改变组分 流动相组成改变,极性改变, 分离状况; 分离状况; (2)亲水性固定液常采用疏水性流动相 , 即流 亲水性固定液常采用疏水性流动相, 亲水性固定液常采用疏水性流动相 动相的极性小于固定相的极性, 动相的极性小于固定相的极性,称为正相液液色 谱法,极性柱也称正相柱。 谱法,极性柱也称正相柱。 (3)若流动相的极性大于固定液的极性 , 则称 若流动相的极性大于固定液的极性, 若流动相的极性大于固定液的极性 为反相液液色谱,非极性柱也称为反相柱。 为反相液液色谱,非极性柱也称为反相柱。组分 31 在两种类型分离柱上的出峰顺序相反。 在两种类型分离柱上的出峰顺序相反。
高效液相色谱的原理和应用

高效液相色谱的原理和应用高效液相色谱(High Performance Liquid Chromatography,HPLC)是一种常用的分离技术,广泛应用于化学、制药、食品科学、环境监测等领域。
本文将介绍高效液相色谱的原理、仪器组成、常见模式、样品制备及其应用。
一、高效液相色谱原理高效液相色谱的原理是利用液相在不同固相填料上的吸附和分配现象,将化合物在不同填充柱中发生分离和纯化。
通常,HPLC 固定相含有一些化学基团,如反相和离子交换基团,可与样品中的化合物进行吸附和分配。
液相进样、柱温及流动相的组成等因素均会影响HPLC分离效果。
二、高效液相色谱仪器组成高效液相色谱仪的组成一般包括进样器、色谱柱、泵、检测器和处理系统等部分。
进样器将样品喷射到柱口,色谱柱用于灌流梳理样品,其中固定填料用于分离和分析所需的化合物。
泵用于将流动相推动柱中的样品,检测器观察所需分析的化合物是否沿着柱流动。
高效液相色谱不仅提供精确且迅速的色谱分离,而且对各种检测器兼容,可选择性地检测各种目标物。
三、高效液相色谱常见模式高效液相色谱常见的模式有反相、离子交换、正相等。
其中,反相色谱在所有柱中应用最广,其固定相通常是羟基烷基硅胶(C18)。
反相色谱的原理在于样品溶解于亲水性较低的溶剂中排出;在色谱柱中遇到亲水性较高的固定相时,由于样品亲水性性质,样品在固定相上发生反相互相作用来获得分离。
离子交换色谱是通过离子交换基团分离化合物中的阴阳离子的;正相色谱固定相仅仅地与正离子发生斥力作用,使分离物在某些环境下进行发生分离和净化,通常情况下正相色谱的相相反色谱。
不过在实际操作过程中,某些离子需要离子交换色谱柱才能实现的很好地分离。
四、样品制备高效液相色谱之前样品制备可能是个需要重视的选项,由于HPLC是在溶液环境中进行的,所以所需的样品必须适合在液相中溶解。
当涉及到样品之前显微技巧之后有必要进行物质氨基酸或肽的酸性或碱性水解,用于小分子化合物的样品溶剂通常为方法文献所标示的洗涤剂和/或过滤剂; 在使用纯度高的离子液体进行样品溶解和/或抑制和保护剂。
高效液相色谱分析(主要分离类型与原理)课件

• 高效液相色谱分析简介 • 高效液相色谱的主要分离类型 • 高效液相色谱的分离原理 • 高效液相色谱分析实验操作与注意事项 • 高效液相色谱分析的应用实例
目录
Part
01
高效液相色谱分析简介
高效液相色谱分析的定义
高效液相色谱分析(HPLC)是一种分离和检测复杂样品中各种组分的方法。它利用不同 物质在固定相和流动相之间的分配平衡来实现分离。
THANKS
感谢您的观看
ቤተ መጻሕፍቲ ባይዱ
Part
03
高效液相色谱的分离原理
高效液相色谱的固定相与流动相
固定相
是色谱柱中的填充物,用于吸附 和固定样品中的组分。常见的固 定相包括硅胶、氧化铝、活性炭 等。
流动相
是携带样品通过色谱柱的液体或 气体,与固定相相互作用,使各 组分得以分离。
高效液相色谱的分离过程
样品在流动相中溶解并被 带入色谱柱。
实验操作前的准备
实验器材与试剂准备
确保所需的色谱柱、检测器、流动相 、样品等都已准备好,并确保试剂的 质量和纯度。
实验条件设定
仪器校准与维护
确保色谱仪器的准确性和稳定性,进 行必要的校准和日常维护。
根据实验需求,设定合适的流动相比 例、流速、检测波长等参数。
实验操作步骤与要点
样品处理
根据实验要求,对样品进 1
Part
02
高效液相色谱的主要分离类型
吸附色谱
STEP 01
原理
STEP 02
应用
利用固定相吸附剂对不同 组分的吸附能力差异实现 分离。
STEP 03
特点
固定相的吸附能力可以通 过改变流动相的组成进行 调节。
高效液相色谱原理
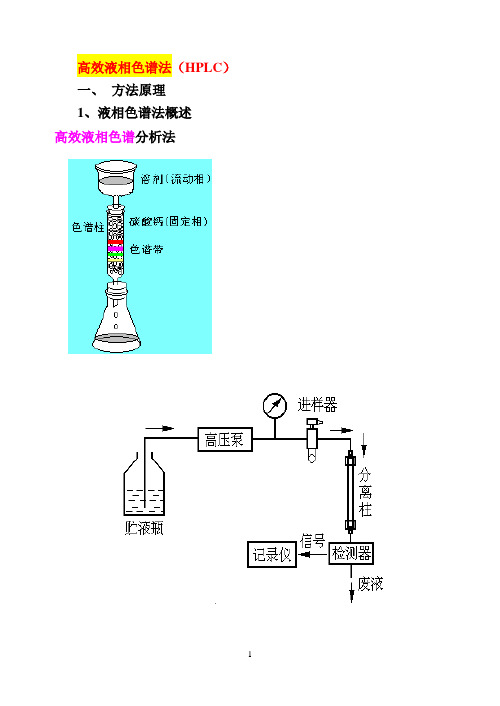
高效液相色谱法(HPLC)一、方法原理1、液相色谱法概述高效液相色谱分析法其工作流程为:高压输液泵将贮液器中的流动相以稳定的流速(或压力)输送至分析体系,在色谱柱之前通过进样器将样品导人,流动相将样品依次带入预柱、色谱柱,在色谱柱中各组分被分离,并依次随流动相流至检测器,检测到的信号送至数据处理系统记录、处理和保存。
HPLC仪器的基本结构2、高效液相色谱法的特点(HPLC)与经典柱色谱原理相同,是由液体流动相将被分离混合物带入色谱柱中,根据各组分在固定相及流动相中吸附能力、分配系数、离子交换作用或分子尺寸大小的差异来进行分离。
由于高压输液泵、高灵敏度检测器和高效固定相的使用,提高了柱效率,降低了检出限,缩短了分析时间。
特点是选择性高、分离效能高、分析速度快的特点。
高沸点有机物的分析、离子型化合物、高分子化合物、热稳定性差的化合物以及具有生物活性的物质,弥补了气相色谱法的不足。
高效液相色谱法与气相色谱法相比,各有所长,互相补充。
如果能用气相色谱法分析的样品,一般不用液相色谱法,因为气相色谱法分析速度更快、更方便、成本更低。
3、高效液相色谱法的固定相和流动相(1)固定相表面多孔型和全多孔型两大类。
(2)流动相(淋洗液)流动相的选择对改善分离效果产生重要的辅助效应。
从实用,选用的流动相具有廉价、易购的特点外,还应满足下列要求:①与固定相互不相溶,并能保持色谱柱的稳定性。
②高纯度,以防所含微量杂质在柱中积累,引起柱性能的改变。
③与所用的检测器相匹配。
④应对样品有足够的溶解能力,以提高测定的灵敏度。
⑤具有低的黏度(可减少溶质的传质阻力,提高柱效)和适当低的沸点。
⑥应避免使用具有显著毒性的溶剂,以保证工作人员的安全。
液相色谱法中常用的流动相有正己烷、正庚烷、甲醇、乙腈等。
4、高效液相色谱法的主要类型(1)液—固吸附色谱法①分离原理:基于各组分吸附能力的差异来进行混合物分离的。
②固定相:极性和非极性两种。
极性固定相:硅胶、氧化镁。
高效液相色谱分析(主要分离类型与原理)

四、离子色谱
ion chromatograph
第二节 主要分离类型与原理
basic principle and main separating types
五、离子对色谱
ion-pair chromatograph
六、排阻色谱
size- exclusion chromatograph
七、亲和色谱(AC)
Affinity chromatograph
2014-9-1
一、 液-固吸附色谱
liquid-solid adsorption chromatography
固定相:固体吸附剂为,如硅胶、氧化铝等,较常使 用的是5~10μm的硅胶吸附剂; 流动相:各种不同极性的一元或多元溶剂。 基本原理:组分在固定相吸附剂上的吸附与解吸; 适用于分离相对分子质量中等的油溶性试样,对具有
阳离子交换:R—SO3H +M+ = R—SO3 M + H +
阴离子交换:R—NR4OH +X- = R—NR4 X + OH应用:离子及可离解的化合物,氨基酸、核酸等。
2014-9-1
四、 离子色谱
ion chromatography
离子色谱是在20世纪70年代中期发展起来的一中技术, 其与离子交换色谱的区别是其采用了特制的、具有极低交换 容量的离子交换树脂作为柱填料,并采用淋洗液抑制技术和
2014-9-1
三、 离子交换色谱
ion-exchange chromatography
固定相:阴离子离子交换树脂或阳离子离子交换树脂; 流动相:阴离子离子交换树脂作固定相,采用酸性水溶 液;阳离子离子交换树脂作固定相,采用碱性水溶液;
基本原理:组分在固定相上发生的反复离子交换反应;
高效液相色谱法的主要类型及其分离原理

高效液相色谱法的主要类型及其分离原理高效液相色谱法是在经典色谱法的基础上,引用了气相色谱的理论,在技术上,流动相改为高压输送(最高输送压力可达4.9´107Pa);色谱柱是以特殊的方法用小粒径的填料填充而成,从而使柱效大大高于经典液相色谱(每米塔板数可达几万或几十万);同时柱后连有高灵敏度的检测器,可对流出物进行连续检测。
特点1.高压:液相色谱法以液体为流动相(称为载液),液体流经色谱柱,受到阻力较大,为了迅速地通过色谱柱,必须对载液施加高压。
一般可达150~350×105Pa。
2. 高速:流动相在柱内的流速较经典色谱快得多,一般可达1~10ml/min。
高效液相色谱法所需的分析时间较之经典液相色谱法少得多,一般少于1h 。
3. 高效:近来研究出许多新型固定相,使分离效率大大提高。
4.高灵敏度:高效液相色谱已广泛采用高灵敏度的检测器,进一步提高了分析的灵敏度。
如荧光检测器灵敏度可达10-11g。
另外,用样量小,一般几个微升。
5.适应范围宽:气相色谱法与高效液相色谱法的比较:气相色谱法虽具有分离能力好,灵敏度高,分析速度快,操作方便等优点,但是受技术条件的限制,沸点太高的物质或热稳定性差的物质都难于应用气相色谱法进行分析。
而高效液相色谱法,只要求试样能制成溶液,而不需要气化,因此不受试样挥发性的限制。
对于高沸点、热稳定性差、相对分子量大(大于400 以上)的有机物(这些物质几乎占有机物总数的75% ~80% )原则上都可应用高效液相色谱法来进行分离、分析。
据统计,在已知化合物中,能用气相色谱分析的约占20%,而能用液相色谱分析的约占70~80%。
高效液相色谱按其固定相的性质可分为高效凝胶色谱、疏水性高效液相色谱、反相高效液相色谱、高效离子交换液相色谱、高效亲和液相色谱以及高效聚焦液相色谱等类型。
用不同类型的高效液相色谱分离或分析各种化合物的原理基本上与相对应的普通液相层析的原理相似。
18章高效液相色谱法

六、反相离子对色谱法
把离子对试剂加入到含水流动相中,被分析组分离 子在流动相中与离子对试剂的反离子(或是称对离子) 生成不带电荷的中性离子对,从而增加溶质与非极性固 定相的作用,使分配系数增加,改善分离效果, 适用于分离可离子化或离子型的化合物。 1、离子对模型
试样离子在流动相中与离子对试剂离解出的反离子 生成不荷电的中性离子对,然后在非极性固定相上产生 保留。
第四节 高效液相色谱分析方法
一、定性和定量分析方法
1、定性方法分为色谱鉴定法和非色谱鉴定法。 2、定量方法常用外标法和内标法进行。 3、主成分自身对照法:
不加校正因子主成分自身对照法: 加校正因子主成分自身对照法: 二、高效液相色谱分离方法的选择 分离模式选择主要依据试样的性质和各种模式的分离 机制。试样的性质包括相对分子量、化学结构、极性和溶 解度等。
(1)化学稳定性好,使用过程中不流失,柱寿命长;
(2)均一性和重现性好;
(3)柱效高,分离选择性好;
(4)适于梯度洗脱;
(5)载样量大. 3、使用注意事项: (1)使用硅胶基质的键合相pH应维持在2-8;硅-碳杂化 硅胶等为基质的键合相pH范围宽(2-12);
(2)不同厂家,不同批号的同类键合相也可表现不同 的色谱特性。
(3)极性键合相:常用氨基、氰基键合相。是分别 将氨丙硅烷基和氰乙硅烷基键合在硅胶是制成。一般用 作正相色谱固定相。 氰基键合相。对双键或含双键的环状化合物有较好 的分离能力。 氨基键合相对糖类化合物的分离选择性好。在酸性 介质中它是一种弱阴离子交换剂,能分离核酸。不宜分 离带羰基的物质
2、键合相的特点
高效液相色谱法的检测器要求:灵敏度高、噪声 低、线性范围宽、重复性好和适用范围广。
1、紫外检测器简介: 灵敏度较高、噪声低、线性范围宽,对流速 和温度的波动不灵敏,还适用于制备色谱。 工作原理:是朗伯比尔定律,即组分的浓度与吸 光度成正比。 2、紫外检测器分类:
高效液相色谱的分离原理

高效液相色谱的分离原理高效液相色谱(High Performance Liquid Chromatography,HPLC)的分离原理主要基于溶质在液相和固相之间的分配行为。
液相色谱将样品溶解在流动相中,然后将其通过填充在色谱柱中的固定相。
溶质与液相和固相之间的相互作用导致在带电痕迹下,样品分子以不同的速度从柱中通过。
分离的原理主要有以下几种方式:1. 亲水性分离:在正常相液相色谱中,固定相一般为疏水膜,溶液中的极性分子会更加倾向于溶解在溶剂中。
相反,非极性分子会更倾向于与固相相互作用。
这样的分离机制适用于众多生物大分子或通过多重氢键与固相相互作用的有机化合物。
2. 反相分离:反相液相色谱(Reverse Phase Liquid Chromatography, RPLC)使用疏水固定相和极性溶剂,溶液中的极性溶质会聚集在固相上,而非极性溶质会倾向于与溶剂混合。
反相分离常用于氢键作用或极性分子之间的相互作用较强的有机化合物。
3. 离子交换分离:它基于离子交换剂与待测物溶解在流动相中,通过与其成键分离。
该方法特别适用于离子性化合物的分离,其中固定相常常是带有交换活性基团(例如磺酸基团或羧酸基团)的阴离子交换树脂或阳离子交换树脂。
4. 大孔态或凝胶态分离:为了分离较大的生物大分子,如蛋白质或多肽,常常使用大孔体积更大的色谱柱和凝胶固相。
这种类型的色谱有助于减小溶质分子的限制,以实现更好的分离效果。
总的来说,高效液相色谱的分离原理是通过溶质与液相和固相之间的分配行为来实现的,不同的分离机制适用于不同类型的化合物和分析目的。
商业HPLC仪器通常配备了多种柱和固定相,以提供灵活的操作,以满足不同类型的分离需求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高效液相色谱法的主要类型及其分离原理高效液相色谱法是在经典色谱法的基础上,引用了气相色谱的理论,在技术上,流动相改为高压输送(最高输送压力可达4.9´107Pa);色谱柱是以特殊的方法用小粒径的填料填充而成,从而使柱效大大高于经典液相色谱(每米塔板数可达几万或几十万);同时柱后连有高灵敏度的检测器,可对流出物进行连续检测。
特点1.高压:液相色谱法以液体为流动相(称为载液),液体流经色谱柱,受到阻力较大,为了迅速地通过色谱柱,必须对载液施加高压。
一般可达150~350×105Pa。
2. 高速:流动相在柱内的流速较经典色谱快得多,一般可达1~10ml/min。
高效液相色谱法所需的分析时间较之经典液相色谱法少得多,一般少于1h 。
3. 高效:近来研究出许多新型固定相,使分离效率大大提高。
4.高灵敏度:高效液相色谱已广泛采用高灵敏度的检测器,进一步提高了分析的灵敏度。
如荧光检测器灵敏度可达10-11g。
另外,用样量小,一般几个微升。
5.适应范围宽:气相色谱法与高效液相色谱法的比较:气相色谱法虽具有分离能力好,灵敏度高,分析速度快,操作方便等优点,但是受技术条件的限制,沸点太高的物质或热稳定性差的物质都难于应用气相色谱法进行分析。
而高效液相色谱法,只要求试样能制成溶液,而不需要气化,因此不受试样挥发性的限制。
对于高沸点、热稳定性差、相对分子量大(大于400 以上)的有机物(这些物质几乎占有机物总数的75% ~80% )原则上都可应用高效液相色谱法来进行分离、分析。
据统计,在已知化合物中,能用气相色谱分析的约占20%,而能用液相色谱分析的约占70~80%。
高效液相色谱按其固定相的性质可分为高效凝胶色谱、疏水性高效液相色谱、反相高效液相色谱、高效离子交换液相色谱、高效亲和液相色谱以及高效聚焦液相色谱等类型。
用不同类型的高效液相色谱分离或分析各种化合物的原理基本上与相对应的普通液相层析的原理相似。
其不同之处是高效液相色谱灵敏、快速、分辨率高、重复性好,且须在色谱仪中进行。
高效液相色谱法的主要类型及其分离原理根据分离机制的不同,高效液相色谱法可分为下述几种主要类型:1 .液—液分配色谱法(Liquid-liquid Partition Chromatography)及化学键合相色谱(Chemically Bonded Phase Chromatography)流动相和固定相都是液体。
流动相与固定相之间应互不相溶(极性不同,避免固定液流失),有一个明显的分界面。
当试样进入色谱柱,溶质在两相间进行分配。
达到平衡时,服从于下式:式中,cs—溶质在固定相中浓度;cm--溶质在流动相中的浓度;Vs—固定相的体积;Vm—流动相的体积。
LLPC与GPC有相似之处,即分离的顺序取决于K,K大的组分保留值大;但也有不同之处,GPC中,流动相对K影响不大,LLPC流动相对K影响较大。
a. 正相液—液分配色谱法(Normal Phase liquid Chromatography): 流动相的极性小于固定液的极性。
b. 反相液—液分配色谱法(Reverse Phase liquid Chromatography): 流动相的极性大于固定液的极性。
c. 液—液分配色谱法的缺点:尽管流动相与固定相的极性要求完全不同,但固定液在流动相中仍有微量溶解;流动相通过色谱柱时的机械冲击力,会造成固定液流失。
上世纪70年代末发展的化学键合固定相(见后),可克服上述缺点。
现在应用很广泛(70~80%)。
2 .液—固色谱法流动相为液体,固定相为吸附剂(如硅胶、氧化铝等)。
这是根据物质吸附作用的不同来进行分离的。
其作用机制是:当试样进入色谱柱时,溶质分子(X) 和溶剂分子(S)对吸附剂表面活性中心发生竞争吸附(未进样时,所有的吸附剂活性中心吸附的是S),可表示如下:Xm + nSa ====== Xa + nSm式中:Xm--流动相中的溶质分子;Sa--固定相中的溶剂分子;Xa--固定相中的溶质分子;Sm--流动相中的溶剂分子。
当吸附竞争反应达平衡时:K=[Xa][Sm]/[Xm][Sa]式中:K为吸附平衡常数。
[讨论:K越大,保留值越大。
]3 .离子交换色谱法(Ion-exchange Chromatography)IEC是以离子交换剂作为固定相。
IEC是基于离子交换树脂上可电离的离子与流动相中具有相同电荷的溶质离子进行可逆交换,依据这些离子以交换剂具有不同的亲和力而将它们分离。
以阴离子交换剂为例,其交换过程可表示如下:X-(溶剂中) + (树脂-R4N+Cl-)=== (树脂-R4N+ X-) + Cl- (溶剂中)当交换达平衡时:KX=[-R4N+ X-][ Cl-]/[-R4N+Cl-][ X-]分配系数为:DX=[-R4N+ X-]/[X-]= KX [-R4N+Cl-]/[Cl-][讨论:DX与保留值的关系]凡是在溶剂中能够电离的物质通常都可以用离子交换色谱法来进行分离。
4 .离子对色谱法(Ion Pair Chromatography)离子对色谱法是将一种( 或多种) 与溶质分子电荷相反的离子( 称为对离子或反离子) 加到流动相或固定相中,使其与溶质离子结合形成疏水型离子对化合物,从而控制溶质离子的保留行为。
其原理可用下式表示:X+水相+ Y-水相=== X+Y-有机相式中:X+水相--流动相中待分离的有机离子(也可是阳离子);Y-水相--流动相中带相反电荷的离子对(如氢氧化四丁基铵、氢氧化十六烷基三甲铵等);X+Y---形成的离子对化合物。
当达平衡时:KXY = [X+Y-]有机相/[ X+]水相[Y-]水相根据定义,分配系数为:DX= [X+Y-]有机相/[ X+]水相= KXY [Y-]水相[讨论:DX与保留值的关系]离子对色谱法(特别是反相)发解决了以往难以分离的混合物的分离问题,诸如酸、碱和离子、非离子混合物,特别是一些生化试样如核酸、核苷、生物碱以及药物等分离。
5 .离子色谱法(Ion Chromatography)用离子交换树脂为固定相,电解质溶液为流动相。
以电导检测器为通用检测器,为消除流动相中强电解质背景离子对电导检测器的干扰,设置了抑制柱。
试样组分在分离柱和抑制柱上的反应原理与离子交换色谱法相同。
以阴离子交换树脂(R-OH)作固定相,分离阴离子(如Br-)为例。
当待测阴离子Br-随流动相(NaOH)进入色谱柱时,发生如下交换反应(洗脱反应为交换反应的逆过程):抑制柱上发生的反应:R-H+ + Na+OH- === R-Na+ + H2OR-H+ + Na+Br- === R-Na+ + H+Br-可见,通过抑制柱将洗脱液转变成了电导值很小的水,消除了本底电导的影响;试样阴离子Br-则被转化成了相应的酸H+Br-,可用电导法灵敏的检测。
离子色谱法是溶液中阴离子分析的最佳方法。
也可用于阳离子分析。
6 .空间排阻色谱法(Steric Exclusion Chromatography)空间排阻色谱法以凝胶(gel) 为固定相。
它类似于分子筛的作用,但凝胶的孔径比分子筛要大得多,一般为数纳米到数百纳米。
溶质在两相之间不是靠其相互作用力的不同来进行分离,而是按分子大小进行分离。
分离只与凝胶的孔径分布和溶质的流动力学体积或分子大小有关。
试样进入色谱柱后,随流动相在凝胶外部间隙以及孔穴旁流过。
在试样中一些太大的分子不能进入胶孔而受到排阻,因此就直接通过柱子,首先在色谱图上出现,一些很小的分子可以进入所有胶孔并渗透到颗粒中,这些组分在柱上的保留值最大,在色谱图上最后出现。
高效液相色谱仪主要有进样系统、输液系统、.分离系统、检测系统和数据处理系统,下面将分别叙述其各自的组成与特点。
1.进样系统一般采用隔膜注射进样器或高压进样间完成进样操作,进样量是恒定的。
这对提高分析样品的重复性是有益的。
2.输液系统该系统包括高压泵、流动相贮存器和梯度仪三部分。
高压泵的一般压强为l.47~4.4X107Pa,流速可调且稳定,当高压流动相通过层析柱时,可降低样品在柱中的扩散效应,可加快其在柱中的移动速度,这对提高分辨率、回收样品、保持样品的生物活性等都是有利的。
流动相贮存错和梯度仪,可使流动相随固定相和样品的性质而改变,包括改变洗脱液的极性、离子强度、PH值,或改用竞争性抑制剂或变性剂等。
这就可使各种物质(即使仅有一个基团的差别或是同分异构体)都能获得有效分离。
3.分离系统该系统包括色谱柱、连接管和恒温器等。
色谱柱一般长度为10~50cm(需要两根连用时,可在二者之间加一连接管),内径为2~5mm,由"优质不锈钢或厚壁玻璃管或钛合金等材料制成,住内装有直径为5~10μm粒度的固定相(由基质和固定液构成).固定相中的基质是由机械强度高的树脂或硅胶构成,它们都有惰性(如硅胶表面的硅酸基因基本已除去)、多孔性(孔径可达1000?)和比表面积大的特点,加之其表面经过机械涂渍(与气相色谱中固定相的制备一样),或者用化学法偶联各种基因(如磷酸基、季胺基、羟甲基、苯基、氨基或各种长度碳链的烷基等)或配体的有机化合物。
因此,这类固定相对结构不同的物质有良好的选择性。
例如,在多孔性硅胶表面偶联豌豆凝集素(PSA)后,就可以把成纤维细胞中的一种糖蛋白分离出来。
另外,固定相基质粒小,柱床极易达到均匀、致密状态,极易降低涡流扩散效应。
基质粒度小,微孔浅,样品在微孔区内传质短。
这些对缩小谱带宽度、提高分辨率是有益的。
根据柱效理论分析,基质粒度小,塔板理论数N就越大。
这也进一步证明基质粒度小,会提高分辨率的道理。
再者,高效液相色谱的恒温器可使温度从室温调到60C,通过改善传质速度,缩短分析时间,就可增加层析柱的效率。
4.检测系统高效液相色谱常用的检测器有紫外检测器、示差折光检测器和荧光检测器三种。
(1)紫外检测器该检测器适用于对紫外光(或可见光)有吸收性能样品的检测。
其特点:使用面广(如蛋白质、核酸、氨基酸、核苷酸、多肽、激素等均可使用);灵敏度高(检测下限为10-10g/ml);线性范围宽;对温度和流速变化不敏感;可检测梯度溶液洗脱的样品。
(2)示差折光检测器凡具有与流动相折光率不同的样品组分,均可使用示差折光检测器检测。
目前,糖类化合物的检测大多使用此检测系统。
这一系统通用性强、操作简单,但灵敏度低(检测下限为10-7g /ml),流动相的变化会引起折光率的变化,因此,它既不适用于痕量分析,也不适用于梯度洗脱样品的检测。
(3)荧光检测器凡具有荧光的物质,在一定条件下,其发射光的荧光强度与物质的浓度成正比。
因此,这一检测器只适用于具有荧光的有机化合物(如多环芳烃、氨基酸、胺类、维生素和某些蛋白质等)的测定,其灵敏度很高(检测下限为10-12~10-14g/ml),痕量分析和梯度洗脱作品的检测均可采用。
