化工热力学实验
化工热力学Ⅱ(高等化工热力学)——第四章 混合物的逸度.

4.1逸度及逸度系数 定义 dμi= d Gi =RTdlnfi
(1-49)
lim fi
p0
yiP
=1
逸度系数: i fi / yiP
(1-50)
4.1.1 以P.T为独立变量
由定义,有dGi =RTdlnf=i RTln(ipyi) =RT(dln i+dlnP) (恒温恒组成) (1)
由热力学函数:dGi=-Sdi T+Vi dP= VidP
(恒T)
(2)
由式(1) (2) 联立,得 d lnˆi
积分得:lnˆi
p 0
(
Zi
-1)
dP P
Vi dP d ln P RT
(恒温恒组成)
(4-1)
或
ln ˆi =
1 RT
p
0
(Vi-RPT)dP
4.1.2 以 V, T为独立变量
ˆi= 2
lnˆi= Vm0p
k
y j1
(Z-1)
jB
dP P
j-lnZ (4-6) (4-1)
式中:Z=PVm/RT=1+B’P=1+BP/RT
Z= i
(nZ) n
i
T,P,n
j
=
(n+nBP/RT) n
i
T,P,n
j
=1+
P RT
=y1B11+y2B22+y1y2(2B12-B11-B22)
=y1B11+y2B22+y1y2δ12 式中δ12=2B12-B11-B22
nB=n1B11+n2B22+(n1n2/n)δ12 上式对n1求偏导,得:
化工热力学实验.

2)如前操作实地测出本试验台CO2在 20℃,9.8MPa时的CO2液柱高度 Δh*(m),(注意玻璃水套上刻度的标记
方法) 3)由1)可知υ(20℃,9.8MPa)=
h A
=0.00117m3/kg
m
m h* k(kg m2 ) A 0.00117
那么任意温度,压力下CO2的比容为
L
V
fi fi
常压下,汽相可视为理想气体,则
Pyi
Pis xi i
i
Pyi Pis xi
二 实验目的
1 测定常压下乙醇(1)-水(2)二元汽液 平衡数据
2 通过实验了解汽液平衡釜的构造,掌握二 元汽液平衡数据的测定方法和技能。
3 绘制汽液平衡相图。
三 实验装置
四 实验步骤
F(p,v,t)=0或t=f(p,v)(1) 本试验就是根据式(1),采用定温方法
来测定CO2 p-v之间的关系,从而找出 CO2的p-v-t的关系。
四、实验步骤
1. 装好实验设备,开启试验台本体上的日光灯 2. 使用恒温器调定温度 3. 加压前的准备 4. 做好实验的原始记录 5. 测定低于临界温度t=20℃时的定温线 6. 测定临界等温线t=31.1℃和临界参数,观
v h h mh k
式中 h h hf ,将测得的数据整理
成表,并在p-v图上作出等温线
2 应用RK方程进行体积数据推算,并与 相应的实验值比较
临界温度以下取气相与液相各一值,其 它每个温度一值
六、实验报告
1. 简述实验原理及过程。 2. 各种数据的原始记录。 3. 计算及在p-v图上画出等温线。 4. 将实验测得的饱和温度与饱和压力的
化工热力学对结晶过程的理论指导及实验测定(热力学II)林晨 201420120303

化工热力学对结晶过程的理论指导及实验测定摘要:结晶过程是净化产品、优化产品尺寸大小、固液相分离的基础,而结晶热力学性质又是结晶的理论前提。
本文从理论和实验的角度对结晶过程中的溶解度、介稳区、诱导期和黏度等热力学性质进行了研究,从而说明了结晶热力学对整个结晶过程的研究具有重要的指导意义。
关键词:结晶;热力学;溶解度;介稳区;诱导期Chemical thermodynamics theoretical guidance of the crystallizationprocess and experimental determination(School of Chem & Energy Eng, South China Univ of Technol, Canton 510640, China) Abstract:Crystallization process is the basic of purification products, optimize product size, solid-liquid phase separation, crystallization thermodynamic properties is the theoretical premise of the crystallization. From the point of theoretical and experimental, solubility, metastable zone, the induction period and viscosity properties of crystallization were studied, thus crystallization thermodynamics is an significance guiding for the study of the crystallization process.Keywords:Crystallization; thermodynamics; solubility; metastable zone; Induction period1、引言结晶过程是一个复杂的传质、传热过程,物化条件的改变就会引起结晶过程控制步骤的改变,表现为不同的结晶行为,因此对特定物系结晶过程行为的研究应该从该物系的热力学性质入手。
化工热力学

5、乙腈(1)和乙醛(2)在87.0 kPa ,80℃时混合形成等分子蒸汽混合物,并且已知B 11= -2.619m 3/kmol ,B 22=- 0.633m 3/kmol ,δ12= - 4.060m 3/kmol请计算:(a) 混合物中组分1和2的逸度1ˆf 和2ˆf 。
(b) 若混合物为理想气体,求1ˆf 和2ˆf 。
6、160°F 的纯硫酸与77°F 的纯水混合形成 25%的溶液。
利用焓浓图计算: (1)、若混合过程为绝热,试求混合后溶液的温度。
(2)、若在混合过程中进行冷却,使溶液终温为80°F,试求每1 lb 25%的溶液所需移除的热量。
第5章 化工过程的能量分析1、1.57MPa 、484℃的过热水蒸气推动透平作功,并在0.0687MPa 下排出。
此透平既不绝热也不可逆,输出的轴功相当于可逆绝热膨胀功的85%。
由于隔热不好,每kg 的蒸汽有7.12kJ 的热量散失于20℃的环境中。
求此过程的理想功、损失功及热力学效率。
2、某炼厂有一台蒸汽透平,已知水蒸汽入口的温度为440℃,压力为40×105Pa ,流率为4000kg/h ,蒸汽排出的压力为7.0×105Pa 。
(1) 假定透平绝热可逆操作,试计算透平的功率;(2) 若透平绝热操作,输出的轴功等于绝热可逆轴功的82.65%。
则蒸汽的出口温度为多少?并计算过程的有效能(火用 )损失。
3、有一逆流式换热器,利用废气加热空气,空气由0.1MPa ,293K 被加热到398K ,空气流量为1.5kg.s –1;而废气从0.13MPa 、523K 冷却到368K 。
空气的等压热容为1.04kJ.kg –1.K –1,而废气的等压热容为0.84 kJ.kg –1.K –1,假定空气与废气通过换热器的压力与动能变化可忽略不计,而且换热器与环境无热量交换,环境状态为0.1MPa 、293K 。
化工热力学7.1~7.3

7.2 互溶体系VLE相图
x y
i 1
由于在这一点压力最大,温度最低,所以称最大压 力(最低温度)共沸点。对于这种体系,用一般精 馏法是不能将其分离开的,必须采用特殊分离法。
GSE
气-固平衡 升华、气相沉积
7 相平衡
如何得到平衡数据,一般通过实验来测取 所研究体系的平衡数据,但存在需要实验设备
和时间的问题,因此计算方法的研究同样具有
重要意义。如今计算机的发展使计算相平衡, 特别是汽液相平衡成为可能。本章着重于讨论 汽—液相平衡-VLE的问题。
7 相平衡
目的:学习汽液相平衡基本规律与计算
对于互溶体系VLE相图大致有两种情况,
具有正偏差体系,
具有负偏差体系。
当偏差较大时,就会形成共沸物,
共沸体系的分离需要特殊的分离方法。
2)低压下互溶体系的汽液平衡相图
7.2 互溶体系VLE相图
7 相平衡
7.1 平衡的判据与相律
7.2 互溶体系VLE相图
7.3 VLE的计算
7.4 用实验数据确定活度系数
7.2 互溶体系VLE相图 1)
二元体系的P-T图
二元体系P-T图
7.2 互溶体系VLE相图 1)
二元体系的P-T图
图中实线为泡点线,虚线为露点线,不同组 成的溶液对应不同的汽液平衡关系,在整个溶液 组成范围内构成了一个上拱的泡点面和下拱的露 点面。泡点面的上方为过冷液体,露点面的下方 为过热蒸汽。C1、C2点分别为纯组分1和2的临界 点,Cm点是二元混合物的临界点,UC1和KC2曲 线分别为纯组分1和2的汽液平衡线,对纯组分来 说泡点线和露点线是重合的。
工程热力学实验指导书(三个实验)

工程热力学课程实验指导书兰州理工大学2006年6月实验1空气定压比热测定实验指导书一、实验目的1.掌握气体比定压热容的测量原理及其操作方法;2.掌握本实验中测温、测压、测热、测流量的方法;3.掌握由基本数据计算比热值的方法;4.分析实验产生误差的原因及减小误差的可能途径。
二、实验装置如图1.1所示,本实验装置由风机、流量计、比热仪主体、调压器和功率表等组成。
实验时,被测空气由风机经流量计送入比热仪主体,经加热、均流、旋流、混流后流出。
比热仪主体构造如图1.2所示,由多层杜瓦瓶、电热器、均流阀、绝缘垫、旋流片、混流网、出口温度计等组成。
气体的流量由节流阀调节,比热仪出口温度由电加热器输入功率来控制。
比热仪可测200℃以下气体的定压比热。
图1.1 比热仪全套装置图1.2 比热仪主体三、实验原理根据气体平均定压比热定义,当气体在定压加热过程中温度由t1升到t2时,其平均定压比热可以由下式确定:21,21|()ptp m tmQcq t t=-J/(kg.℃)式中:Q p-湿空气在定压加热过程中的吸热量J/sq m-湿空气的质量流量kg/s湿空气是干空气和水蒸气的混合物,当湿空气中水蒸气含量较少,分压力较低时,水蒸气可以当作理想气体处理。
显然,当已知湿空气中水蒸气的吸热量Q v时,干空气的定压比热可由下式确定:21,,21|()p v t pm a t m a Q Q c q t t -=- J /(kg.℃)式中: Q p -湿空气在定压加热过程中的吸热量 J /s Q v -水蒸气的吸热量 J /s q m ,a -干空气的质量流量 kg /s由1t 加热到2t 的平均定压比热则可表示为:()212112,212t t t p m t a bt dt t t ca bt t ++==+-⎰ 若以(t 1+t 2)/2为横坐标,21,t p mt c 为纵坐标,如图3所示,则可根据不同温度范围的平均比热确定截距a 和斜率b,从而得出比热随温度变化的计算式。
化工热力学

i
0
对二元系统:
x1d ln γ1 x2 d ln γ 2 0
用途: 由已知组分的活度系数计算未知组分的活度系数。
4-9-2 不对称超额性质
定义:真实溶液与理想稀溶液的摩尔性质之差
若M=G:
M
G G
is*
E
M M
is*
is
G
E*
xi (G i Gi ) xi RT ln γ* i
is fi
其中上标 is " 理想稀溶液 "
2 溶质的计算:Herry规则
H i , solvent xi
H i , solvent 溶质i在溶剂中的 Herry 常数
4-8
活度系数及其归一化
•
根据参考态不同活度系数分为:
1 对称归一化的活度系数 2 不对称归一化的活度系数
4-8-1对称归一化的活度系数
4-10-4 NRTL方程和Uniquac方程
为了改进Wilson方程,出现了许多修正的Wilson方
程,有代表性的有NRTL和Uniquac方程。
优点: 1.二者和Wilson一样,能进行多元系统的计算。 2.能用于液相分层系统,因此可用于L-L平衡计算。
1.NRTL方程:
ln i
x j jiG ji
2 3 4 ln γ1 2 x2 3 x2 4 x2
其中 2 , 3 , 4 仅是T的函数,求:在同T下溶质组分 的活度系数模型。 解: ∵在低P下,对液体的影响不大,故可按 等T、P处理。由G-D的简化式: 有 x d ln γ 0
i
i
x1d ln γ1 x2 d ln γ 2 0
能源化学工程专业《化工热力学》课程教学改革研究

能源化学工程专业《化工热力学》课程教学改革研究《化工热力学》课程是能源化学工程专业的重要基础课程之一,在培养学生的热力学基础、化工过程计算以及工程实践能力方面具有重要作用。
由于传统的课程教学方式单一,教学内容枯燥,学生学习兴趣不高,且与实际工程应用脱节,已经逐渐无法满足当前能源化学工程专业培养目标的要求。
对《化工热力学》课程的教学进行改革研究势在必行。
一、鼓励学生以问题为导向学习以往的教学方式,教师单一传授知识,学生被动接受,容易使学生变成知识的“搬运工”,缺乏主动性。
在新的教学改革中,可以引入问题导向学习(PBL)模式。
在教学中,教师可以通过提出一些实际工程问题,鼓励学生主动参与讨论,自主学习与探索,培养学生分析问题、解决问题的能力。
教师应该注重培养学生掌握基本的热力学理论与方法,在解决问题时注重思维过程,教会学生如何合理运用理论知识解决实际工程问题。
二、加强实验教学实验教学是能源化学工程专业的重要组成部分,对于《化工热力学》课程的教学也至关重要。
通过实验教学,学生可以更加直观地理解热力学理论,培养实践操作能力,提高解决实际问题的能力。
在新的教学改革中,可以增加实验环节,设计一些与实际工程结合紧密的实验项目。
教师可以通过引导学生进行实验操作、数据处理和结果分析,使学生能够将理论知识与实际操作相结合,更好地理解和应用热力学理论。
三、结合软件应用在当今信息技术发达的背景下,软件应用已经成为工程实践中不可或缺的一部分。
在《化工热力学》课程中,可以结合热力学软件的使用,引导学生进行热力学计算与模拟。
通过软件模拟,学生可以更加直观地感受到热力学理论在实际应用中的效果,提高学生的实际操作能力和工程实践能力。
在教学中,教师还可以引导学生学习软件的使用方法,掌握软件的基本功能,为今后的工作和学习打下坚实的基础。
对于能源化学工程专业《化工热力学》课程的教学改革研究可以从鼓励学生以问题为导向学习、加强实验教学和结合软件应用等方面入手。
化工热力学试验

化工热力学试验1. 引言化工热力学试验是在化学工程领域中进行的实验,旨在研究化学反应和物质转化过程中的热力学性质。
通过测量和分析样品的热力学参数,可以确定化学反应的热效应、平衡常数和热力学平衡,为化学工程的设计和优化提供重要参考。
本文将介绍化工热力学试验的目的、原理、常见测量方法以及实验设计和数据处理方面的要点。
2. 试验目的化工热力学试验的主要目的是测量和研究化学反应中的热力学参数,包括热效应、平衡常数和热力学平衡等。
通过试验获得的数据可以用于计算和预测化学反应的热力学性质,为化学工程的设计和优化提供依据。
3. 试验原理化工热力学试验基于热力学基本原理,利用热量的转移和守恒关系,测量和计算样品的热力学参数。
热力学基本原理包括(1)能量守恒原理,即能量可以从一个物体传递到另一个物体或转化为其他形式;(2)熵增原理,即在孤立系统中,熵的增加方向是不可逆的;(3)状态函数和路径函数,即状态函数只与初始状态和最终状态有关,与路径无关,而路径函数则与路径有关。
基于这些原理,化工热力学试验可以通过测量系统在不同条件下的温度、压力、体积等参数,来计算热效应、平衡常数和热力学平衡。
4. 常见测量方法4.1 温度测量方法常见的温度测量方法有接触式和非接触式两种。
接触式温度测量方法包括电阻式温度计、热电偶和热敏电阻等,适用于测量液体和固体的温度。
非接触式温度测量方法包括红外线测温和热像仪等,适用于测量高温物体或难以接触的物体的温度。
4.2 压力测量方法常见的压力测量方法有压力传感器和压力表两种。
压力传感器适用于连续测量压力变化,可以实时监测系统的压力变化。
压力表适用于手动测量压力,通常包括压力计和差压计。
4.3 体积测量方法常见的体积测量方法有液体容积计和气体体积计两种。
液体容积计适用于测量液体的体积变化,通常采用毛细管法或容量瓶法。
气体体积计适用于测量气体的体积变化,通常采用压力容器法或活塞法。
4.4 热量测量方法常见的热量测量方法包括热电偶热量计、热交换器和热流量计等。
化工热力学总结

(mjsj)out> (misi)in
j
i
对于可逆绝热过程, ΔSg = 0,则有:
(mjsj)out (misi)in
j
i
三、温熵图
1
T 3 6 4
2
T T2/
T2
5
P2 P1
2/ 2
S 图4-9 节流膨胀过程
S 图4-10 等熵膨胀过程
四、卡诺循环
热机效率 制冷效率
c 1 TL
m
j
dt
3.开系稳流过程的能量平衡:
0 Q Ws H Ep EK
当进出物料只有一种时:
Q Ws
q ws
mh gmz 1
h
gz
1
2
u
2
mu
2
2
4.几种简化形式:
1 u 2 gz p 0
2
h 1 u2 0 2
h q ws
绝热时: ws h
5.轴功的计算:
⑴ 可逆轴功Ws(R) :(无任何摩擦损耗的轴功)
子的相互作用;……
3. 范德瓦尔斯方程
p
RT V b
a V2
4. RK方程
p
RT V b
T 1/ 2V
a (V
b)
5. SRK方程
p RT aT
V b V (V b) 6. PR方程
p
RT V b
V
(V
aT
b)
bV
b
1)T>Tc
2)T=Tc
仅有一个实根,对应于超临界 流体和气体的摩尔体积。
TH
TL
TH TL
热泵的制热系数
TH
TH TL
例:某热泵功率为10kW,周围自然环境温度为0℃。 用户要求供热的温度为90℃。求此热泵最大的供热 量以及热泵从环境吸收的热量。
aspen在化工热力学上的应用举例

• SRK方程结果:
PR-BW方程结果:
结论:压力在2.35~2.36MPa
结论:压力在2.33~2.34MPa
混合物摩尔体积的计算
例:
• 某合成氨厂原料气的配比是N2∶H2=1∶3(摩尔 比),进合成塔前,先把混合气体压强压缩到 40.532MPa(400atm),并加热到300℃。因混合气 体的摩尔体积是合成塔尺寸设计的必要数据,试用 以下方法计算(已知文献值Zm=1.155) 。 模型: Mixer
模型: 条件: 温度=65℃ 压力=自变量(20~29MPa) 进料流量:0.5kg/h 出料密度=因变量 过程中发现当压力大于3Mpa时,密 度急剧增加,因为气体已经液化
• NRTL方程结果:
NRTL-RK方程结果:
结论:压力在2.75~2.76MPa(最偏离)
结论:压力在2.38~2.39MPa(最接近)
Vm=0.136m³ /1kmol=0.136m³ /kmol 更接近
• 问题: 输入物流默认参数为:温度,压力(戒气相分数), 流量;而我们要解决的问题是压力未知的条件。 • 解决思路: 我们选择不同的压力,求出相应条件下的体积,与 V=0.03m³ 相应的压力即所求。 然而在灵敏度分析中,体积不能成为因变量,但密度 可以成为因变量,而这是很容易求出的,即: 0.5kg/0.03m³ =16.67kg/m³
利用ASPEN PLUS分析热力学问题的 几个实例
气体压力的计算
例2-5
某容器置于65℃的恒温水浴中,体积为0.03m3,内
装0.5Kg气体氨。试分别用下列方法计算气体压力。 试验值为2.382MPa。
模型: Mixer 物性方法:NRTL(理想气体状态方程)
同济大学工程热力学实验报告

工程热力学实验指导书许思传同济大学汽车学院二○一二年三月实验Ⅰ:喷管中气体流动特性实验 (543)一、实验目的 (3)二、实验原理 (3)三、实验装置................................................................................. 错误!未定义书签。
四、实验步骤 (3)实验Ⅱ:空气比定压热容测定实验 ........................................................ 错误!未定义书签。
一.实验目的................................................................................. 错误!未定义书签。
二. 实验装置和原理.................................................................... 错误!未定义书签。
三.实验步骤和数据处理.................................................................. 错误!未定义书签。
四.注意事项................................................................................. 错误!未定义书签。
实验Ⅲ:真空条件下水蒸汽饱和蒸汽压及汽化潜热的测定实验 .. (9)一.实验目的 (9)二.实验装置 (9)三.实验步骤 (10)四.数据记录及计算结果 (10)五、注意事项 (12)实验Ⅳ:二氧化碳p―v―T关系的观察和测定...................................... 错误!未定义书签。
一.实验目的................................................................................. 错误!未定义书签。
化工热力学实验指导书
实验一二氧化碳PVT关系一、实验目的1、了解CO2临界状态的观测方法,增加对临界状态概念的感性认识。
2、增加对课堂所讲的工质热力状态、凝结、汽化、饱和状态等基本概念的理解。
3、掌握CO2的p-v-t关系的测定方法,学会用实验测定实际气体状态变化规律的方法和技巧。
4、学会活塞式压力计,恒温器等热工仪器的正确使用方法。
二、实验内容1、测定CO2的p-v-t关系。
在p-v坐标系中绘出低于临界温度(t=20℃)、临界温度(t=31.1℃)和高于临界温度(t=50℃)的三条等温曲线,并与标准实验曲线及理论计算值相比较,并分析其差异原因。
2、测定CO2在低于临界温度(t=20℃、27℃)饱和温度和饱和压力之间的对应关系,并与图四中的t s-p s曲线比较。
3、观测临界状态(1)临界状态附近气液两相模糊的现象。
(2)气液整体相变现象。
(3)测定CO2的p c、v c、t c等临界参数,并将实验所得的v c值与理想气体状态方程和范德瓦尔方程的理论值相比教,简述其差异原因。
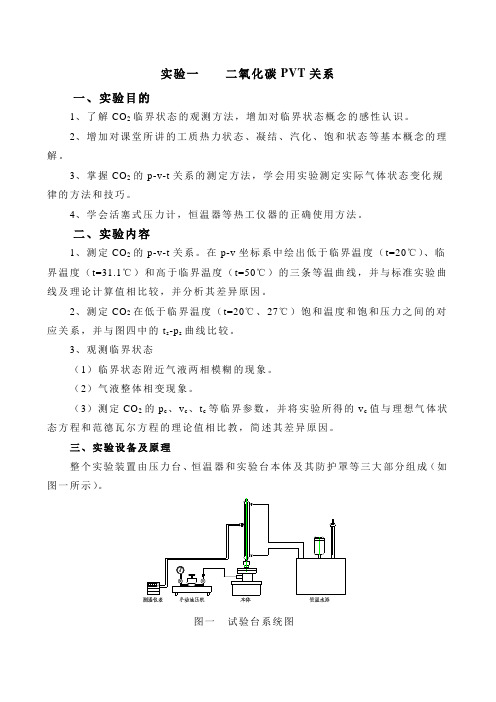
三、实验设备及原理整个实验装置由压力台、恒温器和实验台本体及其防护罩等三大部分组成(如图一所示)。
图一试验台系统图图二试验台本体试验台本体如图二所示。
其中1—高压容器;2—玻璃杯;3—压力机;4—水银;5—密封填料;6—填料压盖;7—恒温水套;8—承压玻璃杯;9—CO2空间;10—温度计。
、对简单可压缩热力系统,当工质处于平衡状态时,其状态参数p、v、t之间有:F(p,v,t)=0 或t=f(p,v) (1)本实验就是根据式(1),采用定温方法来测定CO2的p-v-t关系,从而找出CO2的p-v-t关系。
实验中,压力台油缸送来的压力由压力油传入高压容器和玻璃杯上半部,迫使水银进入预先装了CO2气体的承压玻璃管容器,CO2被压缩,其压力通过压力台上的活塞杆的进、退来调节。
温度由恒温器供给的水套里的水温来调节。
实验工质二氧化碳的压力值,由装在压力台上的压力表读出。
工程热力学二元气液平衡数据的测定

二元气液平衡数据测定实验装置说明书天津大学化工基础实验中心一. 实验设备的特点1. 该实验装置全部采用玻璃材料制成可以清楚观测釜内的实验现象。
2. 该装置具有实验样品用量少,达到平衡速度快的特点,设备造价较低,经久耐用。
3. 设备小型化,学生易于操作,且实验数据重现性良好。
二. 设备的主要技术数据(一) 平衡釜(如图一所示) (二) 物系 (乙醇─正丙醇)1. 纯度:分析纯. 乙醇沸点: 78.3℃; 正丙醇沸点:97.2℃.2. 折光指数与溶液浓度的关系见表1。
式计算:W=58.844116-42.61325 ×n D其中W为乙醇的质量分率; n D 为折光仪读数 (折光指数). 由质量分率求摩尔分率(XA):乙醇分子量MA=46; 正丙醇分子量MB =60BA AAAAA M W M W M W X )](1[)()(-+=三. 实验设备的基本情况实验设备流程示意图: 见图一所示. 四. 实验方法及步骤1. 将与阿贝折光仪配套的超级恒温水浴(用户自备)调整运行到所需的温度,并记下这个温度(例如30℃).2. 测温管内倒入甘油,将标准温度计插入套管中。
3. 配制一定浓度(体积浓度10%左右)的乙醇─正丙醇混合液(总容量50毫升),然后倒入平衡釜中。
4. 打开冷凝器冷却水,接通电源缓慢加热,冷凝回流液控制在每秒2-3滴。
稳定回流20分钟,以建立平衡状态。
5. 达到平衡时停止加热,用微量注射器分别取两相样品用阿贝折光仪分析其组成。
6. 从釜中取出6毫升液体后,在补充6毫升的乙醇溶液,重新建立平衡。
7. 所加溶液视上一次的平衡温度定,以免实验数据点分布不均。
8. 检查数据合理后, 停止加料并将将加热电压调为零。
停止加热后10分钟,关闭冷却水,一切复原。
五. 使用本实验设备应注意事项1. 本实验过程中要特别注意安全,实验所用物系是易燃物品,操作过程中避免洒落以免发生危险。
2. 本实验设备加热功率由电位器来调解,固在加热时应注意加热千万别过快,以免发生爆沸(过冷沸腾),使液体从平衡釜冲出,若遇此现象应立即断电。
工程热力学实验报告

相同的方法和步骤进行。
13
第十三页,共二十一页。
实验一 气体(qìtǐ)定压比热容测定实验
一.实验目的 1.了解气体比热测定(cèdìng)装置的基本原理和构 思。 2.熟悉本实验中测温、测压、测热、测流量的 方法。 3.掌握由基本数据计算出比热值和比热公式的 方法。 4.分析本实验产生误差的原因及减小误差的可 能途径。
(毛细管)内径(截面积)不易测准。本实验用间接方法确定CO2 的比容。假定承压玻璃管(毛细管)内径均匀一致,CO2比容和高 度成正比。具体方法如下: • (1)由文献,纯CO2 液体在25℃,7.8MPa 时,比容V = 0.00124 m3/kg;
7
第七页,共二十一页。
• (2)实验测定本装置在25℃,7.8MPa(注意:绝对压力=表压+
c pm
t2 t1
c
t2 t1
a
bt
dt
a
b
t1
t
为pm 纵tt12 坐t 2标,则t1可根据不同温2度
2
范围的平均比热确定截距a和斜率b,从而得出比热随温度变化
的计算式。
15
第十五页,共二十一页。
大气是含有(hán yǒu)水蒸气的湿空气。当湿空气气流由温 度t1加热到t2时,其中水蒸气的吸热量可用式下式计算:
1
第一页,共二十一页。
实验一 二氧化碳(èr yǎng huà tàn)临界现象观测及pυ-t
关系实验
• 一.实验目的 • 1.了解CO2临界状态的观测方法,增加对临
界状态概念的感性认识。 • 2.加深对课堂所讲的工质的热力(rèlì)状态、
化工热力学——精选推荐

化工热力学1、在某T, p下,测得某二元体系的活度系数值可用下列方程表示:ln?1?x2(2?0.5x2) ,ln?2?x1(2?0.5x1) ,?i为基于Lewis-Randall规则标准状态下的活度系数。
试问,这两个方程式是否符合热力学一致性?2、已知氯仿(1)和甲醇(2)组成的二元溶液,在50℃时,各组分的无限稀释活度系数分别为?1?2.3,?S?2?7.0,饱和蒸汽压分别为:p1S= 67.58kPa,p2= 17.63kPa。
请问:(1) 假定该体系服从van Laar ?方程,请计算50℃时与x1=0.3成平衡关系的汽相组成y1。
(2) 在50℃时由纯组分混合形成1mol 上述溶液的ΔG值。
3、在常压(101.325kPa)下,二元体系氯仿(1)-甲醇(2)恒沸混合物的组成x1=0.65,其沸点为53.5℃,如果气相可视为理想气体,液相服从van Laar 方程。
并已知纯组分在53.5℃下的饱和蒸汽压分别为:Sp1S= 78.26kPa,p2= 64.53kPa。
求:(1) van Laar 方程的常数;(2) 53.5℃时与x1=0.25成平衡关系的汽相组成y1。
4、某换热器内,冷、热两种流体进行换热,热流体的流率为100kmol.h-1,Cp =29 kJ.kmol-1.K-1,温度从500K降为350K,冷流体的流率也是100kmol.h-1,Cp =29 kJ.kmol-1.K-1,进入换热器的温度为300K,换热器表面的热损失为87000 kJ.h-1,求该换热器的有效能损失及有效能利用率。
设T0=300K。
5、苯(1)和环己烷(2)在303 K,0.1013 MPa下形成x1 = 0.7的溶液。
已知此条件下V1=89.96 cm3/mol,V2=109.4 cm3/mol,在该条件下两种物质的偏摩尔体积分别为1=90.20 cm3/mol,2=110.69 cm3/mol,求混合溶液体积V和超额体积VE分别是多少cm3/mol?6、乙醇(1)-苯(2)恒沸混合物的组成x1=0.448,其在常压(101.325kPa)下的沸点为68.2℃,如果气相可视为理想气体,液相服从van Laar 方程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HAC
0.00 1.0
理论数值
0.25
0.6 0.4 0.2
1.00
H20O.00
0.25
0.50
0.75
0.0VAC
1.00
醋酸-水-醋酸乙烯溶解度曲线
三 实验装置
四 实验步骤
1.测定溶解度曲线
或简化为
xi
i
xi
i
(i 1, 2, , N )
二 实验目的
1.测定醋酸—水—醋酸乙烯在25℃下 的液液平衡数据
2.用醋酸—水、醋酸—醋酸乙烯两对 二元系的汽液平衡数据以及醋酸乙烯— 水二元系的液液平衡数据,求得的活度 系数关联式常数,以计算三元液液平衡 结线的推算值,与实验数据比较;
3. 观测临界状态
。
(1) 临界状态时近汽液两相模糊的现象。
(2) 汽液整体相变现象。
(3) 测定的CO2的tc,pc,vc等临界参数, 并将实验所得的vc值与理想气体状态方程 和范德瓦尔方程的理论值相比较,简述其 差异原因
三、实验设备及原理
对简单可压缩热力系统,当工质处于平 衡状态时,其状态参效p、v、t之间有:
2)如前操作实地测出本试验台CO2在 20℃,9.8MPa时的CO2液柱高度 Δh*(m),(注意玻璃水套上刻度的标记
方法) 3)由1)可知υ(20℃,9.8MPa)=
h A
=0.00117m3/kg
m
m h* k(kg m2 ) A 0.00117
那么任意温度,压力下CO2的比容为
v h h mh k
将恒温水浴的温度调至25℃,根据相图, 配制30%醋酸—醋酸乙烯二元溶液约20g, 恒温15min,然后用已称重的针筒缓慢滴 入水不断摇动,仔细观察浊点出现,达浊点 后将针筒拔出称重,减量法求出加样量,计 算各组分的组成。滴加醋酸使溶液澄清,恒 温15min,再加水至第二浊点,同上计算 组成。
2.观察大气压,将100毫升针筒与系统相 连,控制系统压力为101.325kPa。
3.加热:接通电源,调节变压器,缓慢 升温加热至釜液沸腾。
4.调节阿贝折光仪的循环水温至25度
5.取样;观察平衡釜内的沸腾情况,冷凝 回流液控制在每秒2~3滴,稳定地回流约 20分钟,以建立平衡状态。记下平衡温度, 用取样器同时取气液两相样品。(为保证 样品准确,取样时用取样器抽洗2~3次后 再测)
式中 h h hf ,将测得的数据整理
成表,并在p-v图上作出等温线
2 应用RK方程进行体积数据推算,并与 相应的实验值比较
临界温度以下取气相与液相各一值,其 它每个温度一值
六、实验报告
1. 简述实验原理及过程。 2. 各种数据的原始记录。 3. 计算及在p-v图上画出等温线。 4. 将实验测得的饱和温度与饱和压力的
察临界现象 7. 测定高于临界温度t=40℃时的等温线
五、数据处理
1 计算仪器常数 由于充进承压玻璃管内的CO2质量不便测
量,而玻璃管内径或界面(A)又不易测 准,因而实验中采用间接办法来确定CO2 的比容,认为CO2的比容ν与其高度是一 种线性关系。具体如下: 1)已知CO2液体在20℃,9.8MPa时的比 容ν(20℃,9.8MPa ) =0.00117m3/kg
化工热力学实验
实验一 二氧化碳临界状态观测及p-v-t关系测定
一、实验目的 1. 了解CO2临界状态的观测方法,增加对 临界状态概念的感性认识。 2. 加深对课堂所讲工质的热力状态、凝结、 汽化、饱和状态等基本概念的理解。
3. 掌握CO2的p-v-t关系的测定方法, 学会用实验测定实际气体状态变化规律 的方法和技巧。
对应与有关资料上数据进行比较 5. 将实验测得的临界比容vc与理论计算
值比较其差异及原因。RK方程比较。 6. 实验讨论。
实验二 二元汽液平衡数据的测定
一、 原理
循环釜原理示意图
A—蒸馏瓶
B—接收瓶
达到平衡状态时,每一组分在各相中 的化学位相等,即逸度相等。对于二元 两相平衡,其热力学基本关系式为:
F(p,v,t)=0或t=f(p,v)(1) 本试验就是根据式(1),采用定温方法
来测定CO2 p-v之间的关系,从而找出 CO2的p-v-t的关系。
四、实验步骤
1. 装好实验设备,开启试验台本体上的日光灯 2. 使用恒温器调定温度 3. 加压前的准备 4. 做好实验的原始记录 5. 测定低于临界温度t=20℃时的定温线 6. 测定临界等温线t=31.1℃和临界参数,观
4. 学会活塞式压力计、恒温器等部分热 工仪器的正确使用方法。
二、实验内容
1. 测定CO2的p-v-t关系。在p-v坐标图 中绘出低于临界温度(t=20℃)、临界温 度(t=31.1℃)和高于临界温度(t=40℃) 的三条等温曲线,并与标准实验曲线及 理论计算值相比较,并分析差异原因。
2. 测定CO2在低于临界温度时,饱和温 度与饱和压力之间的对应关系。
6.分析:将取下的样品用阿贝折光仪测定 其折光指数,通过标准曲线图查x,y的值; 或采用气相色谱分析检测
7.取样后,改变釜内的组成,重复上述 步骤,进行第二组数据的测定,要求每 组至少测四组平衡数据。
8.实验结束,先把变压器的电压逐渐调 到零,关闭其开关,切断折光仪和恒温 槽的电源,釜内温度降低,关冷却水, 整理好实验仪器试验台。
五、数据处理
1 绘出折光率-组成标准曲线 2将实验测得的平衡数据以表格形式列出 3 计算出活度系数 4 由附录标准值绘制T—x—y图 5 将实验值标在图中,比较偏差,分析
原因。
实验三 三元液液平衡数据的测定
一 、原理 液液平衡准则
f
i
xi
i
fi
xi
i
(i 1, 2, , N )
L
V
fi fi
常压下,汽相可视为理想气体,则
Pyi
Pis xi i
i
Pyi Pis xi
二 实验目的
1 测定常压下乙醇(1)-水(2)二元汽液 平衡数据
2 通过实验了解汽液平衡釜的构造,掌握二 元汽液平衡数据的测定方法和技能。
3 绘制汽液平衡相图。
三 实验装置
四 实验步骤
1.加料:从加料口加入25-30毫升乙醇 和水,组成约为0.1,0.3,0.5,0.7, 检查气密性,然后开冷却水。
