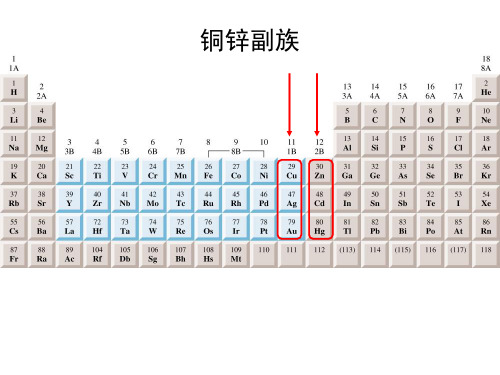
19.铜锌副族
第19章--铜副族和锌副族

容易形成合金,尤其以铜合金居多。常见的铜合金有 黄铜(锌40%),青铜(锡∼15%,锌5%),白铜(镍13%∼ 15%)。
2 化学性质
铜副族元素的氧化态有 +1,+2,+3 三种,这是 铜副族元素原子的 (n-1)d 和 ns 轨道能量相近造成的, 不仅 4s 电子能参加反应,3d 电子在一定条件下也可失去 一个到两个,所以呈现变价。相比之下,碱金属 3s 与次 外层 2p 轨道能量相差很大,在一般条件下很难失去次外 层电子,通常只能为 +1价。
Cu2S 只能溶于浓、热硝酸或氰化钠(钾)溶液中:
3 Cu2S + 16 HNO3 6 Cu(NO3 )2 +3 S+4 NO+8 H2O
Cu2S + 4 CN -
2 [Cu(CN) 2]- +S2-
(4) 配位化合物
Cu+可与单齿配体形成配位数为2、3、4的配位化合
物,由于Cu+ 的价电子构型为d 10,所以配位化合物不会
Cu(NO3)2+ 2 NO2 + 2 H2O
3 Cu + 8 HNO3 (稀) 3 Cu(NO3)2 + 2 NO + 4 H2O
Cu + 2 H2SO4 (浓)
CuSO4 + SO2 + 2 H2O
金的金属活性最差,只能溶于王水中:
Au + 4 HCl + HNO3 H[AuCl4]+ NO + 2 H2O
第 19 章 铜副族和锌副族
前言
铜副族(I B): 原子核外价层电子的构型 :(n-1)d10ns1 常见氧化态:
铜 (+1,+2 ) 银 (+1) 金 (+1,+3)
铜、银、金被称为“货币金属”。 在自然界中,铜、银、金可以以单质状态、也可以以化 合态存在。
高中化学竞赛课件_无机化学全套_第19章_铜、锌副族111

Cu + 4HNO3 (浓) Cu(NO 3 ) 2 + 2NO2 +2H 2O 3Cu + 8HNO3 (稀) 3Cu(NO 3 ) 2 + 2NO + 4H 2O
Ag + 2HNO 3 (浓) AgNO 3 + NO2 + H 2 O Cu + 2H 2SO 4 (浓) CuSO 4 + SO 2 +2H 2 O 2Ag + 2H 2SO 4 (浓) Ag 2SO 4 (s) + SO 2 +2H 2 O Au + 4HCl( 浓) + HNO 3 (浓) H[AuCl 4 ] + NO + H 2 O
Cu(I) 有还原性,在空气中CuCl可被氧化 4CuCl + O2 + 4H2O = 3CuO· CuCl2· 3 H2O + 2HCl Cu(I) 也有氧化性 2CuI(白) + 2Hg = Hg2I2 ( 黄 ) + 2Cu 将涂有白色 CuI 的纸条挂在室内,若常温下3小 时白色不变, 表明空气中汞的含量不超标。 (2) Ag(I) 的氧化还原性 Ag2+ 1.980 Ag+
(2) Cu(II)的氧化-还原性
0.521 2+ 0.152 + + 0.153V 0.52V Cu Cu Cu 2+ Cu Cu Cu 0.337
I2 0.535V I
-
从以上数据上看 Cu2+不能氧化I-,实际反应是: 2Cu2+ + 4I2CuI + I2 生成CuI,[Cu+] 降低,电位升高,将 I- 氧化成 I2 。产 物是 Cu(I) 的难溶盐或稳定配离子时, Cu(II)有较好 的氧化性。又如: 2Cu2++4CN2CuCN + (CN)2 CN-既是还原剂,又是沉淀剂;若CN- 过量,则变为:
第十九章铜副族元素和锌副族元素

第十九章铜副族元素和锌副族元素1.用反应方程式说明下列现象:(1)铜器在潮湿空气中会慢慢生成一层铜绿;(2)金溶于王水中;(3)在CuCl2浓溶液逐渐加入稀释时,溶液颜色有黄棕色经绿色而变为蓝色。
(4)当SO2通入CuSO4与NaCl的浓溶液时析出白色沉淀;(5)往AgNO3溶液滴加KCN溶液时,先生成白色沉淀而后溶解,再加入NaCl溶液时并无AgCl沉淀生成,但加入少许Na2S溶液时却析出黑色Ag2S沉淀。
答(1) 2Cu + O2 + H2O + CO2 = Cu2(OH)2CO3(2) Au + 4HCl + HNO3 = HAuCl4 + NO + 2H2O(3) [CuCl4]2- + 4H2O = [Cu(H2O)4]2+ + 4Cl-[CuCl4]2-为黄色[Cu(H2O)4]2+为蓝色,而当这两种离子共存时溶液呈绿色(4)2Cu2+ + 2Cl- + SO2 + 2H2O = 2CuCl + 4H+ + SO42-(5) Ag+ + CN- = AgCNAgCN + CN-=[Ag(CN)2]-2[Ag(CN)2]- + S2- = Ag2S + 4CN-2.解释下列实验事实:(1)焊接铁皮时,常先用浓ZnCl2溶液处理铁皮表面;(2)HgS不溶于HCl,HNO3和(NH4)2S中而能溶于王水或Na2S中,(3)HgC2O4难溶于水,但可溶于含有Cl-离子的溶液中;(4)热分解CuCl2·2H2O时得不到无水CuCl2;(5)HgCl2溶液中有NH4Cl存在时,加入NH3水得不到白色沉淀NH2HgCl。
答(1)ZnCl2 + H2O = H[ZnCl2(OH)]H[ZnCl2(OH)]有显著的酸性能清除金属表面的氧化物而不损害金属表面如:FeO + 2H[ZnCl2(OH)]2 + H2O(2)HgS不溶于HCl溶液中是因为HgS的容度积常数太小HgS不溶于HNO3是因为它与HNO3反应生成难溶的Hg(NO3)2HgSHgS不溶于(NH4)2S是因为(NH4)2S溶液水解为HS-,因而S2-浓度很低,不能形成配合物HgS溶于王水,它与王水反应生成HgCl42-和S3 HgS + 8H+ + 2NO3- + 12Cl- = 3HgCl42- + 3S + 2NO + 4H2OHgS溶于Na2S溶液反应生成可溶性的HgS22-HgS + S2- = HgS22-(3)为H2C2O4酸性比HCl 弱得多;而Cl-与Hg2+生成的配合物较稳定,因而HgC2O4溶于盐酸HgC2O4 + 4HCl = H2HgCl4 + H2C2O4(4)Cu2+离子极化能力很强,HCl又为挥发性酸,CuCl22H2O 热分解时发生水解,得不到无水CuCl2CuCl22H22O↑ + HCl↑(5)NH4Cl存在抑制了生成NH2-,且NH2HgCl 溶解度较大,因而不能生成NH2HgCl沉淀HgCl2 + 4NH3 = Hg(NH3)42+ + 2Cl-3.试选用配合剂分别将下列各种沉淀溶解掉,并写出相应得方程式。
【高中化学奥赛课件】 铜、锌副族

(3)反射炉形成冰铜:
2 FeS+3O2= 2FeO+2SO2↑ FeO+ SiO2 = FeSiO3 mCu2S+nFeS →冰铜 (4)转炉熔炼:
2Cu2S+3O2=2Cu2O+2SO2↑ 2 Cu2O+ Cu2S=6Cu+SO2↑
吹炼所集粗铜含有0.3%~0.5%的金属杂质(Ni、Fe、 Pd、Sb、Bi、Ag、Au等),粗铜导电性不好,为获得 更纯、高导电性的铜需电解精炼。
(5)电解精炼:
在CuSO4和H2SO4混合液的电解槽内,以 粗铜为阳极,纯铜99.95%为阴极,低压下(约 0.5V)电解。在阴极上得到99.95%的纯铜,在 阳极泥中回收Au,Ag,Pt,Pd,及Se,Te等, 电解液回收Ni。
2、银和金的冶炼: 常用方法—氰化物浸取
• 4Ag+8NaCN+2H2O +O2 =4Na[Ag(CN)2] +4NaOH Ag2S+4NaCN=2Na[Ag (CN)2] +Na2S
△Ho水
M+(g)
升华热/kJ·mol-1 第一电离能/kJ·mol-1 M+水合热/kJ·mol-1 总热效应/kJ·mol-1
铜
331 746 - 582 495
银
284 731 - 485 530
表18-2 铜族原子转为M+(aq)时的能量
金
385 890 - 644 631
2、酸性介质中Cu(Ⅰ)和Au(Ⅰ)不稳定,易歧化
元素 性质
元素符号 原子序数 相对原子质量 价层电子构型 主要氧化数 原子半径/pm 离子半径(M +)/pm 离子半径(M2+)/pm 电离能I1/kJ.mol-1 电离能I2/kJ.mol-1 M +水合热/kJ.mol-1 M2+水合热/kJ.mol-1 升华热/kJ.mol-1 电负性(Pauling)
《无机化学》课件——第19章 铜副族元素和锌副族元素

2 [ Ag(CN)2 ]- + Zn —— [ Zn(CN)4 ]2- + 2 Ag
闪银矿 Ag2S,角银矿 AgCl 的处 理就有所不同,生成 [ Ag(CN)2 ]- 的 反应如下:
Ag2S + 4 NaCN —— 2 Na [ Ag(CN)2 ] + Na2S
固态 CuCl2 具有链状结构。
每个 Cu 处于 4 个 Cl 形成的 平面正方形的中心:
在浓溶液中 CuCl2 是黄色 的,这是由于生成 [ CuCl4 ]2- 配位单元的缘故。
稀溶液中水分子多, CuCl2 变为 [ Cu(H2O)4 ] Cl2,由于水合 显蓝色。
目前这种方法已经被严令禁 止使用。
另一种方法是氰化法提金,用 NaCN 溶液浸取矿粉,将金溶出:
4 Au + 8 CN- + 2 H2O + O2 —— 4 [ Au(CN)2 ]- + 4 OH-
用 Zn 还原 [ Au(CN)2 ]- 得 Au
2 [ Au(CN)2 ]- + Zn —— [ Zn(CN)4 ]2- + 2 Au
4 Cu2++ 8 OH- + N2H4 —— 2 Cu2O + N2 + 6 H2O
Cu2O 呈弱碱性,溶于稀酸,并 立即歧化为 Cu 和 Cu2+:
Cu2O + 2H+ —— Cu + + Cu2+ + H2O
Cu2O 十分稳定,在 1235 ℃ 熔化但不分解。
Cu2O 溶于氨水,生成无色的 络离子:
2. 铜副族元素的提取
铜副族和锌副族优秀课件

前言
铜副族(I B): 原子核外价层电子的构型 :(n-1)d10ns1 常见氧化态:
铜 (+1,+2 ) 银 (+1) 金 (+1,+3)
铜、银、金被称为“货币金属”。 在自然界中,铜、银、金可以以单质状态、也可以以化 合态存在。
铜储量居世界第三位。以三种形式于自然界:
Cu(OH)2 -0.08 CuO2 -0.360 Cu
Ag2O3 0.739 AgO 0.607 Ag2O 0.342 Ag Au(OH)3 1.45 Au
Zn2+ -0.7618 Zn
Cd2+ >-0.6 Cd22+ <-0.2 Cd
-0.4030
Hg2+ 0.92
Hg22+ 0.789 Hg
自然铜:又称游离铜,很少;
硫化物矿:辉铜矿Cu2S、黄铜矿CuFeS2 等; 含氧矿物:赤铜矿Cu2O、黑铜矿CuO、
孔雀石CuCO3·Cu(OH)2、 胆矾CuSO4·5H2O等。
银主要是以硫化物形式存在的,除了较少的闪银矿Ag2S 外,硫化银常与方铅矿共存。
金矿主要是以自然金形式存在,包括散布在岩石中的岩 脉金和存在于沙砾中的冲积金两大类。
而Cu与配位能力较弱的配体作用时,要在氧气存在 下方能进行:
2 Cu + 8 NH3+O2 +2 H2O 2 [Cu(NH3)4]2+ + 4 OH-
铜在生命系统中起着重要作用,人体有30多种含 有铜的蛋白质和酶。血浆中的铜几乎全部结合在 铜蓝蛋白中,铜蓝蛋白具有亚铁氧化酶的功能, 成CuO。在高温下 CuO又分解为Cu2O。
银和金没有铜活泼,高温下在空气中也是稳定的。 与卤素作用,与硫作用,都反映出铜、银、金的活泼 性是逐渐减弱的。 铜与一些强配体作用放出H2,如CN-
16 铜副族和锌副族

汞与浓硝酸反应生成硝酸汞: Hg + 4 HNO3 → Hg(NO3)2 + 2 NO2 ↑ + 2 H2O 但过量的汞与冷的稀硝酸反应得到的是硝酸亚汞: 6 Hg + 8 HNO3 → 3 Hg2(NO3)2 + 2 NO ↑ + 4 H2O 与镉、汞不同,锌是两性金属,能溶于强碱溶液: Zn + 2 NaOH + 2 H2O →Na2[Zn(OH)4] + H2 ↑
在有H+或NH4+存在时,氢氧化铜可溶于氨水形成铜氨配离 子, Cu(OH)2+2NH3· 2O+2NH4+—— H [Cu(NH3)4]2+ + 4 H2O
卤化铜的颜色随着阴离子的不同而变化
CuF2 白色、 CuCl2 黄褐色 和CuBr2 黑色 , 带有结晶水的CuF2· 2O蓝色和CuCl2· 2O蓝绿色 。 2H 2H CuCl2易溶于水,在很浓的CuCl2水溶液中,可形成黄色 的[CuCl4]2-: Cu2+ + 4 Cl- —— [CuCl4]2 -
Au
Cl
Cl
二
锌副族元素
1 单质
锌副族元素的一个重要特点是熔、沸点较低。 由于汞原子 6s 轨道上的两个电子非常稳定,因此它的金 属键更弱,其熔点是所有金属中最低的。 锌副族的常见氧化态为+2。 化学活泼性随着原子序数的增大而递减,与碱土金属恰 好相反,但比铜族强。 Zn > Cd > H > Cu > Hg > Ag > Au
第 19 章 铜副族和锌副族
IB
(n-1)d10 ns1 +1,+2 +1 +3
IIB
(n-1)d10 ns2 +2
Cu Ag
Zn Cd
+1,+2
+1,+2
Au
铜锌副族

电势表中,三种金属的标准电极电势都在氢之下,它们不溶于稀盐酸 及稀硫酸中。但当有空气或配位剂存在时,铜能溶于稀酸和浓盐酸: 2Cu + 2H2SO4 + O2 = 2CuSO4 + 2H2O 2Cu + 8HCl(浓)= 2H3[CuCl4] + H2↑ Cu在常温下不与干燥空气中的氧化合,加热时能产生黑色的氧化铜。 Ag、Au在加热时也不与空气中的氧化合。在潮湿的空气中放久后铜 的表面会慢慢生成一层铜绿
1 铜族元素
1.1 铜族通性
ⅠB族:Cu 周期 元素 Ag Au 氧化态 r 117 134 134 I1 746 731 890 升华热 价电子结构
四 五 六
Cu Ag Au
3d104s1 4d105s1 5d106s1
+1、+2、+3 +1、+2、+3 +1、+2、+3
340 285 385
1 铜族元素
位,铜次之。大量的铜应用于电气及冶金工业,电工器材的制造几乎用
去一半以上的铜。铜易与其它金属形成合金,铜合金,如青铜(80%Cu、 15%Sn、5%Zn)质坚硬,易铸;黄铜(60%Cu、40%Zn)广泛用作仪
器零件;白铜(50~70%Cu、18~20%Ni、13~15%Zn)用作刀具等。
1 铜族元素
2.2 锌族单质的物理性质和化学性质
低熔点、低沸点,低于铜族和碱土金属 从上到下熔点、沸点依次降低 汞是常温下唯一的液态金属,有流动性; 汞能溶解许多金属形成汞齐
ⅠA族性质活泼,且从上到下活泼性增加,是强还原剂,可从水中置
换出氢气; Ⅰ B族性质不活泼,从上到下活泼性降低,不能从水和稀酸 中置换出氢气
《化学》铜锌副族
D、 顶吹还原 把冰铜放入转炉,鼓风熔炼: 2Cu2S + 3O2 = 2Cu2O + SO2↑ 2Cu2O + Cu2S = 6Cu + SO2↑
此粗铜又称泡铜。
E、 精炼
阳极反应:Cu(粗)- 2e- = Cu2+ 阴极反应:Cu2+ + 2e- = Cu (精铜,99.95%)
铜副族元素的金属性远比碱金属的弱,且铜副族元素的金属 性随着原子序数的增加而减弱,而碱金属恰恰相反。
从Cu 到 Au,原子半径虽增加但并不明显,而核电荷对最外层 电子的吸引力增大了许多,故金属活泼性依次减弱。
铜 第一电离能/(kJ·mol-1) 745.5
银 731.0
金 890.1
银应比铜稍活泼。实际上如果在水溶液中反应,涉及的能量 还有:离子的水合热、金属的升华热。若考虑整个过程的能 量,从Cu 到 Au越来越大。
孔雀石
辉铜矿
铜、银、金均有以单质状态存在的矿物。金以单质形 式散存于岩石(岩脉金)或砂砾(冲积金)中。世界上南非金 矿资源最丰富,其次是前苏联和美国,它们共占世界总储 量的76.3%。我国黄金矿藏遍布26省、自治区,主要分布 在山东、河南、甘肃、黑龙江和新疆等地。
二、铜族元素的通性
1、与同周期的碱金属相比,活泼性较小。Cu和Au离子容 易歧化而不够稳定。 2、铜族元素价层电子构型为(n-1)d10ns1,氧化数有+1、+2、 +3,而碱金属只有+1。铜、银、金最常见的氧化数分别为 +2、+1、+3 。
由价电子构型可见,IA、IIA和IB、IIB在失去最外层 s 电子后 分别都呈现+1和+2价氧化态,所以IB与IA有相似之处。
无机化学 第19章铜副族和锌副族

三. IB元素的阳离子多为 18e- 或 (9~17)e- 电子
构型, 具有较强的极化能力和变形性, 阳离子易水
解、 离子水化能较大、易形成共价化合物. 四. IB元素阳离子的(n-1)d、s、p轨道能级相差 不大,易于杂化并作为Lewis酸提供空轨道与Lewis 碱作用,形成一系列稳定的配合物.
NH 3 H 2O
过滤
过量HNO 3
二. 铜 族 元 素 单 质 的 性 质 1. 铜族元素的导电性和传热性极强,在所有金属 中银占首位, 铜次之; 它们有极好的延展性和可塑 性.铜(紫红色)和金(黄色)是所有金属中仅有的呈现
特殊颜色的两种金属.
2. 室温下,Cu,Ag,Au不与氧或水作用;高温下也 不与H2,N2或C作用. Au、Ag在高温下的空气中也 是稳定的.
22Cu(OH)4 C6 H12O6 C6 H12O7 Cu2O 4OH- 2H 2O
4Cu2 8OH N 2 H4 2Cu 2O N 2 6H 2O
1100 C 4C uO (s) 2C u2O (s, 暗红) O 2
1 2Cu(s) O 2 2 Cu2O 十分稳定,在 1235 ℃ 熔化但不分解.
例如Cu2+在有水合条件下能稳定存在,是由于Cu2+
的水化能不仅能补偿I2,而且有余,能量上是有利的. c. IB元素的金属活泼性远小于IA元素,且自上而 下金属活泼性递减,与IA元素的变化规律正好相反. 其原因是IB元素自上而下,原子半径增加不多,而有
效核电荷z* 增加显著,核对价电子的吸引力增大.
3 2
铜的 +1 价氢氧化物很不稳定,易脱水变为相
应的氧化物 Cu2O. 用 NaOH 处理 CuCl 的冷盐酸溶液时,生成黄 色的 CuOH 沉淀,但沉淀很快变为橙色,最后变为
铜副族和锌副族ppt课件

Cu2S + 4 CN - - + S2-
—〔— 2 [C〕u CN 2]
〔4〕 配位化合物
Cu+ 可与单齿配体构成配位数为 2、3、 4 的配位化合物,由于 Cu+ 的价电子构型 为
d10,所以配位化合物不会由于 d-d 跃迁而
产
生颜色[C。〔u NH3〕 2]+ 不稳定,遇到空气那么
变成
〔〕
深蓝色的[Cu NH3 4]2+:
汞 Hg
辰砂,又名朱砂, HgS, 在地壳中的质量 分数为 5 10-6 %。
19 - 1 铜副族元素
19 - 1 - 1 铜副族元素单质
1 铜副族元素单质的性质 〔1〕物理性质
铜副族元素属于重金属,导电性和 导热性在一切金属中是最好的,银占首 位,铜次之。
均具有很好的延展性, 1 g 金可抽成 3 km 长的丝或压成厚度约为 0.0001
—— CuSO4 + 2 H2O
C〔u OH 〕2 + 2 NaOH —— Na2[C〔u OH〕4]
〔2〕卤化铜
CuF2 白色, CuCl2 黄褐色 和 CuBr2 黑色 ,带有结晶水的 CuF2• 2 H2O 蓝色和 蓝绿色的 CuCl2• 2 H2O 。
无水 CuCl2 为无限长链构造。每个 Cu 处于 4 个 Cl 构成的平面正方形的中心:
2CN阳―极主要反响: CN― + 2OH―― 2e― —— CNO― +
H2O 2CNO― + 4OH― ― 6e― —— 2CO2 + N2 + 2H2O
19 - 1 - 2 铜的化合物
1 氧化数为 +1 的化合物
〔1〕氧化物和氢氧化物
氧化亚铜可以经过在碱性介质中复原
无机化学教学课件 19章 铜、锌副族

2020/4/24
重要的铜矿:Cu(I)FeS2,CuCO3.Cu(OH)2,Cu(I)2S 黄铜矿, 孔雀石, 辉铜矿
(d电子屏蔽作用弱) ② 化合物中共价成分 ds区 > s区 ③ 氧化态Cu2+, Au3+ (与族数不一致)
ds区金属的反应性顺序
从上到下,金属活泼性降低; 从左到右,金属活泼性增加。
原子半径增加。 均与s区相反
2020/4/24
ds 区元素
2020/4/24
19-1 铜副族元素
Cuprum Subgroup Elements 19-1-1 铜副族元素单质
分子,再失去另外两个氢键
水分子,最后失去以氢键与
结合的水分子。
无水硫酸铜为白色粉末,难溶于乙醇或乙醚,具有很强的吸水性,吸水 后呈现蓝色。
当硫酸铜加热到 923 K 时,发生分解反应:
923 K
C uSO 4 C uO +SO 3 硫酸铜具有杀菌能力,用作蓄水池、游泳池净化水的除藻剂;在医学上 用作收敛剂、防腐剂和催吐剂;在农业上,硫酸铜与石灰乳的混合液用作果 树和农作物的杀虫剂和杀菌剂。
4 A g + 2 H 2 S + O 2 2 A g 2 S + 2 H 2 O
2020/4/24
(2)化学性质
配制含小苏打和食盐的稀溶液于铝制容器中,将发黑的银器与铝制容器 接触,Ag2S可溶解,发黑银器变亮。
无机化学第十九章-铜锌副族

第十九章铜锌副族1.铜副族单质M(I)化合物M(II)化合物M(III)化合物§本章摘要§2.锌副族单质M(II)化合物M(I)化合物吐锌副族一.单质1.物理性质熔点低,既比IIA族低,也比旧族低,并依Zn、Cd、Hg次序下降,Hg是金属中熔点最低的。
Zn青白色,Cd灰白色,Hg 银白色汞易与某些金属生成汞齐,钠汞齐既保持Hg的情性,又保持Na 的活性。
银汞齐和金汞齐可用于提取贵金属银和金。
2.化学性质常温下,IIB族元素单质都很稳定。
10和非金属的反应3.锌与铜的活性比较Cu、Zn在周期表中相邻,只差一个电子,Zn的第一电势能比Cu大得多,为什么Cu却这不如Zn 活泼?学一小父屿匕小。
整个过程是:可以分解为:M闾?工朋(崎)is升华热T水合热用1M更+能1电高能两级电离能相加后,差别不*加热下,Zn、Cd、Hg均可与O2反应,生成MO式氧化物。
2Zn+O2---2ZnO2Cd+O2---2CdO(褐色)2Hg+O2---2HgO(红色)*Hg+S---HgS由于液体Hg和硫粉反应,面积大,故比Zn、Cd还易些。
用这个反应处理洒落的汞液体。
和卤素的反应也有类似的现象,即Hg比Cd还活泼些。
Hg为液体,接触面积大,反应活性高.*在潮湿的空气中,Zn将生成碱式盐4Zn+2O2+CO2+3H2O---ZnCO33Zn(OH)220和酸碱的反应*Zn、Cd都能与稀盐酸、稀硫酸反应,放出H2,Hg不能。
Hg大,水合热也相近。
关键是Zn的升华能小,财©~时)的热效应是Zn的吸热少。
AG°=AH0-W0也印项是主要的,故Zn转变的AG°/J\所以,Zn电势比Cu的小得多。
4.锌的冶炼主要矿物是闪锌矿ZnS,(常见时含有CdS)2ZnS+3O2----2ZnO(s)+2SO2(g)焙烧得到的SO2,可以用于制硫酸。
ZnO+C---Zn(g)+CO(g)(1000度以上)其中Cd的沸点低,先挥发出,Zn后挥发出,冷却得Zn粉。
第19章 铜锌副族元素习题答案 20120319

第19章铜锌副族元素习题解答1.试分别简要比较铜族元素与碱金属元素、锌族元素与碱土金属元素之间物理性质和化学性质的异同点。
2.铜族元素、锌族元素各有什么特性?3.解释下列现象,写出有关化学方程式:(1)焊接金属时,通常先用浓ZnCl2溶液处理表面;(2)由ZnCl2·H2O制备无水ZnCl2时,通常不用直接加热法制备;(3)银器在含H2S空气中变黑;(4)铜器在潮湿的空气中会生成“铜绿”;(5)[Ag(NH3)2]Cl遇到硝酸时,析出沉淀;(6)HNO3与过量汞反应的产物是Hg2(NO3)2。
4.完成下列反应的化学方程式:(1)Au(s) + HCl(l) + HNO3(l) → ;(2)Cu(s) + NH3(g) + O2(g) + H2O(l)→ ;(3)Cu2+(aq) + I-(aq) → ;(4)AgBr(s) + S2O32-(aq) → ;(5)Au(s) + NaCN(aq) + O2(g) + H2O(l) → ;(6)Zn(OH)2(s) + OH-(aq) → ;(7)Hg22+(aq) + 4I-(aq) → ;(8)Hg2Cl2(s) +NH3(l) → ;(9)HgCl2(aq) + SnCl2(aq) → ;(10)HgS(s) + H+(aq) + NO3-(aq) + Cl-(aq) → 。
5.欲从含有少量Cu2+的ZnSO4溶液中除去Cu2+,从H2S、NaOH、Zn、Na2CO3中选择最适宜加入的试剂。
6.找出实现下列变化所需的物质,并写出反应方程式:(1)Zn → [Zn(OH)4] 2-→ ZnCl2→ [Zn (NH3)4] 2+→ ZnS;(2)Cu → CuSO4→ Cu(OH)2→ CuO → CuCl2→ [CuCl2]-→ CuCl。
7.某一化合物A溶于水得浅蓝色溶液,在A溶液中加入NaOH溶液可得浅蓝色沉淀B。
B 能溶于盐酸,也能溶于氨水。
第二十章铜副族和锌副族

红色的碱性氧化物 Cu2O 不溶于 H2O ,但溶于稀酸,之后 歧化
Cu2O + H2SO4 —— CuSO4 + Cu + H2O
在固相中 Cu ( I ) 很稳定 , Cu ( I ) 具有 d 10 稳定结构 。 Cu2O 的热稳定性比 CuO 还高 。
Cu ( I ) 有还原性,在空气中 CuCl 可被氧化 4 CuCl + O2 + 4 H2O —— 3 CuO ·Cu Cl2 ·3 H2O + 2 HCl Cu ( I ) 也有氧化性
汞易与某些金属生成汞齐 Na – nHg 。 Na – nHg 既保持 Hg 的惰性,又保持 Na 的活泼性。 银汞齐和金汞齐可用于提取贵金属银和金。
二 化学性质 常温下,IIB 族元素单质都很稳定。
1 和非金属的反应
加热条件下,Zn、Cd、Hg 均可与 O2 反应,生成 MO 式 氧化物。
2 Zn + O2 —— 2 ZnO 2 Cd + O2 —— 2 CdO ( 褐色 ) 2 Hg + O2 —— 2 HgO ( 红色 )
Cu
Cl
Cl
在浓溶液中 CuCl2 是黄色的,这是由于生成 CuCl 4 2- 配离
子;稀溶液中由于水分子多,CuCl2 变为 [ Cu ( H2O )4 ] Cl 2 ,
由于水合,显蓝色。
各种配体场强不同,d-d 跃迁的能量不一样,故颜色不同。
Cu ( NH 3 ) 4 2 + 深蓝色,
Cu ( CN ) 4 2 - 无色。
二价 主要是 Cu ; Cu ( II ) 向 Cu ( I ) 转化,必须在有还 原剂的同时,有 Cu ( I ) 的络合剂或沉淀剂存在。
铜副族和锌副族

第92页,共92页。
前言
铜副族(I B):
原子核外价层电子的构型 :(n-1)d10ns1 常见氧化态:
铜 (+1,+2 ) 银 (+1)
金 (+1,+3)
第92页,共92页。
铜、银、金被称为“货币金属”。 在自然界中,铜、银、金可以以单质状态、也可以以化合态 存在。
第92页,共92页。
当生成配离子和难溶化合物时稳定性增强。
第92页,共92页。
(2) 卤化物
CuCl 、CuBr和CuI都是难溶化合物,且溶解度依次减
小。
均为白色。
都可以通过二价铜离子在相应的卤离子存在的条件下
被还原得到,如:
Cu2+ + Cu + 4 Cl -
2 [CuCl2]- (土黄色)
2 Cu2+ + 4 I-
铜储量居世界第三位。以三种形式于自然界: 自然铜:又称游离铜,很少;
硫化物矿:辉铜矿Cu2S、黄铜矿CuFeS2 等; 含氧矿物:赤铜矿Cu2O、黑铜矿CuO、
孔雀石CuCO3·Cu(OH)2、
胆矾CuSO4·5H2O等。
第92页,共92页。
银主要是以硫化物形式存在的,除了较少的闪银矿Ag2S外, 硫化银常与方铅矿共存。
第92页,共92页。
锌族元素在自然界中主要以硫化物形式存在: 锌的最主要矿物是闪锌矿ZnS、菱锌矿ZnCO3 汞的最主要矿物是辰砂(又名朱砂)HgS
硫化镉矿常以微量存在于闪锌矿中。 锌矿常与铅、铜、镉等共存,最常见的是铅锌矿。
闪锌矿
辰砂
第92页,共92页。
铅锌矿
IA ns1
IIA ns2
IB (n-1)d10ns1
第92页,共92页。
将焙烧过的矿石与沙子混合,在反射炉中加热到1273 K 左右,FeS 进一步氧化为FeO,大部分FeO与SiO2形成熔渣
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
mercury, hydrargyrum
货币金属
铜、锌分族通性
同周期,IB ~ IA,IIB ~ IIA的比较:
性质 价电子构型 次外层电子构型
Z* 原子半径r
有效离子势*
金属活泼性 化合物键型 形成配合物倾向
IB、IIB
(n-1)d10ns1~2
18e
(n-1)s2(n-1)p6(n-1)d10
铜族元素-铜
硫酸铜 CuSO4·5H2O 胆矾或蓝矾,蓝色斜方晶体。制法: Cu + 2H2SO4(浓)== CuSO4 + SO2↑+ 2H2O 2Cu + 2H2SO4(稀) + O2 == 2CuSO4 + 2H2O
375K
CuSO4·5H2O
CuSO4·3H2O 386K
CuSO4·H2O531K
CuS,黑色,不溶于水,也不溶于稀酸,但溶于热稀硝 酸,也溶于KCN溶液:
3CuS + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 3S↓ + 4H2O 2CuS + 10CN‾ = 2[Cu(CN)4]3‾ + (CN)2↑ + 2S2‾ ➢ 配合物 Cu2+为d9型,可形成配位数2、4、6的络离子 Cu(Ⅱ)络离子有变形八面体或平面正方形,变形八面体 有时也用平面正方形描述。如
铜族元素-铜
1 铜的化合物 (1) Cu(Ⅰ) 的化合物
➢ 氧化物 ----Cu2O(黄色, 红色, 深棕色), 不溶于水, 有毒 2Cu(OH)42‾ +CH2OH(CHOH)4CHO = Cu2O(红色) + 4OH‾ + CH2OH(CHOH)4COOH + 2H2O --------糖尿病的辅助诊断方法 Cu2O对热稳定,溶于稀硫酸,并立即歧化 Cu2O + H2SO4 = Cu2SO4 + H2O Cu2SO4 = CuSO4 + Cu Cu2O溶于氨水和氢卤酸,生成[Cu(NH3)2]+和[CuCl3]2Cu2O + 4NH3H2O == [Cu(NH3)2]++OH- + 3H2O
2CuCl + 2CO
➢ 硫化亚铜(Ksp=210-47) 2Cu + S =Cu2S (黑色) 2Cu2+ + 2S2O32‾+ 2H2O = Cu2S↓ + S↓ + 2SO42‾ + 4H+
铜族元素
(2) Cu(Ⅱ) 的化合物 ➢ 氧化铜和氢氧化铜
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 Cu(OH)2 == CuO + H2O CuO是碱性氧化物,高温下易被H2、C、NH3还原 3CuO + 2NH3 = 3Cu + 3H2O + N2 Cu(OH)2微显两性 Cu(OH)2 + H2SO4 = CuSO4 + 2H2O Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]
大
>
小
<
大
>
弱
<
明显共价性
>
IA、IIA ns1~2
8e (n-1)s2(n-1)p6
小 大 小 强 主要是离子键
铜、锌分族通性
(二)同周期,IB~IIB比较:
性质 价电子构型 原子半径r/pm
Z* 金属活泼性
IB (n-1)d10ns1
II B (n-1)d10ns2
Cu 127.8
<
Zn 133
硫酸铜溶液中加入KI溶液 →CuI 2Cu2+ + 4I ‾ = 2CuI↓(白色) + I2
此法可用于碘量法测定Cu 2+
铜族元素-铜
➢涂有CuI的纸条可以测定空气中汞的浓度,如果室温下3h 不变色,说明汞含量低于允许含量(0.1mgm-3) 若变为亮黄色 或暗红说明汞含量超标。
4CuI + Hg =Cu2HgI4+2Cu ➢CuCl的盐酸溶液定量吸收CO,可用此法测定CO的含量
工业上可用CuO制备氯化亚铜。 CuO + 2HCl + 2NaCl == 2NaCuCl2+2H2O NaCuCl2 == CuCl↓+ NaCl
Cu(Ⅰ)与Cu(Ⅱ)的相对稳定性还与溶剂有关。在非 水、非络合溶剂中,若溶剂的极性小可大大减弱Cu(Ⅱ) 的溶剂作用,则Cu(Ⅱ)可稳定存在。
=1.70×106
[Cu+]2
即平衡时,[Cu2+]占绝对优势
= 6.23
Cu+与Cu2+的相互转化
歧化
2Cu+
Cu2++Cu
反歧化
[Cu+]较大时,平衡向生成Cu2+方向移动,发生歧化;
[Cu+]降低到非常低时,(如生成难溶盐,稳定的配离子 等),反应将发生倒转(用反歧化表示)。
在水溶液中,要使Cu(I)的歧化朝相反方向进行,必须具 备两个条件:
第十 九章、铜锌副族
Chapter 19. The Copper Subgroup and Zinc Subgroup
周期表中的位置
ds区
❖ 铜族 ---IB Cu
copper, cuprum Ag
silver, argentum Au
gold, aurum
❖ 锌族---IIB Zn zinc Cd
Cu(II)与Cu(I) 的相互转化
4. 在酸性溶液中,简单的Cu+离子不稳定,易发生歧化反 应,产生Cu2+和Cu。
Cu2+ 0.153 Cu+ 0.521 Cu
2Cu+ == Cu + Cu2+
lgK=
n(E+-E–) 0.0592
= 1×(0.521-0.153) 0.0592
[Cu2+]
K=
铜组金属的冶炼
(1) 铜的冶炼CuFe量<5%铜矿为贫矿
b.氧化焙烧:2CuFeS2 + O2== Cu2S + 2FeS + SO2↑ 其中:2FeS + 3O2 ==2FeO + 2SO2
FeO + SiO== FeSiO3(渣) c.Cu2S转化为粗铜:2
周期 元素 价电子结构 氧化态
r
I1 升华热
四 Cu
3d104s1 +1、+2、+3 117 746 340
五 Ag
4d105s1 +1、+2、+3 134 731 285
六 Au
5d106s1 +1、+2、+3 134 890 385
铜族单质的性质
1 物理性质
色泽: 铜
银
金
紫红色 白色 黄色
硬度: Cu、Ag、Au很柔软,有极好的延展性及可塑性,Au
四羟基铜酸钠,蓝色
铜族元素-铜
➢ 卤化铜(CuX2, X=Cl、Br) 无CuI2
CuO + 2HCl = CuCl2 + H2O CuX2随阴离子变形性增大,颜色加深 CuCl2是共价化合物,易溶于水、乙醇和丙酮等,结构为 链状:
[CuCl4]2黄色
[Cu(H2O)4]2+ 蓝色
两者共存 绿色
2CuCl2·H2O == Cu(OH)2·CuCl2 + 2HCl↑ 在HCl气氛中加热CuCl2·H2O(140~150℃),生成CuCl2。 但到了500℃ 2CuCl2== 2CuCl + Cl2↑
铜族元素-铜
[Cu(NH3)2] + + 4NH3 ·H2O + 1/2O2 =2[Cu(NH3)4] 2+ + 2OH‾ + H2O
(应用于除去气体中的氧)
[Cu(NH3)2]Ac + CO + NH3 = [Cu(NH3)3]Ac·CO
醋酸二氨合铜 (Ⅰ)
减压,加热
[Cu(NH3)2]Ac + CO + NH3 用于合成氨工业的铜洗工段,用于吸收使催化剂中毒的
尤其如此。1g金可以辗压成只有230个原子厚的约1m2的薄片,拉
成直径仅20µm长达165m的金线
并且它们有优良的导电性和导热性。在所有金属中银的导电性
居第一位,铜次之。大量的铜应用于电气及冶金工业。铜易与其
它金属形成合金,铜合金,如青铜(80%Cu、15%Sn、5%Zn);
黄铜(60%Cu、40%Zn);白铜(50~70%Cu、18~20%Ni、
CO,加热后放出CO,接着循环使用。
铜族元素-铜
➢ 卤化亚铜(CuX) 除氟电负性很大,不能形成CuF外,其他CuX(Cl, Br, I)
都是白色难溶于水的化合物,溶解度依次降低。 所有的卤化亚铜都可以用还原Cu 2+的方法,还原剂如
SO2、SnCl2等: 2CuCl2+ SO2 + 2H2O = 2CuCl + H2SO4 + 2HCl Cu +Cu2+ + 2Cl- = 2CuCl CuCl + HCl= H[CuCl2] 稀释
Cu在常温下不与干燥空气中的氧化合,加热时能产生的氧化 铜。Ag、Au在加热时也不与空气中的氧化合。
潮湿空气中 2Cu + O2 + H2O + CO2 = Cu(OH)2·CuCO3
铜族元素
➢ Cu、Ag能和H2S、S反应: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O Au则不能
