2.3.6 金红石(TiO2)型
tio2非均相反应

tio2非均相反应TiO2非均相反应(heterogeneous reaction)是指反应物和催化剂处于不同的相态(固体-气体、固体-液体或固体-固体),并通过催化剂的表面吸附和反应发生。
TiO2作为一种重要的催化剂,在环境净化、能源转化和化学合成等领域具有广泛的应用。
本文将从TiO2的结构特点、催化机理以及应用领域等方面对TiO2非均相反应进行探讨。
TiO2的结构特点对其催化性能具有重要影响。
TiO2晶体结构主要有四种形式,分别为金红石型(rutile)、锐钛矿型(anatase)、水锶矿型(brookite)和钛酸钡型(TiO2(B))。
其中,rutile和anatase是最常见的两种晶相。
实验研究表明,rutile相相对anatase相具有更高的催化活性,主要原因是rutile相具有更多的活性位点和更好的晶格结构稳定性。
此外,TiO2的表面性质(如晶面的曝露度、表面缺陷等)也对催化活性起着重要作用。
TiO2非均相反应的催化机理主要涉及光催化、电催化和光电催化等过程。
在光催化系统中,TiO2的带隙能够吸收光能,产生电子-空穴对,并通过表面吸附的反应物参与催化反应。
其中,电子可以被捕获并转移给反应物,使其发生氧化反应;空穴则可以被捕获并转移给其他物质,促使还原反应的发生。
在电催化系统中,外加电压通过电子转移促进了反应物在催化剂表面的吸附和反应。
而光电催化则是光催化和电催化的结合,通过光生电子和外加电压的协同作用,提高了催化反应的效率。
TiO2非均相反应在环境净化方面具有广泛应用。
以光催化为例,TiO2可以通过吸附和光解有机污染物,将其分解为无害的物质。
此外,TiO2还可以催化氧化一氧化氮(NO)和二氧化硫(SO2)等有害气体,将其转化为硝酸盐和硫酸盐等无害物质。
在能源转化领域,TiO2非均相反应可以应用于光电池、光催化水分解和CO2还原等方面。
光电池中,TiO2作为光阳极材料,能够将光能转化为电能。
锐钛型二氧化钛和金红石型二氧化钛的区分
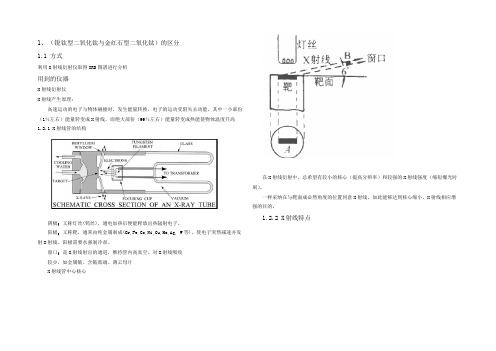
1、(锐钛型二氧化钛与金红石型二氧化钛)的区分1.1 方式利用X射线衍射仪取得XRD图谱进行分析用到的仪器X射线衍射仪X射线产生原理:高速运动的电子与物体碰撞时,发生能量转换,电子的运动受阻失去动能,其中一小部份(1%左右)能量转变成X射线,而绝大部份(99%左右)能量转变成热能使物体温度升高1.2.1 X射线管的结构阴极:又称灯丝(钨丝),通电加热后便能释放出热辐射电子。
阳极:又称靶,通常由纯金属制成(Cr,Fe,Co,Ni,Cu,Mo,Ag, W等),使电子突然减速并发射X射线。
阳极需要水强制冷却。
窗口:是X射线射出的通道,维持管内高真空,对X射线吸收较少,如金属铍、含铍玻璃、薄云母片X射线管中心核心在X射线衍射中,总希望有较小的核心(提高分辨率)和较强的X射线强度(缩短爆光时刻)。
一样采纳在与靶面成必然角度的位置同意X射线,如此能够达到核心缩小,X射线相应增强的目的。
1.2.2 X射线特点理论基础:布拉格方程用X射线衍射分析法中的粉末法来分析两种结构。
只有知足Bragg方程,才能产生衍射现象,因此用粉末法对测定的晶体样品,不改变λ,要持续改变θ。
:用单色的X射线照射多晶体试样,利用晶体的不同取向来改变θ,以知足Bragg方程。
试样要求:粉末,块状晶体。
特点:试样容易取得,衍射花腔反映晶体的全面信息。
粉末法:由于多晶体由无数取向无规的单晶组成,相当于单晶绕所有取向的轴转动,晶体内某等同晶面族{HKL}的倒易点,形成-相应倒易矢量gHKL为半径的倒易球。
一系列的倒易球与反射球相交,其交集是一系列园,那么相应的衍射线束散布于以样品为中心、入射方向为轴、上述交线园为底的园锥面上。
1.2.5 二者结构分析晶胞结构的不同金红石型二氧化钛及锐钛型二氧化钛结晶类型均为正方结晶,前者为R型,后者为A型。
金红石型二氧化钛晶格结构致密,比较稳固,光化学活性小,因此耐久性由于锐钛型二氧化钛。
另外,金红石型二氧化钛晶体结构是细长的成对的孪生晶体,每一个金红石晶胞含有2个二氧化钛分子,以两个棱相连,这比锐钛型二氧化钛八面体的形式体积更小、结构更密,因此硬度和密度增大,介电常数和导热性增加,因此耐候性好,不易粉化(a)金红石型(b)锐钛型金红石型和锐钛型晶胞中TiO2分子数别离是2和4。
TiO2的介绍

TiO2又名钛白粉,白色粉末,无毒,不溶于水、有机酸和弱无机酸,微溶于碱。
在浓硫酸以及氢氟酸长时间煮沸可完全溶解,在1800o C以上逐渐熔融。
TiO2在自然界中存在三种晶体结构:金红石型、锐钛矿型和板钛矿型,其中金红石型和锐钛矿型TiO2均具有光催化活性,尤以锐钛矿型光催化活性最佳,两种晶型结构如图1.1所示[27]。
三种晶体结构均由相同的[TiO6]八面体结构单元构成,但八面体的排列方式、连接方式和晶格畸变的程度是不同的。
其连接方式包括共边和共顶点两种情况,如图1.2所示。
锐钛矿型TiO2为四方晶系,其中每个八面体与周围8个八面体相连(4个共边,4个共顶角),4个TiO2分子组成一个晶胞。
而金红石TiO2也为四方晶系,晶格中心为Ti原子,八面体棱角上为6个氧原子,每个八面体与周围10个八面体相联(其中有两个共边,八个共顶角),两个TiO2分子组成一个晶胞,其八面体畸变程度较锐钛矿要小,对称性不如锐钛矿相,其Ti-Ti键长较锐钛矿小,而Ti-O键长较锐钛矿型大。
板钛矿型TiO2为斜方晶系,6个TiO2分子组成一个晶胞。
这三种晶型的结构参数如表1.2所示。
三种晶相以金红石相最稳定,而锐钛矿和板钛矿相在加热处理过程中会发生不可逆的放热反应,最终都将转变为金红石相。
由锐钛矿相向金红石相的相变过程是一个形核-长大的过程,即金红石相首先在锐钛矿相表面形核,随后向体相扩展。
相变过程是一个逐步实现的过程,不断地发生着键的断裂和原子重排。
锐钛矿相中的{112}面变为金红石相的{100}面,Ti、O原子发生协同重排,大部分Ti原子通过6个Ti-O键中的两个键断裂迁移到新的位置形成金红石相,故氧离子的迁移形成点阵空位可促进相变,而Ti间隙原子的形成则会抑制相变。
锐钛矿和板钛矿向金红石相变温度范围在500-700o C,而且相变温度受到颗粒尺寸、杂质等影响。
尤其是杂质和热处理气氛会导致形成不同的缺陷结构而影响到晶相转变的温度和速度。
山东省钛矿床的类型分布及其主要地质特征

山东省钛矿床的类型分布及其主要地质特征邓觉梅;尹玉静;于明光;孙斌;程伟【摘要】钛是制取钛渣、人造金红石、钛白、海绵钛、钛材、焊条涂料的重要原料,在国民经济发展中有其重要的地位和作用。
目前,山东省工业生产中主要应用的是钛铁矿和金红石。
山东省钛矿矿石主要包含超高压变质榴辉岩型金红石矿、岩浆型钛铁矿、沉积型金红石矿、变质沉积型金红石矿4种类型。
通过对山东省钛矿床地理分布、类型及其主要地质特征进行梳理,对山东省钛矿床勘查起到一定的指导作用。
%Titanium is the important raw material for preparing titanium slag,artificial rutile,titanium white,titanium sponge,titanium and electrode coating.It has important status and role in national eco-nomic development.At present,ilmenite and rutile are mainly used in industrial production in Shandong province.Titanium ore minerals in Shandong province mainly contains four types:ultrahigh pressure met-amorphic eclogite type rutile ore,titanium ore magma type,sedimentary type rutile ore and metamorphic sedimentary type rutile ore.The study ontypes,distribution and main geological characteristics of titani-um deposits can play a guiding role in titanium deposit exploration in Shandong province.【期刊名称】《山东国土资源》【年(卷),期】2016(032)003【总页数】3页(P35-37)【关键词】钛矿床;类型分布;山东【作者】邓觉梅;尹玉静;于明光;孙斌;程伟【作者单位】中化地质矿山总局山东地质勘查院,山东济南 250013;中化地质矿山总局山东地质勘查院,山东济南 250013;中化地质矿山总局山东地质勘查院,山东济南 250013;山东省地质科学研究院,山东济南 250013;山东省地质科学研究院,山东济南 250013【正文语种】中文【中图分类】P618.47钛在岩石中呈氧化物和硅酸盐矿物存在。
2.3.6 金红石(TiO2)型

材料科学基础第 2 章2.3.6 金红石(TiO2)型无机化合物晶体结构2TiO金红石晶体结构示意图离子分布Ti4+位于四方柱的结点与体心位置,O2-位于四方柱内上下底面面对角线位置上有4个,在晶胞半高的连线上有2个。
有缘学习更多驾卫星ygd3076或关注桃报:奉献教育(店铺)化学式TiO2晶体结构四方晶系,a=0.563nm四方简单格子(Ti4+一套,O2-两套),Z=2配位数Ti4+配位数:CN=6,配位八面体O2-配位数:CN=3,配位三角形TiO2晶体结构22金红石(TiO 2)的晶胞结构示意图为什么金红石(TiO 2)结构中单位晶胞分子数为2?O 2-数目上下对角线:4×1/2=2棱边半高连线:2总共:4个Ti 4+数目晶胞角顶:8×1/8=1晶胞体心:1总共:2个Ti 4+ ︰ O 2-=2 ︰ 4=1 ︰ 2化学式:TiO 2金红石(TiO 2)中离子的堆积方式金红石的结构可以近似看成O 2-做六方紧密堆积,而Ti 4+位于二分之一的八面体空隙中,使化学式为TiO 2。
2②①④③金红石晶体结构 (a )晶胞结构图,(b )(001)面上的投影图由图可见,晶胞中2个钛离子的坐标可分别用位于晶胞角顶与体心位置的钛离子来描述,分别是:2②①④③金红石晶体结构 (a )晶胞结构图,(b )(001)面上的投影图 ① ② ④ ③图中编号①~④的氧离子描述,分别是:金红石(TiO)中结构中离子的配位数2在金红石结构中,O2-的配位数为3,构成[OTi]三角形配位,3Ti4+的配位数为6,构成[TiO6]八面体配位2晶胞中心晶胞中心的钛氧八面体与角顶的钛氧八面体共角顶连接,排列方向相差90°晶胞角顶角顶的钛氧八面体以共棱方式连接,排列成沿c 轴方向延伸的钛氧八面体长链。
2金红石结构中[TiO 6]八面体及其连结方式晶胞中心晶胞中心的钛氧八面体也是共棱连接连接形成长链,与角顶的长链方向相差90°在金红石结构中O2-离子电价是否平衡?根据鲍林第二规则,在金红石结构中:常见金红石型离子晶体GeO2、SnO2、PbO2、VO2、NbO2、WO2氟化物MnF2、MgF2等2TiO2晶体结构还有板钛矿、锐钛矿两种晶型性能与用途①性能②用途光学性质:折射率高(2.76);电学性质:介电常数高光学玻璃原料金红石质电子陶瓷原料2。
水热法制备润湿性可调控的金红石型TiO2

成功制备得 到 了二氧化钛 纳米薄膜材料. 然后利 用 X射 线衍射 ( ) 扫描 电镜 ( E 、 触 角等测试手段对样品 Ⅺ 、 s M)接 进行 了分析 表征. 究结果表 明: 研 合成得 到的纳米 Ti 具有金红石型 结构 , 02 其晶粒尺寸仅为 9ln 由这种纳米微粒 i; a 形成的薄膜 呈现 出微 米一纳米复合结构形态. 经过 紫外光辐 照 , 种薄膜 材料 的表 面润湿性 由强疏水 性向超 亲水 这 性 转变, 而且这种转 变具有光控 可逆性. 关键词 : 水热反应 ; 红石 型 T02表 面润湿性 ; 金 i ; 光控转 变
得 到具有 金红 石型 结构 的纳米 二 氧化钛 粉体 及其 薄
采用 以下水热工艺制备纳米二氧化钛 : 首先 配 制用氯化钠饱和的 03mo ・ 的三氯化钛溶液 , . l I 将其 转 人 内置有 已经处 理好 的洁净玻 璃载 片 的聚 四 氟乙烯高压反应釜 中, 然后 于 10℃温度下反应 5 6 h 反应结束后取出玻璃 片并 收集得 到的粉体二氧 . 化钛 , 分别用蒸馏水和乙醇淋洗多次后 , 将得到的纳
保存.
收 稿 日期 :0 90 -0 20 -72
基金项 目: 兰州交通大学 ‘ 青蓝 ’ 人才工程基金资助计划 ( 8o A QI -3 ) 作者简介: 王玉龙 (9 5) 男 , 18 一 , 甘肃武威人 , 士生. 硕
兰
州
交
通
大
学
学
报
第 2 卷 9
1 3 薄膜 的光控 润湿 性实验 .
第2卷 9
第1 期
兰
州
交
通
大
学
学
报
Vo. 9No 1 12 .
F b 2 1 e.00
化工原料金红石型钛白粉

05 金红石型钛白粉的生产现 状及发展趋势
国内外生产现状
国内生产现状
近年来,我国金红石型钛白粉产能持续增长,已成为全球最大的生产国。国内企业数量众多,但产能集中度逐渐 提高,行业整合加速。同时,随着环保要求的提高,部分企业面临生产压力,行业整体技术水平不断提升。
03
产品升级与创新
04
为满足不断升级的市场需求,金 红石型钛白粉产品将向更高品质 、更环保的方向发展。同时,企 业将加大研发投入,推动产品创 新和技术升级,提升核心竞争力 。
国际化合作与拓展
随着全球化的深入发展,金红石 型钛白粉企业将积极参与国际竞 争与合作,拓展海外市场。通过 与国际先进企业合作,引进先进 技术和管理经验,提升我国金红 石型钛白粉的国际竞争力。
粒度分布
粒度分布是影响钛白粉性能的重要因素。一般来 说,粒度越小,比表面积越大,遮盖力和着色力 越强。因此,粒度分布均匀且平均粒径小的产品 通常质量更好。
遮盖力
遮盖力是指钛白粉在制品中遮盖底色的能力。遮 盖力强的产品可以减少用量,降低成本。一般来 说,金红石型钛白粉的遮盖力优于锐钛型钛白粉 。
选购注意事项及建议
能够抵抗多种化学物质的腐蚀,保持 自身性能的稳定。
耐候性与光稳定性
耐候性
金红石型钛白粉具有出色的耐候性,能够长期保持色泽鲜艳,不易褪色。
光稳定性
在强光和紫外线照射下,能够保持稳定的物理和化学性能,不易发生光化学反 应。
与其他颜料的比较
与锐钛型钛白粉的比较
光催化氧化技术在水处理中的应用

光催化氧化技术及其在水处理中旳应用摘要: 简介了光催化氧化旳机理及光催化氧化反应旳重要影响原因, 就TiO2固定化制备、改性、光催化氧化在工业废水以及饮用水处理中旳应用进行了论述。
关键词: 光催化氧化Ti02光催化剂水处理1 引言光催化氧化法是近二十年才出现旳水处理技术, 1972年, Fu—jishima和Honda报道了在光电池中光辐射Ti02可持续发生水旳氧化还原反应, 标志着光催化氧化水处理时代旳开始。
1976年, Carey等在光催化降解水中污染物方面进行了开拓性旳工作。
光催化技术具有反应条件温和、能耗低、操作简便、能矿化绝大多数有机物、可减少二次污染及可以用太阳光作为反应光源等突出长处[1], 在难降解有机物、水体微污染等处理中具有其他老式水处理工艺所无法比拟旳优势, 是一种极具发展前途旳水处理技术, 对太阳能旳运用和环境保护有着重大意义。
2 光催化氧化原理光催化氧化还原以n型半导体为催化剂, 如TiO2.ZnO、Fe2O3.SnO2.WO3等。
TiO2由于化学性质和光化学性质均十分稳定, 且无毒价廉, 货源充足, 因此光催化氧化还原清除污染物一般以TiO2作为光催化剂。
光催化剂氧化还原机理重要是催化剂受光照射, 吸取光能, 发生电子跃迁, 生成“电子—空穴”对, 对吸附于表面旳污染物, 直接进行氧化还原, 或氧化表面吸附旳羟基OH-, 生成强氧化性旳羟基自由基(OH)将污染物氧化[2]。
当用光照射半导体光催化剂时, 假如光子旳能量高于半导体旳禁带宽度,则半导体旳价带电子从价带跃迁到导带, 产生光致电子和空穴。
水溶液中旳OH- 、水分子及有机物均可以充当光致空穴旳俘获剂, 详细旳反应机理[3]如下(以TiO2为例):TiO2 + hν→h+ + eh++ e- →热量H2O →OH- + H+h+ + OH-→OHh+ + H2O + O2- →·OH + H+ + O2-h+ + H2O →·OH + H+e- + O2 →O2-O2- + H+ →HO2·2 HO2·→O2 + H2O2H2O2 + O2- →OH + OH- + O2H2O2 + hν→2 OHMn+(金属离子) + ne+ →M3 光催化氧化反应旳重要影响原因3.1催化剂性质及用量可用于光催化氧化旳催化剂大多是金属氧化物或硫化物等半导体材料, 如TiO2.ZnO、CeO2.CdS、ZnS等.在众多光催化剂中, Ti02是目前公认旳最有效旳半导体催化剂, 其特点有:化学性质稳定, 能有效吸取太阳光谱中弱紫外辐射部分, 氧化还原性极强, 耐酸碱和光化学腐蚀, 价廉无毒, 本文重要简介TiO2。
光催化法降解农药

食品安全已经成为世界各国科学工作者重点研究的问题。
农产品是食品安全中的突出对象,提高农药残留处理技术是食品安全领域广泛研究的热点。
光催化氧化法能耗低,能有效地将有机污染物转化为H2O、CO2、无机离子等小分子,达到完全矿化的目的,避免了对人体健康的危害。
目前国内对该技术大都还只限于实验室研究水平,且进展缓慢。
本文作者采用溶胶-凝胶法成功制备了稀土掺杂改性纳米TiO2粉体,利用XRD,UV-vis等手段对样品的结构、形貌、成分和光谱特性进行了表征。
得到的主要结论如下:以钛酸正四丁酯为原料,采用溶胶-凝胶法成功制备了稀土La3+、Ce3+单掺杂及La-Fe、Ce-Fe、La-Ce共掺杂纳米TiO2粉体。
粉体颗粒均匀,晶粒粒径在14~67nm范围内,随着热处理温度的升高,晶粒逐渐增大。
掺杂纳米TiO2粉体颗粒均匀,掺杂纳米TiO2粉体的粒径比未掺杂纳米TiO2粉体的粒径小,说明掺杂抑制了纳米晶体的生长。
稀土离子掺杂可以抑制TiO2锐钛矿相向金红石相的转变,提高相转变温度;还可以抑制纳米晶体的生长,起到细化晶粒的作用;La3+离子的抑制能力比Ce3+离子的抑制能力强。
稀土-金属共掺杂更好地抑制了TiO2从锐钛矿相向金红石相的转变。
稀土掺杂纳米TiO2的紫外-可见吸收边带位置发生红移现象。
纳米TiO2光催化剂的光催化性能在掺杂后得到明显提高,其中La3+的最佳掺杂量为0.5%,Ce3+的最佳掺杂量为1%,最佳热处理温度为500℃。
稀土-金属共掺杂纳米TiO2光催化剂产生了协同效应,其光催化性能优于单掺杂样品,以La0.5%-Fe0.5%共掺杂效果最佳。
关键词溶胶-凝胶;光催化;稀土掺杂;纳米TiO2;降解农药Food Safety has already become a serious problems in the front of scientist around the world. Among them Agricultural products is the most severe. Improving Pesticide Residues treatment is one of the hot spots in Food Safety field. Photocatalytic oxidation method has many advantages such as it has low energy consumption, can effectively degrade some organics into H2O,CO2and other small molecules, so it avoid secondary contamination. At present, this technology is limited in the laboratory level in China. In this thesis, the RE doped TiO2were prepared by sol-gel method, the structure, shape and spectrum characteristic were characterized by XRD, FE-SEM, EDS, FT-IR and UV-vis. The photocatalytic activities were evaluated by degradation of methyl orange and chloramine phosphorus. At the same time, we investigated the influence of process parameters on the fabrication of doping TiO2. Furthermore, we analyed the reaction kinetic of organics photocatalytic degradation process. The results are as follows: Using Ti(OC4H9)4 as precursor, the La3+、Ce3+ single doped and La-Fe, Ce-Fe co-doped TiO2 were prepared by sol-gel method. The particle size of the powder is homogeneous, particle size is about 10~35nm. With the annealing temperatures increasing, the particle grown. The particle size of RE doped TiO2 is smaller than pure TiO2 ,we consider that doping restrain the growth of crystal.The results show that the doping with optimum RE could restrain the crystal structure changing. RE doping has the effect of refining, and La3+ doping is better than Ca3+ doping. The co-doping with optimum RE and metal can restrain the transform of anatase structure to rutile structure and the growth of crystal more effectively. FT-IR results show that Infrared absorption bands of RE doped TiO2 has been broaden, and characteristic vibration peak of Ti-O is red-shift. UV-vis results show that the absorption sideband of La3+ doped TiO2 has red-shift and widen the spectrum absorption range.After RE doping, the photocatalytic of TiO2 has been highly improved. The optimal doping of La3+ was 0.5mol%, Ce3+ was 1mol%, and annealing temperature of 500℃. The co-doping of RE and metal show a synergistic effect for photocatalytic activity of TiO2. The co-doped TiO2 show higher photocatalytic activity in degradation of methyl orange than that of single doped TiO2. Titania co-doped with La-Fe for n(La):n(TiO2)=0.5%, n(Fe):n(TiO2)=0.05% have the highest photocatalytic efficiency.Key words Sol-gel,Photocatalysis ,RE doping ,NanoTiO2,Degradation of pesticide目录摘要 (I)Abstract (II)目录 (I)第1章绪论 (1)1.1 课题背景 (1)1.2 半导体光催化的基本原理 (1)1.2.1 TiO2的晶型及结构 (1)1.3 稀土掺杂纳米TiO2的概况 (2)1.3.2 掺杂TiO2光催化活性的影响因素 (3)1.4 本论文研究的目的、意义及内容 (5)1.4.1 研究的目的和意义 (5)1.4.2 研究内容 (5)光催化剂的制备和表征 (5)(1)稀土掺杂TiO2第2章实验过程及方案 (6)2.1 实验原料 (6)2.2实验仪器与设备 (6)2.3 工艺流程及控制因素 (6)2.3.1 工艺流程 (6)2.3.2 控制因素 (7)2.4实验方案的选择 (9)2.4.1、原料的选择 (9)2.4.2、热处理温度的选择 (10)2.4.3、降解工艺的选择 (10)2.5 分析测试方法及目的 (10)2.5.1光催化剂的表征 (10)第3章稀土掺杂纳米TiO2光催化剂的制备及表征 (12)3.1 溶胶-凝胶法制备纳米TiO2粉体 (12)3.1.1 制备原理 (12)3.1.2 制备过程 (12)3.2 纳米TiO2粉体的表征 (13)3.2.1 XRD分析 (13)3.2.5 UV-vis分析 (19)3.3 本章小结 (20)主要结论 (21)参考文献 (22)致谢 (24)第1章绪论1.1 课题背景随着人类健康意识的不断提高,人们越来越重视食品安全技术的开发与应用。
tio2(金红石)的表面催化

甲醇在Rutile (110)表面的相关研究
• 2006年Zhang等人第一次在室温下利用STM观测到了
甲醇分子在桥氧空位处的吸附解离过程,同时发现甲 醇羟基上的H原子会转移到旁边位置的桥氧原子上,剩 ang等人 还发现在沿着Ti5c列扩散的CH3OH分子帮助下,桥氧上 吸附的氢原子可以转移到其他桥氧列上。
氢原子,并且这两个氢原子 可以在桥氧链上发生移动, 如图 (B)。
• 2012年,Tan等人应用STM研究发现通过针尖向水分子施加脉冲的方式可以
使吸附在Ti5c上的H2O分子发生解离反应,如图 (A)所示,在2.4 eV的电子激发 下H2O分子的两个H原子可以逐步脱附。同时Tan还应用紫外光照射表面的 方法研究了水分子在Rutile (110)表面的光致解离行为:如图 (B)所示。
参考文献
• [1]. 徐晨彪, 小分子在二氧化钛表面的光化学动力学研究, 2014, 大连理
工大学. 第 195页.
水在Rutile (110)表面的相关研究
• 2006年,Wendt等人首次观
察到了在187 K温度下H2O 分子会在Ti5c列上进行移 动,在运动过程中如果遇到 氧空位Ov时就会在空位处 发生解离并形成OHb对,如 图 (A)。
• 2008年,Li等人发现室温下吸
附在氧空位处的水分子解离
后会形成吸附在桥氧列上的
TiO2(金红石)的表面催化
二氧化钛的结构和性质
• 二氧化钛是一种常见是N型半导体,属于多晶型的化合物,自然界中的二氧化
钛主要有三种存在形式:金红石(Rutile),板钛矿(Brookite)以及锐钛矿(Anatase), 如图所示三种矿物结构堆垛图。其中金红石型的结构最为稳定,其他两种矿 型在超过特定温度加热过程中均会发生相变转化为金红石。
金红石型纳米二氧化钛合成及晶貌控制

金红石型纳米二氧化钛合成及晶貌控制陈健美;杨舟;李伟【摘要】采用溶胶-凝胶法制备了一系列锐钛矿型、金红石型和混晶纳米TiO2,通过改变反应条件获得了具有不同形貌的金红石型样品.借助DTA-TG技术确定所得锐钛矿型向金红石型发生晶型转变的温度,在低于晶型转变的温度下焙烧系列纳米TiO2样品,对样品用XRD、TEM、IR等技术进行了表征.研究表明,缓凝剂的加入不利于金红石型TiO2的形成,钛原料浓度增大使样品中金红石型的含量增大,反应初期氨水的加入可加快体系中锐钛矿型TiO2的生成,反应时间和陈化时间的延长有利于锐钛矿向金红石型的转变.【期刊名称】《湖南有色金属》【年(卷),期】2016(032)001【总页数】5页(P53-57)【关键词】纳米二氧化钛;金红石型;制备与袁征;晶貌控制【作者】陈健美;杨舟;李伟【作者单位】湖南涉外经济学院机械工程学院,湖南长沙410205;湖南涉外经济学院机械工程学院,湖南长沙410205;湖南涉外经济学院机械工程学院,湖南长沙410205【正文语种】中文【中图分类】TF823纳米TiO2是一种理想的半导体材料,其在光电转换、光催化及化学传感等领域具有广泛应用前景[1~3]。
近年来,线、棒、管、球、泡沫和薄膜等不同形貌的纳米TiO2已被合成[4~9]。
其中,金红石型纳米TiO2由于其无毒、无味,对中长波紫外线都有良好的屏蔽作用,且吸收紫外线后不分解、不变色,具有较强的稳定性和持久性,被广泛应用于防晒化妆品、涂料、镀层、汽车漆等领域[10~13]。
目前金红石型TiO2主要由锐钛矿型经高温煅烧转化而成,但高温煅烧必然导致团聚,其粒径难以控制而影响金红石型纳米TiO2的性能。
本文采用溶胶-凝胶法,以TiCl4为原料,通过改变缓凝剂、酸度、钛原料浓度和陈化时间等措施,对金红石型纳米TiO2的晶貌影响因素及最佳合成条件进行了研究。
1.1 试剂试验中使用的试剂均为分析纯,包括:天津市科密欧化学试剂开发中心的四氯化钛(TiCl4),湖南师范大学化学试剂厂的无水乙醇(C2H5OH),湖南株洲湘氮九州化学试剂有限公司的盐酸(HCl),仙桃市第一化工厂的氨水(NH3·H2O)。
TiO2金属氧化物纳米复合结构中TiO2相变过程的研究

TiO2金属氧化物纳米复合结构中TiO2相变过程的研究二氧化钛有板钛矿、金红石和锐钛矿三种晶型。
其中金红石和锐钛型TiO2应用较广泛。
因为金红石的型晶胞比锐钛型的优点更多,所以金红石型TiO2的应用比锐钛型TiO2更为广泛。
要实现TiO2彻底的相变, 通常需要较高的加热温度和较长的加热时间。
这就导致工业生产能耗大, 成本高。
为了降低能耗, 必须寻找降低TiO2相变温度的方法。
我们使用高压静电纺丝法来制备TiO2,并用微区共焦激光Raman、X射线衍射(XRD)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)等表征方式来对TiO2来进行相变研究。
以此来找到更好的TiO2相变方法。
第一章绪论在纳米尺寸上即10-10-10-7m的范围内对自然界事物的认识和改造被称之为纳米技术。
它是直接安排和操作分子与原子来得到全新的物质。
正因为如此随着纳米技术的发展,纳米材料也逐渐增多的产生。
纳米材料也因为具有小尺寸和大比表面积等物理效应,在新世纪的研究与应用上占据了自己的一席之地。
随着现代科学技术的发展,人类对能源的需求量越来越大,而矿物燃料的开采已有日趋枯竭之时,因而对新能源的开发和利用成为中所关注的重要课题[1]。
TiO2因其可见光透过率搞、高折射率和化学稳定性好等优良特性在光催化降解有机物、染料敏化太阳能电池以及防雾自清洁等方面展现出广阔的应用前景[2-4]。
除此以外,TiO2的纳米纤维比较容易制的,所以对TiO2的研究被广泛开展。
1.1关于纳米材料1.1.1纳米材料的物理效应任意小粒子进入纳米量级即1-100nm时,其就会具有纳米材料具有的量子尺寸效应、小尺寸效应、表面效应与宏观量子隧道效应。
1)量子尺寸效应当粒子尺寸下降到某一值时,金属费米能级附近的电子能级由准连续变为离散能级的现象和纳米半导体微粒存在不连续的最高被占据分子轨道和最低未被占据的分子轨道能级,能隙变宽现象均称为量子尺寸效应。
因为量子尺寸效应,当能级间隙比热能、磁能、静电能、静磁能、光子能量大的时候那么此物质纳米材料的光、电、声、热、磁的性质会与其在宏观状态下的特性有明显的不同。
金红石二氧化钛纳米片的性质及其光催化活性

金红石二氧化钛纳米片的性质及其光催化活性赵丹丹;于彦龙;高东子;曹亚安【摘要】采用溶胶-凝胶、质子交换和层状剥离的方法,制备出金红石TiO2纳米片.利用X射线电子衍射谱(XRD)、透射电子显微镜(TEM)、紫外-可见吸收光谱(UV-Vis)、X光电子能谱(xPS)的价带谱和荧光光谱(PL)等对样品进行了表征,研究了光生载流子的转移过程.结果证明:金红石TiO2纳米片具有较大的比表面积(185.7m2/g),厚度约5 nm,与金红石TiO2样品相比,金红石TiO2纳米片的禁带宽度增加,氧化还原能力增强;此外,纳米片结构能够促使光生载流子快速转移到纳米片的表面并产生有效分离,阻止了光生电子和空穴的复合,提高了光催化反应中光生载流子的利用率.金红石纳米片的这些特性导致其具有较高的光催化活性,紫外光催化降解对氯苯酚的实验表明:金红石TiO2纳米片的光催化活性高于金红石TiO2和锐钛矿TiO2样品.【期刊名称】《无机材料学报》【年(卷),期】2016(031)001【总页数】6页(P1-6)【关键词】金红石TiO2纳米片;比表面积;能带结构;光生载流子;光催化活性【作者】赵丹丹;于彦龙;高东子;曹亚安【作者单位】南开大学物理科学学院,泰达应用物理研究院,弱光非线性光子学教育部重点实验室,天津300457;南开大学物理科学学院,泰达应用物理研究院,弱光非线性光子学教育部重点实验室,天津300457;南开大学物理科学学院,泰达应用物理研究院,弱光非线性光子学教育部重点实验室,天津300457;南开大学物理科学学院,泰达应用物理研究院,弱光非线性光子学教育部重点实验室,天津300457【正文语种】中文【中图分类】O643;O644低维结构TiO2具有维度低、化学稳定性好和氧化还原能力强等特点, 近年来被广泛应用于光催化、太阳能电池和纳米器件等领域[1-13]。
Adachi等[2]合成了锐钛矿纳米管, 并研究了其光催化活性; Quan等[6]报道了改性的锐钛矿纳米管, 具有良好的光电协同催化能力; Zhang等[7]制备了一种高度有序的锐钛矿纳米管阵列电极, 有效地提高了电极光电协同催化活性; Macak等[8]合成了金红石锐钛矿混合的纳米管, 大大提高了TiO2光催化降解有机物的性能。
酸在制备金红石型纳米TiO2中的作用

基金项目:江苏省新产品研发基金(200470) 作者简介:蒋银花(1972一),女,工学硕士,讲师,主要从事纳米材料的研究。
万方数据
第9期
蒋银花等:酸在制备金红石型纳米Tioz中的作用
万方数据
ll“一 A
JA 。一L h
R
样品B
.一 。—上.▲-I .儿土^
20
30
40
50
60
70
80
2刚。)
图1样品A和B的XRD图谱
化工新型材料
第34卷
2.2 pH的影响 样品B、C、D和E是在偏钛酸完全溶解的情况
下,水热反应的pH不同的条件下所合成的,样品的 XI①谱图如图2所示。由图2可以看出,当水热反 应的pH≤o.4时,可合成单一的金红石型Ti02;当 水热反应的pH高于o.4时,合成出金红石型和锐 钛型TiO。的混晶,其中金红石型是主要的晶型,锐 钛型Ti02的量很少。并且随pH的降低锐钛型二 氧化钛含量逐渐降低。原因是当溶液中酸性大到一 定程度时,溶液中游离的H+的量很多,从而吸附在 无定型Ti02表面的H+量大大增加,粒子间的排斥 作用非常强,在水热反应所产生的高温高压条件下, 能诱导无定的TiOz全部向更稳定的金红石型TiOz 发生转变;若酸性强度不足够大,粒子间的排斥作用 有所减弱,在水热时则会促使部分无定型Ti02向较 稳定的钛锐钛型的TiO。转变‘14]。
process were 0.4 or lower.
Key w0I‘ds metatitanic acid,rutile TiC)2,acid diss01ution,pH value
从钛酸盐制备介孔锐钛/金红石型双晶TiO2及其光催化性能

Re s u l t s i n d i c a t e d t h a t wh e n t he f u t i l e c o n t e n t wa s 2 2 . 6% ,t h e me s o po r o u s b i c r y s t a l l i n e Ti O2 a n d De g u s s a
S y n t h e s i s a n d c h a r a c t e r i z a t i o n o f me s o p o r o u s a n a t a s e / r u t i l e
Ti O2 f r o m p o t a s s i um t i t a n a t e
微 米尺 寸形貌 更容 易回收再利 用, 具有潜在的工业应用价值 。
关 键 词 :介 孔 T i O 2 ; 锐钛 ; 金红石 ; 光催化 ; 稳 定性
中图分类号 : 0 6 4 3
文献标志码 : A
第二章晶体结构与常见晶体结构类型第四讲

3.立方ZnS(闪锌矿,zincblende)型结构
闪锌矿属于立方晶系,点群3m,空间群F3m,其结构与金刚石
金 红 石 ( TiO 2)型
0.414~0.732
-方石英型
0.225~0.414
1.萤石(CaF2)型结构及反萤石型结构
立方晶系,点群m3m,空间群Fm3m,如图2-19所示。 Ca2+位于立方晶胞的顶点及面心位置,形成面心立方堆积,F-填充 在八个小立方体的体心。 Ca2+的配位数是8,形成立方配位多面体[CaF8]。F-的配位数是4, 形成[FCa4]四面体,F-占据Ca2+离子堆积形成的四面体空隙的 100%。 或F-作简单立方堆积,Ca2+占据立方体空隙的一半。
时才表现出来,故得其名。热释电晶体可以用来作红外探测器。
纤锌矿型结构的晶体,如ZnS、CdS、GaAs等和 其它II与IV族,III与V族化合物,制成半导体器件,可
以用来放大超声波。这样的半导体材料具有声电效应。
通过半导体进行声电相互转换的现象称为声电效应。
二、AX2型结构
AX2型结构主要有萤石(CaF2,fluorite)型,金红石 (TiO2,rutile)型和方石英(SiO2,-cristobalite)型结构。 其中CaF2为激光基质材料,在玻璃工业中常作为助熔剂和晶 核剂,在水泥工业中常用作矿化剂。TiO2为集成光学棱镜材 料,SiO2为光学材料和压电材料。AX2型结构中还有一种层
二氧化钛的性质

二氧化钛的性质原创邹建新等TiO2(钛白)是一种白色粉末,如图2.3。
主要物理性能如下:密度(g/cm3):金红石型4.261(0℃),4.216(25℃);锐钛型3.881(0℃),3.894(25℃);板钛型4.135(0℃),4.105(25℃)。
熔点:金红石型1842±6℃,熔化热811J/g。
沸点:金红石型2670±6℃,气化热(3762±313)J/g。
TiO2是两性化合物,是一种十分稳定的化合物,它在许多无机和有机介质中都有很好的稳定性,它不溶于水和许多其他溶剂。
TiO2不溶于水,可溶于热浓硫酸、硝酸和苛性碱中。
TiO2在自然界中存在三种同素异形态,即金红石型、锐钛型和板钛型三种。
晶型如图2.4所示。
工业上TiO2多数由偏钛酸煅烧而成:H2TiO3==TiO2+H2O工业上生产钛白的方法有:硫酸法和氯化法。
钛白的颜料性质:钛白是当今最佳白色颜料,它的光学和颜料性能都优于其他白色颜料。
A.白度。
白度表示物质对可见光吸收与反射两部分之比。
相对白度是波长和粒度的函数。
晶体结构完美的,对可见光具有很轻的吸收作用和很高的散射能力,即在可见光内晶体发生等幅散射,因而呈现白色。
TiO2的折射率高于其他物质,因此在各种白色颜料中以钛白最白。
影响白度的因素主要有钛白中杂质的种类和数量、晶型和颗粒形状、粒度和粒度分布。
图2.3 商品钛白粉图2.4 金红石型TiO2的晶型结构B.消色力。
消色力是指该颜料和另一种颜料混合后,所给予另一种颜料的消色能力。
TiO2的折射率最大,因而它在白色颜料中,消色力也最高。
消色力除与颜料的折射率有关外,还与它的粒度和粒度分布有关。
当钛白颗粒的平均直径在0.2-0.3μm 范围内,且粒度分布宽度狭窄时,对可见光蓝波段的散射能力增强,着色底相呈现柔和蓝相。
C.遮盖力。
遮盖力是指颜料能遮盖被涂物体表面底色的能力。
颜料遮盖力的大小不仅取决于它的晶型、对光的折射率和散射能力,而且还取决于对光的吸收能力。
金红石型TiO_(2)中四种点缺陷态研究

原子与分子物理学报JOURNAL OF ATOMIC AND MOLECULAR PHYSICS第38卷第1期2021年2月Vol. 38 No. 1Feb. 2021金红石型Ti。
中四种点缺陷态研究朱海霞(盐城师范学院物理与电子工程学院,盐城224051)摘 要:利用第一性原理计算方法研究了金红石型TiO 2中四种缺陷的电子态.这四种缺陷包括氧空位 (O ’)、钛空位(Ti v )、钛间隙(Ti s )以及氧空位O ’与钛间隙态Ti s 共存态.氧空位的存在导致禁带内施主缺陷能级较浅,而深施主能级与Ti 间隙态有关.预测了氧空位更倾向于与钛间隙结合,主要通过钛间隙态的3d 电子部分转移到近邻近氧空位的部分形成O v -Ti s 对缺陷.具有O ’、Ti S 或O v -Ti s 缺陷的体系都出现 间隙态,促进体系出现红外吸收.关键词:金红石型TiO 2;点缺陷;电子性质;第一性计算中图分类号:O483文献标识码:ADOI :10.19855/j.l000-0364.2021.016008Researches on four different point defects of rutile TiO 2ZHU Hai ・Xid(School of Physics and Electronic Engineering , Yancheng Teachers University , Yancheng 224051 , China)Abstract :The electronic states of four types of defects in rutile TiO are studied using the first principles calcula tions. The four types defects include oxygen vacancy ( O v) , titanium vacancy ( Ti v) , titanium interstitial(Ti s) , and the coexistence of O vand Tis ( O v- Ti s) - The existence of oxygen vacancy (v °) leads to a shallow donor defect level in the forbidden band , while a deep donor level is associated with the Ti interstitial (Ti $) - Itis predicted that an oxygen vacancy prefers to combine with a Ti $ to form a O v - Ti $ dimer by a partial 3d electronbeing transferred from the Ti $ to the neighboring O v - The system with defects of O v ,Ti $ orO ” 一 Ti $ appears gap 一 states ,which promotes the infrared absorption of the system.Key words : Rutile TiO ; Point defects ; Electronic structure ;First-principles calculations1引言TiO 2是一种重要工业材料,也是重要的半导体光催化材料-TiO 2有三种基本晶相:锐钛矿型、 板钛矿型和金红石型,而最受关注的是锐钛矿和金红石相-然而,对于光催化剂的应用,TiO 2最优化的带隙应为~2.0 ev ,才能实现大量可见光 吸收-但是实际上纯TiO 2带隙值约3- 0 ev 左右,这意味着纯TiO 2只能吸收紫外线辐射,即只吸收约4.0%的太阳能量,而在优化带隙值这一问题 上已有了大量的研究工作[1>2]-而众所周知,无论是TiO 2粉末形式还是薄膜形式,实际合成的TiO 2都具有高密度的结构缺陷,特别是在常规合成条件下产生的固有点缺陷•这些点缺陷可能会在电子带结构中引入额外的成分,对传输和光学行为产生实质性的影响[3],其中一些在实际应用 中可能是有利的-这是全面研究TiO 2缺陷状态的 动机⑷-氧化钛最容易被发现的缺陷是氧空位(Ov ),这可能导致各种物理后果-例如,锐钛矿型TiO 2 表面上的可以增强分子吸附,有利于表面化学处理⑸,有利于电荷转移到吸收的CO 2-晶格内的 O v 诱导载流子自陷态⑷-对于金红石型TiO 2,有报道称其单重态为反铁磁态,三重态为铁磁态,收稿日期:2020-06-06基金项目:国家自然科学基金(11704326)作者简介:朱海霞,女,博士,副教授,主要从事新能源材料电子结构和物性的研究.E-mail : shyzhhx13@ 163. com第38卷原子与分子物理学报第1期外吸收光谱中的一些关键特征与也二者有关⑺.有研究表明,氧空位O v可以在能隙内产生浅缺陷态,从而抑制相邻Ti离子的局部磁态⑻.此外,还揭示了的钛是红外吸收数异常的•这些乎,一方面,TiO2纳了位以外的点,方面,这些不类型的点可能存在相互作用,了TiO2材料的电子结构的复杂性⑼.鉴于存在各种点缺,这种 可能是二氧化钛在电子结构和输运行为方面难以理解的原因之一⑹.然目在一些关于TiO2的研究68"12】,但主要是探讨氧空位缺陷对TiO2材料电子构的.此,面研究各种不TiO2的电子结构的是一件非常有的工作•为了化考虑,本文具有介电常数高、‘化能的金红石相TiO2为研究对象•主要详细研究了位(O v),Ti位i (%)、Ti子(企)和。
硫酸氧钛制备二氧化钛的研究进展

硫酸氧钛制备二氧化钛的研究进展作者:贾文婷王丽莹付雅君耿子晴来源:《科技资讯》2016年第03期摘要:随着科学技术的发展,二氧化钛这种无机原料的使用越来越广泛,需求量也越来越大。
在这种情况下寻找高效制备二氧化钛的方法是刻不容缓的。
而通常情况下使用硫酸氧钛来制备二氧化钛,主要通过沉淀法、溶胶-凝胶法、水热法、机器化学方式等方法进行制备。
该文主要介绍用硫酸氧钛作为原料来制备二氧化钛的方法。
关键词:硫酸氧钛二氧化钛制备方式沉淀法中图分类号:U66 文献标识码:A 文章编号:1672-3791(2016)01(c)-0071-03Abstract:With the development of science and technology, the use of inorganic materials such as titanium dioxide is more and more widely, and the demand is also increasing. In such a situation, it is urgent to find a method to efficiently prepare titanium dioxide. Usually using titanyl sulfate to prepare titanium dioxide, mainly by precipitation method, sol-gel method,hydrothermal method, chemical methods for preparation of machine. This paper mainly introduces the method of using titanyl sulfate as raw materials to prepare titanium dioxide.Key Words:Titanium dioxide;Titanium dioxide;Preparation method;Precipitation method在日常生活中,二氧化钛因其具有多种优良的特性而被广泛应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
材料科学基础
第 2 章
2.3.6 金红石(TiO2)型无机化合物晶体结构
2
Ti
O
金红石晶体结构示意图
离子分布
Ti4+位于四方柱的结点与体心位置,O2-位于四方柱内上下底面面对角线位置上有4个,在晶胞半高的连线上有2个。
有缘学习更多驾卫星ygd3076或关注桃报:奉献教育(店铺)
化学式TiO2
晶体结构
四方晶系,a
=0.563nm
四方简单格子
(Ti4+一套,O2-两套),
Z=2
配位数
Ti4+配位数:CN=6,配位八面
体
O2-配位数:CN=3,配位三角形TiO2晶体结构
2
2金红石(TiO 2)的晶胞结构示意图
为什么金红石(TiO 2)结
构中单位晶胞分子数为2?
O 2-数目上下对角线:4×1/2=2棱边半高连线:2
总共:4个Ti 4+数目
晶胞角顶:8×1/8=1
晶胞体心:1
总共:2个Ti 4+ ︰ O 2-=2 ︰ 4=1 ︰ 2
化学式:TiO 2
金红石(TiO 2)中离子的堆积方式
金红石的结构可以近似看成O 2-做六方紧密堆积,而Ti 4+位于二分之一的八面体空隙中,使化学式为TiO 2。
2②①④③金红石晶体结构 (a )晶胞结构图,(b )(001)面上的投影图
由图可见,晶胞中2个钛离子的坐
标可分别用位于晶胞角顶与体心位
置的钛离子来描述,分别是:
2②①④③金红石晶体结构 (a )晶胞结构图,(b )(001)面上的投影图 ① ② ④ ③图中编号①~④的氧离子描述,分别是:
金红石(TiO
)中结构中离子的配位数
2
在金红石结构中,O2-的配位数为3
,
构成[OTi
]三角形配位,
3
Ti4+的配位数为6,构成[TiO6]
八面体配位
2晶胞中心
晶胞中心的钛氧八面体与角顶的钛氧八面体共角顶连接,排列方向相差90°
晶胞角顶
角顶的钛氧八面体以共棱方式连接,排列成沿c 轴方向延伸的钛氧八面体长链。
2金红石结构中[TiO 6]八面体及其连结方式
晶胞中心
晶胞中心的钛氧八面体也是共棱连接连接形成长链,与角顶的长链方向相差90°
在金红石结构中O2-离子电价是否平衡?根据鲍林第二规则,在金红石结构中:
常见金红石型离子晶体
GeO2、SnO2、PbO2、VO2、NbO2、WO2氟化物MnF
2
、MgF2等
2
TiO2晶体结构还有板钛矿、锐钛矿两种晶型
性能与用途
①性能
②用途
光学性质:折射率高(2.76);
电学性质:介电常数高
光学玻璃原料
金红石质电子陶瓷原料
2。
