[bmim][PF_6]-DMF-水三元体系的液液相平衡测定
实验四三元液液平衡数据的测定 (1)

实验四三元液-液平衡数据的测定液-液平衡数据是液-液萃取塔设计及生产操作的主要依据,平衡数据的获得目前尚依赖于实验测定。
一、实验目的(1)测定醋酸水醋酸乙烯在25℃下的液液平衡数据(2)用醋酸-水,醋酸-醋酸乙烯两对二元系的汽-液平衡数据以及醋酸-水二元系的液-液平衡数据,求得的活度系数关联式常数,并推算三元液-液平衡数据,与实验数据比较。
(3)通过实验,了解三元系液液平衡数据测定方法掌握实验技能,学会三角形相图的绘制。
二、实验原理三元液液平衡数据的测定,有两不同的方法。
一种方法是配置一定的三元混合物,在恒定温度下搅拌,充分接触,以达到两相平衡;然后静止分层,分别取出两相溶液分析其组成。
这种方法可以直接测出平衡连接线数据,但分析常有困难。
另一种方法是先用浊点法测出三元系的溶解度曲线,并确定溶解度曲线上的组成与某一物性(如折光率、密度等)的关系,然后再测定相同温度下平衡接线数据。
这时只需要根据已确定的曲线来决定两相的组成。
对于醋酸-水-醋酸乙烯这个特定的三元系,由于分析醋酸最为方便,因此采用浊点法测定溶解度曲线,并按此三元溶解度数据,对水层以醋酸及醋酸乙烯为坐标进行标绘,画成曲线,以备测定结线时应用。
然后配制一定的三元混合物,经搅拌,静止分层后,分别取出两相样品,图1 Hac-H2O-Vac的三元相图示意分析其中的醋酸含量,有溶解度曲线查出另一组分的含量,并用减量法确定第三组分的含量。
三、预习与思考(1)请指出图1溶液的总组成点在A,B,C,D,E点会出现什么现象?(2)何谓平衡联结线.有什么性质?(3)本实验通过怎样的操作达到液液平衡?(4)拟用浓度为0.1mol/L的NaOH定法测定实验系统共轭两相中醋酸组成的方法和计算式。
取样时应注意哪些事项,H2O及V Ac的组成如何得到?四、实验装置及流程(1)木制恒温箱(其结构如图2所示)的作用原理是:由电加热器加热并用风扇搅动气流,使箱内温度均匀,温度有半导体温度计测量,并由恒温控制器控制加热温度。
6三元液液平衡数据的测定60分钟

实验七三元液液平衡数据的测定一.实验目的液液平衡数据是萃取进程开发和萃取塔设计的重要依据。
液液平衡数据的取得主要依懒于实验测定。
本实验介绍了醋酸、水、醋酸乙烯酯三元体系液液平衡数据的测定与关联方式,拟达到如下目的。
二.实验原理三元液液平衡数据的测定,有直接和间接两种方式。
直接法是配制必然组成的三元混合物,在恒温下充分搅拌接触,达到两相平衡。
静置分层后,别离测定两相的溶液组成,并据此标绘平衡结线。
些法可以直接取得相平衡数据,但对分析方式要求比较高。
间接法是先用浊点测出三元体系的溶解度曲线,并肯定溶解度曲线上的各点的组成与某一可检测量的关系,然后再测定相同温度下平衡结线数据,这时只需按照溶解度曲线决定两相的组成。
本实验采用间接法测定醋酸、水、醋酸乙烯酯这个特定的三元系的液液平衡数据。
三.实验装置及流程1.实验装置:恒温箱:操作时,开启加热电器加热并用风扇搅动气流,促使箱内温度均匀。
本实验温度控制在25度左右磁搅拌2.实验仪器:分析天平,具有侧口的300ml三角磨口烧瓶及医用注射器等。
3.实验流程配制必然组成的三元混合物,在恒温下充分搅拌接触,达到两相平衡。
静置分层后,别离测定其中油、水相的溶液组成。
4.主要试剂及其物理常如表1表1四.实验步骤1.本实验所需的醋酸、水、醋酸乙烯酯三元体系如表2,实验内容主如果测定平衡结线,首先,按照相图配制一个组成位于部份互溶区的三元溶液约30ml,配制时量取各组分的体积,质量,取一干硅橡胶塞住,用分析天平称取其质量,加入醋酸、水、醋酸乙烯酯后别离称重如表3,计算出三元溶液的浓度。
锥形瓶VAC(ml)H2O(ml)HAC(ml)113107212126313153表2组分试剂瓶/g VAC/g H2O/g HAC/g173.1585.1595.95102.54272.5583.4995.37101.51369.3080.9696.4599.73表32.将此盛有部份互溶的三角瓶放入己调节到25度的恒温箱,用电磁搅拌20min,使系统达到平衡,然后,静止恒温10~15min,使其溶液分层,将烧瓶从恒温箱中小心地掏出,用针筒别离取油层及水层,别离利用酸碱中和法分析其中的醋酸含量,由溶解度曲线查出另一组成,并计算出第三组分的含量。
拟三元体系汽液平衡测定

化工实验报告实验名称 拟三元体系气液平衡测定 班级 化21 姓名 张腾 学号 2012011864 成绩 实验时间 2014.12.11 同组成员 王乙汀 张猛1、实验目的(1)观察三元体系的气液平衡实验现象;(2)掌握常压下互溶体系气液平衡数据的测定方法;(3)掌握利用有限的实验数据回归Wilson 模型参数的方法,并预测全浓度范围的气液平衡过程; (4)掌握用Herrington 面积法对该体系所测定的气液平衡数据进行热力学一致性检验的方法。
2、实验原理乙醇-水体系是一种完全互溶的正偏差非理想溶液体系,它具有最低恒沸点,是化工生产中常见的均相互溶体系料。
由于乙醇-水体系具有恒沸点,为了得到更高组成的乙醇产品,通常要采用恒沸精馏和萃取精馏。
恒沸精馏由于恒沸剂用量大、能耗高,其经济技术指标一般不如萃取精馏。
找出萃取剂的性质与乙醇-水气液平衡变化的关系,对于萃取精馏过程中的萃取剂的选择,具有重要意义。
根据平衡物系的Gibbs 自由能为最小的原则导出相平衡的条件为:“各相的温度相同,压力相等,每一组分在各相的化学势也相等”。
对于由C 个组分,P 个相构成的平衡体系,上述平衡条件可用数学式表示为:p i i i μμμβα == (i=1,2,…C )对于一般的中低压下(1500~2000kPa ),且只要压力还没有接近临界压力,通常可以假设Poynting 因子等于1,同时可以假设活度系数与压力无关,如果在常压条件下,气相可以当作理想气体处理,气液平衡的计算公式可进一步简化为:sat i i i i p x py γ=液相各组分的活度系数可根据有限的实验数据求出,由于γ和x 的关系是非线性的,故要做出γ-x 曲线需要大量的实测数据。
随着热力学在理论和实践上的不断发展,现在已经出现了很多半理论半经验的方程式来关联γ和x ,由于多元体系Wilson 方程提供了由二元体系气液平衡数据推算多元体系气液平衡数据的可能性,故本实验通过气液平衡实验测定有限个数据点,回归出Wilson 方程的配偶参数,就可以较准确地计算全浓度范围内的气液平衡数据,为工艺计算提供重要的基础数据。
实验三 甲醇-水二元体系汽液相平衡数据测定
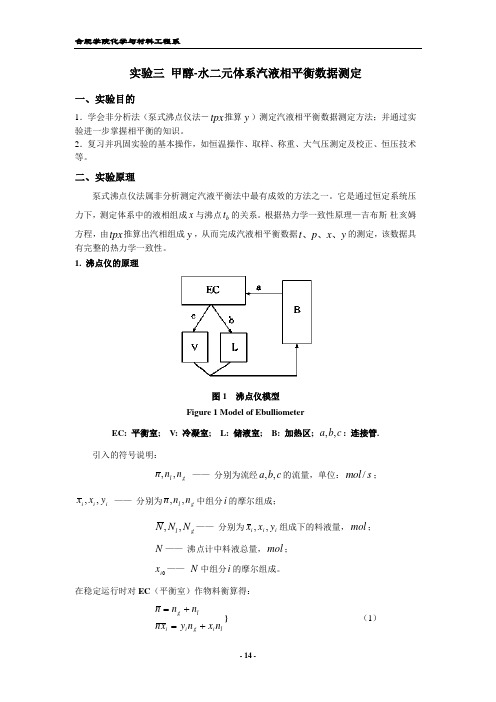
实验三 甲醇-水二元体系汽液相平衡数据测定一、实验目的1.学会非分析法(泵式沸点仪法―tpx 推算y )测定汽液相平衡数据测定方法;并通过实验进一步掌握相平衡的知识。
2.复习并巩固实验的基本操作,如恒温操作、取样、称重、大气压测定及校正、恒压技术等。
二、实验原理泵式沸点仪法属非分析测定汽液平衡法中最有成效的方法之一。
它是通过恒定系统压力下,测定体系中的液相组成x 与沸点b t 的关系。
根据热力学一致性原理—吉布斯-杜亥姆方程,由tpx 推算出汽相组成y ,从而完成汽液相平衡数据y x p t 、、、的测定,该数据具有完整的热力学一致性。
1. 沸点仪的原理图1 沸点仪模型Figure 1 Model of EbulliometerEC: 平衡室; V: 冷凝室; L: 储液室; B: 加热区; c b a ,,: 连接管.引入的符号说明:g l n n n ,, —— 分别为流经c b a ,,的流量,单位:s mol /;i i i y x x ,, —— 分别为g l n n n ,,中组分i 的摩尔组成;g l N N N ,,—— 分别为i i i y x x ,,组成下的料液量,mol ;N —— 沸点计中料液总量,mol ;0i x —— N 中组分i 的摩尔组成。
在稳定运行时对EC (平衡室)作物料衡算得:l i g i i lg n x n y x n n n n +=+=} (1)又因沸点仪可视为封闭系统,故运行前后物料总量不变,所以,li g i i i lg N x N y N x N x N N N N ++=++=0} (2)由式(1)和(2)可推得: ra r K x x x i i i i ++-=-1)1(0 (3) rr K x x x i i i i +-=-1)1( (4) 式中,i i i l g l g x y K N rN N N a n n r /,//,/=-==r :为回流比;a :为滞液量因子;i K :为组分i 的平衡常数。
多元气液相平衡过程的计算程序求解方法及其应用程序的研发

多元气液相平衡过程的计算程序求解方法及其应用程序的研发鲍玲玲;刘杰
【期刊名称】《中国石油和化工标准与质量》
【年(卷),期】2017(037)019
【摘要】本文建立了以BWRS方程为基础的多元气液的相平衡数学模型,并给出了相应的数值计算方法,过程、程序编制及其应用软件的研发,能够判断出在不同条件下多元气存在的状态,并且较精确地计算出多元气液相各组分含量、平衡常数、逸度等相平衡参数以及密度、压缩因子等物性参数.通过应用软件计算实例进行验证,表明所采用的数学模型和数值计算方法是可靠的,计算精度高,计算范围广.
【总页数】3页(P110-112)
【作者】鲍玲玲;刘杰
【作者单位】中国建筑科学研究院建研科技股份有限公司,北京 100013;中国石油天然气勘探开发公司,北京 100034
【正文语种】中文
【中图分类】O642
【相关文献】
1.混合制冷剂气液相平衡计算程序的编制与应用
2.生物质超临界水气化制氢产物多元气液相平衡
3.最小能量函数法求解多元相平衡
4.复合气液传质过程多元传质系数估算方法
5.超临界水葡萄糖制氢中的多元气液相平衡
因版权原因,仅展示原文概要,查看原文内容请购买。
三元体系的液

三元体系的液-液相平衡1.三元体系的相平衡关系都有哪几种表达方法?答:根据组分B 、S 互溶度的不同而采用不同的表达方式。
对B 、S 部分互溶体系,常用三角形相图;当B 、S 完全不互溶时,则可仿照吸收中相平衡关系式的方法。
(1)相平衡关系在三角形相图上的表示根据组分间的互溶性,三元体系可分为三种情况,即①溶质完全溶于稀释剂B 及萃取剂S 中,但B 与S 不互溶。
②溶质A 可完全溶解于组分B 及S 中,但B 于S 为一对部分互溶组分。
③组分A 、B 可完全互溶,但B 、S 及A 、S 为两对部分互溶组分。
通常,①、②两种情况在萃取中较为常见,并称之为I 类物系。
往双组分A 和B 的原料中加入适量的萃取剂S ,经过充分的接触和静置后,便得到两个平衡的液层,其组成如图8-2中的E 和R 所示,此两个液层称为共轭相。
若改变萃取剂S 的用量,则将得到新的共轭相。
将代表各平衡液层组成坐标点联合起来,便得到实验温度下的该三元物系的溶解度曲线CRPED ,若B 、S 完全不互溶,则点C 和D 分别与三角形的顶点B 及S 重合。
溶解度曲线将三角形分为两个区域,曲线以内的区域为两相区,以外的区域为均相区或单相区,萃取操作只能在两相区内进行。
连接共轭液相组成坐标的直线RE 称为联结线。
一定温度下,同一物系的联结线倾斜方向一般是一致的,各结线互不平行;也有少数物系联结线的倾斜方向会发生改变。
影响溶解度曲线形状和两相区面积大小的因素如下:在相同温度下,不同物系具有不同形状的溶解度曲线;同一物系,温度不同,两相区面积的大小将随之改变。
通常,温度升高,组分间的互溶度加大,两相区面积变小。
适当降低操作温度,对萃取分离是有利的。
图8-2 溶解度曲线和联结线 图8-3 辅助曲线与临界混溶点辅助曲线又称共轭曲线,借助它可由某一相组成求得其共轭相组成。
辅助曲线的作法如图8-3 所示,通过已知点1R 、2R 、3R 等分别作 BS 边的平行线,再通过相应联结线的另一端点E 1、E 2、3E等分别作AB 边的平行线,各线分别交于点H 、K 、J 等,联结这些点所得平滑曲线HKJL 即为辅助曲线。
复合萃取剂-磷酸-水三元体系液液相平衡研究

l 实 验
1 1 主 要 试 剂 和 仪 器 .
磷酸 ( 含量> 8 ) 有机酯 ( 5 ; 含量 >9 . ) 多元 85 ;
醇 ( 量 > 9 . ) 含 9 0 。所 有 试 剂 均 为 分 析 纯 。
性。
关 键 词 :液 液相 平 衡 ;萃取 剂 ; 酸 ; 配 系数 磷 分
中 图分 类 号 : TQ 1 . 031 文 献标 识 码 : A 文章 编 号 : 6 2 5 2 ( 0 0 0 - 0 1 - 0 17 - 4 5 2 1 )1 0 6 3
湿法磷 酸净化 技术 的研 究较 多 , 剂 萃取 法是 其 溶 中的重点 l 。选择合 适 的萃 取剂 是溶 剂萃 取法 的关 _ l q]
公式 l 对复合 萃取剂 一磷 酸一水三 元体 系相平衡数 据 _ 4 ] 进行 关联 , 并用最 小二乘法 线性 回归 。该 公式 为 :
I()A c A n o /£ )一 A n o B ∞ B + B c J A l ( ̄ / B ) c
键 。合适 的萃取剂 不仅 要 能 满 足萃 取率 的要 求 , 必 还
2 %下 复合 萃取 剂 一磷 酸 一水 三元体 系液液相平 5
衡 数据 测定结 果见 表 1 。
收 稿 日期 : 0 9 0 1 2 0 —1 ~ 9
作者简介 : 李攀 (9 4 ) 男 , 18 一 , 湖北 武 汉 人 , 士 研 究 生 , 究 方 向 : 学 工 程 与 工 艺 ; 硕 研 化 通讯 作 者 : 丁一 刚 , 授 。Emal y zagi 教 - i d gh n l@ :
实验三元液液平衡数据的测定

实验三三元液-液平衡数据的实验测定液-液平衡数据是液-液萃取塔设计及生产操作的主要依据,平衡数据的获得目前尚依赖于实验测定;在化学工业中,蒸馏、吸收过程的工艺和设备设计都需要准确的液-液平衡数据,此数据对提供最佳化的操作条件,减少能源消耗和降低成本等,都具有重要的意义;尽管有许多体系的平衡数据可以从资料中找到,但这往往是在特定温度和压力下的数据;随着科学的迅速发展,以及新产品,新工艺的开发,许多物系的平衡数据还未经前人测定过,这都需要通过实验测定以满足工程计算的需要;准确的平衡数据还是对这些模型的可靠性进行检验的重要依据;一、实验目的1测定醋酸水醋酸乙烯在25℃下的液液平衡数据2用醋酸-水,醋酸-醋酸乙烯两对二元系的汽-液平衡数据以及醋酸-水二元系的液-液平衡数据,求得的活度系数关联式常数,并推算三元液-液平衡数据,与实验数据比较;3通过实验,了解三元系液液平衡数据测定方法掌握实验技能,学会三角形相图的绘制;二、实验原理三元液液平衡数据的测定,有两不同的方法;一种方法是配置一定的三元混合物,在恒定温度下搅拌,充分接触,以达到两相平衡;然后静止分层,分别取出两相溶液分析其组成;这种方法可以直接测出平衡连接线数据,但分析常有困难;另一种方法是先用浊点法测出三元系的溶解度曲线,并确定溶解度曲线上的组成与某一物性如折光率、密度等的关系,然后再测定相同温度下平衡接线数据;这时只需要根据已确定的曲线来决定两相的组成;对于醋酸-水-醋酸乙烯这个特定的三元系,由于分析醋酸最为方便,因此采用浊点法测定溶解度曲线,并按此三元溶解度数据,对水层以醋酸及醋酸乙烯为坐标进行标绘,画成曲线,以备测定结线时应用;然后配制一定O-Vac的三元相的三元混合物,经搅拌,静止分层后,分别取出两相样品,图1Hac-H2图示意分析其中的醋酸含量,有溶解度曲线查出另一组分的含量,并用减量法确定第三组分的含量;三、实验装置1木制恒温箱其结构如图2所示的作用原理是:由电加热器加热并用风扇搅动气流,使箱内温度均匀,温度有半导体温度计测量,并由恒温控制器控制加热温度;实验前先接通电源进行加热,使温度达到25℃,并保持恒温;2实验仪器包括电光分析天平,具有侧口的100mL三角磨口烧瓶及医用注射器等实验恒温装置示意图1–导体温度计;2–恒温控制器;3–木箱;4–风扇5–电加热器;6–电磁搅拌器;7–三角烧瓶3实验用的物料包括醋酸、醋酸乙烯酯及去离子水,它们的物理常如下表:品名沸点密度醋酸118醋酸乙烯酯水100四、预习与思考1请指出图1溶液的总组成点在A,B,C,D,E点会出现什么现象2何谓平衡联结线.有什么性质3本实验通过怎样的操作达到液液平衡4拟用浓度为L的NaOH定法测定实验系统共轭两相中醋酸组成的方法和计算式;O及VAc的组成如何得到取样时应注意哪些事项,H2五、实验操作指导1、实验准备按P4页配样表制备实验溶液:用50ml的滴定管2根,按配样瓶的序号及配样表的数据,分别将水、醋酸乙烯酯加入到下口瓶中,然后用移液管移取醋酸后加入到上瓶中,盖好盖子;共配4个样让学生选择;2、实验装置的操作1插上电源;2按上装置的电源按钮,指示灯亮,电源接通;3设定装置控制温度,一般设定温度:25℃;加热至恒温;4将样品瓶放入恒温箱中,按动4个开磁力搅拌的按钮,搅拌开始;搅拌15分钟,静止15分钟;5用2个1ml的洗净干燥针筒,分别从样品瓶的上口及下支口取样;上层样取,下层样取,在分析天平上称重后,分别快速打入事先已加入约10ml水的2个锥形瓶中,将锥形瓶摇动后,分别称出两个空针筒的重量,抽样后针筒的重量与空针筒的重量差即为样品的重量;6用的标准NaOH溶液滴定,中性红或酚酞作指示剂,记录终点时所消耗的NaOH 的体积;7按公式计算出上、下层的醋酸的组成;8由下层的醋酸含量查下层HAc-Vac关系图,得到醋酸乙酯的含量从而计算出水的含量;由上层的醋酸含量查上层HAc-HO关系图,得到上层平衡样中水的含量;2从而计算出VAc的含量;10实验结束,关掉磁力搅拌器,关掉电源;3、注意事项1本实验装置只提供加热装置;2设定控制的温度应高于室温10℃以上,否则由于设备运行时的发热,影响温度的控制;3将针头插入下口瓶支口硅橡胶上时,应慢插入慢拔出;4取好上层样后应接着取下层样,以免影响溶液组成的平衡;5抽样后的针筒及空针筒的重量应及时称,否则会影响实验数据的精度;6指示剂用中性红比较好,溶液的颜色从红色变到黄色,但平衡样中醋酸的浓度较多时,指示剂变色迟缓;7针筒及针头应及时清洗;六、数据记录1、平衡标准液配制表Oml HACml 锥形瓶VACml H21 13 10 72 13 12 63 17 10 44 13 15 3配样方法:在干燥洁净的液液平衡配样瓶中,用2支滴定管安上表格中的数据分别加入水和醋酸乙烯酯,然后用10ml 的移液管加入醋酸;2、三元液液平衡标准样品组成表3、总组成点 七、数据处理包括计算过程举例1在三角形相图中,将本实验附录中给出的醋酸水醋酸乙烯三元体系中的溶解度数据作成光滑的溶解度曲线,将测得的数据标绘在图上;2将温度、溶液的HAc 、H 2O 、VAc,质量分数输入计算机,得出两相的计算值以摩尔分数表示及实验值以摩尔分数表示进行比较;具体计算方法见本实验附录; 八、实验结果与讨论1在二元汽液平衡相图上,将附录中给出的醋酸-水二元系统的汽液平衡数据作成光滑的曲线;把计算值与相应标准值进行比较,讨论误差原因;2为何液相中Hac 的浓度大于气相3若改变实验压力,汽液平衡相图将作如何变化,试用简图表明; 4用本实验装置,设计作出本系统汽液平衡相图的操作步骤;5经过实验,对预习与思考题进行补充完善; 九、主要符号说明K —平衡常数γ—活度系数;x —液相摩尔分数;ρ—密度;附录2三元液液平衡的推算若已知互溶的两对二元汽液平衡数据以及部分互溶对二元的液液平衡的数据,应用非线性型最小二乘法;可求出对二元活度系数关联式的参数;由于Wilson 方程对部分互溶体系不适用,因此关联液液平衡常用NRTL 或UNIQUAC 方程.当已计算出HAc-H 2O,HAc-VAc,VAc-H 2O 三对二元体系的NRTL 或UNIQUAC 参数后,用可用Null 法求出;在某一温度下,已知三对二元的活度系数关联式参数,并已知溶液的总组成,即可计算平衡液相的组成;另溶液的总组成为x if ,分成两液层,一层为A,组成为x iA ,另一层为B,组成为x iB ,设混合物的总量为1mol,其中液相占Mmol,液相b 占1-Mmol. 对j 组分进行物料衡算:iB iA if x M A x x )1(-+=1若将,x if 在三角坐标中标绘.则三点应在一条直线上.此直线称为共轭线. 根据液液热力平衡关系式:iA iA x γ=iB iB x γiB i iB iAiBiA x K x x =⋅=γγ2 式中iAiBi K γγ=将式2代入式1)1(1-+=i ifiB K M x x 3由于∑x iA =1及∑x iB =1 因此∑x iB =∑)1(1-+i ifK M x =1∑x iA =∑K i x iB =1 ∑x iB -∑x iA =∑)1(1-+i ifK M x -∑)1(1-+i if i K M x K =0经整理得∑)1(1)1(-+-i if i K M x K =04对三元系可展开为:iA γ是A 相组成及温度的函数,iB γ是B 相组成及温度的函数;x if 是已知数,先假定两相混合的组成;由式2可求得K 1、K 2、K 3,式4中只有M 是未知数,因此是个一元函数求零点的问题;当已知温度、总组成、关联式常数,求两相组成的x if 及x iB 的步骤如下:(1) 假定两相组成的初值可用实验值作为初值,求K i ,然后求解式4中的M 值; (2) 求得M 后,有式3得x iB ,由式2得x iA ; (3) 若满足判据1-iBiB iAiA x x γγ≤ε 则得计算结果,若不满足,则由上面求出的x iA 、x iB 求出K 3,反复迭代,直到满足判据要求;。
DMF的力场构建及乙腈-甲醇-DMF三元体系的汽液相平衡模拟

DMF的力场构建及乙腈-甲醇-DMF三元体系的汽液相平衡模拟张旗;陈文奇;曾爱武【摘要】采用量子化学和Gibbs系综Monte Carlo模拟相结合的方法,对TraPPE-UA力场中缺失的N,N-二甲基甲酰胺(DMF)力场参数进行了补充,为含DMF多元体系的汽液相平衡模拟奠定了基础。
采用新构建的力场参数,在NVT-Gibbs系综中计算了DMF的汽液相平衡性质,结果表明该力场能准确计算出DMF的饱和液相密度、蒸气压、沸点、临界值和蒸发焓。
在NPT-Gibbs系综中,采用TraPPE-UA力场分别计算了乙腈-甲醇、DMF-甲醇、DMF-乙腈二元混合物的汽液相平衡性质,并与实验值进行了比较。
模拟结果与实验值较为吻合,验证了力场模型的可靠性。
最后在NPT-Gibbs系综中采用TraPPE-UA力场对乙腈-甲醇-DMF三元体系的汽液相平衡数据进行了预测,为设计和优化乙腈和甲醇的萃取分离过程提供了基础数据。
%An extensional TraPPE-UA force field for N,N-dimethyl-formamide(DMF) was developed by combination of the quantum chemistry calculation and Gibbs ensemble Monte Carlo simulation, which lays the foundation for the simulation of vapor-liquid phase equilibrium with DMF. First of all, the vapor-liquid phase equilibrium for DMF was calculated in the NVT-Gibbs ensemble by using this new force filed. The results show that the new force field can be used to accurately calculate the saturated liquid densities, vapor pressures, normal boiling point, critical point and heats of vaporization of DMF. Secondly, the vapor-liquid equilibrium for binary mixtures of acetonitrile-methanol, DMF-methanol, DMF-acetonitrile were computed in the NPT-Gibbs ensemble by adoptingthe TraPPE-UA force field. These simulation results were in good agreement with the experimental data, which validated the reliability of this model. Finally, the vapor-liquid equilibrium data of ternary mixture of acetonitrile-methanol-DMF were predicted in the NPT-Gibbs ensemble, which can provide basic data for design and optimization of the separation process of acetonitrile and methanol.【期刊名称】《化工学报》【年(卷),期】2017(068)002【总页数】8页(P567-574)【关键词】N,N-二甲基甲酰胺;Monte Carlo模拟;TraPPE-UA力场;乙腈;甲醇;汽液平衡;统计热力学【作者】张旗;陈文奇;曾爱武【作者单位】化学工程联合国家重点实验室,天津大学化工学院,天津 300072;化学工程联合国家重点实验室,天津大学化工学院,天津 300072;化学工程联合国家重点实验室,天津大学化工学院,天津 300072【正文语种】中文【中图分类】O642.4+2乙腈和甲醇是重要的化工原料。
乳酸甲酯-二氯甲烷-水三元液液平衡数据的测定及关联

( 华东理 : 在二 氯 甲烷 溶剂 中用双氧水氧化乳 酸甲酯法是合 成丙酮酸 甲酯的重要 方法 , 合 成过程需要 r解乳 酸 甲酯一 二
氯 甲烷一 水三元液液平衡 数据。文中根据体系 的特点 , 建立了高效液相 色谱外标 法定量分析 乳酸 甲酯 的方法 , 进而
第4 1 卷 第 1 2期 2 0 1 3年 l 2月
化
学
工
程
Vo 1 . 4 No 1 2
De c 2Ol 3
CHE MI C AL EN GI NE ERI NG( C HI NA)
乳 酸 甲酯 一 二 氯 甲烷 一 水 三元 液 液 平衡 数 据 的测 定 及 关 联
DOI : 1 0. 3 9 6 9 / i . i s s n . 1 0 0 5 — 9 9 5 4. 2 0 1 3 . 1 2 . 0 1 2
Me a s u r e me n t a nd c o r r e l a t i o n o f l i q ui d- l i q ui d e q u i l i br i u m d a t a f o r me t hy l l a c t a t e . . d i c h l o r o me t h a n e . . wa t e r
Abs t r a c t: On e me t ho d o f p r e pa in r g me t h y l p y r u v a t e i s t h a t me t h y l l a c t a t e i s o x i d i z e d b y h y d r o g e n p e r o x i de u s i ng s o l v e n t o f d i c h l o r o me t h a n e, a n d t h e l i q u i d— l i q u i d e q u i l i b iu r m da t a o f me t h y l l a c t a t e — di c h l o r o me t h a n e — wa t e r a r e n e c e s s a r y t o t h i s s y n t h e s i s wa y . Ac c o r d i n g t o t h e pr o pe r t y o f t h i s e q ui l i b r i um s y s t e m ,t h e me t h o d f o r qu a n t i t a t i v e a n a l y s i s o f me t h y l l a c t a t e wa s e s t a b l i s h e d b y h i g h p e r f o r ma n c e l i q u i d c h r o ma t o g r a p h y wi t h e x t e r n a l s t a nd a r d,a n d t he e nv e l o p i n g l i n e d a t a o f me t h y l l a c t a t e — - d i c h l o r o me t ha n e — - wa t e r t e na r y r l i q u i d— - l i q u i d s y s t e m we r e d e t e r mi n e d a t
pvdf-dmf-水三元铸膜体系相图的计算

pvdf-dmf-水三元铸膜体系相图的计算
PVDF-DMF-水三元铸膜体系相图的计算是一项复杂的任务,它可以
用来探究PVDF-DMF-水三元体系的物理和化学状态。
为了得出PVDF-DMF-水三元铸膜体系相图的计算结果,首先需要确定这个系统的模型,并将一些不同的影响因素考虑在内。
其次,对PVDF-DMF-水三元体系进
行热分析测试,根据相关实验结果确定物性参数。
之后,使用基于混
合热力学理论的计算方法,估计PVDF-DMF-水三元体系的热力学性质,
并根据这些性质作出一个详细的相图。
最后,利用计算得出的相图上
各种化学反应的自由能曲线,研究三元体系的特性并对其进行优化。
因此,PVDF-DMF-水三元铸膜体系相图的计算包括模型的定义、物性参
数的测定、混合热力学理论的应用以及自由能曲线分析等多项步骤。
不同温度DMF—正庚烷—甲苯体系液—液平衡的关联

不同温度DMF—正庚烷—甲苯体系液—液平衡的关联
彭建军;段占庭
【期刊名称】《高校化学工程学报》
【年(卷),期】1990(004)004
【摘要】本文对六个温度下DMF-正庚烷-甲苯体系的液-液平衡进行了等温和非等温情况下的关联。
本文用NRTL、UNIQUAC等六种活度系数模型进行了关联,并提出一个修正的Wilson活度系数模型,修正了温度对活度系数的贡献。
本文提出的活度系数模型能够较好地同时关联不同温度下的液-液平衡。
计算误差明显小于进行温度修正后的NRTL等模型,参数也较后者为少。
【总页数】8页(P313-320)
【作者】彭建军;段占庭
【作者单位】不详;不详
【正文语种】中文
【中图分类】O642.42
【相关文献】
1.甲苯-正庚烷-(环丁砜+三甘醇)体系液-液相平衡数据的测定与关联 [J], 朱明英
2.液—液相平衡数据的测定与关联——甲苯—正庚烷—DML三元体系 [J], 高俊斌;何广湘
3.甲苯-正庚烷-(环丁砜十四甘醇)体系液-液平衡数据的测定与关联 [J], 靳广洲;高俊斌;丁福臣
4.正庚烷—甲苯—三甘醇三元体系液—液相平衡数据的测定与关联 [J], 靳广洲;高
俊斌
5.正庚烷—DMF体系液—液平衡的测定与关联 [J], 郑英峨
因版权原因,仅展示原文概要,查看原文内容请购买。
三元物系液液相平衡测定(OK)

三元物系液液相平衡测定实验装置实验指导书三元物系液液相平衡测定液液萃取是化工过程中一种重要的分离方法,它在节能上的优越性尤其显著。
液液相平衡数据是萃取过程设计及操作的主要依据。
平衡数据的获得主要依赖于实验测定。
一、实验目的本实验采用所谓浊点—物性联环合法,测定25℃下,乙醇—环已烷—水三元物系的液液平衡双结点曲线(又称溶解度曲线)和平衡结线。
通过实验要求同学们了解测定方法,熟悉实验技能。
学会三角形相图的绘制,以及分配系数K、选择性系数β的计算。
使同学们掌握该实验所依据的基本原理。
二、实验原理1、溶解度测定的原理乙醇和环已烷。
乙醇和水均为互溶体系。
但水在环已烷中溶解度很小。
在定温下,向乙醇—环已烷溶液中加入水,当水达到一定数量时,原来均匀清晰的溶液开始分裂成水相和油相二相混合物,此时体系不再是均匀的了。
当物系发生相变时,液体由清变浊。
使体系变浊所需的加水量取决于乙醇和环已烷的起始浓度和给定温度。
利用体系在相变时的浑浊和清亮现象可以测定体系中各组分之间的互溶度。
一般,液体由清变浊肉眼易于分辨。
所以本实验采用先配制乙醇—环已烷溶液,然后加入第三组分水,直到溶液出现混浊,通过逐一称量各组分来确定平衡组成即溶解度。
2、平衡结线测定的原理由相律知,定温、定压下,三元液液平衡体系的自由度f=1。
这就是说在溶解度曲线上只要确定一个特性值就能确定三元物系的性质。
通过测定在平衡时上层(油相)、下层(水相)的折光指数,并在预先测制的浓度—折光指数关系曲线上查得相应组成,便获得平衡结线。
三、实验仪器及试料1、仪器液液平衡釜、电磁搅拌器、阿贝折光仪、恒温水槽、电光分析天平,A级温度传感器、医用注射器、量筒烧杯等。
2、试剂分析纯乙醇、分析纯环已烷及去离子水。
四、操作步骤1、打开恒温水槽的电源开关、加热开关。
2、注意观察平衡釜温度计的变化,使之稳定在25℃(可调节恒温水槽的温度表)。
3、将5~6毫升环已烷倒入三角烧瓶,在天平上称重(记下重量G2),然后将环已烷倒入平衡釜,再将三角烧瓶称重(记下重量G1)。
_Bmim_BF_4_H_2O__省略_相体系液液相平衡数据的测定与关联_刘丙艳

第58卷第8期化工学报Vo l158No18 2007年8月Journal o f Chemical Industry and Eng ineering(China)A ugust2007研究简报[Bmim]BF4-H2O-Na2CO3离子液体双水相体系液液相平衡数据的测定与关联刘丙艳,刘培元,王国平,林金清(华侨大学材料科学与工程学院,福建泉州362021)关键词:离子液体;双水相;溶解度;液液相平衡;浊点-密度法中图分类号:O64214+3;T Q01311文献标识码:A文章编号:0438-1157(2007)08-1885-06Measu rement an d correlation of liquid-liqu id equilibriu m datafor ion ic liqu id-based aqueous two-phase system of[Bmim]BF4-H2O-Na2CO3LIU Bingyan,LIU Peiyu an,WAN G Guoping,LIN Jin qin g(College of M aterials S cience and Engineer ing,H uaq iao Univ ers ity,Quanz hou362021,Fuj ian,China)Abstract:The solubility curve and density curve of1-buty-l3-m ethylim idazolium tetr afluoroborate-w ater-sodium carbonate sy stem([Bmim]BF4-H2O-Na2CO3)w ere measured w ith the turbidity titratio n method at 30e under atm ospheric pr essure and w er e corr elated w ith em pirical equatio ns1T he liquid-liquid equilibrium data of the sy stem w ere measured w ith the turbidity-density method and the phase diagr am w as constructed1As show n by ex perimental results,one phase o f the aqueous two-phase system w as composed mainly of w ater and ionic liquid w her eas the so dium carbonate concentratio n w as very low,the other phase w as com po sed m ainly of w ater and sodium carbonate w hereas the io nic liquid concentration w as v ery low1T he system could be used for extraction and separation1It could also be used fo r prim ar y separ ation and reco ver y o f ionic liquids fr om aqueous so lution1Othm er-T obias and Bancroft equations w er e used fo r cor relation of the liquid-liquid equilibrium data,but the result w as not satisfactor y1T he m aximum relative er ror was about94199%,and the m ax imum averag e r elative erro r w as about15169%1A new method fo r the correlation by using Othmer-T obias and solubility equatio ns w as pr opo sed1T he m ax imum relativ e erro r w as about4152%,and the maximum aver ag e relative erro r w as about2177%1The calculated results w ere in goo d agreement w ith exper im ental data1The m ethod could be used for corr elation o f liquid-liquid equilibrium for the system w ith a low content of o ne component.Key words:io nic liquid;aqueous tw o-phase system;solubility;liquid-liquid equilibrium;turbidity-density m ethod2006-09-28收到初稿,2007-05-09收到修改稿。
实验八 三元气液平衡数据测定实验装置

实验八三元气液平衡数据测定实验装置一实验目的(1)测定醋酸–水–醋酸乙烯在25℃下的液液平衡数据;(2)用醋酸–水、醋酸–醋酸乙烯两对二元系的汽液平衡数据以及醋酸–水二元系的液液平衡数据,求得的活度系数关联式常数,并推算三元液液平衡数据,与实验数据比较;(3)通过实验,了解三元系统液–液平衡数据测定方法,掌握实验技能,学会三角形相图的绘制二实验原理及装置实验原理三元液液平衡数据的测定,有不同的方法。
一种方法是配制一定的三元混合物,在恒定温度下搅拌,充分接触,以达到两相平衡。
然后静止分层,分别取出两相溶液分析其组成,这种方法可直接测出平衡联结线数据,但分析常有困难。
另一种方法是先用浊点法测出三元系的溶解度曲线,并确定溶解度曲线上的组成与某一物性(如折光率、密度等)的关系,然后再测定相同温度下平衡结线数据,这时只需根据已确定的曲线来决定两相的组成。
对于醋酸一水一醋酸乙烯这个特定的三元系,由于分析醋酸最为方便,因此采用浊点法测定溶解度曲线,并按此三元溶解度数据,对水层以醋酸及醋酸乙烯为坐标进行标绘,对油层以醋酸及水为坐标进行标绘,画成曲线,以备测定结线时应用,然后配制一定的三元混合物,经搅拌,静止分层后,分别取出两相样品,分析其中的醋酸含量,由溶解度曲线查出另一组分的含量,并用减量法确定第三组分的含量。
HO2图8-1 HAc–HO–VAc的三元相图示意2实验装置及流程(1) 恒温箱其结构图2所示。
作用原理是:由电加热器加热并用风扇搅动气流,促使箱内温度均匀,温度由半导体温度计测量,并由恒温控制器控制加热温度。
实验前应先接通电源进行加热,使温度达到25℃,并保持恒温。
(2) 实验仪器包括电光分析天平,具有侧口的100mL 三角磨口烧瓶及医用注射器等。
图8-2 实验恒温装置示意图1–导体温度计;2–恒温控制器;3–恒温箱;4–风扇;5–电加热器;6–电磁搅拌器;7–三角烧瓶三. 实验方法(1)步骤测定平衡结线:根据相图,配制在部分互溶区的三元溶液约30g,预先计算称取各组分的质量,用密度估计其毫升数。
3—氰基吡啶—水—苯三元体系液液平衡的测定

3—氰基吡啶—水—苯三元体系液液平衡的测定
胡竞民;石秀坤
【期刊名称】《石油化工》
【年(卷),期】1992(021)001
【总页数】5页(P38-42)
【作者】胡竞民;石秀坤
【作者单位】不详;不详
【正文语种】中文
【中图分类】TQ253.2
【相关文献】
1.水—巯基乙酸—异辛醇三元体系液液平衡数据的测定与关联 [J], 徐伟;李星;尹小军;王文彬;苏佳伟;程苏琴;刘颖;林军
2.1,1,2-三氯乙烷—DMF—水三元体系液液平衡数据的测定与关联 [J], 朱晶晶;沈燕波;崔庆帅;付更涛;林军
3.丁酮-水-丙三醇三元体系液液平衡数据的测定与关联 [J], 林军;冯佳佳;顾正桂
4.水-丙烯酸-甲基异丁基甲酮三元体系液液平衡数据的测定 [J], 张雷;张宏勋;李晨
5.水-丙烯酸-甲基异丁基甲酮三元体系液液平衡数据的测定 [J], 张雷; 张宏勋; 李晨
因版权原因,仅展示原文概要,查看原文内容请购买。
二乙氧基甲烷-乙醇-水-甘油体系部分组分液液平衡

二乙氧基甲烷-乙醇-水-甘油体系部分组分液液平衡王春梅;顾正桂;李柏;王延儒【期刊名称】《化学工程》【年(卷),期】2010(38)6【摘要】用液液平衡釜测定了二乙氧基甲烷-水、二乙氧基甲烷-甘油2组二元和二乙氧基甲烷-水-甘油、二乙氧基甲烷-乙醇-甘油、二乙氧基甲烷-水-乙醇3组三元体系常温、常压下的液液平衡数据.用NRTL和UNIQUAC方程对所测二元体系的平衡数据进行了处理.采用单参数法关联了乙醇-甘油体系的模型参数.结合三元体系的液液平衡数据,用NRTL和UNIQUAC方程关联出了三元体系中的第3对模型参数.确定了二乙氧基甲烷-乙醇-水-甘油体系合适的模型及参数,为含二乙氧基甲烷体系的实际分离过程提供了依据.【总页数】5页(P67-70,94)【作者】王春梅;顾正桂;李柏;王延儒【作者单位】南京工业大学,化工学院,江苏,南京,210009;南京师范大学,南京市萃取分离工程技术研究中心,江苏,南京,210097;南京师范大学,南京市萃取分离工程技术研究中心,江苏,南京,210097;南京师范大学,南京市萃取分离工程技术研究中心,江苏,南京,210097;南京工业大学,化工学院,江苏,南京,210009【正文语种】中文【中图分类】TQ028.94【相关文献】1.二乙氧基甲烷-乙醇-丙三醇体系液液平衡研究 [J], 林军;顾正桂2.乙醇——二甲基二乙氧基硅烷二元体系等压汽液平衡研究 [J], 陈华龙;黄春芳;郭玉娣;唐芬芳;3.乙酸乙酯-乙醇-水-甘油体系中部分组分之间汽液平衡数据的测定及关联 [J], 顾正桂;姚虎卿;职慧珍;林军4.乙醇——二甲基二乙氧基硅烷二元体系等压汽液平衡研究 [J], 陈华龙;黄春芳;郭玉娣;唐芬芳5.乙醇——二甲基二乙氧基硅烷二元体系等压汽液平衡研究 [J], 陈华龙;黄春芳;郭玉娣;唐芬芳因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 uy- tyi dz l m e a u rp 0p a ( mi [F] o i l udD — 2 enr yt 一 tl meh l aoi h x n oo h sh t [ m] 6 b 3 mi u e b P )i c i i- MFH 0 t a ss m n q r y e
收稿 日期 :2 1-4l:修 订 日期 ;2 lO・l 0 10-1 0l-72 。 基金 项 目:国 家环保 部 公益性 行业科 研专 项项 F(0 90 ) l 1004。 2 1 作者简 介 :郭斌 (90) 16 -,男 .河北石 家庄 人 ,河北 科技 大学 教授 ,博士 通讯 联系 人: 郭斌 ,Emal bn 9 13c m — i :g i6@ 6 o
机溶剂来萃取水 中的 D MF ,也能有 效地消 除 V C 污染 ,同时离子液体具有几乎没有蒸气压 、热稳定性 O s
高 的特 点使得它与传统 的有机溶剂相 比更具优势 ,分离离 子液体 与 D MF只要简单蒸馏 即可 ,无 需精馏 ,
并且离子液体几 乎无损 失I,故而节 约 了能源 。尽管关于 离子液 体在萃取分离过程 中应 用的文献报道众 引
m u t clq i t es met mp rt r . d wh nt ec mp i no o u i n k e n h n e , h a o n fini i u da h a e e au e An e h o osto ft es l to e psu c a g d t e o o t i h
e ta to N. DMF 是一种性能优 良的化 工原料 ,它能与有机 溶剂及 大部 分无机溶剂化合物 相 )
混溶 ,有“ 万能溶 剂, 称 ,广泛 应用于 化工生产行业f 。 目前工业 上主要采 用直接 精馏 的方法来 回收 ’ 之 。 ,
l l fe t ntes lcii o f ce t e ec ne t f i ee c ee t t c e iin nt o tn F i moeta . h eet i o f ce t  ̄ o h vy wh h o DM s r n1 % T eslci t c e i h 0 vy i n
d c e e t h nce e o e c n e to e r a swih t e i r a ft o tn fDM F i h e n y s se a d i r a e t h n r a eo e s s h n t et r a y tm n nce r s swih t e ic e s ft h
we e d tr n d b sn n e u lb i m uoca ea 8 . o3 3.5 K d amos e i r s u e Th fe t r ee mie y u i g a q ii ru a t lv t2 3 1 t 2 1 a t 5 n ph rcp e s r . ee cs
因此本 文拟 寻求 一种合适的萃取剂来 回收废水 中的 D MF 实现节能降耗 , , 避免 资源 浪费, 提高经济效益 。 离子 液体( ) I 是指完全 由特定 的阴离子和 阳离子组成 的液体 , 在室温 或室温 附近温度下呈液体状态 L 是
的盐,也称 为低温熔 融盐【。它对许 多有机物 或无机物具有 良好 的溶解 性能 ,用离子液 体替代传统的有 7 】
多[1,但对 离子液 体 【mi [F】 MF水三元体系 的液液相平衡研究还未 见报 道。本 文在常压 下,测 83  ̄l b m] 6 D . P - 定 了 2 31- 2 . 8 .5 3 31 K下 【mi ] F卜 MF水三元体系的液液 平衡数据,研究 了 【mi [F】萃取分离 5 b m[ 6D - P b m] 6 P
S  ̄ah ag0 0 1, hn) h i u n 5 0 8 C ia z
Ab ta t I r e o o ti h ai d t o h e o ey o N- i tyf r mie ( sr c: n o d r t ban te b sc aa fr te rc v r f N, dmeh l ma d DMF r m o )fo
o [ m】 P 6 cudb pt 3 . t 8 . h nte ss rco f MFi20 %. h b m] F】 fb mi 【F】 o l eu 36 a 2 31 K w e o 2 5 h ma at no f i D . s 4 T e【mi [ 6 P
GUO n GAO a g DUAN — o g REN —i g LI Zh n we Bi , Lin , Erh n , Ai n , l U e — i
( c o l f n i n na ce c n n ie r g He e iesyo ce c dT c n lg , S h o vr me tl in ea dE gn ei , b i oE o S n Unv ri f in ea e h oo y t S n
o e o t to MFa d[mi [F】n h ra s m adtee p rtr o e e c v yc e cet fh ne s f t c n D n b m] 6i te en ys t m ea e nt l t i of i P t r ye n ht u h s e it i n o 【 m] F] eei et ae . h sl h w ta teae fw -hs el udl ude ul r m fb mi [ 6 w r v sg t T e eut so th rao op aei t q i—q i q ibi P n i d r s h t nh i i i u p aedarm dce e i h n ra ft e p r ue T e sl t i o fc n o b m】[F】 hs i a era sw t te i es o etm ea r. h ee i t cef i t f【mi P 6 g s h c e h t cvy ie
第2 6卷第 4 期
郭斌等:f m [F - MF水三元体 系的液液相平衡测定 b ] oD . mi P l
D 。但 由于 D MF MF的沸 点高,水的气化潜热大 ,当废水中 的 D MF含量较 低时,在精馏 的过程 中需要将 大量的水蒸发 出去,所 以回收工 艺能耗 大,操作很不经济【。为此 ,专 家学者对精馏设 备的节能改造作 3 】 了大量研 究,提出多效热泵精馏工 艺、 双塔或三塔精馏 工艺等 【 , 4 取得很多成果 , 但节能效果 比较有限 。
的质量 分数 为 20% 时,选 择性 系数可达 3 . ,【mi [F】用于萃取分离水中的 DMF可行 。 . 4 36 2 b m] P 关键词 :【mi [F]离子液体 :N’ 二甲基甲酰胺 :水;液液相平衡 ;萃取 b m] 6 P N.
中 图 分 类 号 :06 24 ;T 2 4. 2 Q0 8 文 献 标 识 码 :A
性 系数的影响 。实验 结果表明 ,液液平衡 相图中两相区面积随温度升 高而减小;相 同温度 下,【m m [F】的选择性 b i] P
系数随着三元体系中 DMF的含量增 加而减 小,随着离子液体用量增加而增大 :溶液组成一定时,【mi [F】的选择 b m] P
性系数随着温 度升高而减小 :当 D MF的含量大于 1% 时,温度对选择性系数影响不大 ; 8 . ,三元体系 中 D 0 23 5 1K MF
文 章编 号 : 1 0 -0 52 1)40 9 .6 039 1 (0 20 -6 80
【mi [F】 MF 水 三 元体 系 的液 液 相 平衡 测 定 b m] 6 D P 一 一
郭 斌, 高 亮, 段二 红, 任爱玲 , 刘振伟
( 河北科技 大学 环境科 学与工程学 院, 河北 石 家庄
wa tw ae y e ta to t e l u d lq i ea i a in c r e n i ud-iui ha e e ui b i m aa o e se trb xr c in, h i i -i u d d lm n to u v s a d lq i l q q d p s q l ru d t ft i h
第2 6卷第 4期 2 l 年 8月 02
高 校
化
学
工
程
学
报
NO 4 、 1 6 . ,. 02 Au . 2 2 g O1
J una fCh mia ngn eig o ie eUnv riis o r l e c lE ie rn fChn s ieste o
slcvt e c n o 【mi】 P 6d cess t ei r s o mprtr. w vrte e p r ue a e t i c f i t fb m 【F】 erae h h ce e fe ea eHo e e h m ea r s e i y oi e wi t n a t u , t t h
摘
0 0 1) 5 08
要 :为得到含 N, 二 甲基 甲酰胺( N. DMF废水中萃取回收 DMF工艺所需的基础 数据,用液液平衡釜常压 下测定 了 )
l丁基.一 - 3 甲基咪唑六氟磷酸盐( mi [F.离予液体. MFH2 [ m]P b 】 ) D . O三元体系在 2 31~ 2 . F的液液分层 曲线和液液 8 .5 3 31 K— 5 相 平衡 数据 。在此基础上 ,考察 了三元体 系中 D MF和 【mi [F】离子液体的含量 以及温度对 【mi [F】的选择 b m] 6 P b m] P
c u dp ob by b s d f rtee ta to fDM F fo a u o ss lto . o l r a l eu e o h xr c ino r m q e u o u in
Ke r s 【mi ] F】o il u ; NN・i e yfr mi ; wa r l udl ud h e q ibi y wod : b m [ 6in q i P ci d , dm t l ma d h o e t ; i i i i p a ul r m; e q -q s e i u
