组蛋白甲基转移酶活性or抑制分析试剂盒(H3K27)
EZH2在肿瘤中的研究进展

EZH2在肿瘤中的研究进展表观遗传学修饰参与基因表达的调控过程,并且与肿瘤的发生发展密切相关。
多梳抑制复合体2(polycomb repressive complex 2,PRC2)主要通过三甲基化修饰组蛋白H3第27位赖氨酸fH3K27me3)来调控靶基因的转录。
近年来,已有多项研究表明PRC2的甲基化酶亚基EZH2(果蝇zeste基因增强子的人类同源物2 enhancer of zeste homolog 2)发生过表达或突变后均可以诱发、促进肿瘤的发生和演变。
笔者就EZH2在肿瘤中的研究进展进行综述。
标签:果蝇zeste基因增强子的人类同源物2;多梳抑制复合体2;组蛋白甲基化;肿瘤目前已有研究证实,表观遗传学修饰是癌症发生、发展的重要原因之一。
生命活动过程的调控不仅仅局限于DNA序列改变,还包含DNA甲基化、组蛋白共价修饰、染色质重塑、基因沉默和RNA编辑等多种机制。
其中染色质结构的改变作为重要调节方式之一,很大程度上与DNA甲基化和组蛋白共价修饰密切相关。
它的修饰主要是通过PcG(polycomb group)蛋白抑制靶基因转录和TrxG (trithorax group)蛋白促进靶基因转录所参与完成的。
其中,PcG蛋白可以抑制多种基因的表达,并在维持胚胎干细胞的同一性和多能性上发挥重要作用。
然而,近年研究表明PcG蛋白在多种癌症中失去了这些功能,并且其过表达与癌症的发生密切相关。
果蝇zeste基因增强子的人类同源物2(enhancer of zeste homolog 2,EZH2)是多梳抑制复合物2(polycomb repressive complex 2,PRC2)的催化亚基。
作为PeG蛋白家族的成员之一,可利用其组蛋白甲基转移酶活性(histone methyltransferase,HMTase)将组蛋白H3第27位赖氨酸的三甲基化(H3K27me3),从而抑制靶基因转录,并参与调控细胞周期、细胞衰老、细胞分化等生理或病理过程。
《组蛋白H3K27me3去甲基化酶UTX在合子基因组激活中的作用机制研究》范文

《组蛋白H3K27me3去甲基化酶UTX在合子基因组激活中的作用机制研究》篇一一、引言近年来,表观遗传学作为研究生物体内遗传信息表达与调控的学科,已经成为了生物学领域研究的热点。
其中,组蛋白的修饰作用对于基因的表达和调控具有关键性影响。
而组蛋白H3K27me3作为一种重要的组蛋白修饰标记,其去甲基化过程则对基因组的激活起着决定性作用。
UTX(也称为KDM6A)作为一种组蛋白H3K27me3去甲基化酶,在合子基因组激活过程中扮演着重要角色。
本文旨在探讨UTX在合子基因组激活中的作用机制。
二、UTX的基本特性及其功能UTX是一种组蛋白H3K27me3去甲基化酶,具有特定的酶活性,能够催化H3K27me3的去甲基化过程。
在细胞内,UTX通过调控组蛋白的修饰状态,进而影响基因的表达和调控。
UTX的表达和活性受到多种因素的调控,包括转录因子、其他酶类以及细胞内的信号传导等。
三、UTX在合子基因组激活中的作用合子基因组激活是胚胎发育过程中的一个关键事件,对于胚胎的正常发育具有重要作用。
在合子基因组激活过程中,UTX通过去除H3K27me3的修饰状态,使得基因得以表达和激活。
具体而言,UTX能够与特定基因的启动子区域结合,催化H3K27me3的去甲基化过程,从而降低该区域的染色质密度,使得基因得以表达。
四、UTX的作用机制UTX的作用机制主要包括以下几个方面:首先,UTX能够与特定的DNA序列结合,这种结合是具有序列特异性的。
这种特异性结合使得UTX能够定位到特定的基因启动子区域,并发挥其去甲基化作用。
其次,UTX通过与其他酶类和蛋白质相互作用,形成一个复杂的生物分子网络。
这种相互作用能够使UTX的活性得以充分发挥,从而促进合子基因组的激活。
此外,细胞内的信号传导等因素也能够影响UTX的表达和活性,进而影响合子基因组的激活过程。
五、实验方法与结果为了深入研究UTX在合子基因组激活中的作用机制,我们采用了多种实验方法。
组蛋白h3k27me3甲基化酶

组蛋白h3k27me3甲基化酶组蛋白H3K27me3甲基化酶是一种酶,它在细胞核中负责催化组蛋白H3的赖氨酸残基上的甲基化反应,形成H3K27me3修饰。
这种酶在表观遗传调控中起着重要作用,因为H3K27me3修饰通常与基因沉默相关联。
下面我将从多个角度解释这个问题。
首先,组蛋白H3K27me3甲基化酶属于甲基转移酶家族,它主要通过将甲基基团转移给组蛋白H3的赖氨酸残基来实现对H3K27的甲基化修饰。
这种修饰通常会导致染色质的紧缩和相关基因的沉默,从而影响细胞的转录和表观遗传调控。
其次,组蛋白H3K27me3甲基化酶在干细胞的维持和分化过程中扮演重要角色。
在干细胞中,H3K27me3修饰通常会富集在转录因子基因的启动子区域,从而抑制这些基因的表达,维持干细胞的干性。
而在干细胞向特定细胞系分化的过程中,H3K27me3修饰的重分布和去除则会导致相关基因的表达变化,从而促进细胞的分化。
此外,组蛋白H3K27me3甲基化酶在许多疾病的发生和发展中也扮演着重要角色。
例如,它在多种癌症中的异常活化或者失活通常会导致相关基因的异常表达,从而促进肿瘤的发生和发展。
因此,研究组蛋白H3K27me3甲基化酶的功能和调控机制对于理解疾病发生的分子机制,并且为相关疾病的治疗提供新的靶点和策略具有重要意义。
总的来说,组蛋白H3K27me3甲基化酶作为表观遗传调控中的重要酶类,在细胞命运决定、干细胞维持和疾病发生中都扮演着重要角色。
深入理解该酶的功能和调控机制将有助于我们更好地理解细胞的表观遗传调控网络,为相关疾病的治疗和干细胞治疗提供新的思路和方法。
(完整版)组蛋白甲基化、磷酸化乙酰化检测实验

组蛋白甲基化/磷酸化/乙酰化检测实验
实验技术服务简介:
本检测包括甲基化组蛋白H3K4、甲基化组蛋白H3K9、甲基化组蛋白H3K27、组蛋白H3磷酸化(Ser10)检测、组蛋白H3磷酸化(Ser28)检测、组蛋白H3乙酰化检测、组蛋白H4乙酰化检测等。
【晶莱生物】
本方法基于特异性抗体检测组蛋白各组分,通过比色定量的方法得出各组分的含量。
实验周期:10-12个工作日内完成,重复检测优惠。
客户注意事项
1、抗体:
事先咨询晶莱生物,明确抗体种属以及是否有该抗体可使用,如无可由双方协商而定,客户自己购买提供或我公司代购;
2、标本收集与保存:
组织样品:新鲜组织放入液氮或-70度保存,组织不少于100mg(约绿豆大小);培养细胞:通过细胞计数取不少于2000000个细胞于EP管,加入0.5ml生理盐水或蛋白保护剂,混匀后保存于冰箱(-70℃,避免反复冻融);
血液细胞标本:以抗凝管保存血样或以淋巴细胞分离液分离细胞后加入0.5ml 生理盐水或蛋白保护剂,保存(-70℃可长期保存,避免反复冻融)
血清或细胞培养液标本:离心去掉杂质后取上清入EP管,保存(以上4℃可保存15-20天,-70℃可长期保存,避免反复冻融)
3、样本运输:
可选以下任何的一种方式寄送标本
组织样本、细胞样本以干冰运输或加入蛋白保护剂后加冰袋运输;
细胞样本也可以直接快件寄送培养瓶(密封保证不污染,培养液不漏出,细胞不要长得太满,50%左右,灌满培养液);
血清或上清液直接加冰袋寄送(密封保证液体不漏出,视路途远近2-3天可到达)。
《2024年H3K27me3及其去甲基化酶KDM6A-B在小鼠核移植重构胚中的作用》范文

《H3K27me3及其去甲基化酶KDM6A-B在小鼠核移植重构胚中的作用》篇一H3K27me3及其去甲基化酶KDM6A-B在小鼠核移植重构胚中的作用一、引言近年来,随着生命科学研究的深入,组蛋白修饰及其在生物体发育过程中的作用成为了研究热点。
其中,H3K27me3作为组蛋白H3第27位赖氨酸的三甲基化修饰,以及其去甲基化酶KDM6A/B在小鼠发育过程中的作用逐渐被揭示。
本文旨在探讨H3K27me3及其去甲基化酶KDM6A/B在小鼠核移植重构胚中的作用。
二、H3K27me3与KDM6A/B简介H3K27me3是一种重要的表观遗传修饰,它参与了基因表达调控、染色体稳定性维持等多个生物学过程。
而KDM6A/B作为H3K27me3的去甲基化酶,其作用是移除H3K27上的三甲基化修饰,从而影响基因的表达。
三、H3K27me3在小鼠核移植重构胚中的作用在小鼠核移植重构胚中,H3K27me3的修饰对于胚胎发育具有重要影响。
研究表明,H3K27me3的修饰程度与胚胎发育潜能密切相关,其修饰状态的改变可能影响胚胎的发育能力。
具体而言,H3K27me3的修饰参与了胚胎发育过程中的基因表达调控、细胞分化以及胚胎干细胞多能性的维持等多个关键过程。
四、KDM6A/B在小鼠核移植重构胚中的作用KDM6A/B作为H3K27me3的去甲基化酶,其作用在小鼠核移植重构胚中同样不可忽视。
研究表明,KDM6A/B的表达水平及活性与胚胎发育密切相关,其功能的正常发挥对于胚胎的正常发育至关重要。
具体来说,KDM6A/B的活性会影响H3K27me3的修饰水平,从而影响基因的表达和胚胎的发育。
五、H3K27me3与KDM6A/B的相互作用H3K27me3与KDM6A/B之间的相互作用对于胚胎发育具有重要影响。
一方面,H3K27me3的修饰状态会影响KDM6A/B的活性,进而影响其去甲基化作用;另一方面,KDM6A/B的活性也会反过来影响H3K27me3的修饰水平。
心肌纤维化的表观遗传调控进展

心肌纤维化的表观遗传调控进展李龙;杨水祥【期刊名称】《中国心血管病研究》【年(卷),期】2015(013)012【总页数】4页(P1066-1069)【关键词】心肌纤维化;表观遗传调控;miRNAs【作者】李龙;杨水祥【作者单位】100038北京市,北京大学第九临床医学院北京世纪坛医院心内科;100038北京市,北京大学第九临床医学院北京世纪坛医院心内科【正文语种】中文【中图分类】R542.2+3大多数心脏疾病都与心肌纤维化有关。
心肌纤维化即心肌瘢痕形成的过程,它的特点是成纤维细胞的积累和细胞外基质(ECM)蛋白的过度沉积,从而导致器官的结构畸形和功能改变[1]。
值得注意的是,心肌成纤维细胞表达α-平滑肌肌动蛋白(α-SMA),似乎能分泌大量细胞因子、生长因子、ECM蛋白,从而在纤维化发病中起主要作用[2]。
过量的胶原产生并沉积在心脏,导致了心肌纤维化。
心肌成纤维细胞是心肌纤维化的主要决定因素,激活的心肌成纤维细胞是ECM的主要来源。
目前认为,一些调节因素也对纤维化有实质性的影响。
心肌纤维化同时影响心肌收缩和舒张,损害心肌细胞的电耦联,是导致心力衰竭、致死性心律失常和猝死的重要病理基础。
因此,心肌纤维化的防治是治疗各种心脏疾病的重要目标。
然而现在并没有治疗心肌纤维化的有效方案,这很大程度上是因为心肌纤维化的潜在机制仍不清楚。
表观遗传学讨论的是可遗传的基因改变,这种改变不是归结于DNA序列的改变,而是由于遗传信息翻译或组装的改变所导致。
这些基因表达的改变具体是通过DNA链三级结构的变化和影响基因表达分子的改变来实现的[3]。
表观遗传学重要的改变包括DNA甲基化、组蛋白修饰和microRNA(miRNA)表达调控。
这些基因修饰导致了相同基因的不同表达,这是周围的环境改变所导致的基因增强或沉默。
最近的证据表明,TGF-β1、血管紧张素Ⅱ可能同时在固有的成纤维细胞分化中起着关键的作用。
人们已经证实很多基因与心肌纤维化有关。
ChIP-seq实践(H3K27Ac,enhancer的筛选和enhancer相关基因的GO分析)

ChIP-seq实践(H3K27Ac,enhancer的筛选和enhancer相关基因的GO分析)转自简书生信start_site在实践之前,我先查找了一下有关组蛋白修饰的知识点:(参考文章:https:///p/8aca72809c5c)组蛋白修饰能预测染色质的类型(异染色质或常染色质)、区分基因组功能元件(启动子、增强子、基因主体)以及检测决定这些元件处于活性状态或是抑制状态。
例如H3K4me2和H3K4me3修饰大多数富集在转录起始位点附近的启动子上激活基因表达,而H3K27me2和H3K27me3与基因抑制相关。
因此可通过CHIP-seq 分析组蛋白修饰的分布寻找基因的启动子区和增强子区域及其是激活或抑制基因表达。
H3K4me1可作为增强子的标志,H3K4me3作为启动子标志。
研究表明,H3K4me1和H3K4me3与基因激活相关,H3K4me3主要富集在转录起始位点附近的启动子区域,而大多数H3K4me1修饰富集在增强子区域;H3K27ac与基因激活相关,主要富集在增强子和启动子区域,当增强子区只有H3K4me1修饰富集时,该增强子处于平衡状态,而当增强子区域同时富集H3K4me1和H3K27ac修饰时,该增强子就处于激活状态促进基因表达;H3K27的甲基化是可逆的过程,H3K27me1显示出对转录具有正向影响,启动子区域的H3K27me3甲基化修饰时抑制基因的转录,而H3K27me2广泛分布并且在沉默非细胞类型特异性增强子中起作用。
下表为常见的组蛋白修饰的主要分布及功能:image异染色质是染色质的浓缩,转录无活性状态,H3K9甲基化是异染色质的标志。
H3K27me1和H3K9me3存在于着丝粒异染色质区域,而H3K27me3和H3K9me2共同存在于抑制的常染色质区域中。
H3K9ac也与H3K14ac和H3K4me3高度共存共同作为活性基因启动子的标志。
本次实践文章:Targeting super-enhancer-associated oncogenes in oesophageal squamous cell carcinoma用不同浓度的OSCC抗癌物THZ1处理两种OSCC细胞系:KYSE510和TE7。
h3k27me3组蛋白 转录

h3k27me3组蛋白转录
h3k27me3是一种特殊的组蛋白修饰,它在基因的转录调控中起着重要的作用。
在细胞核内,DNA会缠绕在组蛋白上形成染色质,而组蛋白上的修饰可以影响基因的表达。
h3k27me3是一种甲基化修饰,它可以导致染色质的紧密包裹,从而阻止基因的转录。
当h3k27me3修饰出现在某个基因上时,它会吸引一系列的蛋白质结合到该基因的启动子区域,形成一个复杂的蛋白质复合物。
这个复合物会阻止转录因子的结合,从而导致基因的沉默和抑制。
也就是说,h3k27me3的存在会使得某个基因在细胞中无法被转录和表达。
h3k27me3修饰的形成与维持是一个复杂的过程。
首先,一些特殊的酶会在染色质上添加甲基基团,将h3k27甲基化。
这些酶的活性受到多种因素的调控,包括细胞内信号传导和环境因素等。
一旦h3k27me3修饰形成,它可以通过相互作用来在染色质上形成一个稳定的修饰网络。
h3k27me3修饰不仅在基因的正常转录调控中起作用,还与一些疾病的发生和发展密切相关。
例如,在某些癌症中,h3k27me3的异常修饰会导致一些抑癌基因的失活,从而促进肿瘤的发生。
因此,h3k27me3修饰在肿瘤治疗中也被认为是一个重要的靶点。
总的来说,h3k27me3是一个重要的组蛋白修饰,它在基因的转录
调控中起着关键的作用。
它的存在可以阻止某些基因的转录和表达,从而影响细胞的功能和命运。
对于理解细胞的分化、发育和疾病的发生机制,研究h3k27me3修饰具有重要的意义。
《2024年组蛋白H3K27me3去甲基化酶UTX在合子基因组激活中的作用机制研究》范文

《组蛋白H3K27me3去甲基化酶UTX在合子基因组激活中的作用机制研究》篇一一、引言近年来,表观遗传学的研究在生物学领域引起了广泛关注。
其中,组蛋白修饰作为一种重要的表观遗传机制,在基因表达调控中发挥着关键作用。
组蛋白H3K27me3是一种常见的组蛋白修饰形式,而UTX(也称为KDM6A)作为H3K27me3的去甲基化酶,其在合子基因组激活过程中的作用机制逐渐成为研究热点。
本文将围绕这一主题,深入探讨UTX在合子基因组激活中的作用机制。
二、UTX与组蛋白H3K27me3UTX是一种特异性去甲基化酶,能够催化H3K27me3的去除。
H3K27me3是一种常见的组蛋白修饰,参与调控基因的表达和基因组的稳定性。
在细胞发育和分化过程中,H3K27me3的动态变化对于基因的表达调控至关重要。
UTX作为去甲基化酶,通过去除H3K27me3,参与调控基因的表达和基因组的激活。
三、UTX在合子基因组激活中的作用合子基因组激活是胚胎发育过程中的一个关键事件,涉及到母本和父本基因的重新激活。
在这个过程中,UTX发挥重要作用。
一方面,UTX能够去除合子中某些关键基因的H3K27me3修饰,从而促进这些基因的表达;另一方面,UTX还能通过与其他蛋白质的相互作用,参与调控基因组的整体激活。
四、UTX的作用机制UTX的作用机制主要包括以下几个方面:1. 识别与结合:UTX通过识别H3K27me3修饰的组蛋白,与其结合并催化其去甲基化。
这一过程需要UTX与其他蛋白质的相互作用。
2. 协同作用:UTX与其他蛋白质相互作用,共同参与基因的表达调控。
这些蛋白质包括染色质重塑复合物、DNA甲基化酶等。
3. 调节基因表达:通过去除H3K27me3修饰,UTX促进某些关键基因的表达,从而影响细胞的发育和分化。
此外,UTX还能通过与其他蛋白质的相互作用,影响基因的表达模式。
五、实验方法与结果为深入研究UTX在合子基因组激活中的作用机制,研究人员采用了多种实验方法。
H3K27me3及其影响因素

H3K27me3,即trimethylation of lysine 27 on histone 3,组蛋白3上的第27位赖氨酸的三甲基化,是与基因抑制密切相关的一个修饰作用,在调控基因表达以及细胞增生与分化的平衡之间起着至关重要的作用。
目前,在很多肿瘤中已经发现该修饰的改变,不论其增加或缺失都会引起致癌作用。
如图,H3K27me3的异常主要原因有:H3K27转甲基酶复合物PRC2(转甲基酶EZH2及其附属蛋白SUZ12,EED,RbAp等构成)的成分及其附属蛋白的异常,或H3K27去甲基酶UTX及JMJD3的缺失。
也有研究发现儿童胶母中存在H3K27本身的突变。
同时,在肿瘤中也有发现识别H3K27me的蛋白(PRC1)发生异常从而导致其表达异常的情况。
同时,由于蛋白修饰的交叉作用,控制H3K36me的修饰子产生突变亦会最终改变H3K27me的表达和分布。
伴有H3K27me 改变的肿瘤常有不良预后,但这一改变也为靶向治疗提供了新的突破口。
1.EZH2:过表达会导致H3K27me的下调,从而抑制肿瘤干细胞的分化,同时抑制一些抑癌基因的表达如RUNX3和CDH1,也有学者发现胶母中,EZH2会使STAT3甲基化,提高该致癌因子的活性。
弥漫大B细胞淋巴瘤中,22%发现EZH2的突变,借由突变,其使H3K27的甲基化能力大大加强,从而是生发中心细胞分化受到抑制。
2.PRC2复合物的附属蛋白:PRC2中的其他蛋白SUZ12,EED等亦会缺失或去活,编码PRC2复合物相关因子的基因ASXL1在一些肿瘤如MDS,AML中发现发生了缺失和突变,从而导致PRC2既不和H3K27结合,亦不会使其甲基化,继而使H3K27me3的下调,导致其他大量基因的异常激活。
3.H3K27me3清除者的异常:这方面的异常常常为UTX的缺失,其缺失常使H3K27me3上调,乳腺癌中,UTX的过表达常常伴随H3K27me3的下调以及癌细胞基因的整体上调。
《2024年组蛋白H3K27me3去甲基化酶UTX在合子基因组激活中的作用机制研究》范文

《组蛋白H3K27me3去甲基化酶UTX在合子基因组激活中的作用机制研究》篇一一、引言随着表观遗传学研究的深入,组蛋白修饰在基因表达调控中的作用越来越受到关注。
其中,组蛋白H3K27me3修饰作为一种重要的表观遗传标记,在胚胎发育和基因表达调控中发挥着关键作用。
UTX(ubiquitously transcribed X-linked gene)作为一种组蛋白H3K27me3去甲基化酶,在合子基因组激活过程中扮演着重要角色。
本文旨在探讨UTX在合子基因组激活中的作用机制。
二、UTX的基本特性及其功能UTX是一种组蛋白H3K27me3去甲基化酶,属于JUMONJI C(JmjC)家族。
其广泛存在于细胞中,并且在许多生物学过程中发挥关键作用,如胚胎发育、细胞分化等。
UTX的主要功能是通过移除组蛋白H3K27me3修饰来调节基因的表达,从而影响细胞的生长发育。
三、合子基因组激活概述合子基因组激活是指在受精卵发育过程中,合子基因开始表达并参与细胞分化的过程。
这一过程涉及到许多复杂的分子机制和表观遗传修饰,其中组蛋白修饰起着重要作用。
在合子基因组激活过程中,UTX发挥着不可或缺的作用。
四、UTX在合子基因组激活中的作用机制1. UTX与H3K27me3的去除UTX通过与组蛋白H3K27me3结合并催化其去甲基化,从而调节基因的表达。
在合子基因组激活过程中,UTX能够识别并去除特定基因的H3K27me3修饰,从而激活这些基因的表达。
2. UTX与其他蛋白质的相互作用UTX与其他蛋白质的相互作用也是其发挥功能的重要机制之一。
例如,UTX可以与一些DNA结合蛋白相互作用,影响其与DNA的结合和功能;还可以与其他去甲基化酶、甲基转移酶等表观遗传修饰酶相互作用,共同调节基因的表达。
3. UTX在胚胎发育中的作用UTX在胚胎发育过程中具有重要作用。
研究表明,在早期胚胎发育阶段,UTX的表达水平与胚胎的发育潜力密切相关。
EZH2作为抗肿瘤免疫治疗靶点研究进展

EZH2作为抗肿瘤免疫治疗靶点研究进展李倩;王艳林【摘要】多梳蛋白复合体(PcG)的核心亚基zeste基因增强子同源物2(Enhancer of zeste homolog2,EZH2)是一种组蛋白甲基转移酶,参与维持细胞密度、干细胞多能性、细胞周期调节等重要的生理作用。
研究发现,EZH2在多种肿瘤组织中高表达,是促进肿瘤发生和发展的致癌因子。
由于EZH2在正常组织中低表达或者不表达,使其新近被鉴定为一种肿瘤相关抗原。
已经在EZH2蛋白分子中鉴定出多条特异性抗原肽,这些抗原肽能激发机体免疫细胞对EZH2表达异常增高肿瘤细胞的杀伤活性。
上述研究提示,EZH2可能是一种新的抗肿瘤治疗分子靶点,并在肿瘤免疫治疗中具有潜在的应用价值。
就该领域的最新研究进展作一简要综述。
%EZH2(enhancer of Zeste homolog2), the core subunit of polycomb group protein complex(PcG), is a histone methyltransferase which involves in cell density maintenance, stem cell pluripotent, cell cycle regulation and other important physiological roles. The study has found that EZH2 is over-expressed in many tumor tissues and can be used as a carcinogen to promote tumorigenesis. Since EZH2 has been proved to be non- or low-expressed in normal tissues, it has recently been identified as a tumor-associated antigen. Multiple antigen peptides derived from the EZH2 protein have been identified and their ability in stimulating the killing activity of immune cells against the tumor cells with over-expressed EZH2 has been proved. These studies indicate that EZH2 could be a new molecular target for anti-tumor therapy and has potential value in tumorimmunotherapy. This paper gives a brief review on the research progress in these study fields.【期刊名称】《生物技术通报》【年(卷),期】2015(000)001【总页数】4页(P29-32)【关键词】EZH2;分子靶点;抗肿瘤免疫;肿瘤相关抗原【作者】李倩;王艳林【作者单位】三峡大学医学院三峡大学分子生物学研究所,宜昌 443002;三峡大学医学院三峡大学分子生物学研究所,宜昌 443002【正文语种】中文多梳蛋白复合体(Polycomb group protein,PcG)是参与染色质基因表观遗传负性调控重要蛋白因子,在哺乳动物中,PcG主要分为结构和功能不同的两类,即多梳蛋白抑制性复合体2(Polycomb repressive complex 2,PRC2)和多梳蛋白抑制性复合体1(Polycomb repressive complex 1,PRC1)。
H3K27三甲基化蛋白可作为MPNST的重要诊断标记物

H3K27三甲基化蛋白可作为MPNST的重要诊断标记物宋紫暄;李光明;张静;张卫民;杨吉龙;朱泽【摘要】目的:探讨组蛋白3赖氨酸27位点的三甲基化(H3K27me3)在恶性周围神经鞘瘤(MPNST)中的表达及对预后的影响.方法:收集恶性周围神经鞘瘤病理组织标本43例,经福尔马林固定,石蜡包埋后,利用组织芯片技术(TMA)制成组织芯片,免疫组织化学方法检测H3K27me3等蛋白的表达,根据临床数据和随访信息,运用SPSS 19.0统计软件进行分析比较不同H3K27me3表达水平与患者临床病理特征之间的关系.结果:MPNST组织芯片位点完整.H3K27me3表达缺失组约占65.11%,其中完全缺失组占39.53%,部分缺失组约占25.58%,即以H3K27me3表达缺失为诊断依据则MPNST的检出率可达65.11%,且与原诊断一致;在39例散发病例样本中有43.58%完全缺失、28.20%部分缺失,4例NF1相关样本100%保留表达,即在非NF1相关的MPNST中检出率可达71.78%.结论:检测H3K27me3的表达水平对MPNST的诊断具有良好的灵敏性和特异性,特别是在除外NF1相关临床背景的MPNST前期诊断中具有重要意义,有望成为早期诊断散发型MPNST的生物学标记物.【期刊名称】《天津医科大学学报》【年(卷),期】2018(024)004【总页数】4页(P353-356)【关键词】恶性周围神经鞘瘤;H3K27me3;NF1;组织芯片【作者】宋紫暄;李光明;张静;张卫民;杨吉龙;朱泽【作者单位】天津医科大学病原生物学系,天津300070;天津医科大学病原生物学系,天津300070;天津医科大学病原生物学系,天津300070;天津市第三中心医院输血科,天津300170;天津医科大学肿瘤医院骨与软组织肿瘤科,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津市恶性肿瘤临床医学研究中心,天津300060;天津医科大学病原生物学系,天津300070【正文语种】中文【中图分类】R73恶性周围神经鞘瘤(malignant peripheral nerve sheath tumor,MPNST)是一种罕见的高度恶性神经源性软组织肉瘤,约占所有肉瘤的4%[1];50%的MPNST继发于1型神经纤维瘤(NF1),约10%与患者先前的放射治疗相关[2-3];截止到目前为止,其余的40%尚没有明确的易感因素。
《2024年组蛋白H3K27me3去甲基化酶UTX在合子基因组激活中的作用机制研究》范文

《组蛋白H3K27me3去甲基化酶UTX在合子基因组激活中的作用机制研究》篇一一、引言基因组是遗传信息的储存库,它的正确激活与表达是生命活动的基石。
组蛋白H3K27me3,作为一种常见的基因转录抑制标志,它的存在可以控制特定基因的表达状态。
然而,基因的表达也受制于一种称为UTX的去甲基化酶的调控。
UTX作为一种组蛋白H3K27me3去甲基化酶,在合子基因组激活过程中起着至关重要的作用。
本文将详细探讨UTX在合子基因组激活中的作用机制。
二、UTX的基本特性与功能UTX是一种组蛋白去甲基化酶,主要作用是去除组蛋白H3K27me3标记,从而影响基因的转录活性。
它通过与染色质的相互作用,调控基因的表达状态。
其独特的酶学特性和作用方式使得它在生命过程中具有重要的功能。
三、合子基因组激活的过程及意义合子基因组激活是指在生殖细胞形成新的生命个体时,通过重编程来重新激活遗传物质,进而恢复遗传信息的正确表达状态。
这一过程对生命的发育和成长至关重要。
四、UTX在合子基因组激活中的作用机制UTX在合子基因组激活过程中起着关键作用,其作用机制主要体现在以下几个方面:1. 去除H3K27me3标记:UTX通过其去甲基化酶的功能,识别并结合组蛋白H3K27me3标记,然后进行去甲基化操作。
这能够影响染色体结构的重塑,使得被抑制的基因能够得以表达。
2. 参与染色体构象改变:UTX通过与其他蛋白相互作用,影响染色质的可塑性。
在合子基因组激活过程中,这有助于调节基因表达的时空特异性。
3. 协调与其他调节因子的关系:UTX可以与许多转录因子和其他调控蛋白相互作用,这些调控蛋白同样参与合子基因组激活的进程。
这种协同作用有利于调节基准确切的开启和关闭时机。
五、研究进展及挑战尽管关于UTX在合子基因组激活中的作用已经有所了解,但仍有许多未知之处需要探索。
如我们对于UTX的酶活性的具体调控机制,以及它在与各种调控因子的协同作用中的角色仍需进一步研究。
H3K27me3及其影响因素
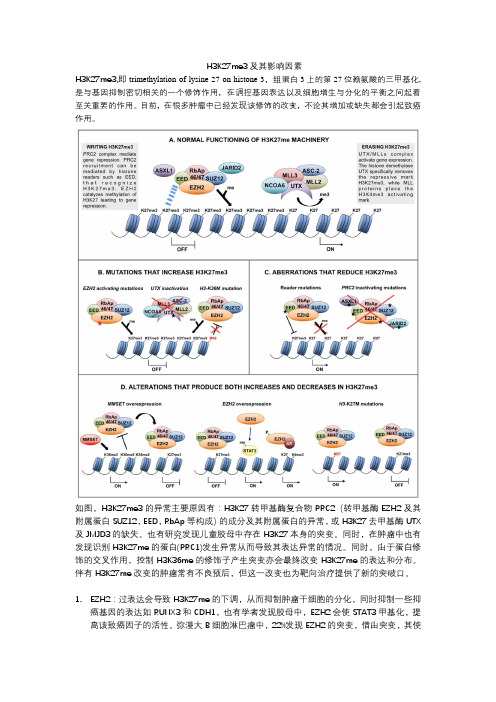
2.PRC2复合物的附属蛋白:PRC2中的其他蛋白SUZ12,EED等亦会缺失或去活,编码PRC2复合物相关因子的基因ASXL1在一些肿瘤如MDS,AML中发现发生了缺失和突变,从而导致PRC2既不和H3K27结合,亦不会使其甲基化,继而使H3K27me3的下调,导致其他大量基因的异常激活。
3.H3K27me3清除者的异常:这方面的异常常常为UTX的缺失,其缺失常使H3K27me3上调,乳腺癌中,UTX的过表达常常伴随H3K27me3的下调以及癌细胞基因的整体上调。
如图,H3K27me3的异常主要原因有:H3K27转甲基酶复合物PRC2(转甲基酶EZH2及其附属蛋白SUZ12,EED,RbAp等构成)的成分及其附属蛋白的异常,或H3K27去甲基酶UTX及JMJD3的缺失。也有研究发现儿童胶母中存在H3K27本身的突变。同时,在肿瘤中也有发现识别H3K27me的蛋白(PRC1)发生异常从而导致其表达异常的情况。同时,由于蛋白修饰的交叉作用,控制H3K36me的修饰子产生突变亦会最终改变H3K27me的表达和分布。伴有H3K27me改变的肿瘤常有不良预后,但这一改变也为靶向治疗提供了新的突破口。
rbap等构也有研究发27me3及其onhistone3在调控基因表发现该修饰的h3k27转甲成的成分及发现儿童胶母其影响因素组蛋白3上表达以及细胞增的改变不论其甲基酶复合物及其附属蛋白中存在h3k上的第27位赖增生与分化的其增加或缺失物prc2转白的异常或27本身的突赖氨酸的三甲基的平衡之间起失都会引起致转甲基酶ezh或h3k27去突变
Anti-HistoneH3(trimethylK27)antibody:抗组蛋白H3(三甲..

47 Abrev119 ReferencesReacts with: Mouse, Rat, Cow, Human, Arabidopsis thaliana, Fruit fly (Drosophila melanogaster), Plants,Zebrafish, Rhesus monkey, RicePredicted to work with: Rabbit, Chicken, X enopus laev is, Chinese HamsterUse at an assay dependent concentration.Use at an assay dependent dilution.Use 5-10 µg for 25 µg of chromatin.Use at an assay dependent dilution.Use at an assay dependent dilution.Use a concentration of 1 - 5 µg/ml. Detects a band of approximately 17 kDa (predicted molecular weight: 15 kDa).Can be blocked withsignal is very weak with milk blocking.Use at an assay dependent dilution.Use a concentration of 5 µg/ml.ChIP - Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002)Chromatin was prepared from Hela cells according to the A bcam X-ChIP protocol. Cells were fixed with formaldehyde for 10min. The ChIP was performed with 25µg of chromatin, 5µg of ab6002 (blue), and 20µl of Protein A/G sepharose beads. No antibody was added to the beads control (yellow). The immunoprecipitated DNA was quantified by real time PCR (T aqman approach for active and inactive loci, Sybr green approach for heterochromatic loci). Primers and probes are located in the first kb of the transcribed region.Western blot - A nti-Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002)All lanes : A nti-Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002) at 1 µg/mlLane 1 : Calf Thymus Histone Preparation Nuclear Lysate Lane 2 : Calf Thymus Histone Preparation Nuclear Lysate with Human Histone H3 peptide (ab17163) at 0.5 µg/ml Lane 3 : Calf Thymus Histone Preparation Nuclear Lysate with Human Histone H3 (mono methyl K4) peptide(ab1340) at 0.5 µg/mlLane 4 : Calf Thymus Histone Preparation Nuclear Lysate with Histone H3 (di methyl K4) peptide (ab7768) at 0.5µg/mlLane 5 : Calf Thymus Histone Preparation Nuclear Lysate with Human Histone H3 (tri methyl K4) peptide (ab1342) at 0.5 µg/mlLane 6 : Calf Thymus Histone Preparation Nuclear Lysate with Human Histone H3 (mono methyl K9) peptide(ab1771) at 0.5 µg/mlLane 7 : Calf Thymus Histone Preparation Nuclear Lysate with Human Histone H3 (di methyl K9) peptide (ab1772) at 0.5 µg/mlLane 8 : Calf Thymus Histone Preparation Nuclear Lysate with Human Histone H3 (tri methyl K9) peptide (ab1773) at 0.5 µg/mlLane 9 : Calf Thymus Histone Preparation Nuclear Lysate with Histone H3 (mono methyl K27) peptide (ab1780) at 0.5 µg/mlLane 10 : Calf Thymus Histone Preparation Nuclear Lysate with Human Histone H3 (di methyl K27) peptide (ab1781) at 0.5 µg/mlLane 11 : Calf Thymus Histone Preparation Nuclear Lysate with Human Histone H3 (tri methyl K27) peptide (ab1782) at 0.5 µg/mlLysates/proteins at 0.25 µg per lane.SecondaryGoat A nti-M ouse IgG H&L (HRP) preadsorbed (ab97040) at 1/50000 dilutiondeveloped using the ECL techniquePerformed under reducing conditions.Predicted band size : 15 kDaObserved band size : 17 kDaE xposure time : 3 minutesThis blot was produced using a 4-12% Bis-tris gel under the M ES buffer system. The gel was run at 200V for 35 minutes before being transferred onto a Nitrocellulose membrane at 30V for 70 minutes. The membrane was then blocked for an hour using 3% milk before being incubated with ab6002 overnight at 4°C. A ntibody binding was detected using an anti-mouse antibody conjugated to HRP, and visualised using ECL development solutionab133406.Western blot - A nti-Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002)Lanes 1 - 3 : A nti-Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002) at 1 µg/ml (2% BSA)Lanes 4 - 6 : A nti-Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002) at 1 µg/ml (3%M ILK)Lane 1 : HeLa (Human epithelial carcinoma cell line) Nuclear LysateLane 2 : EED-/- mouse ES Whole Cell LysateLane 3 : WT mouse ES Whole Cell LysateLane 4 : HeLa (Human epithelial carcinoma cell line) Nuclear LysateLane 5 : EED-/- mouse ES Whole Cell LysateLane 6 : WT mouse ES Whole Cell LysateLysates/proteins at 10 µg per lane.SecondaryGoat A nti-M ouse IgG H&L (HRP) preadsorbed (ab97040) at 1/50000 dilutiondeveloped using the ECL techniquePerformed under reducing conditions.Predicted band size : 15 kDaObserved band size : 17 kDaE xposure time : 12 minutesThis blot was produced using a 4-12% Bis-tris gel under the M ES buffer system. The gel was run at 200V for 35 minutes before being transferred onto a Nitrocellulose membrane at 30V for 70 minutes. The membrane was then blocked for an hour using 2% Bovine Serum A lbumin (lanes 1-3) and 3% milk (lanes 4-6) before being incubated with ab6002 overnight at 4°C. A ntibody binding was detected using an anti-mouse antibody conjugated to HRP, and visualised using ECL development solutionab133406.ELISA - A nti-Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002)A ll batches of ab6002 are tested in ELISA against peptides to different Histone H3 modifications. Results show strong binding to Histone H3 - tri methyl K27 immunising peptide (ab1782), indicating that this antibody specifically recognises the Histone H3 - tri methyl K27 modification. Weak binding is also detected against the Histone H3 - di methyl K27 modification (<12%) (ab1781).ab17163 - Histone H3 - unmodifiedab1340 - Histone H3 - mono methyl K4ab7768 - Histone H3 - di methyl K4ab1342 - Histone H3 - tri methyl K4ab1771 - Histone H3 - mono methyl K9ab1772 - Histone H3 - di methyl K9ab1773 - Histone H3 - tri methyl K9ab1780 - Histone H3 - mono methyl K27ab1781 - Histone H3 - di methyl K27ab1782 - Histone H3 - tri methyl K27Immunocytochemistry/ Immunofluorescence - A nti-Histone H3 (tri methyl K27) antibody [mA bcam 6002] -ChIP Grade (ab6002)ICC/IF image of ab6002 stained HeLa cells. The cells were 4% PF A fixed (10 min) and then incubated in 1%BSA / 10% normal goat serum / 0.3M glycine in 0.1% PBS-T ween for 1h to permeabilise the cells and block non-specific protein-protein interactions. The cells were then incubated with the antibody (ab6002, 5µg/ml) overnight at +4°C. The secondary antibody (green) was A lexa Fluor®488 goat anti-mouse IgG (H+L) used at a 1/1000 dilution for 1h. A lexa Fluor® 594 WGA was used to label plasma membranes (red) at a 1/200 dilution for 1h. DA PI was used to stain the cell nuclei (blue) at a concentration of 1.43µM. This antibody also gave a positive result in 4% PF A fixed (10 min) Hek293, HepG2 and M CF7 cells at5µg/ml, and in 100% methanol fixed (5 min) HeLa,Hek293, HepG2 and M CF7 cells at 5µg/ml.Western blot - Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002)All lanes : A nti-Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002) at 1 µg/mlLane 1 : Calf Thymus Histone Preparation Nuclear Lysate at 0.5 µg with BSA BLOCKLane 2 : Calf Thymus Histone Preparation Nuclear Lysate at 0.5 µg with M ILK BLOCKLane 3 : M EF1 (M ouse embryonic fibroblast cell line) Whole Cell Lysate at 10 µg with BSA BLOCKLane 4 : NIH 3T3 (M ouse embryonic fibroblast cell line) Whole Cell Lysate at 10 µg with BSA BLOCKLane 5 : M EF1 (M ouse embryonic fibroblast cell line) Whole Cell Lysate at 10 µg with M ILK BLOCKLane 6 : NIH 3T3 (M ouse embryonic fibroblast cell line) Whole Cell Lysate at 10 µg with M ILK BLOCKSecondaryGoat polyclonal to M ouse IgG - H&L - Pre-A dsorbed (HRP) at 1/3000 dilutionPerformed under reducing conditions.Predicted band size : 15 kDaObserved band size : 17 kDaE xposure time : 12 minutesImmunocytochemistry/ Immunofluorescence -Histone H3 (tri methyl K27) antibody [mA bcam 6002] -ChIP Grade (ab6002)Luke H ughes-D avies and R hiannon Jade, Gurdon Institute, C am bridge, U K Immunofluorescent imaging of human cells (U2OS) with ab6002 reveals broadly dispersed interphase nuclear staining corresponding to trimethylation of K27, with multiple foci of brighter staining, exactly agreeing with published studies of K27-trimethyl IF [See figure 3 of Peters et al M ol Cell 12(6):1577-1589 (2003)] . The lack of nucleolar or cytoplasmic staining background confirms the high specificity of the antibody in this application.IF was performed with a standard paraformaldehyde technique (fixed in PBS buffered PFH 4% for 5 minutes, permeabilised with 0.5% triton-PBS for 5 minutes, blocked with 5% milk / 0.2% tween for one hour. Primary antibody used at 1/200 in 5% milk / 0.2% TWEEN for one hour, secondary antibody A lexa 488 for 30 minutes. A ll blocking and incubation steps carried out at 37 degrees C.Immunocytochemistry/ Immunofluorescence -Histone H3 (tri methyl K27) antibody [mA bcam 6002] -ChIP Grade (ab6002)Figure showing the nuclear distribution of H3 (tri-methyl K27) antibody, ab6002 in a) a 46 chromosome, X X cell line, and b) a 49 chromosome, X X X X X cell line.The location of facultative heterochromatin at the inactive X chromosome is indicated by white arrow heads.Immunocytochemistry/ Immunofluorescence -Histone H3 (tri methyl K27) antibody [mA bcam 6002] -ChIP Grade (ab6002)Kirk M cm anus Interphase 10T1/2 mouse fibroblasts were paraformaldehyde fixed (4%), immunofluorescently labeled with anti-trimethyl K27 antibody (ab6002) and counterstained with DA PI. The merge image presents the DA PI and ab6002 channels as red and green, respectively. The scale bar represents 3µm.Flow Cytometry - Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002)This im age is courtesy of an Abreview subm itted by P rof Albrecht Müller ab6002 staining mouse embyronic stem cells by flow cytometry. The ES cell colonies were trypsinized and permeabilized prior to blocking and staining with the antibody (1ug/1.5 x 10 5 cells. A Cy3 conjugated anti-mouse antibody was used as the secondary.ChIP - Histone H3 (tri methyl K27) antibody [mA bcam 6002] - ChIP Grade (ab6002)This im age is a courtesy of Steve BilodeauImmunocytochemistry/ Immunofluorescence - A nti-Histone H3 (tri methyl K27) antibody [mA bcam 6002] -ChIP Grade (ab6002)。
常见组蛋白修饰

常见组蛋白修饰1、H3K27ac组蛋白H3上的第27位赖氨酸残基发生乙酰化,与较高的转录激活有关,因此被定义为活性增强子信号,H3K27ac在TSS(转录起始位点)的近端远端都有发现。
1.1、赖氨酸的乙酰化与去乙酰化蛋白质通常在赖氨酸残基上发生乙酰化,这个反应依赖于乙酰辅酶A作为乙酰基团的供体。
在组蛋白乙酰化和去乙酰化过程中,组蛋白在N-末端赖氨酸残基上乙酰化和去乙酰化,是基因调控的一部分。
这些反应是由具有组蛋白乙酰转移酶(HAT)或组蛋白去乙酰化酶(HDAC)活性的酶催化的,尽管HATs和HDACs也可以改变非组蛋白的乙酰化状态。
通过乙酰化和去乙酰化对转录因子、效应蛋白、分子伴侣(molecular chaperones)和细胞骨架蛋白的调控是一种重要的翻译后调控机制。
这些调节机制类似于激酶和磷酸酶作用下的磷酸化和去磷酸化。
蛋白质的乙酰化状态不仅可以改变其活性,而且最近有研究表明,这种翻译后修饰还可以与磷酸化、甲基化、泛素化、素酰化等相互作用,以动态控制细胞信号转导。
1.2、与H3K4me1的平衡由于H3K27ac和H3K27me3修饰在组蛋白尾部的相同位置,它们相互拮抗。
H3K27ac常用于寻找活性增强子和平衡增强子,这些增强子是由含有所有增强子的另一个增强子标记H3K4me1减去的1.3、基因上调乙酰化通常与基因的上调有关。
H3K27ac是一个积极的增强标记。
它存在于基因的远端和近端区域。
它在转录起始位点(TSS)中富集。
H3K27ac与H3K27me3共享一个位置,它们之间存在拮抗作用。
2、H3K27me3H3K27me3是组蛋白H3上的27位赖氨酸发生三甲基化,这种三甲基化通过形成异染色质区域下调附近基因。
2.1 机制与功能在赖氨酸27上放置抑制标记需要通过转录因子募集染色质调节子。
这些修饰物要么是组蛋白修饰复合物(这些复合物可以共价修饰组蛋白以在核小体周围移动并打开染色质),要么是染色质重塑复合体(涉及核小体的移动而无需直接修饰它们)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
EpiQuik组蛋白甲基转移酶活性/抑制检
测试剂盒(H3K27)
EpiQuik™ Histone Methyltransferase Activity/Inhibition Assay Kit (H3-K27)
产品名称:EpiQuik组蛋白甲基转移酶活性/抑制检测分析试剂盒(H3K27),EpiQuik™ Histone Methyltransferase Activity/Inhibition Assay Kit (H3K27)
产品货号:P-3005
规格:48次、96次分析
产品简介:
EpiQuik组蛋白甲基转移酶活性/抑制检测试剂盒(H3K27)是方便实验人员专门检测组蛋白H3第27位赖氨酸(H3-K27)的组蛋白甲基转移酶活性/抑制分析的一整套工具。
该试剂盒即时使用,提供全部必需的试剂用于成功进行组蛋白甲基转移酶活性/抑制性试验,不接触放射性物质或任何特殊设备(启维益成有售)。
这个试剂盒具有如下优点:
●快速操作,3小时内可完成。
●安全独创的比色测定,不接触放射性物质,无需提取和层析分析。
●专一性检测H3-K27组蛋白甲基转移酶活性/抑制。
●可剥离的微孔板让实验人员灵活选择手工或高通量分析。
●极其简便,结果可靠,一致的分析条件。
背景信息:
EpiQuik组蛋白甲基转移酶活性/抑制检测试剂盒(H3K27)是为了专门检测组蛋白H3第27位赖氨酸处组蛋白甲基转移酶活性而设计的。
在该试剂盒在实际检测中,组蛋白底物紧密结合在微孔表面,组蛋白甲基化转移酶把腺苷基蛋氨酸(Adomet)的一个甲基基团转移到组蛋白H3基质的第27个赖氨酸上将其甲基化。
甲基化的H3-K27能被一种高亲和性抗体识别,其数量与组蛋白甲基转移酶活性成线性关系,并且可通过HRP偶联的二抗显色系统进行定量。
因此,组蛋白甲基转移酶活性可以依据其所转换的甲基化H3-K27的数量进行计算(启维益成有售)。
试剂盒组分:
HM1 (10X 冲洗缓冲液)
HM2 (组蛋白检测缓冲液)
HM3 (腺苷基蛋氨酸)*
HM4 (生物素标记的底物, 25 µg/ml)*
HM5 (组蛋白甲基转移酶标准品, 10 µg/ml)*
HM6 (结合抗体, 100 µg/ml)*
HM7 (检测抗体, 200 µg/ml)*
HM8 (显色溶液)
HM9 (反应终止溶液)
对照酶样品(100 µg/ml)*
8孔检测板(带96孔框架)
产品应用案例:
Veazey KJ et. al. (September 2015). Dose-dependent alcohol-induced alterations in chromatin structure persist beyond the window of exposure and correlate with fetal alcohol syndrome birth defects. Epigenetics Chromatin. 8:39.
Zhang J et. al. (September 2015). Disruption of KMT2D perturbs germinal center B cell development and promotes lymphomagenesis. Nat Med.
Wan J et. al. (April 2015). PCAF-primed EZH2 acetylation regulates its stability and promotes lung adenocarcinoma progression. Nucleic Acids Res. 43(7):3591-604.
De la Cruz-Hernandez E et. al. (February 2015). Ribavirin as a tri-targeted antitumor repositioned drug. Oncol Rep.
Liu J et. al. (January 2015). Chromatin landscape defined by repressive histone methylation during oligodendrocyte differentiation. J Neurosci. 35(1):352-65.
Morishita M et. al. (December 2014). In vitro histone lysine methylation by NSD1, NSD2/MMSET/WHSC1, and NSD3/WHSC1L. BMC Struct Biol. 14(1):25.
Malmgren S et. al. (April 2013). Coordinate changes in histone modifications, mRNA levels, and metabolite profiles in clonal INS-1 832/13 β-cells accompany functional adaptations to lipotoxicity. J Biol Chem. 288(17):11973-87.
Latrasse D et. al. (March 2013). Dual function of MIPS1 as a metabolic enzyme and transcriptional regulator. Nucleic Acids Res. 41(5):2907-17.
Li Y et. al. (January 2013). Epigenetic regulation of multiple tumor-related genes leads to suppression of breast tumorigenesis by dietary genistein. PLoS One. 8(1):e54369.
Batra V et. al. (March 2012). Interaction between γ-radiation and dietary folate starvation metabolically reprograms global hepatic histone H3 methylation at lysine 4 and lysine 27 residues. Food Chem Toxicol. 50(3-4):464-72.
Rugg-Gunn PJ et. al. (June 2010). Distinct histone modifications in stem cell lines and tissue lineages from the early mouse embryo. Proc Natl Acad Sci U S A. 107(24):10783-90.
Nakade K et. al. (April 2009). JDP2 (Jun Dimerization Protein 2)-deficient mouse embryonic
fibroblasts are resistant to replicative senescence. J Biol Chem. 284(16):10808-17.。
