国家创新医疗器械特别审批项目
创新医疗器械特别审批程序(试行)

附件1创新医疗器械特别审批程序(试行)(征求意见稿)第一条为鼓励医疗器械的研究与创新,促进自主创新医疗器械产业发展,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规和规章,制定本程序。
第二条食品药品监督管理部门对同时符合下列情形的医疗器械按本程序实施审评审批:(一)申请人具有产品核心技术的自主知识产权,权益状况明确。
申请人具有自主知识产权是指,申请人经过其主导的技术创新活动,在我国依法拥有发明专利的所有权,或依法通过受让取得在我国发明专利的所有权或使用权。
(二)产品主要工作原理/作用机理为国内首创,产品性能或安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
(四)申请人为中国境内的企业法人,产品在中国境内生产,并具有医疗器械生产企业许可证。
第三条各级食品药品监督管理部门及相关技术机构,根据各自职责和本程序规定,按照早期介入、专人负责、科学审批的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。
第四条申请人申请创新医疗器械特别审批,应当填写《创新医疗器械特别审批申请表》(见附件1),并提交支持拟申请产品符合本程序第二条要求的资料。
资料应当包括:(一)申请人企业法人资格证明文件。
(二)医疗器械生产企业许可证。
(三)产品知识产权情况及证明文件。
(四)产品研发过程及结果的综述。
(五)产品技术文件,至少应包括:1. 产品的预期用途;2. 产品工作原理/作用机理;3. 产品主要技术指标及确定依据,主要原材料、关键元器件的指标要求,主要生产工艺过程及流程图,主要技术指标的检验方法。
(六)产品创新的证明性文件,至少应包括:1. 国家级信息或专利检索机构出具的查新报告;2. 核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;3. 与产品主要技术相关的发明专利说明书;4. 国内外已上市同类产品应用情况的分析;5. 产品的创新内容及在临床应用的显著价值。
国家创新医疗器械特别审批项目

国家创新医疗器械特别审批项目国家创新医疗器械特别审批项目是指为推动医疗器械创新,提高医疗器械技术水平,满足人民群众的医疗需求,国家采取特殊审批方式对创新医疗器械项目进行审批和支持的一项政策措施。
该项目的实施可以加快医疗器械技术研发和创新成果的转化应用,为医疗器械企业提供更快捷、更优惠的审批通道。
1.新技术新材料类器械:针对新技术新材料的医疗器械,如生物材料、纳米技术、激光技术、光谱技术等,可以申请特别审批项目,以提高其研发和上市速度。
2.特定疾病防治类器械:对于面向特定疾病的医疗器械,如癌症治疗设备、心脏支架、人工关节等,可以通过特别审批项目加快研发和上市进程。
3.稀缺病种救治类器械:针对罕见病或稀缺病种的救治器械,如常染色体显性遗传病治疗器械、先天性心脏病救治器械等,可以申请特别审批项目,以满足罕见病患者的救治需求。
1.申请材料准备:申请单位需要准备详细的医疗器械研发计划、技术规范、临床试验方案、预期结果及市场分析等申请材料,以便国家相关部门进行审批。
2.专家评审:申请材料通过初步审核后,会组织专家对项目进行评审,评估其技术方案的科学性与可行性,并提出评审意见。
3.特别审批:根据专家评审意见,相关部门对项目进行审批,决定是否给予特别审批项目的支持。
4.跟踪管理:一旦项目获得特别审批,申请单位需要按照项目计划进行研发,并及时向国家相关部门报送进展情况。
1.促进医疗器械技术创新:通过特别审批项目,可以加强医疗器械技术创新,推动新技术新材料的研发和应用。
2.缩短上市时间:特别审批项目减少了审批程序和时间,可以加快医疗器械的研发上市进程,更快地满足患者的治疗需求。
3.降低研发成本:特别审批项目为医疗器械企业提供了更优惠的审批通道,减少了研发成本,为企业创新提供良好的政策环境。
4.提高医疗水平:特别审批项目的实施可以推动医疗器械技术的发展,提高医疗水平和治疗效果,提供更好的医疗服务。
总之,国家创新医疗器械特别审批项目的实施对于促进医疗器械技术创新、提高医疗水平、满足患者需求具有重要意义。
文解政策:创新医疗器械特别审查程序之一

文解政策:创新医疗器械特别审查程序之一近年来,中国医疗器械行业的发展势头迅猛,市场需求不断扩大,竞争格局日趋激烈。
为促进医疗器械创新,提升行业水平,加强监管,国家实施了创新医疗器械特别审查程序。
本文将从政策出台的背景、特别审查程序的要点以及影响等方面进行分析和解读。
一、政策背景创新医疗器械特别审查程序的出台可追溯至2015年9月,当时国务院办公厅发布了《关于深化医药卫生体制改革加快药品器械审评审批制度改革的意见》,其中明确提出将建立医疗器械创新审评制度,鼓励医疗器械创新,支持创新型医疗器械企业发展。
医疗器械创新审评制度的设立,在政策层面上,为医疗器械行业的发展注入了新的活力。
但长期以来,医疗器械注册审批周期长、标准不统一、审查标准不明确等问题长期困扰着广大医疗器械企业。
为了解决这些问题,国家在创新医疗器械审查中实施了特别审查程序。
二、特别审查程序的要点特别审查程序是一种国家实施的医疗器械审查机制,旨在提高医疗器械创新审评的效率和质量,同时促进科技成果的转化和应用。
具体来说,特别审查程序主要包括以下几个方面:(一)支持优质医疗器械的发展。
特别审查程序优先审查和审批国内外技术先进、市场需求量大、具有重要的临床应用价值和可推广性的医疗器械,为这些医疗器械提供更快捷、高效的审评审批服务。
(二)针对创新医疗器械采取差别化审查。
根据医疗器械的技术特点和临床应用需求,特别审查程序会对创新医疗器械的注册审批标准进行差别化的制定和审查,对符合条件的企业给予优先审批,提高审评效率。
(三)实行绿色通道审评制度。
为扶持具有核心技术和临床应用前景的中小企业和技术团队,特别审查程序实行绿色通道审评制度,以更快捷的审批速度和更优惠的政策扶持中小企业和技术团队的发展。
三、特别审查程序的影响创新医疗器械特别审查程序的实施,对行业发展产生了深远的影响:(一)促进技术创新,激发市场活力特别审查程序实行差别化审查,针对创新医疗器械制定专门的审评标准,极大地鼓励了行业内企业的技术创新和产业升级。
创新医疗器械政策梳理

创新医疗器械政策梳理
针对创新医疗器械的政策梳理如下:
1. 创新医疗器械特别审查程序:为鼓励医疗器械创新,国家药监局修订发布了《创新医疗器械特别审查程序》,将医疗器械创新纳入发展重点,推动医疗器械产业的高质量发展。
2. 医疗器械监督管理条例:新《条例》提出将医疗器械创新纳入发展重点,并推动医疗器械产业的高质量发展。
在完善创新体系方面,新《条例》提出国家完善医疗器械创新体系,支持医疗器械的基础研究和应用研究,促进医疗器械新技术的推广和应用。
3. 奖励措施:对在医疗器械的研究与创新方面做出突出贡献的单位和个人,按照国家有关规定,给予表彰奖励。
对第三类创新医疗器械进入创新审批程序后,单个产品给予最高100万元奖励;对取得第三类创新医疗器械(免临床试验的除外)注册证并在本市投产的,按照不超过临床试验协议或合同金额的30%给予最高1400万元奖励。
对第二类创新医疗器械进入创新审批程序后,单个产品给予最高50万元奖励;对取得第二类创新医疗器械(免临床试验的除外)注册证并在本市投产的,按照不超过临床试验协议或合同金额的20%给予最高250万元奖励。
以上信息仅供参考,如有需要,建议您查阅相关网站。
一文解析“创新医疗器械特别审批程序”
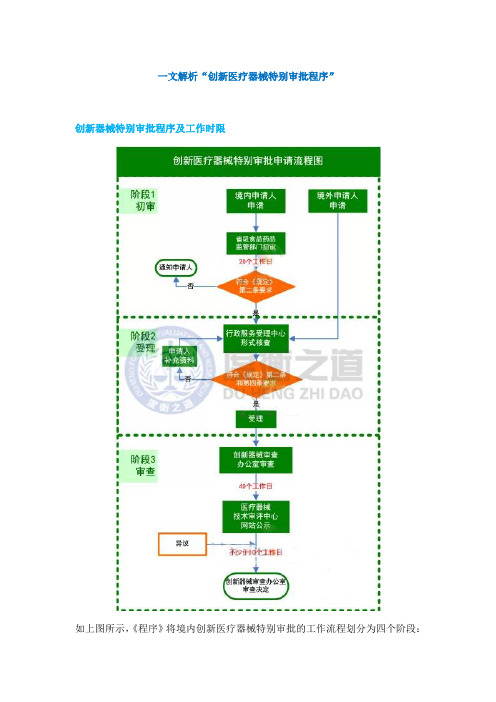
一文解析“创新医疗器械特别审批程序”创新器械特别审批程序及工作时限如上图所示,《程序》将境内创新医疗器械特别审批的工作流程划分为四个阶段:初审、受理、审查、公示;境外创新医疗器械特别审批的工作流程仅包含三个阶段:受理、审查、公示。
《程序》限定初审应于20个工作日内完成,审查应于40个工作日内完成,公示应≥10个工作日。
据此是否可以估算境内创新器械特别审批申请应在≤70个工作日内获得审查结果;境外创新医疗器械特别审批申请应在≤50个工作日内获得结论呢?可能还需考虑申请人提供信息有欠缺或进行补充资料的情况。
依据法规事务经验,在初审、受理、审查这三个环节,企业均面临补正资料或补充资料的可能。
但《程序》并未明确提及资料的补充、期限和复审期限。
其中,补充资料时间企业必须根据材料的缺失程度和补正所需周期估算。
此外,在《程序》中并未对受理以及资料流转给予时间限定。
依据现有要求,受理与流转时限为8个工作日。
但是由于这部分时间涉及到多个部门之间的交接问题,在同类情形中也出现过超出时限、难以推进的情况。
提请各位注意,对于境内创新医疗器械还需估算企业所在地省级食品药品监督管理部门的受理及结转的时限。
具体可参照当地的相关配套文件。
“创新特别审批”将给与企业哪些优待?我们将创新产品的上市划分为两个阶段:创新医疗器械特别审批申请阶段和创新医疗器械注册申请阶段。
第二阶段是建立在第一阶段基础上的。
这两个阶段《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)(以下简称《程序》)究竟为企业创造了哪些便捷和优待?请参见下图(以境内创新产品为例)。
此处要提请广大会员注意的是:在第一阶段中,《程序》给予企业最大的优待政策是在产品注册申请受理前以及技术审评过程中,指定专人,应申请人的要求及时沟通、提供指导,共同讨论相关技术问题。
沟通交流应形成记录,供该产品的后续研究及审评工作参考。
沟通内容至少涉及两个方面:一方面是审查产品的创新性;另一方面,也是创新企业的沟通重点,是在指定专人的条件下,就重大技术、安全、临床方案问题与技术审评中心在产品最终定型注册申请前进行充分的沟通和分步确认。
国家食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知

国家食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2014.02.07•【文号】食药监械管[2014]13号•【施行日期】2014.03.01•【效力等级】部门规范性文件•【时效性】失效•【主题分类】药政管理正文国家食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知(食药监械管〔2014〕13号)各省、自治区、直辖市食品药品监督管理局:为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,总局组织制定了《创新医疗器械特别审批程序(试行)》,现印发给你们,请遵照执行。
国家食品药品监督管理总局2014年2月7日创新医疗器械特别审批程序(试行)第一条为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规和规章,制定本程序。
第二条食品药品监督管理部门对同时符合下列情形的医疗器械按本程序实施审评审批:(一)申请人经过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
(二)产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
第三条各级食品药品监督管理部门及相关技术机构,根据各自职责和本程序规定,按照早期介入、专人负责、科学审批的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。
第四条申请人申请创新医疗器械特别审批,应当填写《创新医疗器械特别审批申请表》(见附件1),并提交支持拟申请产品符合本程序第二条要求的资料。
中国创新医疗器械特别审批程序介绍(顾汉卿)-新版特别审批

• 受理创新医疗器 • After accepting the application for 械注册申请后, registration of 应当将该注册申 innovative medical 请项目标记为 devices, the registration items “创新医疗器 械”,并及时进 shall be marked as "innovative medical 行注册申报资料 devices", and 流转。 register to declare information flow in a timely manner.
1.Legal person qualificat ion certificates of the applicant; 2.Intellectual property information and supporting documents of products; 3.Summary of product development process and results;
• 医疗器械检测机构 • 应当在接受样品后 优先进行医疗器械 注册检测,并出具 检测报告。
Testing institution for medical devices shall make a registration test for medical devices in priority after accepting samples , and issue the report.
supervision and inspection according to the process of clinical trials.
• 在产品注册申请受理• Before accepting an 前以及技术审评过程 application for registration of the product 中,食品药品监管总 and in the process of 局医疗器械技术审评 technical review, Center 中心应当指定专人, for Medical Device 应申请人的要求及时 Evaluation of SFDA shall designate someone, at the 沟通、提供指导,共 request of the 同讨论相关技术问题。applicant, provide guidance for timely communication and discuss the related technical problems.
食药监械管〔2014〕13号——创新医疗器械特别审批程序(试行)

创新医疗器械特别审批程序(试行)食药监械管〔2014〕13号2014-02-07第一条为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规和规章,制定本程序。
第二条食品药品监督管理部门对同时符合下列情形的医疗器械按本程序实施审评审批:(一)申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
(二)产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
第三条各级食品药品监督管理部门及相关技术机构,根据各自职责和本程序规定,按照早期介入、专人负责、科学审批的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。
第四条申请人申请创新医疗器械特别审批,应当填写《创新医疗器械特别审批申请表》(见附件1),并提交支持拟申请产品符合本程序第二条要求的资料。
资料应当包括:(一)申请人企业法人资格证明文件。
(二)产品知识产权情况及证明文件。
(三)产品研发过程及结果的综述。
(四)产品技术文件,至少应当包括:1.产品的预期用途;2.产品工作原理/作用机理;3.产品主要技术指标及确定依据,主要原材料、关键元器件的指标要求,主要生产工艺过程及流程图,主要技术指标的检验方法。
(五)产品创新的证明性文件,至少应当包括:1.信息或者专利检索机构出具的查新报告;2.核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;3.国内外已上市同类产品应用情况的分析及对比(如有);4.产品的创新内容及在临床应用的显著价值。
创新医疗器械特别审批程序

创新医疗器械特别审批程序创新医疗器械是指相对于已有的医疗器械,在技术、功能、性能等方面有显著不同和创新性的产品。
这类医疗器械的研发和上市,往往需要经过一系列的审批程序,以确保其安全性和有效性。
然而,由于创新医疗器械的特殊性,传统的审批流程可能过于繁琐和耗时,因此需要创新医疗器械特别审批程序。
首先,创新医疗器械特别审批程序应采取一站式服务,即为创新医疗器械提供集成化服务,简化流程,减少环节。
审批机构应设立专门的审核团队,由相关领域的专家组成,对创新医疗器械的技术、安全性、临床应用等进行全面评估。
其次,创新医疗器械特别审批程序应明确标准和要求。
审批机构应制定明确的技术评估指南,提供具体要求和要点,以便创新医疗器械生产企业提供相应的技术资料和数据。
同时,应设立尽早介入机制,与企业建立良好的沟通和合作关系,协助企业完善技术资料。
第三,创新医疗器械特别审批程序应注重前瞻性评估。
由于创新医疗器械在技术和临床应用上具有较高的不确定性,传统的审批流程往往依赖于过去的经验和数据,无法全面考虑到创新医疗器械的潜在风险和患者的实际需求。
因此,特别审批程序应加强前瞻性评估,引入新的评估方法和技术,提高创新医疗器械审批的准确性和科学性。
第四,创新医疗器械特别审批程序应加强管理和监督。
特别审批程序的实施应建立健全的管理和监督制度,确保审批工作的公正、透明和高效。
同时,要加强对创新医疗器械在市场上的监测和评估,在上市后继续跟踪和监督其安全性和有效性,确保创新医疗器械能够真正造福于患者。
最后,创新医疗器械特别审批程序应鼓励创新和合作。
审批机构应积极支持和鼓励创新医疗器械的研发和应用,提供相关政策和资金支持。
同时,应加强与科研机构、医疗机构和企业的合作,利用各方的资源和优势,共同推进创新医疗器械的发展。
综上所述,创新医疗器械特别审批程序对于促进医疗器械创新发展具有重要意义。
通过简化审批流程、明确标准和要求、加强前瞻性评估、加强管理和监督,并鼓励创新和合作,特别审批程序能够提供更加便捷和高效的审批通道,为创新医疗器械的研发和应用提供有力支持,为患者提供更好的医疗服务。
创新医疗器械特别审批程序(试行)

附件1创新医疗器械特别审批程序(试行)(征求意见稿)第一条为鼓励医疗器械的研究与创新,促进自主创新医疗器械产业发展,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规和规章,制定本程序。
第二条食品药品监督管理部门对同时符合下列情形的医疗器械按本程序实施审评审批:(一)申请人具有产品核心技术的自主知识产权,权益状况明确。
申请人具有自主知识产权是指,申请人经过其主导的技术创新活动,在我国依法拥有发明专利的所有权,或依法通过受让取得在我国发明专利的所有权或使用权。
(二)产品主要工作原理/作用机理为国内首创,产品性能或安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
(四)申请人为中国境内的企业法人,产品在中国境内生产,并具有医疗器械生产企业许可证。
第三条各级食品药品监督管理部门及相关技术机构,根据各自职责和本程序规定,按照早期介入、专人负责、科学审批的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。
第四条申请人申请创新医疗器械特别审批,应当填写《创新医疗器械特别审批申请表》(见附件1),并提交支持拟申请产品符合本程序第二条要求的资料。
资料应当包括:(一)申请人企业法人资格证明文件。
(二)医疗器械生产企业许可证。
(三)产品知识产权情况及证明文件。
(四)产品研发过程及结果的综述。
(五)产品技术文件,至少应包括:1. 产品的预期用途;2. 产品工作原理/作用机理;3. 产品主要技术指标及确定依据,主要原材料、关键元器件的指标要求,主要生产工艺过程及流程图,主要技术指标的检验方法。
(六)产品创新的证明性文件,至少应包括:1. 国家级信息或专利检索机构出具的查新报告;2. 核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;3. 与产品主要技术相关的发明专利说明书;4. 国内外已上市同类产品应用情况的分析;5. 产品的创新内容及在临床应用的显著价值。
《创新医疗器械特别审查程序》解读

《创新医疗器械特别审查程序》解读近年来,医疗器械行业逐渐走向高端化、智能化,医疗器械的创新也日益成为关注焦点。
为了推动医疗器械的发展和规范创新,国家食品药品监督管理局(以下简称“国家药监局”)于2018年发布了《创新医疗器械特别审查程序》,该程序的出台标志着中国医疗器械创新进入一个新的阶段。
一、背景医疗器械属于高风险产品,其安全性和有效性一直备受关注。
在过去,开发新的医疗器械需要经过复杂的审批程序,涉及标准制定、临床试验、注册等众多环节,时间和成本都极为高昂。
因此,医疗器械的创新过程缓慢,限制了市场发展及技术变革。
为了加速医疗器械创新,提高医疗器械审批效率,国家药监局于2018年10月发布了《创新医疗器械特别审查程序》。
这一程序的出台旨在为医疗器械的创新提供更多的可能性和空间,加快中国医疗器械产业的发展。
二、创新医疗器械特别审查程序的定义《创新医疗器械特别审查程序》是一项特别审查制度,旨在对符合规定的医疗器械创新进行加速审批,并保证创新医疗器械的安全性、有效性和质量。
这项特别审查程序适用于比较独特、前沿、创新的医疗器械,在原有审批程序基础上实施的一种简化认证机制。
申请人需提交符合要求的技术报告,经专家评审认可后,医疗器械将获得更快的审批速度,获得临床试验和市场推广的许可。
三、创新医疗器械特别审查程序的特点(1)缩短备案时间:普通的医疗器械备案时效需要12个月以上,而在特别审查程序下,医疗器械的审批时间会大幅缩短,只需3-6个月就能拿到批准。
(2)专家评审:该程序对医疗器械的技术及外貌进行全面评估,专家组会从产品的安全性、有效性、适用性、技术先进性等方面进行审议,并根据需要提出改进建议,提高创新医疗器械的安全性和有效性。
(3)适用规范:医疗器械创新审批需要符合一定的规范,包括《医疗器械注册管理办法》等各项转制要求,以保证医疗器械创新能够在制度上得以审查和承认。
(4)容错机制:为了鼓励企业创新积极性,特别审查程序提供“容错机制”,对于因拓宽技术应用范围、代替已有产品等原因尚有不足的创新医疗器械,同样能够得到特别审查程序的批准。
《创新医疗器械特别审查程序》解读

《创新医疗器械特别审查程序》解读2018年11月05日发布一、关于创新医疗器械特别审查程序中有关专利方面的要求创新医疗器械的审查条件之一就是申请人在中国依法拥有产品核心技术发明专利权。
考虑存在核心技术发明专利的申请已由国务院专利行政部门公开,但最终未被授予专利权的情况,因此增加对产品核心技术方案的预评价。
国家知识产权局专利检索咨询中心是国家知识产权局直属单位,申请人可向专利检索咨询中心提出检索申请。
为进一步鼓励创新,激发医疗器械生产企业的研发活力,考虑到专利的特点与医疗器械研发的平均周期,因此,确定创新医疗器械特别审查申请时间距专利授权公告日不超过5年。
二、关于创新医疗器械审查结果告知方式和内容申请人可通过登录国家局器审中心网站审评进度查询页面查询审查结果。
告知内容包括审查结论、审结日期、不同意理由(不同意项目)、管理类别(同意项目)等。
新修订的程序实施后将不再印送纸质通知。
三、关于创新医疗器械企业沟通交流的方式国家局器审中心按照早期介入、专人负责、科学审查的原则,根据《医疗器械审评沟通交流管理办法(试行)》等工作要求,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。
关于专家审查会,器审中心目前已在部分省市开展试点,通过远程视频方式对提交的创新医疗器械特别审查申请召开专家审查会,企业可参加并与专家交流。
四、关于第一类医疗器械根据《医疗器械监督管理条例》(国务院令第680号),第一类医疗器械实施备案管理,因此第一类医疗器械不适用本程序。
五、关于实施新修订程序的时间新修订的《创新医疗器械特别审查程序》自2018年12月1日起施行。
新修订程序实施前已受理申请但未审批的,不需按照新修订程序补充申报资料及审查,其他要求均执行新修订程序的规定。
考虑到对已同意按照该程序进行审查、长期未申报注册的创新医疗器械需重新评估其是否仍符合相关审查条件,新修订程序增加了“审查结果告知后5年内,未申报注册的创新医疗器械,不再按照本程序实施审查”的要求。
创新医疗器械特别审批程序

国务院各有关部门的沟通和交流,及时了解创新医疗器械的研发进展。 第二十四条 突发公共卫生事件应急所需医疗器械,按照《医疗器 械应急审批程序》办理。 第二十五条 医疗器械注册管理要求和规定,本程序未涉及的,按 照《医疗器械注册管理办法》等相关规定执行。 第二十六条 本程序自2014年3月1日起施行。 附件:1.创新医疗器械特别审批申请表(略) 2.创新医疗器械特别审批申请审查通知单(略) 3.创新医疗器械沟通交流申请表(略) 4.创新医疗器械沟通交流申请回复单(略)[1-2]
见。经初审不符合第二条要求的,省级食品药品监督管理部门应当通知 申请人;符合第二条要求的,省级食品药品监督管理部门将申报资料和 初审意见一并报送国家食品药品监督管理总局(以下简称食品药品监管 总局)行政受理服务中心。 境外申请人应当向食品药品监管总局提出创新医疗器械特别审批申 请,食品药品监管总局行政受理服务中心对申报资料进行形式审查,对 符合本程序第四条规定的形式要求的予以受理。 第六条 食品药品监管总局行政受理服务中心对受理的特别审批申 请,给予产品特别审批申请受理编号,受理编号编排方式为:械特 ×××× 1-××× 2,其中×××× 1为申请的年份;××× 2 为产品流水号。 第七条 食品药品监管总局医疗器械技术审评中心设立创新医疗器 械审查办公室(以下简称创新医疗器械审查办公室),对创新医疗器械 特别审批申请进行审查。 第八条 食品药品监管总局受理创新医疗器械特别审批申请后,由 创新医疗器械审查办公室组织专家进行审查,并于受理后40个工作日内 出具审查意见。 第九条 经创新医疗器械审查办公室审查,对拟进行特别审批的申 请项目,应当在食品药品监管总局医疗器械技术审评中心网站将申请 人、产品名称予以公示,公示时间应当不少于10个工作日。对于公示有 异议的,应当对相关意见研究后作出最终审查决定。 第十条 创新医疗器械审查办公室作出审查决定后,将审查结果书 面通知申请人,对境内企业的申请,同时抄送申请人所在地省级食品药 品监督管理部门(格式见附件2)。 第十一条 创新医疗器械审查办公室在审查创新医疗器械特别审批 申请时一并对医疗器械管理类别进行界定。对于境内企业申请,如产品
国家创新医疗器械特别审批项目

在这里,还有一项工作对于今后产品上市是很重要的,就 是申报产品安全风险管理报告。新的《医疗器械管理条例》 十分重视风险管理。风险管理是一个产品管理环节,它是 一个过程管理。在产品开发的整个过程不断地进行风险分 析与管理,把所有在开发过程中发现的产品风险因素通过 管理转化为可控制因素,从而实现产品的最终风险控制。
(1)设计输入; (2)产品设计验证(有效性、安全性、动物试验 等验证工作);
(3)产品设计输出。
同时,根据设计输出,进行:
1)生产工艺设计; 2)生产工艺验证; 3)工艺过程质量控制; 4)产品的质量控制(性能指标、检测方法 与验证、生物学评价、产品货架说明验证、灭菌 验证、包装性能验证等)。
问题是这二类机构出具的查新报告都有自己的局 限性。专利检索机构往往从专利的科学性、新颖 性和实用性这些方向来出具报告。信息机构的报 告往往从申请者的创新点与文献中的相比有没有 相同性来论述。当然这些报告,很好,符合我们 法规的规定。
问题是评审必须了解的申报产品从工作原理与 作用机理为国内首创,国内没有申报产品上市, 尤其是同类产品上市的情况。再有申报产品的 性能或安全性与同类产品比较有没有达国际领 先水平。这些查新资料,企业在产品的研发过 程应了解,在设计输入中应形成报告并在申报 资料中应提供。实际工作中发现提供这些资料 的单位很少。影响产品的批准。
按新的医疗器械注册管理办法规定,《需进行临 床试验审批的第三类医疗器械目录》中的医疗器 械,临床试验是必须经国家总局批准方能在临床 实施。因为,创新医疗器械就大多数而言,它的 临床方案问题较多,特别是它的适应症、禁忌症 以及方案设计计算,对照组与主要考核指标的选 择都容易出错,多听一些审查员及临床专家的意 见,绝对不会错。
6、关于发明专利的组合。资料中理想的发明专 利组合应该是:
2020创新医疗器械特别审查程序

2020创新医疗器械特别审查程序随着科技的不断发展和医疗领域的不断进步,医疗器械行业一直处于快速发展的状态。
为了更好地促进医疗器械创新和生产,国家药监局于2020年推出了创新医疗器械特别审查程序。
这一举措在医疗器械行业引起了广泛关注和讨论。
一、什么是创新医疗器械特别审查程序?创新医疗器械特别审查程序是指国家药监局为鼓励和支持医疗器械创新,加快相关产品上市审评流程而设立的一项特别审查程序。
该程序主要针对那些具有创新意义、技术难度较大、临床需求紧迫等特点的医疗器械产品,为其提供了更为便利和快速的审评通道。
二、创新医疗器械特别审查程序的意义和作用创新医疗器械特别审查程序的推出,为医疗器械行业的发展带来了积极的影响。
它有助于激励企业不断加大对医疗器械创新的投入,促进了医疗器械技术的进步和升级。
该程序能够更好地满足临床需求,加快新技术、新产品在临床应用中的推广和应用,为患者提供更好的医疗服务。
它还有利于促进医疗器械行业的健康发展,提升了国内医疗器械产品的竞争力和国际地位。
三、创新医疗器械特别审查程序的具体实施及影响具体而言,创新医疗器械特别审查程序的实施主要体现在以下几个方面:一是缩短了医疗器械产品的审评时间。
二是简化了审评流程,降低了企业的研发和生产成本。
三是提高了创新医疗器械产品的市场准入速度,为企业带来了更多商机和发展空间。
而在整个医疗器械行业中,这一举措也产生了深远的影响,引领了医疗器械技术和产业的发展方向,推动了整个行业的升级和转型。
四、展望未来展望未来,创新医疗器械特别审查程序将继续发挥重要的作用。
随着医疗技术的不断进步和医疗需求的不断提升,创新医疗器械特别审查程序将会不断优化和完善,为更多医疗器械产品的创新和上市提供更为便利的通道。
政府和企业也应加强合作,共同推动医疗器械行业的发展,为人民健康事业作出更大的贡献。
个人观点与理解笔者认为,创新医疗器械特别审查程序的推出,是对医疗器械行业发展的积极促进,有助于激发企业的创新活力,加快了医疗器械技术的发展和应用,对于提升人民群众的健康水平和促进医疗器械行业的发展具有重要意义。
国家创新医疗器械特别审查程序

国家创新医疗器械特别审查程序国家创新医疗器械特别审查程序1. 背景介绍国家创新医疗器械特别审查程序,是指国家食品药品监督管理局为了鼓励和支持医疗器械创新,在确保产品安全和有效的前提下,为符合条件的医疗器械产品提供一种特殊审评通道,用于加快创新医疗器械的上市审评进度,减少审评周期。
2. 程序设立的必要性国家创新医疗器械特别审查程序的设立,是因为传统医疗器械审评流程存在审评周期长、费用高等问题,这对于创新医疗器械的研发和上市产生了一定的阻碍。
为了鼓励企业加大医疗器械研发投入,加快创新医疗器械产品的研发进程,国家食品药品监督管理局设立了国家创新医疗器械特别审查程序。
3. 程序的具体作用和意义国家创新医疗器械特别审查程序的设立,可以更加精准地满足创新医疗器械产品的审评需求,加速创新医疗器械产品的上市进程,促进医疗器械行业的创新发展。
通过提高医疗器械研发的效率,还可以更快地满足患者和医疗机构对于新型医疗器械产品的需求。
4. 程序的申报条件和流程申报国家创新医疗器械特别审查程序需要符合一定的条件,例如医疗器械产品具有明显的创新特点,在临床上具有重要的临床应用效果等。
而申报的流程则需要企业按照国家食品药品监督管理局相关规定提交相关材料,经过专家评审后确定是否符合国家创新医疗器械特别审查程序的条件。
5. 个人观点和理解国家创新医疗器械特别审查程序的设立,对于医疗器械行业的发展具有积极的促进作用。
通过加快创新医疗器械产品的上市进程,可以大大刺激企业增加医疗器械研发投入,推动医疗器械行业技术创新和产品升级。
也能够更快地让患者受益于新型医疗器械产品,提高医疗服务质量和水平。
总结回顾国家创新医疗器械特别审查程序的设立,是国家食品药品监督管理局为了促进医疗器械行业创新发展而采取的一项重要举措。
通过提供更加快速、精准的审评通道,在保证医疗器械产品安全和有效的前提下,加速创新医疗器械产品的上市审评进度,从而推动医疗器械行业的技术创新和产品更新换代。
创新医疗器械特别审批申报资料

创新医疗器械特别审批申报资料创新医疗器械特别审批申报资料:开启医疗新篇章随着科技的日新月异,医疗器械也在不断升级换代,越来越多的创新医疗器械开始进入人们的视野。
创新医疗器械特别审批申报资料是为了加快审评、审批速度,鼓励创新医疗器械研发而设立的特殊审批程序。
本文将详细介绍创新医疗器械特别审批申报资料的审批流程、注意事项以及案例分析,以期为相关企业和研究人员提供帮助和参考。
一、创新医疗器械特别审批申报资料概述创新医疗器械特别审批申报资料是指医疗器械研发企业在申请创新医疗器械注册时,需要提交的特殊审批申报资料。
该程序主要针对具有重大创新和临床价值的医疗器械,旨在加快审评、审批速度,推动医疗器械的研发和应用。
二、审批流程1、申请人需提交以下申请材料:(1)创新医疗器械特别审批申请表;(2)产品说明书;(3)注册产品标准及编制说明;(4)产品技术要求及编制说明;(5)产品注册检验报告;(6)临床试验协议(包括伦理审查意见);(7)其他相关材料。
2、审批部门对申请材料进行形式审查,符合要求的,进入评审环节。
3、评审环节包括技术审查和行政审查,主要审查内容包括技术先进性、安全性、有效性等方面。
4、审批部门根据审查结果,出具特别审批意见,对符合条件的医疗器械给予特别审批通过。
5、申请人获得特别审批通过后,即可进行注册申请。
三、注意事项1、申请人应具备以下基本条件:(1)具备独立法人资格;(2)具备研发、生产医疗器械的能力和条件;(3)具备完整的质量管理体系。
2、申请材料应真实、准确、完整,符合相关规定。
3、申请人在提交申请前,应充分了解创新医疗器械特别审批的相关政策和要求。
4、评审环节中,申请人应配合评审工作,提供必要的资料和信息。
5、获得特别审批通过后,申请人应按照评审意见进行产品改进和完善,确保产品符合相关标准和要求。
四、案例分析某医疗器械研发企业成功研发出一款具有重大创新和临床价值的医疗器械,通过提交创新医疗器械特别审批申报资料,获得了特别审批通过。
中国创新医疗器械特别审批程序介绍新版特别审

中国创新医疗器械特别审批程序介绍新版特别审中国创新医疗器械特别审批程序是指国家药监局为了促进医疗器械创新,加快满足医疗领域对新技术、新产品的需求,设立的一种特殊审批程序。
该程序的推行,旨在加速创新医疗器械的研发、注册和上市过程,为广大患者提供更加先进、安全、有效的医疗器械。
新版特别审批程序的主要特点包括:1.优化流程:新版特别审批程序简化了审核流程,缩短了审批时间。
申请人只需提交一套申请材料,受理机构负责组织专家评审,大大加快了审批效率。
2.强化授权:新版特别审批程序赋予了受理机构一定的审批权限。
经受理机构审核通过的创新医疗器械可以直接进入市场,而不需要再向国家药监局进行再次审批。
3.引入平行审评:新版特别审批程序引入了平行审评机制,即在国内审评的同时,可以进行国外审评,并将国外审评结果作为参考意见。
这一机制有效缩短了审评时间,降低了申请人的研发成本。
5.提高透明度:新版特别审批程序强化了信息公开,通过建立信息发布平台和举办相关专题会议等方式,及时向社会公布审评进展情况和结果,提高了透明度,增强了公众对特审程序的信任和理解。
新版特别审批程序的推行,有助于促进医疗器械技术的创新和进步,增强企业的创新活力和市场竞争力。
同时,也有利于提升医疗器械的品质和安全性,为患者提供更好的医疗服务。
然而,需要注意的是,特别审批程序并非对所有医疗器械都适用,只有符合特定条件的创新医疗器械才能申请特审。
具体而言,特审适用于符合以下条件的医疗器械:1)具有新技术或新原理;2)已在国内推广应用;3)试用期内,在临床试验阶段已取得一定临床数据和安全有效性证据。
此外,特审申请人还需满足一定的申请条件和提交相应的申请材料,包括产品说明、临床试验报告等。
特审申请通过后,申请人仍需按照相关法规和政策,继续进行监管要求的后续工作,并承担相应的责任和义务。
总的来说,中国创新医疗器械特别审批程序的推行,为创新医疗器械的研发和上市提供了更加灵活、快捷的途径,有助于满足社会对高质量医疗服务的需求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、特别要强调,我们申报的是创新医疗器 械具体产品的特别审批。这就清楚地表明, 创新的是产品,而不是技术创新。
二者,审批的要求是不同的。
二、哪些医疗器械产品属于创新医疗器械?
同时符合下列四点的产品属于创新医疗器械:
1、申请者在中国依法拥有申报产品核心技术的发明专利权, 或者依法通过受让取得在中国发明专利权或其使用权; 或者核心技术发明专利的申请已由国务院专利行政部门 公开。
(1)设计输入; (2)产品设计验证(有效性、安全性、动物试验 等验证工作);
(3)产品设计输出。
同时,根据设计输出,进行:
1)生产工艺设计; 2)生产工艺验证; 3)工艺过程质量控制; 4)产品的质量控制(性能指标、检测方法 与验证、生物学评价、产品货架说明验证、灭菌 验证、包装性能验证等)。
6、关于发明专利的组合。资料中理想的发明专 利组合应该是:
(1)申请产品的核心技术的发明专利,说明书 应涵盖申报产品。
(2)申报产品的发明专利,资料说明书中应说 明所使用的核心技术是哪些,并说明核心技术已申 报了发明专利。
我们在资料中期待能看到(1)、(2)的组合。
一个企业建立适合自己产品的专利体系是件非常 重要的事情。要保护企业产品的知识产权,仅仅 靠几个专利是远远不够,一定要建立体系。这个 体系越完整,越齐全,越丰富,那么产品的知识 产权既不侵犯别人的专利,又能保护好自己产品 的知识产权,对于创新医疗器械,尤为重要。
4、由以上的叙述不难看出,我们强调发明专利的 重要性的原因,目的是为了保证进入创新医疗器 械特别审批的产品,它的知识产权能得到国家法 律的保护。正由于这个原因审评中对产品的发明 专利不足以保护产品知识产权的问题,对不是首 次使用的发明专利问题都提出一些补充和加强专 利的建议。
5、关于发明专利技术水平的审评。正如前所述, SFDA《创新医疗器械特别审批程序》对创新医疗 器械发明专利技术水平要求很高的。因此并不是 发明专利的产品一定能获批,也不是一些“小 的”“简单的”发明专利的产品一定不会获批, 关键是这些专利能不能给产品的安全有效性带来 显著的提高,用数据来说话。
同时,这些产品的核心技术的应用,使产品的性 能或者安全性有根本性改进。根本性改进是指相 关的产品性能与安全性的检测指标与国内同类产 品相比有统计意义上的进步,即应该用数据来说 话,而不是用文字描述来表达。同时,性能达国 际领先。
在这里想谈一下查新的问题:《创新医疗器械特 别审批程序》文件中提到的是信息或专利检查机 构出具的查新报告即可。后来,创新办又规定了 查新报告必须是一年之内的查新报告。这二条现 在越来越多的申报资料都符合要求。
在这里我们强调的是申报产品核心技术的 发明专利,审评的是产品的核心技术专利 水平。并不是审评申报企业的专利数量和 专利水平。因此申报材料中没必要,也不 该把企业的所有专利罗列一遍,即便是把 与申报产品同类的发明专利罗列也是没有 必要的。喧宾夺主,反而把申报产品的发 明点、创新点淡化了,适得其反。完整的 Nhomakorabea件包括:
(1)已批准发明专利的产品,专利文件应包括: 发明专利批准证书和专利全文(含:摘要、权利 要求、说明书等内容)
(2)已有公开的发明专利的产品,专利文件应 包括:发明专利受理通知书,发明专利公开的通 知书(或公告)和公开的专利全文(含:摘要、 权利要求、说明书等内容)。
(3)购买发明专利权的产品(或已公开发明 专利):除提供上述文件1(或文件2)外,还 需提供购买专利合同(有盖章及签字正式合 同)的副本,以及专利局有关专利权人变更 的通知(或公告)。
在这里,还有一项工作对于今后产品上市是很重要的,就 是申报产品安全风险管理报告。新的《医疗器械管理条例》 十分重视风险管理。风险管理是一个产品管理环节,它是 一个过程管理。在产品开发的整个过程不断地进行风险分 析与管理,把所有在开发过程中发现的产品风险因素通过 管理转化为可控制因素,从而实现产品的最终风险控制。
2、产品主要工作原理/作用机理为国内首创,产品性能或 者安全性与同类产品比较有根本性改进,技术上处于国 际领先水平。
3、该产品具有显著的临床应用价值。 4、已完成该产品的前期研究并具有基本定型产品,研究过
程真实和受控,研究数据完整和可溯源。
三、关于发明专利
发明专利是企业产品自主知识产权 的法律文件,也是保护创新医疗器械 知识产权的根据。
谢 谢!
为此,创新医疗器械特别审批的审评中特 别关注:申报的产品有没有发明专利以及 该发明专利保护的是不是产品的核心技术。 国家局希望批准的创新医疗器械知识产权 能得到国家法律的保护。
对创新医疗器械的核心技术的专利水平 要求是很高的,要求核心技术在国内申 报的产品中是首次使用,而且是该核心 技术的使用使产品的性能有显著提高, 居国际领先水平。
五、产品具有显著的临床应用价值
这里指申报的创新医疗器械与已在临床应用的 同类产品相比,或者与临床的“金标准”相比, 它在有效性、安全性以及降低临床费用这三方 面,有一方面有特别的贡献,数据与统计学分 析能说明问题,即可以认为应该具有显著的临 床应用价值。
创新医疗器械的临床应用,往往伴随一种疾病 新的临床解决方案的诞生。新的与传统的临床 解决方案相比,一定要在优势。这种优势不仅 企业要用产品设计验证性能的数据说话,更需 要文献资料的证明以及动物实验的数据以及结 果加以佐证。
四、创新产品应该是国内首创
强调的是:
(1)产品主要的作用原理/作用机理为国内首创; (2)产品的性能或安全性有根本改进,技术处于
国际领先水平。
实际上这一条是对发明专利的技术水平的要求。 产品的发明专利也好,核心技术的发明专利也 好,必须是国内首创。国内首创的概念是指国 内没有相同的产品被国内各级医疗器械管理机 构批准上市。
审查申报创新医疗器械产品发明专利 的过程中我们感到一些问题是企业应 该避免、需要改进的和引起重视的。
1、不符合国家食品药品监督管理局 《创新医疗器械特别审批程序》对申 报产品有关专利的要求的产品,这些 申报资料千万不要报。
2、申报资料中有关产品核心技术中国发明专利 的相关文件不齐全,均不会批准。
其中,权威机构、著名专家发表的文章, 尤其是与产品开发研究相关的专家在国内 外著名刊物发表的署名文章最能说明问题。
创新医疗器械特别审批的审评不要求企业必须进 行和完成产品的临床验证。但是,若企业能提供 申报产品临床验证的完整报告,哪怕是部分临床 案例的总结报告,方法与结果正确。那么必定会 提高该产品获得创新医疗器械特别审批的几率。
对一些产品,影响其定型的特殊性能验证应 完成,如:体内植入物与导管的动物实验, 耐疲劳实验,免疫原性验证,病毒灭活验证 等实验。
申请创新医疗器械特别审批,性能检测不一定 要全部完成,但制定好技术要求与产品标准还 是很重要的工作,能提供也是产品基本定型的 佐证。没有也不影响审批。
以上四个方面的工作同时都完成了,符合 条件才能通过专家审评。之后,尚需经创 新办工作会议审核通过,以及公示征求意 见。都通过了才能认为被批准成为创新医 疗器械特别审批的产品。
按新的医疗器械注册管理办法规定,《需进行临 床试验审批的第三类医疗器械目录》中的医疗器 械,临床试验是必须经国家总局批准方能在临床 实施。因为,创新医疗器械就大多数而言,它的 临床方案问题较多,特别是它的适应症、禁忌症 以及方案设计计算,对照组与主要考核指标的选 择都容易出错,多听一些审查员及临床专家的意 见,绝对不会错。
其次,是临床验证的中期检查总结,希望企业 能开展此项工作,以便发现临床方案的问题并 及时调整。对于创新医疗器械下一阶段的申报 注册又是一个重要环节,虽与创新医疗器械特 别审评关系不大,但与产品注册关系很大务请 重视。
六、申报的产品已完成前期工作并有基本 定型产品
这里讲的前期工作是指按质量体系开发产品的要 求完成了:
问题是这二类机构出具的查新报告都有自己的局 限性。专利检索机构往往从专利的科学性、新颖 性和实用性这些方向来出具报告。信息机构的报 告往往从申请者的创新点与文献中的相比有没有 相同性来论述。当然这些报告,很好,符合我们 法规的规定。
问题是评审必须了解的申报产品从工作原理与 作用机理为国内首创,国内没有申报产品上市, 尤其是同类产品上市的情况。再有申报产品的 性能或安全性与同类产品比较有没有达国际领 先水平。这些查新资料,企业在产品的研发过 程应了解,在设计输入中应形成报告并在申报 资料中应提供。实践中发现提供这些资料的单 位很少。影响产品的批准。
申报资料中安全风险管理报告要体现过程管理的概念,各 阶段的风险管理都要包括其中。
还有一个要强调一下,凡是申报产品是省部 级以上批准的项目,务请将批准原件的盖章 复印件附上。审评中,在相同条件下,优先 通过省部级以上批准的项目。
由于本项目的审评工作2014年3月才开始,中国 食品药品监管局欢迎和境内外的企业合作搞好 创新医疗器械特别审批工作,欢迎多提意见和 建议,改进工作。
国家创新医疗器械特别审批项目 审评实务
一、为什么要设立国家创新医疗器械特别审批程序? 二、那些医疗器械产品属于创新医疗器械? 三、关于发明专利。 四、创新产品应是国内首创。 五、产品具有显著的临床应用价值。 六、申报的产品已基本定型。
一、为什么要设立国家创新医疗器械 特别审批程序?
1、随着科学技术的进步,医疗器械在临床疾病的 预防、诊断、治疗中的作用越来越显得重要。为 了鼓励医疗器械的研究与创新,推动我国医疗器 械的发展,提高产品的安全有效和技术水平,加 快医疗器械的上市速度,减少投入,让更多创新 的高科技医疗器械快速受惠于普通百姓,中国食 品药品监督管理局颁布了《创新医疗器械特别审 批程序(试行)》。
(4)购买产品发明专利使用权,除提供上述 文件1(或文件2)外还需提供购买专利使用权 的合同(要求同3)及公证机关的公证书。
3、光有国外专利和国际专利,这些专利没 有在中国申请注册发明专利并已公开或取 得发明专利。这些专利的产品,尽管技术 水平不低,申请创新医疗器械特别审批也 不会获得批准。原因是这些产品的知识产 权不能在中国得到法律保护。
