国家创新医疗器械特别审批的项目45页PPT
创新医疗器械特别审批申请资料模板-4产品研发过程及结果的综述

XXXXX检测试剂盒(XXXXX法)4. 产品研发过程及结果的综述XXXXX有限公司目录4.1立项依据 (4)4.1.1背景介绍 (4)4.1.1.1全球的发病情况 (4)4.1.1.2中国的发病情况 (4)4.1.1.3临床现状 (4)4.1.1.4目前现有的检测技术 (4)4.1.1.5需要解决的关键点 (4)4.1.2项目概况 (4)4.2研发过程 (4)4.2.1项目设计开发策划阶段 (4)4.2.1.1必要性分析 (5)4.2.1.2可行性分析 (5)4.2.2项目设计开发输入阶段 (6)4.2.1.1依据的法律法规和标准 (6)4.2.1.2预期用途与技术原理 (6)4.2.1.3方法的选择 (6)4.2.1.4技术设计 (6)4.2.1.5工艺设计 (7)4.2.1.6性能要求设计 (7)4.2.1.7研发进度安排 (8)4.2.3项目设计开发输出阶段 (9)4.2.3.1小试阶段 (9)4.2.3.2中试阶段 (12)4.2.3.3试生产阶段 (15)4.2.4项目设计开发验证阶段 (16)4.2.5项目设计开发确认阶段 (17)4.2.5.1临床试用 (17)4.2.5.2临床试验 (1)4.3结果综述 (2)4.4参考文献 (3)4.1立项依据4.1.1背景介绍(介绍相关疾病情况如临床表现、发病机理、我国每年发病率等、检测技术或手段的临床现状、目前的检测手段存在的问题、需要解决的关键点等。
)4.1.1.1全球的发病情况4.1.1.2中国的发病情况4.1.1.3临床现状4.1.1.4目前现有的检测技术4.1.1.5需要解决的关键点4.1.2项目概况(简单介绍本项目的一些基本情况,如项目来源,立项背景,将来规划,临床意义等。
)4.2研发过程XXXXXX试剂盒的临床前研究从20XX年X月开始,至今已完成的研究工作分成如下五个阶段:●项目设计开发策划阶段●项目设计开发输入阶段●项目设计开发输出阶段●项目设计开发验证阶段●项目设计开发确认阶段4.2.1项目设计开发策划阶段4.2.1.1必要性分析(综述)4.2.1.2可行性分析(从技术可行性、临床可行性、市场可行性进行介绍。
我国医疗器械监管PPT课件

3.1 注册上市(3)
需要注册的是特定的医疗器械产品,可能是某一
个或某一些。但必须是确定的。
注册证是产品的唯一身份证明。
注册证由注册证书和注册登记表两部分组成,必
要时还附有附件。
注册证的时效性。
3.1 注册上市(4)
技术审评是注册中的重点工作,具体工作 由事业单位(技术审评中心)来承担
守,而是一类或一大类产品都遵守的共性要求。
பைடு நூலகம்例:
ISO10993 GB/T16886 医疗器械生物学评价标准
门认为风险可接受时,即可批准产品上市
被批准上市的医疗器械
合理风险 受益大于风险 风险可接受 上市前产品
3.1 注册上市(7)
医疗器械注册工作发展趋势(1): 1. 提高注册资料的技术要求,加强对注册资料 真实性有效性的审查以保证产品的安全性. 2.通过标准体系建设和发布”技术指导原则” 引导
企业从产品研发阶段就将安全性、有效性放
1979年至1998年国家医药管理局改为国务院
直属机构,承担医疗器械监督管理职责;
1998年组建国家药品监督管理局,直属国务
院,负责医疗器械监督管理;
1.2 SFDA监督管理机制的现状(1)
2003年组建国家食品药品监督管理局,直属
国务院,负责医疗器械监督管理;
2008年为理顺食品药品监管体制,国家食品
6802 6803 …… 6821 6822 6823 …… 6840 6841 6858 6863 6864 …… 6870 6877
基础外科手术器械 显微外科手术器械 神经外科手术器械 …………. 医用电子仪器设备 医用光学器具、仪器及内窥镜设备 医用超声仪器及有关设备 ……………… 临床检验分析仪器及诊断试剂 医用化验和基础设备器具 医用冷疗、低温、冷藏设备及器具 口腔科材料 医用卫生材料及敷料 …………. 软件 介入器材
医疗器械注册资料格式和批件的说明PPT参考幻灯片

和批准证明文件格式的公告 (2014年第43号)
1
日期:2014年09月05日 发布, 2014年10月1日起 施行
依据:《医疗器械监督管理条例》(国务院令 第650号)和《医疗器械注册管理办法》(国 家食品药品监督管理总局令第4号)
2
一、申报资料:
9
+ (三)型号规格
+ 对于存在多种型号规格的产品,应当明确各型号规格的区别。 应当采用对比表及带有说明性文字的图片、图表,对于各种型 号规格的结构组成(或配置)、功能、产品特征和运行模式、性 能指标等方面加以描述。
+ (四)包装说明
+ 有关产品包装的信息,以及与该产品一起销售的配件包装情况; 对于无菌医疗器械,应当说明与灭菌方法相适应的最初包装的 信息。
1.医疗器械注册申报资料要求及说明 2.医疗器械延续注册申报资料要求及说明 3.医疗器械注册变更申报资料要求及说明 4.医疗器械临床试验审批申报资料要求及说明
二、批件格式:
1.中华人民共和国医疗器械注册证(格式) 2.中华人民共和国医疗器械注册变更文件(格式) 3.国家食品药品监督管理总局医疗器械临床试验批件(格式)
10
《医疗器械监督管理条例》第七十六条 本条例下列用语的含义: 医疗器械,是指直接或者间接用于人体的仪器、设备、器
具、体外诊断试剂及校准物、材料以及其他类似或者相关的物 品,包括所需要的计算机软件;其效用主要通过物理等方式获 得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然 有这些方式参与但是只起辅助作用;其目的是:
+ 3.境外申请人在中国境内指定代理人的委托书、代理人承诺书 及营业执照副本复印件或者机构登记证明复印件。
2024版医疗器械PPT模板

制定研发计划、时间节点、资源预算等。
2024/1/26
18
设计与开发阶段
1 2
设计输入 将需求转化为设计输入,包括功能、性能、接口 等要求。
设计输出 完成产品设计,包括结构、电路、软件等设计文 件。
3
设计评审
组织专家对设计进行评审,确保设计符合要求和 规范。
2024/1/26
19
试验验证阶段
医疗器械PPT模板
2024/1/26
1
目录
2024/1/26
• 医疗器械概述 • 医疗器械核心技术 • 常见医疗器械介绍 • 医疗器械研发流程与规范 • 医疗器械生产管理与质量控制 • 医疗器械市场营销策略与推广手段
2
01 医疗器械概述
2024/1/26
3
定义与分类
2024/1/26
定义
医疗器械是指用于预防、诊断、治 疗、缓解人类疾病、损伤或残疾的 设备、器具、器材、材料或其他物 品。
14
辅助类器械
2024/1/26
医用导管与介入器材
如导管、导丝等,用于引导手术器械进入体内或输送药物。
医用敷料与包扎材料
如纱布、绷带等,用于伤口包扎和止血。
医用高分子材料制品
如输液器、注射器等,用于药物的输送和注射。
15
康复类器械
2024/1/26
理疗设备
01
如超声波治疗仪、红外线治疗仪等,用于缓解疼痛和促进伤口
03
价格调整机制
根据市场变化和客户需求,灵活调整产品价格,以保持竞争优势和市场
份额。同时,要关注政策法规的变化,确保价格策略合规合法。
31
THANKS
感谢观看
2024/1/26
一文解析“创新医疗器械特别审批程序”
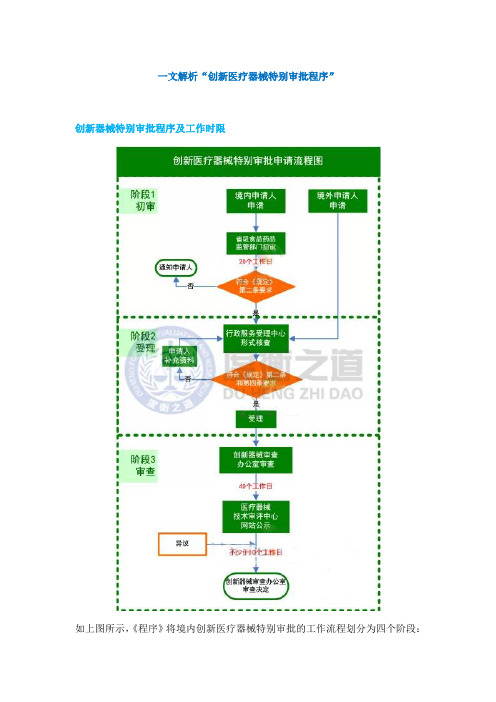
一文解析“创新医疗器械特别审批程序”创新器械特别审批程序及工作时限如上图所示,《程序》将境内创新医疗器械特别审批的工作流程划分为四个阶段:初审、受理、审查、公示;境外创新医疗器械特别审批的工作流程仅包含三个阶段:受理、审查、公示。
《程序》限定初审应于20个工作日内完成,审查应于40个工作日内完成,公示应≥10个工作日。
据此是否可以估算境内创新器械特别审批申请应在≤70个工作日内获得审查结果;境外创新医疗器械特别审批申请应在≤50个工作日内获得结论呢?可能还需考虑申请人提供信息有欠缺或进行补充资料的情况。
依据法规事务经验,在初审、受理、审查这三个环节,企业均面临补正资料或补充资料的可能。
但《程序》并未明确提及资料的补充、期限和复审期限。
其中,补充资料时间企业必须根据材料的缺失程度和补正所需周期估算。
此外,在《程序》中并未对受理以及资料流转给予时间限定。
依据现有要求,受理与流转时限为8个工作日。
但是由于这部分时间涉及到多个部门之间的交接问题,在同类情形中也出现过超出时限、难以推进的情况。
提请各位注意,对于境内创新医疗器械还需估算企业所在地省级食品药品监督管理部门的受理及结转的时限。
具体可参照当地的相关配套文件。
“创新特别审批”将给与企业哪些优待?我们将创新产品的上市划分为两个阶段:创新医疗器械特别审批申请阶段和创新医疗器械注册申请阶段。
第二阶段是建立在第一阶段基础上的。
这两个阶段《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)(以下简称《程序》)究竟为企业创造了哪些便捷和优待?请参见下图(以境内创新产品为例)。
此处要提请广大会员注意的是:在第一阶段中,《程序》给予企业最大的优待政策是在产品注册申请受理前以及技术审评过程中,指定专人,应申请人的要求及时沟通、提供指导,共同讨论相关技术问题。
沟通交流应形成记录,供该产品的后续研究及审评工作参考。
沟通内容至少涉及两个方面:一方面是审查产品的创新性;另一方面,也是创新企业的沟通重点,是在指定专人的条件下,就重大技术、安全、临床方案问题与技术审评中心在产品最终定型注册申请前进行充分的沟通和分步确认。
第二类医疗器械创新医疗器械特别审批中的体现临床应用价值的资料

第二类医疗器械创新医疗器械特别审批中的体现临床应用价值的资料摘要:一、第二类医疗器械的定义和分类二、创新医疗器械特别审批的背景和意义三、临床应用价值在特别审批中的体现四、临床应用价值资料的具体要求和审查标准五、案例分析:某第二类创新医疗器械特别审批过程正文:一、第二类医疗器械的定义和分类根据我国《医疗器械监督管理条例》规定,医疗器械分为三类,其中第二类医疗器械是指对人体具有潜在危险,需要严格控制其安全性、有效性的医疗器械。
这类医疗器械包括心脏起搏器、人工关节、人工晶体等。
二、创新医疗器械特别审批的背景和意义为了鼓励医疗器械研究和创新,支持新技术的推广和应用,国家食品药品监督管理局(CFDA)于2014 年发布了《创新医疗器械特别审批程序》。
该程序旨在加快创新医疗器械的审批速度,缩短患者等待治疗的时间,提高患者的生活质量。
三、临床应用价值在特别审批中的体现在第二类医疗器械创新医疗器械特别审批中,临床应用价值是重要的评审依据。
具体体现在以下几个方面:1.产品能否解决临床急需,提高疾病诊断、治疗或预防效果;2.产品是否具有显著的临床优势,如安全性、有效性、便利性等;3.产品是否有助于推动医疗器械产业发展和技术进步。
四、临床应用价值资料的具体要求和审查标准在申请创新医疗器械特别审批时,申请人需要提交临床应用价值的资料,包括:1.产品的临床应用背景和需求;2.产品的临床研究方案和已完成的研究成果;3.产品的临床效果和安全性评估;4.产品的市场前景和临床推广策略。
审查标准方面,CFDA 主要从临床急需、显著临床优势、推动产业发展和技术进步等方面进行评估。
五、案例分析:某第二类创新医疗器械特别审批过程以某公司研发的人工心脏瓣膜为例,该产品通过特别审批程序,成功获得了上市许可。
在审批过程中,该公司充分展示了产品的临床应用价值,包括:1.人工心脏瓣膜能够有效替代受损心脏瓣膜,治疗心脏瓣膜疾病;2.产品具有优良的生物相容性和耐久性,降低了患者术后并发症风险;3.产品采用了创新的设计理念和技术,提高了手术成功率。
《医疗器械注册申报》PPT课件.ppt

创新医疗器械
Inno vating Medical D evice
创新医疗器械申报的前提条件:
有专利
申请人经过其技术创新活动,在中国依法拥有产品核 心技术发明专利权,或者依法通 过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院 专利行政部门公开。
有创新
产品主要工作原理/作用机理为国内首创,产品性能 或者安全性与同类产品比较有
医疗器械法律法规
La w s And Regulations
医疗器械法规主干结构
《条例》
国务院发布
《办法》 《规范》
国家食品药品监 督管理局发布
《指导意见》《实施细则》
<医疗器械监督管理条例> 于2014年2月12日国务院第 39次常务会议修订通过, 3月7日李克强总理签发, 为国务院令第659号。2014 年6月1日起实施。
医疗器械注册法规
The Registration regulations of Medical instruments
2016-01-28
01
Partone 医疗器械的介绍
目录
02
Parttw o 医疗器械注册申报
03
Partthree 医疗器械注册申报常
见问题
PART 1
医疗器械的介绍
医疗器械是指直接或者间接用于人体的仪器、设备、器具、 体外诊断试剂等,包括所需要的计算机软件
延续注册申请期限?
医疗器械注册证有效期届满,注册人应当在 有效期届满 6个月前申请延续注册,并按照相关 要求提交申报资料。除 以下情形 :未在规定期 限内提出延续注册申请、强制性标准已经修订, 该器械未达到新要求、重大公共安全急需的医 疗器械外,接到延续注册申请的管理部门应当 在有效期届满前作出准予延续的决定, 逾期未 作决定 的,视为准予延续。
国家创新医疗器械特别审批项目

在这里,还有一项工作对于今后产品上市是很重要的,就 是申报产品安全风险管理报告。新的《医疗器械管理条例》 十分重视风险管理。风险管理是一个产品管理环节,它是 一个过程管理。在产品开发的整个过程不断地进行风险分 析与管理,把所有在开发过程中发现的产品风险因素通过 管理转化为可控制因素,从而实现产品的最终风险控制。
(1)设计输入; (2)产品设计验证(有效性、安全性、动物试验 等验证工作);
(3)产品设计输出。
同时,根据设计输出,进行:
1)生产工艺设计; 2)生产工艺验证; 3)工艺过程质量控制; 4)产品的质量控制(性能指标、检测方法 与验证、生物学评价、产品货架说明验证、灭菌 验证、包装性能验证等)。
问题是这二类机构出具的查新报告都有自己的局 限性。专利检索机构往往从专利的科学性、新颖 性和实用性这些方向来出具报告。信息机构的报 告往往从申请者的创新点与文献中的相比有没有 相同性来论述。当然这些报告,很好,符合我们 法规的规定。
问题是评审必须了解的申报产品从工作原理与 作用机理为国内首创,国内没有申报产品上市, 尤其是同类产品上市的情况。再有申报产品的 性能或安全性与同类产品比较有没有达国际领 先水平。这些查新资料,企业在产品的研发过 程应了解,在设计输入中应形成报告并在申报 资料中应提供。实际工作中发现提供这些资料 的单位很少。影响产品的批准。
按新的医疗器械注册管理办法规定,《需进行临 床试验审批的第三类医疗器械目录》中的医疗器 械,临床试验是必须经国家总局批准方能在临床 实施。因为,创新医疗器械就大多数而言,它的 临床方案问题较多,特别是它的适应症、禁忌症 以及方案设计计算,对照组与主要考核指标的选 择都容易出错,多听一些审查员及临床专家的意 见,绝对不会错。
6、关于发明专利的组合。资料中理想的发明专 利组合应该是:
最新医疗器械监管新规定ppt课件精品课件

(续四)新旧注册管理办法主要区别
十四、对于已注册受理的器械申请,在行 政许可决定前,企业可申请撤回注册申请 材料。
十五、对于注册评审有异议的,企业可申 请复审。
十六、对分类目录里面没有企业申请注册 产品的,申请人可直接按三类申请,或先 申请分类界定后,再办理注册或备案。
四、新医疗器械生产监督管理办法
《医疗器械生产监督管理办法》于2014 年6月27日经国家食品药品监督管理总局 局务会议审议通过,以国家食品药品监督 管理总局局令第7号公布
实施时间(2014年10月1日) 《医疗器械注册管理办法》共七章七十一
条
新旧生产监督管理办法主要区别
一、由原先的一类生产企业告知性登记调整 为一类生产企业备案。
(续五)新旧注册管理办法主要区别
十七、注册证登记事项变更,变更批件同 原注册证一并使用,企业自行修订自己的 产品技术要求、说明书。
十八、注册证有效期满,由原来换证改为 延续,证号不变。但产品类别有调整的, 需重新编号。
十九、一类产品备案在第地市局办理。
(续六)新旧注册管理办法主要区别
二十、产品类别调整有规定,由高类别划 到低类别,注册证继续有效,直至有效期 满为止;由低类别划到高类别,以国家局 通知为准,及时申请注册证变更。
二、拟注册产品没有国家或行业标准,企 业在提交产品产品技术要求注册资料时, 建议企业考虑产品技术要求的溯源。
三、接到技术审评机构补正、补充通知时 ,要看清楚补正、补充内容,并及时上报 补充材料。
(续)办理产品注册时应注意的问题:
四、制定产品技术要求时,要考虑国家总局 对产品说明书和标签管理规定。
中国创新医疗器械特别审批程序介绍新版特别审

3.该产品具有 显著的临床应 用价值。
3. The product has significant value in clinical application.
学习改变命运,知 识创造未来
中国创新医疗器械特别审批程序介绍新版特别审
4.已完成该产 品的前期研究并 具有基本定型产 品,研究过程真 实和受控,研究 数据完整和可溯 源。
• 医疗器械检测机构 • Testing institution for
应当在接受样品后 medical devices
优先进行医疗器械 shall make a
注册检测,并出具 registration test
检测报告。
for medical devices in
priority after
accepting samples , and
布了《创新医疗器械 特别审批程序(试行 )》。
(SFDA) issued Special Approval Procedure on Innovative Medical Devices (trial).
学习改变命运,知 识创造未来
中国创新医疗器械特别审批程序介绍新版特别审
一、哪些医疗器 械产品属于创新 医疗器械,可以 申报特别审批。
中国创新医疗器械特别审批程序介绍新版特别审
• 已受理注册申报 • For the innovative 的创新医疗器械 medical devices that
,食品药品监管 have been declared to
总局医疗器械技 accept the registration,
术审评中心应当 Center for Medical
医疗器械监管 ppt课件

ppt课pp件t课pp件t课件
13
一类:如外科用手术器械(刀、剪、钳、 镊夹、针、钩)、听诊器(无电能)、反 光镜、反光灯、医用放大镜、(中医用) 刮痧板、橡皮膏、透气胶带、手术衣、手 术帽、检查手套、集液袋
21
◆通用标准
一些具有共性要求、不只是某一个、某一些产 品要遵守,而是一类或一大类产品都遵守的共性要求。 如: ISO10993 GB/T16886 医疗器械生物学评价标准 IEC60601 GB9706 医用电气设备安全标准
ppt课pp件t课pp件t课件
22
◆管理标准
一般是从技术管理、质量管理的角度,对企 业的生产技术工作作出的规定。
例:GB16174.1-1996 心脏起搏器 GB12279-1990 人工心脏瓣膜标准
ppt课pp件t课pp件t课件
24
四、医疗器械注册管理
ppt课pp件t课pp件t课件
25
注册管理
◆境内一类:由设区的市级药监局审查批准,并 发给产品注册证书;注册证有效期四年。
ppt课pp件t课pp件t课件
9
医疗器械监管法规
◆规范性文件(举例)
(1)医疗器械分类目录; (2)境外医疗器械生产企业质量体系审查实施规定; (3)角膜塑形镜经营验配监督管理规定; (4)一次性使用无菌医疗器械(注、输器具)生产实施细则; (5)一次性使用无菌医疗器械经营企业资格认可实施细则(暂行); (6)医疗器械生产企业日常监督调度管理规定(试行); (7)医疗器械检测机构资格认可办法(试行)………
颁布) 2000.4.1.实施 (修订中)
ppt课pp件t课pp件t课件
医疗器械的监督管理PPT演示课件

12
有关问题讨论
• 组成复杂、多产品组合的判断 (各种包)
• 性能组合、可分为不同大类的情况(胎 监)
2020/10/1
广东省药品监督管理局
13
七、医疗器械生产企业许可证、 备案表
• 生产二.三类产品,应有相应范围的许可证
• 生产一类产品,应登记
2020/10/1
广东省药品监督管理局
14
八、医疗器械标准
• 分列式(一个型号一个注册证) • 有利销售
2020/10/1
广东省药品监督管理局
18
十、医疗器械产品质量检验
1、国家级12个国家级检验机构、检验范围 2、检验分类:(试产、准产注册)检验、周期检验、
质量监督抽查、质量体系认证检验
3、检验报告 4、企业自己进行的检验
A.出厂检验 B.中间过程检验 C.安装验收
2020/10/1
广东省药品监督管理局
9
四、我国医疗器械市场的现状、 问题和发展方向
2020/10/1
广东省药品监督管理局
10
五、医疗器械办证程序
• 2、产品注册证 标准制定
•
↓
•
法定检测机构检测
•
↓
•
临床验证、制定临床方案
•
↓
•
临床验证报告
•
↓
•
产品注册评审
2020/10/1
广东省药品监督管理局
• 医院要求办注册证的就是医疗器械? • 用于运动科学的仪器是医疗器械? • 美容产品是医疗器械? • 各种软件是医疗器械?
2020/10/1
广东省药品监督管理局
7
二、医疗器械的特点
• 1、是和药品一样直接关系人民群众生命 安全的特殊商品;
创新医疗器械特别审查公示总结

【创新医疗器械特别审查公示总结】一、引言创新医疗器械是指具有创新性、独特性、高技术含量和高风险的医疗器械产品,因此在审查上也具有一定的特殊性。
近期,国家药监局发布了一批创新医疗器械特别审查公示,这些产品涉及到多个领域,包括医疗影像、介入治疗、体外诊断、植入材料等。
本文将就此进行全面评估和总结,以期深入了解创新医疗器械特别审查的相关内容。
二、创新医疗器械特别审查内容概述根据公示内容,这批创新医疗器械产品涉及的技术创新点较为突出,包括但不限于:新的设计理念、新的材料应用、新的技术手段等。
这些创新点在一定程度上带来了医疗器械在临床应用中的效果提升和安全性增强,对患者的治疗和康复产生了积极的影响。
三、创新医疗器械特别审查公示部分产品总结1. 医疗影像领域在医疗影像领域,一些创新医疗器械产品在影像成像清晰度、对比度以及辐射剂量等方面有了明显改进。
其中,部分产品采用了先进的影像重建技术,使得影像在诊断上更加精准可靠,极大地提升了临床影像诊断的准确性。
2. 介入治疗领域在介入治疗领域,一些创新医疗器械产品在操作便捷性和治疗效果上取得了显著突破。
对于某些疾病,这些产品能够实现微创、精准治疗,大大降低了手术风险和患者的痛苦,也提高了治疗的成功率。
3. 体外诊断领域在体外诊断领域,一些创新医疗器械产品在检测灵敏度和特异性上有了显著提升。
新型的检测技术不仅能够提供更为准确的诊断结果,还能够缩短检测时间,为临床诊断提供更为及时的依据。
4. 植入材料领域在植入材料领域,一些创新医疗器械产品在生物相容性和植入效果上取得了明显进展。
这些新型材料不仅能够更好地与人体组织相融合,还能够释放药物以实现更好的治疗效果,为患者的康复带来了更多的希望。
四、个人观点和理解共享在我看来,创新医疗器械的特别审查十分重要。
创新医疗器械产品的推出可以为医疗行业注入新的活力,带来更多更好的治疗选择;另专门的审查机制也能够确保这些创新产品的安全性和有效性,为患者提供更多的保障。
医疗器械技术审评实施程序PPT课件

12000 10000
8000 6000 4000 2000
0
审评任务
850 1997年
1500 2000年
11233
6737
注册申报量 增加了10倍之多
2008年
2014年
产品技术审评情况
近6年总局器械审评中心转入及审结项目情况
12000 11000 10000
9000 8000 7000 6000 5000 4000 3000 2000 1000
主任
副主任 副主任
审评 二处
审评 三处
审评 四处
综合 业务处
业务管理协调 专家咨询
有源器械
无源
体外
无源
植入器械 诊断用品 非植入器械
中心当前内设机构图
审评一处 负责有源医疗器械产品的技术审评。
磁共振成像系统
生物电子耳
心脏起搏器
审评二处 负责无源产品(主要是植入类)的技术审评。
血管支架
颅骨网板
审评三处 负责临床检验仪器及体外诊断试剂的技术审评。
技术规章
技术咨询管理规范 专家咨询管理规范
补充资料管理规范 退审管理规范
纠错管理规范 说明书备案审查管理规范
应该知晓和掌握的知识
技术规范编制情况
55项指导原则 20项审评要点 35项审评规范 有效规范申请人的注册申报资料,提高其质量和水平。
有源产品技术指导原则
医用磁共振成像系统注册技术 审查指导原则
合
以器械作用为主的申报器械 审评
产
由局器械审评中心牵头审评
品
药品部分由药审 中心同步审评
并出具审评结论
器械部分由器审 中心同步审评
并出具审评结论
创新医疗器械申报法规宣讲PPT

权利要求书 说明书
检索报告 手续合格通知书
类型 复印件 复印件 复印件 原件 复印件
备注 如受让或变更
• 合格的专利证书或通知书 • 发明专利证书、 • 发明专利申请公布通知书、 • 发明专利申请进入实质审查阶段通知书、 • 发明专利申请公布及进入实质审查阶段通知书、 • 授予发明专利通知书等
审批流程
专家5-7人(基础研究和临床应用领 域),会审1-2小时,企业不参与。
会审结束给出审查结论及不同意理由, 无发补。
递交省局
• 20个工作日 • 初审意见
国家局
• 60个工作日
网上公示
• 至少10个工 作日
审查结果 网站告知 (5年有效)
不批准, 终止
不批准, 终止
注:如不批准,可补充资料后 重复申报,审核专家不变
解读: ✓ 在中国依法拥有产品核心技术发明专利权 ✓ 发明专利应具备新颖性和创造性
证明资料:
(二)产品知识产权情况及证明文件。
基本要素1-专利
已授权的专利
文件名称 专利授权证书 权利要求书
说明书 专利登记簿副本 专利实施许可合同备案证明
类型 复印件 复印件 复印件 原件 原件
备注 如受让
未授权的专利
✓指导用药产品应有用药案例。
基本要素3-显著临床价值-已有数据分析
•临床上其他方法学结果的一致率分析
• 形成报告,签字盖章。
申报资料
申请书及以下资料: (一)申请人企业法人资格证明文件。 (二)产品知识产权情况及证明文件。 (三)产品研发过程及结果的综述。 (四)产品技术文件。 (五)产品创新的证明性文件。 (六)产品安全风险管理报告。 (七)产品说明书(样稿)。 (八)其他证明产品符合本程序第二条的资料。 (九)境外申请人应当委托中国境内的企业法人作为代理人或者由其在 中国境内的办事机构提出申请。 (十)所提交资料真实性的自我保证声明。
