核外电子排布
核外电子排布

核外电子排布规律:(1)电子尽量先排能量低的电子层,再排能量高的。
(2)每个电子层最多能容纳22n个电子(3)最外层不能超过8个(4)次外层不能超过18个,类推倒数第三层不能超过32个电子。
怎样确定原子的电子层排布唐荣德一、电子层容量原理在原子核外电子排布中,每个电子层最多容纳的电子数为2n2,这个规律在一些无机化学教材中叫做最大容量原理。
我认为,该原理并不能全面反映原子核外电子排布的真实情况,其一,它只适合于离核近的内电子层,且不是最大,而是等于2n2;其二,离核远的外电子层,实际排布的电子数则远远小于2n2,根本不能用此原理来描述。
离核近的内电子层与离核远的外电子层,各有其电子容量的规律,原子的电子层排布,就是这两种规律结合而成的。
为此,我总结出内电子层和外电子层的各自的容量规律,并将两者结合起来,称为“电子层容量原理”,其内容如下:设ω为原子的电子层数,n为从原子核往外数的电子层数,m为由原子最外层往里数的电子层数。
当n<22ω+时,为内电子层,每个电子层容纳的电子数=2n2。
当n≥22ω+时,为外电子层,每个电子层最多容纳的电子数=2(m+1)2。
核外只有k层时,最多容纳2个电子。
由上述两个关系组成的电子层排布如下:从以上图示可知,原子的电子排布是两头少,中间多。
应用电子层容量原理,可使外电子层不用2n2,避免出现太大偏差。
应用外电子层的公式,可以取代中学教材中的如下规律:(1)最外层电子数不超过8个(最外层为K层,则不超过2个)。
(2)次外层电子数不超过18个。
(3)外数第三层电子数不超过32个。
……因为这些规律可直接从外电子层的公式推出。
稀有气体原子的电子层排布则是很规整的相等关系,其内电子层电子数为2n2,外电子层电子数为2(m+1)2,因此,稀有气体元素原子的电子层结构是一种稳定结构。
主族元素的原子,最外层未达到2(m +1)2个电子(即8个电子),一般副族元素的原子,最外层和次外层的电子数均小于2(m +1)2。
核外电子排布

3、核外电子排布的表示方法:
原子结构示意 :
• • • 小圈表示原子核; 圈内的“+”和数字表示原子核带正电和核内 质子数; 弧线表示电子层,弧线上的数字表示该层的电 子数。
一、核外电子排布
1、核外电子的分层排布 : 2、电子排布规律 :
3、核外电子排布的表示方法:
4、1~20号元素原子结构示意图: 5、原子核外电子排布的周期性变化:
1、核外电子的分层排布 :
离核远近 能量高低 电子层数 符号 1 K 2 L 3 M 近→远 高→低 4 N 5 O 6 P 7 Q
2、电子排布规律 :
3.有A、B两种元素,已知元素A的核电荷数为a, 且A3-与Bn+的电子排布完全相同,则元素B的核 电荷数为 ( ) A.a—n一3 B.a +n+33 4.由短周期两种元素形成化合物A2B3 ,A3+比 B2-少一个电子层,且A3+具有与Ne原子相同的 核外电子层结构,下列说法正确的是( )双选 A.A2B3是三氧化二铝 B.A3+与B2-最外层上的电子数相同 C.A是第2周期第ⅢA族的元素 D.B是第3周期第ⅥA族的元素
4、1~20号元素原子结构示意图:
5、原子核外电子排布的周期性变化:
• 同一周期,从左到右,最外层电子数由1 递增至8(第一周期,由1至2) ; • 同一主族,从上到下,电子层数递增。
• 1.A、B两原子,A原子L层比B原子M层少 3个电子,B原子L层电子数恰为A原子L层 电子数的2倍,则A、B分别是 ( ) A.硅和钠 B.硼和氮 C.碳和氯 D.碳和铝 • 2.某元素原子最外层电子数为次外层电子 数的3倍,则该元素原子核内质子数为( ) A.3 B.7 C.8 D.10
(完整版)核外电子排布规律总结

原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K 层为最外层时不能超过2个)次外层最多只能容纳18个电子(K 层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH 、N 、NH 、NH 、NH 、O、OH 、H O 、H O 、F 、HF 、Ne 、Na 、Mg 、Al 等。
4-3-23+4-2-23+-++2+3 ②18电子粒子:SiH 、P 、PH 、S 、HS 、H S 、Cl 、HCl 、Ar 、K 、Ca 、PH 等。
4-33-2-2-++2+4 特殊情况:F 、H O 、C H 、CH OH222263 ③核外电子总数及质子总数均相同的阳离子有:Na 、NH 、H O 等;阴离子有:++43+F 、OH 、NH ; HS 、Cl 等。
---2--前18号元素原子结构的特殊性:(1)原子核中无中子的原子:H11(2)最外层有1个电子的元素:H 、 Li 、Na ;最外层有2个电子的元素:Be 、Mg 、He(3)最外层电子总数等于次外层电子数的元素:Be 、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li 、P(6)电子层数与最外层电子数相等的元素:H 、Be 、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li 、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He 例外)(2)在元素周期表中,同周期的ⅡA、ⅢA 族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。
核外电子排布规律总结

核外电子排布规律总结1.周期性表现:元素的核外电子排布呈现周期性的特征,即每个周期(横行)中,核外电子的数量增加一格,直到达到最大值,然后重新从一开始增加。
这是因为每个周期都对应着一个新的能级,新的能级能够容纳更多的电子。
例如,第一周期(1s^2)能容纳的电子数最多为2个,第二周期(2s^2,2p^6)能容纳的电子数最多为8个,以此类推。
2.塞满次能级原理:每个次能级(能级中的电子轨道)先填满一个自旋相同的电子,然后再填入反自旋相反的电子。
这是因为同一次能级中的电子具有相同的能量,自旋相同的电子之间存在排斥,而反自旋的电子则可以共存。
例如,2s轨道中的两个电子的自旋相同,而2p轨道中的六个电子的自旋相反。
3.近核电子屏蔽原理:近核电子对核外电子的吸引力比较大,能够屏蔽核外电子与核之间的排斥作用。
因此,核外电子的有效吸引力与核电荷数并不完全成正比,而是受到近核电子屏蔽的影响。
例如,对于周期表中的同一周期来说,核外电子数量相同,但随着核电荷数的增加,核外电子的有效吸引力减小。
4.具体的元素周期表规律:根据元素周期表中的周期和族(纵列),我们可以总结出一些具体的规律。
例如,周期表中第一周期的元素(氢和氦)只有一个能级(1s),且最多只能容纳两个电子;第二周期的元素(锂、铍、硼、碳、氮、氧、氟、氖)具有两个能级(2s和2p),且最多只能容纳八个电子;第三周期的元素(钠、镁、铝、硅、磷、硫、氯、氩)具有三个能级(3s、3p和3d),且最多只能容纳十八个电子,以此类推。
此外,同一族的元素具有相似的核外电子排布,因为它们具有相似的化学性质。
5.化合价与核外电子数:化合价是元素的一个重要的化学性质,它与元素的核外电子数密切相关。
一般来说,阳离子的化合价等于核外电子数减去气体电子层(最高能级)的电子数,而阴离子的化合价等于气体电子层的电子数减去核外电子数。
这是因为阳离子通过失去核外电子来形成稳定的结构,而阴离子通过获得核外电子来形成稳定的结构。
原子核外电子排布规律是怎样的?

原⼦核外电⼦排布规律是怎样的?
原⼦核外电⼦排布要遵循什么规律呢?不知道的考⽣看过来,下⾯由店铺⼩编为你精⼼准备了“原⼦核外电⼦排布规律是怎样的?”,持续关注本站将可以持续获取更多的考试资讯!
原⼦核外电⼦排布规律是怎样的?
原⼦核外电⼦排布规律:电⼦总是尽先排布在能量最低的电⼦层⾥;每个电⼦层最多只能排布2n²个电⼦;K层为最外层时,最多只能容纳两个电⼦;其它各层为最外层时,最多只能容纳8个电⼦;次外层最多不超过18个电⼦。
⼀、排布规律
原⼦核外电⼦排布规律是指介绍原⼦核外电⼦的排布规律,主要有泡利不相容原理、能量最低原理、洪特定则、不相容原理等。
1、泡利不相容原理:每个轨道最多只能容纳两个电⼦,且⾃旋相反配对。
2、能量最低原理:电⼦尽可能占据能量最低的轨道。
3、洪特规则:当电⼦排布在同⼀能级(能量相同)的不同轨道时,总是优先单独占据⼀个轨道,⽽且⾃旋⽅向相同。
⼆、稀有⽓体元素原⼦电⼦层排布
三、核外电⼦排布的⽅法。
原子核外电子的排布需要遵循的三个原理

原子核外电子的排布需要遵循的三个原理“原子核外电子排布”是指原子核以外的电子以某种特定的模式存在于原子的外部。
这种模式由三个重要的原理决定:定律,原子数和能量状态。
定律:原子核外电子是按照一系列规则组织的,这些规则统称为原子核外电子排布定律。
根据经典牛顿力学及其波动形式,原子核外电子会以某种特定的排布形式存在,这种形式就是现代原子核外电子排布规则的精华内容。
主要的原子核外电子排布定律有巴斯特定律、晶体电荷定律、周期表排序定律等。
根据巴斯特定律,电子只能按照一定的规律存在于原子的外部,这些规律是由电子的能量状态和数量决定的。
原子数:原子核外电子排布的特定模式受原子核外电子的数量限制。
每种元素都有不同的原子核外电子数量,根据不同元素其原子核外电子数量不同,其原子核外电子分布模式也不尽相同。
例如氢原子只有一个原子核外电子,它的电子排布模式就是“1s1”;氦原子有两个原子核外电子,它的电子排布模式就是“1s2”。
能量状态:原子核外电子排布的特定模式受原子核外电子的能量状态限制。
电子的能量状态主要是指电子的动能与势能之间的平衡。
电子的动能是指电子的运动能量,电子的势能是指电子与原子核的相互作用能量。
电子的运动能量随着距离的增加而减小,而电子与原子核的相互作用能量随着距离的增加而增加。
由于电子的动能和势能之间的变化,电子的能量状态会随着其距离原子核的远近而变化。
电子在距离原子核较近时,其能量状态会变得十分紧张,而在距离原子核较远时,其能量状态会变得比较安定。
电子在它的能量状态变化中,会随着原子核的距离变化而变化,这种能量变化也影响了其在原子核外的排布。
总之,原子核外电子的排布是由定律、原子数和能量状态三个原理决定的。
在原子核外,由于原子核外电子的定律性,它们构成了一个由指定原子核外电子数量组成的能量状态,这一能量状态又决定了具体的原子核外电子排布模式。
通过对原子核外电子排布的原理有了深入的了解,有助于我们更好地理解原子核外电子排布以及元素的特性,为化学的研究奠定基础。
核外电子排布

能量最低原理
自然界任何体系,能量越低最稳定。因此,核外电子 在轨道上的排布,应使整个原子的能量处于最低状态, 即电子先充满能量低的轨道。 在同一个原子里,不存在四个方面的运动状态完全相 同的电子。
泡利不相容原理
H:1s1 Li:1s2 2s1 Na:1s22s22p63s1
He:1s2 B:1s22s22p1 Fe:1s22s22p63s23p63d64s2
核外电子排布
一、核外电子的运动特征
电子以很小的质量,极高的运动速度,在 极小的空间,做高速运动。
电子云:电子在原子核外出 现的概率密度分布。电子云 是核外电子运动状态的形象 化描述。
氢原子电子云剖面图
90%
电子云轮廓图的制作过程
二、电子运动状态的描述
电子层
符号 电子亚层数 电子亚层符号
一
二
三
四
B
↑↓ ↑↓ ↑↓ ↑ ↑
1s 2s
C
2p
N
2p1s 2sO源自2pKr:1s22s22p63s23p63d104s24p6
三、核外电子排布的规则
洪特规则
当电子排布在同一能级的不同轨道时,总是优 先占据一个轨道,而且自旋方向相同。
↑↓ ↑↓ ↑↓ ↑↓ ↑
↑↓ ↑
1s 2s
2p
1s 2s
2p
↑ ↑ ↑
1s 2s
2p
Li
↑↓ ↑↓ ↑ ↑
B e ↑↓ ↑↓
1s 2s
五
六
七
K
1 1s 2
L
M
3
N
4
O
5…
P
Q
2s2p
核外电子层电子排布图

锝 钌 铑 钯 银 镉 铟 锡 锑 碲 碘 氙 铯 钡 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 铪 钽 钨 铼 锇 铱 铂 金 汞 铊 铅 铋 钋 砹
Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At
6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6
10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10
0 0 0 0 0 2 3 4 6 7 7 9 10 11 12 13 14 14 14 14 14 14 14 14
6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6
10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10
氡 钫 镭 锕 钍 镤 铀 镎 钚 镅 锔 锫 锎 锿 镄 钔 锘 铹 * * * * * *
Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Unq Unp Unh Uns Uno Une
2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2
核外电子分层排布示意图

原子核
原子结构示意图
质子数(核电荷数)
要点: 圆圈标核电, 正号写在前, 弧线呈扇面,
电子数 电子层
数字一条线。
3、元素性质与元素最外层电子数的关系
元素分类 最外层电子数 得失电子倾向 (He为 不易得失、 稀有气体 8个(He为2个) 不易得失、相对 稳定 元素 金属元素 一般少于4个 一般少于4 化学性质 稳定
阳离子
物质与其构成粒子间的关系
[例1]六种粒子结构示意图分别为: 例
(1)A、B、C、D、E、F共表示 元素。 (2)表示原子的粒子是 下同)。 (3)表示离子的粒子是 ACF BDE
四
种 (填序号, 。
[例2]铜是由 铜元素 例 组成 铜原子 构成的;水 的,由 是由 氢元素和氧元素 组成的, 由 水分子 构成的;氯化钠 是由 氯元素和钠元素组成的, 由 钠离子和氯离子构成的。
课题3 离子
核外电子分层排布是分层排布的 电子层:1 2 3 4 5 离核:近 能量:低 6 7 远 高
能量低的在离核近的区域运动,能量高的 在离核远的区域运动
2、电子在电子层上的分布规律
第一层最多容纳2 第一层最多容纳2个电子 第二层最多容纳8 第二层最多容纳8个电子 18 第三层最多容纳18个电子 第三层最多容纳18个电子 2n2 个电子 第n层最多容纳 最外层最多容纳8个电子
5.右图是钠原子的结构示意图: 弧线表示 电子层 。 原子核内的质子数 11 。第二层上的电子数是 8 。 是 6.金属元素在化学反应中一般较易 失去 电 子,变成 离子,这是因为金属原 阳 少于 子最外层电子数目一般 4个。 7.某种原子结构简图为 ,该原子的 ,在化学反应中易 失 (填 核电荷数为 11 金属 “得”或“失”)电子,属 元素(填 “金属”或“非金属”)。
核外电子排布
C它有3个电子层
D.它的最外层有2个电子 2、右图为硫原子的结构示意图。 (1)硫原子核内质子数为 16 (2)硫离子的符号为 S ; ;
(3)硫元素属于 金属元素 素”)
(填“金属元素”或“非金属元
3、 1998年中国十大科技成果之一是合成氮化镓纳米 材料,已知镓(Ga)的原子结构示意图如下图(甲) 31 所示,则x的值为________ ,镓元素的化学性质与下列 B 哪种元素的化学性质最相似________ (在A、B、C图 中选择,填字母);下列所示的四种元素最本质的区 质子数不同 别是_________________________ 。
铵根离子碳酸根离子来自12Mg2 82
+16
2 8 6
S
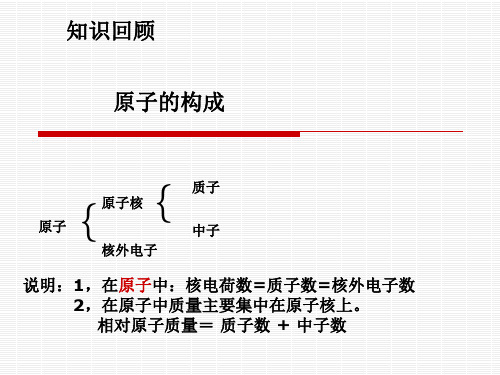
原子中,质子数=电子数
1、在原子中,质子数和电子数有何关系 ?
Mg2+
+12 2 8
S2- +16 2 8
8
2、在离子中,质子数和电子数又有何关系?
阳离子中,质子数>电子数 阴离子中,质子数<电子数
1、如右图是某原子结构示意图,有关它的说法错误的是 ( ) A.它的核内有12个质子 B.它属于非金属元素
He
二
Li Be B C N O F Ne
三
Na Mg Al Si P S Cl Ar
四
K Ca
周 期 一 二
1——20号元素的原子核外电子的排布
H He
Li
Be
B
C
N
O
F
Ne
三
Na Mg Al Si P S Cl Ar
非金属元素:原 子最外层 电子个 稀有气体元素: 四 数一般大于或等 原子最外层一般 于 4 (易得到电 K Ca 子) 为8个电子 金属元素:原子最外层电子个 (氦是2个电子) 数一般少于4 ( 易失去电子)
核外电子的排布

轨道能量顺序
7
泡利不相容原理
每个原子轨道上最多只能容纳两个电子自旋状态不同的电子
①电子成对方式
2s
↓
↑
↓
↓
↑
↑
1s
2p
②在轨道表示式中体现
洪特规则
原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同。
①能量相同的轨道中,自旋相同的单电子越多,体系越稳定
轨道表示式
电子排布式
用原子实简化的电子排布式 电子排布式
外围(价)电子排布式 轨道表示式 原子结构示意图
1
2
3
原子核外电子排布的表示
课本P16:1-6、8
01
练习册P6:3、8、9、12、13
02
第一次作业
作业
01
基态:能量最低的状态
1.基态原子与激发态原子
02
激发态:能量高于基态的状态
原子的发射与吸收光谱
01
02
03
04
05
06
07
1
2
3
4
5
6
例
(2011年常州高二检测)A、B、C、D、E代表5种元素。请填空: (1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为________。 (2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________。
C
Ne
Mn
r(K)>r(Mg)>r(Si)
Mn
Mg
Ne
Si
K
原子核外电子排布遵循的原理
原子核外电子排布的表示
原子核外电子的排布
核外电子排布规律

核外电子排布规律
核外电子排布规律是指原子的核外电子在空间中的排列方式。
它可以通过配对原子核和核外电子来理解,这种配对叫做键合。
核外电子排布规律主要遵循以下原则:
1. 原子核周围的核外电子最多可以排列八个,叫做“八元规则”。
2. 原子核周围的核外电子会尽可能的排列成正好占据八个椭球形的位置,叫做“立方化原则”。
3. 原子核周围的核外电子排列时,会尽可能的保持能量最低,叫做“最小能量原则”。
4. 原子核周围的核外电子排列时,会尽可能的使电子的总自旋为最小,叫做“最小自旋原则”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、电子分布和近似能级图
电子层与电子距离核的远近和电子能量高低的关系
名 称 第一层 第二层 第三层 第四层 第五层 第六层 第七层
电子层
符号 K
LMN
OP
Q
电子距离原子核距离
电子离核距离由近到远
电子的能量高低
电子的能量由低到高
多电子原子的能级
物质结构
美国著名结构化学家Pauling ,根据大 量光谱实验数据和理论计算,提出了多 电子原子的原子轨道近似能级图。共分 成七个能级组.
价电子层结构。
*主族:同一主族元素具有相同的价电子结构 和相同的最外层电子数。
纵行 (16个族)
主族:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA 副族:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB Ⅷ族: 排 8、9、10 列 0 族: He、Ne、Ar、Kr、Xe、Rn 6 种稀有气体
物质结构
第七周期: 32 种元素 第七能级组:32 个电子 4 个能级 7s 5f 6d 7p 16 个轨道
5f Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
7s Fr Ra
物质结构
2.族与价电子结构
元素的原子参加化学反应时,能参与化学键形成的电
子称为价电子,价电子所在的电子层的电子排布式,称
IB族中的铜、银、金的电子层结构如何?为什么?
物质结构
三、原子的电子结构与元素周期律
周期名称 元素数目
Байду номын сангаас
1. 周期
第1周期 (2种元素) 第2周期 (8种元素) 第1、2、3周期含有元素较少,叫短周期。 第3周期 (8种元素) 第4周期 (18种元素) 第5周期 (18种元素) 第4、5、6周期含有元素较多,叫长周期。 第6周期 (32种元素) 第7周期 (理论上存在32种,已发现29种) 叫不完全周期。
每个○代表一个原子轨道
p 三重简并 d 五重简并 f 七重简并
物质结构
二、核外电子的排布
多电子原子处于基态时,核外电子排布遵循以下 三个条原理:
1.泡利不相容原理——在一个原子中,不可能有 运动状态完全相同的两个电子存在。
2.能量最低原理——在不违反泡利原理的条件下, 电子优先占据能量较低的原子轨道
物质结构
1.周期与族的划分
周期与能级组
元素周期表
把电子层数相同而按原子序数由小到大的顺 序排列的一系列元素作为表中的一个横行,称为 一个周期。
元素周期表中有7个横行,也就是7个周期。
周期的序数就是该周期元素原子具有的电子层数。
物质结构
元素的周期
周期的划分与能级组的划分完全一致,每个能级组都独自 对应一个周期。共有七个能级组, 所以共有七个周期。
第五周期: 18 种元素 第五能级组: 18 个电子
3 个能级 5s 4d 5p 9 个轨道
物质结构
第六周期: 32 种元素 第六能级组: 32 个电子 4 个能级 6s 4f 5d 6p 16 个轨道
4f Ce Pr No Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 6s Cs Ba
2 个能级 3s 3p
4 个轨道
4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
第四周期: 18 种元素 第四能级组: 18 个电子
3 个能级 4s 3d 4p 9 个轨道
5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
1H
第一周期: 2 种元素 第一能级组: 2 个电子
1 个能级 1s
He
1 个轨道
2 Li Be
第二周期: 8 种元素 第二能级组: 8 个电子
B C N O F Ne
2 个能级 2s 2p
4 个轨道
3 Na Mg
第三周期: 8 种元素 第三能级组: 8 个电子
物质结构
Al Si P S Cl Ar
例如:E1s<E2s<E3s E2p<E3p<E4p E3s<E3p<E3d
物质结构
3.洪特规则——在同一原子的等价轨道上,自 旋方向 相同的电子数目最多时,原子的能量最低。 能量相等的轨道全充满(p6、d10、f14)、半充 满(p3、d5、f7)或全空(p0、d0、f0)的状态比 较稳定。
问题:
