水通道蛋白的基本结构与特异性通透机理王晶桑建利北京师范大学
水通道蛋白结构

水通道蛋白结构水通道蛋白是一类在生物体中起着重要作用的蛋白质。
它们存在于细胞膜上,形成了细胞膜的一种通道,能够允许水分子快速通过细胞膜。
水通道蛋白的发现和研究为我们理解细胞内外液体平衡以及水分运输提供了重要的线索。
水通道蛋白最早是在1980年代被发现的,研究者发现一种叫做水通道蛋白1(Aquaporin-1,简称AQP1)的蛋白质在红细胞膜上表达,能够加速水分子通过细胞膜。
这项发现引起了科学家们的广泛关注,并在接下来的几十年里,研究人员陆续发现了多种水通道蛋白。
水通道蛋白的结构非常特殊,它们由多个亲水性的氨基酸残基组成,形成了一条通道,通道中心是一个疏水性的区域,能够排斥离子和其他溶质,只允许水分子通过。
水通道蛋白的结构使其具有高度选择性和通透性,能够快速而特异地传输水分子。
水通道蛋白的结构在进化过程中发生了一些变化,目前已经发现了多种类型的水通道蛋白。
其中,AQP1是最早被发现的一种,广泛存在于多种细胞类型中,包括红细胞、肾脏和眼睛等。
AQP1的结构由四个相同的亚单位组成,每个亚单位由六个跨膜螺旋组成,形成了一个中央水通道。
除了AQP1之外,还有其他类型的水通道蛋白,如AQP2、AQP3等。
它们在组织和细胞中的分布具有一定的特异性,发挥着不同的生理功能。
例如,AQP2主要存在于肾脏中,调节尿液的浓缩和稀释;AQP3主要存在于皮肤和肠道中,参与水分的吸收和散发。
水通道蛋白的功能不仅仅局限于水分的传输,它们还参与了一系列重要的生理过程。
例如,水通道蛋白在维持细胞内外液体平衡方面发挥着重要作用。
细胞内外液体平衡的失调会导致细胞的肿胀或收缩,影响细胞的正常功能。
水通道蛋白能够调节细胞内外水分的平衡,保持细胞内外环境的稳定。
水通道蛋白还参与了一些特殊细胞功能的实现。
例如,在肾脏中,水通道蛋白能够调节尿液的浓缩和稀释,帮助维持体内水分的平衡。
在眼睛中,水通道蛋白参与了眼内房水的生成和排泄,维持了眼压的稳定。
铁死亡 水通道蛋白

铁死亡水通道蛋白-概述说明以及解释1.引言1.1 概述铁死亡是一种与水通道蛋白功能紧密相关的现象,它在生物体内产生了广泛的研究兴趣。
铁作为生物体内重要的营养元素,参与了许多生理过程的调节和维持,包括氧运输、能量代谢和DNA合成等。
水通道蛋白则是一类跨膜蛋白,主要负责水的跨膜运输。
它们的关系影响着生物体内水分平衡、细胞内外渗透压的维持以及许多其他重要的生物过程。
本文旨在探讨铁与水通道蛋白之间的关联,并分析铁死亡对生物体的影响。
我们将首先回顾铁的重要性,介绍其在生物体内的作用与功能。
随后,我们将重点讨论水通道蛋白的功能及其在维持细胞内外渗透压平衡中的作用。
在此基础上,我们将深入探讨铁与水通道蛋白之间的关系,并阐述铁对水通道蛋白的调控机制。
接下来,我们将详细讨论铁死亡对生物体的影响。
铁死亡是指铁的水平过高或过低导致的一系列生理和病理变化。
我们将重点探讨铁死亡对水通道蛋白的损害,以及由此引发的水分失衡和细胞功能障碍等问题。
最后,我们将对铁死亡的意义进行归纳和总结,并探讨水通道蛋白在疾病治疗和生物技术领域的潜在应用。
同时,我们还将提出一些对策和建议,以有效预防或治疗铁死亡引起的相关问题。
通过对这一重要领域的深入研究,我们可以更好地理解铁与水通道蛋白之间的相互作用,为相关疾病的治疗和新药开发提供科学依据。
相信本文的内容将对相关领域的学者和研究人员具有一定的参考和指导价值。
1.2 文章结构文章结构:本文采用以下结构进行组织和呈现。
首先,在引言中概述了本文的主要内容和目的,以及将要讨论的问题。
接下来,正文部分分为四个章节,具体涵盖了铁的重要性、水通道蛋白的功能、铁与水通道蛋白的关系以及铁死亡的影响。
在每个章节中,将以相关的研究和实例来说明所探讨的问题。
最后,在结论部分总结了本文的重点观点,并提出了关于铁死亡意义、水通道蛋白潜在应用、对策和建议等方面的讨论。
在整篇文章中,通过理论探讨和实证研究相结合的方式,旨在深入剖析铁死亡和水通道蛋白的相关知识,并探讨其在生物学和医学领域中的重要性和应用前景。
水通道蛋白的名词解释

水通道蛋白的名词解释水通道蛋白是一类存在于生物体细胞膜上的蛋白质,其主要功能是调节细胞内外水分的平衡。
这些蛋白质以其独特的细胞膜通透性,通常被形容为“细胞的水渠”。
尽管细胞膜对水具有一定的渗透性,但水通道蛋白的出现使得水分的跨膜运输变得更加高效和方便。
水通道蛋白主要通过形成一个微小的通道,让水分子直接穿过细胞膜,从而加速细胞内外的水分交换。
水通道蛋白最早被发现于红细胞膜,其中最为著名的是被称为Aquaporin-1(AQP1)的蛋白质。
AQP1被发现能够高效地传输水分子,使其成为研究者们研究水通道蛋白的重要起点。
此后,越来越多的水通道蛋白被发现,它们在各种生物体的细胞膜上广泛存在。
水通道蛋白家族主要包括两类:小分子量蛋白(20~35kDa)和大分子量蛋白(约为50~90kDa)。
小分子量蛋白包括AQP1、AQP2和AQP4等,它们主要负责水分子的传输。
大分子量蛋白则包括AQP0、AQP5和AQP6等,除了与水分交换有关,这些蛋白质还可能参与其他细胞功能的调节。
水通道蛋白在生物体中具有广泛而重要的作用。
例如,在人体内,水通道蛋白在器官和组织中起着维持水分平衡的关键作用。
当体内水分过多或过少时,水通道蛋白能够根据需要调整细胞膜的通透性,控制水分大量吸收或排泄。
这一过程在保持人体内部环境稳定方面非常重要。
此外,水通道蛋白还在植物、昆虫、微生物等生物体中发挥着类似的功能。
在植物体内,水通道蛋白不仅参与了水分的吸收和输送,还对维持细胞渗透稳定性和调节植物生长发育起到了重要作用。
在昆虫和微生物中,水通道蛋白也发挥着类似的水分调节作用,确保它们能够在不同环境下生存和繁衍。
随着科学技术的发展,研究人员对水通道蛋白进行了深入的研究。
他们通过结构生物学、细胞生物学以及分子生物学等多种手段,揭示了水通道蛋白的分子结构和生理功能,并进一步研究了其与疾病之间的关系。
例如,某些疾病,如肾脏功能障碍、肿瘤、水肿等,与水通道蛋白的异常表达或功能失调密切相关。
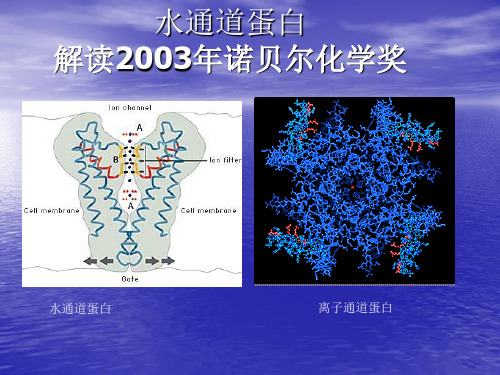
水通道蛋白

水通道蛋白水通道蛋白(Aquaporin),又名水孔蛋白,是一种位于细胞膜上的蛋白质(内在膜蛋白),在细胞膜上组成“孔道”,可控制水在细胞的进出,就像是“细胞的水泵”一样。
水通道是由约翰霍普金斯大学医学院的美国科学家彼得·阿格雷所发现,他与通过X射线晶体学技术确认钾离子通道结构的洛克斐勒大学霍华休斯医学研究中心的罗德里克·麦金农共同荣获了2003年诺贝尔化学奖。
水分子经过Aquaporin时会形成单一纵列,进入弯曲狭窄的通道内,内部的偶极力与极性会帮助水分子旋转,以适当角度穿越狭窄的通道,因此Aquaporin的蛋白构形为仅能使水分子通过之原因水通道蛋白的发现编辑Agre等(1988)在分离纯化红细胞膜上的Rh多肽时,发现了一个28 kD的疏水性跨膜蛋白,称为形成通道的整合膜蛋白28(channel-forming inte—gral membrane protein,CHIP28),1991年完成了其cDNA克隆(Verkman,2003)。
但当时并不知道该蛋白的功能,在进行功能鉴定时,将体外转录合成的CHIP28 mDNA 注入非洲爪蟾的卵母细胞中,发现在低渗溶液中,卵母细胞迅速膨胀,并于5 min 内破裂。
为进一步确定其功能,又将其构于蛋白磷脂体内,通过活化能及渗透系数的测定及后来的抑制剂敏感性等研究,证实其为水通道蛋白。
从此确定了细胞膜上存在转运水的特异性通道蛋白,并称CHIP28为Aquaporinl(AQPl)。
水通道蛋白分类编辑AQP0AQP0最初称之为主体内在蛋白(major intrinsic protein,MIP),在晶状体纤维中细胞中表达丰富,与晶状体的透明度有关.AQpo的突变可能导致晶状体水肿和白内障。
小鼠缺乏AQPO将患先天性白内障[61]。
AQP1AQP1是1988年发现的,开始将这种蛋白称为通道形成整合蛋白(CHIP),是人的红细胞膜的一种主要蛋白。
水通道蛋白的基本结构与特异性通透机理

水通道蛋白的基本结构与特异性通透机理王晶桑建利(北京师范大学生命科学学院北京100875 )摘要水通道蛋白是一个具有跨膜运输水分子功能的蛋白家族。
从1988 年Agre 等发现水通道蛋白起,目前在不同物种中已经发现了200 余种水通道蛋白,其中存在哺乳动物体内的有13 种。
概述了水通道蛋白的结构、组织特异性分布及特异性通透机理。
关键词水通道蛋白水分跨膜转运水分子的跨膜转运对维持不同区域的液体平衡和内环境稳态非常重要。
水分子作为一种不带电荷且半径极小的极性分子,很早被证实能通过自由扩散穿透脂质双分子层。
在发现水通道蛋白以前,人们一直认为这是水分子透过质膜的唯一方式。
但通过实验发现,红细胞和肾小管细胞中水的通透速率之快远非简单扩散强度所能提供的,因此猜测,质膜上可能存在某种通道介导水的转运。
1 水通道蛋白的发现1988年,Agre等从人类红细胞膜上纯化分离分子量为32X 106的Rh多肽时,偶然鉴定到一种新的分子量为28X 106的整合膜蛋白,并且通过免疫印迹发现这类蛋白也存在于肾脏的近端肾小管中[1],把它称为类通道整合膜蛋白(channel-like integralmembrane protein, CHIP28。
随后,在1991 年Agre 和Preston成功克隆得到了CHIP28的cDNA通过分析其编码的氨基酸序列,发现CHIP28含有6个跨膜区域、2个N-糖基化位点、且N端和C端都位于膜的胞质一侧。
另外,对比CHIP28 与早期从牛晶体纤维中克隆得到的主要内源性蛋白(major intrin sicprotei n,MIP )的DNA序列,发现二者具有高度同源性。
由于很早以前就证实了MIP 家族的成员蛋白参与形成允许水和其他小分子通透的膜通道,因此,推测CHIP28 可能也具有类似功能[2]。
1992 年,Preston 等通过在非洲爪蟾的卵母细胞中表达CHIP28,首次证实它是一种水通道蛋白。
《通道蛋白的讲解》课件

通道蛋白在细胞生长和分化过程中也起着 重要作用,如Ca2+通道在骨骼肌细胞和心 肌细胞的生长和分化中起关键作用。
03
CATALOGUE
通道蛋白的特性与作用机制
特性
选择性
通道蛋白只允许特定类型的离子或分子通过,这取决 于通道的构型和电荷分布。
通透性
通道蛋白具有高度的通透性,允许大量的离子或分子 快速通过。
研究现状
1 2 3
通道蛋白的结构与功能研究
通道蛋白的结构和功能关系是当前研究的热点, 通过解析通道蛋白的三维结构,可以深入了解其 作用机制。
通道蛋白的调控机制研究
通道蛋白的开关调控对细胞内外物质的转运具有 重要影响,研究其调控机制有助于揭示生命活动 的奥秘。
通道蛋白在疾病中的作用研究
许多疾病的发生和发展与通道蛋白的功能异常有 关,研究其在疾病中的作用有助于寻找新的治疗 靶点。
应用前景
药物研发
通道蛋白作为药物作用的靶点, 通过对其结构和功能的深入研究 ,可以为新药研发提供理论支持 。
生理和病理过程研
究
通ቤተ መጻሕፍቲ ባይዱ蛋白在细胞生理和病理过程 中发挥重要作用,对其深入研究 有助于揭示生命活动的规律。
疾病诊断和治疗
通道蛋白的功能异常与多种疾病 有关,通过对其检测和调控,可 以为疾病的诊断和治疗提供新的 手段。
可调控性
通道蛋白的开放和关闭状态可以被多种因素调节,如 膜电位、化学物质、温度等。
作用机制
门控机制
通道蛋白通过门控机制控制离子 的通透性。当膜电位达到一定阈 值时,通道蛋白打开,允许离子
通过。
构象变化
通道蛋白的构象变化可以影响其通 透性。某些刺激可以导致通道蛋白 构象改变,从而打开或关闭通道。
水通道蛋白
水通道蛋白的发现
Agre等(1988)在分离纯化红细胞膜上的Rh多肽时,发现 了一个28 kD的疏水性跨膜蛋白,称为形成通道的整合膜 蛋白28(channel-forming inte—gral membrane protein, CHIP28),1991年完成了其eDNA克隆(Verkman,2003)。 但当时并不知道该蛋白的功能,在进行功能鉴定时,将体 外转录合成的CHIP28 eDNA注入非洲爪蟾的卵母细胞中, 发现在低渗溶液中,卵母细胞迅速膨胀,并于5 min内破 裂。为进一步确定其功能,又将其构于蛋白磷脂体内,通 过活化能及渗透系数的测定及后来的抑制剂敏感性等研究, 证实其为水通道蛋白。从此确定了细胞膜上存在转运水的 特异性通道蛋白,并称CHIP28为Aquaporinl(AQPl)。
•
20世纪80年代中期,美国科学家彼得· 阿格雷研究了不 同的细胞膜蛋白,经过反复研究,他发现一种被称为水通 道蛋白的细胞膜蛋白就是人们寻找已久的水通道。为了验 证自己的发现,阿格雷把含有水通道蛋白的细胞和去除了 这种蛋白的细胞进行了对比试验,结果前者能够吸水,后 者不能。为进一步验证,他又制造了两种人造细胞膜,一 种含有水通道蛋白,一种则不含这种蛋白。他将这两种人 造细胞膜分别做成泡状物,然后放在水中,结果第一种泡 状物吸收了很多水而膨胀,第二种则没有变化。这些充分 说明水通道蛋白具有吸收水分子的功能,就是水通道。
学奖。
Peter Agre
Roderick MacKinnon
• 2000年,阿格雷与其他研究人员
一起公布了世界第一张水通道蛋 白的高清晰度立体照片。照片揭 示了这种蛋白的特殊结构只允许 水分子通过。 • 水通道的发现开辟了一个新的研 究领域。目前,科学家发现水通 道蛋白广泛存在于动物、植物和 微生物中,它的种类很多,仅人 体内就有11种。它具有十分重要 的功能,比如在人的肾脏中就起 着关键的过滤作用。通常一个成 年人每天要产生170升的原尿, 这些原尿经肾脏肾小球中的水通 道蛋白的过滤,其中大部分水分 被人体循环利用,最终只有约1 升的尿液排出人体。
水通道蛋白结构

水通道蛋白结构水通道蛋白(aquaporin)是一种在细胞膜上广泛存在的蛋白质。
它们扮演着调节细胞内外水分平衡的重要角色。
本文将从水通道蛋白的结构、功能和应用等方面进行阐述。
一、水通道蛋白的结构水通道蛋白是一类跨膜蛋白,由六个跨膜α螺旋构成。
这些α螺旋呈现出一种特殊的编折结构,形成了一个水分子通过的通道。
通道的内部是由高度保守的氨基酸残基组成,这些残基能够与水分子形成氢键,从而促进水分子的快速通过。
二、水通道蛋白的功能水通道蛋白的主要功能是通过调节细胞膜的通透性来控制细胞内外的水分平衡。
它们可以快速而选择性地促进水分子的跨膜运输,而阻止离子和其他溶质的通过。
这种高度选择性的水通透性使得细胞能够维持稳定的细胞内环境。
三、水通道蛋白的亚型水通道蛋白有多个亚型,其中最为典型的是AQP1、AQP2和AQP3。
AQP1广泛分布于许多组织和器官中,参与维持细胞内外液体平衡;AQP2主要存在于肾小管上皮细胞中,调节尿液的浓缩和稀释;AQP3主要分布在皮肤和肾脏中,参与水分的吸收和排泄。
这些不同的亚型在不同组织和器官中发挥着特定的生理功能。
四、水通道蛋白的应用水通道蛋白在许多领域都有重要的应用价值。
例如,在生物医学研究中,水通道蛋白可以作为肿瘤标志物,用于癌症的诊断和治疗。
此外,水通道蛋白还可以用于制备高效的水处理膜,用于海水淡化和废水处理等领域。
此外,水通道蛋白还被应用于药物传递系统的设计和开发,以提高药物的透过性。
因此,水通道蛋白的研究和应用具有广阔的前景。
总结:水通道蛋白是一类重要的蛋白质,通过调节细胞膜的通透性来控制细胞内外的水分平衡。
它们的结构独特,具有高度的水选择性通透性。
水通道蛋白有多个亚型,在不同组织和器官中发挥着特定的功能。
此外,水通道蛋白还具有广泛的应用价值,可以用于肿瘤诊断和治疗、水处理和药物传递系统等领域。
随着对水通道蛋白的深入研究,我们对其机制和应用的理解将进一步加深,为生命科学和工程技术的发展提供更多的可能性。
水分子通道蛋白的结构与功能

反而造成了一些分类概念上的混乱 。在此我们仍然 沿用“主体蛋白家族”的名称 。主体蛋白家族大致可 以分成两个蛋白家族 ,即允许水分子通过的“水通道 蛋白”AQP 和允许甘油分子通过的“甘油通道蛋白 (glycerol facilitators) ”[18 ,19] 。甘油通道蛋白的发现和 鉴定早于水通道蛋白的发现和鉴定[20 ,21] ,其家族成 员大多存在于细菌 、真菌等低等生物中 。绝大多数 甘油通道蛋白在传输甘油分子的同时也可以允许一 些水分子通过 。水通道蛋白家族成员则主要存在于 动物和植物中 ,除一部分水通道蛋白可以允许少量 甘油分子通过外 ,其余的水通道蛋白都能高效地阻 挡其他分子和离子 (包括质子) 并只允许水分子快速 通过 。AQP1 蛋白就是一个存在于哺乳动物中的只 传输水分子的典型水通道蛋白 。它在哺乳动物中保 守性 3 非常好 。
由此可见 ,水通道蛋白对于生命活动至关重要 。
二 、水通道蛋白的发现与分类
早在 19 世纪中叶 ,人们就设想生物器官的表面 存在传输水和小分子溶质的“通道 ( channel) ”。从 20 世纪 50 年代后期到 80 年代中期 ,一些对血红细 胞进行研究的学者提出在血红细胞膜上可能存在有 可以传输水分子的蛋白[2 —7] 。例如 Macey 和 Farmer 在 1970 年发现血红细胞的很好的透水性可以被水 银化合物所阻塞[4] 。由此他们推断 ,红细胞膜上应 该存在一种基本上只允许水分子通过的水通道蛋 白 。这种蛋白的过滤性质可以被 pCMBS 等水银化 合物所改变 。这一设想与发现水通道蛋白后的一些 实验结果相符合[8 —10] 。但是上述这些工作并没有确 定无疑地找到并表征出水通道蛋白 。同不少科学上 的重要成果一样 ,第一个水分子通道蛋白的发现和 纯化是一个意外收获 。80 年代中期 ,John Hopkins 大学的 Peter Agre 研究小组设法从血细胞膜上提纯 Rh 血液组抗原的 32 kDa 单元 3 3 。他们在提纯过程 中发现有一种分子量为 28kDa 的物质总是会被一同 提纯出来 。他们起初以为这是 Rh 蛋白的降解产 物 。后来意识到这是一种以前没有被发现的蛋白 。 于是 Agre 研究组的主要研究方向转而投向这个新 蛋白 。他们于 1988 年从血红细胞和肾小管中分离 纯化了这种蛋白[11] ,并根据其分子量命名该蛋白为
水通道蛋白结构与功能研究进展

水通道蛋白结构与功能研究进展刘树荣;张少斌【期刊名称】《现代预防医学》【年(卷),期】2007(34)12【摘要】生物体的主要组成部分是水溶液,约占人体重量的70%。
生物体内的水溶液主要由水分子和各种离子组成,它们在细胞膜内外穿梭中实现细胞的多种功能,故水的跨膜转运对维持细胞正常代谢具有重要作用。
Agre等发现并证明了一种分子量为28kD的蛋白质是细胞膜转运水的特异性通道蛋白,并将其命名为1号水通道蛋白Aquaporin l(AQP1)。
迄今为止,已在哺乳动物体内发现13中水通道蛋白(AQP0-AQP12),前11种水通道蛋白有高度保守的天冬酰胺-脯氨酸-丙氨酸(Asn-Pro-Ala,NPA)特征性序列,但最近发现的AQP11的天冬酰胺-脯氨酸-丙氨酸序列保守性较差。
水通道的分子结构以AQP1研究最清楚。
AQP1在质膜中以四聚体的形式存在,每个单体都由6个贯穿膜两面的长a螺旋构成基本骨架,其间还有两个嵌入但不贯穿膜的短a螺旋。
每个单体蛋白的中空部分都形成具有高度选择性的通道,只允许水分子跨膜运输而不允许带电质子或其他离子通过,在功能上都可以作为一个独立水通道。
【总页数】3页(P2260-2262)【关键词】水通道蛋白;分布;生理功能;分子结构【作者】刘树荣;张少斌【作者单位】沈阳农业大学生物科学技术学院【正文语种】中文【中图分类】R113【相关文献】1.水甘油通道蛋白结构和功能与疾病研究进展 [J], 孙夕林;赵周社;李宏利;林艳红;王凯;申宝忠2.功能性便秘患者结肠黏膜水通道蛋白3和水通道蛋白9的表达及意义 [J], 袁维堂;杨会锋;张志永;刘金波3.水通道蛋白的功能及水通道蛋白4与脑水肿关系的研究进展 [J], 顾永锋;刘文忠4.伴发脑部异常对髓鞘少突胶质细胞糖蛋白抗体阳性的视神经炎与水通道蛋白4抗体阳性的视神经炎视网膜视神经结构和功能的影响 [J], 熊佳伟;黃詠恒;余建;王敏因版权原因,仅展示原文概要,查看原文内容请购买。
水通道蛋白结构与功能的关系(教学课件)

•
14、抱最大的希望,作最大的努力。2021年5月15日 星期六 2021/5/152021/5/152021/5/15
•
15、一个人炫耀什么,说明他内心缺 少什么 。。2021年5月 2021/5/152021/5/152021/5/155/15/2021
•
16、业余生活要有意义,不要越轨。2021/5/152021/5/15May 15, 2021
•
15、一个人炫耀什么,说明他内心缺 少什么 。。2021年5月 *21.5.15*May 15, 2021
•
16、业余生活要有意义,不要越轨。* *5/15/2021
•
17、一个人即使已登上顶峰,也仍要 自强不 息。*** 21.5.15
谢谢大家
•
9、 人的价值,在招收诱惑的一瞬间被决定 。21.5.1521.5.15Saturday, May 15, 2021
•
11、人总是珍惜为得到。2021/5/152021/5/152021/5/15May- 2115-M ay-21
•
12、人乱于心,不宽余请。2021/5/152021/5/152021/5/15Saturday, May 15, 2021
•
13、生气是拿别人做错的事来惩罚自 己。2021/5/152021/5/152021/5/152021/5/155/15/2021
•
14、抱最大的希望,作最大的努力。2021年5月15日 星期六 **21.5.15
•
15、一个人炫耀什么,说明他内心缺 少什么 。。2021年5月 *21.5.15*May 15, 2021
•
16、业余生活要有意义,不要越轨。* *5/15/2021
水通道蛋白

水通道蛋白水通道蛋白是介导水跨膜转运的一大膜蛋白家族,分布于高等脊椎动物上皮细胞或内皮细胞。
结构上由28-KDa 亚单位组成四聚体,每个亚单位构成孔径约的水孔通道,在渗透压驱动下实现水双向跨膜转运【1】。
目前11 种亚型已经在哺乳动物中被确定,各种亚型的体内分布具有组织特异性,其中水通道蛋白-4 (Aquaporin 4,AQP4)以极化形式集中分布于中枢神经系统脑毛细血管周边的星形胶质细胞足突或室管膜细胞【2】。
血脑屏障为脑内另一调控水平衡的复合体,由无窗孔的脑毛细血管内皮细胞及细胞间紧密连接、基底膜、星形胶质细胞等组成,介于血液和中枢神经系统之间,限制血液中某些离子、大分子物质转移到脑实质,此屏障作用为维持CNS 内环境稳定、保障脑功能正常行使提供了重要保障。
BBB 分化发育过程中脑毛细血管内皮细胞间紧密连接的形成虽被认为是其成熟的标志,但BBB 生理功能的实现有赖于各组成成分间的相互作用。
近来对星形胶质细胞调控BBB 物质交换和脑内水平衡方面的作用日益受到重视,并认为与AQP4 表达有关。
本文就AQP4 与血脑屏障发育及其完整性关系的研究进展作一综述。
分化发育过程中AQP4 的表达目前由于对鸡胚视顶盖中血管及BBB 分化的研究已较完善,因此常被用于BBB 的研究模型。
Nico 及其同事【3】采用免疫细胞化学、分子生物学技术研究了鸡胚视顶盖AQP4 在BBB 分化发育过程的动态表达。
免疫电镜显示鸡胚视顶盖发育第9 d,BBB仅由不规则的内皮细胞组成,内皮细胞间紧密连接尚未形成,AQP4 未见表达。
待发育至第14 d,Western blot 技术首次在约30 kDa 链附近检测出AQP4 的免疫活性,电镜下显示短的内皮细胞间紧密连接已形成,并串联构成BBB 的微血管,星形胶质细胞间断黏附于血管壁,AQP4 不连续地表达于血管周边,血管周围仍然存在小空隙。
发育第20 d BBB 成熟,内皮细胞间紧密连接形成,BBB 微血管被星形胶质细胞紧紧包被,血管周边星形胶质细胞足突上的AQP4 呈现强阳性表达,且冷冻断裂研究显示AQP4 的正交排列阵也同步形成。
水通道蛋白结构

水通道蛋白结构水通道蛋白(aquaporin)是一类存在于细胞膜上的蛋白质,其主要功能是调控细胞内外水分的运输。
水通道蛋白的结构具有一定的特点,这些特点使其能够高效地传递水分子,并在维持生物体内水平衡中发挥重要作用。
水通道蛋白的结构由一系列螺旋状的α螺旋和两个高度保守的氨基酸残基NPA(天冬氨酸-丙氨酸-天冬氨酸)序列组成。
这些α螺旋通过跨膜区域连接在一起,形成了一个通道。
水分子通过这个通道进出细胞膜,实现水的快速传输。
水通道蛋白的结构具有高度的选择性和通透性。
其选择性是由通道内存在的氨基酸残基决定的。
水分子通过水通道蛋白时,其氢键与蛋白内的氨基酸残基形成相互作用,这种相互作用有助于水分子的选择性传输。
与水分子大小相似的分子,如甘油和尿素,也能通过水通道蛋白,但其通透性要低于水分子。
水通道蛋白的通道内部具有高度的亲水性。
这是因为通道内部存在大量的亲水氨基酸残基,如精氨酸和赖氨酸。
这些氨基酸残基能够与水分子形成氢键,从而增强通道内的亲水性,有利于水分子的传输。
水通道蛋白的结构还具有调节功能。
研究发现,水通道蛋白的通道内部存在着一些调节位点,这些位点能够与一些小分子物质或离子相互作用,从而影响水通道蛋白的通透性。
例如,一些药物和离子能够结合到水通道蛋白上,改变其通透性,从而调节细胞内外水分的平衡。
水通道蛋白的结构与其功能密切相关。
水分子在生物体内的传输对于维持细胞内外水分平衡至关重要。
水通道蛋白通过其独特的结构,实现了水分子的快速传输和选择性通透,从而维持了细胞内外水分的平衡。
水通道蛋白的结构研究不仅有助于深入理解生物体内水分调节的机制,还为开发新型药物和治疗水分失衡相关疾病提供了重要的理论基础。
总结起来,水通道蛋白的结构由α螺旋和NPA序列组成,具有高度的选择性和通透性。
通道内部具有亲水性和调节位点,能够实现水分子的快速传输和选择性通透,维持细胞内外水分平衡。
水通道蛋白的结构研究对于了解水分调节机制、开发新药物具有重要意义。
水通道及其分子生物学研究

水通道及其分子生物学研究摘要: 水通道是处于持续开放的膜通道蛋白, 是细胞膜上选择性高效转运水分子的特异孔道。
本文通过叙述了水通道的发现、分子结构、生理功能、活性调节等方面,具体深入介绍了水通道及其分子生物学研究。
关键词: 水通道 AQP 分子结构功能生物体的主要组成部分是水溶液, 约占人体重量的70%。
细胞摄取和排出水分是生命最基本的活动之一,水分子的跨膜转运有着非常重用的生理作用。
当AQP1第一个水通道蛋白被发现,人们便开始了对水通道的深入研究。
随后,各种水通道蛋白被相继发现。
水通道普遍存在与动、植物及微生物中,主要分布于水分代谢活跃的器官中,主要介导自由水被动跨膜转运,对保持细胞内外环境的稳态平衡起重要作用,也参与完成一些机体重要的生理功能。
1 水通道的发现长期以来,人们普遍认为细胞内外的水分子是以简单的跨膜扩散方式透过脂质双分子膜的。
后来,发现红细胞及近端肾小管对渗透压改变引起的水的通透性很高,很难单纯以弥散来解释。
因此,人们推测水的跨膜转运除了简单扩散外,还存在某种特殊的机制,并提出水通道的概念。
1988年,Agre 等在鉴定人类Rh 血型抗原时,偶然在红细胞膜上发现一种新的28KD 的疏水性跨膜蛋白,称之为形成通道的整合膜蛋白28(CHIP)。
在1991 年完成其cDNA 克隆,但当时并不了解该蛋白的功能。
在进行功能鉴定时,将体外转录合成的CHIP28 cDNA 注入非洲爪蟾的卵母细胞中,发现在低渗溶液中,卵母细胞迅速膨胀,并于5min 内破裂。
为进一步确定其功能,又将其构建于蛋白磷脂体内,通过活化能及渗透系数的测定以及后来的抑制剂敏感性等研究,证实其为水通道蛋白。
从此确定了细胞膜上存在转运水的特异性通道蛋白,并称CHIP28 为AQP1。
以后又陆续从哺乳动物组织中鉴定出9 种水通道蛋白(AQP2~AQP10),它们与先前克隆的晶体纤维中的主要内源性蛋白(major intrinsic protein ,MIP) 有20 %~40 %的氨基酸序列同源性,目前所发现的水通道均属MIP家族,后经证明MIP 亦有弱的水通道活性,被命名为AQP0。
水通道蛋白研究进展

水通道蛋白研究进展水通道蛋白是一种专门负责水分子跨膜运输的蛋白,对于生物体的水分平衡和调节具有重要意义。
近年来,随着研究的深入,水通道蛋白的作用机制和应用领域逐渐引起人们的。
本文将概述水通道蛋白的基本概念、分类、功能,并重点介绍其研究进展。
水通道蛋白概述水通道蛋白是一种位于细胞膜上的运输蛋白,主要负责水分子在细胞膜上的跨膜运输。
水通道蛋白可根据其分布位置和功能不同分为不同类型,例如:AQP0、AQP1、AQP2等。
这些蛋白在细胞膜上形成水通道,帮助水分子快速、高效地通过细胞膜,从而维持细胞内外水平衡及细胞生长代谢。
水通道蛋白研究进展1、水通道蛋白的分子结构与功能关系水通道蛋白的分子结构由6个跨膜片段组成,形成一种特定的构象,从而有利于水分子通过。
不同的水通道蛋白具有不同的构象和功能,例如:AQP0主要分布于视网膜色素上皮细胞,参与调节眼部水分平衡;AQP1主要分布于肾脏、膀胱等器官,参与调节水平衡和尿生成;AQP2主要分布于肾小管和集合管,参与调节尿浓缩和稀释。
2、水通道蛋白的研究方法与技术目前,水通道蛋白的研究方法主要包括以下几种:基因克隆、表达与纯化;蛋白质结晶与结构解析;功能及动力学研究等。
这些方法分别从基因、蛋白质和功能等方面对水通道蛋白进行研究。
同时,随着生物技术的发展,如荧光标记、基因敲除等技术也为水通道蛋白研究提供了有力支持。
3、水通道蛋白的应用领域与展望水通道蛋白在生物学、医学等领域具有广泛的应用价值。
首先,水通道蛋白参与维持生物体内环境稳态,对治疗与预防水肿、脱水等疾病具有重要意义。
例如,AQP1在急性肾损伤和慢性肾功能衰竭等疾病中表达异常,成为治疗上述疾病的潜在靶点。
此外,水通道蛋白还与某些肿瘤细胞的生长和转移密切相关,因此有望为肿瘤治疗提供新思路。
其次,水通道蛋白在物质跨膜转运、药物研发等方面也具有潜在应用价值。
例如,通过研究AQP4在脑内的分布和作用机制,有助于理解脑内物质跨膜转运的规律,为药物研发提供新靶点。
水通道蛋白

发展前景
• 很多疾病,比如一些神经系统疾病和心血管疾病 很多疾病,比如一些神经系统疾病和心血管疾病
就是由于细胞膜通道功能紊乱造成的,对细胞膜 通道的研究可以帮助科学家寻找具体的病因,并 研制相应药物。 水通道的发现开辟了一个新的研究领域。目前, 科学家发现水通道蛋白广泛存在于动物、植物和 科学家发现水通道蛋白广泛存在于动物、植物和 微生物中,它的种类很多,仅人体内就有11种。 微生物中,它的种类很多,仅人体内就有11种。 它具有十分重要的功能,比如在人的肾脏中就起 它具有十分重要的功能,比如在人的肾脏中就起 着关键的过滤作用。通常一个成年人每天要产生 170升的原尿,这些原尿经肾脏肾小球中的水通道 170升的原尿,这些原尿经肾脏肾小球中的水通道 蛋白的过滤,其中大部分水分被人体循环利用, 最终只有约1升的尿液排出人体。
• 1988年,罗德里克·麦金农利用X射线晶体 1988年,罗德里克·
成像技术获得了世界第一张离子通道的高 成像技术获得了世界第一张离子通道的高 清晰度照片,并第一次从原子层次揭示了 清晰度照片,并第一次从原子层次揭示了 离子通道的工作原理。这张照片上的离子 通道取自青链霉菌,也是一种蛋白。麦金 通道取自青链霉菌,也是一种蛋白。麦金 农的方法是革命性的,它可以让科学家观 测离子在进入离子通道前的状态,在通道 中的状态,以及穿过通道后的状态。对水 通道和离子通道的研究意义重大。
• 生物体的主要组成部分是水溶液,水溶液占人体
水通道蛋白作用原理

水通道蛋白作用原理嘿,朋友们!今天咱来聊聊水通道蛋白的作用原理,这可真是个神奇的玩意儿啊!你看啊,水通道蛋白就像是一扇扇特别的小门,专门让水分子快速通过。
这就好比是在一个拥挤的人群中,有了专门的通道让特定的人快速通过一样。
想象一下,细胞就像一个小房子,里面需要水来维持各种活动。
如果没有水通道蛋白,水分子就得慢悠悠地挤进去,那多耽误事儿啊!但有了水通道蛋白,水分子就可以顺畅地进进出出啦。
这些水通道蛋白可挑剔了呢,它们只让水分子通过,其他的分子想混进去,门儿都没有!这就像一个严格的守卫,只放自己认识的人进去。
它们是怎么做到这么精准的呢?原来啊,水通道蛋白的结构特别巧妙。
它有一个合适的形状和大小,刚好能让水分子舒舒服服地通过。
这就好像是为水分子量身定制的通道一样。
而且哦,水通道蛋白的工作效率超高的!它们能在很短的时间内让大量的水分子通过。
这要是换成我们人类来干这活儿,那得累个半死吧!水通道蛋白在我们身体里的作用可大了去了。
比如在肾脏里,它们帮助过滤和重吸收水分,让我们的身体能保持水分平衡。
要是没有它们,我们的身体可就乱套啦!在我们的细胞里,水通道蛋白就像一群勤劳的小蜜蜂,默默地工作着,保障着细胞的正常运转。
没有它们,细胞可能就会变得干巴巴的,没法好好工作啦。
你说神奇不神奇?水通道蛋白虽然小小的,可它们的作用却是大大的呀!它们就像是我们身体里的无名英雄,一直在为我们的健康默默奉献着。
所以啊,我们可千万不能小看了这些小小的水通道蛋白。
它们虽然不显眼,但却在我们的身体里发挥着至关重要的作用。
我们得好好感谢它们呢!这就是水通道蛋白的作用原理啦,是不是很有趣呢?。
水通道蛋白名词解释

水通道蛋白名词解释
水通道蛋白(aquaporin)是一类存在于细胞膜上的跨膜蛋白,其功能是调节细胞内外水分的平衡。
水通道蛋白是由8个跨膜α螺旋结构组成,形成一个具有水分子通过能力的通道。
它们广泛存在于多种生物体的细胞膜上,包括植物、动物和微生物等。
水通道蛋白的主要功能是促进水分子在细胞膜上的快速跨膜传递。
由于水分子是极性的,无法通过细胞膜的疏水层,而水通道蛋白则提供了一个高度选择性通道,使水分子能够迅速通过细胞膜而不受阻碍。
水通道蛋白的通道结构限制了其他溶质的通过,从而确保水分子的优先通道。
除了调节水分平衡外,水通道蛋白还在细胞内外水分调节以及保护细胞免受渗透压和压力变化等环境因素的影响中发挥重要作用。
在植物中,水通道蛋白在根系中的表达调控了植物对于土壤中水分的吸收和利用。
在人体中,水通道蛋白在肾脏、眼睛和脑组织等重要器官中的表达与正常的水平维持和离子浓度平衡密切相关。
水通道蛋白的发现为我们深入了解细胞内外水分平衡的调控机制提
供了重要的线索。
通过研究水通道蛋白的结构和功能,人们可以进一步探索其在疾病发生和发展中的作用,为相关疾病的治疗和预防提供新的策略和途径。
水通道蛋白的研究

水通道蛋白的研究【关键词】水通道蛋白,法医病理学【中图分类号】q503;d919.1【文献标识码】b【文章编号】1007 9297(20XX)01—0053—03一、水通道蛋白的发现水是生物机体细胞的主要成分,每时每刻有大量的水分子通过细胞膜进出细胞。
在90年代以前,对于水分子的转运机制,主要有两种理论解释,一种是水分子的简单扩散学说,认为细胞内外渗透压差是其动力源,需要较高的阿里纽斯活动能(arrhenius activation energy,以下简称ea),一般ea> 10 keal/mol,达到平衡时渗透率(coefficient of osmotic permeability,简称pf)与扩散率(coefficient of diffusional permeability,简称pd)趋于相等,不能被汞等通道蛋白阻断剂所抑制。
但水分子简单扩散理论不能解释一些生理现象,如尿的浓缩、pf/pd> 1时水的转·法医学理论与实践·运及有些细胞水转运可被通道蛋白阻断剂抑制等,所以就产生了另一种理论,认为细胞膜上存在水分子转运的特殊通道,即水通道学说。
水分子通过该通道进出细胞,水通过水通道时需要的ea较低,一般eaaqp3和aqp7对甘油和尿素等有机小分子有一定的通过性,并且它们的核苷酸序列也很相似,[14, ]可据此将aqps家族分为两个亚家族,即aqp3和aqp7为一个亚家族,其余aqps为另一个亚家族。
对aqps的调节存在长期和短时调节之分。
长期调节作用在核酸转录水平上,主要表现为aqps的mrna合成增加,蛋白表达量增强,如皮质醇类激素可以从该水平上增加aqp1的表达等。
[ ]短时调节主要表现为细胞浆内的囊泡等膜单位短时与细胞膜融合,它们膜上的aqps转移到细胞膜上,导致细胞膜单位面积上aqps的量短时增加,如当受到加压素的作用时,肾组织细胞浆中的囊泡与肾脏细胞顶端膜融合,使囊泡中的aqp2转移到胞膜中发挥作用,一旦刺激消失,又通过形成囊泡载体,aqp2返回到胞浆中,从而减少细胞膜上的aqp2,水通透性降低,所以这种短时调节机制又称为“穿梭机制”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水通道蛋白的基本结构与特异性通透机理王晶桑建利(北京师范大学生命科学学院北京 100875)摘要水通道蛋白是一个具有跨膜运输水分子功能的蛋白家族。
从1988 年Agre 等发现水通道蛋白起,目前在不同物种中已经发现了200 余种水通道蛋白,其中存在哺乳动物体内的有13 种。
概述了水通道蛋白的结构、组织特异性分布及特异性通透机理。
关键词水通道蛋白水分跨膜转运水分子的跨膜转运对维持不同区域的液体平衡和内环境稳态非常重要。
水分子作为一种不带电荷且半径极小的极性分子,很早被证实能通过自由扩散穿透脂质双分子层。
在发现水通道蛋白以前,人们一直认为这是水分子透过质膜的唯一方式。
但通过实验发现,红细胞和肾小管细胞中水的通透速率之快远非简单扩散强度所能提供的,因此猜测,质膜上可能存在某种通道介导水的转运。
1 水通道蛋白的发现1988年,Agre 等从人类红细胞膜上纯化分离分子量为32×106的Rh 多肽时,偶然鉴定到一种新的分子量为28×106的整合膜蛋白,并且通过免疫印迹发现这类蛋白也存在于肾脏的近端肾小管中[1],把它称为类通道整合膜蛋白(channel-like integralmembrane protein, CHIP28)。
随后,在1991 年Agre 和Preston 成功克隆得到了CHIP28 的cDNA,通过分析其编码的氨基酸序列,发现CHIP28 含有6个跨膜区域、2个N-糖基化位点、且N 端和C 端都位于膜的胞质一侧。
另外,对比CHIP28 与早期从牛晶体纤维中克隆得到的主要内源性蛋白(major intrinsicprotein,MIP)的DNA 序列,发现二者具有高度同源性。
由于很早以前就证实了MIP 家族的成员蛋白参与形成允许水和其他小分子通透的膜通道,因此,推测CHIP28 可能也具有类似功能[2]。
1992 年,Preston 等通过在非洲爪蟾的卵母细胞中表达CHIP28,首次证实它是一种水通道蛋白。
非洲爪蟾的卵母细胞对水具有极低的渗透性,当向其中显微注射体外转录的CHIP28 的RNA后,卵母细胞在低渗溶液中迅速膨胀,并于5 min内破裂。
这一现象表明注射CHIP28 的RNA 后卵母细胞膜的水通透性有了明显提高。
为了进一步确定CHIP28 的功能,将提纯的CHIP28 构建在蛋白磷脂体中,构建后的蛋白磷脂体对水的通透性增长了50 倍,但对尿素却不具备通透性[3]。
这些结果最终证实了CHIP28 为水通道蛋白,后来它被命名为水通道蛋白-1(aquaporin-1,AQP1)。
水通道蛋白的发现,开辟了一个崭新的领域。
随着更多亚型的发现,水通道蛋白相关研究成为了膜转运方向的研究热点,Agre 也因其对水通道蛋白做出的突出贡献而获得2003 年诺贝尔化学奖。
2 水通道蛋白的分子结构水通道蛋白分布广泛,目前已在哺乳动物、两栖类、植物、酵母、细菌以及各种各样的有机体中发现水通道蛋白的存在。
水通道蛋白是一类高度保守的疏水小分子膜整合蛋白,各种亚型之间蛋白序列及三维结构非常相似。
哺乳动物水通道蛋白的分子大小在26×106~34×106之间,氨基酸序列同源性为19%~52%[4]。
因水通道蛋白的三维结构相似,一般以AQP1的结构作为代表。
AQP1 是一条由269 个氨基酸残基构成的单肽链,对比AQP1 分子前后半段的氨基酸序列,发现2 段序列具有相关性,推测AQP1在进化上可能是通过基因复制而来。
单肽链在细胞膜上往返折叠形成6 个α螺旋的跨膜区域,并且肽链的N 端和C 端都位于质膜内侧;6 个跨膜区域由5 条环(A~E loop)相连。
目前,被人们广为接受的水通道蛋白三维结构是“沙漏模型(hourglassmodel)”[4],模型指出:肽链中的B 环和E 环具有高度保守的天冬酰胺- 脯氨酸- 丙氨酸(Asn -Pro - Ala,NPA)特征性序列,B 环和E 环折返进入膜双分子层,2个保守的NPA 序列在膜的磷脂双层中间位置相互结合,6 条跨膜区域在四周包围,共同构成了一个供水分子通过的亲水通道(图1)。
通过对AQP1 的三维结构进一步研究发现,B环和E 环折返入膜后分别形成短螺旋B(HB)和短螺旋E(HE),中心孔道处起稳定作用的2 条NPA基序几乎呈90°交叉,所形成的亲水通道的直径约为2.8×10-10 m,刚好能容纳单个水分子通过,外围6 条跨膜区域呈现右手螺旋包围。
构成中心孔道表面的除B 环和E 环外,还有螺旋2、5 以及螺旋1、4 的C 端部分。
有研究指出,将B 环和E 环联系在一起的作用力主要是2 条NPA 基序中脯氨酸残基间的范德华力,同时也受到离子键和氢键的稳定。
几乎所有AQP 分子的B 环和E 环上都有高度保守的NPA 特征性序列。
但也有少数例外:在AQP11 和AQP12 中仅发现E 环上具有NPA 序列,另一个在B 环上的NPA 序列分别由天冬酰胺-脯氨酸-半胱氨酸(Asn-Pro-Cys,NPC)和天冬酰胺-脯氨酸-苏氨酸(Asn-Pro-Thr,NPT)替代[6]。
在体内,AQP1 主要以同源四聚体的形式存在。
研究发现,四聚体中某个水通道蛋白单体发生突变并不会影响其他3 个蛋白单体的功能,即每一个水通道蛋白单体是一个独立的功能单位。
水分子的跨膜渗透是通过水通道蛋白单体的中心通道完成的,而无法通过中聚体的中央孔洞(4 个单体衔接处的中心缝隙)[7]。
每个单体通过跨膜的α螺旋与邻近的2 个单体相互作用。
这些相互作用很有可能受到一些氨基酸残基之间的氢键的稳固。
3 水通道蛋白的种类迄今为止,已有200 余种水通道蛋白在不同物种中被发现,其中存在于哺乳动物体内的水通道亚型有13 种,即AQP0-AQP12(见下表)。
根据它们的基因结构和通透性,这13 种水通道蛋白可划分为3 组:传统水通道蛋白(orthodox aquaporins)(包括AQP0、1、2、4、5、6、10)、甘油水通道蛋白(aquaglyceroporins)(包括AQP3、7、9)和未明确分类的AQP8、11、12。
目前对哺乳动物中较早发现的10 个水通道蛋白AQP0~AQP9 研究较为透彻,它们的功能也通过人类疾病的鉴定及对基因缺失小鼠的研究而被鉴定;而较近发现的3 个成员AQP10~AQP12 则相对研究较少,它们的胞内定位及表达异常导致的人类疾病都还未被鉴定[8]。
4 水分子特异性通透机理水通道蛋白对水分子具有高度选择性。
大部分水通道蛋白严格排斥除水分子O+)、甘油以外的所有物质通过,包括结合水分子的氢离子(水合氢离子,H3和各种离子等,但也有部分水通道蛋白对甘油等小分子中性溶质具有通透性。
AQP1膜蛋白的密度可达到大于109 个/μm2,。
这一密度远远高于普遍的离子通道的密度(除突触后膜上的乙酰胆碱受体外,大多小于1 个/μm2)。
水通道蛋白是怎样对水分子进行严格筛选的呢?首先,通道的空间大小只能容纳单个水分子,限制了比水分子大的分子通过。
以对水分子具有专一通透性的AQP1 为例,AQP1 的中心通道呈哑铃状,狭口处在脂双层中央B 环和E 环相互作用的NPA 序列位置附近。
构成中心孔道表面的氨基酸残基中,亲水和疏水的残基数量基本是对等的。
这些亲水残基在对水分子去水化过程中有重要作用。
另外,中心孔道最窄处由4 个残基构成,包括亲水的His180、Arg195、Cys189 和疏水的Phe56。
虽然这一缩口只有1 个氨基酸残基的跨度,但是它2.8×10-10 m 的直径仍然阻断了比水分子大的离子和溶质的通过。
因此,这4 个残基的变化都可以对水通道的选择性产生影响。
根据已有研究可知,His180 在只对水具有通透性的水通道蛋白中高度保守,但在一些对甘油也具通透性的水通道蛋白,如GlpF 中则被甘氨酸残基代替[11]。
另一个困扰人们已久的问题是何种机制阻断了水道蛋白对质子的跨膜运输。
早在短杆菌肽中的研究就已表明,水可以以连续不断的方式通过膜上的开放孔,这种水分子排列成一条直线、质子由一个水分子传递到另一个水分子、并伴随着氢键的断裂和重建的过程,被研究者称为“Grotthus 效应”。
既然水通道蛋白对水具有特异通透性, 那么可通过“Grotthus效应”传递的质子运输又是怎样被阻断的呢?目前被较多人接受的另一个机制是在NPA 序列处有1对偶极子对水分子起着定向作用。
在每个水通道的中心位置,NPA 序列上的Asn76 和Asn192 的氨基向孔道最窄处延伸。
此时,位于此处的水分子与其邻近的水分子之间的氢键发生断裂,其氧原子替代性地与Asn76 和Asn192 的氨基形成氢键。
这一变化重排了水的分子轨道,使最窄处水分子的2 个氢原子定向到与通道轴线垂直的方向(图2)。
因此,中心处水分子的2 个氢原子无法与周围邻近的水分子形成氢键;另外,在通道最窄处的残基附近的氨基酸残基都是疏水的,因此不会有另外的残基与水分子的2 个氢原子形成氢键。
这一模式使得位于通道上下2 部分中的水分子在取向上相反,不利于形成氢键链,从而也阻断了质子通过“Grotthus 效应”完成连续传输,同时,因为疏水氨基酸不参与形成氢键,也保证了水分子在通过孔道时只需要跨越一个相当低的能量障碍[7,12]。
a:NPA 基序上的偶极矩改变了中心水分子的定向,使通道上下水分子取向相反。
b,c:水分子与Asn192、Asn76 的氨基形成氢键,水分子的2 个氢原子重定向至与通道轴线垂直[7]据已有研究,水通道蛋白几乎严格排斥其他所有离子。
从理论上来说,水合化的离子直径为7.16×10-10 m,而去水合化的离子只有1.9×10-10 m的直径,是可以通过最窄处为2.8×10-10 m 的中心通道的。
孔道狭窄的阳离子通道就具有使离子去水合化的能力,如KcsA 钾通道中就有16 个羰基氧以4 个每环的结构垛叠排列,这一结构具有分离与离子水合的水分子的能力。
而AQP1 中孔道中的羰基氧的结构虽然足以分离体相水中的水分子,但是只能使水合离子部分去水合化,而后者则因直径仍大于狭口直径而无法通过水通道[13]。
主要参考文献1 Denker B.M., Smith B.L., Kuhajda F.P. et al . Identification,purification, and partial characterization of a novel Mr 28000 integral membrane protein from erythrocytes and renal tubules.J Biol Chem,1988,263(3):15634.2 Preston G. M., Agre P.. Isolation of the cDNA for erythrocyte integral membrane protein of 28 kilodaltons:member of an ancient channel family. Proc Natl Acad Sci USA, 1991, 88:11110—11114.3 Preston G.M.,Carroll T.P., Guggino W.B.et al . Appearance ofwater channels in Xenopus oocytes expressing red cell CHIP28 protein.Science,1992, 256(5055):385—387.摘自《生物学通报》2011年第2期。
