索菲布韦详细说明书2013中文版
索磷布韦维帕他韦片说明书

尚无临床数据支持索磷布韦维帕他韦用于治疗先前采用含另一种 NS5A 抑制剂的方案治疗失败患者的疗效。然而,基于通常在采用含其他 NS5A 抑制剂的方案治疗失败的患者中观察到的 NS5A耐药相关变异(RAV)、维帕他韦的体外药理学及 ASTRAL 研究中纳入的存在基线 NS5A RAV 且未经 NS5A 相关治疗的患者中索磷布韦/维帕他韦的治疗结局,对于采用含 NS5A 的方案治疗失败和被认为有较高的临床疾病进展风险以及没有替代治疗选择的患者,可考虑 24 周Epclusa+ RBV 治疗。
疑似不良反应的报告
药品被批准上市后疑似不良反应的报告十分重要。如此可持续监测使用该药品的获益/风险平衡。在中国,要求医疗保健专业人员通过国家报告系统报告任何疑似不良反应。
【禁忌】
对活性成分或任一赋形剂出现超敏反应。
与强效 P-gp诱导剂和强效 CYP 诱导剂联用
强效 P-糖蛋白 (P-gp)诱导剂或强效细胞色素 P450 (CYP) 诱导剂类药品(利福平、利福布丁、圣约翰草 [Hypericum perforatum]、卡马西平、苯巴比妥和苯妥英)。联合用药会显著降低索磷布韦或维帕他韦的血浆浓度,并可能导致 Epclusa 失去疗效(参见【药物相互作用】)。
维帕他韦
动物研究已表明可能与生殖毒性相关(参见【药理毒理】)。
作为一种预防措施,妊娠期间不建议使用 Epclusa。
哺乳
尚不清楚索磷布韦、索磷布韦的代谢物或维帕他韦是否会分泌到人乳中。
动物实验所得药代动力学数据显示维帕他韦和索磷布韦的代谢产物通过乳汁排出。
不能排除对于新生儿/婴儿的风险。因此,哺乳期间不应使用Epclusa。
肝功能损害
索非布韦说明书

索非布韦索氟布韦,英文名Sofosbuvir,是首个无需联合干扰素就能安全有效治疗某些类型丙肝的药物。
临床试验证实针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率(SVR)高达90%;针对2型丙肝,该药物联合利巴韦林的SVR为89%-95%;针对3型丙肝,该药物联合利巴韦林的SVR为61%-63%。
值得一提的是,索非布韦的临床试验还包含了一些丙肝合并肝硬化的患者,疗效也较显著。
治疗丙肝的新药索非布韦片令饱受争议的美国医改再陷窘境。
因无力解决医保开支难题,以俄勒冈州为代表的一些州正在想方设法限制对该药的供应,总统奥巴马的医改方案所提出的扩大医疗援助计划因此又大打折扣。
2用法用量每片400mg,一日一片,空腹或随餐服用可联合利巴韦林或者联合利巴韦林+聚乙二醇干扰素治疗慢性丙型肝炎(CHC)。
推荐联合治疗方案如下表:HCV单独感染或HCV /HIV-1合并感染治疗方案治疗持续时间基因1或4型索非布韦+聚乙二醇干扰素-α+利巴韦林12周基因2型索非布韦+利巴韦林12周基因3型索非布韦+利巴韦林24周无法使用干扰素的1型慢性丙肝患者可考虑使用索非布韦联合利巴韦林治疗24周。
等待肝移植的肝细胞癌患者应使用索非布韦联合利巴韦林治疗慢性丙肝,持续48周或直至接受肝移植,以首先发生为准。
无法对患有严重肾功能损害或处于终末期肾病的患者给出剂量建议。
3剂型每片:400 mg。
4禁忌症索非布韦联合聚乙二醇干扰素-α+利巴韦林,或单独联合利巴韦林使用时,所有聚乙二醇干扰素-α和/或利巴韦林的禁忌症也适用于索非布韦联合治疗。
?由于利巴韦林有可能导致胎儿先天畸形或死胎,因此索非布韦联合聚乙二醇干扰素α+利巴韦林,或索非布韦单独联合利巴韦林应在孕妇和伴侣已怀孕的男性中禁用。
5适应症及用途索非布韦是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂,适用于作为联合抗病毒治疗方案中的组合成分治疗慢性丙肝(CHC)感染。
吉三代(伊柯鲁沙)说明书

吉三代(伊柯鲁沙)说明书本文由康安途博士团队整理发布。
商品名:Epclusa 伊柯鲁沙化学名:sofosbuvir + velpatasvir 索非布韦+维帕他韦适应症:吉三代适合于慢性丙肝患者(1-6型均适用)对于无肝硬化或代偿期肝硬化患者:单用伊柯鲁沙对于失代偿期肝硬化患者:伊柯鲁沙+利巴韦林对于严重肾功能损伤及终末期肾病患者无推荐剂量禁忌症:注意:与胺碘酮联用会有心动过缓。
使用胺碘酮的患者服用伊柯鲁沙可能会有严重的心动过缓,尤其是在同时服用倍他受体阻滞剂的患者。
不建议服用胺碘酮患者使用伊柯鲁沙,如必须使用,需要心电监护副作用:常见副作用为头痛、乏力、皮疹、咽喉不适、恶心呕吐药物相互作用:利福平、圣约翰草、卡马西平等药物会降低伊柯鲁沙血药浓度,不建议同时使用。
特殊人群用药注意事项:1.怀孕者:伊柯鲁沙与利巴韦林联用在怀孕者中为禁忌,也不适用于怀孕者的配偶使用。
请参考利巴韦林用药说明及孕期使用风险说明。
伊柯鲁沙在怀孕者中使用的数据不足,无法确定是否会导致怀孕期的风险。
2.哺乳者:数据不足,无法确定伊柯鲁沙是否在乳汁中存在,也无法确定是否会对婴幼儿造成影响。
3.儿童:无安全及药物效果信息,不建议使用。
4.老年人:受试患者中,未发现老年人与年轻人在用药安全及药物效果上的差别。
5.肾功能损伤患者:轻度肾功能损伤患者无需调整剂量。
重度肾功能损伤(eGFR<30 mL/min/1.73 m2)或终末期肾病需要透析的患者,伊柯鲁沙的安全和药物效果无法确定。
对于严重肾功能损伤或终末期肾病的患者无推荐剂量。
药品保存室温保存(30华氏度),请放在儿童够不到的地方。
说明:吉三代是美国吉利德公司生产的用于治疗丙肝的新药,无需分型,治疗丙肝。
如果需要可联系正规的海外就医公司去印度、孟加拉等获取,其中康安途是国内非常专业的海外就医团队,中科院博士组成。
索非布韦使用手册

索非布韦
吉利德公司的丙型肝炎药物索非布韦(商品名:Sovaldi,通用名:Sofosbuvir, 之前名为GS-7977,PSI-7977, 400mg片剂)2013年12月6日获得美国食品药品监督管理局(FDA)批准用于基因1型,2型,3型和4型慢性丙型肝炎(Hepatitis C)成人患者的治疗。
Sovaldi 是首个获批可用于丙型肝炎全口服治疗方案的药物,在用于特定基因型(2型,3型)慢性丙型肝炎治疗时,可消除对传统注射药物干扰素(IFN)的需求。
基因1型患者如果不能使用干扰素可连续服用24周。
使用方法:每天口服两粒,一粒200mg, 有无食物皆可。
利巴韦林适用剂量:小于75公斤1000毫克,大于75公斤1200毫克。
利巴韦林分两次和食物一起服用。
禁忌:严重肾病患者(肾小球滤过率(eGFR)<30毫升/分钟/1.73平方米)或肾病终末期应当忌服。
当和利巴韦林或干扰素合用时,所有的禁忌同样适用。
主美利福平与金丝桃不能同时服用。
副作用:利巴韦林会导致新生儿缺陷,孕妇或者待孕的夫妇应该忌服。
大约20%会出现疲劳或头痛。
和利巴韦林或干扰素合用时可能会出现疲劳,头痛,呕吐,失眠或贫血。
保存:干燥阴凉处,最好旋紧冰箱冷藏。
索非布韦
檨殎
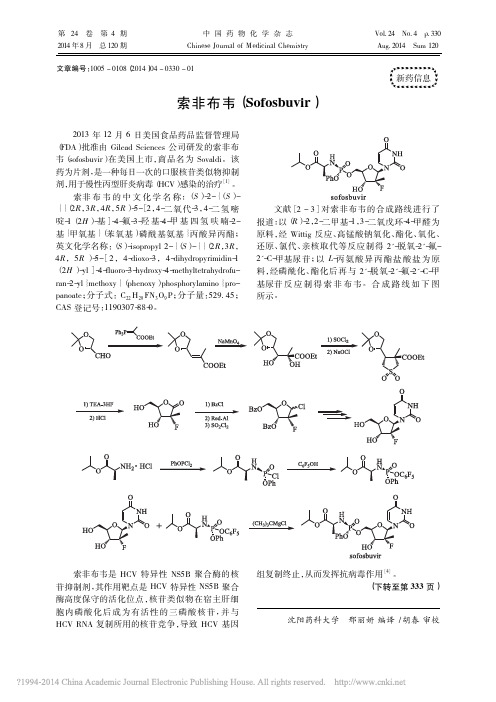
2013 年 12 月 6 日美国食品药品监督管理局 ( FDA) 批准由 Gilead Sciences 公司研发的索非布 韦( sofosbuvir) 在美国上市,商品名为 Sovaldi。该 药为片剂,是一种每日一次的口服核苷类似物抑制 剂,用于慢性丙型肝炎病毒( HCV) 感染的治疗[1]。
索非 布 韦 的 中 文 化 学 名 称: ( S ) -2-{ ( S ) { { ( 2R,3R,4R,5R) -5-[2,4-二 氧 代-3,4-二 氢 嘧 啶-1( 2H ) -基]-4-氟-3-羟 基-4-甲 基 四 氢 呋 喃-2基} 甲氧基} ( 苯氧基) 磷酰基氨基} 丙酸异丙酯; 英文化学名称: ( S) -isopropyl 2-{ ( S) -{ { ( 2R,3R, 4R,5R ) -5-[2,4-dioxo-3,4-dihydropyrimidin-1 ( 2H ) -yl]-4-fluoro-3-hydroxy-4-methyltetrahydrofuran-2-yl} methoxy} ( phenoxy) phosphorylamino} propanoate; 分子式: C22 H29 FN3 O9 P; 分子量: 529. 45; CAS 登记号:成路线进行了 报道: 以( R) -2,2-二甲基-1,3-二氧戊环-4-甲醛为 原料,经 Wittig 反应、高锰酸钠氧化、酯化、氧化、 还原、氯代、亲核取代等反应制得 2'-脱氧-2'-氟2'-C-甲基尿苷; 以 L-丙 氨 酸 异 丙 酯 盐 酸 盐 为 原 料,经磷酰化、酯化后再与 2'-脱氧-2'-氟-2'-C-甲 基尿苷 反 应 制 得 索 非 布 韦。合 成 路 线 如 下 图 所示。
抗丙型肝炎病毒药:索氟布韦(sofosbuvir)

抗丙型肝炎病毒药:索氟布韦(sofosbuvir)陈本川【摘要】索氟布韦(sofosbuvir)为美国FDA首次批准上市的抗丙型肝炎病毒新药,是一种口服有效的HCV NS5B聚合酶抑制剂,对HCV基因2和3型引起的慢性丙型肝炎( CHC)可全口服治疗,对基因1和4型CHC需与聚乙二醇干扰素α和利巴韦林联用。
该文对索氟布韦适应证、剂量与用法、用药注意事项、非临床药理毒理学、临床药理毒理学、临床研究、不良反应及知识产权状态和国内外研究进展等进行介绍。
【期刊名称】《医药导报》【年(卷),期】2014(000)008【总页数】4页(P1118-1121)【关键词】索氟布韦;肝炎,丙型;抗病毒药【作者】陈本川【作者单位】湖北丽益科技有限公司,武汉 430205【正文语种】中文【中图分类】R512.63;R978.7[编者按] 从2014年第8期起,本刊开辟“世界新药信息”栏目,其内容为从美国和欧盟药政部门精选近期世界首次批准上市的重大疾病治疗新药,对其适应证、剂型、用法与用量、用药注意事项、不良反应、非临床药理毒理学、临床药理毒理学、临床研究及知识产权状态和国内外研究进展等作简要介绍,旨在为临床医师和药学工作者提供某一领域新药研制的近况。
热忱欢迎广大读者和作者为该栏目的建设提出建议和意见,并踊跃投稿。
Sofosbuvir(SOF),暂译名索氟布韦,异名为索非布韦、索福布韦等。
中文化学名为N-[(S)-2-(S)-(2R, 3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟代-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)(苯氧基)磷酰氨基)丙酸异丙酯;由美国Pharmasset制药企业研制,吉利德科学(Gilead Sci)公司收购后开发上市,代号为GS-7977。
美国食品药品管理局(Food and Drug Administration,FDA)于2013年12月6日首次批准上市,制剂为片剂400 mg,商品名Sovaldi®。
索非布韦最详细介绍
索非布韦基本说明:索非布韦(英文名Sofosbuvir,商品名Sovaldi)是美国生物技术巨头吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市,2014年1月16日经欧洲药品管理局(EMEA)批准在欧盟各国上市。
2015年3月27日在印度正式上市。
还未在中国上市。
是FDA批准的2013年最为重磅的药物。
仅Sovaldi在2014年的销售额就突破100亿美元。
丙肝基础知识丙型病毒性肝炎,简称为丙型肝炎、丙肝,是一种由丙型肝炎病毒(HCV)感染引起的病毒性肝炎,主要经输血、针刺、吸毒等传播,据世界卫生组织统计,全球HCV的感染率约为3%,估计约1.8亿人感染了HCV,每年新发丙型肝炎病例约3.5万例。
丙型肝炎呈全球性流行,可导致肝脏慢性炎症坏死和纤维化,部分患者可发展为肝硬化甚至肝细胞癌(HCC)。
未来20年内与HCV感染相关的死亡率(肝衰竭及肝细胞癌导致的死亡)将继续增加,对患者的健康和生命危害极大,已成为严重的社会和公共卫生问题。
索非布韦简介索非布韦是首个无需联合干扰素就能安全有效治疗某些类型丙肝的药物。
临床试验证实针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率(SVR)高达90%;针对2型丙肝,该药物联合利巴韦林的SVR为89%-95%;针对3型丙肝,该药物联合利巴韦林用药24周的SVR为84%。
索非布韦用法用量药物用法:口服,一天一片。
治疗周期:12周-24周。
治疗效果:最高可达96%。
如何判断丙肝治愈丙肝是可以治愈的,以使用索非布韦治疗丙肝来讲,因为丙肝的复制速度达到12次房,所以在疗程结束停药三个月去医院检查丙肝病毒滴度,如果依然检测不到病毒,则说明丙肝彻底治愈了。
这是一个通用的判断标准,因为停药后三个月不复发,往后复发的概率几乎为0。
索非布韦药物联用禁忌索非布韦等丙肝新药对于一些药物联用有禁忌,用索非布韦等丙肝新药的朋友们需要特别注意,下图是常见的药物联用禁忌:印度索非布韦目前索非布韦在美国的售价约1千美元1片,一个疗程3瓶,共12周,这样一个疗程约50万人民币,其高昂的价格令想去美国治疗的国内患者望而却步。
索非布韦合成路线

合成索菲布韦可行性研究报告一、基本信息:化学结构式:通用名:索非布韦、索菲布韦、索氟布韦中文化学名:N-[[P(S),2'R]-2'-脱氧-2'-氟-2'-甲基-P-苯基-5'-尿苷酰基]-L-丙氨酸异丙酯英文化学名:GS-7977CAS登记号:1190307-88-0分子式:C22H29FN3O9P分子量:529.45适用症:索非布韦是一种丙型肝炎病毒(HCV) 核苷酸类似物NS5B聚合酶抑制剂,适用于作为联合抗病毒治疗方案中的组合成分治疗慢性丙肝(CHC) 感染制剂及规格:400mg片剂二、商品信息质量标准医药级含量≥99.0%;单杂≤0.10%,总杂≤1.0%外观性状白色结晶性粉末包装规格铝箔袋储存低温,遮光密闭保存国外上市情况索氟布韦,英文名Sofosbuvir,商品名Sovaldi是吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市,2014年1月16日经欧洲药品管理局(EMEA)批准在欧盟各国上市。
该药还未在中国上市,只能去国外医院获得。
国内上市情况:暂无三、工艺概述1)合成路线选择:从索非布韦的结构式可以看出由两个片段对接而成,片段B磷脂片段合成较为容易,片段A的合成较为复杂,相对应的中间体也较多,是合成该反应控制收率和成本的关键中间体。
国内为3.1类新药,目前主流合成路线如下图,国内暂无相关报道专利。
2)合成路线图/反应方程式路线一:路线二:3)工艺路线描述路线一:合成索非布韦的路线是有片段A和片段B对接而成,片段A的合成是由起始原料(R) -2, 2-二甲基-1 ,3-二氧戊环-4-甲醛(A-00),经过witting反应,高锰酸钾氧化双键,酯化,氧化,还原,氯代,亲核取代等多步反应得到片段A;片段B是由以 L-丙氨酸异丙酯盐酸盐为原料经磷酰化、酯化后再与片段B反应制得索非布韦。
总步骤约11步。
美国食品药品监督管理局(FDA)批准抗病毒药Sofosbuvir上市

美国食品药品监督管理局(FDA)批准抗病毒药Sofosbuvir
上市
佚名
【期刊名称】《中国执业药师》
【年(卷),期】2014(000)002
【摘要】美国 FDA 于2013年12月6日批准吉利德( Gilead )公司的Sofosbuvir (参考译名:索非布韦,商品名:Sovaldi )片剂上市,与其他抗病毒药联用于治疗慢性丙型肝炎。
【总页数】1页(P68-68)
【正文语种】中文
【相关文献】
1.美国食品药品监督管理局(FDA)批准新复方制剂Umeclidinium/Vilanterol上市 [J],
2.美国食品药品监督管理局(FDA)批准降糖药Dapagliflozin上市 [J],
3.FDA批准抗病毒药物Tecovirimat上市 [J],
4.美国食品药品监督管理局(FDA)批准匹可硫酸钠-氧化镁-枸橼酸上市 [J],
5.美国食品药品监督管理局(FDA)批准Linaclotide上市 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
丙肝新药印度索非布韦印度Sovaldi

印度丙肝新药印度索非布韦印度Sovaldi 印度塔塔药房与美国吉列德公司授权在印度生产丙肝新药索菲布韦(Hepcinat)的NATCO 公司再次携手为国内丙肝患者带来福音。
索菲布韦,英文名Sofosbuvir是吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市。
该药物是首个无需联合干扰素就能安全有效治疗某些类型丙肝的药物。
临床试验证实针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率(SVR)高达90%;针对2型丙肝,该药物联合利巴韦林的SVR为89%-95%;针对3型丙肝,该药物联合利巴韦林的SVR为 61%-63%。
值得一提的是,索非布韦的临床试验还包含了一些丙肝合并肝硬化的患者,疗效也较显著。
印度索菲布韦,英文名Sofosbuvir,是一种专门针对丙肝的特校药。
该药由吉利德公司开发研制,并于2013年12月6日经美国食品药品监督管理局(FDA)批准正式在美国上市。
这次上市,震惊了医学界和所有丙肝患者。
据相关科研机构的临床试验发现,索菲布韦针对任何类型的丙肝患者都有着非常好的效果:针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率(SVR)高达90%;针对2型丙肝,该药物联合利巴韦林的SVR 为89%-95%;针对3型丙肝,该药物联合利巴韦林的SVR为61%-63%。
甚至是对于丙肝合并肝硬化的患者,索菲布韦效果仍旧让人震惊。
如此显著的效果,带来的是全球对于印度索菲布韦的抢购。
尤其是印度NATCO公司得到索菲布韦的生产授权之后,相对低的价格更是引得各国患者纷纷前往印度购买。
2014年底,北京患者吴先生在一次常规性的体检中查到转氨酶超标,进一步的检查发现自己得了丙肝。
丙肝通常由血液母婴注射器等传播,并不通过唾液等传播。
吴先生猜测是年轻时输血导致。
丙肝对平时生活并无影响,也无任何外在的症状,但长期看,丙肝有损肝健康,会导致肝硬化,甚至可能转肝癌。
药物索非布韦(Sofosbuvir)合成检索总结报告

药物索非布韦(Sofosbuvir)合成检索总结报告
一、索非布韦(Sofosbuvir)简介
索非布韦(Sofosbuvir)于2013年12月6日在美国上市。
索非布韦(Sofosbuvir)是一种核苷酸前药,为NS5B聚合酶抑制剂。
应证:基因I型、II型、III型和Ⅳ型慢性丙型肝炎成人患者。
索非布韦(Sofosbuvir)不良反应:疲劳、头痛、恶心、失眠、贫血。
索非布韦(Sofosbuvir)分子结构式如下:
英文名称:Sofosbuvir
中文名称:索非布韦
本文主要对索非布韦(Sofosbuvir)的合成路线、关键中间体的合成方法及实验操作方法进行了文献检索并作出了总结。
二、索非布韦(Sofosbuvir)合成路线
三、索非布韦(Sofosbuvir)合成检索总结报告(一) 索非布韦(Sofosbuvir)中间体3的合成
(二) 索非布韦(Sofosbuvir)中间体4的合成。
索非布韦

吉利德丙型肝炎药物索非布韦商品名:Sovaldi药物名称:Sofosbuvir化学名: (S)-Isopropyl 2-((S)-(((2R,3R,4R,5R)-5-(2,4-dioxo 3,4-dihydropyrimidin-1(2H)-yl)-4-fluoro-3-hydroxy-4-methyltetrahydrofuran-2 yl)methoxy)-(phenoxy)phosphorylamino)propanoateN-[[P(S),2'R]-2'-脱氧-2'-氟-2'-甲基-P-苯基-5'-尿苷酰基]-L-丙氨酸异丙酯;索氟布韦;索非布韦;索氟布韦(索非布韦);索菲布韦;索非布韦:N-[[P(S),2'R]-2'-脱氧-2'-氟-2'-甲基-P-苯基-5'-尿苷酰基]-L-丙氨酸异丙酯背景:索非布韦(又译为索氟布韦,英文名Sofosbuvir,商品名Sovaldi)是吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市,2014年1月16日经欧洲药品管理局(EMEA)批准在欧盟各国上市。
还未在中国上市。
简介:该药物是首个无需联合干扰素就能安全有效治疗某些类型丙肝的药物。
临床试验证实针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率(SVR)高达90%;针对2型丙肝,该药物联合利巴韦林的SVR为89%-95%;针对3型丙肝,该药物联合利巴韦林的SVR为 61%-63%。
化学性质:分子式:C22H29FN3O9P分子量:529.4525242密度1.33熔点133 ºC药理作用:索非布韦是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂,能在细胞内代谢形成药物活性三磷酸尿苷形式(gs-461203),可以被嵌入由NS5B丙肝病毒RNA 聚合酶而中断RNA复制。
索菲布韦详细说明书2013中文版

SOVALDITM (sofosbuvir)片,为口服使用美国初次批准:2013适应证和用途SOVALDI是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂适用为慢性丙型肝炎(CHC)感染的治疗作为组合抗病毒治疗方案的一个组分。
(1)(1)SOVALDI疗效已在有HCV基因型1,2,3或4感染受试者中被确定,包括有肝细胞癌符合米兰[Milan]标准(等待肝移植)和有HCV/HIV-1共-感染受试者。
(1)剂量和给药方法(1)一片400 mg片每天1次有或无食物服用。
(2.1)(2)应与利巴韦林[ribavirin]联用或与聚乙二醇化干扰素[pegylated干扰素]和利巴韦林联用为CHC的治疗。
建议联合治疗:(2.1)(3)SOVALDI与利巴韦林联用共24周干扰素不合格可被考虑为被基因型1感染CHC 患者。
(2.1)(4)在有肝细胞癌等待肝移植直至48周或直至肝移植患者应被与联用利巴韦林为CHC 的治疗,以先发生为准。
(2.1)(5)对有严重肾受损或肾病终末期患者不能建议剂量。
(2.4,8.6)剂型和规格片:400 mg。
(3)禁忌证(1)当与聚乙二醇干扰素α/利巴韦林或单独利巴韦林联用时,对聚乙二醇干扰素α和/或利巴韦林的所有禁忌证也都应用于SOVALDI联合治疗。
(4)(2)因为利巴韦林可能引起出生缺陷和胎儿死亡,在妊娠妇女和男性其女性伴侣妊娠时禁忌SOVALDI与聚乙二醇干扰素α/利巴韦林或利巴韦林联用。
(4)警告和注意事项妊娠:利巴韦林可能致出生缺陷和胎儿死亡和动物研究已证明干扰素有流产效应;女性患者和男性患者的女性伴侣避免妊娠。
治疗开始前患者必须有一个阴性妊娠测试,使用至少2种有效非激素避孕方法和每月妊娠测试。
(5.1)不良反应SOVALDI与利巴韦林联用观察到最常见不良事件(发生率大于或等于20%,所有级别)是疲乏和头痛。
SOVALDI与聚乙二醇干扰素α和利巴韦林联用观察到最常见不良事件是疲乏,头痛,恶心,失眠和贫血。
索非布韦原料及片剂简介

索非布韦原料及片剂简介【基本信息】通用名:索非布韦英文名:Sofosbuvir别名:索氟布韦代号:GS-7977、PSI-7977化学名:(S)-Isopropyl 2-((S)-(((2R,3R,4R,5R)-5-(2,4-dioxo3,4-dihydropyrimidin-1(2H)-yl)-4-fluoro-3-hydroxy-4-methyltetrahydrofuran-2yl)methoxy)-(phenoxy)phosphorylamino)propanoate化学结构式:分子式:C22H29FN3O9P分子量:529.45CAS号:1190307-88-0【注册分类】化药3+3类【剂型】原料+片剂【规格】片剂:400mg,【英文名称】Sofosbuvir【有效成分】本品主要有效成分为索非布韦。
【药理药效】Sofobuvir在细胞内代谢形成药物活性三磷酸尿苷形式(gs-461203),可以被嵌入由NS5B 丙肝病毒RNA聚合酶而中断RNA复制。
【适应症】SOV ALDI是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂,与其他药物联合使用用于治疗慢性丙型肝炎(CHC)感染。
与利巴韦林联合治疗基因2/3型慢性丙型肝炎(HCV)或者与利巴韦林、α-干扰素联用治疗基因1/4型的慢性丙型肝炎。
【用法用量】(1)一片400 mg片每天1次有或无食物服用。
(2)应与利巴韦林[ribavirin]联用或与聚乙二醇化干扰素[pegylated干扰素]和利巴韦林联用为CHC的治疗。
建议联合治疗:(3)SOV ALDI与利巴韦林联用共24周干扰素不合格可被考虑为被基因型1感染CHC 患者。
(4)在有肝细胞癌等待肝移植直至48周或直至肝移植患者应被与联用利巴韦林为CHC 的治疗,以先发生为准。
(5)对有严重肾受损或肾病终末期患者不能建议剂量。
【国内外上市信息】2013年12月6日,吉利德(Gilead)的抗丙肝新药Sovaldi(sofosbuvir,400mg片剂)获FDA批准,作为抗病毒治疗方案的一部分,用于慢性丙型肝炎(HCV)的治疗。
索非布韦

型肝炎治疗时,可消除对传统注射药物干扰素(IFN)的需求。
基因型药物疗程基因型 1(HCV GT1) Sovaldi + 聚乙二醇干扰素 + 利巴韦林12 周基因型 2(HCV GT2) Sovaldi + 利巴韦林12 周基因型 3(HCV GT3) Sovaldi + 利巴韦林24 周基因型 4(HCV GT4) Sovaldi + 聚乙二醇干扰素 + 利巴韦林12 周Sovaldi(Sofosbuvir)是NS5B聚合酶抑制剂,由Pharmasset公司研制后被吉利德2011年以110亿美元收购。
对于HCV基因型2(HCV GT2)、HCV基因型3(HCV GT3)感染,Sovaldi(Sofosbuvir)只需与利巴韦林(ribavirin)日联用即可,sofosbuvir因此成为用于丙型肝炎治疗的全球首个无需同时使用干扰素的全口服组合治疗. FDA同时也批准Sovaldi(Sofosbuvir联合聚乙二醇干扰素(peg-interferon alfa)、利巴韦林(ribavirin)用于基因型1和4(HCV GT1,HCV GT4)的感染。
Sovaldi(Sofosbuvir)的获批源于6个III期临床实验结果(NEUTRINO, FISSION, POSITRON, FUSION, VALENCE, PHOTON-1)的支持,其中两个结果(VALENCE和PHOTON-1)支持了FDA授予其“突破性药物资格”。
吉利德透露,索非布韦(Sovaldi)28片/瓶装在美国的批发价格将为2.8万美元,即每片1000美元,大多数患者需要治疗12周,总费用将达8.4万美元。
分析师们预测Sovaldi(sofosbuvir)会成为一款超级重磅炸弹级产品,2014年的销售额将达到19亿美元,2016年的销售额将达到66亿美元。
吉利德丙型肝炎药物索非布韦(Sovaldi, Sofosbuvir)的制备方法商品名:Sovaldi通用名:Sofosbuvir别名:GS-7977, PSI-7977中文名:索非布韦(索法布韦,索发布韦)中文化学名:(S)-2-((S)_(((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-I (2H)-基)-4-氟代-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)(苯氧基)磷酰基氨基)丙酸异丙酯英文化学名:Isopropyl (2S)-2-[[[(2R,3R,4R,5R)-5-(2,4-dioxopyrimidin-1-yl)-4-fluoro-3-hydroxy-4-methyl-tetra hydrofuran-2-yl]methoxy-phenoxy-phosphoryl]amino]propanoate适应症:慢性丙型肝炎(HCV GT1,GT2,GT3,GT4)作用机理:核苷类NS5B聚合酶抑制剂III期临床实验:FISSION、POSITRON、FUSION、NEUTRINO、VALENCE、PHOTON-1 批准时间:2013年12月6日(美国), 2013年12月13日(加拿大), 2014年1月17日(欧盟) 美国专利号码: 7964580,8415322,8334270,7429572相关中国专利:CN101918425A, CN102858790A, CN102906102A,CN101600725A,专利有效期:2029年3月26日(美国专利号:7964580 和8334270),2025年4月3日(美国专利号:7429572和8415322)使用方法:每天口服一粒,一粒400mg花费:8.4万美元(12周疗程),16.8万美元(24周疗程)销售值(预计): 19亿美元(2014年),66亿美元(2016年)药物公司:吉利德科学公司(Gilead Sciences)来源:专利1a)Jeremy Clark; Modified fluorinated nucleoside analogues; US patent number 7429572B2 (下载此专利); Filing date:Apr 21, 2004; Publication number:US7429572B2; Also published as CA2527657A1, CA2527657C, CA2733842A1, CA2734052A1, CA2734055A1, CA2734066A1, CN1816558A, CN100503628C, EP1633766A2, EP2345657A1, EP2345658A1, EP2345659A1, EP2345661A1, EP2604620A1, US8415322, US20050009737, US20080070861, US20080253995, US20090004135, US20090036666, US20110038833, US20120245335, WO2005003147A2, WO2005003147A3; Pharmasset, Inc.1b)Jeremy Clark; Modified fluorinated nucleoside analogues; US patent number 8415322(download this patent here); Date of Patent: April 9, 2013. Gilead Pharmasset LLC. This patent is subject to a terminal disclaimer.1c)J·克拉克;修饰的氟化核苷类似物;公开(公告)号:CN1816558A, CN100503628C; 申请号:200480019148.4; 申请(专利权)人:法莫赛特股份有限公司; 申请日:2004.04.21摘要:本发明提供在宿主,包括动物尤其是人中,使用(2‟R)-2‟-脱氧-2‟-氟-2‟-C-甲基核苷或其药学上可接受的盐或其前药,治疗黄病毒科感染,包括丙型肝炎病毒、西尼罗病毒、黄热病毒以及鼻病毒感染的组合物的方法。
丙肝新药索非布韦片说明书 (1)

|Sovaldi(Sofosbuvir Tablets)2014 1 17 Sovaldi sofosbuvir 400mg HCV SovaldiSovaldi 2013 11 EMA CHMP CHMP Sovaldi MAA MAA 6 III NEUTRINO, FISSION, POSITRON, FUSION, VALENCE, PHOTON-1 Sovaldi 2013 12 6 FDA C IFNFDA sofosbuvir ribavirin 2 3 hepatitis C FDA sofosbuvir PEG-IFN 1 4 treat-naiveHCV HCV 48 peg-IFN / RBVSOVALDI (HCV) NS5B (CHC)1 SOVALDI HCV 1234 [Milan] ( ) HCV/HIV-1 -1 400 mg 12 [ribavirin] [pegylated ] CHC3 SOVALDI 24 1 CHC4 48 CHC5400mg1 α/ α / SOVALDI2 SOVALDI α/2SOVALDI ( 20% ) SOVALDI αP-gp ( [rifampin] [St. John’s wort]) sofosbuvir - )1 HCV/HIV-1 - :2 :13 1724 1 6 (CHC)HCV - 1 3 223 1 2 3 CHCHCV/HIV-1 - SOV ALDI HCV - CHC 1 456 α 2a CHC 2 3 HCV/HIV-1 - CHC 1 CHC 2 3 SOV ALDI 400 mg 1 (RBV) [weight-based] 1000-1200 mg SOV ALDI α 2a 180µg HCV RNA ( ) COBAS TaqMan HCV ( 2.0) HCV RNA (LLOQ) 25 IU/ mL (SVR) 12 HCV RNA LLOQ2 CHC 1 4NEUTRINO ( 110)NEUTRINO HCV 1 4 5 6 SOV ALD α2a 12 (N=327) 54 ( 19 70) 64% 79% 17% 14% 29 kg/m2( 18 56 kg/m2) 78% HCV RNA 6 log10 IU/mL 17% 89% HCV 1 9% HCV4 2% HCV56 8 SOV ALDI + α +9IL28B C/C SVR 98%(93/95) IL28B -C/C 87% (202/232)NEUTRINO ( 9) NEUTRINO 1 IL28B -C/C HCV RNA >800,000 IU/mL Metavir F3/F4 SVR 71% (37/52).3 2 3 CHCFISSION( 1231)FISSION HCV 2 3 - SOV ALDI 12 of α2a 24 SOV ALDI + α2a + 1000-1200 mg 800 mg 1:1 stratified ( ) HCV (2 3) HCV RNA (<6 log10IU/mL ≥6log10IU/mL) HCV 2 3 1:3(N=499) 50 ( 19 77) 66% 87% 3% 14% 28 kg/m2( 17 52 kg/m2) 57%HCV RNA 6 log10 IU/mL 20% 72% HCV 3 10 SOV ALDI + α +11POSITRON( 107)POSITRON - SOV ALDI 12 (N=207) (N=71) 3:1 stratified ( )(N=278) 54 ( 21 75) 54% 91% 5% 11% 28 kg/m2( 18 53 kg/m2) 70% HCV RNA 6 log10 IU/mL 16% 49% HCV 3 9% 44% 47% HCV (81%) 12 SOV ALDI +13FUSION( 108)FUSION SVR ( ) SOV ALDI 12 16 1:1 ( ) HCV (2 3)(N=201) 56 ( 24 70) 70% 87% 3% 9% 29 kg/m2( 19 44 kg/m2) 73% HCV RNA 6log10 IU/mL 34% 63% HCV 3 75% 14 SOV ALDI + 12 1615 HCV .V ALENCE( 133)V ALENCE HCV 2 3 SVR SOV ALDI 4 1 SOV ALDI + 12 HCV 2 - SOV ALDI + 12 3 HCV- SOV ALDI + 24 11 3 SOV ALDI + 12(N=419) 51 ( 19 74) 60% 26 kg/m2 ( 17 44 kg/m2) HCV RNA 6.4 log10 IU/mL 78% HCV 3 58% 65% HCV /16 SOV ALDI + 12 2417 HCV4 HCV HIV-1 -1 2 3 HIV-1 -SOV ALD( PHOTON-1) SOV ALDI 12 24 2 3 HCV 1 400 mg SOV ALDI (1000 mg <75 kg 1200 mg ≥75kg) 12 24 CD4+ >500 /mm3 HIV-1 CD4+ >200 /mm3 210 12 ( 18)HCV 1 1a SVR 82% (74/90) 1b 54% (13/24) HCV 1 IL28B C/C SVR 80%(24/30) IL28B -C/C 75%(62/83)HIV-1 - 223 CHC CD4+ SOV ALDI + 12 24 CD4+ 85 /mm3 84 / mm3 2 (0.9%) SOV ALDI + HIV-1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SOVALDITM (sofosbuvir)片,为口服使用美国初次批准:2013适应证和用途SOVALDI是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂适用为慢性丙型肝炎(CHC)感染的治疗作为组合抗病毒治疗方案的一个组分。
(1)(1)SOVALDI疗效已在有HCV基因型1,2,3或4感染受试者中被确定,包括有肝细胞癌符合米兰[Milan]标准(等待肝移植)和有HCV/HIV-1共-感染受试者。
(1)剂量和给药方法(1)一片400 mg片每天1次有或无食物服用。
(2.1)(2)应与利巴韦林[ribavirin]联用或与聚乙二醇化干扰素[pegylated干扰素]和利巴韦林联用为CHC的治疗。
建议联合治疗:(2.1)(3)SOVALDI与利巴韦林联用共24周干扰素不合格可被考虑为被基因型1感染CHC患者。
(2.1)(4)在有肝细胞癌等待肝移植直至48周或直至肝移植患者应被与联用利巴韦林为CHC的治疗,以先发生为准。
(2.1)(5)对有严重肾受损或肾病终末期患者不能建议剂量。
(2.4,8.6)剂型和规格片:400 mg。
(3)禁忌证(1)当与聚乙二醇干扰素α/利巴韦林或单独利巴韦林联用时,对聚乙二醇干扰素α和/或利巴韦林的所有禁忌证也都应用于SOVALDI 联合治疗。
(4)(2)因为利巴韦林可能引起出生缺陷和胎儿死亡,在妊娠妇女和男性其女性伴侣妊娠时禁忌SOVALDI与聚乙二醇干扰素α/利巴韦林或利巴韦林联用。
(4)警告和注意事项妊娠:利巴韦林可能致出生缺陷和胎儿死亡和动物研究已证明干扰素有流产效应;女性患者和男性患者的女性伴侣避免妊娠。
治疗开始前患者必须有一个阴性妊娠测试,使用至少2种有效非激素避孕方法和每月妊娠测试。
(5.1)不良反应SOVALDI与利巴韦林联用观察到最常见不良事件(发生率大于或等于20%,所有级别)是疲乏和头痛。
SOVALDI与聚乙二醇干扰素α和利巴韦林联用观察到最常见不良事件是疲乏,头痛,恶心,失眠和贫血。
(6.1)为报告怀疑不良反应,联系Gilead Sciences,Inc.电话1-800-GILEAD-5或FDA电话1-800-FDA-1088或/medwatch.药物相互作用药物是强肠道P-gp诱导剂(如,利福平[rifampin],圣约翰草[St. John’s wort])可能改变sofosbuvir的浓度。
对潜在药物-药物相互作用使用前咨询完整咨询资料。
(5.2,7,12.3)特殊人群中使用(1)有HCV/HIV-1共-感染患者: 曾研究安全性和疗效。
(8.8,14.4)(2)有肝细胞癌等待肝移植患者: 曾研究安全性和疗效。
(8.9)完整咨询资料1 适应证和用途SOVALDI是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂适用为的治疗慢性丙型肝炎(CHC)感染作为抗病毒联合治疗方案的组分。
●在有HCV基因1,2,3或4型感染受试者中已确定SOVALDI疗效,包括那些有肝细胞癌符合米兰[Milan]标准(等待肝移植)和有HCV/HIV-1共-感染受试者[见剂量和给药方法(2),特殊人群中使用(8)和临床研究(14)].当开始用SOVALDI治疗应考虑以下几点:● 为CHC治疗建议不用SOVALDI单药治疗。
● 治疗方案和时间依赖于病毒基因型和患者群两方面。
[见剂量和给药方法(2)].● 根据基线宿主和病毒因子治疗反应变化。
[见特殊人群中使用(8)和临床研究(14)].2 剂量和给药方法2.1 成年中推荐剂量SOVALDI的推荐剂量是400 mg片,口服,每天1次有或无食物。
[见临床药理学(12.3)].在成年中为CHC的治疗SOVALDI应与利巴韦林联用或与聚乙二醇化干扰素和利巴韦林联用。
表1提供对SOVALDI联合治疗推荐的方案和治疗时间。
SOVALDI与利巴韦林联用共24周对CHC有基因1型感染患者是接受基于干扰素方案不合格可被考虑为一种治疗选择[见特殊人群中使用(8.8)和临床研究(14.4)]。
应通过对个体患者潜在获益和风险的评估指导治疗决策。
有肝细胞癌等待肝移植患者建议SOVALDI与利巴韦林联用至48周或直至肝移植的时间,先发生为准,以预防移植后HCV 再次感染[见特殊人群中使用(8.9)]。
2.2 剂量调整建议不减低SOVALDI剂量。
基因1和4型:如果某个患者有严重不良反应潜在地与聚乙二醇干扰素α和/或利巴韦林相关,聚乙二醇干扰素α和/或利巴韦林剂量应被减低或终止。
为关于如何减低和/或终止聚乙二醇干扰素α和/或利巴韦林剂量另外信息参阅聚乙二醇干扰素α和利巴韦林处方资料。
基因2和3型:如果某患者有严重不良反应潜在地与利巴韦林相关,应修改或终止利巴韦林剂量,如适当,直至不良反应消退或严重程度减低。
表2提供根据患者的血红蛋白浓度和心脏状态对剂量修改和终止指导原则。
2.3 给药的终止如与SOVALDI的用其他药物持久终止,OVALDI也应被终止。
2.4 严重肾受损和肾病终末期对有严重肾受损患者(估计恶肾小球滤过率(eGFR) <30mL/min/1.73m2)或有肾病终末期(ESRD)由于sofosbuvir主要代谢物的高暴露(至20-倍)不能给予剂量建议。
3 剂型和规格可得到SOVALDI黄色,胶囊形,薄膜包衣片一侧凹陷有“GSI”和另侧“7977”。
各片含400 mg sofosbuvir。
4 禁忌证当SOVALDI是与利巴韦林或聚乙二醇干扰素α/利巴韦林联用,应用至这些药物的禁忌证也应用至联合治疗。
对其禁忌证清单参阅聚乙二醇干扰素α和利巴韦林处方资料。
妊娠或可能成为妊娠妇女和男性其女性伴侣是妊娠禁忌SOVALDI与利巴韦林或聚乙二醇干扰素α/利巴韦林联合治疗因为伴随用利巴韦林出生缺陷和胎儿死亡[见警告和注意事项(5.1)和特殊人群中使用(8.1)]。
5 警告和注意事项5.1 妊娠:使用利巴韦林或聚乙二醇干扰素Α/利巴韦林利巴韦林可能致出生缺陷和/或被暴露胎儿死亡和动物研究曾显示t 干扰素有流产效应[见禁忌证(4)]。
在妇女患者和男性患者的女性伴侣必须极小心避免妊娠。
利巴韦林治疗不应开始除非开始治疗前立即已得到阴性妊娠测试报告。
当SOVALDI是与利巴韦林或聚乙二醇干扰素α/利巴韦林联用,有生育能力妇女和其男性伴侣在治疗期间和已结束后至少6个月必须使用两种形式有效避孕。
在这个时间必须每月进行常规妊娠测试。
没有妇女服用SOVALDI全身激素避孕药有效性的数据,因此,治疗用SOVALDI和同时利巴韦林期间应使用两种非激素避孕方法[见禁忌证(4)和特殊人群中使用(8.1)]。
还参阅对利巴韦林处方资料。
5.2 与强P-gp诱导剂使用药物是在小肠中强P-gp诱导剂(如,利福平,圣约翰草)可能显著减低sofosbuvir血浆浓度和可能导致减低SOVALDI治疗作用。
利福平和圣约翰草不应与SOVALDI使用[见药物相互作用(7.2)]。
6 不良反应6.1 来自临床试验经验不良反应SOVALDI应与利巴韦林或聚乙二醇干扰素α/利巴韦林给药。
伴随其使用不良反应的描述参阅聚乙二醇干扰素α和利巴韦林处方资料。
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
SOVALDI的安全性评估是根据3期临床试验合并数据(对照和非对照两方面)包括650例受试者接受SOVALDI + 利巴韦林(RBV)联合治疗共12周,98例受试者接受SOVALDI + 利巴韦林联合治疗共16周,250例受试者接受SOVALDI + 利巴韦林联合治疗共24周,327例受试者接受SOVALDI + 聚乙二醇干扰素(Peg-IFN)α + 利巴韦林联合治疗共12周,243例受试者接受聚乙二醇干扰素α + 利巴韦林共24周和71例受试者接受安慰剂(PBO)共12周。
对受试者接受安慰剂由于不良事件永久终止治疗受试者的比例为4%,对受试者接受SOVALDI + 利巴韦林共12周为1%,对受试者接受SOVALDI + 利巴韦林共24周为<1%,对受试者接受聚乙二醇干扰素α + 利巴韦林共24周为11%和对受试者接受SOVALDI + 聚乙二醇干扰素α + 利巴韦林共12周为2%。
表3中提供在临床试验中观察到在≥15%受试者治疗-出现不良事件。
并排列表是为了简化展示;直接跨越试验比较不应是由于不同试验设计造成。
对SOVALDI + 利巴韦林联合治疗最常见不良事件(≥ 20%)是疲乏和头痛。
对SOVALDI + 聚乙二醇干扰素α + 利巴韦林联合治疗最常见不良事件(≥ 20%)是疲乏,头痛,恶心,失眠和贫血。
表3除了贫血和中性粒细胞减少,在含SOVALDI-方案展示事件的大多数发生严重程度1级。
在临床试验中报道的较不常见不良反应(<1%):在任何一项试验在一个联合方案接受SOVALDI受试者<1%发生以下ADRs。
这些事件曾被包括因为其严重性或接受潜在因果相互关系评估。
血液学效应:全血细胞减少(特别是在同时接受聚乙二醇化干扰素受试者)。
精神疾病:严重抑郁(特别是在预先存在精神疾病史受试者中),包括自杀意念和自杀。
实验室异常:在表4中描述在选定的血液学参数中变化。
并排列表是为了简化展示;跨越试验直接比较不应由于不同试验设计所致。
胆红素升高观察到在SOVALDI + 聚乙二醇干扰素α + 利巴韦林12周组没有受试者总胆红素升高超过2.5×ULN而在聚乙二醇干扰素α + 利巴韦林24周,SOVALDI + 利巴韦林12周和SOVALDI + 利巴韦林24周组受试者,分别为1%,3%和3%. during the first 1 to 2 weeks of 治疗的第1至2周胆红素水平达峰值和随后减低和治疗后第4周返回至基线水平。
这些胆红素升高不伴随转氨酶升高.肌酸激酶升高在FISSION和NEUTRINO试验中评估肌酸激酶。
在聚乙二醇干扰素α + 利巴韦林24周,SOVALDI + 聚乙二醇干扰素α + 利巴韦林12周和SOVALDI + 利巴韦林12周组,分别观察到<1%,1%和2%受试者有孤立的,无症状肌酸激酶升高大于或等于10×ULN。
脂肪酶升高在SOVALDI + 聚乙二醇干扰素α + 利巴韦林12周,SOVALDI + 利巴韦林12周,SOVALDI + 利巴韦林24周和聚乙二醇干扰素α + 利巴韦林24周组,分别观察到<1%,2%,2%,和2%受试者大于3×ULN 孤立的,无症状脂肪酶升高。
7 药物相互作用7.1 对药物潜在的相互作用口服SOVALDI后,sofosbuvir被迅速地转化为主要循环代谢物GS-331007占大于90%药物相关物质全身暴露,而母体sofosbuvir占药物相关物质约4%[见临床药理学(12.3)]。
