南京师范大学物理化学考研真题2物理化学2010
南京师范大学物理科学与技术学院普通物理(力学、电磁学部分)历年考研真题专业课考试试题

2016年南京师范大学638普通物理(力 学、电磁学部分)考研真题
2011年南京师范大学626普通物理(力学、电磁学)考研真题
2012年南京师范大学625普通物理(力学、电磁学)考研真题
2013年南京师范大学639普通物理(力学、电磁学部分)考研真题
2014年南京师范大学641普通物理(力学、电磁学部分)考研真题
2015年南京师范大学643普通物理(力学、电磁学部分)考研真题
2016年南京师范大学638普通物理(力学、电磁学部分)考研真题
目 录
2011年南京师范大学626普通物理(力 学、电磁学)考研真题
2012年南京师范大学625普通物理(力 学、电磁学)考研真题
2013年南京师范大学639普通物理(力 学、电磁学部分)考研真题
2014年南京师范大学普通物理(力 学、电磁学部分)考研真题
2015年南京师范大学643普通物理(力 学、电磁学部分)考研真题
南京师范大学考研真题清单

中国古代文学史2013-2017
中国现当代文学史1999-2017(2010-2012科目为综合基础,部分年份整理版)
专业二:
807外国文学史(古代到20世纪)2000-2018(部分年份整理版)
8.应用文体学
专业一:
610文学基础2017-2018(2017年新考试科目)
2.英语语言文学01、04方向
专业一:
623外国语言文学基础知识与汉语写作2010-2012、2016-2018
英语文学基础知识与写作2013-2015(汉语答题)
英语语言学基础知识与写作2013-2015(汉语答题)
专业二:
829英语文学基础知识与翻译2016-2018
英文翻译与写作2010-2015
4.翻译硕士
专业一:
211翻译硕士英语2010-2018(含答案2010-2015、2017)
专业二:
357英语翻译基础2010-2018(缺2011年,含答案2010-2015、2017)
专业三:
448汉语写作与百科知识2010-2018(含答案2010-2015、2017)
5.二外日语2001-2018
古代汉语2007-2016(2007-2012科目为语言学与古代汉语)
文献阅读基础2013-2016
专业二:
804中国古典文献学2011-2018
5.中国古代文学
专业一:
610文学基础2017-2018(2017年新考试科目)
文学理论基础与文学评论写作2013-2016(2013科目为外国文学评论写作)
古代汉语2007-2016(2007-2012科目为语言学与古代汉语)
专业二:
[考研类试卷]考研物理化学(电化学)历年真题试卷汇编2.doc
![[考研类试卷]考研物理化学(电化学)历年真题试卷汇编2.doc](https://img.taocdn.com/s3/m/e5a98d620722192e4436f601.png)
[考研类试卷]考研物理化学(电化学)历年真题试卷汇编2一、填空题请完成下列各题,在各题的空处填入恰当的答案。
1 KCl常用作构造盐桥的试剂,因为其具备______的特性。
需注意,如果溶液中含有某些离子,如______,则应改换其他合适的盐。
(2014年南京航空航天大学)2 离子独立运动定律适用于无限稀释条件下的______电解质和______电解质。
(2013年南京航空航天大学)3 已知某电解质正离子的运动速率与负离子的运动速率的关系是:v-=0.6v+,则负离子的迁移数t-等于______,正离子的迁移数t+等于______。
(2012年南京航空航天大学)4 溶液中含有活度均为1.00的H+、Zn2+、Pb2+。
已知H2在阴极上析出的超电势为0.4 V,则正确的析出顺序是______。
已知:EΘ(Zn2+|Zn)=一0.763 0 V;EΘ(Ph2+|Pb)=一0.1265 V。
(2012年南京航空航天大学)二、单项选择题下列各题的备选答案中,只有一个是符合题意的。
5 已知25℃,EΘ(Cl-|Cl2)=1.360 V,EΘ(OH-|O2)=0.401 V,EΘ(Cu2+|Cu)=0.337 V。
现以铜板做电极,电解0.00l mol/kg CuCl2水溶液,设O2和Cl2在铜电极上的超电势可忽略,则当电解池的电压由小到大变化时,在阳极上首先进行的电极反应为( )(2015年西北大学)(A)2OH-一2e→O2+H2O(B)Cu一2e→Cu2+(C)2Cl-一2e→Cl2(D)无法判定6 在Hittorf法测迁移数的实验中,用Ag电极电解AgNO3溶液,测出在阳极部AgNO3的浓度增加了xmol,而串联在电路中的Ag库仑计上有ymol的Ag析出,则Ag+迁移数为( )(2013年西北大学)(A)x/y(B)y/x(C)(x—y)/x(D)(y一x)/y7 盐桥的作用是( )(2015年南京师范大学)(A)将液接电势完全消除(B)将不可逆电池变成可逆电池(C)将液接电势降低到可以忽略不计(D)相当于一根导线将两个电解质溶液沟通8 当有电流通过时,电极发生极化。
2010年硕士学位研究生入学考试物理化学试题

$ $ (D) Pt|H 2 (p )|H 2 SO4 ( a ) |O 2 (p )|Pt
30.电池的电动势测定中不需要用到的装置或方法是: (A) 对消法 (B) Wheatstone 电桥 (C) 温度计 (D) 标准电池
+ 31.298K 时,在 Pt | H 2 ( p = 1 atm) | H ( aH + ) CuSO4 ( aCuSO4 ) | Cu ( s ) 右边的
考试科目: 物理化学 第 3 页 共 6 页
(D) 活化熵
(A) θ = k ⋅ p1/n
a ⋅p (C) θ = 1+ a ⋅ p
= (B) θ
RT ln ( A 0 ⋅ p ) a
C⋅p ( ps − p ) 1 + ( c − 1) p / ps
(D)
V = Vm
25.对反 应 A3+ + B2- ⇔ {A⋅⋅⋅B}+ → P,当向体系中加入惰性支持电解质时,其 反应速率常数将: (A) 增大 (B)减小 (C)不变 (D)很难确定 26.当电解池的两极流过一定电流时,阴极和阳极的电势(用ϕc 和ϕa 表示) 将比平衡时的电极电势 (A) 二者均更正 (B) 二者均更负 (C) ϕc 更负,ϕa 更正 (D) ϕc 更正,ϕa 更负 27.一定浓度下,某强电解质溶液的摩尔电导率是 0.12 Ω-1⋅m2⋅mol-1, 当向该 溶液加入 2 m3 的水时,其摩尔电导率将 (A) 增大 (B)减小 (C)不变 (D)很难确定 28.通过电沉积的方式对溶液中金属离子 A2+和 B2+进行分离, 若要使[A2+] ≤ 10-7∙[B2+], 则要求ϕB2+|B − ϕA2+|A (A) > 0.21 V (B) < -0.21 V (C) >0.14 V (D) <-0.14 V 29.下列电池中,哪一个不能用来测量 H2O 的离子积 KW?
南京师范大学年研究生物理化学考试真题(2001-2015)

南京师范大学 2012 年研究生入学考试试卷
南京师范大学 2013 年研究生入学考试试卷
南京师范大学 2014 年研究生入学考试试卷
南京师范大学 2015 年研究生入学考试试卷
南京师范大学 2007 年研究生入学考试试卷
B C=2; f=2 D C=3; f=2
南京师范大学 2008 年研究生入学考试试卷
南京师范大学 2009 年研究生入学考试试卷
南京师范大学 2010 年研究生入学考试试卷
南京师范大学 2011 年研究生入学考试试卷
南京师范大学 2001 年研究生入学考试试卷
南京师范大学 2002 年研究生入学考试试卷
南京师范大学 2003 年研究生入学考试试卷
南京师范大学 2004 年研究生入学考试试卷
南京师范大学 2005 年研究生入学考试试卷
南京师范大学 2006 年研究生入学考试试卷
(NEW)傅献彩《物理化学》(第5版)(上册)配套题库【名校考研真题+课后习题+章节题库+模拟试题】

目 录第一部分 名校考研真题第1章 气 体第2章 热力学第一定律2.1 mol理想气体依pV2 =C(C为常数)从100 kPa,47.64dm3可逆膨胀到57.72dm3,求该过程的ΔH、ΔU、Q、W。
已知Cv,m =20.9 J.K-1.mol-1。
[华南理工大学2010研]第3章 热力学第二定律第4章 多组分系统热力学及其在溶液中的应用4.298 K时.有一浓度为xB的稀水溶液,测得渗透压为1.38×l06Pa,试求:第5章 相平衡第6章 化学平衡第7章 统计热力学基础2.1 mol双原子分子理想气体,当其温度由T2=2T1时,若其转动惯量不变,则其转动熵将是( )。
[首都师范大学2010研]第二部分 课后习题第1章 气 体15.273 K和100 kPa时,有1mol某实际气体符合Virial型状态方程,,已知第二Virial系数。
试求该气体在这时所占的体积。
18.348 K时,0.3 kg NH3(g)的压力为1.61×103kPa,试用下述两种方法计算其体积。
试比较哪种方法计算出来的体积与实测值更接近(已知实测值为28.5 dm3)。
已知在该条件下NH3(g)的临界参数为:Tc=405.6 K,pc=1.13×104 kPa;van der Waals气体常数:a=0.417 Pa·m6·mol-2,b=3.71×10-5 m3·mol-1。
第2章 热力学第一定律3.1 mol单原子理想气体,始态(1)的温度为273K,体积为22.4dm3,经历如下三步,又回到始态,请计算每个状态的压力、10.1 mol单原子理想气体,从始态:273 K,200kPa,到终态323 K,100 kPa,通过两个途径:11.273 K,压力为的体积为2.0dm3在外压为100 kPa下等温膨胀,直到N2(g)的压力也等于100 kPa为止。
《物理化学》试卷及答案解析

《物理化学》试卷及答案解析一、填空题(每小题2分,共20分)1、状态函数可分为两类:其数值在系统中具有加和性的是,请举三个这类函数的例子;其数值取决于系统自身而与系统中物质数量无关的是,请举三个这类函数的例子。
2、写出Joule-Thomson系数的定义式:。
若Joule-Thomson系数大于0,则该气体经节流过程后,随压力降低,温度。
3、可逆热机的效率与两热源温度的关系是;在其他条件都相同的前提下,用可逆热机去牵引机车,机车的速度将会是。
4、Zn与稀硫酸作用,其他条件相同的情况下,分别在敞口容器中进行和在密闭容器中进行,所放出的热量进行比较,前者后者。
(填“<”、“>”或“=”)5、NH4Cl(s)在真空容器中分解生成NH3(g)和HCl(g)达平衡,该系统的组分数为,相数为,自由度数为。
6、某分解反应为A(s) = 2B(g)+C(g) ,气体视为理想气体,其标准平衡常数K o与解离压力P 之间的关系是。
7、双变量体系的热力学基本公式:dU= PdV ;dG= VdP。
8、在200℃和25℃之间工作的卡诺热机,其效率为%。
9、纯物质混合形成理想液态混合物时,△mix V 0,△mix H 0,△mix S 0,△mix G 0。
(填“<”、“>”或“=”)10、理想气体反应,标准平衡常数K o与用分压表示的经验平衡常数K p之间的关系是;标准平衡常数K o与用物质的量分数表示的经验平衡常数K x之间的关系是。
二、选择题(每小题2分,共20分)1、某气体的压缩因子Z> 1,表示该气体比理想气体()(A)容易压缩(B)不易压缩(C)容易液化(D)不易液化2、关于气体的隙流,下列说法错误的是()(A)气体隙流速度与摩尔质量的平方根成正比(B)隙流定律可以用来求气体的摩尔质量(C)利用隙流作用可以分离摩尔质量不同的气体(D)气体分子运动论是隙流定律的理论依据3、系统从一个状态经不可逆过程到达另一状态,系统的ΔS ()(A)大于零(B)小于零(C)等于零(D)无法确定4、碳酸钠和水可以形成Na2CO3·H2O,Na2CO3·7H2O,Na2CO3·10H2O三种水合物,在101.3kPa 时该物系共存的相数最多为()(A)2 (B)3 (C)4 (D)55、常压下-10℃过冷水变成-10℃的冰,此过程的()(A)ΔG<0 ,ΔH>0 (B)ΔG>0 ,ΔH>0(C)ΔG=0 ,ΔH=0 (D)ΔG<0 ,ΔH<06、A、B两组分的气液平衡T-x图上,有一最低恒沸点,恒沸物组成为x A=0.7。
江苏师范大学《物理化学》考研真题解析

,
N
=
NkT
2
1
2e-E / kT + 2e-E / kT
E ´ kT 2
=
2Ne-E / kT × E 1+ 2e-E / kT
=
2NE × e-1 1+ 2e-1
= 0.424NkT
六、电化学
1、空气中的氧能将分散在水中的液态汞按下式
Hg2+,2Hg(l)+O2(g)+2H2O→2Hg2++4OH- , 已 知
(2)2
´
K
q p
(3)
=
8.99
´10-8
五、统计热力学
1. 计算 298.2K pθ 下 1 mol N2 的平动配分函数,大致估算平动能回分部数 N 与
平动能级的量子态之比。(华中师大)
解: q t
=
(2pmkT)3 h3
2
V
gi = e-a -bei Ni
a = ln N - ln ebei
既得: 1.229=fQ
+
0.05916
lg
aO
2
×
a
2 H
2O
O2 H2O OH-
4
a4 OH-
即:
fQ
=1.229 - 0.05916 lg 1
O2 H 2O OH-
4
a4 OH-
=1.229 - 0.05916 lg10-14 =0.401V
则:
f阴
=0.401
+
0.05916 4
lg
aO2 a4
298K
时
,
jQ Hg2+ Hg
《物理化学》试卷(含答案)

《物理化学》试卷A一、选择题 ( 每题2分,共20分 )1、对于理想气体的内能有下述四种理解:(1) 状态一定,内能也一定(2) 对应于某一状态的内能是可以直接测定的(3) 对应于某一状态,内能只有一个数值,不可能有两个或两个以上的数值(4) 状态改变时,内能一定跟着改变其中正确的是: ( )(A) (1),(2) (B) (3),(4) (C) (2),(4) (D) (1),(3)2、下列的过程可应用公式ΔH=Q进行计算的是: ( )(A) 不做非体积功,终态压力相同但中间压力有变化的过程(B) 不做非体积功,一直保持体积不变的过程(C) 273.15 K,p 下液态水结成冰的过程(D) 恒容下加热实际气体3、某理想气体从同一始态(p1,V1,T1)出发,分别经恒温可逆压缩和绝热可逆压缩至同一体积V2,若环境所做功的绝对值分别为W T和W A,问W T和W A的关系如何? ( )(A) W T>W A (B) W T <W A(C) W T =W A (D) W T和W A无确定关系4、关于偏摩尔量,下面的叙述中不正确的是:()(A) 偏摩尔量的数值可以是正数、负数和零(B) 溶液中每一种广度性质都有偏摩尔量,而且都不等于其摩尔量(C) 除偏摩尔吉布斯自由能外,其他偏摩尔量都不等于化学势(D) 溶液中各组分的偏摩尔量之间符合吉布斯-杜亥姆关系式5、某体系存在 C(s),H2O(g),CO(g),CO2(g),H2(g) 五种物质,相互建立了下述三个平衡: H2O(g) + C(s) =H2(g) + CO(g)CO2(g) + H2(g)= H2O(g) + CO(g)CO2(g) + C(s)= 2CO(g)则该体系的独立组分数C为: ( )(A) C=3 (B) C=2 (C) C=1 (D) C=4=-280 J⋅mol-1,则对该反应有利的条件是: ( )6、已知反应3O2(g) = 2O3(g) 在25℃时,Δr Hm(A) 升温升压 (B) 升温降压 (C) 降温升压 (D) 降温降压7、298标K,当 H2SO4溶液的浓度从 0.01 mol·kg-1增加到 0.1 mol·kg-1时,其电导率k和摩尔电导率Λm将: ( )(A) k减小 , Λm增加 (B) k增加 , Λm增加 (C) k减小 , Λm减小 (D) k增加 , Λm减小8、对于亲水性固体表面,其表面张力间的关系是: ( )(A) γ固-水 > γ固-空气 (B) γ固-水 < γ固-空气 (C) γ固-水 = γ固-空气 (D) 不能确定其液固间的接触角θ值为: ( )(A) θ> 90° (B) θ= 90°(C) θ= 180° (D) θ< 90°9、已知E Cl-Cl = 243 kJ/mol,E H-H= 436 kJ·mol-1,用光照引发下面反应:H2+ Cl2 → 2HCl所用光的波长约为:( h=6.626×10-34 J·s C=2.998×10 8m·s-1) ( )(A) 4.92×10-4 m (B) 4.92×10-7 m (C) 2.74×10-7 m (D) 1.76×10-7 m10、对于 AgI 的水溶胶,当以 KI 为稳定剂时,其结构式可以写成:[(AgI)m·n I-,(n-x)K+]x-·x K+,则被称为胶粒的是指: ( )(A) (AgI)m·n I-(B) (AgI)m(C) [(AgI)m·n I-,(n-x)K+]x-·x K+(D) [(AgI)m·n I-,(n-x)K+]x -二、填空题 (每题2分,共10分 )《物理化学》试卷A第 1 页共 18 页1、 1kg水中分别加入相同数量(0.01mol)的溶质:葡萄糖, NaCl, CaCl2和乙醇溶液。
2012-1013-10级物理化学2A卷-含答案
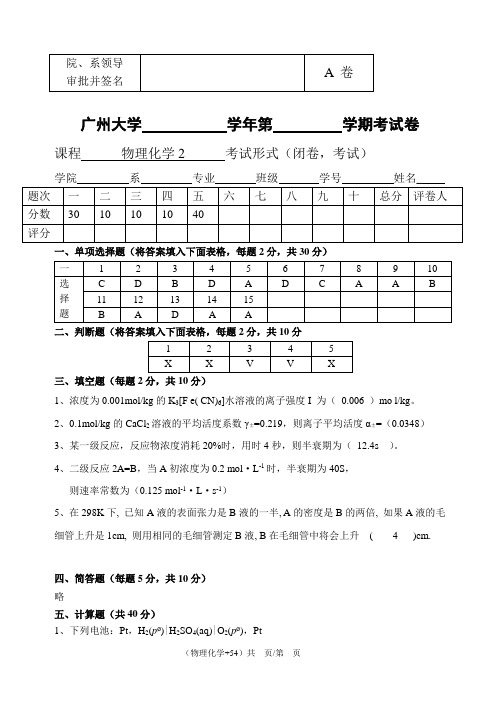
广州大学学年第学期考试卷课程物理化学2 考试形式(闭卷,考试)学院系专业班级学号姓名_一、单项选择题(将答案填入下面表格,每题2分,共30分)二、判断题(将答案填入下面表格,每题2分,共10分三、填空题(每题2分,共10分)1、浓度为0.001mol/kg的K3[F e( CN)6]水溶液的离子强度I 为(0.006 )mo l/kg。
2、0.1mol/kg的CaCl2溶液的平均活度系数γ±=0.219,则离子平均活度α±=(0.0348)3、某一级反应,反应物浓度消耗20%时,用时4秒,则半衰期为(12.4s )。
4、二级反应2A=B,当A初浓度为0.2 mol·L-1时,半衰期为40S,则速率常数为(0.125 mol-1·L·s-1)5、在298K下, 已知A液的表面张力是B液的一半, A的密度是B的两倍, 如果A液的毛细管上升是1cm, 则用相同的毛细管测定B液, B在毛细管中将会上升( 4 )cm.四、简答题(每题5分,共10分)略五、计算题(共40分)1、下列电池:Pt,H2(pø)|H2SO4(aq)|O2(pø),Pt在298K 时E =1.228V ,已知液体水的生成热Δf H m ø (298,H 2O ,l)=-2.851×105J·mol -1。
(1) 写出电极反应和电池反应; (2) 计算此电池电动势的温度系数。
(10分) )(10537.814--⋅⨯-=⎪⎭⎫ ⎝⎛∂∂K V T E p2、写出电池Zn | ZnCl 2(αZnCl =0.5) | AgCl(s) | Ag 的电池反应,计算25℃时电池的电动势及电池反应的∆r G m ,并指出该电池能否自发进行。
(已知:25℃时E θ (Zn 2+/Zn)= -0.7630 V ,E θ (Cl -/ AgCl(s) /Ag)= 0.2221 V )(10分) 解:∆r G m = -ZEF = -2⨯0.9940 ⨯96500 = -191.84 kJ·mol -1 ∆r G m < 0,则该电池能够自发进行。
