沉降菌测试原始记录
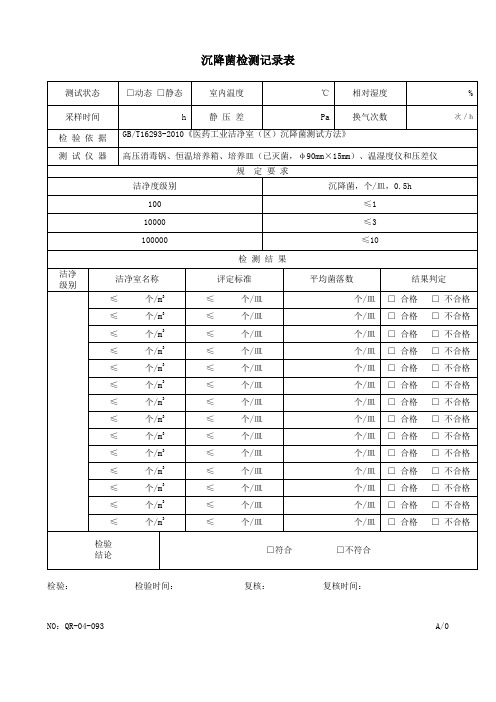
沉降菌检测记录表
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
检验
结论
□符合 □不符合
检验:检验时间: 复核: 复核时间:
NO:QR-04-093A/0
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
100
≤1
10000
≤3
100000
≤10
检 测 结 果
洁净
级别
洁净室名称
评定标准
平均菌落数
结果判定
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
□ 合格 □ 不合格
≤个/m3
≤个/皿
个/皿
沉降菌检测记录表
测试状态
□动态 □静态
室内温度
℃
相对湿度
%
采样时间
h
静 压 差
Pa
微检室沉降菌检验原始记录
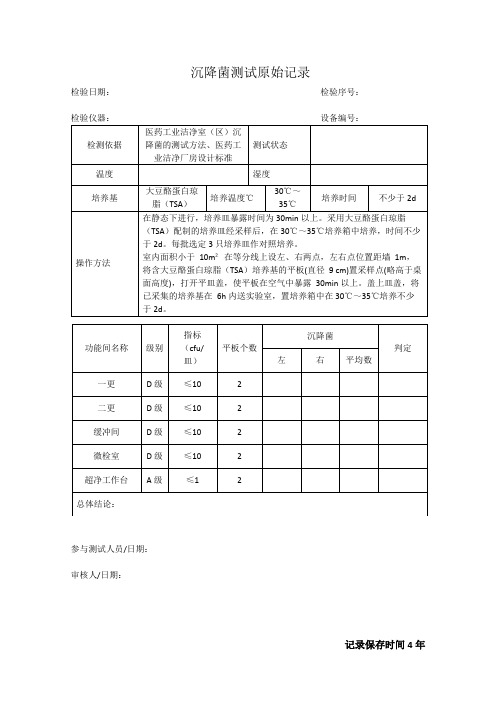
检验日期:检验序号:
检验仪器:设备编号:
检测依据
医药工业洁净室(区)沉降菌的测试方法、医药工业洁净厂房设计标准
测试状态
温度
湿度
培养基
大豆酪蛋白琼脂(TSA)
培养温度℃
30℃~35℃
培养时间
不少于2d
操作方法
在静态下进行,培养皿暴露时间为30min以上。采用大豆酪蛋白琼脂(TSA)配制的培养皿经采样后,在30℃~35℃培养箱中培养,时间不少于2d。每批选定3只培养皿作对照培养。
室内面积小于10m²在等分线上设左、右两点,左右点位置距墙1m,将含大豆酪蛋白琼脂(TSA)培养基的平板(直径9cm)置采样点(略高于桌面高度),打开平皿盖,使平板在空气中暴露30min以上。盖上皿盖,将已采集的培养基在6h内送实验室,置培养箱中在30℃~35℃培养不少于2d。
功能间名称
级别
指标
(cfu/皿)
平板个数
沉降菌
判定
左
右ቤተ መጻሕፍቲ ባይዱ
平均数
一更
D级
≤10
2
二更
D级
≤10
2
缓冲间
D级
≤10
2
微检室
D级
≤10
2
超净工作台
A级
≤1
2
总体结论:
参与测试人员/日期:
审核人/日期:
洁净室沉降菌检测原始记录表

主要 仪器 设备
检验 步骤 计算 公式
名称 高压蒸汽灭菌器 电热恒温培养箱 电热恒温培养箱
生化培养箱
型号 LDZF-75KB-Ⅱ
DH-360AB DH-420A SPL-250
编号
1016A1-001
1011A1-001 1001A1-001 1018A1-001
将送检样品置于__36___℃的培养箱内培养__24___ h 后计数。
菌落总数
CFU
/
皿
平皿菌落数之和CFU
平皿个数
主要培养基 及试剂
培养基名称 TSA 琼脂 营养琼脂 沙氏琼脂
批号 /
××× ×××
序号
样品编号
各平皿菌落数(CFU/皿) 12345678
平均菌落总数(CFU/皿)
1
×××-001
00000000
0
2
×××-002
24232443
3
3
×××-003
15435644
4
4
空白
00000000
0
生产厂家 /
××× ×××
备注
测定人: 第 页共 页
复核人:
审核人: 2023 年 月 日执行
表格编号:
××技术有限公司
沉降菌测定原23___年____月____日 测定日期:_2023_年__月__日~__月__日
分析项目:沉降菌(空气中的细菌菌落总数)
环境条件:____25____℃,RH___47_____%
方法依据:GB/T16294-2010GB50073-2013GB50457-2019GB50591-2010GB50333-2013GB51110-2015其它____________
沉降菌测试原始记录
微生物检验室沉降菌测试原始记录评定标准十万级w 10CFU 皿;万级w 3CFU 皿;百级w 1CFU 皿RSB60-00°C采样点图示 见附图:报告日期 _________结 论 _______________________ 检验者 ____________ 复核者 ___________________RSB64-00固体制剂车间沉降菌测试原始记录(2)编 号______________________ 测试依据SPG108-01环境温度________________ °C培养基批号__________________ 测试单位 ______________ 测试状态 ______________ 相对湿度% _____________培养温度 ______________采样点图示 见附图:评定标准:十万级w 10CFU皿;万级w 3CFU皿;百级w 1CFU皿结论___________________检验者_________________ 复核者______________RSB63-00 固体制剂车间沉降菌测试原始记录(1 )评定标准: 十万级w 10CFU/皿; 万级w 3CFU/皿; 百级w 1CFU/皿 结 论 检验者 复核者 _____________________RSB61-00原料车间沉降菌测试原始记录编 号 ______________________ 测试单位 ________________ 测试依据SPG108-01 测试状态 _______________环境温度 _______________ ° C 相对湿度% ______________ 培养基批号 _________________ 培养温度 _________________ °C 静压差 ___________________ 检测日期 __________________ 报告采样点图示 见附图:日期评定标准:十万级w 10CFU/皿;万级w 3CFU/皿;百级w 1CFU/皿检验者复核者RSB62-00 原料车间沉降菌测试原始记录评定标准:十万级w 10CFU皿;万级w 3CFU皿;百级w 1CFU皿结论检验者复核者____________________RSB61-01 原料车间沉降菌测试原始记录编号测试单位测试依据SPG108-01 测试状态环境温度°C相对湿度% 培养基批号培养温度静压差检测日期采样点图示见附图:报告日期 _________评定标准:十万级w 10CFU/皿;万级w 3CFU/皿;百级w 1CFU/皿结论________________ 检验_______________ 复核者_______________。
沉降菌监测记录

沉降菌监测记录
集团企业公司编码:(LL3698-KKI1269-TM2483-LUI12689-ITT289-
沉降菌监测记录编码:SOR-QC-03
一、前期准备:
1、器皿灭菌:将已洗涤干净的培养皿(9cm),置于160℃干热灭菌4h备用。
2、培养基平皿的制备:
(1)平皿的制备:将制备好的培养基冷至约40℃,在无菌操作要求下将培养基注入培养皿每皿约15ml,同一方向旋转平皿,置净化工作台上待凝。
(2)将凝固后平皿倒置于培养箱中30℃-35℃恒温培养箱中培养48h,若培养基平皿上确无菌落生长,即可供采样用。
二、采集样品:
(1)将已制备好的培养皿,按洁净室沉降菌采样点布置图的要求放置,打开
培养皿盖,使培养基表面暴露30分钟,再将培养皿盖盖上后倒置。
(2)对照试验:每批培养基选定3个培养皿作对照培养,检验培养基本身是
否污染。
(3)培养:全部采样结束后,将平皿倒置于培养箱中按规定条件培养。
三、检测结果:
见附表:
附表1固体车间
附表2
液体车间
附表3
栓剂车间
附表4
提取理车间
附表5
质检中心
取样间。
洁净区(室)沉降菌测试记录

ABC制药有限公司
洁净区(室)沉降菌测试记录
文件编码:
测试依据:《医药工业洁净室(区)沉降菌的测试方法》GB/T16294-1996测试状态静态静压差Pa
相对湿度%培养基批号培养日时年月日时
环境温度℃培养温度℃ 被测单位记数日时年月日时
皿号
菌落数
ABC制药有限公司GMP文件
文件名称
洁净区(室)沉降菌测试记录
共 页
文件编码
文件类型
JL
颁发部门
GMP办公室
分发数量
起 草 人
日 期
审 核 人
日 期
批 准 人
日 期
执Байду номын сангаас日期
变更内容
修订号修订原因与内容执行日期
00
分发部门
总经 理 [ ] 副 总 经 理 [ ] 设备动力部 [ ]
生产 部 [ ] 质 保 部 [ ] 营 销 部 [ ]
房间名称
1
2
3
4
5
6
7
8
9
10
11
12
13
14
平均数
净化级别
评定标准
结论
检验人:复核人:
2011沉降菌测试记录
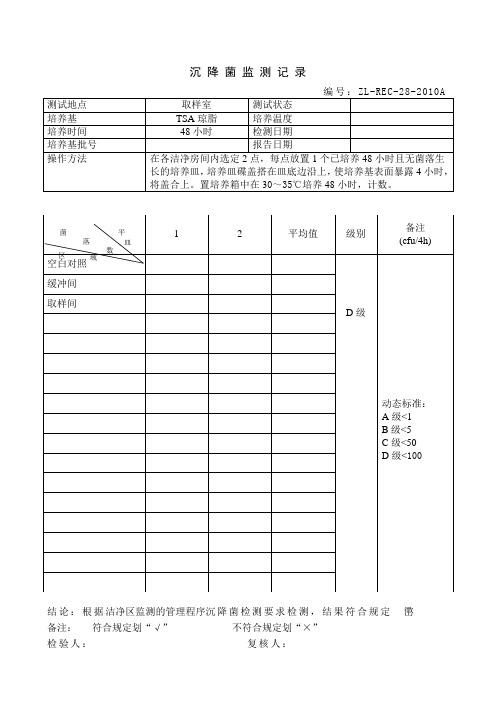
结论:根据洁净区监测的管理程序沉降菌检测要求检测,结果符合规定㠞备注:符合规定划“√”不符合规定划“×”
结论:根据洁净区监测的管理程序沉降菌检测要求检测,结果符合规定㠞备注:符合规定划“√”不符合规定划“×”
结论:根据洁净区监测的管理程序沉降菌检测要求检测,结果符合规定㠞备注:符合规定划“√”不符合规定划“×”
结论:根据洁净区监测的管理程序沉降菌检测要求检测,结果符合规定㠞备注:符合规定划“√”不符合规定划“×”
结论:根据洁净区监测的管理程序沉降菌检测要求检测,结果符合规定㠞备注:符合规定划“√”不符合规定划“×”
结论:根据洁净区监测的管理程序沉降菌检测要求检测,结果符合规定㠞备注:符合规定划“√”不符合规定划“×”
结论:根据洁净区监测的管理程序沉降菌检测要求检测,结果符合规定㠞备注:符合规定划“√”不符合规定划“×”
结论:根据洁净区监测的管理程序沉降菌检测要求检测,结果符合规定㠞备注:符合规定划“√”不符合规定划“×”。
洁净室(区)洁净空气(沉降菌)检验记录1

测试房间
房间编号
面积(㎡)
采样时间
采样点数
皿数
菌落数
(cfu/皿)
平均菌落数(cfu/ 皿)
采样点分布
时分~时分
1
1皿
2皿
2
1皿
2皿
时分~时分
1
1皿
2皿
2
1皿
2皿
时分~时分
1
1皿
2皿
2
1皿
2皿
时分~时分
1
1皿
2皿
2
1皿
2皿
时分~时分
1
1皿
2皿
2
1皿
2皿
时分~时分
1
1皿
2皿
2
1皿
2皿
时分~时分
名 称
沉 降 菌
分析号
车间或部门
测试状态
洁净度级别
测试日期
年 月 日
完成日期
年 月 日
检验依据
质量标准
《企业内控标准》2010-02版
文件编号
ZLT-TS-ZK-BZ-0008
检验操作规程
洁净室(区)沉降菌测试操作规程
文件编号
ZLT-SOP-ZK-TY-0056
洁净室(区)环境条件:温度:□符合规定 □不符合规定;相对湿度:□符合规定 □不符合规定;压差:□符合规定 □不符合规定;
A级
<1
B级
5
C级
50
D级
100
测试人: 测试日期:年 月 日
结论:本品按《企业内控标准》2010-02版ZLT-TS-ZK-BZ-0008检验,结果:□符合规定;□不符合规定。
复核人: 复核日期:年 月 日
超净工作台沉降菌检测记录

嘉兴康谷医用材料有限公司 QMR-086-00
检测人
复核人
生效日期:2016年05月18日
KANGGU
无菌室
微生物限度室 1 2 3
无菌室
123
结果计 算:
平均菌落 数 M(个/ 皿) =
M1+ M2+. ..… Mn
n
456
456
M-平均 菌落 数
M11号 培养 皿菌 落数
M22号 培养 皿菌 落M数nnn号-培养
1 2 3 4 5 6 7 8 9 10 11 12 13 14
微生物限度室 1 2 3 4 5 6 7 8 9 10 11 12 13 14
无菌室
1 2 3 4 5 6 7 8 9 10 11 12 13 14
微生物限度室 1 2 3 4 5 6 7 8 9 10 11 12 13 14
无菌室
1 2 3 4 5 6 7 8 9 10 11 12 13 14
超净工作台沉降菌检测记录
7 8 9 10 11 12 13 14 7 8 9 10 11 12 13 14-086-00
生效日期:2016年05月18日
无菌室
1 2 3 4 5 6 7 8 9 10 11 12 13 14
微生物限度室 1 2 3 4 5 6 7 8 9 10 11 12 13 14
无菌室
1 2 3 4 5 6 7 8 9 10 11 12 13 14
微生物限度室 1 2 3 4 5 6 7 8 9 10 11 12 13 14
无菌室
KANGGU
超净工作台沉降菌检测记录
洁净度级
别:100
级测
试状态:
静态
检测依
洁净度微生物原始记录
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
广东省河源市药品检验所
洁净度检测记录
被检测单位
检测地点
广东省河源市药品检验所
洁净度检测记录
被检测单位
检测地点
功能间数
采样日期
检测状态
静态
检验依据
《药品生产质量管理规范》(1998年修订)
一、沉降菌落数
仪器及试剂:1、LS-B50L高压蒸汽灭菌器(器号:HX02U-265)上海华线医用核子仪器有限公司
2、DH5000A电热恒温培养箱(537)天津市泰斯特特仪器有限公司
3、营养琼脂培养基(批号070119)中国药品生物制品检定所
检测结果:
功能间名称
级别
温度(℃)
湿度(%)
沉降菌微生物数量
最大允许数(个/皿)
Байду номын сангаас检测
结论
标准
实测
标准
实测
标准
实测
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
18~26℃
45~65%
18~26℃
功能间数
采样日期
检测状态
静态
检验依据
《药品生产质量管理规范》(1998年修订)
检验室洁净区沉降菌测试记录表

结果判定
结论
经测试,洁净区沉降菌测试结果:
检验
日期
复核
日期
阴性手消间
S11
S12
微生物限度室工作台
S19
S20
阳性对照室
S5
S6
无菌室
S13
S14
1#
2#
3#
生物安全柜
S7
S8
无菌室工作台
S15
S16
洁净度级别
300,000级
100,000级
10,000级
100级
判定标准
-----
≤10个/皿
≤3个/皿
≤1个/皿
培养温度
℃
培养时间
月 日 时至 月 日 时
测试点名称
阳性对照室二更
阳性手消间
阳性对照室
生物安全柜
阴性对照室二更
阴性手消间
测试点
S1
S2
S3
S4
S5
S6
S7
S8
S9
S10
S11
S12
培养后菌落数(个)
平均菌落数(个/皿)
结果判定
测试点名称
无菌室
无菌室工作台
微生物限度室
微生物限度室工作台
阴性对照
测试点
S13
S14
S15
S16
S17
S18
S19
S20
1#
2#
2、全部采样结束后,将培养皿倒置于培养箱中培养。
3、在30℃—35℃培养箱中培养,时间不少于48小时。
4、每批培养基应有对照试验,检验培养基本身是否污染。每批选定3只培养基作空白对照培养。
检测点分布及编号
检验室洁净区沉降菌测试记录表

检验室洁净区沉降菌测试记录表1次/季
测试依据
GB/T16294-2010?医药工业洁净室悬浮粒子的测试方法,卫生部《中国生物制品规程》制格情况
温湿度:压差:换气次数:
操作方法
1、采用平板暴露法:将姨酪大豆胨琼脂平板(9cm直径)按检测点中间直线的1/4和3/4布放,打开培养皿盖,使培养基表暴露30分钟后,将培养基皿盖上后倒置。
阴性手消间
S11
S12
微生物限度室工作台
S19
S20
阳性对照室
S5
S6
无菌室
S13
S14
1#
2#
3#
生物安全柜
S7
S8
无菌室工作台
S15
S16
洁净度级别
300,000级
100,000级
10,000级
100级
判定标准
-----
≤10个/皿
≤3个/皿
≤1个/皿
培养温度
℃
培养时间
月 日 时至 月 日 时
测试点名称
2、全部采样结束后,将培养皿倒置于培养箱中培养。
3、在30℃—35℃培养箱中培养,时间不少于48小时。
4、每批培养基应有对照试验,检验培养基本身是否污染。每批选定3只培养基作空白对照培养。
检测点分布及编号
阳性对照室二更
S1
S2
阴性对照室二更
S9
S10
微生物限度室
S17
S18
阴性对照
阳性手消间
S3
S4
3#
培养后菌落数(个)
平均菌落数(个/皿)
结果判定
结论
经测试,洁净区沉降菌测试结果:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
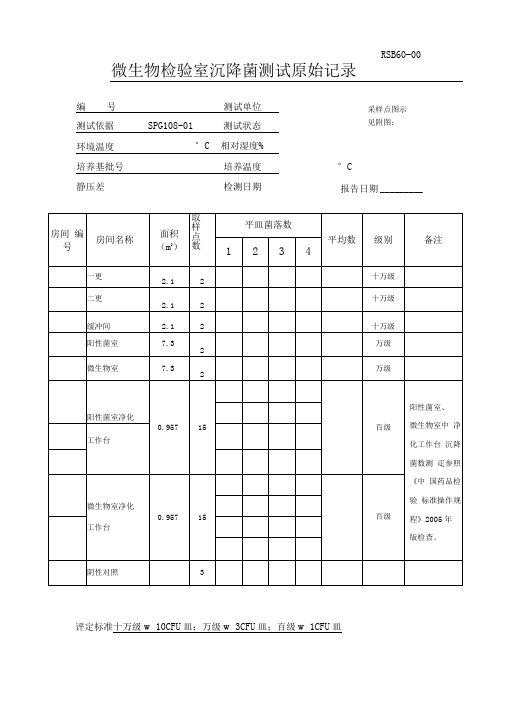
RSB60-00 微生物检验室沉降菌测试原始记录
测试依据SPG108-01 测试状态
环境温度°C 相对湿度%
培养基批号培养温度°C
静压差检测日期报告日期
评定标准十万级≤10CFU/皿;万级≤3CFU/皿;百级≤1CFU/皿
结论检验者复核者
RSB64-00 固体制剂车间沉降菌测试原始记录(2)
测试依据SPG108-01 测试状态
环境温度°C 相对湿度%
培养基批号培养温度°C
静压差检测日期报告日期
评定标准:十万级≤10CFU/皿;万级≤3CFU/皿;百级≤1CFU/皿
结论检验者复核者
RSB63-00 固体制剂车间沉降菌测试原始记录(1)
测试依据SPG108-01 测试状态
环境温度°C 相对湿度%
培养基批号培养温度°C
静压差检测日期报告日期
评定标准:十万级≤10CFU/皿;万级≤3CFU/皿;百级≤1CFU/皿
结论检验者复核者
RSB61-00 原料车间沉降菌测试原始记录
测试依据SPG108-01 测试状态
环境温度°C 相对湿度%
培养基批号培养温度°C
静压差检测日期报告日期
评定标准:十万级≤10CFU/皿;万级≤3CFU/皿;百级≤1CFU/皿
结论检验者复核者
RSB62-00 原料车间沉降菌测试原始记录
测试依据SPG108-01 测试状态
环境温度°C 相对湿度%
培养基批号培养温度°C
静压差检测日期报告日期
评定标准:十万级≤10CFU/皿;万级≤3CFU/皿;百级≤1CFU/皿
结论检验者复核者
RSB61-01
原料车间沉降菌测试原始记录
编 号 测试单位 测试依据 SPG108-01 测试状态 环境温度 °C 相对湿度% 培养基批号 培养温度 °C
静 压 差 检测日期 报告日期
评定标准: 十万级≤10CFU/皿; 万级≤3CFU/皿; 百级≤1CFU/皿 结 论 检 验 者 复核者。
