大学无机化学第十二章试题与答案解析
完整版)大学无机化学试题及答案

完整版)大学无机化学试题及答案1.对于H2O2和N2H4,下列叙述正确的是:(C)都具有氧化性和还原性。
2.下列含氧酸中属于三元酸的是:(C)H3PO3.3.下列各对含氧酸盐热稳定性的大小顺序,正确的是:(B)CaCO3<CdCO3.4.铝在空气中燃烧时,生成(A)单一化合物Al2O3.5.下列含氧酸根中,属于环状结构的是:(C)。
6.下列化合物与水反应放出HCl的是:(C)POCl3.7.InCl2为逆磁性化合物,其中In的化合价为(C)+3.8.鉴别Sn4+和Sn2+离子,应加的试剂为(D)硫化钠(过量)。
9.下列各组化合物中,都有颜色的一组化合物是(B)CCl4,NO2,HgI2.10.将过量SiF4通入NaOH溶液中,主要产物是(C)Na2SiO3,Na2SiF6.11.将NCl3.(缺少选项,无法判断正确与否)。
改写后的文章:无机化学试题一、选择题1.H2O2和N2H4都具有氧化性和还原性。
2.H3PO3是三元酸。
3.正确的含氧酸盐热稳定性大小顺序是:CaCO3<CdCO3.4.铝在空气中燃烧时生成单一化合物Al2O3.5.环状结构的含氧酸根是C。
6.与水反应放出HCl的化合物是POCl3.7.InCl2为逆磁性化合物,其中In的化合价为+3.8.鉴别Sn4+和Sn2+离子,应加的试剂是硫化钠(过量)。
9.有颜色的一组化合物是CCl4,NO2,HgI2.10.将过量SiF4通入NaOH溶液中,主要产物是Na2SiO3,Na2SiF6.11.(缺少选项,无法判断正确与否)。
填空题:16.N2O5很容易分解为NO2和O2.将棕黄色的NO2冷却到-15℃左右,它几乎全部转变为淡黄色的N2O5.经X射线衍射研究,证明固体N2O5含有两种离子。
17.NCl3的水解产物是NH3和HCl;PCl3的水解产物是H3PO3和HCl;SbCl3的水解产物是SbOCl和HCl;BiCl3的水解产物是BiOCl和HCl;AsCl3的水解产物是AsO(OH)和HCl。
《无机化学》习题解析和答案

1、教材《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章s区元素(4学时)第二十一章p区金属(4学时)第二十二章ds区元素(6学时)第二十三章d区元素(一)第四周期d区元素(6学时)第二十四章d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?●化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)●化学研究的是化学物质(chemicals) 。
●化学研究分子的组成、结构、性质与变化。
●化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
●化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
大学《无机化学》第四版_习题答案

无机化学(第四版)答案第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
北师大无机化学四版习题答案12章氧族元素

北师大无机化学四版习题答案12章氧族元素第12章氧族元素:49.10mL , 12.1 空气中O与N 的体积比是21:78 ,在273K和101.3kPa 下lL 水能溶解O222N:49.10mL。
问在该温度下溶解于水的空气所含的氧与氮的体积比是多少, 2 解: 己知空气中氧、氮分压比为21:78。
在273K、10 1.3 kPa 下lL 水能溶解O为49.10mL,2N为23.20 mL。
溶解于水的空气中氧的体积分数为 249.10×0.21,0.36 (49.10×0.21)+(23.20×0.78)氮的体积分数为:1,0.36,0.64因此溶解于水的空气所含的氧与氮的体积比是1:1. 8 。
12.2 在标准状况下,750 mL 含有O的氧气,当其中所含O完全分解后体积变为780mL ,若33将此含有O的氧气lL 通入KI溶液中,能析出多少克I ? 32解:设750mL 氧气中有x mL O : 3则有: 2 O? 3 O增加的体积 3 22 3 1x 30所以 2/x,1/30 x, 60mL即此氧气中O百分比为60/750,8 % , lL 氧气中含80mL O . 33设能析出I yg ,已知M (I), 254 22+ , 2I+ 2H+ O? I+ O+ HO 3 2 221mol 254g(0.08/22.4)mol y所以1/(0.08/22.4),254/y y,254×0.08/22.4,0.91(g)12.3 大气层中臭氧是怎样形成的,哪些污染物引起臭氧层的破坏,如何鉴别O,它有什么特征3反应,解: ( 1 )O+hv ? O +O (λ<242nm ) 2O + O? O 2 3( 2 )氟氯烃:CFCl ,CFCl等,以及氮氧化物:NO 、NO 等可引起臭氧层的破坏。
如3222NO、CFCl 对臭氧层的破坏反应 222CFCl+hv?CFCl?+Cl? (λ<221nm) 222Cl?+O?ClO?+O32ClO?+O?Cl?+O 2即 O+O?O+O 322NO+hv?NO+O (λ<426nm) 2NO+ O? NO+O 322NO+O?NO+O 22即 O+O?O,O 322所以Cl原子或NO分子能消耗大量O 23( 3 )鉴别O时,只需将气体通入淀粉碘化钾的酸性溶液中或用湿淀粉碘化钾试纸检查,3若有蓝色,即证明有O,其反应式为 3+ , 2I+ 2H+ O? I+ O+ HO 3 2 22 或2KI+ HO + O? I+ O+ 2KOH 23 2 212.4 比较O和O氧化性、沸点、极性和磁性的相对大小。
无机化学(上册):第12章 氧化还原与电化学 习题与答案

第12章氧化还原与电化学习题与详细答案1.计算下列化合物中右上角带“*”元素的氧化态:KCl*O3,NaCl*O,H2O*2,O*3,S*8,C*60,KO*2,Na2S*2O3,Cr*2O72-,S*4O62-,N*H4+,N*2H4,Fe*3O4,Ni*(CO)4,Na[Co*(CO)4],H[Mn*(CO)5],[Fe*(CN)6]4-,[Fe(N*CS)6]3-.解:+5 +1 -1 0 0 0 -½ +2 +6 +2.5 -3KCl*O3,NaCl*O,H2O*2,O*3,S*8,C*60,KO*2,Na2S*2O3,Cr*2O72-,S*4O62-,N*H4+,-2 +8/3 0 -1 -1 +2 -3N*2H4,Fe*3O4,Ni*(CO)4,Na[Co*(CO)4],H[Mn*(CO)5],[Fe*(CN)6]4-,[Fe(N*CS)6]3-.2.用“氧化数法”配平以下列各氧化还原反应的方程式;(8)-(15)同时用“离子-电子法”配平:(1)AgNO3(s) → Ag(s) + NO2(g) + O2(g)(2)(NH4)2Cr2O7(s) → N2(g) + Cr2O3(s)(3)H2O2(aq) → H2O(l) + O2(g)(4)Cu(s) + HNO3(稀)→ Cu(NO3)2 + NO(g)(5)CuS(s) + HNO3(浓)→ CuSO4 + NO2(g)(6)H2S(g) + H2SO4(浓)→ S(s) + SO2(g)(7)C(s) + H2SO4(浓)→ CO2(g) + SO2(g) + H2O(8)SO2(g) + MnO4-→ Mn2+ + SO42-(9)Cr2O72- + H2O2→ Cr3+ + O2(g)(10)CrO42- + CN-→ Cr(OH)3(s) + OCN-(11)Cl2(g) + CN- + OH-→ Cl- + OCN-(12)I2(s) + OH-→ I- + IO3-(13)I- + IO3-→ I2(s) + H2O(14)I2(s) + S2O32-→ I- + S4O62-(15)NaBiO3(s) + Mn2+ + H+→ Bi3+ + MnO4-解:(1)氧化数+1 +5 -2 0 +4 -2 02 AgNO3(s) = 2 Ag(s) + 2 NO2(g) + O2(g)(2)(NH4)2Cr2O7(s) = N2(g) + Cr2O3(s) + 4 H2O(3)2 H2O2(aq) = 2 H2O(l) + O2(g)(4)3 Cu(s) + 8 HNO3(稀)= 3 Cu(NO3)2 + 2 NO(g) + 4 H2O(5)CuS(s) + 8 HNO3(浓)= CuSO4 + 8 NO2(g) + 4 H2O(6)H2S(g) + H2SO4(浓)= S(s) + SO2(g) + 2 H2O(7)C(s) + 2 H2SO4(浓)→ CO2(g) + 2 SO2(g) + 2 H2O(8)“氧化数法”:5 SO2(g) + 2 MnO4- + 2 H2O = 2 Mn2+ + 5 SO42- + 4 H+“离子-电子法”:5 SO2(g) + 10 H2O = 5 SO42- + 20 H+ + 10 e2 MnO4- + 10 e + 16 H+ = 2 Mn2+ + 5 SO42-两式相加,得:5 SO2(g) + 2 MnO4- + 2 H2O = 2 Mn2+ + 5 SO42- + 4 H+(9)“氧化数法”:Cr2O72- + 3 H2O2 + 8 H+ = 2 Cr3+ + 3 O2(g) + 7 H2O“离子-电子法”:3 H2O2 = 3 O2(g) + 6 H+ + 6 eCr2O72- + 14 H+ + 6 e = 2 Cr3+ + 7 H2O两式相加,得:Cr2O72- + 3 H2O2 + 8 H+ = 2 Cr3+ + 3 O2(g) + 7 H2O (10)“氧化数法”:2 CrO42- + 3 CN- + 5 H2O = 2 Cr(OH)3(s) + 3 OCN- + 4 OH-“离子-电子法”:3 CN- + 6 OH- = 3 OCN- + 3 H2O + 6 e2 CrO42- + 8 H2O + 6 e = 2 Cr(OH)3(s) +10 OH-两式相加,得:2 CrO42- + 3 CN- + 5 H2O = 2 Cr(OH)3(s) + 3 OCN- + 4 OH- (11)“氧化数法”:Cl2(g) + CN- + 2 OH- = 2 Cl- + OCN- + H2O“离子-电子法”:CN- + 2 OH- = OCN- + H2O + 2 eCl2(g) + 2 e = 2 Cl- + H2O两式相加,得:Cl2(g) + CN- + 2 OH- = 2 Cl- + OCN- + H2O(12)“氧化数法”:3 I2(s) + 6 OH- = 5 I- + IO3- + 3 H2O“离子-电子法”:I2(s) + 12 OH- = 2 IO3- + 6 H2O + 10 e5 I2(s) + 10 e = 10 I-两式相加,约简系数,得:3 I2(s) + 6 OH- = 5 I- + IO3- + 3 H2O(13)“氧化数法”:5 I- + IO3- + 6 H+ = 3 I2(s) + 3 H2O“离子-电子法”:10 I- = 5 I2(s) + 10 e2 IO3- + 12 H+ + 10 e = I2(s) + 6 H2O两式相加,约简系数,得:5 I- + IO3- + 6 H+ = 3 I2(s) + 3 H2O(14)“氧化数法”:I2(s) + 2 S2O32- = 2 I- + S4O62-“离子-电子法”:2 S2O32- = S4O62- + 2 eI2(s) + 2 e = 2 I-两式相加,得:I2(s) + 2 S2O32- = 2 I- + S4O62-(15)“氧化数法”:5 NaBiO3(s) + 2 Mn2+ + 14 H+ = 5 Bi3+ + 5 Na+ + 2 MnO4- + 7 H2O “离子-电子法”:2 Mn2+ + 8 H2O= 2 MnO4- + 16 H+ + 10 e5 NaBiO3(s) + 30 H+ + 10 e = 5 Bi3+ + 5 Na+ + 15 H2O两式相加,得:5 NaBiO3(s) + 2 Mn2+ + 14 H+ = 5 Bi3+ + 5 Na+ + 2 MnO4- + 7 H2O 3.含氰(CN-)工业废水可以用漂白粉[有效成份Ca(ClO)2]或氯气或H2O2在碱性介质中进行氧化处理后排放,写出各反应方程式。
无机化学12章答案

第十二章 配位平衡12-1 在1L 6 mol ·L -1的NH 3水中加入0.01 mol 固体CuSO 4,溶解后加入0.01 mol 固体NaOH ,铜氨络离子能否被破坏?(K 稳[Cu(NH 3)42+]=2.09×1013,K SP [Cu(OH)2]=2.2×10-20) 解:CuSO 4在过量的氨水溶液中几乎完全形成[Cu(NH 3)4]2+,则[Cu(NH 3)4]2+ === Cu 2+ + 4NH 3平衡时: 0.01-x x (6-0.04)+4x1342431009.2)496.5()01.0(])([⨯=+⋅-=+x x x NH Cu K 稳 11910792.3--⋅⨯=L mol x ])([108.3)01.0(10792.3]][[22321922OH Cu K OH Cu sp <⨯=⨯⨯=---+铜氨络离子不能被破坏。
12-2 在少量N H 4S C N 和少量Fe 3+同存于溶液中达到平衡时,加入NH 4F 使[F -]=[SCN -]= 1 mol ·L -1,问此时溶液中[FeF 63-]和 [Fe(SCN)3]浓度比为多少?(K 稳[Fe(SCN)3]=2.0×103,K 稳[FeF 63-]= 1×1016)解: ---+=+SCN FeF F SCN Fe 3][6])([363123163633663336105102101)]([][])([][]][)([]][[⨯=⨯⨯====-----SCN Fe K FeF K SCN Fe FeF F SCN Fe SCN FeF K 稳稳12-3 在理论上,欲使1×10-5 mol 的AgI 溶于1 cm 3氨水,氨水的最低浓度应达到多少?事实上是否可能达到这种浓度?(K 稳[Ag(NH 3)2+]=1.12×107,K SP [AgI]=9.3×10-17)解: -++=+I NH Ag NH AgI ])([2233起始浓度 a 0 0达到平衡时 a-2x x x (全部溶解时:101.0-⋅=L mol x )此反应的平衡常数:9177231004.1103.91012.1)(})({--+⨯=⨯⨯⨯=⨯=AgI Ksp NH Ag K K 稳 因此: 9221004.1]2[(-⨯=-=x a x K 1310-⋅=L mol a 事实上不可能达到这种浓度。
天津大学无机化学 课后习题参考答案

� 9.6d
��解� T
�
pV nR
�
MpV mR
= 318 K � 44.9 ℃
��解�根据道尔顿分压定律
p(N2) = 7.6�104 Pa p(O2) = 2.0�104 Pa p(Ar) =1�103 Pa
pi
�
ni n
p
��解��1� n(CO2 ) � 0.114mol; p(CO2 ) � 2.87 � 104 Pa �2� p(N 2 ) � p � p(O2 ) � p(CO2 ) � 3.79 �104 Pa
�
r
H
� m
(298.15
K)
�1573.15
�
r
S
� m
(298.15
K)
= 70759 J ·mol�1
lg K � (1573.15 K) = �2.349, K � (1573.15 K) = 4.48�10�3
10. 解� 平衡分压�kPa
H2(g) + I2(g)
2HI(g)
2905.74 �χ 2905.74 �χ
平衡分压/kPa
x
x
� �� � K � = p (NH 3 ) / p� p (H 2S) / p� = 0.070
则 x = 0.26�100 kPa = 26 kPa
平衡时该气体混合物的总压为 52 kPa
�2�T 不变� K � 不变。
NH4HS(s) � NH3(g) + H2S(g)
平衡分压/kPa
�2� K c
=
�c
(N
2
)�
1 2
�c
(H 2 )
�3 2
无机化学(下)参考答案(重要).docx

《无机化学》下册(第三版)习题参考答案武汉大学、吉林大学等校编曹锡章、宋天佑、王杏乔修订高等教育出版社屮国石油大学(华东)化学化工学院第十二章卤族元素1. 单质的活泼性次序为:F 2»Cl 2>Br 2>I 2从F 2到Cl 2活泼性突变,其原因归结为F 原了和厂离了的半径特别小。
F Cl Br I 厂 cr Br _ 厂r/pm 64 99114 133 136 181 195 216 (1)由于F 的原了半径非常小,F —F 原了间的斥力和非键电了对的斥力较大,使 F2的解离能(155KJ/mol)远小于CH 的解离能(240KJ/mol)。
(2)山于F 离了半径特别小,因此在形成化合物时,氟化物的离了键更强,键能或 晶格能更大。
(3) 由于F 离子半径特别小,F"的水合放热比其他卤素离子多。
2. 氧化性顺序为:F2>C12>Bf2>l2 ;还原性顺序为:I->BF>C 「>F. 尽管在同族中氯的电子亲合能最高,但最强的氧化剂却是氛卤索单质绘很强的氧化剂,随着原子半径的增大,卤素的氧化能力依次减弱。
尽管在同 族屮氯的电子亲合能最高,但最强的氧化剂却是氟。
一种氧化剂在常温下,在水溶液屮 氧化能力的强弱,可用具标准电极电势值來表示,0&值的大小和下列过程有关(见课本 P524)3. (1)2C12+Ti =TiCl 4 加热, 干燥 (2)3C12+2A1 =2A1C13 加热, 干燥 (3)C12+H 2=2HC1 点燃 (4)3Cb+2P (过量)=2PCb 干燥 5Cb(过量)+2P=2PC15干燥 (5) C12+H 2O=HC1O +HC1(6) C12+2K2C03+H2OKC1+KC10+2KHC034. (1) CC14为非极性溶剂,【2溶在CC14中后仍为分子状态,显示出12单质在蒸气时的紫颜 色。
江苏师范大学《无机化学》习题库及答案第十二章 s区元素

第十二章S区元素一、选择题(每题3分,共30分)( ) 1. 钠在空气中燃烧,得到的产物是(A) Na2O (B) Na2O2(C) NaO2(D) Na2CO3( ) 2. 下列氢氧化物中碱性最强的是(A) LiOH (B) NaOH (C) KOH (D) Mg(OH)2 ( ) 3. 下列氢氧化物中溶解度最小的是(A) LiOH (B) NaOH (B) KOH (D) RbOH( ) 4. 下列哪一个氢氧化物是两性的?(A) Be(OH)2(B) Mg(OH)2(C) Ca(OH)2(D) Sr(OH)2( ) 5. 下列晶体中熔点最高的是(A) BeCl2(B) MgCl2(C) CaCl2(D) SrCl2 (E) BaCl2( ) 6. 下列物质中热稳定性最高的是(A) BeCO3(B) MgCO3(C) CaCO3(D) SrCO3 (E) BaCO3( ) 7.下列成对元素中化学性质最相似的是()(A) Be和Mg (B) Mg和Al (C) Li和Mg (D) Be和B( ) 8. 氢化铷与水反应可放出氢气,则下列叙述正确的是()(A) 氢化铷溶于水显酸性。
(B) 氢化铷中的氢离子被还原为氢气。
(C) 氢化铷与水反应时,水是还原剂。
(D) 氢化铷中的氢离子最外层有两个电子。
( ) 9. 现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L。
这种碱金属可能是( )(A) Na (B) K (C) Rb (D) Cs( ) 10. 我国人民很早就知道用焰色反应来鉴别某些物质。
南北朝时期,著名的炼丹家和医药大师陶弘景在他的《本草经集注》中就有这样的记载:“以火烧之,紫青烟起,云是真硝石也”。
这一记载所鉴别出的物质应该是()(A) NaNO3(B) KNO3(C) KMnO4(D) I2二、填空题(每空1分,共31分)1. 钠与水剧烈作用,生成___和____,易引起燃烧和爆炸,需贮存在_________或_________中,而锂的密度很小,能浮在煤油上,所以将其保存在__________。
大学无机化学试题及答案
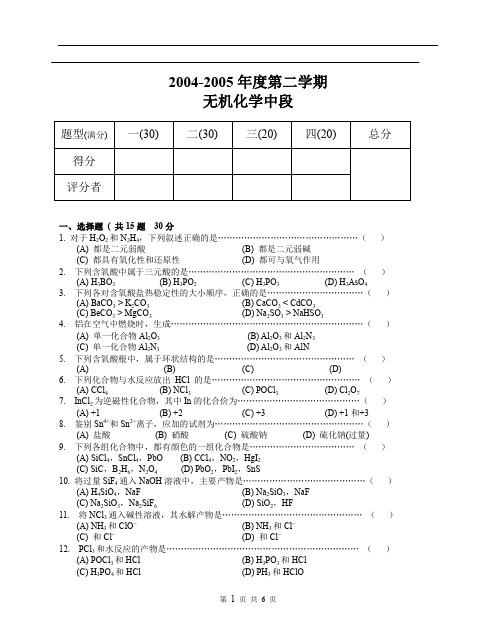
2004-2005年度第二学期无机化学中段一、选择题( 共15题30分1. 对于H2O2和N2H4,下列叙述正确的是…………………………………………()(A) 都是二元弱酸(B) 都是二元弱碱(C) 都具有氧化性和还原性(D) 都可与氧气作用2. 下列含氧酸中属于三元酸的是…………………………………………………()(A) H3BO3(B) H3PO2(C) H3PO3(D) H3AsO43. 下列各对含氧酸盐热稳定性的大小顺序,正确的是……………………………()(A) BaCO3 > K2CO3(B) CaCO3 < CdCO3(C) BeCO3 > MgCO3(D) Na2SO3 > NaHSO34. 铝在空气中燃烧时,生成…………………………………………………………()(A) 单一化合物Al2O3(B) Al2O3和Al2N3(C) 单一化合物Al2N3(D) Al2O3和AlN5. 下列含氧酸根中,属于环状结构的是…………………………………………()(A) (B) (C) (D)6. 下列化合物与水反应放出HCl 的是……………………………………………()(A) CCl4(B) NCl3(C) POCl3(D) Cl2O77. InCl2为逆磁性化合物,其中In的化合价为……………………………………()(A) +1 (B) +2 (C) +3 (D) +1和+38. 鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)9. 下列各组化合物中,都有颜色的一组化合物是………………………………()(A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2(C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS10. 将过量SiF4通入NaOH溶液中,主要产物是……………………………………()(A) H4SiO4,NaF (B) Na2SiO3,NaF(C) Na2SiO3,Na2SiF6(D) SiO2,HF11. 将NCl3通入碱性溶液,其水解产物是…………………………………………()(A) NH3和ClO-(B) NH3和Cl-(C)和Cl-(D)和Cl-12. PCl3和水反应的产物是…………………………………………………………()(A) POCl3和HCl (B) H3PO3和HCl(C) H3PO4和HCl (D) PH3和HClO13. 下列各对物质,水解能力对比,正确的是………………………………………()(A)>(B)>(C) SnCl2 > SnCl4(D) PCl3 > BiCl314. 二氧化氮溶解在NaOH溶液中可得到:(A) NaNO2和H2O (B) NaNO2,O2和H2O(C) NaNO3,N2O5和H2O (D) NaNO3,NaNO2和H2O15. 下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………()(A) SnS (B) SnS2(C) PbS (D) Bi2S3二、填空题( 共12题30分)16. N2O3很容易分解为和。
大学无机化学第十二章试题及答案

第十三章硼族元素总体目的:硼单质、氢化物、卤化物和含氧化物的性质、用处和制备方法2. 通过硼及其化合物的构造和性质,掌握缺电子化合物的成键特征铝及其化合物的构造、性质和制备4. .认识铍和铝的相似性各节目的:第一节硼单质及其化合物1.掌握硼单质的构造、化学性质、用处和制备方法2.掌握乙硼烷、硼酸〔H3BO3〕、硼砂和三卤化硼的性质、构造和制备方法3.通过硼及其化合物的构造和性质,掌握缺电子化合物的成键特点和桥键的形成第二节铝单质及其化合物的构造,理解铝的提取和冶炼32.认识铍和铝的相似性,如金属单质、无水卤化物、水合卤化物、氢氧化物第三节镓、铟、铊理解镓、铟、铊单质及其重要化合物的性质习题一、选择题⒈以下有关硼、铝性质的表达,错误的选项是( )(OH)3是弱酸,Al(OH)3是两性偏碱性⒉在以下a—Al2O3的制备方法中,不妥的是( )(OH)3(NO3)3(SO4)32⒊以下铝的化合物不能用湿法制得的是( )A. Al2(CO3)32(SO4)3 C.AlCl3(Ac)34. 以下矿物中含有铝的是( )5. 以下化合物属于缺电子化合物的是( ) (吉林大学?无机化学例题与习题?)A.BCL3B. H[BF4]C. B2O3D. Na[Al(OH)4]6. 在硼的化合物中,硼原子的最高配位数不超过4,这是因为( )A .硼原子半径小 B.配位原子半径大C.硼与配位原子电负性差小D. 硼原子无价层d轨道7. 以下关于BF3的表达中,正确的选项是( )易形成二聚体3为离子化合物3C. BF3为路易斯酸D. BF3常温下为液体8. 以下金属单质中,熔点最低的是( ) (吉林大学?无机化学例题与习题?)A. CuB. ZnC. NaD. Ga9. 以下化合物中,熔点最低的是( ) (吉林大学?无机化学例题与习题?)A. BCl3B. CCl4C. SiCl4D. SnCl410. 以下物质中水解并能放出H2的是( ) (吉林大学?无机化学例题与习题?)A. B2H6B. N2H4C. NH3D. PH311. 以下化合物中不能稳定存在的是( ) (吉林大学?无机化学例题与习题?)A. SbI3B. PI3C. AlI3D. TiI312 . 以下含氧酸中属于一元酸的是( ) (吉林大学?无机化学例题与习题?)A .H3AsO3 B.H3BO3 C.H3PO3 D .H2CO313.以下物质中,酸性最弱的是( ) (吉林大学?无机化学例题与习题?)A.. H3PO3 B . H2S C. H3BO3 D. H5IO614.以下金属中,与硝酸反响得到产物的氧化数最低是( )A .In B. Tl C. Fe D . Bi15.以下金属中,氧化才能最强的是( ) (吉林大学?无机化学例题与习题?)A. NO2B.SO3 C .B2O3 D. Tl2O316.以下分子中,偶极矩最小的是( ) (吉林大学?无机化学例题与习题?)A .B2H6 B. SO2 C. NCl3 D. SF417.以下化合物中,氧化性与惰性电子对效应有关的是( )A .I2O5 B. Tl2O3 C . Mn2O7 D. CrO3溶液反响生成碱式盐沉淀的离子是( )33+2+2+2+( )A. Al2O3B. Ga2O3C. In2O3D. Tl2O3( )A. AlCl3B. AlBr3C. NaClD. KNO3( )D. AlCl322. 用电解法制备金属铅时,在Al2O3中参加Na3AlF6的作用是( )O3的熔化温度降低 B.作为原料223.以下关于乙硼烷的表达中,不正确的选项是( )A.它是缺电子化合物—B键可自由旋转24.硼酸与多元醇反响,生成配位酸,使其酸性( )二、填空题1. 最简单的硼氢化合物是,B原子的杂化方式为;由于它属于化合物,B与B存在碱。
大学无机化学第十二章试题(卷)与答案解析

第十三章硼族元素总体目标:1.掌握硼单质、氢化物、卤化物和含氧化物的性质、用途和制备方法2. 通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特征3.掌握铝及其化合物的结构、性质和制备4. .认识铍和铝的相似性各节目标:第一节硼单质及其化合物1.掌握硼单质的结构、化学性质、用途和制备方法2.掌握乙硼烷、硼酸(H3BO3)、硼砂和三卤化硼的性质、结构和制备方法3.通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特点和桥键的形成第二节铝单质及其化合物1.掌握铝及其化合物的主要性质和AlCl3的结构,了解铝的提取和冶炼2.认识铍和铝的相似性,如金属单质、无水卤化物、水合卤化物、氢氧化物第三节镓、铟、铊了解镓、铟、铊单质及其重要化合物的性质习题一、选择题⒈下列有关硼、铝性质的叙述,错误的是()A.都是缺电子原子B.B(OH)3是弱酸,Al(OH)3是两性偏碱性C.其三卤化物分子都是平面三角形结构D.都是亲氧元素⒉在下列a—Al2O3的制备方法中,不妥的是()A.灼烧Al(OH)3B.灼烧Al(NO3)3C.高温电解Al2(SO4)3D.金属铝在氧中燃烧⒊下列铝的化合物不能用湿法制得的是()A. Al2(CO3)3B.Al2(SO4)3C.AlCl3D.Al(Ac)34.以下矿物中含有铝的是()A.冰晶石B.孔雀石C.白云石D.方铅矿5.下列化合物属于缺电子化合物的是()(吉林大学《无机化学例题与习题》)A.BCL3B. H[BF4]C. B2O3D. Na[Al(OH)4]6.在硼的化合物中,硼原子的最高配位数不超过4,这是因为()A .硼原子半径小B.配位原子半径大C.硼与配位原子电负性差小D. 硼原子无价层d轨道7. 下列关于BF3的叙述中,正确的是()A.BF3易形成二聚体B.BF3为离子化合物C. BF3为路易斯酸D. BF3常温下为液体8. 下列金属单质中,熔点最低的是()(吉林大学《无机化学例题与习题》)A.CuB.ZnC. NaD. Ga9. 下列化合物中,熔点最低的是()(吉林大学《无机化学例题与习题》)A. BCl3B. CCl4C. SiCl4D. SnCl410. 下列物质中水解并能放出H2的是()(吉林大学《无机化学例题与习题》)A.B2H6B.N2H4C.NH3D. PH311. 下列化合物中不能稳定存在的是()(吉林大学《无机化学例题与习题》)A.SbI3B. PI3C. AlI3D. TiI312 . 下列含氧酸中属于一元酸的是()(吉林大学《无机化学例题与习题》)A .H3AsO3B.H3BO3 C.H3PO3 D .H2CO313.下列物质中,酸性最弱的是()(吉林大学《无机化学例题与习题》)A..H3PO3 B . H2S C. H3BO3 D. H5IO614.下列金属中,与硝酸反应得到产物的氧化数最低是()A .In B. Tl C. Fe D . Bi15.下列金属中,氧化能力最强的是()(吉林大学《无机化学例题与习题》)A. NO2B.SO3 C .B2O3 D. Tl2O316.下列分子中,偶极矩最小的是( )(吉林大学《无机化学例题与习题》)A .B2H6 B. SO2C. NCl3 D. SF417.下列化合物中,氧化性与惰性电子对效应有关的是( )A .I2O5 B. Tl2O3 C . Mn2O7 D. CrO318.与NaCO3溶液反应生成碱式盐沉淀的离子是()A.Al3+B.Ba2+C.Cu2+D.Hg2+19.氧化性最强的是()A. Al2O3B. Ga2O3C. In2O3D. Tl2O320.水解性最强的是()A. AlCl3B. AlBr3C.NaClD. KNO321.下列物质熔点最高的是()A.单质硼B.金属铝C.金属镓D. AlCl322.用电解法制备金属铅时,在Al2O3中加入Na3AlF6的作用是()A.使Al2O3的熔化温度降低B.作为原料C.防止金属铝氧化D.加快反应速度23.下列关于乙硼烷的叙述中,不正确的是()A.它是缺电子化合物B.围绕B—B键可自由旋转C.分子中存在三中心二电子氢桥键D.它最终水解产物是氢气和硼酸24.硼酸与多元醇反应,生成配位酸,使其酸性()A.减弱B.增强C.不变D.变化不定二、填空题1. 最简单的硼氢化合物是,B原子的杂化方式为;由于它属于化合物,B与B存在碱。
大学无机化学试题及答案(DOC)

无机化学试题一、选择题1.对于H2O2和N2H4,下列叙述正确的是…………………………………………()(A) 都是二元弱酸(B) 都是二元弱碱(C) 都具有氧化性和还原性(D) 都可与氧气作用2.下列含氧酸中属于三元酸的是…………………………………………………()(A) H3BO3(B) H3PO2(C) H3PO3(D) H3AsO43.下列各对含氧酸盐热稳定性的大小顺序,正确的是……………………………()(A) BaCO3 > K2CO3(B) CaCO3 < CdCO3(C) BeCO3 > MgCO3(D) Na2SO3 > NaHSO34.铝在空气中燃烧时,生成…………………………………………………………()(A) 单一化合物Al2O3(B) Al2O3和Al2N3(C) 单一化合物Al2N3(D) Al2O3和AlN5.下列含氧酸根中,属于环状结构的是…………………………………………()(A) (B) (C) (D)6.下列化合物与水反应放出HCl 的是……………………………………………()(A) CCl4(B) NCl3(C) POCl3(D) Cl2O77. InCl2为逆磁性化合物,其中In的化合价为……………………………………()(A) +1 (B) +2 (C) +3 (D) +1和+38.鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)9.下列各组化合物中,都有颜色的一组化合物是………………………………()(A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2(C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS10.将过量SiF4通入NaOH溶液中,主要产物是……………………………………()(A) H4SiO4,NaF (B) Na2SiO3,NaF(C) Na2SiO3,Na2SiF6(D) SiO2,HF11.将NCl3通入碱性溶液,其水解产物是…………………………………………()(A) NH3和ClO-(B) NH3和Cl-(C)和Cl-(D)和Cl-12.PCl3和水反应的产物是…………………………………………………………()(A) POCl3和HCl (B) H3PO3和HCl(C) H3PO4和HCl (D) PH3和HClO13.下列各对物质,水解能力对比,正确的是………………………………………()(A)>(B)>(C) SnCl2 > SnCl4(D) PCl3 > BiCl314.二氧化氮溶解在NaOH溶液中可得到:(A) NaNO2和H2O (B) NaNO2,O2和H2O(C) NaNO3,N2O5和H2O (D) NaNO3,NaNO2和H2O15.下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………()(A) SnS (B) SnS2(C) PbS (D) Bi2S3二、填空题16.N2O3很容易分解为和。
湖南理工学院2021年化学化工系无机化学(下)课程考试试题及答案(B卷)

湖南理工学院2021年化学化工系无机化学(下)课程考试试题及答案(B卷)化工系《无机化学》课程考试试题(B卷)2021-2021学年第二学期_07级制药、应化、化学班级时量:120分钟总分100分,考试形式:闭卷一、选择题 ( 共 20题 40分 )1 在下列化合物中,属杂多酸盐的是……………………………() (A)Na3[P(W12O40)] (B) KCr(SO4)2・12H2O (C) Na4Mo7O23 (D) Fe2(CO)92 某金属离子在八面体弱场中的磁矩是4.90 B.M.,而在八面体强场中的磁矩为0,该中心金属离子可能是……………()(A) Cr(III) (B) Mn(II) (C) Mn(III) (D) Fe(II)3 在[Co(en)(C2O4)2]配离子中,中心离子的配位数为…………………………………()(A) 3 (B) 4 (C) 5 (D) 64 根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋或低自旋的电子构型是…()(A) d2 (B) d3 (C) d4 (D) d85 不属于强氧化剂的是()。
A PbO2B NaBiO3C HClD (NH4)2S2O86 下列化合物,不属于多元酸的是()A H3AsO4B H3PO4C H3BO3D H4 SiO47 下列新制备出的氢氧化物沉淀在空气中放置,颜色不发生变化的是()A Fe(OH)2B Mn(OH)2C Co(OH)2D Ni(OH)2 8 过渡金属与许多非金属的共同点是:()A 有高的电负性B 许多化合物有颜色C 多种氧化态D 许多顺磁性化合物 9 Fe2+具有d5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能p所要满足的条件是:()A △和P越大越好B △〉PC △〈PD △=P 10 下列配离子属于反磁性的是:()A [Mn(CN)6]4-B [Cu(en)2]2+C [Fe(CN)6]3-D [Co(CN)6]3- 11 在氯的含氧酸中,氧化能力最强的是:()A HClOB HClO2C HClO3D HClO4 12 下列物质中酸性最强的是:()A H3PO4B H3PO3C H3AsO3D H3AsO4 13 下列物质中不属于缺电子化合物的是:()A BCl3B H[BF4]C B2H6D H3BO3 14 下列物质在水中溶解度最小的是:()第 1 页共3页A NaHCO3B Na2CO3C KHCO3D K2CO3 15 下列物质碱性最强的是:()A Be(OH)2B Mg(OH)2C Ca(OH)2D LiOH16 导致水的沸点在同族元素氢化物中反常高的主要原因是:()A 色散力B 诱导力C 取向力D 氢键 17 下列物质中晶格能大小顺序中正确的是:()A MgO��CaO �� NaFB CaO��MgO �� NaFC NaF ��MgO��Ca OD NaF ��Ca O��MgO 18 下列分子中偶极矩等于0的是:()A CS2B NH3C H2SD SO319 下列分子中,含有极性键的非极性分子是:()A P4B BF3C IClD PCl320 下列分子或离子中没有孤对电子的是:()A H2OB H2SC NH4+D PCl3二、填空题 ( 共 5题 15分 )1、K2Cr207溶液分别与BaCl2、KOH和浓HCl(加热)作用,将分别转变为______1_________,_______2_______,____3_________ 。
《无机化学习题》及答案12

K2SO4 + H2O K2SO4 + H2SO4 + H2O2
(IV)
S (⎯VI)⎯⎯ Na2SO3 ⎯(⎯V)→ SO2
(VII) SO42-
(VIII)
S2O42-
(I) SO2 + NaOH NaHSO3 + H2O
(II) NaHSO3 + NaOH
Na2SO3 + H2O
煮沸
Na2SO3 + S
3S↓ + 2Cr3++ 7H2O
10.硫作氧化剂:S + H2
H2S S +Fe
FeS 2S +C
CS2
硫作还原剂:S + O2
SO2 S +Cl2(过量)
SCl2(l) S + 2HNO3
H2SO4 + 2NO
11. (1) 5H2O2 + 2KMnO4 + 6H+
5O2↑ + 2Mn2+ + 8H2O
CS2 S +Fe FeS
S2Cl2 S +Cl2(过量)
SCl2
S + 2HNO3 H2SO4 + 2NO
9. H2S + 2Fe3+
S↓ + 2Fe2+ + 2H+
5H2S + 2MnO4-+ 6H+
2Mn2+ + 5S↓ + 8H2O
H2S + 4Br2 + 4H2O
H2SO4 + 8HBr 3H2S + Cr2O72-+ 8H+
大学无机化学课后答案第六版孟第十二章答案

大学无机化学课后答案第六版孟第十二章答案1、沉淀法的分类不包括以下哪一种方法()[单选题] *A水提醇沉法B碱提酸沉法C铅盐沉淀法D结晶法(正确答案)2、碱性最强的生物碱是()[单选题] *A季铵碱类(正确答案)B哌啶类C吡啶类D吡咯类3、所有游离香豆素均可溶于热的氢氧化钠水溶液,是由于其结构中存在()[单选题] * A异戊烯基B酮基C内酯环(正确答案)D酚羟基对位活泼氢4、中药厚朴中含有的厚朴酚是()[单选题] *A双环氧木脂素类B联苯环辛烯型木脂素类C环木脂内酯木脂素类D新木脂素类(正确答案)5、以下哪种方法是利用混合中各成分在溶剂中的溶解度不同或在冷热情况下溶解度显著差异的原理而达到分离的()[单选题] *A沉淀法B分馏法C结晶法(正确答案)D升华法6、生物碱碱性的表示方法常用()[单选题] *ApKBBKBCpH(正确答案)DpKA7、单萜和倍半萜在化学结构上的明显区别是()[单选题] *A氮原子数不同B碳原子数不同(正确答案)C碳环数不同D硫原子数不同8、下列化合物中,酸性最强的是()[单选题] *A芦荟大黄素B大黄酚C大黄素甲醚D大黄酸(正确答案)9、属于二萜的化合物是()[单选题] *A龙脑B月桂烯C薄荷醇D穿心莲内酯(正确答案)10、水提醇沉法可以沉淀下列()等成分()[单选题] * A葡萄糖B多糖(正确答案)C树脂D生物碱11、E连续回流提取法(正确答案)能用乙醇作溶剂提取的方法有(多选)()*A浸渍法(正确答案)B渗漉法(正确答案)C煎煮法D回流提取法(正确答案)12、具有酚羟基或羧基的游离蒽醌类成分有一定酸性,可用的提取方法是()[单选题]* A酸溶碱沉法B碱溶酸沉法(正确答案)C水提醇沉法D醇提水沉法13、关于肿节风,说法正确的有(多选)()*A别名:接骨金粟兰、九节茶等(正确答案)B功能主治抗菌消炎凉血清热解毒(正确答案)C肿节风为白色针晶(正确答案)D不易溶于甲醇,乙醇14、在简单萃取法中,一般萃取几次即可()[单选题] *A3~4次(正确答案)B1~2次C4~5次D3~7次15、检识黄酮类化合物首选()[单选题] *A盐酸-镁粉反应(正确答案)B四氢硼钠反应C硼酸显色反应D锆盐-枸橼酸反应16、南五味子具有的主要化学成分是()[单选题] *A色原酮B胆汁酸C多糖D木脂素(正确答案)17、具有暖脾胃、散风寒、通血脉作用的是()[单选题] * A穿心莲内酯B青蒿素C莪术醇D桂皮醛(正确答案)18、适用于队热及化学不稳定的成分、低极性成分的提取()[单选题] * A渗漉法B超声提取法C回流提取法D超临界流体提取法(正确答案)19、以下黄酮类化合物中,以离子状态存在的是()[单选题] *A黄酮B花色素(正确答案)C二氢黄酮D查耳酮20、组成木脂素的单体基本结构是()[单选题] *AC5-C3BC5-C2CC6-C3(正确答案)DC6-C421、下列基团在极性吸附色谱中的被吸附作用最强的是()[单选题] *A羧基(正确答案)B羟基C氨基D醛基22、除了能够沉淀有羧基或邻二酚羟基成分,还能沉淀一般酚羟基成分的是()[单选题] *A碱式醋酸铅(正确答案)B中性醋酸铅C酸碱沉淀法D以上都不对23、结晶法一般是在分离纯化物质的哪个阶段常常使用的()[单选题] *A开始B中期C最后(正确答案)D以上均可24、能溶于水的生物碱是()[单选题] *A莨菪碱B小檗碱(正确答案)C长春新碱D长春碱25、牛蒡子属于()[单选题] *A香豆素类B木脂内酯(正确答案)C苯丙酸类D26、容易发霉变质的是()[单选题] *A中药水提取液(正确答案)B中药乙醇提取液C二者均是D二者均非27、分馏法分离挥发油的主要依据是()[单选题] * A密度的差异B沸点的差异(正确答案)C溶解性的差异D旋光性的差异28、苯丙素类的基本母核是具有一个或数个()单元的天然化合物()[单选题] * AC6-C3基团(正确答案)BC6-C6基团CC5-C3基团DC8-C8基团29、临床用于上呼吸道抗菌消炎的是()[单选题] *A穿心莲内酯(正确答案)B青蒿素C莪术醇D薄荷脑30、四氢硼钠反应变红的是()[单选题] *A山柰酚B橙皮素(正确答案)C大豆素D红花苷。
《无机化学》题库(含答案)

2.波函数和原子轨道二者之间的关系是…………………………………………(C) A.波函数是函数式,原子轨道是电子轨迹; B.波函数和原子轨道是同义词; C.只有轨道波函数与原子轨道才是同义的; D.以上三种说法都不对. 3.多电子原子的原子轨道能级顺序随着原子序数的增加………………………(D) A.轨道能量逐渐降低,但能级顺序不变; B.轨道能量基本不变,但能级顺序改变; C.轨道能量逐渐增加,能级顺序不变; D.轨道能量逐渐降低,能级顺序也会改变. 4.周期表中各周期元素数目是由什么决定的……………………………………(C) A.2n2(n 为主量子数); B.相应能级组中所含轨道总数; C.相应能级组中所含电子总数 D. n + 0.7 规则 5.下列电子构型中,电离能最低的是……………………………………………(A) A.ns2np3 B.ns2np4 C.ns2np5 D.ns2np6 6.下列元素中,第一电离能最大的是……………………………………………(B) A.B B.C C.Al D.Si 7.原子光谱中存在着不连续的线谱,证明了……………………………………(B) A.在原子中仅有某些电子能够被激发 B. 一个原子中的电子只可能有某些特定的能量状态 C.原子发射的光,在性质上不同于普通的白光 D.白光是由许许多多单色光组成. 8.原子轨道中"填充"电子时必须遵循能量最低原理,这里的能量主要是指……(C) A.亲合能 B.电能 C.势能 D.动能 9.下列哪一原子的原子轨道能量与角量子数无关? ……………………………(D) A.Na B.Ne C.F D.H 10.下列哪一种元素性质的周期规律最不明显…………………………………(A) A.电子亲合能 B.电负性 C.电离能 D.原子体积
大学无机化学复习题
《无机化学》习题解析和答案

1、教材《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章s区元素(4学时)第二十一章p区金属(4学时)第二十二章ds区元素(6学时)第二十三章d区元素(一)第四周期d区元素(6学时)第二十四章d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?●化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)●化学研究的是化学物质(chemicals) 。
●化学研究分子的组成、结构、性质与变化。
●化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
●化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
(完整版)无机化学试题及答案解析

第12 章S 区元素(第一套)一、单选题1. 重晶石的化学式是(A) BaCO3 , (B) BaSO4 , (C) Na2SO4 , (D) Na2CO32. 下列碳酸盐,溶解度最小的是(A) NaHCO3 , (B) Na2CO3 , (C) Li2CO3 , (D) K2CO33. NaN03受热分解的产物是(A) Na2O,NO2,O2;(B)NaNO2,O2;(C)NaN02,N02,02;(D)Na20,N0,02。
4. 下列哪对元素的化学性质最相似(A) Be 和Mg (B) Mg 和Al (C) Li 和Be (D) Be 和Al5. 下列元素中第一电离能最小的是(A) Li (B) Be (C) Na (D) Mg6. 下列最稳定的氮化物是(A) Li3N (B) Na3N (C) K3N (D) Ba3N27. 下列水合离子生成时放出热量最少的是(A) Li+ (B) Na+ (C) K+ (D) Mg2+8. 下列最稳定的过氧化物是(A) Li202 (B) Na202 (C) K202 (D) Rb2029. 下列化合物中键的离子性最小的是(A) LiCl (B) NaCl (C) KCl (D) BaCl210. 下列碳酸盐中热稳定性最差的是(A) BaC03 (B) CaC03 (C) K2C03 (D) Na2C0311. 下列化合物中具有磁性的是(A) Na202 (B) Sr0 (C) K02 (D) Ba0212. 关于s 区元素的性质下列叙述中不正确的是(A) 由于s 区元素的电负性小,所以都形成典型的离子型化合物(B) 在s 区元素中,Be、Mg 因表面形成致密的氧化物保护膜而对水较稳定(C) s 区元素的单质都有很强的还原性(D) 除Be、Mg 外,其他s 区元素的硝酸盐或氯酸盐都可做焰火材料13. 关于Mg , Ca , Sr , Ba及其化合物的性质下列叙述中不正确的是(A) 单质都可以在氮气中燃烧生成氮化物M3N2(B) 单质都易与水水蒸气反应得到氢气(C) M(HCO3)2在水中的溶解度大MC03的溶解度(D) 这些元素几乎总是生成+2 价离子二、是非题(判断下列各项叙述是否正确对的在括号中填“/ 错的填“X”)1. 因为氢可以形成H+所以可以把它划分为碱金属2. 铍和其同组元素相比离子半径小极化作用强所以形成键具有较多共价性3. 在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十三章硼族元素总体目标:1.掌握硼单质、氢化物、卤化物和含氧化物的性质、用途和制备方法2. 通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特征3.掌握铝及其化合物的结构、性质和制备4. .认识铍和铝的相似性各节目标:第一节硼单质及其化合物1.掌握硼单质的结构、化学性质、用途和制备方法2.掌握乙硼烷、硼酸(H3BO3)、硼砂和三卤化硼的性质、结构和制备方法3.通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特点和桥键的形成第二节铝单质及其化合物1.掌握铝及其化合物的主要性质和AlCl3的结构,了解铝的提取和冶炼2.认识铍和铝的相似性,如金属单质、无水卤化物、水合卤化物、氢氧化物第三节镓、铟、铊了解镓、铟、铊单质及其重要化合物的性质习题一、选择题⒈下列有关硼、铝性质的叙述,错误的是( )A.都是缺电子原子(OH)3是弱酸,Al(OH)3是两性偏碱性C.其三卤化物分子都是平面三角形结构D.都是亲氧元素⒉在下列a—Al2O3的制备方法中,不妥的是( )A.灼烧Al(OH)3B.灼烧Al(NO3)3C.高温电解Al2(SO4)3D.金属铝在氧中燃烧⒊下列铝的化合物不能用湿法制得的是( )A. Al2(CO3)3(SO4)3 C.AlCl3(Ac)34. 以下矿物中含有铝的是( )A.冰晶石B.孔雀石C.白云石D.方铅矿5. 下列化合物属于缺电子化合物的是( ) (吉林大学《无机化学例题与习题》)B. H[BF4]C. B2O3D. Na[Al(OH)4]6. 在硼的化合物中,硼原子的最高配位数不超过4,这是因为( )A .硼原子半径小 B.配位原子半径大C.硼与配位原子电负性差小D. 硼原子无价层d轨道7. 下列关于BF3的叙述中,正确的是( )易形成二聚体为离子化合物C. BF3为路易斯酸D. BF3常温下为液体8. 下列金属单质中,熔点最低的是( ) (吉林大学《无机化学例题与习题》)A. CuB. ZnC. NaD. Ga9. 下列化合物中,熔点最低的是( ) (吉林大学《无机化学例题与习题》)A. BCl3B. CCl4C. SiCl4D. SnCl410. 下列物质中水解并能放出H2的是( ) (吉林大学《无机化学例题与习题》)A. B2H6B. N2H4C. NH3D. PH311. 下列化合物中不能稳定存在的是( ) (吉林大学《无机化学例题与习题》)A. SbI3B. PI3C. AlI3D. TiI312 . 下列含氧酸中属于一元酸的是( ) (吉林大学《无机化学例题与习题》)A .H3AsO3 3 C D .H2CO313.下列物质中,酸性最弱的是( ) (吉林大学《无机化学例题与习题》)A.. H3PO3 B . H2S C. H3BO3 D. H5IO614.下列金属中,与硝酸反应得到产物的氧化数最低是( )A .In B. Tl C. Fe D . Bi15.下列金属中,氧化能力最强的是( ) (吉林大学《无机化学例题与习题》)A. NO2 3 C .B2O3 D. Tl2O316.下列分子中,偶极矩最小的是( ) (吉林大学《无机化学例题与习题》)A .B2H6 B. SO2 C. NCl3 D. SF417.下列化合物中,氧化性与惰性电子对效应有关的是( )A .I2O5 B. Tl2O3 C . Mn2O7 D. CrO318.与NaCO3溶液反应生成碱式盐沉淀的离子是( )++++19.氧化性最强的是( )A. Al2O3B. Ga2O3C. In2O3D. Tl2O320.水解性最强的是( )A. AlCl3B. AlBr3C. NaClD. KNO321.下列物质熔点最高的是( )A.单质硼B.金属铝C.金属镓D. AlCl322. 用电解法制备金属铅时,在Al2O3中加入Na3AlF6的作用是( )A.使Al2O3的熔化温度降低B.作为原料C.防止金属铝氧化D.加快反应速度23.下列关于乙硼烷的叙述中,不正确的是( )A.它是缺电子化合物B.围绕B—B键可自由旋转C.分子中存在三中心二电子氢桥键D.它最终水解产物是氢气和硼酸24.硼酸与多元醇反应,生成配位酸,使其酸性( )A.减弱B.增强C.不变D.变化不定二、填空题1. 最简单的硼氢化合物是,B原子的杂化方式为;由于它属于化合物,B与B存在碱。
(吉林大学《无机化学例题与习题》)6H2O加热后,产物是。
3.由于铝,所以它不溶于水。
由于铝,所以它不与浓硝酸反应。
铝与氢氧化钠溶液作用生成和。
是磁性物质,结构式应写成5.硼砂的化学式为,其为元碱。
(吉林大学《无机化学例题与习题》)6.写出用稀硝酸处理金属铊的反应方程式。
7.写出向KI溶液中加入TlCl3溶液的反应方程式。
8.无机苯的化学式为,其结构为,与的结构相似。
9.硼酸为状晶体,硼酸分子之间以键结合,层与层之间以结合,故硼酸晶体具有性,可作为剂。
10.放在手中能够融化的金属有,以液相存在的温度范围最大的是。
(吉林大学《无机化学例题与习题》)11.硼酸与乙醇生成硼酸三乙酯的化学式,其火焰为色,以此可以鉴定硼酸。
(吉林大学《无机化学例题与习题》)与金属氧化物共熔生成的硼珠有特征的颜色,称为硼珠试验,如CoO的硼珠Co(BO2)2为深蓝色,则CuO 的硼珠为色,MnO 的硼珠为色,NiO 的硼珠为色,Cr2O3的硼珠为色,Fe2O3的硼珠为色。
(吉林大学《无机化学例题与习题》)13.判断:⑴化合物的热稳定性Ga2O3Tl2O3⑵化学活泼性a—Al2O3r—Al2O3⑶酸性Al(OH)3Ga(OH)3⑷酸性溶液中,氧化性Ga2O3Tl2O3⑸In+和Tl+在水中歧化的是14AlCl3在气态或CCl4溶液中是体,其中有桥键。
+与F-配位时形成,与Cl-配位时形成。
三、简答题TlOH易溶而TlCl难溶;(吉林大学《无机化学例题与习题》)BCl3的沸点比AlCl3低(吉林大学《无机化学例题与习题》)CuCl2 顺磁性而InCl2 为逆磁性。
(吉林大学《无机化学例题与习题》)1. 4.铝和硼有哪些相同和不同的性质5.⑴就铝盐和铝酸盐的生成和性质作一简单扼要的比较。
⑵就Al2Cl6和B2H6的结构作一比较。
6.根据铝在酸性或碱性时的标准电极电势说明:(1)铝在酸、水、碱中溶解的可能性,以便确定铝在这些溶液中的稳定性。
(2)实际上铝不溶于水中,但能溶于NH4Cl或Na2CO3的溶液中。
四、计算题⒈在铝盐溶液中滴加碱溶液,并充分搅拌,当刚有Al(OH)3沉淀生成时,溶液中Al3+离子浓度为L,问开始沉淀时溶液的pH值为多少(已知Ksp[Al(OH)3]=×10-33)2.求饱和Al(OH)3水溶液的pH值。
(Ksp[Al(OH)3]=×10-33)3.在pH=10时,要使0.10M铝盐溶液不生成Al(OH)3沉淀,NaF浓度至少需要多大参考答案一、选择题4. A 10A 21 A22. A二、填空题1、乙硼烷,sp3,缺电子,三中心二电子氢桥健。
2. Al(OH)Cl2+HCl 。
3.表面有一层致密氧化膜覆盖,能被浓硝酸钝化,Na[Al(OH4)],H24. 逆,Ga[GaCl4]二6..3Tl+4HNO3(稀)===3TlNO3+NO↑+2H2O7. TlCl3+3KI===TlI↓+I2+3KCl9.片,氢,分子间力,理解,润滑和Ga11.(C2H5O)3B ,绿12.蓝,紫,绿,绿,黄13. ⑴> ⑵< ⑶> ⑷< ⑸In+14. 双聚体,氯三、简答题变形小,与Tl +间极化作用差,TlOH 为离子化合物;Tl +半径较大,与间的离子键不强;所以TlOH 易溶。
Cl -变形性比OH -大,Cl -与半径大的Tl +间有相互极化作用,TlCl 中共价成分较大;所以,TlCl 难溶。
2.三氯化硼的共价性比三氯化铝强,而分子半径比三氯化铝小,因而三氯化硼的沸点应比三氯化铝低中的Cu 2+电子构型为3d 0,有一个单电子,因而CuCl 2为顺磁性。
InCl 2化合物是由In + 和 In 3+构成,即可以写成In[InCl 4],,In + 和 In 3都无单电子,因而InCl 2是反磁性的。
4. 答:Al 和B 的价电子层结构都是ns 2np 1,最高氧化态为+3,都是缺电子原子,都有桥状结构化合物,都有MX 3卤化物和M 2O 3氧化物。
MX 3是缺电子化合物,为路易斯酸,容易形成卤化物(如AlCl 3、BF 3等)。
这些卤化物也都容易水解。
但两者金属性不同,Al 为金属,B 为非金属,Al(OH)3系两性,而B(OH)3为酸。
5.答:⑴Al 、Al 2O 3或Al(OH)3与酸作用都得铝盐(Al 3+);与强碱作用,都生成铝酸盐(-2AlO )。
铝盐和铝酸盐一般都溶于水,只要价结合的相反电荷离子无色,这些盐一般无色,它们都水解。
Al 3+水解使溶液显酸性,而-2AlO 水解使溶液显碱性。
⑵Al 为缺电子原子,它与Cl 2结合形成双聚分子而具有桥状结构。
Al 原子进行sp 3杂化,每个Al 原子与3个Cl 原子形成3个Al~Cl σ键,还有一个sp 3空轨道可以接受来自Cl 原子的孤对电子对,形成三中心四电子键,生成桥键配位化合物。
这种桥键称卤桥键。
B 也是缺电子原子,它与氢形成化合物时也必须形成组成为B 2H 6的分子才能满足价轨道的需要。
两个B 原子各以两个sp 3杂化轨道同两个H 原子形成2个B —H σ键,这4个σ键在同一个平面之上,剩下的四个价电子在2个B 原子和另外2个H 原子之间垂直于上述平面的两个三中心两电子键,一个在平面之上,一个在平面之下,每个三中心键是由一个H 原子和二个B 原子共用价电子构成的,这种B —H —B 三中心两电子键称为氢桥键。
所以Al 2Cl 6与B 2H 6都是桥式结构,分子中卤桥键及氢桥键也都是三中心键。
但由于Cl 原子对由孤电子对,H 原子没有;Al 的原子半径比B 大,Cl 的原子半径比氢大,Cl 桥键的键长比B —H 桥键的键长长一些,键能则弱一些。
Al —Cl —Al 桥键同B —H —B 桥键都是离域键,但前者有配键性质。
6. 答:(1)有关标准电极电势如下:Al 3++3e -=Al E A 0=H 2AlO 3-+H 2O+3e --=Al+4CH - E B 0=2H ++2e -=H 2 E A 0=2H 2O+2e -= H 2+2OH - E B 0=由此可见无论在酸、水或碱中Al 都是不稳定的,容易置换溶液中的H +使之成为H 2而自身被氧化为Al(Ⅲ)。
但事实上铝却不与水反应,这是由于铝在空气中放置时表面被氧化生成一层致密的Al 2O 3氧化膜,它不能被水溶解,因而隔绝了与水的进一步接触而使之作用。
