化工原理课件95双组分精馏的设计型计算(精)
合集下载
化工原理课件第五章 蒸馏

Q FcP (T tF )
FcP (T te ) (1 q)Fr
T
te
(1
q)
r cp
tF-原料液的温度℃ T-通过加热器后原料液的温度℃
te-分离器中的平均温度℃ F-原料液流量Kmol/h
cp-原料液平均比热KJ/(Kmol. ℃) r-平均汽化潜热
三、气液平衡关系
理想溶液:
x
A
A
p
1.2.2 非理想物系的气液平衡
1.具有正偏差的溶液 一般正偏差:pA>pA理, pB>pB理。
乙醇-水溶液相图 正偏差溶液:x=0.894,最低恒沸点,78.15℃
2. 具有负偏差的溶液 一般负偏差 pA<pA理, pB<pB理。
硝酸-水溶液相图 负偏差溶液:x=0.383,最高恒沸点,121.9℃
组分: A、B 一、相律分 析: 变量 : t、p、xA、 yA
相数: 气相、液相
自由度:f c 2 2
C:独立组分数
Ø:相数
一定压力下:液相(气相)组成xA(yA)与温度t存在一 一对应关系气液组成之间xA~yA存在一一对应关系
二、两组分理想物系气液平衡函数关系 1. 拉乌尔定律( Raoult’s Law)
xF,y,x--分别为原料液、气相与液相产 品的组成,摩尔分率。
y
FxF Wx D
F
F W
xF
W F W
x
q W 液化分率 F
=1 1 q
xF
q 1 q
x
qx q 1
q
1
1
xF
平率衡为蒸馏中气液相平衡组q 成的关系。通过(xF, xF )斜
化工原理下1-3 精馏的物料衡算(课堂PPT)

1(1.61)x1
x1 0.92
R
1
(2) y2R1x1R1xD
2210.9220.9150.93
(3) V (质)= ( R + 1 ) D(质)
= ( 2 + 1 )×50 kg / h = 150 kg / h M氯访= 119.35 kg / kmol M四氯化碳 = 153.8kg / kmol Mm= (0.95×119.35 + 0.05×153.8) kg / kmol
质量分率化为摩尔分率
x
xG/MA
xG/MA(1xG)/MB
摩尔分率化为质量分率
xGxMAx(1M Ax)MB
XG表示轻组分的质量分率
例题1:将5000kg/h含正戊烷0.4(摩尔分率)的正戊烷正 己烷混合液在连续精馏塔内分离,馏出液含正戊烷0.98, 釜液含正戊烷不高于0.03,求馏出液、釜液的流量及塔 顶易挥发组分的回收率。
yn1L内 L 内DxnL内 D DxD
若令 R内L内/D
则yn1R内 R内 1xnR内 xD 1
R内与R关系? 令R内q回流 R
则 q回流 R R 内L L 内 //D DL L 内
LLLpC m (tbtR)/rm
L
L
q回流cpm(tb
tR)rm rm
例题2
例: 氯仿和四氯化碳的混合液在连续精馏塔内 分离,要求馏出液氯仿浓度为0.95(摩尔分率),流
塔釜难挥发组分回收率
W (1 xW )
F(1xF)
思考
为什么不再对重组分进行物料衡算? 答:由于xB=1-xA,并不是独立的,
对重组分物料衡算所得的方程:
F (1-xF) = D(1- xD)+ W (1-xW) 可由F = D + W 与
化工原理第一节 精馏1.概述、相平衡(课堂PPT)

Boiling Point 泡点线:
Boiling Curve
对应液体的每一个组成,都有与之对应的泡 点。所有这些泡点形成的蓝色线叫泡点线
2
23
混合蒸汽冷凝过程
在t ~ x ~ y相图上表
达
露点 : Dew point 露点线 : Dew point curve
2
24
注意
• 混合液体的泡点、 露点随组成而变, 不是定值
m
1 2
(1
2 )
--算术
m
1
---几何
2
要求:
1(塔顶)和2(塔底)相差 < 15%
超过这个范围,应将相平衡曲线分段
2
P242 (例子6-3 ):
19
表1、苯和甲苯混合物的相对挥发度
温度(℃)
80
90
100
110
2.62 2.44 2.40 2.39
苯沸点:80.1 ℃,甲苯沸点:110.63 ℃, 可看成常数。近似理想物系。
易挥发组分越来越少
6
2. 平衡蒸馏(闪蒸) Equilibrium (Flash) Distillation
关键部件:节流阀
经过节流阀以后的气液两相成平衡状态:故称之为平衡蒸馏
2
7
3. 精馏 Rectification
冷凝器
加热器
2
8
4. 特殊精馏
恒沸精馏 Azetropic-Distillation 萃取精馏 Extrative-Distillation 分子蒸馏 现代科技进展之一:分子水平上的分离 催化精馏 现代科技进展之二:加入催化剂之精馏 反应精馏 现代科技进展之三:反应与精馏之耦合
组分的饱和蒸汽压实际上是温度的函数—Antoine 方程 (附录10---P.335)
中山大学化工原理课件 第6章-精馏

0 P pB xA 0 0 p A pB
0 0 pA P pB yA 0 0 P p A pB
上式为一定总压下汽相组成与温度的关系式。该温度又称为露点 (dew-point),上式又称为露点方程。
严格地说没有完全理想的物系。对那些性质相近、结构相似的组分 所组成的溶液,如苯-甲苯,甲醇-乙醇等,可视为理想溶液;若汽相 压力不太高,可视为理想气体,则物系可视为理想物系。 对非理想物系不能简单地使用上述定律。汽液相平衡数据更多地依靠 实验测定。
塔顶产品 yA 加热器 原料液
减压阀
闪 蒸 罐 xA
Q
塔底产品
三、精馏原理与流程 1. 精馏操作流程 精馏塔 精馏段 提馏段 塔顶冷凝器 塔釜再沸器 塔顶冷凝液 馏出液 回流液 塔釜产品 – 釜液 进料液 – 原料液 进料板
精 馏 段
提 馏 段
2. 精馏原理
T y2 o2 x2 x1 b 0 o1 y1
第四节 物料衡算和操作线方程
V
一. 全塔物料衡算 总:
D, xD
F D W
轻:
F, xF
FxF DxD WxW
W, xW
应用1: 确定产量及组成之间的关系
应用2: ① 确定馏出液采出率
F, xF
V
L
D, xD
D xF xW F xD xW
② 确定xD,max或 Dmax
露点
气相区
t/C
两相区
露点线
泡点 泡点线
液相区
0
xA
xf x(y)
yA
. 1.0
当温度达到该溶液的露点,溶液全部汽化成为组成为 yA= xf 的气相, 最后一滴液相的组成为 xA。
0 0 pA P pB yA 0 0 P p A pB
上式为一定总压下汽相组成与温度的关系式。该温度又称为露点 (dew-point),上式又称为露点方程。
严格地说没有完全理想的物系。对那些性质相近、结构相似的组分 所组成的溶液,如苯-甲苯,甲醇-乙醇等,可视为理想溶液;若汽相 压力不太高,可视为理想气体,则物系可视为理想物系。 对非理想物系不能简单地使用上述定律。汽液相平衡数据更多地依靠 实验测定。
塔顶产品 yA 加热器 原料液
减压阀
闪 蒸 罐 xA
Q
塔底产品
三、精馏原理与流程 1. 精馏操作流程 精馏塔 精馏段 提馏段 塔顶冷凝器 塔釜再沸器 塔顶冷凝液 馏出液 回流液 塔釜产品 – 釜液 进料液 – 原料液 进料板
精 馏 段
提 馏 段
2. 精馏原理
T y2 o2 x2 x1 b 0 o1 y1
第四节 物料衡算和操作线方程
V
一. 全塔物料衡算 总:
D, xD
F D W
轻:
F, xF
FxF DxD WxW
W, xW
应用1: 确定产量及组成之间的关系
应用2: ① 确定馏出液采出率
F, xF
V
L
D, xD
D xF xW F xD xW
② 确定xD,max或 Dmax
露点
气相区
t/C
两相区
露点线
泡点 泡点线
液相区
0
xA
xf x(y)
yA
. 1.0
当温度达到该溶液的露点,溶液全部汽化成为组成为 yA= xf 的气相, 最后一滴液相的组成为 xA。
化工原理第九章液体精馏

FiF Li V I Li VI
由恒摩尔假定,不同温度和组成的饱和液体焓i和汽 化潜热均相等。
20
联立上二式,得 定义:
L L I iF F I i
q
I iF分子:1kmol原料变成饱和蒸气所需的热 I i 分母:原料的摩尔汽化热
可得
L L qF
V V (1 q)F
q为加料热状态参数 q=0,饱和气体(露点);q=0,饱和液体(泡点) q<0,过热蒸气;0<q<1,气液两相,q>1,冷液
不管加料板上状态如何,离开加料板的两相温度相
等,组成互为平衡。
V,I,ym
L,i,xm-1
物料衡算式
F,iF,xF
FxF V ym1 Lxm1 Vym Lxm 相平衡方程
ym f (xm )
3)精馏段和提馏段流量的关系
V’,I,ym+1
L’,i,xm
列加料板物料和热量衡算式
F LV LV
临界压强时,气液共存区 缩小,分离只能在一定范 围内进行,不能得到轻组 分的高纯度产品。
8
9.3 平衡蒸馏和简单蒸馏
D
9.3.1 平衡蒸馏
令W q, F
则D 1q F
物料衡算:F xF D y W x
F
F DW
xF
联立得:y q x xF q 1 q 1
热量衡算:忽略组成对比热影响,
2)对理想物系
A / B
pA / xA pB / xB
p
0 A
xA
/
xA
pB0 xB / xB
pA0
pB0
3)对物系相对挥发度 1和相差2 不大
m
1 2
(1
9.5双组份连续精馏的计算—本章的核心内容
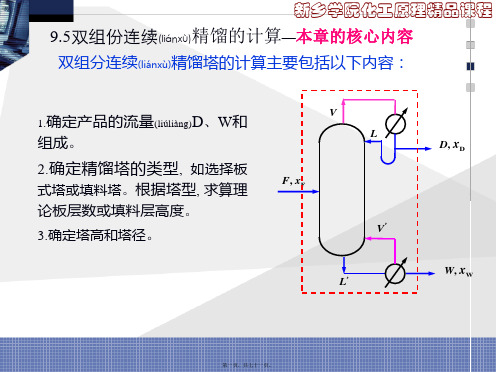
5
f
6
xn xd xF x2
1a x1 xD 1
第十七页,共七十一页。
新乡学院化工原理精品课程
⑤ 将q线、精馏段操作线的交
点d与点b连成提馏段操作线bd;
⑥ 从点a开始,在平衡线与
1 y1
精馏段操作线之间作梯级,当梯
y2 y3
级跨过点d时(这个梯级相当于加
料板),然后在平衡线与提馏段
操作线之间作梯级,直到跨过点b 为止。数梯级的数目,就可以分 别得出精馏段和提馏段的理论板 数,同时(tóngshí)也就确定了加料 板的位置。
L L qF
V V 1 qF
F,xF
V (1-q)F
L
qF L
L
V 精馏段
进料板 属提馏段
V
提馏段
图 加料板上的物流关系示意图 (进料为汽液混合物)
(7-52)
(7-53)
第二十二页,共七十一页。
新乡学院化工原理精品课程
二 、进料状态及各种进料状况下的q值
(1)进料状态
根据进料的料液温度有五种状态
求 yn 1 相平衡
提馏段
求 xn 1
求 yn 2 相平衡 求 xn 2
。。。,
直至 xnm xW 为止。
计算过程总共用了n+m次相平衡关系,因而(yīn ér)全塔所需的理论 板数N = n + m块(包括再沸器)。为什么理论板数中包含再沸器的
呢?
第十五页,共七十一页。
新乡学院化工原理精品课程
1 y1
角线;
y2
② 在x轴上定出xD、xF、xw的点,y3
并通过这三点作垂线(chuíxiàn)定出对
角线上的点a、f、b;
化工原理:10_3双组分连续精馏的计算

L L D
xn
D L D
xD
令 R L ——回流比 D
yn1
R R 1 xn
xD R 1
——精馏段操作线方程
3
返回
精馏段操作线:
y
当R, xD为一定值时,该操 作线为一直线.
斜率: R L
xD
R 1 V
R 1
截距:
xD R 1
操作线为过点(xD, xD )
画操作线过程如下:
4
xD x 返回
10-10 提馏段操作线方程
F( iV-iF)=(L’-L)(iV-iL) 令:
iV iF L' L iV iL F
q iv iF
每千摩尔进料从进料状况变成饱和蒸汽所需的热量
iv iL
原料的千摩尔汽化潜热
q——进料热状况参数
q L L L L qF F V V (1 q)F
9
返回
F
L
VF
L
V
F
14
其他条件不变,q值变化 只会影响提馏段操作线, 精馏段不变。
返回
提馏段操作线求法
1、公式法:
y
L' V'
x
W V'
xw
或
y L qF x WxW L qF W L qF W
2、两点法:
y R x xD R 1 R 1
y q x xF q 1 q 1
x xd y yd
特殊情况:
7
返回
1、加料板的物料衡算
物料恒算:F+V’+L=V+L’ V V ' F (L' L)
或 (L' L) F (V V ')
化工原理 精馏 图例

' v F v L
精馏操作线方程例题1
全塔物料衡算例的溶液中,若进料为饱 和液体,选用的回流比R=2.0,试求提馏 段操作线方程式,并说明操作线的斜率 和截距的数值。
精馏操作线方程例题2
在一连续操作的精馏塔中分离苯-甲苯溶 液,其平均相对挥发度为α =2.46。进料流量 为250Kmol/h,其中苯的摩尔分率为0.4。馏出 液流量为100Kmol/h,其中苯的摩尔分数为 0.97。试计算:①塔顶第一层理论板下降的液 体组成;②精馏段每层塔板下降的液体流量为 200Kmol/h时,塔顶第二层理论塔板的上升蒸 汽组成;③若为冷液进料,进料热状况参数 q=1.2,提馏段每层塔板上升蒸汽的流量和塔 釜的气相回流比;④提馏操作线方程;⑤塔釜 上一层塔板的下降液体组成。
原料液的进料热状况
原料液可有五种进料热状况: ⑴低于泡点的冷液进料(q>1); ⑵泡点温度下的饱和液体进料(q=1); ⑶泡点和露点之间的气液混合物进料(0<q <1); ⑷露点下的饱和蒸汽进料(q=0); ⑸高于露点的过热蒸汽进料(q<0).
不同进料对精馏塔两段操作的 影响
定性分析如上页各图. 定量讨论用进料热状况参数q. I I 数值计算式:q= I I L F L 物理意义:原料加热成板上气相所需焓 差与加料板处汽化潜热之比。
⑵最小回流比—两操作线交点位于平衡线 上,理论塔板层数无穷.
全回流最少塔板数计算公式芬斯克公式
最小回流比解析计算公式
适宜回流比
应综合考察回流比对精馏总费用的影响 情况,以成本最低为宜—理论上.
实际取最小回流比的1.1~2.0倍.
回流比计算例
对正戊烷-正己烷混合液连续精馏,其 xF=0.4,xD=0.98(均为摩尔分率),已 知平均相对挥发度α=2.92,计算如下三 种进料情况下的最小回流比:①冷液进 料(=1.22);②饱和液体进料;③气液 混合物进料,原料温度为55℃。
精馏操作线方程例题1
全塔物料衡算例的溶液中,若进料为饱 和液体,选用的回流比R=2.0,试求提馏 段操作线方程式,并说明操作线的斜率 和截距的数值。
精馏操作线方程例题2
在一连续操作的精馏塔中分离苯-甲苯溶 液,其平均相对挥发度为α =2.46。进料流量 为250Kmol/h,其中苯的摩尔分率为0.4。馏出 液流量为100Kmol/h,其中苯的摩尔分数为 0.97。试计算:①塔顶第一层理论板下降的液 体组成;②精馏段每层塔板下降的液体流量为 200Kmol/h时,塔顶第二层理论塔板的上升蒸 汽组成;③若为冷液进料,进料热状况参数 q=1.2,提馏段每层塔板上升蒸汽的流量和塔 釜的气相回流比;④提馏操作线方程;⑤塔釜 上一层塔板的下降液体组成。
原料液的进料热状况
原料液可有五种进料热状况: ⑴低于泡点的冷液进料(q>1); ⑵泡点温度下的饱和液体进料(q=1); ⑶泡点和露点之间的气液混合物进料(0<q <1); ⑷露点下的饱和蒸汽进料(q=0); ⑸高于露点的过热蒸汽进料(q<0).
不同进料对精馏塔两段操作的 影响
定性分析如上页各图. 定量讨论用进料热状况参数q. I I 数值计算式:q= I I L F L 物理意义:原料加热成板上气相所需焓 差与加料板处汽化潜热之比。
⑵最小回流比—两操作线交点位于平衡线 上,理论塔板层数无穷.
全回流最少塔板数计算公式芬斯克公式
最小回流比解析计算公式
适宜回流比
应综合考察回流比对精馏总费用的影响 情况,以成本最低为宜—理论上.
实际取最小回流比的1.1~2.0倍.
回流比计算例
对正戊烷-正己烷混合液连续精馏,其 xF=0.4,xD=0.98(均为摩尔分率),已 知平均相对挥发度α=2.92,计算如下三 种进料情况下的最小回流比:①冷液进 料(=1.22);②饱和液体进料;③气液 混合物进料,原料温度为55℃。
化工原理精馏PPT课件全

用饱和蒸气压表示的气液平衡关系
2)用相对挥发度表示 ☆挥发度定义
某组分在气相中的平衡分压与该组分在液相中
的摩尔分率之比
挥发度意义
vi
pi xi
某组分由液相挥发到气相中的趋势,是该组分 挥发性大小的标志
双组分理想溶液
vA
pA xA
pAo xA xA
pAo
vB
pB xB
pBo xB xB
pBo
☆相对挥发度定义
pA pyA
pB pyB p(1 yA )
p
o A
xA
pyA
yA
p
o A
xA
p
pBo xB pyB
yB
pBo xB p
yA
p
o A
x
A
p
xA
p pBo pAo pBo
yA
pAo p
p pBo pAo pBo
xA
p pBo pAo pBo
,
yA
pAo p
p pBo pAo pBo
解 (1)利用拉乌尔定律计算气液平衡数据
xA
p pBo pAo pBo
yA
p
o A
x
A
p
t/℃ x y
80.1 84 88 92 96 100 104 108 110.8 1.000 0.822 0.639 0.508 0.376 0.256 0.155 0.058 0.000 1.000 0.922 0.819 0.720 0.595 0.453 0.305 0.127 0.000
xF,y,x---原料液、气相、液相产品的组成,摩尔分数
y
1
F D
x
化工原理蒸馏PPT课件

1
16
1. 利用饱和蒸气压计算气液平衡关系
在 一 定 的 压 力 下t fx
t gy
? 理想物系
在 一 定 的 温 度 下pAf x 理想物系 pBgx
p
A
pB
ห้องสมุดไป่ตู้
p
0 A
x
A
p
0 B
x
B
拉乌尔定律
理 想 物 系 的 t - x ( y ) 相 平 衡 关 系 :
对 理 想 物 系 , 汽 相 满 足 : P p A p B p0 AxpB 0(1x)
vA
pA xA
vB
pB xB
显 然 对 理 想 溶 液 , 根 据 拉 乌 尔 定 律 有 :
Ap0 A,BpB 0
什 么 是 相 对 挥 发 度 ?
相对挥发度
vA vB
pA pB
xA xB
yA yB
xA xB
显然对理想溶液,有:
p
0 A
p
0 B
y x 1( 1)x
8
液体混合物的蒸气压
10
§6.2 双组分溶液的气液相平衡
二元物系汽液相平衡时,所涉及的变量有:
温度t、压力P、汽相组成y、液相组成x等4个。
t, P, y
A
B
f C 2 2 2 2 2 t, x
溶 液 ( A+B)
加热
11
§6.2 二元物系的汽液相平衡
P 一定
B
露点线 汽相区
t-y
t 泡点线 两相区
露点线一定在泡点线上方。 杠杆原理: 力力臂 = 常数
t-x
L1
液相区
0
x 或y
化工原理精馏-PPT

Rmin
理想溶液 x D yq
Rmin 1
xD xq
吸收
c
xW xq xF
xD
非理想溶液
Rmin
xD yq yq xq
37
6、3 双组分连续精馏塔得计 算 NT,min
当操作线远离平衡线 NT减少,与对角线重合 时达到 NT,min,一般由图解法求取。若体系为双组 分理想溶液,则可通过解析法计算 (Fenske方程):
–
0 +
6、3 双组分连续精馏塔得计
算 不同q值对操
作线得影响
f
0 < q <1
q值不同改变得
是提馏段得操作线
q=0
方程。当进料组成、q < 0 回流比及分离要求
一定时,q值得减少使
提馏段操作线越来
越靠近平衡线。
xW
吸收
28
q=1
q>1
eHale Waihona Puke xFxD29
6、3 双组分连续精馏塔得计 算6、3、5 NT及加料板位置得确定
一次部分气化和部分冷
凝
t
y1>xF>x1
y1——加热原料液时产 生得第一个 气泡得组成。
x1——经过一次气化后 原料剩下得液体得组成。
11
P=定值
D C B
A
xw x1 xF y1 yF
吸收
大家学习辛苦了,还是要坚持
继续保持安静
6、2 精馏原理
多次得部分气化和部分冷凝
t
y3
冷凝器
y1
xF
分离 器
需 NT及进料板位置均不同。
3)随着进料得 q值逐渐减小,精馏塔所需得 NT 是逐渐增加得。
化工原理第六章(双组分连续精馏的计算与分析)

2019/5/26
L' W ym1 V ' xm V ' xw
提 馏 操 作 线
( xm=xW , ym+1=xW ) 截距=- WxW/V’
2019/5/26
(4)提馏操作线方程的其他表现形式
令: R ' L' ——再沸比 W
【说明】再沸比R’是提馏段内各块塔板下降的液体 量与塔底引出的釜液(馏残液)量之比。
2019/5/26
【解】依题意知 xF=0.84 xD=0.98 xw=0.002 F=235kmol/h
据 F=D+W FxF=DxD+Wxw
∴ 235=D+W 0.84×235=0.98D+0.002W 联立后可解得: D=201.36kmol/h
W=33.64kmol/h 即塔顶采出量为 201.36kmol/h
第六章
蒸馏
第三节 双组分连续精馏的计算与分析 一、全塔物料衡算 二、恒摩尔流的假定 三、精馏塔的进料热状况 四、操作线方程 五、理论塔板数的确定 六、回流比的影响及选择 七、简捷法求理论板层数
2019/5/26
【精馏过程的计算内容】
1、设计型计算 (1)根据精馏塔的塔板层数以 确定塔的高度; (2)适宜的加料位置。 2、操作型计算 (1)确定产品的流量或组成; (2)确定适宜的操作回流比; (3)计算冷凝器、再沸器的热 负荷等。
2019/5/26
三、精馏塔的进料热状况
1、五种进料热状态 ①温度低于泡点的冷液体; ②泡点下的饱和液体; ③温度介于泡点和露点之间的气液混合物; ④露点下的饱和蒸气; ⑤温度高于露点的过热蒸气。
2019/5/26
【结论】进料热状况不同,其温度不同,状态亦不同。
L' W ym1 V ' xm V ' xw
提 馏 操 作 线
( xm=xW , ym+1=xW ) 截距=- WxW/V’
2019/5/26
(4)提馏操作线方程的其他表现形式
令: R ' L' ——再沸比 W
【说明】再沸比R’是提馏段内各块塔板下降的液体 量与塔底引出的釜液(馏残液)量之比。
2019/5/26
【解】依题意知 xF=0.84 xD=0.98 xw=0.002 F=235kmol/h
据 F=D+W FxF=DxD+Wxw
∴ 235=D+W 0.84×235=0.98D+0.002W 联立后可解得: D=201.36kmol/h
W=33.64kmol/h 即塔顶采出量为 201.36kmol/h
第六章
蒸馏
第三节 双组分连续精馏的计算与分析 一、全塔物料衡算 二、恒摩尔流的假定 三、精馏塔的进料热状况 四、操作线方程 五、理论塔板数的确定 六、回流比的影响及选择 七、简捷法求理论板层数
2019/5/26
【精馏过程的计算内容】
1、设计型计算 (1)根据精馏塔的塔板层数以 确定塔的高度; (2)适宜的加料位置。 2、操作型计算 (1)确定产品的流量或组成; (2)确定适宜的操作回流比; (3)计算冷凝器、再沸器的热 负荷等。
2019/5/26
三、精馏塔的进料热状况
1、五种进料热状态 ①温度低于泡点的冷液体; ②泡点下的饱和液体; ③温度介于泡点和露点之间的气液混合物; ④露点下的饱和蒸气; ⑤温度高于露点的过热蒸气。
2019/5/26
【结论】进料热状况不同,其温度不同,状态亦不同。
精馏详细说明

将用上述方法求出的的数据画在同一张图上,就得 到下图。
9.2.1 理想物系的气液相平衡
(4)t~x(或y)关系式
①两端点A与B.端点A代表纯易挥发A组分(x=1),端点B 代表纯难挥发B组分(x=0 )。t A,沸点 t B,沸点 。 ②两线:t~x线为泡点线,泡点与组成有关;t~y线为 露点线,露点与组成y有关。
pA A xA
pB B xB
(6)相对挥发度 和相平衡方程
9.2.1 理想物系的气液相平衡
在蒸馏中表示分离难易程度要用两组分挥发度之比,称为相 对挥发度
A p A / x A y A / x A y A / y B y /(1 y ) B pB / xB y B / xB x A / xB x /(1 x)
9.1蒸馏概述
⑵工业蒸馏过程
②简单蒸馏 简单蒸馏为间歇操作过程,其流程如下图。
9.1蒸馏概述
⑶讨论几个问题
①平衡蒸馏及简单蒸馏产生的汽液相其组成服从什么关系?此 外,蒸馏时各股物料和各组分还应满足另一种关系,是什么
关系?
②平衡蒸馏和简单蒸馏能否实现高纯度的分离,为什么? ③如何蒸馏可得到高纯度的产品?
0
9.2.1 理想物系的气液相平衡
(6)相对挥发度 和相平衡方程 即理想溶液的 值仅依赖于各纯组分的性质。纯组分的饱
和蒸汽压pA0、 pB0均系温度t的函数,且随温度的升高而加大,
o o 因此 原则上随温度(也即随x)而变化。但 pA / pB 与温度的关
系较或单独与温度的关系小得多,因而可在操作的温度范围内取 一平均的相对挥发度 并将其视为常数,这样利用相平衡方程 数的理想溶液好用。 那么怎么取 的平均值呢?(P74-75两种取法) 就可方便地算出y~x平衡关系。换句话说相平衡方程仅对为 常
9.2.1 理想物系的气液相平衡
(4)t~x(或y)关系式
①两端点A与B.端点A代表纯易挥发A组分(x=1),端点B 代表纯难挥发B组分(x=0 )。t A,沸点 t B,沸点 。 ②两线:t~x线为泡点线,泡点与组成有关;t~y线为 露点线,露点与组成y有关。
pA A xA
pB B xB
(6)相对挥发度 和相平衡方程
9.2.1 理想物系的气液相平衡
在蒸馏中表示分离难易程度要用两组分挥发度之比,称为相 对挥发度
A p A / x A y A / x A y A / y B y /(1 y ) B pB / xB y B / xB x A / xB x /(1 x)
9.1蒸馏概述
⑵工业蒸馏过程
②简单蒸馏 简单蒸馏为间歇操作过程,其流程如下图。
9.1蒸馏概述
⑶讨论几个问题
①平衡蒸馏及简单蒸馏产生的汽液相其组成服从什么关系?此 外,蒸馏时各股物料和各组分还应满足另一种关系,是什么
关系?
②平衡蒸馏和简单蒸馏能否实现高纯度的分离,为什么? ③如何蒸馏可得到高纯度的产品?
0
9.2.1 理想物系的气液相平衡
(6)相对挥发度 和相平衡方程 即理想溶液的 值仅依赖于各纯组分的性质。纯组分的饱
和蒸汽压pA0、 pB0均系温度t的函数,且随温度的升高而加大,
o o 因此 原则上随温度(也即随x)而变化。但 pA / pB 与温度的关
系较或单独与温度的关系小得多,因而可在操作的温度范围内取 一平均的相对挥发度 并将其视为常数,这样利用相平衡方程 数的理想溶液好用。 那么怎么取 的平均值呢?(P74-75两种取法) 就可方便地算出y~x平衡关系。换句话说相平衡方程仅对为 常
蒸馏操作技术—精馏计算(化工原理课件)

总物料衡算
L’ = V’ + W
易挥发组分衡算 L’x’m =V’y’m+1+WxW 整理得整理得:
ym 1
L L W
xm
W L W
xW
为方便起见省去下标,可变化为:
y L x W x L W L W
提馏段下降液 体的摩尔流量 第m层塔 板下降液 体的组成
N
L,xb
第m+1层塔板上 升蒸汽的组成
方程式中y与x的关系是一条直线,称为
精馏段操作线。
精馏段操作线方程
是对精馏段做局部物料衡算 得出的结论
它反映了精馏段内任意相邻的两 层塔板之间的气液相组成关系
对精馏计算有重要意义
精馏段操作线的斜率是什么?
化工原理
下降液相组成xn
精馏塔提馏段
下一层板上升蒸汽组成yn+1
N L,xb
V,y'w
特点
L 斜率为 L W
截距为 W L W
与对角线相交,交点坐标 (Xw,Xw)
提馏段操作线方程
对提馏段做局部物料衡算得 出的结论
它反映了提馏段内任意相邻的两 层塔板之间的气液相组成关系
对精馏计算有重要意义
提馏段操作线的斜率是什么?
化工原理
先确定理论板层数N理
工程上确定 塔板数的方法
再求实际塔板数N实
lg
(1
xD xD
)(1
xW xW
lg m
)
1
方
程
全回流时的最少理论 全塔平均相对挥发度,一般可取塔
板数,不包括再沸器
顶、塔底或塔顶、塔底、进料的平均值
全回流
装置开工阶 段为迅速建 立塔内正常
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
非理想物系的最小回流比(b)
最小回流比:对规定的分离要求,特定的加料组成与加 料热状态,平衡线已定的情况下,回流比从无穷大减小的过 程中,首次出现挟紧点时的回流比。 最小回流比的特点:完成分离要求所需理论板数为无穷大。
影响最小回流比的因素:分离要求、物系的汽液相平衡、 加料热状况
2. 经济优化——存在最优回流比
q↓即进料前原料经过预热和部分汽化 提馏段 L / V (V W ) / V
结论:
V 不变,q ↓,塔板数减小,
L / V 不变
1.0
q减 小
a
这是以增加热耗为代价的。
QF QB QD QW QC
y
f c
x V 不变,q↓对塔板数的影响
0 xW
xF
xD1.0
三、加料状态的选择依据
R (1.1 ~ 2.0) Rmin
近年,由于能源紧张,其倍数有降低的趋势,甚至 可小至1.05倍。
四.理论塔板数的捷算法
1. 思路 将已有的实验数据以 N N
2.Gilliland关联图 吉利兰关联图的依据:
N N min N 1
N 1
对
R Rmin R 1
作图。
8种物系在广泛的精馏条件下,由 逐板计算得到的结果:组分数目2~11, 加料热状况包括过冷至过热等5种情况, Rmin为0.53~7.0;组分间的相对挥发 度为1.26~4.05;理论板层数为 2.4~43.1。
( xA / xB )D 1 ( yA / yB )2
( yA / yB )2 2 ( xA / xB )2
W
( xA / xB ) D 12 ( xA / xB )2
xW
全回流精馏流程
( xA / xB )D 123
…
N 1 N ( xA / xB )W
( xA / xB )D 123
xD=y1 y2 y3
(1)
(2)
(3)
xm<xq (3) ym ym+1 ym+2 xm+1 xm+2
… …
xn<xW yn
…
使用相平衡方程的总次数,就是总理论板数。 冷凝器类型 塔板数 塔顶为全凝器 n(包括塔釜) n-1(不包括塔釜)
塔顶为分凝器
n-1(包括塔釜) n-2(不包括塔釜)
三、图解法
9.5双组分精馏的设计型计算
9.5.1理论板数的计算 9.5.2 9.5.3
回流比的选择
进料热状况的选择
9.5.4双组分精馏过程的其他类型
用精馏方法分离乙烯-乙烷(常压泡点分别为-88.6℃, -103.7℃)混合物。
已知xF=0.78(指乙烯的摩尔分数,下同)。要求:
xD 0.996
R↑
L / V ( R 1) / R
R V / W R ↑
(L/V)↑ 操作线远 离平衡线
L /V
↓
操作线远 离平衡线
1.0 q
y
1.0
a
a q
R↑ f c
y
f R↑ c
xD1.0
x R增大时精馏段操作线的变化规律
0 xW
xF
x R增大时提馏段操作线的变化规律
0 xW
xF
xD1.0
1. 一般而言,在热耗不变的情况下 热量应尽可能在塔底输入 冷量应尽可能施加于塔顶
2. 前道工序的来料状态就是进料状态 3. 工业上有时采用热态甚至汽态进料的原因
减少塔釜的加热量。尤其是塔釜温度过高,物料易 产生聚合或结焦的情况。
9.5.4双组分精馏过程的其他类型
一、直接蒸汽加热
操作前提: 1、物料中有水 2、水是重组分,从塔釜出去
xW 0.0035
试设计一板式精馏塔来完成上述设计任务。
目标:确定塔板类型、实际塔板数、塔径和塔板结构设计 要选择的变量:操作压力、回流比、加料热状态。
9.5.1理论板数的计算
一、设计型计算的命题 根据规定的分离要求,选择精馏的操作条件, 计算所需的理论板数。
规定分离要求:对塔顶、塔底产品的质量和数 量(产率或回收率)提出一定的要求,即在D、W、 xD、xW、η中规定任意2个条件。
理论板数N
结论: R↑,塔板数下降,设 备费用降低。
Rmin 回流比R 回流比与理论板数的关系
Nmin
总费用
② 最适宜回流比 最适宜回流比应通过经 济衡算来决定,即按照操作 费用与设备折旧费用之和为 最小的原则来确定
设备费用
费用
操作费用 Ropt 回流比R 最适宜回流比的选择
三.适宜回流比的选择 通常适宜回流比可取最小回流比的(1.1~2.0)倍,即
二、逐板计算法 先考虑操作压力、回流比、加料热状态均 已知时理论板数的计算。 假设塔顶冷凝器为全凝器,泡点回流,塔釜 为间接蒸汽加热。 1.计算依据 相平衡方程: yn f ( xn ) 理想溶液 精馏段操作方程: 提馏段操作方程:
yn
xn yn (1) ( 1) y n
Rmin
x y 1 ( 1) x
xD ye ye xe
xe、ye
1.0
a q e f c
ye
xF q y x q 1 q 1
y
泡点进料 q=1,xe=xF 露点进料 q=0,ye=xF
x 理想溶液的最小回流比
0 xW
xe x F
xD1.0
xF ye 1 ( 1) xF
N N min N 1
R Rmin 0.5667 0.751 R 1
适用条件:
R Rmin 0.1 0.5 R 1
9.5.3 进料热状况的选择
讨论前提:处理量F、xF及分离要求xD、xW不变
1.0 2 1 a
y
3
4 c 0 xW
d
q线
xq x F x
理论板数图解
x D 1.0
四、最优加料位置的确定
1. 加料位置的体现? 图解法中,更换操作线; 逐板计算法中更换精馏段操作方程。 2. 设计型计算时加料位置的改变 会不会影响操作线的位置? 不会。 3. 加料位置是否可任选? 不能,必须在pm之间。
② 芬斯克(Fenske)方程法
y1 1 y2 x1 2 x2 N-1 y N xD
待分离物系:理想溶液
相平衡方程 操作方程 自塔顶开始计算
( xA / xB )D ( yA / yB )1
( yA / yB )1 1 ( xA / xB )1 ( yA / yB )n n ( xA / xB )n
1、绘对角线 2、绘相平衡曲线 3、绘精馏段操作线 4、绘提馏段操作线 5、绘直角梯级 从a点开 始,在精馏段操作线与平衡 线之间作水平线及垂直线, 当梯级首次跨过d点时,则改 在提馏段操作线与平衡线之 间作直角梯级,直至梯级的 水平线达到或跨过c点为止。 其中过d点的梯级为加料板, 最后一个梯级为再沸器。
令
N 1 2 N
N 1 N ( xA / xB )W
x A x B log x x B D A W N min (包括塔釜) log x D 1 xW log[( )( )] 1 xD xW (包括塔釜) 二元精馏 N min log
① 理想溶液
两操作线的交点只能落在ef线段上 R=∞ 交点为e时
1.0
a q e f c
ye
交点为f时 R=Rmin
恒浓区:在e点上下塔板无增浓 作用,所以此区称为恒浓区(或称挟 紧区), e点称为挟紧点
0 xW
y
x 理想溶液的最小回流比
xe x F
xD1.0
xD ye Rmin Rmin 1 xD xe
一、R不变时q对过程的影响
q↓即进料前原料经过预热和部分汽化 结论:R不变,q ↓,塔板数增加
1.0
q减 小
a
QF QB QD QW QC
总结论:在总供热量不变的 情况下,热量尽可能自塔低输入。
y
f c
x R不变,q↓对塔板数的影响
0 xW
xF
xD1.0
二、 V 不变时q对过程的影响
③ 两板之间任一截面上,上升蒸汽组成yn+1与下降液体组成xn 相等
④全回流时操作线和平衡线的距离最远,因此达到指定分离 程度所需的理论板数最少,以Nmin表示。
2. 最少理论板数Nmin的求法
① 图解法。
1.0
y
0 xW
x
xD1.0
图解法求全回流时的理论板数
该法繁琐,但对理想溶液和非理想溶液均适用。
yn1 xn
W
xW
全回流精馏流程
( xA / xB )D 1 ( xA / xB )1
yA xA ( )n n ( )n yB xB
yn1 xn
y1 1 y2 x1 2 x2 N-1 y N xD
( xA / xB )D 1 ( xA / xB )1
( xA / xB )1 ( yA / yB )2
R 1 xn xD R 1 R 1
L W x n xW V V
(2) (3)
yn
精馏段与提馏段交点坐标 ( xq,y q )
yn xn ( 1) y n R 1 yn xn xD R 1 R 1
L W y n x n xW V V x1 x2 x3 … (1) (2)
Rmin
0 xW xq xF xe xD1.0 x x 非理想物系的最小回流比 (a)
xD ye ye xe
1.0
