前列腺素E2合酶的研究进展
前列腺素受体4与肾脏疾病相关性研究进展

· 54 ·熊梦瑶 贾英丽 杨宝学天然药物及仿生药物国家重点实验室,北京大学基础医学院药理学系,北京,100191,中国【摘要】 前列腺素受体4(prostaglandin receptor 4,EP4)是内源性脂质介质前列腺素E2(prostaglandin E2,PGE2)的作用受体,属G-蛋白偶联受体(G protein coupled receptor ,GPCR )的一种。
EP4在体内分布广泛,几乎在所有组织、脏器表达。
在肾脏,肾小球旁颗粒细胞、肾小球上皮细胞、远曲小管和皮质集合管上皮细胞均有EP4的高度表达。
因EP4可同时与Gs 、Gi 蛋白途径偶联,与血管张力、氧化应激、炎症、细胞增殖等生理功能和病理生理过程密切相关。
目前通过对全身性及肾组织特异性EP4敲除小鼠模型的研究和选择性EP4激动剂/拮抗剂的作用研究,证明EP4在肾脏发挥重要作用,其PGE2-EP4信号通路同时能产生保护和不良的影响。
该文将EP4与肾脏疾病,包括肾性高血压、肾缺血/再灌注损伤、肾源性尿崩症、肾小球肾炎、肾小球硬化、慢性肾脏病及常染色体显性遗传性多囊肾病发生发展的相关性进行分析和总结。
【关键词】 前列腺素受体4;EP4-Gs 激动剂/拮抗剂;EP4-Gi 激动剂/拮抗剂;肾脏疾病【中图分类号】 R 363 【文献标识码】 A DOI :10.3969/j.issn.2095-1396.2020.03.010Relationship between Prostaglandin Receptor EP4 and Renal DiseasesXIONG Meng-yao ,JIA Ying-li ,YANG Bao-xueState Key Laboratory of Natural and Biomimetic Drugs &Department of Pharmacology ,School of Basic Medical Sciences ,Peking University ,Beijing ,100191,China【ABSTRACT 】 Prostaglandin receptor 4 (EP4) is the receptor of endogenous lipid medium prostaglandin E2 (PGE2) ,belongs to the G protein coupled receptor (GPCR ) . EP4 is widely distributed in almost all tissues and organs in the body. In the kidney ,there is high expression in the glomerular granulosa cells and epithelial cells ,distal convoluted tubules and cortical collecting tubular cells. Because EP4 can be coupled with the Gs ,Gi protein pathways at the same time ,it is closely related to the physiological functions and pathophysiological processes ,such as vascular tone ,oxidative stress ,inflammation ,cell proliferation. Studies on systemic and renal specific EP4 knockout mice and the development of selective EP4 agonist/antagonist proved EP4 receptors play a key role in the kidney ,the PGE2-EP4 signaling pathway can produce protective and adverse effects at the same time. This review article analyzes and summarizes the association of EP4 receptor in renal diseases ,including renal hypertension ,renal ischemia/reperfusion injury ,nephrogenic diabetes insipidus ,glomerulonephritis ,glomerulosclerosis ,chronic kidney disease and autosomal dominant polycystic kidney disease. 【KEY WORDS 】 prostaglandin receptor 4;Gs ;Gi ;EP4 agonist/antagonist ;kidney related diseases前列腺素受体4与肾脏疾病相关性研究进展基金项目:国家自然科学基金项目(No. 81620108029、No. 81974083)作者简介:熊梦瑶,博士研究生;研究方向:肾脏药理学;E-mail:********************通讯作者:杨宝学,教授;研究方向:肾脏药理学;E-mail:***************.cn前列腺素受体4(prostaglandin receptor 4,EP4)是细胞表面七次跨膜受体的亚家族,属G-蛋白偶联受体(G protein-coupled receptor,GPCR)的一种,是内源性脂质介质前列腺素E2(prostaglandin E2,PGE2)的特异性受体之一。
COX2-PGE2调节肿瘤的发生和发展机制研究进展

COX2-PGE2调节肿瘤的发生和发展机制研究进展张翅腾;王毅【摘要】前列腺素E2(prostaglandin E2,PGE2)是体内的一种花生四烯酸代谢产物,它与机体的发热、炎症反应和细胞生长及分化等生理活动密切相关.环氧化酶2(Cyclooxygenase 2,COX2)是PGE2合成的主要限速酶,主要在细胞因子、生长因子等促炎症因素作用下产生.近年来的一些研究发现COX2-PGE2信号通路与多种类型的肿瘤细胞的增殖和转移有关,然而,其具体机制尚未完全清楚,目前的研究提示其在不同的肿瘤细胞中可能具有不同的作用机制.针对COX2-PGE2通路调节肿瘤细胞生长的机制的研究对深入了解肿瘤的发生和发展具有重要的意义,并有望为抗肿瘤药物的研发提供一个新靶点.【期刊名称】《西南军医》【年(卷),期】2018(020)001【总页数】4页(P50-53)【关键词】前列腺素E2;肿瘤;环氧合酶2【作者】张翅腾;王毅【作者单位】421000 湖南衡阳,南华大学附属第二医院泌尿外科;421000 湖南衡阳,南华大学附属第二医院泌尿外科【正文语种】中文【中图分类】R73.34恶性肿瘤是21世纪威胁人类健康最重要的因素之一,每年至少有800万人死于恶性肿瘤。
预计在下一个20年内,全球每年新发癌症病例数将由2012年的1400万上升到2200万。
正因如此,恶性肿瘤的发生与治疗也成为了本世纪医学研究最热门的课题之一。
随着肿瘤发病机制研究的深入以及临床治疗方案的不断改进,人类已经在肿瘤的预防和治疗方面取得了很大的进步。
但是目前临床普遍应用的肿瘤治疗方案,包括各类手术切除、放疗和/或化疗等的疗效都在很大程度上依赖肿瘤的早期诊断。
然而,在实际临床工作中,大多数癌症患者就诊时已经处于肿瘤的中晚期,目前所用的常规治疗方案只能维持较短的生存期限(一般小于5年)。
因此,我们迫切的需要进一步明确肿瘤发生及发展的相关机制,并研发出更为有效的抗肿瘤药物。
心血管疾病中前列腺素E2的防治作用研究

心血管疾病中前列腺素E2的防治作用研究随着年龄的增长,人体的生理机能逐渐弱化,导致多种疾病的发生,其中心血管疾病是影响人类健康的主要疾病之一。
心血管疾病的多种形式包括心绞痛、心肌梗死、高血压和血管瘤等。
虽然我们有了许多预防措施,例如改善饮食习惯、适度运动、戒烟等,但这些措施并不能一劳永逸地解决问题,还需要通过药物治疗来控制疾病的发展。
在心血管疾病的治疗过程中,前列腺素E2可以发挥重要的作用。
前列腺素E2,简称PGE2,是一种型号相对简单的化合物,是前列腺素家族中的一员。
前列腺素家族成员包括PGE、PGD、PGF、PGI和TX等,其中PGE2是其中最为重要的成员之一。
PGE2具有广泛的生理功能,包括调节通风和血流、控制炎症以及斑块形成和微血管增生。
研究表明,PGE2具有对心血管疾病的预防和治疗作用。
近年来,越来越多的研究表明,前列腺素E2可以改善心血管疾病的发展。
在实验研究中,PGE2被发现有多种抗炎作用。
PGE2可以调节多种信号通路,通过影响白细胞的活性,从而降低血管壁的炎症反应。
血管壁的炎症反应是心血管系统疾病的重要病理基础。
另外,PGE2还可以影响血小板的活性和凝血过程,从而减少血栓的形成。
这些研究结果表明,通过改善血管的炎症反应和减少血栓的形成,PGE2可以预防和缓解心血管疾病。
此外,最近的实验室研究表明,PGE2还可以影响内皮细胞和血管平滑肌细胞的生长,促进血管的修复和重建。
在血管损伤后,PGE2可以促进内皮细胞和平滑肌细胞的增殖,从而促进血管修复。
同时,PGE2还可以通过增加内皮细胞的血管活性物质,例如一氧化氮和血管紧张素转化酶等,从而促进血管扩张和血流的增加。
这些研究结果表明,PGE2可以通过促进血管修复和增加血流,为血管疾病的治疗提供新方向。
除了研究PGE2自身对心血管疾病的作用外,也有研究人员探索了PGE2与其他药物的联合作用。
例如,一些研究人员发现,将PGE2和一些抗心血管疾病的药物结合使用,可以提高治疗的效果。
前列腺素E2在癌症发生发展中的研究进展

近三十年以来,癌症发病率以年均 3% ~5%的 速度递增;3/4新 增 病 例 发 生 在 新 兴 工 业 国 家 及 发 展中国家,癌症已成为人类第一位死因。目前,我国 每年新发肿瘤病例约 312万例,平均每天 8550余 人,全国每分钟有 6人被诊断为癌症。我国癌症发 病呈现年轻化趋势,包括乳腺癌、肺癌、结肠癌、甲状 腺癌等。流行病学资料显示近 25%的癌症死亡与 持续性感染及继而发生的慢性炎症相关。在肿瘤微 环境中,多数肿瘤均含有大量的炎性细胞及其分泌 的炎性因子,这些细胞和炎性因子的存在与多种肿 瘤的不良临床预后相关。在各种炎性介质中,前列 腺素 E2及其相关代谢酶类在多种肿瘤微环境中的 升高,提示前列腺素 E2与这些肿瘤的发生、发展密 切相关。
图 1 前列腺素 E2的代谢过程[1] COX:环氧合酶,cPLA2:胞浆磷脂酶 A2,sPLA2:可溶性磷脂酶 A2,mPGES:微粒体前列腺素 E合酶,cPGES:胞浆前列腺素 E合 酶,15PGDH:15羟基前列腺素脱氢酶
国家自然科学基金(81603119);北京市重点学科基础医学 学科 建 设 项 目 (BMU20110254);北 京 市 自 然 科 学 基 金 (7162099), 深 圳 市 科 技 项 目 资 助 项 目 (JCYJ20150403110829615)资助课题
生理科学进展 2018年第 49卷第 1期
·53·
前列腺素 E2在癌症发生发展中的研究进展
蒋彩虹1,2 高子蕊1 郭丽凯1 章琳琪1 范天睿1 王月丹1,△ 初 明1,△
(1北京大学医学部基础医学院,北京 100191;2新疆石河子大学食品学院,石河子 832003)
摘要 环氧合酶 2、微粒体前列腺素 E合酶 1催化产生的前列腺素 E2在肿瘤的发展过程中具有重 要作用。COX2/PEG2途径的失调通过多种机制影响癌症的发生和发展。如促进肿瘤细胞的增殖 和存活、抗凋亡,在肿瘤微环境中,前列腺素 E2的升高促进血管再生、肿瘤细胞的粘附和迁移,促 进癌症的转移。因此,研发在前列腺素 E2合成过程中关键酶的抑制剂是治疗前列腺素 E2相关癌 症的策略之一。 关键词 前列腺素 E2;癌症 中图分类号 R73;Q493
铝碳酸镁对大鼠胃黏膜前列腺素E2水平及环氧合酶-2表达的影响研究

立 胃黏膜损伤模 型 , 进 而测定 胃黏膜 P G E 、 环氧合酶 ( c o x ) . 2 蛋白、 C O X . 2 m R N A水平 ,评价 铝碳 酸镁 对乙醇诱导 胃黏膜 损伤 的保 护作 用 , 旨在 明确 铝碳 酸镁 的 胃黏膜保护与 C O X 一 2
国药物 与l 临 床2 0 1 3 年6 月第 1 3 卷第 6 期 C h i n e s e R e m 堕鱼 i n i c s 』 盟 Q ! ! : ! :
・
73 3 ・
铝碳酸镁对大 鼠胃黏膜前 列腺素 E 2 水 平 及环 氧合 酶一 2表达 的影响研 究
定 胃黏膜 P G E 的酶联免 疫吸 附试 验 ( E L I S A) 试 剂盒 由美 国 A L D公 司生产 。铝碳酸镁 由拜耳 医药保健有 限公司生产 提
编程 直接得 出其浓 度。黏 膜组织 P G E 含量需 用其蛋 白浓度
加以校正 。 1 . 2 . 4 C O X . 1和 C O X . 2在 胃黏膜 中表达测定 :取材方法 同 上, 中性 甲醛 固定 石蜡包埋 . 每 只大 鼠胃黏膜 随机切取 2张
供。兔抗 C O X . 1 多克隆抗体 ( B A 0 7 3 8 ) 及兔抗 C O X . 2多克 隆 抗体 ( B A 0 7 3 8 ) 均购 自博士德生物工程有 限公 司; 即用型辣 根 过氧 化物酶 ( H R P ) 标记 羊抗兔 I g G亲和性纯 化抗体 购 自上
海长岛生物技术有限公 司; 二氨基联苯胺 ( D A B ) 染色试剂 盒 购 自华美 生物工程公 司; 牛血浆 白蛋 白( B S A) 购 自上海伯 奥 生物科技有限公司。 T r i z o l 试剂盒为 G i b c o 公 司产 品。 逆转 录
PGE2/EP信号通路在肺部疾病中作用的研究进展

管系统及维持水盐内环境稳态中起重要作用。近年来,越来越多的研究 表 明 PGE2/EP 信 号 通 路
在慢性阻塞性肺疾病中发挥着 重 要 作 用, 且 其 在 哮 喘、 肺 癌 以 及 急 性 肺 损 伤 中 可 能 均 起 到 一 定
的作用。本文将对 PGE2/EP 信号通路在各种肺部疾病中的作用进行综述。
Re
s
e
a
r
chp
r
o
r
e
s
sonr
o
l
eo
fp
r
o
s
t
a
l
and
i
nE2 p
r
o
s
t
a
c
c
l
i
nr
e
c
ep
t
o
rs
i
l
i
ngpa
t
hwa
nl
ungd
i
s
e
a
s
e
s
g
g
y
gna
yi
ChenJi
an
'an1 LiDe
u1 YuanLi
ang2 YiGao1
f
Depar
tmen
tof Re
spi
ra
t
o
es
t
ud
i
e
shaveshownt
ha
tPGE2 EPs
i
l
i
ngpa
t
hwayp
l
ay
sanimpo
r
t
an
tr
o
l
前列腺素E2受体亚型EP2和EP4的最新研究进展

万方数据临春医学工程2009年7月第16卷第7期3信号传导迄今为止.对于这螳EP受体介导的信号传导机制的研究主要是通过检测激动剂诱导的第二信使如cAMP、Ca“和磷酸肌酸的变化,以及分析激动剂诱导的下游激酶或靶分子的激活实现的。
目前.人们对涉及这4种EP受体亚型的主要信号传导通路已有较深的认识。
EP2和EP4主要是和激活型G蛋白(Gs)偶联,激活后促进细胞内cAMP水平升高,cAMP水平升高激活蛋白激酶A(PKA),其随后激活信号传导通路的下游分子(表1)。
由于EP2和EP4介导的信号传导通路具有一定的相似性.因此二者的生物学功能有时是重叠的。
比如在破骨细胞生成(OStCO-clastogenesis)时。
PGE2无论是与EP2还是与EP4结合都可以通过增加细胞cAMP水平,进而增加核因子KB活化受体配体(recep!oFactivatorofnuclearfactor-KBligand。
RANKL)mRNA的表达.差异仅仅在于两者的激活程度有所不同。
但在有些生理或病理生理过程中.EP2和EP4会发挥不同的作用。
在这些过程中两者功能的差异,有的是由于二者在相关细胞中的选掸性表达造成的,如排卵和着床时卵泡内促卵丘扩展过程中(cumu]u¥expansion)EP2的作用。
以及在动脉导管闭合过程中EP4的作用。
而在有些情况下两者功能差异则与其选择性表达无关,比thEl'2和EP4在树突状细胞中都有表达,但只有EP4参与调节此类细胞的迁移.而EP2对此类细胞的迁移则无明显的调节作用。
这种EP4选择性的功能可能是因为EP4除了和腺苷酸环化酶(adenylylcyclase,AC)的激活相偶联外还和磷脂酸肌醇3一激酶(phosphatidylinositol3一kina∞,P13K)相偶联,这一偶联可能是通过抑制型c蛋白(inhibitoryGprotein,Gi)而非G8实现的㈣。
近年来还有研究显示在肿瘤细胞侵袭过程中,EP4也参与了细胞的迁移.这和EP,在新生小鼠动脉导管闭合川和斑马鱼原胚肠形成中的作用是一致的。
脑复聪对脂多糖激活的小胶质细胞合成环氧合酶-2和分泌前列腺素E2作用的实验研究

2 S t e r n l i e b .P e r s p e c e t i v e s o n Wi l s o n d i s e a s e [ J ] .H e p a t o l o g y , 1 9 9 0 ,
2 0 0 7 , 5 6 ( 1 ): 1 1 5—1 2 0
6
Eu r o p e a n As s o c i a t i o n f o r t he S t u d y o f t h e Li v e r . EAS L c l i n i c a l p r a c t i c e
—
5
Me r l e U, S c h a e  ̄r M, F e r e n c i P, e t a 1 .Cl i n i c a l p r e s e n t a t i o n, d i a g n o s i s
a n d l o n g—t e r m o u t c o me o f Wi l s o n s d i s e a s e : a c o h o r t s t u d y [ J ] .G u t ,
F环不 仅有 助 于 WD的早期 诊 断 , 其分 级 大小 还 可
7
g u i d e l i n e s : Wi l s o n s d i s e a s e [ J ] .J H e p a t o l , 2 0 1 2 , 5 6 ( 3 ): 6 7 1— 6 8 5
1 2 ( 5 ): 1 2 3 4— 1 2 3 9
3 杨 任 民.肝 豆 状 核 变 性 [ M] .合 肥 : 安徽科 学技术 出版社 , 1 9 9 5 :
前列腺素E2代谢的相关基因及其与疾病的关系

前列腺素E2代谢的相关基因及其与疾病的关系前列腺素E2(PGE2)是一种重要的生物活性物质,对于人体生理功能的维持具有重要的作用。
不过,对于PGE2代谢过程中相关基因的研究,以及这些基因与一些疾病之间的关系,还有很多人不是非常了解。
本文将对这方面的内容进行介绍。
1、PGE2的代谢途径前列腺素E2的代谢过程中涉及到多种基因的参与,其中包括芳香氧化酶(CYP450),环氧化酶(COX)和PGE2合成酶(PGES)。
这些基因都会对PGE2代谢途径产生一定的影响。
CYP450属于一类复杂的细胞色素P450酶,能够介导多种内源性和外源性物质的氧化代谢。
它们参与了前列腺素E2合成的第一个关键步骤——花生四烯酸(AA)的环氧化反应。
而COX酶则是PGE2代谢途径的第二个重要步骤。
它能够将AA转化为一系列前列腺素,其中包括流行性感冒病毒所依赖的PGE2。
最后,PGES在PGE2的合成过程中也扮演了重要角色。
它能够催化前列腺素G2的分解,从而形成PGE2,使其具有生物学活性。
2、PGE2代谢相关基因与疾病PGE2代谢相关基因因其参与前列腺素E2合成过程而成为了研究的热点。
而基因的多态性差异也使其成为了一些疾病的重要影响因素。
在心血管疾病方面,肿瘤坏死因子α受体(TNF-αR)是一个重要的基因。
它的多态性会影响到TNF-α信号通路,并最终影响到PGE2的合成和清除。
这也使得其与心血管疾病的发生和发展相关联。
而在肿瘤方面,直肠癌患者中常见的突变的基因包括KRAS和TP53。
研究表明,KRAS突变会增加COX-2产生的PGE2的生产,从而导致癌细胞的生长、增殖和侵袭。
而TP53突变则可以抑制COX-2和PGE2的合成,从而对肿瘤的发生和发展起到了保护作用。
此外,研究还发现,在一些自身免疫性疾病中,例如风湿性关节炎和全身性红斑狼疮等,PGE2的合成也得到了一定的研究。
结果表明,COX-1与COX-2对于维持免疫应答和发炎反应的平衡起到了重要作用。
PGE2、COX-2表达与牙槽骨成骨活性、内氧水平的关系

PGE2、COX-2表达与牙槽骨成骨活性、内氧水平的关系苏娟娟;陈洪婷;王旭;靳强;王琳【期刊名称】《上海口腔医学》【年(卷),期】2024(33)1【摘要】目的:探讨前列腺素E2(prostaglandin E2,PGE2)、环氧合酶2(cyclooxygenase-2,COX-2)表达与牙槽骨成骨活性、内氧水平的关系。
方法:选择2021年3月—2023年3月收治的56例慢性牙周炎且牙槽骨感染的患者为试验(牙周炎)组,同一时段53例健康牙槽骨为对照组。
采用组织块培养法进行成骨细胞培养,采用改良Kaplow碱性磷酸酶(alkaline phosphatase,ALP)染色鉴定细胞,利用ELISA试剂盒检测COX-2、PGE2、破骨细胞抑制因子(osteoclastogenesis inhibitory factor,OPG)和核因子κB受体活化因子配体(receptor activator of nuclear factor-κb ligand,RANKL)等的表达,比较2组患者PGE2、COX-2、OPG、内氧水平、ALP和RANKL的表达水平,并分析其相关性。
采用SPSS 27.0软件包对数据进行统计学分析。
结果:牙周炎组的PGE2、COX-2、RANKL显著高于对照组,而OPG、内氧水平、ALP显著低于对照组(P<0.05)。
PGE2、COX2呈高度正相关,与OPG、内氧水平和ALP呈高度负相关,但与RANKL呈高度正相关(P<0.05)。
结论:PGE2、COX-2表达与ALP、内氧水平呈高度负相关,可考虑通过增加内氧水平,加大氧分压,并通过药物调节ALP水平,改变牙周炎或其他类似疾病的炎症状况。
【总页数】5页(P85-89)【作者】苏娟娟;陈洪婷;王旭;靳强;王琳【作者单位】河南大学第一附属医院口腔科【正文语种】中文【中图分类】R781.4【相关文献】1.2型糖尿病大鼠骨髓间充质干细胞中Dickkopf-1蛋白的表达水平及其与成骨活性的关系2.HPV感染对宫颈COX-2表达及血PGE2表达水平的影响3.人健康和炎性牙槽骨成骨细胞COX-2、PGE2、OPG,RANKL的表达4.2b凝胶联合微波治疗宫颈炎合并HPV感染患者疗效及对宫颈COX-2表达、血PGE2表达水平的影响因版权原因,仅展示原文概要,查看原文内容请购买。
前列腺素E2途径与动脉导管闭合的关系

动 脉导管 是胎 儿时 期肺 动脉 与主动 脉 间正 常交 通 , 于降 主动脉 与左肺 动脉 根部 之间 , 胎儿 循环 位 是 的重要 途径 。正常 小 鼠约在 出生 后 3小 时 闭合 , 人 类 出生后 约 1 0~l 时发 生 功 能性 闭 合 , 月 内 5小 3个 8% 解剖 闭合 ; 出生 后 持 续 开放 则 称 为 动脉 导 管 0 若 未 闭 (a n dcu rr ssP A) 在 先 天 性 心 脏 pt t utsat i u ,D , e eo 病 中 居 于 第 三 位 , 低 体 重 儿 中 发 生 率 高 达 超
。
种亚 型 C X 1和 C X2 O 一 达 定 位 于 内质 O 一 O -。C X 1表
网 和细胞核 膜周 ; O . C X 2主要 定位 于核膜 周 围 , 还可 见于 核 内 J O 一 表 达 不受 诱 导 而保 持 恒 量 , 。C X 1 属
前列腺 素 ( rs gadn ) pot l is 是广 泛 存 在 于动 物 和 a n
前列 腺 素 E (rs gadnE ,G 2 的舒 张作用 维 2 pot lni 2P E ) a 持, 出生 后 P E G 2浓 度 降低 也 是 动 脉 导管 闭合 的 触 发 因素 J 。因此 参 与 P E G 2催 化 作 用 的各 种 酶类 ,
如环 氧酶 ( yl xgn ss C X ) P E c c oy eae , O s 、 G 2合 酶 ( rs o po— t ln i E y tae , G S ) 前 列 腺 素 l 一 基 a a dn 2 snh ss P E s 和 g 5羟 脱 氢 酶 ( H doyrs gadnD h do eae P — 1 ・ y rxpot l i ey rgn s , G 5 a n
环氧合酶2前列腺素E2通路调控口腔肿瘤机制的研究进展

肿瘤是在全球范围内导致死亡的一个主要原因。
其中口咽癌是全球第6大最常见的恶性肿瘤[1],包括口腔癌及下咽癌,据估计口腔癌每年新增病例超过500 000例[2],2/3发生在发展中国家。
中国是口腔肿瘤的高发国家[3],每年新增病例超过11 900例[4]。
口腔肿瘤具有高侵袭性,易发生淋巴结转移[5],也有肺部、心脏等远处器官转移的报道[6-7],导致治疗困难,易复发,5年生存率低于60%[5-9],已经对公共健康构成了严重的威胁[10]。
研究[11]证实,肿瘤的发生、发展及转移与环氧合酶(cyclooxygenase ,COX )-2/前列腺素(prostaglandin ,PG )E 2通路关系密切。
该通路已成为肺癌和结直肠癌等的候选治疗靶点,针对该通路的非甾体类抗炎药(nonsteroidal anti-inflam-matory drug )具有显著的抗肿瘤活性,有望成为预防肿瘤的候选药物[12-14]。
在口腔肿瘤的发生、发展及转移过程中,COX-2/PGE 2通路显著高表[摘要] 口咽癌是全球第6大最常见的恶性肿瘤,5年生存率低于60%,严重影响着人类的健康和生活质量。
口腔肿瘤中环氧合酶2(COX-2)/前列腺素E 2(PGE 2)显著高表达,表明该通路与口腔肿瘤密切相关,是口腔肿瘤重要的调控通路。
研究表明COX-2/PGE 2通路可通过上调表皮生长因子受体促进肿瘤生长、上调内皮生长因子调节血管生成、上调Bcl-2调节凋亡等不同方式调节口腔肿瘤的发生、发展。
本文对该通路在口腔肿瘤中的研究进展进行综述。
[关键词] 环氧合酶2; 口腔肿瘤; 口腔恶性肿瘤; 炎性通路; 癌前病变; 抗肿瘤[中图分类号] R 739.8 [文献标志码] A [doi] 10.7518/gjkq.2020038 Research progress on regulation of cyclooxygenase-2/prostaglandin E 2 pathway on oral cancer Kong Lixin, Ren Biao, Cheng Lei. (State Key Laboratory of Oral Diseases & National Clinical Research Center for Oral Diseases & Dept. of Cariology and Endodontics, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)This study was supported by National Key Research Program of China (2017YFC0840100, 2017YFC0840107).[Abstract] Oral cancer is the sixth most common tumour worldwide. The 5-year survival rate of oral cancer is lower than 60%, and this disease seriously affects human health and quality of life. The cyclooxygenase (COX)-2/prostaglandin (PG) E 2 pathway is significantly elevated in oral tumour tissues. This pathway is thus closely related to oral cancer. The COX-2/PGE 2 pathway can upregulate epidermal growth factor receptor to enhance cancer growth, upregulate vascular endothelial growth factor to promote angiogenesis and upregulate Bcl-2 to induce cancer apoptosis. The COX-2/PGE 2 pathway is one of the most important regulatory pathways in oral cancer. This article will summarise the latest research progress on this pathway in oral cancer.[Key words] cyclooxygenase-2; oral cancer; oral malignant cancer; inflammatory pathway; precancerous lesions; anti-cancer环氧合酶2/前列腺素E 2通路调控口腔肿瘤机制的研究进展孔利心 任彪 程磊口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院牙体牙髓病科 成都 610041开放科学(资源服务)标识码(OSID)[收稿日期] 2019-09-03; [修回日期] 2020-02-09[基金项目] 国家重点研发计划重点专项课题(2017YFC0840100,2017- YFC0840107)[作者简介] 孔利心,住院医师,硕士,Email :****************[通信作者] 程磊,教授,博士,Email :***********************·综述·达,而且研究[15-18]证明该通路可促进口腔肿瘤的生长,抑制细胞凋亡,促进血管生成,增加对化疗药物的耐药等,因此该通路同样是口腔肿瘤中重要的调节通路,也有望成为口腔肿瘤治疗靶点之一。
抗炎药物作用新探

抗炎药物作用新探
静雨
【期刊名称】《国外医学情报》
【年(卷),期】2002(023)012
【摘要】@@ 1982年,英国伦敦William Harvey研究所的John Vane因其非类固醇类抗炎药物的研究成果而荣获诺贝尔奖.在近期《自然》杂志上发表的两项研究结果显示,Vane的假说前列腺素E2(PGE2)通过环氧合酶(cyclo-ox-ygenase)的诱导在周围炎症部位的产生与炎性疼痛的发生有关是不完全的.美国马萨诸塞总医院的Clifford Woolf对此解释说,还有一个重要的中心部分.
【总页数】1页(P33)
【作者】静雨
【作者单位】无
【正文语种】中文
【中图分类】R971.1
【相关文献】
1.抗炎药物作用新靶点的研究进展 [J], 刘巍;王玉丽;徐为人;张士俊
2.抗炎药物作用靶点的研究进展 [J], 刘巍;王玉丽;张士俊;徐为人
3.抗炎镇痛药物作用机制的研究进展 [J], 亢炎;佟继铭
4.非甾体类抗炎药对人牙髓细胞的抗炎修复作用 [J], 李婧宜; 王赛楠; 董艳梅
5.抗炎药的新探索 [J], 李潇
因版权原因,仅展示原文概要,查看原文内容请购买。
前列腺素E2促进损伤肠黏膜修复的研究进展
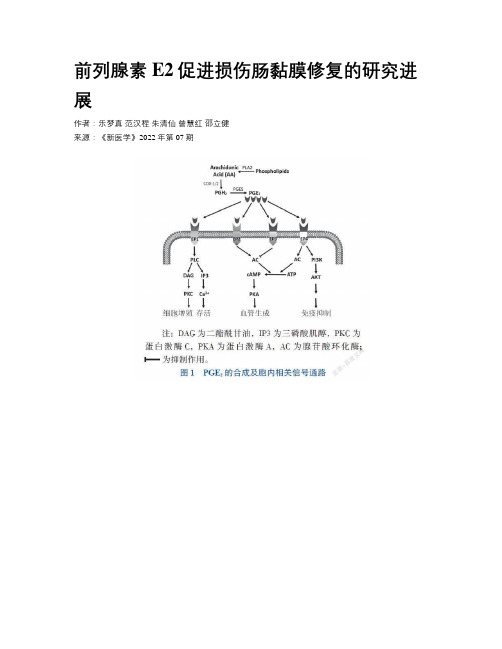
前列腺素E2促进损伤肠黏膜修复的研究进展作者:乐梦真范汉程朱清仙曾慧红邵立健来源:《新医学》2022年第07期【摘要】前列腺素E2(PGE2)是前列腺素E的一种,属于类花生酸类物质,参与机体炎症反应与免疫调节。
正常生理情况下,肠黏膜上皮处于不断自我更新的过程,其自我更新由肠隐窝底部的肠道干细胞(ISC)完成,ISC对维持肠黏膜完整性具有重要意义。
随着PGE2对成体干细胞(包括ISC等)作用的深入研究,发现PGE2不仅参与炎症免疫反应,而且能通过激活Wnt等信号通路促进成体干细胞增殖,从而维持正常组织的新旧更替。
该文主要综述PGE2对肠黏膜损伤的修复作用及其对ISC功能的影响。
【关键词】前列腺素E2;肠黏膜上皮;肠道干细胞;Wnt信号通路;炎症性肠病Research progress on the role of prostaglandin E2 in promoting recovery of intestinal mucosal injury Yue Mengzhen△, Fan Hancheng, Zhu Qingxian, Zeng Huihong, Shao Lijian. △Basic Medical College, Nanchang University, Nanchang 330006, ChinaCorresponding author, Shao Lijian, E-mail:*************.cn【Abstract】 Prostaglandin E2 (PGE2), as a member of prostaglandin E, belongs to eicosanoids. It participates in inflammatory reaction and immune regulation. Under normal physiological conditions, intestinal mucosa undergoes persistent self-renewal. This process is mediated by intestinal stem cells (ISC), which reside in the base of intestinal crypts. ISC play a very important role in maintaining the integrity of intestinal mucosa. Along with in-depth study of therole of PGE2 in adult stem cells (including ISC), PGE2 has been proven to not only participate in inflammatory reaction, but also promote the proliferation of adult stem cells by activating the Wnt signaling pathway, thereby properly maintaining normal intestinal tissue renewal. In this article,the role of PGE2 in the repair of intestinal mucosal injury and the effect upon ISC were mainly reviewed.【Key words】 Prostaglandin E2; Intestinal mucosa; Intestinal stem cell; Wnt signaling pathway; Inflammatory bowel disease肠道黏膜上皮处于不断的再生-凋亡循环,更新周期通常为3~5 d。
ptges3基因

ptges3基因PTGES3基因编码的是一种酶,它在体内发挥着重要的生物功能。
本文将探讨PTGES3基因的结构、功能以及与疾病相关的研究进展。
PTGES3基因位于人类基因组的第1号染色体上,由7个外显子和6个内含子组成。
该基因的编码产物是一种酶,被称为前列腺素E合成酶3(PTGES3),它参与了前列腺素E2(PGE2)的合成过程。
PTGES3酶主要在细胞质中活动,它的主要功能是催化花生四烯酸(AA)转化为PGE2。
PGE2是一种重要的炎症介质,参与了多种生理和病理过程,如炎症反应、细胞增殖和分化、疼痛传导等。
PTGES3酶的活性对于维持正常的生理状态具有重要意义。
PTGES3基因的突变与多种疾病的发生发展密切相关。
研究发现,PTGES3基因的突变与风湿性关节炎、哮喘、肿瘤等疾病的发生有关。
在风湿性关节炎患者中,PTGES3基因的突变导致其编码产物的功能异常,从而引发免疫炎症反应的持续激活。
在哮喘患者中,PTGES3基因的突变可能导致PGE2合成减少,进而影响炎症反应的调节。
此外,PTGES3基因在肿瘤中的异常表达与肿瘤的发生发展也存在一定的关联。
近年来,PTGES3基因在疾病治疗中的潜在作用引起了科学家们的广泛关注。
研究发现,通过抑制PTGES3酶的活性,可以减少PGE2的合成,从而抑制炎症反应的发生。
因此,PTGES3酶被认为是治疗炎症性疾病的潜在靶点。
目前,一些研究正在开展,以探索PTGES3酶抑制剂的疗效和安全性。
PTGES3基因在药物代谢中也起到了一定的作用。
研究发现,PTGES3基因的表达水平可能影响某些药物的代谢过程,从而导致药物疗效的差异。
因此,在个体化药物治疗中,PTGES3基因的检测可能有助于优化药物的使用和剂量的选择。
PTGES3基因编码的PTGES3酶在人体内发挥着重要的作用。
其参与了前列腺素E2的合成过程,对于维持正常的生理状态至关重要。
PTGES3基因的突变与多种疾病的发生发展密切相关,因此,对该基因的研究有助于揭示疾病的发生机制,并为疾病的治疗提供新的思路和方法。
环氧合酶2和前列腺素E2在肺纤维化发病中的作用

Journal of China-Jap a n Friendship Hospital,2020Jun,Vol.34t No.3中日友好医院学报2020年第34卷第3期167环氧合酶2和前列腺素E2在肺纤维化发病中的作用王颜华(中日友好医院急诊科,北京100029)中图分类号:R56文献标识码:A文章编号:1001-0025(2020)03-0167-03doi:10.3969/j.issn.l001-0025.2020.03.010肺纤维化(pulmonary fibrosis,PF)是一类成纤维细胞(fibroblast,Fb)过度增殖,并向肌成纤维细胞(myofibroblast,mFb)转化,产生大量胶原(collagen,COL)等细胞外基质导致肺脏顺应性和弥散功能下降的疾病。
它是多种弥漫性肺实质疾病的共同病理改变和最终通路,已知的很多因素,如感染、风湿免疫性疾病、急性肺损伤、粉尘吸入、放化疗等都可以引起PF,此外还有相当部分病因未知的特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)O PF病程一旦启动,在某些因素的诱导下将持续进展,最终导致患者呼吸衰竭和多脏器功能衰竭而亡,至今尚无有效的治疗,诊断后平均生存期不足5年【4。
PF的诊断依靠临床症状和影像学检査,虽然有一些概念上的认识,但是具体发病机制尚不十分清楚卩1。
尽管如此,大量的研究表明,环氧合酶2(cyclooxygenase2,COX-2)及其催化产物前列腺素E2 (prostaglandin E2,PGE2)可能是抑制Fb增殖和转化的关键物质,现将此方面的研究做一综述。
1肺纤维化的认识目前普遍认为・PF是由肺泡上皮细胞不可修复的损伤引起Fb过度地增殖和转化,大量细胞外基质沉淀而成。
肺泡上皮修复异常可能涉及Wnt信号通路的异常激活,也可能与端粒酶功能障碍性缩短有关。
比较清楚的是生长因子、细胞因子和其他介质与肺内固有细胞的相互作用对PF反应进展具有重要作用,其中转化生长因子(transforming growth factor-01,TGF~P1)促纤维化作用研究较为明确。
矿产

矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.mPGES一1与泌尿系统:mPGES一1也基础表达 于肾脏多个部位。在家兔,mPGES一1与COX.1共表 达于远曲小管远段和集合管,而与COX-2共表达在 致密斑及髓质问质细胞¨4。,研究发现低盐饮食能上 调致密斑细胞中COX-2和mPGES一1的表达,进而促 进PGE:合成和释放¨5。,这提示mPGES一1可能与肾 脏血流调节和水盐代谢有关。另外mPGES.1在膀 胱和输尿管移行上皮细胞也有较高水平表达¨6I。
在前炎症因子刺激下,多种培养细胞的mPG- ES一1和COX-2表达明显上调,同时伴随PGE:合成 增加u’8 J,这三种变化均可被糖皮质激素完全阻 断¨J。然而,酶动力学研究发现,COX-2与mPGES一 1的诱导情况有时也不一致一J,因为某些情况下 COX-2还可以与mPGES-2偶联,mPGES一1也可以与 COX一1偶联,而且COX-2催化产生的PGH:除在 mPGES.1的作用下生成PGE:外,还可能生成其他 类型的前列腺素,所以COX-2与mPGES-1表达的调 节机制既有重叠又有区别。
·专题讲座·
生理登堂遂退!Q竖生筮!!鲞筮!塑
前列腺素E2合酶的研究进展冰
杨光锐管又飞 (北京大学医学部生理学与病理生理学系北京大学糖尿病中心,北京100083)
目
录
一、前列腺素E:合酶的分类
二、胞质型前列腺素E:合酶 三、膜结合型前列腺素E:合酶一1(mPGES一1)
(一)mPGES.1的结构及酶学特性 (二)mPGES一1与COXs偶联 (三)mPGES.1的生理及病理生理作用 四、膜结合型前列腺素E:合酶-2 五、仙族谷胱甘肽S转移酶 六、展望
4.mPGES.1与肿瘤:大量流行病学研究表明长 期使用非甾体类抗炎药(NSAIDs)能降低直结肠癌 患者的死亡率,NSAIDs还能有效地减少家族性腺瘤 息肉病患者的息肉发生。现在已经知道NSAIDs的 作用靶点是COXs,尽管COXs下游除PGES外,还有 多种前列腺素合酶催化PGH:生成相应的PGs,但 有证据表明COX-2主要与mPGES.1偶联,因此推测 mPGES一1在肿瘤发生发展中可能发挥着与COX-2 类似的作用。
事实证明mPGES一1和COX一2(而不是COX-1) 共转染的HEK293细胞出现分化,表现为快速生长, 细胞堆积以及形态异常…。这两种酶共转染的细 胞在软琼脂培养基中形成许多大的细胞群落,将这 些细胞植入到裸鼠体内可导致肿瘤发生。另外,在 胃癌、直肠癌等肿瘤组织中mPGES.1和COX-2表达 也明显升高¨7|。但是在肺癌模型小鼠高表达mPG. ES.1后,并不引起癌组织过快生长¨8I,提示mPG. ES一1在不同肿瘤中的病理生理作用可能存在差异。
+国家自然科学基金资助课题(30271521)
生堡型堂逛屋!QQ鱼生墓!!鲞筮!翅
表1小鼠三种前列腺素合酶的特性比较
6:在LPS处理的大鼠大脑中cPGES水平升高;4:部分数据来源于人;+:数据来源于人
二、胞质型前列腺素E:合酶 最初认为分子量为23kD的cPGES是Hsp90的 一个辅助因子,故称为Hsp90相关蛋白23拉j,它在 不同物种之问高度保守(>90%),其基因在小鼠含 有8个外显子¨1。 GSH是cPGES活性必需的辅助因子旧J。尽管 cPGES与其它已知胞质GSTs的同源性很低(约 20%),但N-末端附近的Tyr9却高度保守。Tyr9突 变将导致cPGES失活旧J,提示该残基可能是GSH 的结合位点。除GSH外,cPGES还需与Hsp90结 合_4 J,且需在酪蛋白激酶2催化下磷酸化后才有活 性‘5|。 cPGES作为一种看家基因广泛地表达在多种组 织和细胞,通过共转染技术研究显示cPGES主要与 COX一1偶联,介导生理状态下PGE:的产生,尤其是 在ca2+触发的速发型PGE:合成过程中心J。但也有 例外,在LPS处理的大鼠脑内cPGES表达升高数 倍旧o。经放射线照射后,小鼠脑组织中的cPGES表 达也被上调旧J。另外,最近的一项研究发现在猪和 大鼠的大脑及脑血管中的cPGES也可以和微粒体 结合,这种结合可能与其c.末端的35个氨基酸残 基以及Cys58残基有关,由于其与微粒体的结合,脑 组织中这种cPGES既可与COX一1偶联又可与COX. 2偶联,从而介导PGE:的合成一J。这可能是脑内 cPGES既有组成性表达,又能被诱导的基础。 三、膜结合型前列腺素E:合酶-1(mPGES-1) (一)mPGES.1的结构及酶学特性人mPGES一 1基因定位于2号染色体,有三个外显子。其一级 结构在内外显子交界处与MGST.1相似,而与其他 MAPEG不同。人mPGES.1的启动子具有高GC含 万方数据
另外,Thoren等(2003)发现mPGES一1还可以催 化PGG:生成15一氢过氧化PGE:,然后该产物可能 在COX的过氧化物酶活性作用下,或者在其他依赖 GSH的过氧化物酶作用下转化成PGE:,对于这一 通路尚有待进一步研究。
(二)mPGES.1与COXs偶联当给HEK293细 胞同时转染COX-2和mPGES.1后,与单独转染一种
(三)mPGES.1的生理及病理生理作用 通过 基因敲除技术及药理学研究已经对COX-2和四种 PGE:受体的功能有了较多了解,用相似的技术也使 我们对mPGES.1的认识有了长足的进步。由于该 酶具有可诱导性,以及在众多生理及病理生理过程 中发挥重要的作用,使其成为最受关注的PGES。
1.mPGES一1与炎症:mPGES.1与炎症关系密 切。在体内和体外,mPGES一1均可被前炎症因子诱 导。事实上,在LPS处理的大鼠绝大多数组织中, mPGES一1的表达均升高u J。其中,在血管组织中, 尤其是大脑的静脉,mPGES.1介导的PGE:合成增 加后透过血脑屏障,触发发热效应(Yamagata等. 2001)。在风湿性关节炎患者的滑膜细胞中的 mPGES.1的表达增加可能参与了炎症的发生归j。 另外,有证据表明核受体PPARl的抗炎作用也与 mPGES.1有关,在培养的新生大鼠心室肌细胞及人 滑膜成纤维细胞中,PPAR^y激动剂15d—PGJ:及tro. glitazone能抑制IL.1诱导的mPGES一1的上调-l…。
一、前列腺素E:合酶的分类 1999年,Jakobsson发现一种新的MAPEG (membrane-associated proteins involved in eicosanoid and glutathione metabolism,与廿烷类物质及谷胱甘 肽代谢有关的膜相关蛋白)超家族成员,称为人微 粒体GST一1一like-1(MGSTl-L1),它能够非常特异地 将PGH:转变成PGE:。随后,其同源蛋白在其他几 个物种也相继克隆成功,将其命名为膜结合型PG— Es…。紧接着又发现了几种存在于胞质但也具有 特异催化PGE,合成的PGES,它们在谷胱甘肽(glu. tathione,GSH)存在时,可特异地将PGH:转变成 PGE,,其中一种胞质型PGES与热休克蛋白90 (Hsp90)有关,大小为23kD,被命名为胞质型PG— ES旧j。2002年,Tanikawa等克隆成功另一种具有催 化活性的膜结合型PGES,即mPGES.2。表1总结 了小鼠三种PGES的基因特点和主要生物学特征。
万方数据
2.mPGES一1与动脉粥样硬化:有症状的动脉粥 样硬化患者与无症状患者相比,其硬化区的斑块组 织中COX-2与mPGES一1明显升高。其病理生理意 义可能在于COX-2和mPGES一1偶联产生的PGE, 可诱导基质金属蛋白酶(matrix metalloproteinase, MMP)-2和-9表达,而这两种MMP是公认的引起斑 块不稳定的因素¨引。另有研究表明,statins类降脂 药的稳定动脉粥样硬化斑块的作用很可能是通过下 调COX-2及mPGES一1来实现的¨“。
膜磷脂
‘1)
磷脂酶A。(PLA。)卜~—一,溶血磷脂
花生四烯酸媳q
,/一r一102
(21环氧酶一1,2==:尊列腺索‘毛(P6G2)
(COX-I,COX-2)\\.、}
0
@GH2)(3)P源自hTXA.前列豫索啄PGE2)
图1前列腺素E:生物合成途径
万方数据
目前已知至少有3种PGES,即胞质型PGES (cPGES)或称PGES4,膜结合型PGES-1(mPGES一 1)和膜结合型PGES-2(mPGES-2)。cPGES通常与 COX.1偶联,基础表达于多种组织和细胞,主要介 导生理状态下PGE:的产生,用以维持机体内环境 的稳定,如胃黏膜的保护,神经功能的维护及正常 肾脏血流调节等。mPGES.1主要与COX-2偶联,共 同参与血压调节、水盐代谢、生殖、炎症、肿瘤等多 种生理及病理生理过程,这也为mPGES一1作为多种 药物研发的靶点提供了可能。mPGES-2与COX一1 及COx_2均可偶联,其表达不易被调节,目前对 mPGES-2的了解尚少。此外,部分斗族谷胱甘肽S 转移酶(glutathione S-transferase,GST)家族中的成 员也具有PGES的活性。本文将就这几种PGES的 克隆、分类、生物学特性及其生理和病理生理作用 作一综述。
生理型堂进屋!Q竖生筮!!鲞笠!塑
酶相比,从内源性AA和外源性AA来源的PGE:均 明显升高…。相比之下,只有在AA浓度相当高时, COX.1才和mPGES.1偶联。这一研究充分说明 mPGES.1主要与COX-2相偶联,特别是在前炎症因 子引起的迟发反应中mPGES一1和COX-2共同介导 PGE,合成的增加,mPGES一1和COX-2的功能相关 的另外一个证据是二者都是定位在微粒体膜上¨J。
前列腺素E2(prostaglandin E2,PGE2)是一种 最常见的前列腺素(PG),参与机体多种生理及病 理生理过程。它的化学合成由三个连续的酶促反 应组成:(1)花生四烯酸(arachidonic acid,AA)在 磷脂酶A2(phospholipase A2,PLA:)的催化下从膜 上的甘油磷脂中释放出来;(2)AA在环氧酶(cy. clooxygenase,COX)的作用下生成PGG2和PGH2; (3)PGE2合酶(prostaglandin E2 synthase,PGES)催 化PGH:生成PGE2(图1)。
