人教版选修42.3化学平衡--等效平衡
选修化学平衡等效平衡PPT课件

1、定温(T)定容(V)条件:
对于mA(气)+nB(气) pC(气)+qD(气)
(1)若m+n≠p+q ,若建立等效平衡状 态,必须满足什么条件?
第9页/共36页
探究1
定温(T)定容(V)下等效平衡的条件
N2+3H2
500℃ 1L
1molN2 3molH2
2NH3
500℃ 1L
0mH132.mm133o5mmmmlooHlloooNHo2ll1llNH22NNm222H1ol.3N5
对于mA(气)+nB(气) pC(气)+qD(气)
(2)若m+n=p+q ,若建立等效平衡 状态,必须满足什么条件?
第22页/共36页
探究4
500℃ 1L
1molBr2 2molH2
500℃
1L
1L
1molH2 2molHBr
1molH2 2molHBr
500℃ 1L
H2 Br2 HBr
A
B
C
请总结反应前后气体计量数之和相等反 应的等效平衡条件。
③若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是
y号mo)。l和3amol,3则a x=__mol,y=___ __ mol。平衡时,B的物质的量______(选填一个编
(A)大于2mol (B)等于2mol (C)小于2mol (D) 以上都有可能
做出此判断的理由是_____________________________2_____
第2页/共36页
等效平衡
对于一个确定的可逆反应, 化学平衡状态只与条件(T、c、p) 有关,而与建立 平衡的途径无关。即在相同的条件下,无论是从正反应开始,还是从逆反应开始,或 是从正逆反应同时开始;无论是一次投料,还是分次投料,只要经极值换算后,起始 投料物质的浓度对应相等,则平衡时的状态都为等效平衡,即各组分的百分含量对应 相等。
高中化学选修4第二章 等效平衡

编号 1 2 3 4 5 起始物质的量 起始物质的量 起始物质的量 起始物质的量 起始物质的量
I2 4 1.5 1 0.1 0
HI 0 1 2 1.8 a
练习5:在一个1L的密闭容器中,加入 2molA和1molB ,发生下述反应:
达到平衡时, C的浓度为1.2mol/L 。维持 容器的体积和温度不变,按下列配比作为 起始物质,达到平衡后,C的浓度仍为 1.2mol/L的是 B A、0.3mol C+0.1mol D
如何理解“等效平衡”? 相同效果的平衡状态。 相同效果指的是什么? 达到平衡时,反应混合物中各组成成分的
含量(体积分数、物质的量分数等)相等。
等效平衡成立条件探究一
反应:2A(g)+B(g) = 3C(g)+D(g),
根据下表有关数据分析恒温、恒容下等效平衡建成的条件。
A 起 始 充 入 2mol 0 1mol 4mol
1、恒温、恒容下对于(△n≠0)等效平衡是:
极限转化后有关物质的物质的量对应相等。 产生结果: 各组分百分量、n、c均相同
亦称为同一平 衡
练习1:在一个1L的密闭容器中,加入2molA 和1molB ,发生下述反应:
2A(气)+B(气)
3C(气)+D(气)
达到平衡时, C的体积分数为a% 。维持容器 的体积和温度不变,按下列配比作为起始物质, 达到平衡后,C的体积分数为a%是
B. 2 mol H2+2 mol I2
极限转化
(2 2 0) 0)
C. 1 mol H2+1 mol I2+2 mol HI
D. 0.5 mol H2+0.5 mol I2+1 mol HI
等效平衡课件【人教版】化学高二选择性必修

0.5
1
a 2a
0.5a
3、在一固定容积的密闭容器中充入2molA和1molB,
发生反应:2A(气)+B(气)
xC(气),达到平
衡后,C的体积分数为W%。若维持容器体积和温度不
变,按0.6molA、0.3molB和1.4molC为起始物质,达
到平衡后,C的体积分数仍为W%,则x值为( B C )
A、1
一、等效平衡的分类及判断方法
1、恒温、恒容条件下的等效平衡(T、V)
① mA(g)+nB(g) pC(g)+ qD(g)
m+n=p+q
特点: 两次平衡时各组分百分量相同,n、c同比例变化
判断方法:
使用极限换算法,把各体系的起始物质的量换算 成同一反应物或生成物,若各物质起始的物质的量 比值相同,则两平衡等效。
条件
等效条件
结果
恒温恒压
恒温恒容 m+n=p+q
投料换算成相同 两次平衡时各组分百分
物质表示时等比 量相同、c相同,n同比
例
例变化
投料换算成相 同物质表示时 等比例
两次平衡时各组分百分 量相同, c 、 n同比 例变化
恒温恒容 m+n ≠p+q
投料换算成相同 物质表示时量相 等
两次平衡时各组分百分 量、 c 、 n均相同
B、2
C、3
D、4
解析:若反应前后气体体积不变,则x=3,要保持C的 体积分数不变,只需要起始状态的物质的量之比不变, 反应物的系数比为n(A):n(B)=2:1,而0.6: 0.3=2:1,C完全转化成A和B生成的量之比总等于2: 1,所以x=3成立。此种情况是等效平衡而不等同。 若反应前后气体体积不相等,要保持C的体积分数不 变,两种情况的起始量必须相等,1.4molC必须转化 为1.4molA和0.7molB,所以x=2成立。此种情况是等 同平衡,也一定等效。本题正确答案为B、C。
【人教版】高中化学选修等效平衡精品教学课件-PPT

平衡状态
SO2 a% O2 b% SO3 c%
2SO3
开始
4mol SO2 2mol O2
2mol SO2 1mol O2 2mol SO2 1mol O2
SO2 a% O2 b% SO3 c%
SO2 a% O2 b% SO3 c%
SO2 a%
平衡状态
O2 b% 加压 SO2 <a%
SO3 c%
O2 <b% SO3 >c%
3A(气)+2B(气) xC(气)+yD(气),达到平衡时, C的体积分数为m%。若维持温度压强不变,以0.6L A , 0.4L B,4L C ,0.8L D作为起始物质充入密闭容器中,达到
平衡时C的体积分数仍为m%,则x、y的值分别为( C )
A x=3 y=1
B x=4 y=1
C x=5 y =1
C.1molCO2、1molH2O
D.1molCO2、1molH2、1molH2O
【人教版 】高中 化学选 修等效 平衡精 品教学 课件-PP T优秀 课件( 实用教 材)
ห้องสมุดไป่ตู้
【人教版 】高中 化学选 修等效 平衡精 品教学 课件-PP T优秀 课件( 实用教 材)
习题1
03
在一定温度下,将1molCO和2molH2O通入一个密闭容器中, 发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),一定时 间后达到平衡,此时,CO的含量为p%,若维持温度不变, 改变起始加入物质的物质的量,平衡时CO的含量仍为p%的 是( )
2 HI(气)
开始
平衡状态
情 1mol H2
况 一
1mol I2
开始
化学课件《化学平衡——等效平衡》优秀ppt2 通用

可左右
K
移动
(1)A中X的转化率Aα(A) = _____。 B (2)A、B中X的转化率的关系:α(A)_α(B)。 (3)打开K,一段时间后又达到平衡时,A的体 积为_____ L(连通管中气体体积不计)
7、相同容积的四个密闭容器中,进行同样的可逆反应
2A (g) +B(g)
3C(g)+2D(g) ,起始时四个
二、等效平衡的含义
• 完全等同——相同组分的分数和 物质的量都相同(等量等比)
• 比例相同——相同组分的分数相 同、物质的量不等(等比不等量)
三、等效平衡建立的规律
1、恒温恒容条件下
I类:对于反应前后气体分子数不 等的可逆反应,只改变起始加入 情况,只要通过可逆反应的化学 计量数比换算成平衡式左右两边 同一边物质的物质的量与原平衡 相同,则二平衡等效。
它条件不变时,若按下列四种配比作为起始物
质,平衡后A的体积分数大于a%的是( )
A.2molC B.2molA、1molB和1molHe(不参加反应) C.1molB和1molC D.2molA、3molB和3molC
4、将amolPCl5充入一个容积恒为VL的 密闭容器中,发生如下反应:
PCl5(g) == PCl3(g) + Cl2(g) ,在t℃ 的温度下反应达到化学平衡,此时容器 内气体压强为P1,保持温度不变,再向该 容器中充入amolPCl5再达到化学平衡时, 容器内气体压强为P2,则P1和P2的大小 关系是
人教版高二化学选修四化学平衡等效平衡课件
二、等效平衡的基本标志或结果
反应混合物中各组分的质量分 数、体积分数、物质的量分数均 相同
人教版高二化学选修四化学平衡等效 平衡课 件
三、等效平衡的判断方法 任何状态的体系,都用“极端状态”
来比较,通过可逆反应的化学计量数换 算成同一边物质
四、等效平衡的分类
完全等同——相同组分的分数和物质的量 都相同(等量等比) (等同等效)
等效平衡建成条件的探究二
恒温恒容下,H2 (g)+I2 (g) • 途径1起始 2 mol 1mol • 途径2起始 1mol 0 • 途径3起始 4mol 2mol • 途径4起始 3mol 1mol
2HI(g) 0
1mol 0
2mol
途径2、 3、4与 途径1 等效吗?
500℃ 1L
500℃
1L
比例相同——相同组分的分数相同、物质 的量不等(等比不等量) (等比等效)
人教版高二化学选修四化学平衡等效 平衡课 件
人教版高二化学选修四化学平衡等效 平衡课 件
探究一
恒温恒容条件下等效平衡的条件
1、反应前后气体分子数发生变化的可逆反应 也就是△n(g)≠0的可逆反应
人教版高二化学选修四化学平衡等效 平衡课 件
D.3mol C + 1mol D 2molA+1molB
E、1molA+0.5molB+1.5molC+0.5molD
(1+1)molA+ (0.5+0.5)molB
课堂练习
2、某温度下,在一个容积恒定的密闭容器中发生如下可逆 反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0 , 反应达到 平衡时,测得容器中各物质均为nmol,现欲使H2的平衡浓度 增大一倍,在其他条件不变时,下列措施可以采用的是
化学选修四《等效平衡》PPT课件(精选)PPT文档共28页

2、要冒一次险!整个生命就是一场冒险。走得最远的人,常是愿意 去做,并愿意去冒险的人。“稳妥”之船,从未能从岸边走远。-戴尔.卡耐基。
梦 境
3、人生就像一杯没有加糖的咖啡,喝起来是苦涩的,回味起来却有 久久不会退去的余香。
化学选修四《等效平衡》PPT课件(精选) 4、守业的最好办法就是不断的发展。 5、当爱不能完美,我宁愿选择无悔,不管来生多么美丽,我不愿失 去今生对你的记忆,我不求天长地久的美景,我只要生生世世的轮 回里有你。
谢谢你的阅读
❖ 知识就是财富 ❖ 丰富你的人生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
等效平衡 人教版高中化学选修四

分数不变,
(1)若要使平衡时生成3amol的HBr,应加入H2
mol,
Br2 mol (2)若加入1molHBr,平衡时得到1.5amol的HBr,还需
要加入H2
mol, Br2
mol
2、恒温、恒压条件下的等效平衡
在恒温恒压条件下,不论反应前后气体总体积是否变 化的反应,把所给物质按方程式换算到一边,若物质 的量之比相等,则两平衡等效。(相似等效)
A
SO2 0mol O2 0mol SO3 2mol
SO2 1mol O2 0.5mol SO3 1mol
SO2 0.5mol O2 0.25mol SO3 1.5mol
? B
c
D
特点:
平衡状态
SO2 1.2mol O2 0.6mol SO3 0.8mol
E
1、两次平衡时 各组分百分量、
且n、c均相同
第二章 化学反应速率和化学平衡
§2.3 化学平衡 (第4课时)
等效平衡
一、等效平衡的概念
在相同的条件下,对同一个可逆反应,反应 无论从正反应方向开始进行还是从逆方向开始进 行,只要起始时加入物质的物质的量不同,而达 到相同的平衡状态,这样的平衡称为等效平衡。
相同的条件:①同T同V ②同T同P
相同的平衡状态:通常是指平衡混合物各组分的百
判断方法: 极限转化法
T、V不变 H2(g)+I2 (g)
2HI(g)
I2 1mol H2 1mol HI 0mol
I2 2mol H2 2mol HI 0mol
I2 0mol H2 0mol HI 2mol
特点:
两次平衡时各组
分百分量相同,
但n、c同比例变 化
化学选修四_等效平衡

为(用两个式子表示,一个只含a和c,一个
只含b和c ——a+—c—/2—=——2 —、 —b—+3—c—/2—=——6—
11
例2、在一个固定容积的密闭容器中,加入
2molA和1molB,发生
2A(g)+B (g)
3C(g) +D(g) ,达到化学
平衡时,C的浓度为w mol/L。若保持温度容
积不变,改变起始物质的用量,达到平衡后,
C、2molA+1molB+3molC+1molD
D、1molA+0.5molB+1.5molC+0.5molD
18
6、在一个固定体积的密闭容器内,保持一定的温度 发生以下反应:H2+Br2 2HBr。已知加入1molH2和 2molBr2 时,达到平衡状态生成amolHBr。在相同条 件下,且保持平衡时的各物质的百分含量相同,则填 写下列空白:
编号
已知 ① ② ③
起始状态(mol)
H2
Br2
HBr
1
2
0
2
4
0
0
0.5
1
m n(n≥2m)
0
平衡HBr物质 的量(mol)
a
2a
0.5a
≥ma
19
7、在一固定容积的密闭容器中充入2molA和 1molB,发生反应:
2A(g)+B(g)
xC(g),达到平衡后,C的体
积分数为W%。若维持容器体积和温度不变,
返5 回
2.等比平衡
定义:
一定条件下从不同起始投料开始的同一可逆 反应达平衡时,各物质的物质的量分数、质量分 数、体积分数(气体)对应相等,这样的两个或 两个以上的平衡状态互称为等比平衡状态,简称 等比平衡。
2018-2019学年人教版选修4 第2章第3节 化学平衡——等效平衡 教案

第3节化学平衡——等效平衡教学目标1.构建等效平衡的模型,掌握等效平衡在解题中的应用2.通过对化学反应进行方向及其应用的学习,提高运用比较、归纳的能力,培养学生学习化学思维能力,以及应用理论解决实际问题能力3.建立化学平衡的观点,并通过分析化学平衡的建立,增强学生的归纳和形象思维能力教学重点等效平衡教学难点等效平衡教学过程一、导入水往低处流,而不会自发的向上流;一般在室温下,冰块会融化,铁器在潮湿空气中会生锈,甲烷与氧气的混合气体遇明火就燃烧,这些过程都是自发的。
这些不用借助于外力就可以自动进行的自发过程的共同特点是,体系会对外部做功或释放热量,即体系趋向于从高能状态转变为低能状态。
那是否就意味着放热反应自发进行,吸热反应就是非自发进行呢?二、知识讲解等效平衡对于一些学生理解起来不是特别容易,希望老师在讲解此内容的时候多一些耐心,重点讲典型例题和习题。
考点1 等效平衡含义及原理1.含义在一定条件下(等温等容或等温等压),对同一可逆反应体系,起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同。
2.原理同一可逆反应,当外界条件一定时,反应无论从正反应开始,还是从逆反应开始,最后都能达到平衡状态。
其中平衡混合物中各物质的含量相同。
由于化学平衡状态与条件有关,而与建立平衡的途径无关。
因而同一可逆反应,从不同的状态开始,只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。
考点2 等效平衡规律对于可逆反应aA(g)+bB(g)cC(g)+dD(g)三、例题精析使用建议说明:此处内容主要用于教师课堂的精讲,每个题目结合试题本身、答案和解析部分,教师有的放矢的进行讲授或与学生互动练习。
例题1 一定温度下,在3个体积均为1.0 L 的恒容密闭容器中反应2H 2(g)+CO(g)CH 3OH(g) 达到平衡。
下列说法正确的是A .该反应的正反应放热B .达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大C .达到平衡时,容器Ⅱ中c(H 2)大于容器Ⅲ中c(H 2)的两倍D .达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大【答案】AD【解析】A 项,根据Ⅰ、Ⅲ中数据可知反应开始时Ⅰ中加入的H 2、CO 与Ⅲ中加入甲醇的物质的量相当,平衡时甲醇的浓度:Ⅰ>Ⅲ,温度:Ⅰ<Ⅲ,即升高温度平衡逆向移动,该反应正向为放热反应,所以A 项正确。
化学平衡移动与等效平衡

化学平衡移动影响条件(一)在反应速率(v)-时间(t)图象中,在保持平衡的某时刻t1改变某一条件前后,V正、V逆的变化有两种:V正、V逆同时突变——温度、压强、催化剂的影响V正、V逆之一渐变——一种成分浓度的改变【总结】:①增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。
②增大压强,化学平衡向系数减小的方向移动;减小压强,平衡会向系数增大的方向移动。
③升高温度,平衡向着吸热反应的方向移动;降低温度,平衡向放热反应的方向移动。
④催化剂不改变平衡移动(二)勒夏特列原理(平衡移动原理)如果改变影响平衡的一个条件,平衡就会向着减弱这种改变的方向移动。
具体地说就是:增大浓度,平衡就会向着浓度减小的方向移动;减小浓度,平衡就会向着浓度增大的方向移动。
增大压强,平衡就会向着压强减小的方向移动;减小压强,平衡就会向着压强增大的方向移动。
升高温度,平衡就会向着吸热反应的方向移动;降低温度,平衡就会向着放热反应的方向移动。
注意:平衡移动原理对所有的动态平衡都适用,如对后面将要学习的电离平衡,水解平衡也适用。
(讲述:“减弱”“改变”不是“消除”,更不能使之“逆转”。
例如,当原平衡体系中气体压强为P时,若其它条件不变,将体系压强增大到2P,当达到新的平衡时,体系压强不会减弱至P甚至小于P,而将介于P~2P之间。
)一、选择题1.关于催化剂的叙述,正确的是()A.催化剂在化学反应前后性质不变B.催化剂在反应前后质量不变,故催化剂不参加化学反应C.使用催化剂可以改变反应达到平衡的时间D.催化剂可以提高反应物的转化率2.对于可逆反应2A2(g)+B2(g) 2B(1)(正反应为放热反应)达到平衡,要使正、逆反应的速率都增大,而且平衡向右移动,可以采取的措施是()A.升高温度B.降低温度C.增大压强D.减小压强3.在一容积固定的密闭容器中,反应2SO(g)+O2(g) 2SO3(g)达平衡后,再通入18O气体,重新达平衡。
化学平衡等效平衡

化学平衡等效平衡
化学平衡中的等效平衡指的是在一定条件下(如恒温恒容或恒温恒压),不同起始反应物投料达到的平衡状态具有相同的组分百分含量。
等效平衡通常涉及以下几个方面的内容:
1. 定义:在相同的环境条件下,对同一可逆反应体系,即使起始加入物质的情况不同(例如不同的投料方式),但最终达到化学平衡时,同种物质的百分含量(体积分数、物质的量分数或质量分数)均相同,这样的平衡状态互称为等效平衡。
2. 全等平衡:作为等效平衡的一个特例,全等平衡不仅要求相同组分的分数均相同,而且相同组分的物质的量也完全相同。
这通常发生在恒温恒容或恒温恒压条件下的定量投料情况。
3. 应用结论:
-在恒温恒容或恒温恒压的条件下进行定量投料,都能建立全等等效平衡状态。
-在恒温恒压条件下进行定比投料,能建立相似等效平衡状态。
-在恒温恒容条件下进行定比投料,只有等体反应能建立相似等效平衡状态。
等效平衡的概念对于理解和预测化学反应的行为具有重要意义,尤其是在工业化学过程中,通过对原料投料比例的调整,可以预期达到相同的产品组成,从而优化生产过程和提高原料利用率。
第四课时 等效平衡

A、 B
B、1mol A+0.5mol B+1.5mol C+0.5mol D D、4mol A+2mol B
练习2、某温度下,向某密闭容器中加入 1molN2和3molH2,使之反应合成NH3,平 衡后测得NH3的体积分数为m。若T不变, 只改变起始加入量,使之反应平衡后NH3 的体积分数仍为m,若N2、H2、NH3的加 入量用X、Y、Z表示应满足: (1)恒定T、V: 2mol [1]若X=0,Y=0,则Z=-----------。 0.5mol 2.25mol [2]若X=0.75,Y=----------,Z=----------。
③也可从加入反应物和生成物,从正、 逆反应方向同时开始
一、化学平衡中的两大原则
1、可逆反应的“不为零”原则 可逆反应是化学平衡的前提,达平衡 时反应物、生成物共存,每种物质的物 质的量不为零。 应用:一般可用极限分析法:先假设 反应不可逆,则最多生成产物多少,有 无反应物剩余,余多少,找到极限点, 从而确定某些范围或在范围中选择合适 的量。
2、等效法——“一边倒”原则 在可逆反应中,将加入的物质(反应 物或生成物)按方程式的反应规律及其计 量数由一边完全转化到另一边的方法 如: aA(g)+bB(g) cC(g) 最初加入:nmol mmol xmol 现将生成物C的加入量X按“一边倒”转化 为反应物A、B: b xmol a xmol xmolC 相当于 c A; c B, a 最初相当于加入:A: n+ c xmol , a m+ xmol B: C: 0 mol 。 c
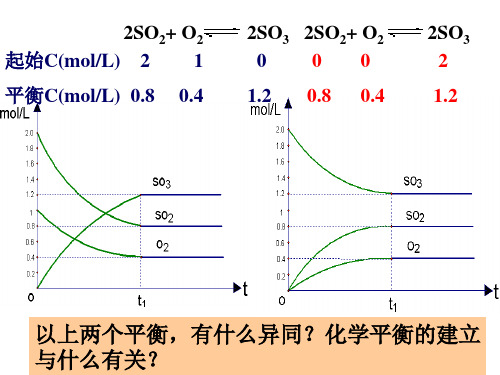
开始 2mol SO2 1mol O2 开始
恒温恒容过程 相当于开始加入 催化剂
加热
2SO3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人 教 版 选 修 4 2.3 化学平 衡--等效 平衡( 共32张 PPT)
完全等效平衡的条件:
①在等温等容的密闭容器中加入1摩尔N2和4摩尔 H2开始反应,在相同的容器中加入a摩尔N2、b摩 尔H2和c摩尔NH3开始反应 ,发现最终的化学平 衡状态完全相同,思考:abc三者之间的关系:
过程设计
1摩尔SO2 2摩尔O2 压强不变 甲反应设计
1摩尔SO2 2摩尔O2 压强不变
平衡时SO2的转化率为a%
乙 化学平衡移动方向 逆向移动
平衡时SO2的转化率为a% 乙与甲发生联系 体积增大
知识巩固:向两只完全相同的密闭容器中分别通 入相同的2摩尔氧气和1摩尔二氧化硫,甲容器保 持体积不变,乙容器保持压强不变,比较: (3)达到化学平衡时SO2的浓度, 甲 小于 乙。
1.
在体积不变的密闭容器中,加入
4molSO2和1molO2,在催化剂的作用下发生反 应达到化学平衡时,SO3的浓度为Wmol/L。在 另一个相同的容器中加amolSO2 、 bmolO2、 cmolSO3,若达到化学平衡时SO3的浓度依然是 Wmol/L,
(1)如果 a=2 c= _2_ b = _0__
1摩尔NO2
1摩尔NO2
a摩尔/升
a摩尔/升
不考虑化学平衡的移动 NO2的浓度为2 a摩尔/升
化学平衡:2NO2
N2O4 正向移动
NO2的浓度:小于2 a摩尔/升。NO2的浓度变化:
先增大,后减小,减小也比原来的大。
等效平衡
一、含义:
在一定条件(恒温恒容或恒温恒压)下 的同一可逆反应中,因起始加入的各组分物质的 量不同,而达到平衡后任何相同组分的百分含量 (体积分数、物质的量的分数等)均对应相同, 这样的化学平衡称等效平衡。
叫完全等效平衡
即
两种情况的:浓度、物质的量、各物质的百分 含量、密度、压强等等完全相同。
条件:任何条件下的任何化学反应当起始条件
和理想的起始条件完全相同时,达到完全等效 平衡状态。
人 教 版 选 修 4 2.3 化学平 衡--等效 平衡( 共32张 PPT)
人 教 版 选 修 4 2.3 化学平 衡--等效 平衡( 共32张 PPT)
N2 + 3H2
第一种的起始状态 1
4
第二种的状态
a
b
第二种的理想起始 状态
a c 2
b 3c 2
2NH3 0 c
0
所以完全等效平衡条件
a c 1 2
b 3c 4 2
人 教 版 选 修 4 2.3 化学平 衡--等效 平衡( 共32张 PPT)
一、容器的体积不发生变化,即等体积。 人教版选修4 2.3化学平衡--等效平衡(共32张PPT)
(一)化学反应是体积改变的反应
在等温等容的密闭容器中加入1摩尔N2和4摩尔H2开始反 应,在相同的容器中加入a摩尔N2、b摩尔H2和c摩尔 NH3开始反应 ,发现最终达到化学平衡状态时NH3的百 分含量一样(或氮气的浓度一样),思考:abc三者之
间的关系: 完全等效平衡
所以
ac 4
2
特点:(1)恒温恒容
1摩尔SO2 2摩尔O2 体积不变
平衡时SO2的转化率为a%
甲 化学平衡移动方向 正向移动
平衡时SO2的转化率为a% 乙与甲发生联系 体积减小
知识巩固:向两只完全相同的密闭容器中分别通
入相同的2摩尔氧气和1摩尔二氧化硫,甲容器保
持体积不变,乙容器保持压强不变,比较: (2)达到化学平衡时SO2的转化率,甲小于 乙。
(2)则a、b、c的关系_____________________
考试知识点是:等效平衡,属于 完全等效平衡 。
ac4 b c 1 2
人 教 版 选 修 4 2.3 化学平 衡--等效 平衡( 共32张 PPT)
人 教 版 选 修 4 2.3 化学平 衡--等效 平衡( 共32张 PPT)
2.
在体积不变的密闭容器中,加入
2SO2 + O2 甲小于乙
2SO3
化学反应都达到化学平衡后容器体积大小?
甲大于乙
知识巩固:向两只完全相同的密闭容器中分别通
入相同的2摩尔氧气和1摩尔二氧化硫,甲容器保
持体积不变,乙容器保持压强不变,比较: (2)达到化学平衡时SO2的转化率,甲小于 乙。
过程设计
1摩尔SO2 2摩尔O2 体积不变 乙反应设计
1摩尔NO2 a%
1摩尔NO2 a%
不考虑化学平衡的移动 NO2的百分含量a%
化学平衡:2NO2
N2O4 正向移动
NO2的百分含量减小
在温度一定、体积为VL密闭容器中加入1摩尔NO2发 生反应,达到化学平衡后,NO2的浓度为a摩尔/升, 再加入1摩尔NO2,达到新的化学平衡后,NO2的浓度
的范围? am /l c o (N l2 ) O 2 am /Lo
过程设计 先增大,后减小,减小也比原来的大
1摩尔SO2 2摩尔O2 体积不变 乙反应设计
1摩尔SO2 2摩尔O2 体积不变
平衡时SO2的浓度为a摩尔/升甲 化学平衡移动方向 Nhomakorabea正向移动
平衡时SO2的浓度为a摩尔/升 乙与甲发生联系 体积减小
在温度一定、体积为VL密闭容器中加入1摩尔NO2发 生反应,达到化学平衡后,NO2的百分含量a%,再加 入1摩尔NO2,达到新的化学平衡后,NO2的百分含量 增大还是减小?
等效平衡 一、化学平衡的设计
知识巩固:向两只完全相同的密闭容器中分别通
入相同的2摩尔氧气和1摩尔二氧化硫,甲容器保
持体积不变,乙容器保持压强不变,比较: (1)达到化学平衡的时间,甲 大于 乙。
(2)达到化学平衡时SO2的转化率,甲
乙。
(3)达到化学平衡时SO2的浓度, 甲
乙。
解析:化学反应都达到化学平衡后压强大小?
b 3c 1 2
(2)气体体积改变的化学反应 (3)浓度、百分含量或物质的量等保持不变。 (4)完全等效平衡。 (5)方法:根据方程式系数,转化为起始状
态进行比较。
人 教 版 选 修 4 2.3 化学平 衡--等效 平衡( 共32张 PPT)
人 教 版 选 修 4 2.3 化学平 衡--等效 平衡( 共32张 PPT)
4molSO2和1molO2,在催化剂的作用下发生反 应达到化学平衡时,SO3的百分含量为W。在另 一个相同的容器中加amolSO2 、 bmolO2、 cmolSO3,若达到化学平衡时SO3的百分含量 (各物质浓度相等)为W 。则a、b、c的关系
