金属有机化学(7)
金属有机化合物

第三章金属有机化合物在有机合成中的应用第一部分金属有机化合物概述一、什么是金属有机化合物?金属有机化合物,简单的说,就是碳原子和金属原子直接相连的化合物。
最经典的金属有机化合物包括格氏试剂、丁基锂等;后来研究范围扩展到过渡金属有机物。
金属与碳直接键合的“有机的”化合物才是金属有机化合物含B—C,Si—C,P—C等键的有机化合物,在制法、性质、结构等方面与金属有机化合物很相似,可称它们为元素有机化合物或类金属有机化合物并把它们放在金属有机化学中讨论。
广义金属有机化合物,将硫、硒、碲、磷、砷、硅、硼等带有金属性质的非金属都算成金属,实际上已经超越了经典金属有机化合物的范畴。
但是由于元素有机化学和金属有机化学有着千丝万缕的联系,将其混在一起也不致引起太大的混乱。
二、金属有机化合物的分类总体上可分为二大类:即非过渡金属有机化合物和过渡金属有机配合物。
(1) 非过渡金属有机化合物:包括主族金属有机化合物和类金属(元素)有机化合物。
主族金属的d层轨道中已填满了电子,用s、p轨道中的电子与有机基团成键。
(2) 过渡金属有机配合物:主要是指由过渡金属与有机基团所形成的化合物。
过渡金属除s、p轨道外,d轨道的电子也参加成键。
配位不饱和的过渡金属有机配合物存在空轨道,为它们作为催化剂和有机合成试剂提供了条件。
非过渡金属有机化合物通常包括三类:第一类:主族金属有机化合物第一族的锂、钠、钾第二族的铍、镁、钙第十三族的铝、镓、铟、铊第十四族的锡、铅第十五族的铋第二类:第十一、十二族金属有机合物第十一族的铜、银、金第十二族的锌、镉、汞CuLiRCu R2第三类:元素有机化合物第十三族的硼第十四族的硅第十五族的磷、砷第十六族的硫、硒、碲等所形成的有机化合物用于形成非过渡金属有机化合物的金属包括:过渡金属有机配合物主要是指由第三~第十族的过渡金属形成的有机物几种有代表性的过渡金属配合物三、金属有机化合物的发展历程下面按时间顺序来说明金属有机化合物产生和发展及其规律以及在实践中的应用,并探讨学科的研究方法。
有机化学第7章羰基的反应

O C H 3
顺反烯烃的生成受条件和Ylide试剂的结构、活性等影响很大
精选2021版课件
31
The use of Wittig reaction in industry
精选2021版课件
32
关于亲核加成的小结 1. 概述 —— 结构、机理、反应活性、立体化学 2. 含O, S亲核试剂 包括H2O, ROH, RSH, 和NaHSO3
O R M g B r
O M g B r
O H
H 2 O
R
R
OR M g B r O M g B r -Y M g B r OR M g B rH 2 OO H
Y
Y R
R
R R
其 中 : Y = X o r O R
C NR M g B r
N M g B r R
精选2021版课件
H 2 O
O R
25
格氏试剂的应用
酯
O C R' RN
R"
酰胺
酰卤 > 酸酐 > 醛 > 酮 > 羧酸 ~ 酯 > 酰胺
取决于与羰基相连的基团的电子效应
精选2021版课件
7
二、羰基的亲核加成
1. Summary
2. (1) Nucleophiles
负离子亲核试剂(碱性条件): ¯OH、 ¯OR、 ¯SR、 ¯H、 ¯C≡N、 ¯C≡CR、 ¯CR3、(M-R) 中性分子亲核试剂(中性或酸性条件): HOH、HOR、HSR、NH3、H2NR、HNR2
精选2021版课件
28
二、羰基的亲核加成
4. 含C亲核试剂
(4) Ylide试剂 Ylide试剂的形成
金属有机化合物的合成与应用

金属有机化合物的合成与应用金属有机化合物是由金属离子和有机配体组成的化合物,其合成和应用在无机化学和有机化学领域具有重要意义。
本文将介绍金属有机化合物的合成方法和它们在催化、材料、医学等方面的应用。
一、金属有机化合物的合成方法1. 配体取代法:通过将金属离子的配体逐步替换成有机配体,从而得到金属有机化合物。
这种方法可以通过与有机化合物反应或进行配体交换反应实现。
2. 氧化还原法:通过加热或化学反应,使金属离子与有机配体发生氧化还原反应,生成金属有机化合物。
3. 直接合成法:将金属离子与有机配体一起反应,直接得到金属有机化合物。
二、金属有机化合物在催化领域的应用1. 都是金属配合物,拥有良好的催化性能。
金属有机化合物在催化反应中可以作为催化剂,提高反应的效率和选择性。
2. 金属有机化合物催化剂可用于有机合成领域,如烯烃的转化、羰基化反应、环化反应等。
三、金属有机化合物在材料领域的应用1. 金属有机化合物可以用于制备金属有机框架材料(MOF),这是一种具有高比表面积和孔隙结构的新型材料。
MOF在气体吸附、储氢、催化反应等方面具有潜在的应用价值。
2. 金属有机化合物还可用于制备有机金属聚合物(OMP)。
OMP在导电、光电、光催化等方面具有广泛的应用前景。
四、金属有机化合物在医学领域的应用1. 铂类金属有机化合物,如顺铂、卡铂等是广泛应用于抗肿瘤药物。
它们可与DNA结合,抑制肿瘤细胞的DNA复制和细胞分裂,从而起到治疗肿瘤的作用。
2. 铜类金属有机化合物则可以用于抗菌和抗炎症药物的研究和开发。
综上所述,金属有机化合物的合成和应用具有重要的科学意义和实际价值。
在未来的研究中,我们可以进一步改进合成方法,并探索新的应用领域,以推动金属有机化合物在化学和材料科学的进一步发展。
金属有机化学

金属有机化学基础第5章非过渡金属有机化合物第5章非过渡金属有机化合物⏹反应试剂:许多非过渡金属有机化合物是高活性、高选择性的有机合成试剂,如Grignard试剂、锂试剂、硼试剂等在现代有机合成中占有重要位置。
⏹辅助催化剂:过渡金属有机化合物是配位催化的催化剂,但也离不开非过渡金属有机化合物作为助催化剂,如著名的Ziegler-Natta催化剂中必须用一个非过渡金属有机化合物活化。
⏹合成方法:许多过渡金属有机化合物可借鉴合成非过渡金属有机化合物的方法并用非过渡金属有机化合物作为试剂来制备。
⏹反应性质:过渡金属有机化合物的一些基本化学性质、结构也与非过渡金属有机化合物密切相关。
第5章非过渡金属有机化合物⏹非过渡金属有机化合物的通用制法⏹碱金属有机化合物----有机锂⏹碱土金属有机化合物----有机镁⏹硼族有机化合物----有机铝和有机硼⏹金属与卤代烃反应的机理自由基反应–––非过渡金属易失去价电子,卤代烃接受了这个电子后生成烃基自由基,这是速度控制阶段。
Mꞏ+ R-X → M++ Rꞏ + X-●对第IA族金属,烃基自由基与另一个零价金属反应生成金属有机化合物,金属正离子与卤素负离子形成盐,如合成锂有机化合物。
Mꞏ+ R ꞏ→ MRM++ X-→ MXMꞏ+ R-X → M++ Rꞏ + X-●第IIA族金属失去一个价电子后与卤素负离子生成一价的盐,但这个金属上还有一个价电子,它立即与烃基自由基结合得到金属有机化合物,如合成Grignard试剂。
M ꞏ++ X-→ MX ꞏR ꞏ +MX ꞏ →RMX●与第IIA族金属一样,第14族金属先失去一个价电子后与卤素负离子形成RMX,但它是不稳定的,继续与卤代烃反应,得到第14族金属有机化合物。
[RMX] + RX → R2MX25.1.2 用非过渡金属有机化合物对金属烃基化反应这是由一种金属有机化合物制备另一种金属有机化合物的方法,也称为转金属化反应(Transmetalation)。
金属有机化学基础-金属有机化学理论基础

第3 章
金属有机化学理论基础
Back
1
第3 章
金属有机化学理论基础
原子结构与轨道
晶体场理论
分子轨道理论
原子价键理论
金属-碳键的性质
18电子规则及EAN规则
2
3.1 原子结构与轨道
金属有机化合物价键的显著特点是至少含有 一个M-C键。除此之外,还存在有机、无机分子 或基团作为配体与中心金属配位,形成不同形式 的化学键。金属有机化合物,特别是过渡金属有 机配合物的价键状况是很复杂的。研究它们形成、 变化的本质与规律是金属有机化学的最重要的理 论问题。公认的金属有机化合物化学键理论是晶 体场理论和分子轨道理论。
20300 24900 29000
27000
当配位体一定时,∆值随中心原子而变; 同一元素中心原子的电荷数越大,∆值也越大; 过渡金属三价离子水溶液颜色往往比二价离子水溶液的颜
色要深;
同族同价的过渡金属,周期数越大,∆值也越大。
27
2. 解释配合物的稳定性、磁性 稳定性
由于配体静电场的作用,d轨道的能级发生分裂,d电子
4d4
3d4 3d5 3d6 4d6 5d5
Mo3+
Cr2+ Mn3+ Mn2+ Fe3+ Fe2+ Co3+ Rh3+ Ir3+ Pt4+ 18900 23100 24000
19200
24000
13900 21000 7800 13700 10400 18600 23000 33900 35000 32800 34000 45500
12
3.2.1 六配位八面体金属配合物
有机化学中的金属有机化合物

有机化学中的金属有机化合物金属有机化合物是有机化学领域中的一类重要化合物,其分子结构中含有金属与有机基团的化学键。
金属有机化合物具有独特的性质和广泛的应用,对于研究金属有机化学以及发展金属有机合成方法具有重要意义。
本文将介绍金属有机化合物的定义、合成方法以及其在催化反应和材料科学中的应用。
一、金属有机化合物的定义金属有机化合物是指化合物中含有金属元素(如铁、铜、锌等)和有机基团(如烃基、醇基等)的共价键。
这些化合物通常以配合物的形式存在,其中金属中心与有机基团通过配位键相连。
金属有机化合物可以根据金属元素的性质和配位方式进行分类,如金属卡宾、金属烯烃配合物等。
二、金属有机化合物的合成方法1. 金属有机化合物的合成可以通过直接反应法实现。
直接反应法是指金属与有机底物直接发生反应生成金属有机化合物。
例如,Grignard 试剂与卤化物反应生成金属有机化合物,这是一种常用的合成金属有机化合物的方法。
2. 金属有机化合物的合成也可以通过还原法实现。
还原法是指用还原剂还原金属盐类,使金属离子与有机底物发生反应生成金属有机化合物。
这种方法常用于合成铁、镍等金属有机化合物。
3. 另一种常用的合成金属有机化合物的方法是配体交换法。
配体交换法是通过将金属配合物中的配体与有机配体交换,从而生成金属有机化合物。
这种方法广泛应用于合成含铂、钯等金属的有机化合物。
三、金属有机化合物的应用金属有机化合物在催化反应中具有重要作用。
例如,铁-铍双金属有机化合物可以催化烯烃羰基化反应,得到醛和酮化合物。
铜配合物可用作C-C键的形成催化剂,广泛应用于有机合成领域。
金属有机化合物在材料科学中也具有广泛应用。
例如,金属有机化合物可以用于合成金属有机聚合物,这些聚合物在光电、荧光材料方面具有良好性能。
金属有机化合物还可以用于制备金属有机框架材料(MOF),这种材料在气体吸附、分离等方面具有重要应用价值。
总结金属有机化合物是有机化学中的重要研究对象,对于金属有机化学的发展和应用具有重要意义。
有机金属化学

(四)金属有机化学和无机化学
(Ph3P)2PdMe2与 (Ph3P)4Pd性质类似 RSi(OR)3与Si(OR)4性质类似
金属有机化学与不含碳-金属键的络合物化 学重叠,与无机化学重叠
金属有机化学是介于无机化学和有机化 学之间的边缘学科。
(五)有些含M-C键的化合物不属于 金属有机化合物
1983年,K. G.Bergman和
W.A.G.Graham在金属络合物和烷烃的 分子间反应中观察到了C—H键活化,再次掀 起金属有机化学的热潮
三、金属有机化合物分类
(一)按中心金属元素在周期表中的位置: 主族金属有机化合物
包括IA,IIA,IIIA,IVA,VA族及IIB族的金属与准金属
随后,很多化学家对砷、锑、锡、汞的 元素有机化合物进行过不少研究工作。
我国的化学家于20世纪五六十年代,制备了 许多锑化合物,用于治疗血吸虫病和黑热病。 为了减低锑化合物的毒性,还合成了一些新 的有机锑化合物。
其他,如锡有机物作为杀菌剂,汞有机物作 为消毒剂,“顺铂”做为抗癌药物等
(二)金属有机化合物的工业直接应用
四乙基铅:汽油的抗震剂,有机锡化合物:高分子
聚合物的稳定剂和聚烯烃、橡胶等的防老剂等
硅酮聚合物:橡胶、塑料、涂料、粘合剂、润滑剂等, 可用作火箭、高速飞机等领域中耐油、耐高温或低温 的特种材料。
其他元素有机聚合物,包括高分子金属络合物,可用 作胶粘剂、阻燃剂、催化剂等。
金属有机聚合物在粘流态拉丝或制成其他形状,然后 高温裂解,可制得特定形状的陶瓷材料。用这种方法 已合成出有机碳硅烷--碳化硅纤维。
1917年,W.Schlenk从有机汞试剂出发,合成了烷
基锂试剂,并发展了金属有机化学实验中常用的 Schlenk 系列玻璃仪器及其相关操作
金属有机化学

有机金属化学是现代化学发展最迅速的领域之一,是无机化 学、配位化学和有机化学形成的交叉学科。100多年前制备的 Zeise盐(分子式为Na[PtCl3(C2H4)]),是人们在有机金属化学领域 迈出的第一大步。本世纪初,由W. Hieber所发展起来的过渡金 属羰基化合物, 进一步推动了有机金属化学的发展。五十年代 初,G. Pansan等合成出第一个环戊二烯类金属化合物—二茂 铁;随后,E. O. Fischer测定和描述了二茂铁的结构,即由上下 两个平行的环戊二烯与一个铁原子配位而形成的夹心结构。
1981 年 R. West 合成出含有稳定双键的化合物:(1,3,5−Me3C6H2)4Si2。
1981 年
Nobel 奖授予 R. Hoffmann 和 K. Fukui 以表彰它们在无机、有机、有机 金属化合物分子结构及其反应活性分子轨道理论处理上的成就,即等瓣 相似理论(isolobal analogies)。
1922年 T. Midgley和T. A. Boyd首先将Pb(C2H5)4作为抗震剂添 加到汽油中,促进了汽车工业的发展,同时也埋下了环境污 染的隐患。
1928年 W. Hieber系统地研究了过渡金属羰基化合物,奠定了 羰基化合物化学的基础。
1929年 F. A. Panth通过PbR4的热分解来获取有机自由基。
1909年 P. Ehrlich,化疗法的创始人,获Nobel奖
1917年 W. Schlenk制备了各种有机锂化合物,并发展了无水 无氧操作技术—Schlenk技术。
2 Li + R2Hg2 ⎯⎯→ LiR + Hg 2 EtLi + Me2Hg2 ⎯⎯→ MeLi + Et2Hg
1919年 F. Hein研究了CrCl3与PhMgBr的反应,得到了一种未 知的化合物。后来这种未知物测定为具有Sandwich结构 的化合物。
金属有机配合物

7-1 金属茂及其催化不对称合成
环戊二烯的负离子, 即 环戊二烯基叫茂, 记作 Cp-。 20 世纪初 ,Wilkinson 等人发现 Cp- 和 Fe2+ 反应生成 Cp2Fe, 叫铁 茂。
这类金属环戊二烯基化合物, 统称为金属茂。
金属茂化学蓬勃发展起来,开创了近代金属有机 化学的新时代。因此 ,Wilkinson 获得了 1973 年的诺贝尔化学奖。
第七章 金属有机配合物
定义:至少含有一个金属-碳键的化合 物称为金属有机配合物
范畴:无机化学和有机化学的交叉学科
金属有机化学研究的主要内容: 过渡金属和稀土元素配合物
金属有机化合物合成和结构多种多样;促进 了基础化学的发展
在工业、精细有机合成、催化剂、新型功 能材料的开发、生命科学等方面具有重要 意义。
➢ 通过围绕键的旋转而产生的分子中原子或基团在 空间的不同排列方式,称为构象。
➢ 其中较稳定的结构,称为该化合物的构象异构体。 ➢ 上下两个茂旋转,形成一系列构象,相对夹角为构象
角α ➢ α=0°为覆盖型 ➢ α =36°为交错型
绝大多数金属茂是交错型构象。
也发现有覆盖型的 , 如 (Me4Cp)2 Ru。
• Al(Me)3+H2O (MeAlO) n (11)
可作为聚合催化剂的金属茂的类型
(M=Ti,Zr,Hf;X=Cl,Br; R=Me)
大多数是柄型夹心化合物 , 是手性分子。这些分子比较刚 性 ,活性空位 ,手性源位置固定且比较接近。
最大的优点是:
结构一致性 , 从而导致催化活性位置的单一 , 这就保证了 催化聚合物的窄分子量分布,这是金属茂聚合物性能上优 于传统催化剂聚合物的原因。
开环夹心化合物又叫开环金属茂,与金属茂比 较 , 其配位体是戊二烯(7)的负离子-戊二烯
金 属 有 机 化 学

金属有机化学1.序言2.主族金属有机化学3.过渡金属有机化学4.稀土金属有机化学5.有机合成中的金属有机化学6.金属有机化学催化反应一、序言1. 定义:金属有机化学是研究含有金属-碳键的化合物的化学,包括合成、结构、反应性质及催化性能等。
其中金属包括硼、硅、砷等类金属。
严格区分:有机金属化合物 M -C金属有机化合物 M -O ,M -N ,M -C金属有机化学是无机化学和有机化学的交叉学科,既可以归属于无机化学,也可以归属于有机化学。
2. 发展史1760年 合成第一个金属有机化合物1827年 合成第一个过渡金属有机化合物(第一个含烯烃的金属有机化合物)Zeise’s 盐,Na[Pt(C 2H 4)Cl 3]1849年 E. Frankland 用氢气作保护气体3C 2H 5I + 3Zn → (C 2H 5)2Zn + C 2H 5ZnI + ZnI 21890年 第一个有工业应用价值的金属有机化合物Ni(CO)4,可用于提纯金属镍。
1901年 格氏试剂的发现,V . Grignard (1912年诺贝尔奖)RX + Mg → RMgX1919年 H. Hein, CrCl 3 + PhMgBr → Ph 2Cr1925年 Fischer-Tropsch 反应的发现,其机理的研究目前仍然是金属有机化学的一个重要研究领域,可能是先生成M -C 或者M =C 。
1938年 O.Roelen 发现氢甲酰化反应(Hydroformylation, oxo process)。
PdCl 2催化乙烯水合生成乙醛。
1938~1945年 Reppe 合成的发展CO + H 2 + CH 2=CH 2 → CH 3CH 2CHO1951年 二茂铁的发现 FeCl 2 + C 5H 5- → Fe(C 5H 5)2,导致烯烃-金属π络合物理论的提出。
1953年 Wittig 反应的发现,利用膦叶立德合成烯烃的方法1955年 Ziegler-Natta 催化剂的发现 MCl 3/AlR 3催化烯烃低压聚合 "Cadet's fuming liquid" [(CH 3)2A s]2O A s 2O 3 + 4CH 3COOK1956年H. C. Brown 硼氢化反应的发现,符合反马可夫尼可夫原则,R 2B 接在最少取代的碳原子上。
金属有机化合物

Fe(C2 H5 )2 Fe+ 2C2 H5 4 Fe 3O2 2 Fe2O3
400 C以上
2 RCH 2OOH+ Fe 2O3 2 RC H O+ 2 FeO+ 2 H 2O+ O 2 .4 FeO+ O 2 2 Fe 2O3
10
• 1951 英 T.J.Kaely 和 P.J.Pauson 与 美 ler 分 别 独 立 地 发 现 了 二 茂 铁 Fe(C5H5)2 , 第 二 年 G.Wilkinson 和 R.B.Woodward 等人提出了二茂铁的夹心 式结构(全新),从此,人们才对这类化合物 产生了兴趣。至今,在这类化合物中发现 了许多新结构、新键型,以及不同于经典 有机化学反应机理的新反应。
缺电子化合物 [Al(CH3)3] 2、[LiMe] 2、[BeMe2]x 熔沸点低、有挥发性(与分子量有关)
22
23
24
[LiMe]4
25
(3)含有π键的有机金属化合物 过渡金属与含π键的配体形成的 π配体 (定域 C2H4、 C2H2 ) (离域 C5H5、 C6H6 )
Zieglar试剂 包括烷基铝(R3Al), 烷基卤化铝(R2AlX,RAlX2),
烷基氢化铝( R2AlH,RAlH2 ),
烷基烷氧化铝( R2AlOR’,), 芳基铝、以及含N、S、P等有机铝。
9
④ 1951 合成夹心结构二茂铁 火箭燃料添加剂
RCH3 (烃) + O2 RCH2OOH(过氧化物)
11
⑤ 有机锡:二烷基锡: 聚氯乙烯和橡胶的稳定剂;
三烃基锡羧酸酯的3种可能的结构
可像C,4配位,有空d ,可5、6配位 C-Sn键易断,不对称,催化、助催化。 烯丙基锡与羧基化合物不对称加成。
《金属有机化学》作业

《金属有机化学》作业一选择题1.最早的哪个金属有机化合物是1827年由丹麦药剂师Zeise合成的。
()A. (CH3)4TiB. K[Pt(C2H4)Cl3]C. (CH3)2HgD. CH3MgCl2.二茂铁(C5H5)2Fe属于哪一类非经典键合的化合物?()A. M—C键中为缺电子型键B. M—C键中碳原子为π键电子给予体的多中心键化合物C. M—C键以夹心型键形成的π键化合物D. M—C键以σ—π配键形成的化合物3.烯烃和B—H键的加成遵循以下哪个规则?()A. Markovnikov规则B. 反Markovnikov规则C. Zaitsev规则D. 反Zaitsev规则4.下列有关烷基铝说法不正确的是()A.烷基铝化合物是缺电子化合物B.烷基铝化合物一般是强的Lewis酸C.当三烷基铝的烷基为烷氧基所取代后,烷基铝化合物的反应性即降低。
D.从烷基铝和烯烃的反应能得到有很长链的烷基的化合物5.Ni(CO)4的几何构型是()A.正四面体型 B. 正方锥型 C.八面体型 D. 三角锥型6.Si—C键的反应性一般比C—C键的反应性为()A. 大B. 小C. 相等D. 不确定7.下列采用sp3杂化轨道成键的是()A. Cr(CO)6B. Fe(CO)5C. Ni(CO)4D. [Ag(CN)2]-8.Fred属于下列哪类配合物?()A. 混合配体羰基金属配合物B. 单核全羰基金属配合物C. 双核羰基金属配合物D. 原子簇配合物9.炔烃配体配合物中炔配体提供给金属的电子数是()A.4B.3C.2D.110.下列不属于类环戊二烯基配体的是()A. B. C. D.11.IA族金属的烷基物和芳基物的活性正确的是()A. Li-R<Na-R<K-R<Rb-R<Cs-RB. Li-R<K-R<Na-R<Rb-R<Cs-RC. Cs-R<Rb-R<K-R<Na-R<Li-RD. Cs-R<Rb-R<Na-R<K-R<Li-R12.Ni(CO)4属于哪一类非经典键合的化合物?()A. M—C键中为缺电子型键B. M—C键中碳原子为π键电子给予体的多中心键化合物C. M—C键以夹心型键形成的π键化合物D. M—C键以σ—π配键形成的化合物13.铝氢化物中最重要的是氢化铝锂,LiAlH4是重要的()A.还原剂 B. 氧化剂C. 催化剂D.脱水剂14.Fe(CO)5的几何构型是( )A. 正四面体型B. 正方锥型C. 三角锥型D. 八面体型15.Si —C 键的反应性一般比C —C 键的反应性为( )。
(化学)金属有机化学

Na[ (C2H4)PtCl3 + NaCl
Pt(PPh3)4 + 2PhC CPh
(PPh3)2( PhC CPh )2 + 2PPh3
金属有机化合物的制备(V)
⑸ 小分子的配位反应:一些小分子化合物如CO、 CO2、N2、SO2、CS2等也可和金属进行配位:
(PEt3)2Pt(CH3)Cl + CO (CH3)Mn(CO)5 + CO*
满足电子构型要求,或者单核金属成分不能满足电 子构型要求,可以通过二聚体等各种方式达到电子 构型的要求,以达到稳定存在的目的。
金属有机化合物的制备(I)
⑴ 金属元素与烃类或卤代烃的反应:
Na + RC CH
RC CH + H2
2Al + 3H2 + 6CH CH
2(C2H5)3Al
RX + 2Li
(C2H5)2Hg + 2CH3Li
金属有机化合物的制备(IV)
⑷ 烯(炔)烃的插入反应和取代反应,烯烃或
炔烃可以通过插入金属与氢或金属与碳之间的键 中或取代某个配体而生成新的配位化合物:
(PEt3)2Pt(H)Cl + CH2 CH2
(PEt3)2Pt(C2H5)Cl
Na2PtCl4 + CH2 CH2
(PEt3)2Pt(COCH3)Cl (CH3CO)Mn(CO)4CO*
金属有机化合物的制备(VI)
⑹ 分解反应:酰基、羰基、芳基磺酸基和重氮化合物等都
可以发生分解反应脱去一分子小分子得到新的金属有机化
合物。
N2Cl
HgCl
+ HgCl2
COCl
+ N2
化学中的金属有机化学

化学中的金属有机化学金属有机化学是一门研究金属和有机化合物之间相互作用的学科,也被称为金属有机合成化学。
它研究的对象包括有机金属化合物、烷基金属化合物、金属簇化合物、金属配合物等,这些化合物在化学合成中具有重要的应用价值。
一、有机金属化合物有机金属化合物指的是含有金属-碳键的化合物。
常见的有机金属化合物有乙二醇铜、四乙基铅、二茂铁等。
有机金属化合物的特点是:化学性质活泼,易于发生反应;物理性质稳定,具有一定的热稳定性和溶解性;结构复杂,分子量较大。
有机金属化合物的应用非常广泛。
它们可以用于有机合成反应,例如羰基还原、烯烃和炔烃的加成反应、卤代烃的交换反应等。
此外,有机金属化合物还可以用于材料化学、电子化学、生物化学等领域。
例如,有机金属化合物可被用作催化剂,例如钯和铂等金属的有机化合物常常用于重要的催化反应,如膦化物的交叉偶联。
二、烷基金属化合物烷基金属化合物指的是含有金属与烷基(CnHm)基团形成的化合物。
常见的烷基金属化合物有四甲基锡、三甲基铝、四乙基锡等。
这些化合物的分子结构呈现出极高的对称性,因此在配位作用和催化反应中具有独特的优势。
烷基金属化合物通过取代反应、加成反应和还原反应来发挥其作用。
其中,烷基锡化合物和烷基铝化合物是广泛应用的反应性分子。
它们也可被用作还原剂,例如四甲基锡和三甲基铝常常被用于合成空气敏感材料。
此外,烷基金属化合物也经常在医药领域应用。
三、金属簇化合物金属簇化合物指的是含有多个金属原子形成的团簇化合物。
常见的金属簇化合物有四面体八面体簇、六面体簇、环簇、桥烷簇等。
这些团簇化合物具有独特的物理性质和化学性质。
金属簇化合物有着广泛的应用领域,例如当它们与选择性催化剂配合时,可以用于各种催化反应,如的格氏反应和羰基化反应等。
此外,金属簇化合物还可应用于电子学等领域。
四、金属配合物金属配合物指的是由金属与配体形成的稳定配合物。
常见的金属配合物包括铁萘固定剂、铜(II)茂配合物、钙离子配合物等。
金属有机化学-张涛
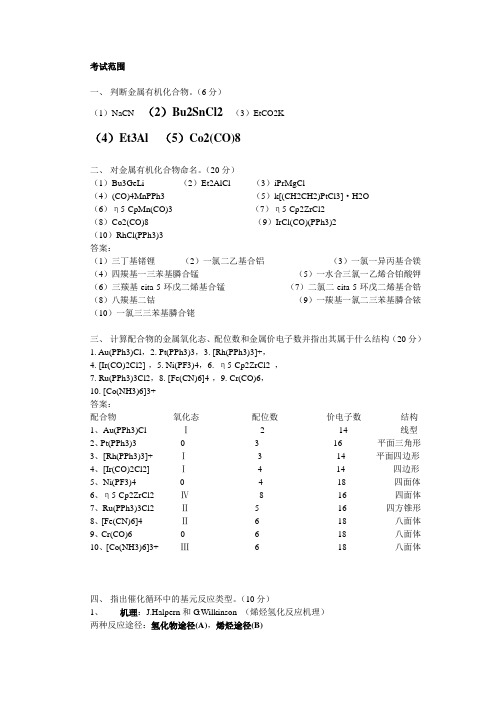
考试范围一、判断金属有机化合物。
(6分)(1)NaCN (2)Bu2SnCl2(3)EtCO2K(4)Et3Al(5)Co2(CO)8二、对金属有机化合物命名。
(20分)(1)Bu3GeLi (2)Et2AlCl (3)iPrMgCl(4)(CO)4MnPPh3 (5)k[(CH2CH2)PtCl3]·H2O(6)η5-CpMn(CO)3 (7)η5-Cp2ZrCl2(8)Co2(CO)8 (9)IrCl(CO)(PPh3)2(10)RhCl(PPh3)3答案:(1)三丁基锗锂(2)一氯二乙基合铝(3)一氯一异丙基合镁(4)四羰基一三苯基膦合锰(5)一水合三氯一乙烯合铂酸钾(6)三羰基-eita-5-环戊二烯基合锰(7)二氯二-eita-5-环戊二烯基合锆(8)八羰基二钴(9)一羰基一氯二三苯基膦合铱(10)一氯三三苯基膦合铑三、计算配合物的金属氧化态、配位数和金属价电子数并指出其属于什么结构(20分)1. Au(PPh3)Cl,2. Pt(PPh3)3,3. [Rh(PPh3)3]+,4. [Ir(CO)2Cl2]-,5. Ni(PF3)4,6. η5-Cp2ZrCl2 ,7. Ru(PPh3)3Cl2,8. [Fe(CN)6]4-,9. Cr(CO)6,10. [Co(NH3)6]3+答案:配合物氧化态配位数价电子数结构1、Au(PPh3)Cl Ⅰ 2 14 线型2、Pt(PPh3)3 0 3 16 平面三角形3、[Rh(PPh3)3]+ Ⅰ 3 14 平面四边形4、[Ir(CO)2Cl2]- Ⅰ 4 14 四边形5、Ni(PF3)4 0 4 18 四面体6、η5-Cp2ZrCl2 Ⅳ8 16 四面体7、Ru(PPh3)3Cl2 Ⅱ 5 16 四方锥形8、[Fe(CN)6]4- Ⅱ 6 18 八面体9、Cr(CO)6 0 6 18 八面体10、[Co(NH3)6]3+ Ⅲ 6 18 八面体四、指出催化循环中的基元反应类型。
金属有机化学

1953-5年齐格勒(K.Ziegler)发现 TiCl4/Et3Al体系在低压催化乙烯聚合反应。 纳塔(G.Natta)将此体系用于丙烯或二 烯烃聚合催化剂,得到等规聚合物。他 们的工作开创了现代聚烯烃工业的新纪 元,同时有力地推动了金属有机化学的 发展。
宝库。现在人们称镁有机化合物为格林雅试 剂(Grignard Reagent)。镁有机化合物同有机 化合物的反应称为格林雅反应(Grignard Reaction)。为此,1912年他获得诺贝尔化学 奖。这是第一个获诺贝尔奖的金属有机化学 家。
1922年:T.Midgley T.A. Boyd Pd(C2H5)4作为汽 油中的抗震剂。
1891年:L.Mond和M.Berthelot,Fe(CO)5 的合成
Fe + CO 250。C 压
Fe(CO)5
1899年法国化学家巴比尔(P.Barbier)和格林雅 (V. Grignard)在研究锌有机化合物基础上, 发 现了镁有机化合物RMgX并将它用于有机合 成。由于他及以后百余年各国化学家的努力, 形成了用镁有机化合物进行有机合成的巨大
近50年以来,金属有机化学发展极为迅 速,已逐渐成为介于无机化学,有机化 学,结构化学,量子化学,催化科学, 物理有机,高分子化学,立体化学等学 科的内容广泛的边缘学科,成为当前化 学领域的最热门领域和最前沿学科。
1827年:丹麦化学家(药剂师)W.C.Zeise制得了 世界上第一个金属有机化合物,称之为Zeise盐。 当时人们不知道它是什么结构,后来才知道,这 是铂和乙烯的配合物K[Pt(CH2=CH2)Cl3]。这个化 合物长期以来未被人们注意。
金属有机化学教案7

第十一章 烯和炔络合物
Alkenes act as neutral 2e donors (per C=C double bond). Due to the presence of empty π* antibonding orbitals, there is the possibility of some π-backbonding:
So electron-rich that it transfers two electrons to the butadiene via the π-backdonation and generates a metallocyclopentene resonance structure, shown schematically to the right. Electronic effects with alkenes can often be somewhat easily monitored using infrared (IR) spectroscopy, much as with CO ligands. The more π-backbonding, the weaker the C=C double bond and the lower the C=C stretching frequency in the IR. The table shows a series of alkene compounds with differing amounts of σ-donation and π-backbonding.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钼络合物催化的烯烃环氧化反应的历程
5. 不对称环氧化反应
• 首次报道的不对称环氧化反应是用钼和e
50% e.e
• 利用钼的手性过氧络合物MoO5L*(L*=手性配 体)对简单烯烃进行不对称环氧化时,得到 30%e.e的光学产率。
Sharpless环氧化
1980年,Sharpless的出色工作,使不对称环氧化反应得到 了优异的结果。他们以烯丙醇为底物,叔丁基过氧化氢为 氧化剂,四异丙氧基钛为催化剂,用光学活性酒石酸作为 不对称诱导试剂,进行环氧化反应,光学产率在90%以上。
H DO C H2C (A) H Pd DO CH CH2 (B) H Pd O CH CH3 D Pd (C) O
0 + CH + Pd + H
CH3
DO
CH CH2
CH2DCHO
以重水为溶剂时,产物中没有检出氘代物,否认了由 A还原消除生成乙烯醇再转化成乙醛的路线。
2. 其它烯烃的氧化反应
H 2O CH2 CH2 H Pd HO C H2 C H Pd + H+
顺-1,2-二氘乙烯的钯配合物与H2O/CO的反应产物为反-2,3二氘-β-丙酸内酯
反-1,2-二氘乙烯反应生成β-氯乙醇的产物是苏式异构体。
羟乙基钯络合物经过1,2-位移,由β-羟基烷基络合物(A) 异构化为α-羟基烷基络合物(C)。
CH2
CH2 + 1/2O2
CH3CHO
这个化学工艺,比以往的方法优越得多
过去的方法:
1). 电石法:
CaC2 CH CH + H2O HgSO4 CH3CHO
乙炔不及乙烯来源丰富和价廉,硫酸汞有污染问题。 2). 乙烯水化或粮食发酵
CH3CH2OH + 1/2O2
CH3CHO
该法是先将乙烯水化为乙醇,然后再氧化,是两步过程。 所以,Wacker法更为经济。
从而开创了一个很有价值的新的化学过程。
3). 氯化亚铜氧化生成氯化铜
为了使其成为一个完整的催化体系,可以很容易地利用水溶 液中的空气将氯化亚铜氧化成为氯化铜。
2 CuCl + 1/2 O2 + 2HCl
2 CuCl2 + H2O
若将以上三个方程式加合起来,最终结果就是空气中的氧使 乙烯氧化为乙醛:
这是化学计量反应,早在1894年F.C.Phillips就作了报道,并将 此反应应用到Pd的分析上。
2). Pd(0)重新氧化成Pd(Ⅱ)
Smidt发现,在反应中加入CuCl2可以将Pd(0)重新氧化生成 Pd(Ⅱ),从而使一个化学计量反应变为催化反应。
Pd(0) + 2CuCl2 + 2ClPdCl42- + 2CuCl
机理:
HO * O HOR Ti O O * O * Ti O O O * * Ti OR OR t-BuOOH OH *
O * Ti O O *
*
* O Ti O O * * * O Ti O * O*
6. 脱氢反应
• 钌络合物催化剂RuCl2(PPh3)3和叔胺氧化物可以 使伯醇或仲醇脱氢分别生成醛或酮。
N-甲基吗琳-N-氧化物是钌的再次氧化剂(reoxidation)。
• 氯化钯也能够把仲醇氧化成酮,O2是再次氧化剂。
可能的脱氢机理
习题
• 写出下列反应的机理
1. Wacker法制备乙醛的反应机理 2. 以烷基过氧化氢为氧化剂,钼酸酯为催化剂 的烯烃环氧化反应机理
Wacker法反应机理
O H HO CH CH2 CH2 CH2OH Pd2+ CH2 H
+
H Pd2+
HC
Pd
CH3CHO
CH3 Pd0 Pd2+ Pd2+ Cu2+ Cu+ H2O 1/2 O2
CH2 H 2O
CH2=CH2
H2O或OH-对烯烃的亲核进攻是从外侧过来发生反式加成 反应,π络合物转化为σ络合物
• 催化反应的结果:
CH2=CH2 + HOAc + 1/2O2 CH2=CHOAc + H2O
CH2=CHOAc H2C CHOAc Pd+ H HPdX HX AcO CH2 H2C Pd+ H+ HOAc CH2 CH2 Pd2+ CH2=CH2 Pd0 Pd2+ Cu2+ Cu+ H2 O 1/2O2 + 2H+
R1、R2是环的一部分时,反应生成环扩大的酮。
Wacker 反应在有机合成上有广泛应用,例如:由烯烃合成二氢 茉莉酮:
PdCl2/CuCl2 O2 O
O PdCl2/CuCl2 O
O OH 二氢茉莉酮
Br
O2
O
3. 烯烃的乙酸基化反应
与乙烯氧化生成乙醛的Wacker反应类似,乙烯在醋酸中与 钯盐反应生成乙酸乙烯酯
O D-( )-酒石酸二乙酯(非天然的) -
R2 R R
3 1
ButOOH, DET i (CH3)3COOH, Ti(OPr )4 CH2Cl2, 20℃ R3
R2 O * * R1
OH
OH
O
L-(+)-酒石酸二乙酯(天然的) DET
产率:70-87% ≥ 90% e.e.
优点: 1. 一次可以引进两个手性中心。 2. 手性源是酒石酸酯,通过选用天然的,或非天然的酒石酸酯, 可以实现不同的对映面选择性。 3. 反应操作简单,产率高。 4. e.e.值优异。 缺点:1. 限于烯丙醇体系,2. 反应比较缓慢。
α-烯烃被氧化生成醛或酮,除苯乙烯外,酮 是主要产物。
RCH=CH2 PdCl42H2O RCOCH3 + RCH2CHO
Wacker反应具有选择性,同时具有链端和链 中双键时,只氧化链端双键。
对于1,1-二取代烯烃,取代基发生迁移得到重排产物。
R1 C CH2 R2 O R1C CH2R2
CH2=CH2 + PdCl2 + HOAc CH2=CHOAc + Pd(0) + 2HCl
零价钯被CuCl2氧化,重新得到二价钯盐,
Pd(0) + 2CuCl2 + 2ClPdCl42- + 2CuCl
生成的CuCl被氧气或空气中的氧所氧化,重新得到CuCl2,
2 CuCl + 1/2 O2 + 2HCl 2 CuCl2 + H2O
3-羟基环己烯能与过渡金属催化剂配位,它的反应速度是环己烯的 200倍。
醇羟基与过渡金属形成特定的络合物,从而使烯丙醇 的环氧化反应具有很高的区域选择性。
反应中总是生成顺式环氧化产物。
• 分子中若同时含有烯丙醇C=C双键和一般C=C 双键时,环氧化反应将优先发生在烯丙醇的双键 上。
当烯丙醇双键周围的空间障碍很大时,环氧化反应可能发生 在远离羟基的孤立双键上。
第七章 烯烃的氧化反应
将烯烃氧化为醇、醛或环氧化物是均相催化反应在 工业上的重要应用。
1.Wacker 法合成乙醛
此法由西德Wacker-Chemie公司的J.Smidt于50年代末发现的, 它包括了三个分反应:
1). 乙烯被Pd(Ⅱ)盐在水溶液中氧化为乙醛
PdCl42- + C2H4 + H2O CH3CHO + Pd(0) + 2HCl + 2Cl
4. 烯烃的环氧化反应
过氧酸与烯烃的环氧化反应
O C C + RCOOOH C C + RCOOH
过渡金属络合物催化下,烷基过氧化氢ROOH 选择性氧化烯烃
催化剂:Mo、V、W、Ti等高氧化态的过渡金属络合物
• 环氧化反应的速度随烯烃取代基的增多而增大
利用VO(acac)2和ButOOH进行环氧化反应时, α-位有双键 的烯烃反应速度明显加快。
