武汉科技大学物理化学下册练习册答案
物理化学(下)答案(完整版)

第七章 电化学7.1 用铂电极电解CuCl 2溶液。
通过的电流为20A ,经过15min 后,问:(1)在阴极上能析出多少质量的Cu?(2)在的27℃,100kPa 下阳极上能析出多少体积的的Cl 2(g )?解:电极反应为:阴极:Cu 2+ + 2e - → Cu 阳极: 2Cl - -2e - → Cl 2(g ) 则:z= 2 根据:Q = nzF =It()22015Cu 9.32610mol 296500It n zF -⨯===⨯⨯ 因此:m (Cu )=n (Cu )× M (Cu )= 9.326×10-2×63.546 =5.927g 又因为:n (Cu )= n (Cl 2) pV (Cl 2)= n (Cl 2)RT因此:3223Cl 0.093268.314300Cl 2.326dm 10010n RT Vp ⨯⨯===⨯()() 7.2 用Pb (s )电极电解PbNO 3溶液。
已知溶液浓度为1g 水中含有PbNO 3 1.66×10-2g 。
通电一定时间后,测得与电解池串联的银库仑计中有0.1658g 的银沉积。
阳极区的溶液质量为62.50g ,其中含有PbNO 31.151g ,计算Pb 2+的迁移数。
解法1:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。
显然阳极区溶液中Pb 2+的总量的改变如下: n 电解后(12Pb 2+)= n 电解前(12Pb 2+)+ n 电解(12Pb 2+)- n 迁移(12Pb 2+)则:n 迁移(12Pb 2+)= n 电解前(12Pb 2+)+ n 电解(12Pb 2+)- n 电解后(12Pb 2+)n 电解(12Pb 2+)= n 电解(Ag ) =()()3Ag 0.16581.53710mol Ag 107.9m M -==⨯223162.501.1511.6610(Pb ) 6.15010mol 12331.22n -+--⨯⨯==⨯⨯解前()电2311.151(Pb ) 6.95010mol 12331.22n +-==⨯⨯解后电n 迁移(12Pb 2+)=6.150×10-3+1.537×10-3-6.950×10-3=7.358×10-4mol()242321Pb 7.358102Pb 0.4791 1.53710(Pb )2n t n +-+-+⨯==⨯移解()=迁电解法2:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。
物理化学课后(下册)部分习题答案

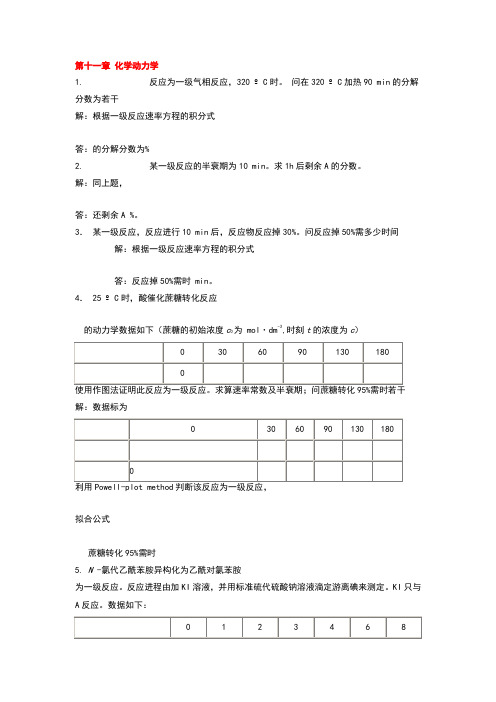
第十一章化学动力学1. 反应为一级气相反应,320 ºC时。
问在320 ºC加热90 min的分解分数为若干?解:根据一级反应速率方程的积分式答:的分解分数为11.2%2. 某一级反应的半衰期为10 min。
求1h后剩余A的分数。
解:同上题,答:还剩余A 1.56%。
3.某一级反应,反应进行10 min后,反应物反应掉30%。
问反应掉50%需多少时间?解:根据一级反应速率方程的积分式答:反应掉50%需时19.4 min。
4. 25 ºC时,酸催化蔗糖转化反应的动力学数据如下(蔗糖的初始浓度c0为1.0023 mol·dm-3,时刻t的浓度为c)0 30 60 90 130 1800 0.1001 0.1946 0.2770 0.3726 0.4676 解:数据标为0 30 60 90 130 1801.0023 0.9022 0.8077 0.7253 0.6297 0.53470 -0.1052 -0.2159 -0.3235 -0.4648 -0.6283拟合公式蔗糖转化95%需时5. N -氯代乙酰苯胺异构化为乙酰对氯苯胺为一级反应。
反应进程由加KI溶液,并用标准硫代硫酸钠溶液滴定游离碘来测定。
KI只与A反应。
数据如下:0 1 2 3 4 6 849.3 35.6 25.75 18.5 14.0 7.3 4.6解:反应方程如下根据反应式,N -氯代乙酰苯胺的物质的量应为所消耗硫代硫酸钠的物质的量的二分之一,0 1 2 3 4 6 84.930 3.560 2.575 1.850 1.400 0.730 0.4600 -0.3256 -0.6495 -0.9802 -1.2589 -1.9100 -2.3719。
6.对于一级反应,使证明转化率达到87.5%所需时间为转化率达到50%所需时间的3倍。
对于二级反应又应为多少?解:转化率定义为,对于一级反应,对于二级反应,7.偶氮甲烷分解反应为一级反应。
物理化学下册课后习题答案

物理化学下册课后习题答案
《物理化学下册课后习题答案》
在物理化学下册的课程中,学生们经常需要完成大量的习题来巩固所学的知识。
习题答案不仅能够帮助学生检验自己的学习成果,还可以帮助他们更好地理解
课程内容。
在这篇文章中,我们将为大家提供一些物理化学下册课后习题的答案,并探讨一些相关的学习方法和技巧。
1. 请解释化学反应速率的概念,并给出速率常数的定义。
答案:化学反应速率是指单位时间内反应物消耗或生成物产生的量。
速率常数
是指在一定温度下,反应物浓度为单位的情况下,反应速率的比例常数。
2. 什么是化学平衡?请列举一些影响化学平衡的因素。
答案:化学平衡是指在闭合系统中,反应物和生成物的浓度达到一定比例时,
反应速率相等的状态。
影响化学平衡的因素包括温度、压力、浓度和催化剂等。
3. 请解释氧化还原反应的概念,并给出一个例子。
答案:氧化还原反应是指在反应中,氧化剂和还原剂之间电子的转移。
一个典
型的例子是铁的氧化反应:Fe + O2 → Fe2O3。
通过这些习题的答案,我们可以看到物理化学下册的知识点涉及到了化学反应
速率、化学平衡和氧化还原反应等内容。
在学习这些知识点时,学生们可以通
过多做习题来巩固所学的知识,并且要注意掌握相关的概念和定义。
此外,还
可以通过实验来加深对这些知识点的理解,从而更好地掌握物理化学下册的知识。
物理化学(下)_武汉大学中国大学mooc课后章节答案期末考试题库2023年

物理化学(下)_武汉大学中国大学mooc课后章节答案期末考试题库2023年1.对于金属Fe的防腐措施中,下列哪一种不能发挥作用()答案:使Fe与金属Cu相连2.气固相反应 CaCO3(s)=CaO(s) + CO2(g) 已达平衡。
在其它条件不变的情况下,若把 CaCO3(s) 的颗粒变得极小,则平衡将:()答案:向右移动3.在平行反应中要提高活化能较低的反应的产率,应采取的措施为: ( )答案:降低反应温度4.化学动力学是物理化学的重要分支,它主要研究反应的速率和机理。
下面有关化学动力学和化学热力学的陈述中不正确的是( )答案:化学动力学不涉及状态函数的问题5.反应A─→2B在温度T时的速率方程为 d[B]/d t=k B[A],则此反应的半衰期为:( )答案:2ln 2/k B6.反应 2I-+H2O2→I2+2H2O 的速率方程为 r=k[I-][H2O2], 又知其反应历程为:I-+H2O2→IO-+2H2O I-+IO-→I2+2H2O则对反应 2I-+H2O2→I2+2H2O来说:( )答案:反应级数为2,不存在反应分子数7.一级反应完成99.9%所需时间是完成50%所需时间的多少倍( )答案:108.某一反应只有一种反应物,其转化率达到75%的时间是转化率达到50%的时间的3倍,反应转化率达到64%的时间是转化率达到x的时间的两倍,则x为( )。
答案:47%9.根据范特霍夫经验规则,一般化学反应,温度每上升10℃其反应速率约增大为原来的2~4倍,对于在298K(指室温)左右服从此规则的化学反应,其活化能(单位:kJ/mol)的范围约为( )答案:50~10010.基元反应A+B-C→A-B+C的摩尔反应焓变△rHm>0,B-C键的键能为εB-C,A-B键的键能为εA-B, A为自由基,则反应活化能等于( )。
答案:△rHm +0.055×LεA-B11.简单碰撞理论属基元反应速率理论,以下说法不正确的是: ( )答案:从理论上完全解决了速率常数的计算问题12.根据过渡态理论, Arrhenius公式中的指前因子与以下哪一个因素有关( )。
武科大物理化学习题答案公开课一等奖优质课大赛微课获奖课件

3.3 熵与克劳修斯不等式 1.判断下列过程熵改变情况 1)熵增; 2)熵减; 3)熵增; 4)熵减; (5) 熵增。 2. 选择题 (1)b 3. 简答题 (1)绝热可逆过程熵变等于零,绝热不可逆膨胀过程 熵变不小于零,绝热不可逆压缩过程熵变不小于零。 (2)不能,由于绝热不可逆过程熵变不小于零,绝热 可逆过程熵变等于零。
m fus H 1
m2C
p
In
T T2
16.52J
K 1
第8页
3.5 热力学第三定律和化学改变过程熵变计算 3.6 亥姆赫兹函数和吉布斯函数
1. 简答题
(1)(a) U 0, H 0
(b) S 0 (c) U 0 (d) G 0
(e) U 0, H 0, S 0, A 0, G 0
(a)下面表示水蒸气压与温度关系方程式中A和B值。 (b)在此温度范围内水摩尔蒸发焓。 (c)在多大压力下水沸点为105℃。
解:(1)将两个点代入方程得
(2)依据克-克方程
(3)
第16页
力下水蒸气。设计可逆路径,并按可逆路径分别求过程S及G。
第11页
5. (天大教材p148,习题3.40)已知化学反应CH4(g)+CO2(g)=2CO(g)+2H2(g):
1)利用附录中各物质数据
,求上述反应在25 °C时
;
2)利用附录中各物质原则摩尔生成吉布斯函数数据,计算上述反应在25 °C时原则摩尔反应吉布斯函数变数据;
解:将过程看作恒压绝热过程
Q 0, H QP 0 1kg, 25C的水降温至0C,放出的热量为
QP m2Cp (273.15 T2 ) 104.6kJ
武科大物理化学(二)习题册

8
学院 §7.11 极化作用
专业班级
姓名
学号
1. 不论是电解池还是原电池,极化的结果都将使阳极电势
。
A. 变大
B. 变小
C. 不发生变化 D. 变化无常
2. 随着电流密度的增加,原电池的端电压__________ 。
A.不变
B.减少
C.增加
D.不确定
3. 298K,0.1 mol dm-3的HCl溶液中氢电极的热力学电势为-0.06 V,电解此溶液时,氢在
温度时,气液界面张力
(>0,<0,或=0)。
3、同温度下,固体冰的表面张力和水的表面张力,哪个大?
4、矿泉水的表面张力和水的表面张力,哪个大?
5、乙醇的表面张力和水的表面张力,哪个大?
6、气相中相邻的大小液泡相碰, 两泡将发生的变化是
。
(A) 大泡变大, 小泡变小
(B) 大泡变小, 小泡变大
(C) 大泡、小泡均不变
已知电池电动势E与温度T的关系为:E /V = 0.0694 + 1.881×10-3 T / K-2.9×10-6 ( T / K)2 (1) 分别写出该电池的电极反应式和电池反应式;
(2) 计算 25 oC时,该电池的电动势E 及电动势的温度系数 (∂E / ∂T ) ; p
(3) 计算 25 oC, z = 1 时, 该电池反应的△rSm、△rHm、△rGm 及电池恒温可逆放电时该 反应过程的热Qr,m 。
在 25 oC时电动势为 0.9647 V,电动势的温度系数为 1.74×10-4 V·K-1。
(1) 写出电池反应;
(2)计算 25 oC时该反应的△rSm、△rHm、△rGm,及电池恒温可逆放电时该反应的Qr,m。
物理化学课后下册部分习题答案
第十一章化学动力学1. 反应为一级气相反应,320 ºC时。
问在320 ºC加热90 min的分解分数为若干解:根据一级反应速率方程的积分式答:的分解分数为%2. 某一级反应的半衰期为10 min。
求1h后剩余A的分数。
解:同上题,答:还剩余A %。
3.某一级反应,反应进行10 min后,反应物反应掉30%。
问反应掉50%需多少时间解:根据一级反应速率方程的积分式答:反应掉50%需时 min。
4. 25 ºC时,酸催化蔗糖转化反应的动力学数据如下(蔗糖的初始浓度c0为mol·dm-3,时刻t的浓度为c)解:数据标为拟合公式蔗糖转化95%需时5. N -氯代乙酰苯胺异构化为乙酰对氯苯胺为一级反应。
反应进程由加KI溶液,并用标准硫代硫酸钠溶液滴定游离碘来测定。
KI只与A反应。
数据如下:解:反应方程如下根据反应式,N -氯代乙酰苯胺的物质的量应为所消耗硫代硫酸钠的物质的量的二分之一,。
6.对于一级反应,使证明转化率达到%所需时间为转化率达到50%所需时间的3倍。
对于二级反应又应为多少解:转化率定义为,对于一级反应,对于二级反应,7.偶氮甲烷分解反应为一级反应。
287 ºC时,一密闭容器中初始压力为 kPa,1000 s后总压为 kPa,求。
解:设在t时刻的分压为p,1000 s后,对密闭容器中的气相反应,可以用分压表示组成:8.硝基乙酸在酸性溶液中的分解反应为一级反应。
25 ºC, kPa下,于不同时间测定放出的CO2(g)的体积如下解:设放出的CO2(g)可看作理想气体,硝基乙酸的初始量由时放出的CO2(g)算出:在时刻t, 硝基乙酸的量为,列表得到。
9.某一级反应,初始速率为,1 h后速率为。
求和初始浓度。
解:一级反应的速率方程10.现在的天然铀矿中。
已知的蜕变反应的速率常数为,的蜕变反应的速率常数为。
问在20亿年()前,等于多少(a是时间单位年的符号。
武汉科技大学物理化学练习册答案

第四章 多组分系统热力学4.1 偏摩尔量1.选择填空题(1)b 、d(2)d化学势就是吉布斯自由能对成分的偏微分,化学势又称为偏摩尔势能。
偏摩尔量是系统的强度性质。
(3) ∑∑=αβααμ0)()dn (B B(4)0.79dm 3.mol -1(5)>4.3 气体组分的化学势1.<4.5 拉乌尔定律和亨利定律1.选择填空题(1)C(2)拉乌尔 溶剂B 的饱和蒸汽压;亨利 溶质B 的亨利常数2.20℃下HCl 溶于苯中达到平衡,气相中HCl 的分压为101.325kPa 时,溶液中HCl 的摩尔分数为0.0425。
已知20℃时苯的饱和蒸汽压为10.0kPa ,若20℃时HCl 和苯的蒸汽压为101.325kPa ,求100g 苯中溶解多少克HCl?解:HCl 在苯中的溶解符合亨利定律,即:P(HCl)=k 亨利. x Bk 亨利=p(HCl)/ x B =101.325/0.0425=2384.12kPax(HCl)=p(HCl)/ k 亨利=(101.325-10)/2384.12=0.0383设100g 苯中溶解m 克HCl ,其中苯的分子量为78克/摩尔,HCl 的分子量为36.5克/摩尔,则:0383.07810036.5m 36.5m=+ 解之得:m=1.859g 4.6 理想液态混合物1.选择填空题(1)=0, = 0,>0,<02.80℃时纯苯的蒸汽压为100kPa ,纯甲苯的蒸汽压为38.7kPa ,两液体可形成理想溶液,若有苯-甲苯的气液平衡混合物,80℃时气相中苯的摩尔分数y(苯)=0.300,求液相组成。
解:根据拉乌尔定律3.液体B与C可形成理想液态混合物。
在常压及25℃下,向总量n=10mol,组成为x C=0.4的B,C液态混合物中加入14mol的纯液体C,形成新的混合物,求该过程的△G,△S?解:理想液态混合物中组分B的化学势为因此,新混合物的组成为所以:4.8 活度及活度因子1.选择填空题(1)当溶液中溶质采用不同浓标时,溶质的化学势相同;溶质的活度不相同;溶质的活度因子不相同;4.9 稀溶液的依数性1.现有蔗糖(C12H22O11)溶于水形成某一浓度的稀溶液,其凝固点为-0.200℃,计算此溶液在25℃时的蒸汽压。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
武科大物理化学习题解答(下册)第七章 电化学7.1 电解质溶液的导电机理及法拉第定律 1. 阳极; 阴极; 正极; 负极 2. C7.3 电导、电导率和摩尔电导率 1. 0.02384 s.m 2.mol -1解:(1)电导池系数11-cell 3904.125453m 0.2768s )()(k -=Ω⨯•=⨯=mKCl R KCl k(2)CaCl 2溶液的电导率11221194.010503904.125)()k(CaCl --•=Ω==m s m CaCl R k cell(3)CaCl 2溶液的摩尔电导率CaCl 2溶液的浓度:351000111555.0-•=⨯m mol 1231222m 0239.051194.0)()()(---••=••==Λmolm s m mol m s CaCl c CaCl k CaCl解:由7.3.2可知:124m109.61)(--+∞••⨯=molm s Ag λ124m101.78)(---∞••⨯=mol m s Br λ 则:124m 10140)(--∞••⨯=mol m s AgBr λAgBr 的溶解度34131096.71034.6---•⨯=⨯==m mol k c sp164410144.11 101401096.7)()(----∞•⨯=⨯⨯⨯=⋅=ms AgBr c AgBr k mλ得饱和水溶液的电导率为:16210644.16)k(H k(AgBr)(--•⨯=+=m s O k 溶液)7.4 电解质溶液的平均离子活度因子及德拜-休克尔极限公式 1. 1.8mol/kg 2. 0.7503. 0.175mol/kg4. NaCl>MgCl 2>MgSO 45. C6. 4)(±α 7. 10b7.5 可逆电池及其电动势的测定 1. D 2. B7.6 原电池热力学 1. C 2. A3. Zn ︳Zn 2+(a=1) ‖H+(a=1)|H 2( g,P θ)|pt221)2()1(r 21)(K 2 E θθθθθθK G G E m r m =∆=∆=4. 解:(1)写出电极反应阳极: Pb+SO 42-=PbSO 4+2e - 阴极: Hg 2SO 4+2e -=2Hg+SO 42-电池总反应:Pb+Hg 2SO 4=PbSO 4+2Hg (2)有关热力学数据计算114r 582.331074.1965002)(---•=⨯⨯⨯=∂∂=∆K mol J TEZF S P m 11871.1869647.0965002-•=⨯⨯-=-=∆mol kJ ZFE G m r11746.176-•-=∆+∆=∆mol kJ S T G H m r m r m r1m 0125.10-•=∆=mol kJ S T Q m r r 、解:(1)电池反应阳极反应:H 2=2H ++2e -阴极反应:Hg 2Cl 2+2e -=2Hg+2Cl - 电池反应:H 2+ Hg 2Cl 2= 2Hg+2HCl(2)温度系数及电动势KV T P /101.5173 15.298109.2210881.1 109.2210881.1T E 4-6363⨯=⨯⨯⨯-⨯=⨯⨯-⨯=∂∂----)(0.3724V15.298109.215.298101.8810.0694E 26-3=⨯⨯-⨯⨯+=-(3) 相关热力学数据计算114r 641945.14105173.1965001)(---•=⨯⨯⨯=∂∂=∆K mol J TEZF S P m1.9366353724.0965001-•-=⨯⨯-=-=∆mol kJ ZFE G m r15711.31-•-=∆+∆=∆mol kJ S T G H m r m r m r1m 65.3441945.6145.1298-•=⨯=∆=mol kJ S T Q m r r 、解:(1)电极反应及电池反应 阳极:Ag+Cl -=AgCl+e -阴极:Hg 2Cl 2+2e -=2Hg+2Cl -总反应:2Ag+ Hg 2Cl 2=2AgCl+2Hg(2)Z=1时,对应的电极反应为 Ag+1/2 Hg 2Cl 2=AgCl+Hg 该反应相应的:11-r mol 33.15J 2/18.19555.422.964.77-••=⨯--+=∆KS m θ148367.4100015.3315.2984.5 -•-=÷⨯-=∆-∆=∆mol kJ S T H G mr m r m r θθθ(3) 电动势和温度系数VZF G E mr 046463.0965001100048367.4=⨯⨯-=-∆=θθP m TE ZF S )(r ∂∂=∆KV ZF S T E m P /104352.3 96500115.33)(4r -⨯=⨯=∆=∂∂解:阳极H2=2H++2e-阴极Hg2Cl2+2e-=2Hg+2Cl-电池总反应:H2+ Hg2Cl2=2Hg+2HClθθpHpHClaFRT)()(ln2EE22-=解:电池反应++++=+224SnZn SnZn)()()(ln2EE422+++⋅-=SnaSnaZnaFRTθ解:阳极Ag+Cl-(b1)=AgCl+e-阴极AgCl+e-=Ag+Cl-(b2)电池反应:Cl-(b1)=Cl-(b2)12lnFRT-Ebb=解:阳极H2=2H+(b)+2e-阴极Cl2+2e-=2Cl-(b)电池总反应:H2 +Cl2=2H+(b)+ 2Cl-(b)对应的nernst 方程为:)()(lg 05917.0E 1)()H (ln2E E 22-+-+⋅-=⋅-=Cl H Cl a a F RT ααθθ依题V H H E ClCl E E 3579.1)()(22=-=+-θθθ0623.00)()()()(lg 05917.0579.311.4884=⋅⋅-=-+-+Cl H Cl H αααα212)]()([)())(()(-+±±⋅==Cl H HCl HCl HCl ααααα=0.0789kg mol b b HCl /1.0)(b ==-+±789.01.00789.0)(b b HCl HCl ===±±±HCl θαγ)()(解:1,r 2129862581-⋅===∆K J KJTQ S m r m )( 13r 2102981058.62H 2-⋅=⨯=∆=∆K J KJ T S 环境)( 1m 23121210S S -⋅=+=∆+∆=∆K J S 环境总(3) -56.322kJK 21J 298K -62.58kJ 1-'=⋅⨯+=∆-∆=∆=mr m r m r r S T H G w7.7 电极电势和液体接界电势 1. B2. -0.440V解:相应的能斯特方程式为)()()()(lg 05917.0E E 4233++++⋅⋅-=Ce Fe Ce Fe ααααθ由已知可知:E θ=1.61V-0.770V=0.84V 且:代入上式可得:E=0.84-0.05917lg1=0.84V>0 所以 反应正向进行。
解:电池反应为Cd+Cl 2(g)=Cd 2+(a=0.01)+2Cl -(a=0.5)1.8381V0.25)g(0.010.05917/2l -0.4032V 1.3579V )()(lg 205917.0E E 22=⨯+=-=-+Cl a Cd a θ发应自发。
075.3548381.19650021π-⋅-=⨯⨯-=-=∆mol kJ ZFE G m r523.5905917.0761.1205917.0lgK =⨯==θθZEK θ=1059.523=3.3374×10597.8 原电池设计举例1. Ag|AgCl|Cl-‖I-|AgI|Ag解:对应电池符号为Pt|H 2(p 1)|H +(a1)‖Ag +(a 2)|Ag0.7994V0-0.7994 )()(E 2==-=++H H E Ag Ag E θθθ128.1547994.0965002-⋅-=⨯⨯-=-=∆mol kJ ZFE G r θθ02.2705917.07994.0205917.0lgK =⨯==θθZEK θ= 1.048×1027解:设计如下原电池Pt|H 2(p 1)|H 2O|O 2(p 2) |Pt 阴极:O 2+2H 2O+4e -=4OH - 阳极:H 2=2H ++2e -(1)查表 12f 18.237)(-⋅-=∆mol kJ O H G mθ1.18.237--=∆mol kJ G m r θV E 2289.19650021018.2373=⨯⨯=θ(2)VV V H H E OHO E 229.10229.1 )()(E 22=-=-=+-θθθ (3)1-1-3r r r K ol 163.173J.m 15.29810)18.23783.285(=⨯+-=∆-∆=∆T G H S m m m θθθP m TEZF S )(r ∂∂=∆KV ZFS T E m P /104545.8 965002173.163)(4r -⨯=⨯=∆=∂∂解:(1)设计原电池Ag|Ag +(a 1)‖Br-(a 2)|AgBr|Ag 阳极:Ag=Ag ++e -阴极:AgBr+e -=Ag+Br - 总反应:AgBr=Ag ++Br -)()(lg 05917.0E E -+⋅-=Br a Ag a θ式中,)()AgBr(E Ag Ag E AgE +-=θθθ系统平衡时,E=0; 同时)()()(AgBr K Br a Ag a sp =⋅-+ 将上述数据代入:)(lg 05917.0)()AgBr (AgBr K Ag Ag E Ag E sp +=+θθ=0.7994V+ 0.05917lg ( 4.88×10-13) =0.0709V(2)Ag(s)+1/2Br 2(l)=AgBr(s) 设计原电池,实现上述反应Ag|AgBr(s) |Br-(1)|Br 2(100kPa )|Pt 该原电池 E θ=1.065-0.0709=0.9941VΔG θ=-ZFE θ=-96500×0.9941=-95.930kJ.mol -1 所以:ΔG θ f (AgBr)= -95.930kJ.mol -17.11 极化作用 1. A 2. B 3. C7.12 电解时电解反应 1. C2. D3. Cu>Fe>Zn>Ca第十章界面现象10.1 界面张力一、填空题1、③④2、降低=03、冰的表面张力大4、矿泉水表面张力大5、水的表面张力大6、A7、w’=γA s= 7.17×10-2×2×10-4=14.34×10-6J二、计算题10.2 弯曲液面的附加压力及其后果一、填空题1、④2、②3、②4、③5、20℃高6、大小7、①微小晶粒大8、③超微毛细管9、过饱和度超大10、1.521×10-6m11、①饱和蒸汽12、②毛细现象13、过饱和蒸汽过冷液体过热液体过饱和溶液14、②向右移动二、计算题10.3 固体表面1、②2、降低3、高大4、放热5、物理吸附6、单分子层吸附二、计算题10.4 固体表面一、填空题1、△G △G>02、γ尘-液较大3、>4、④146.8º二、计算题解:(1))(cos )(H g)-Hg 22O H Hg g O -+-=γθγγ( 0.483=0.0728cos θ+0.375解之得:θ不存在,因此水可在汞的表面上铺展。
