BSEN14683-2019医用口罩.要求和试验方法
医用防护口罩技术要求及检验方法

医用防护口罩技术要求及检验方法GB 19083-2010 对医用防护口罩的技术要求和检验方法做了详细的规定。
该标准属于强制性标准,凡是医用防护口罩产品都应符合标准规定的所有要求,对于医用防护口罩的检验也要严格按照标准执行。
医用防护口罩技术要求及检验方法01基本要求基本要求:口罩应覆盖佩戴者的口鼻部,应有良好的面部密合性,表面不得有破洞、污渍,不应有呼气阀。
检验方法:取3个口罩,在300 lx ~700 lx的照度下目力检查,应符合以上要求。
02鼻夹鼻夹要求:口罩上应配有鼻夹。
鼻夹应具有可调节性。
检验方法:按照说明书规定的使用方法调节,应符合以上要求。
03口罩带口罩带要求:口罩带应调节方便。
应有足够强度固定口罩位置。
每根口罩带与口罩体连接点的断裂强力应不小于10N。
检验方法:•样品数量:取4个口罩,打开包装,其中2个进行温度预处理,2个不进行预处理。
•温度预处理条件。
预处理条件为:a、70℃±3℃ 环境试验箱中放置24 h。
b、-30℃±3℃环境试验箱中放置24 h。
注:经温度预处理后应在室温条件下恢复至少4h。
•通过目力检查和拉力试验装置测量,结果均应符合调节方便、有足够强度固定口罩的位置,以及每根口罩带与口罩体连接点的断裂强力应不小于10N。
04过滤效率与气流阻力过滤效率要求:在气体流量为85 L/min 情况下,口罩对非油性颗粒过滤效率应符合表1的要求。
过滤效率等级等级过滤效率%1级≥ 952级≥ 993级≥ 99.97▲ 表1气流阻力:在气体流量为85 L/min 情况下,口罩的吸气阻力不得超过343.2 Pa (35 mm H2O)。
检验方法:•样品数量:应该使用6个口罩样品进行试验。
3个经过温度预处理,3个不经过预处理。
•温度预处理条件:a、70℃±3℃ 环境试验箱中放置24 h。
b、-30℃±3℃环境试验箱中放置24 h。
注:经温度预处理后应在室温条件下恢复至少4h。
微生物测试作业指导书

微生物测试作业指导书编制:岗位:理化工程师签字:日期:审核:岗位:理化主管签字:日期:批准:岗位:质量经理签字:日期:1.目的:为了对口罩产品和初包装材料的微生物限度和控制菌进行有效控制且满足相应销售区域的标准,特制定本测试作业指导书。
2.范围:适用于本公司口罩产品及初包装材料的微生物检测。
3.职责3.1 质量部负责按照本规程的要求对初包装材料的微生物限度以及口罩产品的细菌、真菌总数和控制菌(大肠菌群、绿脓杆菌、金黄色葡萄球菌、溶血性链球菌)进行检验,并出具判定报告。
3.2质量部负责定期对检测结果进行汇总及趋势分析。
3.3质量部负责本文件的编制、审核、批准。
4.工作程序4.1 测试标准:●YY 0469-2011医用外科口罩●GB 19083-2010 医用防护口罩技术要求●GB 15979-2002一次性使用卫生用品卫生标准●EN 14683:2019 Medical face masks-Requirements and test methods●《中国药典2015版四部》4.2样品的取样数量:对于符合GB 19083-2010、YY 0469-2011和YY /T 0969-2013的口罩产品,取同一生产批的4个样品用于检测。
对于符合EN 14683:2019的口罩产品,取同一生产批的5个样品用于检测。
4.3控制标准:4.3.1产品相关控制标准医用防护口罩(GB 19083-2010):医用外科口罩(YY 0469-2011)和一次性使用医用口罩(YY /T 0969-2013):医用口罩(EN 14683:2019)微生物限度标准:≤30cfu/g4.3.2初包装材料微生物控制标准5.检测方法5.1 检测前准备5.1.1培养基a)需从合格供应商处购置成品培养基,作为支持微生物生长繁殖或新陈代谢产物的营养基础。
b)配置前需检查培养基名称和批号,打开后观察有无大型结块和污染。
如果出现上述现象不得使用。
COVID-19 预防相关医疗设备欧洲标准中英文

COVID-19 预防相关医疗设备欧洲标准中英文Brussels 20 March 2020 - In response to the coronavirus outbreak, CEN, the European Committee for Standardization, and CENELEC, the European Committee for Electrotechnical Standardization, agreed, in collaboration with all their Members and after the urgent request from the European Commission, to make freely available a series of European standards (ENs) for medical devices and personal protective equipment used in the context of the COVID-19 pandemic.This exceptional decision is motivated by the need to tackle the severe shortage of protective masks and medical equipment experienced all around Europe due to the exponential growth of the COVID-19 emergency. The standards will enable a quicker and smoother access to market of new fundamental medical and protection equipment. Providing free access to the national adoptions of this set of European standards facilitates the work of the many companies within the European Economic Area which are reconverting their production lines to deliver tangible results quickly and ensure that healthcare professionals and patients have access to the equipment they urgently need. The 11 standards developed by CEN and potentially 3 additional ones developed jointly with ISO made available cover common filtering masks, medical gloves and protective clothing. They are the fruit of a collective European effort. These Europeanstandards were developed and adopted by different Technical Bodies, taking into account the contributions of hundreds of experts and stakeholders in the personal protective equipment and medical field all around Europe. The standards are available for free download from the websites of CEN national members. Thierry Breton, European Commissioner for the Internal Market, saluted the init iative: “In our battle against the coronavirus we need to act with urgency, solidarity and in a coordinated manner. We need audacity and innovative ways of producing the equipment we need. I am encouraging manufacturers to evaluate the possibilities of increasing and diversifying production, building on positive examples such as textile and shoe manufacturers starting to produce masks and gowns. I will do everything possible to support their efforts. I am pleased to announce that following contacts with the Commission, today CEN and CENELEC agreed to make freely available the standards needed for such companies to be able to produce masks and other protective equipment. This agreement has immediate effect.”Vincent Laflèche, CEN President, commented: “Due to the coronavirus pandemic, we are living unprecedented circumstances which require exceptional measures. By making a set of standards available for free, the European standardization community is committed to help the European Commission in its effort to build the first common European reserve of emergency medical equipment (RescEU)”. Dany Sturtewagen,CENELEC President, added: “European standards play a crucial role in ensuring the availability of key medical devices and personal protective equipment. This extraordinary step is in line with the key drivers of our European standardization work: inclusiveness and unity. I salute the reaction of solidarity and commitment from our Members to support the global fight against COVID-19”. The list of the standards follows:EN 149:2001 + A1:2009 Respiratory protective devices –Filtering half masks to protect against particles - Requirements, testing, marking (commonly referred to as ‘FFP masks’)EN 14683:2019 Medical face masks - Requirements and test methodsEN 166:2001 Personal eye-protection – SpecificationsEN 14126:2003 + AC 2004 Protective clothing - Performance requirements and tests methods for protective clothing against infective agentsEN 14605:2009 + A1:2009 Protective clothing against liquid chemicals - performance requirements for clothing with liquid-tight(Type 3) or spray-tight (Type 4) connections, including items providing protection to parts of the body onlyEN 13795-1:2019 Surgical clothing and drapes - Requirements and test methods - Part 1: Surgical drapes and gownsEN 13795-2:2019 Surgical drapes, gowns and clean air suits, used as medical devices for patients, clinical staff and equipment - Part 2: Test methodsEN 455-1:2000 Medical gloves for single use - Part 1: Requirements and testing for freedom from holes (MDD)EN 455-2:2015 Medical gloves for single use - Part 2: Requirements and testing for physical properties (MMD)EN 455-3:2015 Medical gloves for single use - Part 3: Requirements and testing for biological evaluation (MDD)EN 455-4:2009 EN Medical gloves for single use - Part 4: Requirements and testing for shelf life determination (MDD)In addition, possibly:EN ISO 374-5:2016 Protective gloves against dangerous chemicals and micro-organisms - Part 5: Terminology and performance requirements for micro-organisms risksEN ISO 13688:2013 Protective clothing - General requirementsEN ISO 10993-1:2009 + AC 2010 Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process后面是中文版本布鲁塞尔2020年3月20日——为应对新冠病毒COVID-19爆发,应欧委会紧急要求,欧洲标准化委员会与欧洲电工标准化委员会(CEN-CENELEC)与成员国达成共识,免费提供一系列医疗设备和个人防护设备的欧洲标准。
欧盟防护口罩认证要求

欧盟防护口罩认证要求
常见的个人防护口罩(非医用) 需要满足欧盟(EU) 2016/425个人防护设备指令(PPE) 的要求,进行CE认证,采用的标准是EN 149-2001,按照标准将口罩分为FFP 1/FFP 2和FFP 3三个类别。
认证流程为:产品的型式试验报告--技术文件评审―-工厂质量体系审查一一颁发CE证书--产品出口。
医用口罩按照MDR的要求进行CE认证,采用的标准是EN 14683-2014。
医用口罩产品按照l类器械进行管理。
依据产品是无菌或非无菌状态提供,其认证模式不一样。
1)非无菌方式认证流程:编制技术文件一一提供测试报告(可以提供熔喷布性能测试报告和无纺布的生物学报告,咨询合作的公告机构的意见) ――编制DOC-一指定欧盟授权代表并完成欧洲注册。
2) 无菌方式认证流程:灭菌验证--建立ISO 13485体系――编制技术文件一一提供测试报告(口罩本身的生物学、性能、无菌等测试报告)-一公告机构审核―-获CE证书―一指定欧盟授权代表并完成欧洲注册。
无菌的医用口罩,例如外科口罩,需要欧盟公告机构参与,取得带公告号的CE证书方可在欧盟销售。
从目前整体情况来看,医用外科无菌口罩如果之前没有获得公告机构的CE证书,现在临时去申请周期太长。
建议选择一类非无菌Class I 方式进行编写MDR技术文档,自我声明,选择欧代,进行欧盟注册,加贴CE标识,产品出口欧盟。
口罩执行标准对照表

口罩执行标准对照表随着新冠病毒的传播,口罩成为了人们日常生活中必不可少的防护用品。
然而,市面上的口罩种类繁多,标准各异,很多消费者对口罩的执行标准并不了解。
因此,本文将介绍口罩执行标准对照表,帮助消费者更好地选择适合自己的口罩。
一、国际标准。
1. N95口罩。
N95口罩是美国国家职业安全卫生研究所(NIOSH)认证的口罩标准,其过滤效率达到95%以上,能够有效阻挡空气中的颗粒物,包括细菌、病毒等。
N95口罩通常用于医疗领域和工业防护领域。
2. KN95口罩。
KN95口罩是中国国家标准GB2626-2006中规定的口罩标准,其过滤效率也达到95%以上,与N95口罩类似。
在疫情期间,KN95口罩被广泛使用,但消费者在购买时需要注意是否具有相关认证标识。
3. FFP2口罩。
FFP2口罩是欧洲标准EN149:2001+A1:2009中规定的口罩标准,其过滤效率也达到94%以上。
FFP2口罩通常用于医疗领域和工业防护领域,与N95口罩和KN95口罩类似。
二、国内标准。
1. 医用外科口罩。
医用外科口罩是中国国家标准YY0469-2011中规定的口罩标准,其主要用于医疗领域,能够阻挡飞沫和微粒。
医用外科口罩通常为一次性使用,不能重复使用。
2. 医用防护口罩(N95口罩)。
医用防护口罩是中国国家标准GB19083-2010中规定的口罩标准,其过滤效率达到95%以上,能够有效阻挡空气中的颗粒物。
医用防护口罩通常用于医疗领域,能够有效防护医护人员免受感染。
3. 自吸过滤式防颗粒物呼吸器(FFP2口罩)。
自吸过滤式防颗粒物呼吸器是中国国家标准GB2626-2006中规定的口罩标准,其过滤效率达到94%以上,能够有效阻挡空气中的颗粒物。
自吸过滤式防颗粒物呼吸器通常用于工业防护领域,能够有效防护工人免受有害颗粒物的侵害。
通过以上对口罩执行标准的对照,消费者可以更清晰地了解不同类型口罩的特点和用途,从而选择到更适合自己的口罩。
一次性使用医用口罩IQC、IPQC、FQC及OQC检验规范

一次性使用医用口罩IQC、IPQC、FQC及OQC检验规范IQC进料检验规范1.目的和范围1.1目的规范一次性使用医用口罩的原材料进货检验操作,确保原材料符合规定要求,保证产品质量。
1.2范围适用于本公司一次性使用医用口罩产品的原材料进货检验。
2.工作程序2.1原材料进厂后应放原材料仓库待检区,由仓库填写请检单,送交质量部,质量部收到请检单后派员到现场进行检验或取样。
2.2质量部收集产品质量证明书。
3检验项目、要求、方法及抽样方案3.1熔喷布3.1.1外观质量3.1.2理化性能3.1.3徼生物3.2鼻夹3.3口罩带3.4包装袋IPQC过程检验1.目的规范一次性使用医用口罩产品生产过程中的检验项目、检验方法与检具、抽样方案及判定准则的要求,确保产品在生产过程中的质量要求。
2.范围适用于本公司一次性使用医用口罩生产过程检验。
3.检验项目、要求、检验方法、检验规则见下表FQC及OQC成品检验1.目的规范一次性使用医用口罩产品岀厂前检验项目、检验内容与要求、检验方法、抽样方案判定准则及检验记录的要求,桷保出厂成品符合注册标准要求。
2.范围适用于本公司一次性使用医用口罩成品出厂前检验。
3.检验依据3.1一次性使用医用口罩技术要求4.检测项目、质量要求、检验方法检测包括出厂检验和型式检验。
出厂检验项目项目:4.1外观、4.2结构与尺寸、4.3鼻夹、4.4口罩带、4.7微生物指标。
其中4.7为委托第三方检测项目,每批原材料送检一次。
型式检验应为产品标准的全性能检验。
4.1外观4.1.1口罩外观应整洁、形状完好,表面不得有破损、污渍。
4.1.2口罩的超声波复合应均匀、平直、牢固、无明显皱折。
4.1.3口罩超声波复合处粘合应牢固。
检验方法:随机抽取3个样品进行试验。
目视检查,结果应符合要求。
4.2结构与尺寸口罩佩戴好后,应能罩住佩戴者的口、鼻至下颌。
应符合表1的规定尺寸,最大偏差应不超过士5%表1口罩规格型号和基本尺寸单位:mm检验方法:随机抽取3个样品进行试验。
国内外口罩标准介绍

第49卷第3期2021年3月塑料工业CHINAPLASTICSINDUSTRY国内外口罩标准介绍郑㊀雯ꎬ鲁㊀明ꎬ袁绍彦ꎬ叶南飚ꎬ陈平绪ꎬ刘奇祥ꎬ石㊀鑫(金发科技股份有限公司企业技术中心ꎬ广东广州510663)㊀㊀摘要:2019年底ꎬ湖北省武汉市持续开展流感及相关疾病监测ꎬ发现多起病毒性肺炎病例ꎬ均诊断为病毒性肺炎/肺部感染ꎮ世界卫生组织(WHO)宣布ꎬ将新型冠状病毒疫情列为国际关注的突发公共卫生事件(PHEIC)ꎮ新冠肺炎疫情的爆发已经构成一次全球性 大流行 ꎮ疫情的爆发直接导致口罩需求量激增ꎬ各国对口罩有不同的标准ꎬ作者调研了国内外相关的口罩标准并进行了分析ꎬ对生产者和消费者提供参考ꎮ关键词:口罩ꎻ标准ꎻ新型冠状病毒中图分类号:TB34㊀㊀㊀文献标识码:A㊀㊀㊀文章编号:1005-5770(2020)11-0013-04doi:10 3969/j issn 1005-5770 2021 03 003开放科学(资源服务)标识码(OSID):IntroductionofDomesticandForeignMaskStandardsZHENGWenꎬLUMingꎬYUANShao ̄yanꎬYENan ̄biaoꎬCHENPing ̄xuꎬLIUQi ̄xiangꎬSHIXin(National ̄certifiedEnterpriseTechnologyCenterꎬKingfaScienceandTechnologyCo.ꎬLtd.ꎬGuangzhou510663ꎬChina)Abstract:Attheendof2019ꎬWuhancityꎬHubeiprovincecontinuedtocarryoutinfluenzaandrelateddiseasesurveillanceꎬandfoundmultiplecasesofviralpneumoniaꎬalldiagnosedasviralpneumonia/pulmonaryinfection.TheWorldHealthOrganization(WHO)announcedthatthenewcoronavirusepidemichadbeenlistedasapublichealthemergency(PHEIC)ofinternationalconcern.Theoutbreakofthenewcrownpneumoniaepidemichadconstitutedaglobal"pandemic."Theoutbreakoftheepidemichaddirectlyledtoasharpincreaseinthedemandformasks.Differentcountrieshaddifferentstandardsformasks.Theauthorinvestigatedandanalyzedrelevantdomesticandforeignmaskstandardstoprovidereferencesforproducersandconsumers.Keywords:MaskꎻStandardꎻNovelCoronavirus1㊀口罩的发展13世纪初在元朝宫殿中ꎬ为皇帝献食的人都需要带上由蚕丝和黄金线制成的绢布ꎬ以防气息影响到皇帝的食物ꎬ这是口罩最早的雏形ꎮ到了14世纪ꎬ黑死病在欧洲蔓延ꎬ出现了 鸟嘴医生 ꎬ他们将棉花填充在鸟嘴之中ꎬ戴在口鼻处ꎬ以过滤吸入的空气ꎬ这是最早的呼吸防护用品ꎮ到19世纪末到20世纪初ꎬ人们发现纱布口罩可以阻隔空气中细菌的传播ꎬ在西班牙流感和肺鼠疫传播期间被广泛应用ꎮ到了21世图1㊀口罩的发展历程Fig1㊀Thedevelopmenthistoryofmasks纪ꎬ由于雾霾㊁ 非典 及此次新冠病毒的全球大流行ꎬ口罩更是成为了炙手可热的防疫物资ꎮ2㊀口罩的技术要求口罩的关键技术要求是口罩的过滤效率和通气阻力ꎬ前者决定了口罩对于空气中的颗粒物㊁细菌㊁病毒等污染物的滤除能力ꎬ后者决定了口罩的佩戴舒适性ꎮ此外ꎬ医用级别的口罩还有抗体液穿透㊁微生物清洁度等方面的要求ꎬ防护用口罩则要求有好的面部贴合性ꎬ以防污染物从口罩边缘进入呼吸系统ꎮ2 1㊀过滤效率图2㊀不同污染物的尺寸Fig2㊀Thesizeofdifferentpollutants根据目标污染物(图2)的不同ꎬ过滤效率可以分为颗粒物过滤效率(PFE)㊁细菌过滤效率(BFE)和病毒过滤效31 ∗联系人zhengwen@kingfa com cn作者简介:郑雯ꎬ女ꎬ1988年生ꎬ硕士研究生ꎬ从事标准化研究ꎮ塑㊀料㊀工㊀业2021年㊀㊀率(VFE)ꎮ根据颗粒物属性ꎬ颗粒物过滤效率又可以分为盐性颗粒物过滤效率和油性颗粒物过滤效率ꎮ2 2㊀通气阻力口罩的通气阻力代表了口罩透气性的好坏ꎬ它是在一定风速下ꎬ由于口罩对空气的拦截作用而在内外两侧产生的压力差ꎮ低的阻力和高的滤效是一对矛盾ꎬ好的口罩(滤材)应追求 高效低阻 ꎮ通常ꎬ标准会对口罩的压差或者呼气/吸气阻力的上限值做出规定ꎮ2 3㊀泄露率/密合度/防护效果防护类口罩ꎬ除了有好的过滤效率ꎬ还应该有很好的密合性ꎬ防止污染物从间隙进入呼吸系统ꎮ泄露率㊁密度度和防护效果都是通过口罩内部和口罩外部的粒子浓度差异来评估口罩与佩戴者面部的贴合性ꎬ不同标准的测试方法存在差异ꎬ但原理相同ꎮ需要对口罩进行人体工学设计ꎬ使口罩边缘ꎬ尤其是鼻梁两侧等位置与面部紧密贴合ꎬ使空气尽量通过滤材进入呼吸系统ꎬ减少从边缘缝隙的漏入ꎮ3㊀国内外口罩标准3 1㊀中国口罩标准国内目前的相关口罩标准主要有:YY/T0969 2013«一次性使用医用口罩»㊁YY0469-2011«医用外科口罩»㊁GB19083 2010«医用防护口罩技术要求»㊁GB2626 2019«呼吸防护㊀自吸过滤式防颗粒物呼吸器»㊁GB/T32610 2016«日常防护型口罩技术规范»㊁GB/T38880 2020«儿童口罩技术规范»ꎬ这些标准的适用场合以及过滤效率等介绍见表1ꎮ其中ꎬ医用和儿童口罩在细菌过滤效率都要求在95%以上ꎬ其他日常防护口罩只要求颗粒过滤效率ꎮ泄漏率的测试方法(GB2626)防护效果的测试方法(GB/T32610)图3㊀泄漏率和防护效果的测试方法Fig3㊀Testmethodforleakagerateandprotectioneffect表1㊀国内相关口罩标准介绍Tab1㊀Introductionofrelevantdomesticmaskstandards名称一次性使用医用口罩医用外科口罩医用防护口罩自吸过滤式防颗粒物呼吸器日常防护型口罩儿童防护口罩儿童卫生口罩执行标准YY/T0969 2013YY0469 2011GB19083 2010GB2626 2019GB/T32610 2016GB/T38880 2020适用场合普通医疗环境ꎬ人群密集环境ꎬ阻隔飞沫临床医护人员有创操作过程高暴露风险的医疗工作环境粉尘/油烟等工作环境ꎬ劳保雾霾㊁花粉等空气污染环境6~14岁儿童适用ꎬ隔离颗粒物ꎬ细菌ꎬ花粉ꎬ飞沫等PFE-ȡ30%1级ȡ95%(盐)2级ȡ99%(盐)3级ȡ99 97%(盐)盐:KN90ȡ90%KN95ȡ95%KN100ȡ99 97%油:KP90ȡ90%KP95ȡ95%KP100ȡ99 97%I级ȡ99%(油㊁盐)II级ȡ95%(油㊁盐)III级ȡ90%(盐)III级ȡ80%(油)ȡ95%ȡ90%BFEȡ95%ȡ95%----ȡ95%阻力/压差压差ɤ49Pa/cm2压差ɤ49Pa/cm2吸阻ɤ343 2PaKN95ɤ210Pa吸阻ɤ175Pa呼阻ɤ145Pa吸阻ɤ45Pa呼阻ɤ45Pa阻力ɤ30Pa密合性--总密合度因子ȡ100KN95:TIL1)ɤ11%(动作46/50)TILɤ8%(人8/10)防护效果A级ȡ90B级ȡ85C级ȡ75D级ȡ65防护效果ȡ90-其他要求鼻夹㊁口罩带㊁微生物㊁环氧乙烷残留㊁生物相容性鼻夹㊁口罩带㊁微生物㊁环氧乙烷残留㊁生物相容性㊁阻燃㊁血液穿透性鼻夹㊁口罩带㊁微生物㊁环氧乙烷残留㊁生物相容性㊁阻燃㊁血液穿透性㊁表面抗湿性死腔㊁视野㊁呼吸阀㊁可清洗㊁阻燃摩擦色牢度㊁甲醛㊁pH㊁微生物㊁视野㊁致癌芳香胺染料摩擦色牢度㊁甲醛㊁pH㊁微生物㊁可迁移性荧光增白物㊁尖端和边缘锐利性注:1)TIL为总泄漏率ꎮ 41第49卷第3期郑㊀雯ꎬ等:国内外口罩标准介绍3 2㊀欧盟口罩标准欧盟执行的相关标准主要为BSEN14683:2019«医用口罩㊀要求和试验方法»㊁BSEN149:2001+A1:2009«呼吸防护装置㊀颗粒防护用过滤半面罩㊀要求㊁检验和标记»ꎬ医用口罩主要是规定了细菌过滤效率ꎬ防护口罩主要规定了颗粒过滤效率和密合性等方面ꎬ具体见表2ꎮ表2㊀欧盟相关口罩标准介绍Tab2㊀IntroductionofEUrelevantmaskstandards名称医用口罩个人防护口罩执行标准BSEN14683:2019BSEN149:2001+A1:2009类别I型II型IIR型FFP1FFP2FFP3适用场合病人佩戴或普通人为减少流行病传播风险佩戴ꎬ不适于医护或临床操作临床医护人员有创操作过程粉尘/油烟等工作环境ꎬ劳动保护用ꎬ亦可在雾霾㊁花粉等空气污染环境下使用PFE---盐:ȡ80%油:ȡ80%盐:ȡ94%油:ȡ94%盐:ȡ99%油:ȡ99%BFEȡ95%ȡ98%ȡ98%---阻力/压差压差ɤ40Pa/cm2压差ɤ40Pa/cm2压差ɤ60Pa/cm2吸:30L/min:60Pa95L/min:210Pa呼:160L/min:300Pa吸:30L/min:70Pa95L/min:240Pa呼:160L/min:300Pa吸:30L/min:100Pa95L/min:300Pa呼:160L/min:300Pa密合性---TILɤ25%(动作46/50)TILɤ22%(人8/10)TILɤ11%(动作46/50)TILɤ8%(人8/10)TILɤ5%(动作46/50)TILɤ2%(人8/10)其他要求微生物清洁度㊁生物相容性微生物清洁度㊁生物相容性微生物清洁度㊁生物相容性㊁血液穿透性阻燃㊁视野㊁死腔㊁生物相容性㊁阻塞试验(可选)3 3㊀美国口罩标准美国的相关口罩标准有ASTMF2100-19«医用面罩材料的性能规范»和42CFRPart84«呼吸防护设备»ꎮ按照颗粒过滤效率和细菌过滤效率不同ꎬ医用外科口罩分为3类ꎬ且对微生物清洁度㊁生物相容性㊁血液穿透性做出了相关规定ꎮ个人防护口罩按照颗粒过滤效率也分为3类ꎬ医用级别需满足总密合度因子大于100ꎬ具体见表3ꎮ表3㊀美国相关口罩标准介绍Tab3㊀IntroductionofrelevantUSmaskstandards名称医用口罩个人防护口罩执行标准ASTMF2100-1942CFRPart84类别1级2级3级N95/N99/N100R95/R99/R100P95/P99/P100适用场合用于外科或给患者提供健康照护---PFEȡ95%ȡ98%ȡ98%NaCl(200mg):N95ȡ95%N99ȡ99%N100ȡ99 97%DOP1)(200mg):R95ȡ95%R99ȡ99%R100ȡ99 97%DOP(最大):R95ȡ95%R99ȡ99%R100ȡ99 97%BFEȡ95%ȡ98%ȡ98%---阻力/压差压差ɤ49Pa/cm2压差ɤ58 8Pa/cm2压差ɤ58 8Pa/cm2吸ɤ343Paꎬ呼ɤ245Pa密合性---医用级别需满足总密合度因子大于100其他要求微生物清洁度㊁生物相容性㊁血液穿透性微生物清洁度㊁生物相容性㊁血液穿透性微生物清洁度㊁生物相容性㊁血液穿透性-注:1)DOP为邻苯二甲酸二辛酯ꎮ3 4㊀日本口罩标准介绍日本的口罩标准主要是根据应用场合分为医用和防护口罩ꎬ都按照过滤效率和通气阻力等分为三个等级ꎬ具体见表4ꎮ51塑㊀料㊀工㊀业2021年㊀㊀表4㊀日本相关口罩标准介绍Tab4㊀IntroductionofrelevantJapanmaskstandards名称医用口罩个人防护口罩执行标准沿用ASTMF2100-19JISHA:STANDARDFORDS2类别1级2级3级DS1/DL1RS1/RL1DS2/DL2RS2/RL2DS3/DL3RS3/RL3适用场合用于外科或给患者提供健康照护粉尘/油烟等工作环境ꎬ劳动保护用ꎬ亦可在雾霾㊁花粉等空气污染环境下使用PFEȡ95%ȡ98%ȡ98%S1:盐:ȡ80%L1:油:ȡ80%S2:盐:ȡ95%L2:油:ȡ95%S3:盐:ȡ99 9%L3:油:ȡ99 9%BFEȡ95%ȡ98%ȡ98%---阻力/压差压差ɤ49Pa/cm2压差ɤ58 8Pa/cm2压差ɤ58 8Pa/cm2D吸:40L/min:45PaD呼:40L/min:45PaR吸:40L/min:70PaR呼:40L/min:70PaD吸:40L/min:50PaD呼:40L/min:50PaR吸:40L/min:80PaR呼:40L/min:70PaD吸:40L/min:100PaD呼:40L/min:80PaR吸:40L/min:160PaR呼:40L/min:80Pa其他要求微生物清洁度㊁生物相容性㊁血液穿透性微生物清洁度㊁生物相容性㊁血液穿透性微生物清洁度㊁生物相容性㊁血液穿透性死腔4㊀口罩的发展方向目前国外疫情依然很严峻ꎬ新冠病毒的传播形式决定了人们必须注重呼吸防护ꎬ以阻断病毒的传播ꎮ呼吸防护产品的未来的发展在于开发更加高效低阻的过滤材料ꎬ更加亲肤透湿㊁长效抑菌抗菌的本体材料ꎮ另外ꎬ口罩作为一次性用品ꎬ随着其使用量的日益增加ꎬ开发可回收可降解口罩产品势必成为其重要的发展方向ꎮ参㊀考㊀文㊀献[1]国家市场监督管理总局ꎬ国家标准化管理委员会.呼吸防护自吸过滤式防颗粒物呼吸器:GB2626 2019[S].北京:中国标准出版社ꎬ2019.StateAdministrationforMarketRegulationꎬNationalStand ̄ardizationAdministrationCommittee.Respiratoryprotectionself ̄primingfilteranti ̄particulaterespirator:GB2626-2019[S].Beijing:ChinaStandardPressꎬ2019. [2]中华人民共和国国家质量监督检验检疫总局ꎬ中国国家标准化管理委员会.日常防护型口罩技术规范:GB/T32610 2016[S].北京:中国标准出版社ꎬ2016.TheGeneralAdministrationofQualitySupervisionꎬInspec ̄tionandQuarantineofthePeople sRepublicofChinaꎬtheNationalStandardizationAdministrationofChina.Technicalspecificationsfordailyprotectivemasks:GB/T32610-2016[S].Beijing:ChinaStandardPressꎬ2016. [3]国家食品药品监督管理总局.一次性使用医用口罩:YY/T0969 2013[S].北京:中国标准出版社ꎬ2013.StateFoodandDrugAdministration.Disposablemedicalmasks:YY/T0969-2013[S].Beijing:ChinaStandardPressꎬ2013.[4]国家食品药品监督管理局.医用外科口罩:YY0469 2011[S].北京:中国标准出版社ꎬ2011.StateFoodandDrugAdministration.Medicalsurgicalmask:YY0469-2011[S].Beijing:ChinaStandardPressꎬ2011.[5]中华人民共和国国家质量监督检验检疫总局ꎬ中国国家标准化管理委员会.医用防护口罩技术要求:GB19083 2010[S].北京:中国标准出版社ꎬ2010.TheGeneralAdministrationofQualitySupervisionꎬInspec ̄tionandQuarantineofthePeople sRepublicofChinaꎬtheNationalStandardizationAdministrationofChina.Technicalrequirementsformedicalprotectivemasks:GB19083-2010[S].Beijing:ChinaStandardPressꎬ2010. [6]TheEuropeanCommitteeforStandardization.Respiratoryprotectivedevices ̄filteringhalfmaskstoprotectagainstpar ̄ticles ̄requirementsꎬtestingꎬmarking:EN149:2001+AL2009[EB/OL].(2018-09-17)[2020-02-02].http://www grain ̄iteworkwear com/upload/pdfs/919d. [7]ASTMInternational.Standardspecificationforperformanceofmaterialsusedinmedicalfacemasks:ASTMF ̄2100-11(Reap ̄proved2018)[EB/OL].(2018-09-17)[2020-02-02].http://www.astm.org.database.cart/his ̄torical/f2100-11.htm.[8]BritishStandardsInstitution.Medicalfacemasks ̄Require ̄mentsandtestandtestmethods:BSEN14603:2019[EB/OL].(2019-03-31)[2020-02-02].http://shop.sigroup.[9]日本呼吸用保護具工業会.防じんマスクParticulatere ̄spire ̄torsJIST8151:2018[EB/OL].[2020-02-02].http://www.kikakurui.com.t8/T8151-2018-01.ht ̄ml.(修改稿于2020-12-28收到)61。
口罩成品检验标准
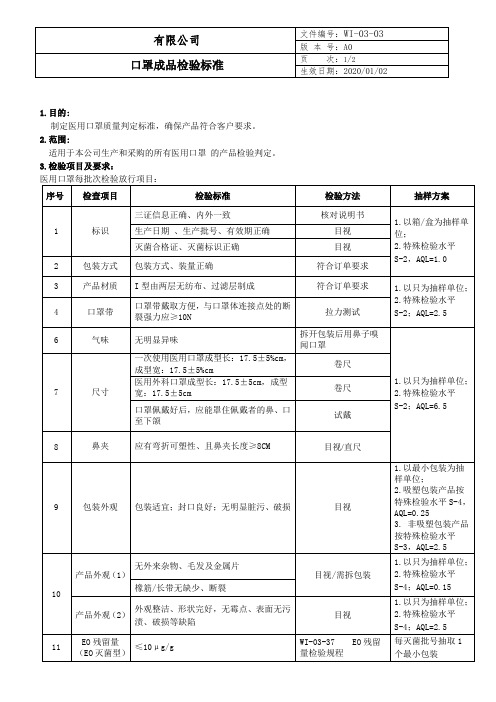
目视
灭菌合格证、灭菌标识正确
目视
2
包装方式
包装方式、装量正确
符合订单要求
3
产品材质
I型由两层无纺布、过滤层制成
符合订单要求
1.以只为抽样单位;
2.特殊检验水平S-2;AQL=2.5
4
口罩带
口罩带戴取方便,与口罩体连接点处的断裂强力应≥10N
拉力测试
6
气味
无明显异味
拆开包装后用鼻子嗅闻口罩
1.目的:
制定医用口罩质量判定标准,确保产品符合客户要求。
2.范围:
适用于本公司生产和采购的所有医用口罩 的产品检验判定。
3.检验项目及要求:
医用口罩每批次检验放行项目:
序号
检查项目
检验标准
检验方法
抽样方案
1
标识
三证信息正确、内外一致
核对说明书
1.以箱/盒为抽样单位;
2.特殊检验水平S-2,AQL=1.0
9
包装外观
包装适宜;封口良好;无明显脏污、破损
目视
1.以最小包装为抽样单位;
2.吸塑包装产品按特殊检验水平S-4,AQL=0.25
3. 非吸塑包装产品按特殊检验水平S-3,AQL=2.5
10
产品外观(1)
无外来杂物、毛发及金属片
目视/需拆包装
1.以只为抽样单位;
2.特殊检验水平S-4;AQL=0.15
1.以只为抽样单位;
2.特殊检验水平S-2;AQL=6.5
7
尺寸
一次使用医用口罩成型长:17.5±5%cm,成型宽:17.5±5%cm
卷尺
医用外科口罩成型长:17.5±5cm,成型宽:17.5±5cm
中国YY0469-2011与欧盟EN14683-2019医用口罩标准指标对比表

中国YY0469-2011与欧盟EN14683-2019医用口罩标准指标对比表国家中国欧盟
品种医用外科口罩医用口罩
执行标准YY0469-2011
医用外科口罩EN 14683-2019
医用口罩-要求和测试方法
范围适用于临床医务人员在有创操
作等过程中所佩戴的一次性口
罩适用于在外科手术中或其他类
似医疗场景中使用,以限制其他工作人员产生的污染物传播给病人,同时也可有效阻隔可疑携
带者或具有临床症状的病人从口、鼻喷出的污染物。
密合性X X
颗粒过滤效
率(PFE)
≧30 X
细菌过滤效
率(BFE)
≧95 Type I:≥95
Type II、Type IIR:≥98
压力差√(≤49Pa)Type I 和 Type II:≤40Pa
Type IIR: ≤60Pa(kPa)√
血液穿透性√(≥16kPa)Type I 和 Type II:X Type IIR: ≥16(kPa)√
表面抗湿性X X 微生物指标√√。
一次性使用医用口罩检验规程

一次性使用医用口罩进货、过程、成品检验规程进货检验1.目的和围1.1目的规一次性使用医用口罩的原材料进货检验操作,确保原材料符合规定要求,保证产品质量。
1.2围适用于本公司一次性使用医用口罩产品的原材料进货检验。
2.工作程序2.1原材料进厂后应放原材料仓库待检区,由仓库填写请检单,送交质量部,质量部收到请检单后派员到现场进行检验或取样。
2.2质量部收集产品质量证明书。
3检验项目、要求、方法及抽样方案3.1非织造布3.1.1外观质量3.1.2理化性能3.1.3徼生物3.2鼻夹3.3口罩带3.4包装袋过程检验1.目的规一次性使用医用口罩产品生产过程中的检验项目、检验方法与检具、抽样方案及判定准则的要求,确保产品在生产过程中的质量要求。
2.围适用于本公司一次性使用医用口罩生产过程检验。
3.检验项目、要求、检验方法、检验规则见下表成品检验1.目的规一次性使用医用口罩产品岀厂前检验项目、检验容与要求、检验方法、抽样方案判定准则及检验记录的要求,桷保出厂成品符合注册标准要求。
2.围适用于本公司一次性使用医用口罩成品出厂前检验。
3.检验依据3.1一次性使用医用口罩技术要求4.检测项目、质量要求、检验方法检测包括出厂检验和型式检验。
出厂检验项目项目:4.1外观、4.2结构与尺寸、4.3鼻夹、4.4口罩带、4.7微生物指标。
其中4.7为委托第三方检测项目,每批原材料送检一次。
型式检验应为产品标准的全性能检验。
4.1外观4.1.1口罩外观应整洁、形状完好,表面不得有破损、污渍。
4.1.2口罩的超声波复合应均匀、平直、牢固、无明显皱折。
4.1.3口罩超声波复合处粘合应牢固。
检验方法:随机抽取3个样品进行试验。
目视检查,结果应符合要求。
4.2结构与尺寸口罩佩戴好后,应能罩住佩戴者的口、鼻至下颌。
应符合表1的规定尺寸,最大偏差应不超过士5%表1口罩规格型号和基本尺寸单位:mm检验方法:随机抽取3个样品进行试验。
实际佩戴,并以通道或专用量具测量,结果应符合要求4.3鼻夹4.3.1口罩上应配有鼻夹,鼻夹由可塑性材料制成。
一次性医用口罩检验规范

注3:环氧乙烷残留量应控制在低于规定值(4.7)后口罩方可出厂。
6.4周期检查
6.4.1下列情况下应对口罩进行周期检查:
a) 新口罩产品投产前;
b) 连续生产中每年不少于一次;
c) 间隔一年以上再投产时;
d) 在口罩的设计、工艺或材料有重大改变时;
e) 国家质量监督部门提出要求时。
不可有
耳线断裂
不可有
耳线错面/错位
不可有
切片不良
不可有
脏污/油渍
不可有
表面破损
不可有
鼻梁线错位
不可有
5.1.1每批随机抽取5个样品进行外观检验,目视检查,需符合5.1要求
5.1.2口罩外形应端正,表面应整洁,不应有污迹、霉点、破损及异味。
5.1.3口罩的超声波复合应均匀、平直、牢固、无明显皱折。
5.1.4口罩超声波复合处粘合应牢固。
5.2.2结构检验标准
5.2.2.1鼻夹;鼻夹长度应大于8cm,使用通用或专用两局进行测量。
5.2.2.2口罩带;口罩带应戴取方便,每根口罩带与口罩连接点处的断裂强度不小于10N,使用静拉力机以10N进行测量,持续5秒。
5.2.2.3细菌过滤效率(BFE);口罩的细菌过滤效率应不小于95%
5.2.2.4通气阻力;口罩两侧面进行气体交换的通气阻力应不大于49Pa/cm2。
d) 口罩生产批号或生产日期;
e) 口罩的消毒日期、灭菌失效期或保质期;
f) 口罩包装数量(中包装适用);
g) “包装破损禁止使用”等字样或标志,如灭菌口罩。
7.3口罩的外包装上至少应有下列标志:
a) 生产单位名称、商标;
b) 产品名称、规格;
口罩相关标准及测试要求

口罩相关标准及测试要求平面口罩材料1、EN14683-2014医疗口罩材料注:a代表着这种材料只能给病人、易过敏的人群2、ASTMF2100-2004医疗口罩材料3、YY0469-2004医用外科口罩技术要求表1口罩的分类表2口罩微生物指标防尘口罩材料1.欧盟阻尘口罩标准EN149:2001+A1-2009穿透率代表着口罩不能重复使用,R代表着口罩可以重复使用,RD代表着口罩可以重复使用,并满足加载测试。
如果粉尘的浓度为400mg/cm3,加载的时间就是125min,或者是95lpm对于有阀的口罩材料来说FFP1的吸气阻力达到40MMH20,FFP2的吸气阻力达到50mmH20,FFP3的吸气阻力达到70mmH20;对于无阀的口罩材料来说FFP1的吸气阻力达到30MMH20,FFP2的吸气阻力达到40mmH20,FFP3的吸气阻力达到50mmH20;2、美国阻尘口罩标准:NIOSHStandards(Title42CFRPart84)测试物质:NaCl&DOP粒径:0.3μm测试流速:85L/MinN(Non-oilresistance),95,99and100防护非油性悬浮颗粒,无时限,测试物质:0.3μmNaCl气溶胶,测试流速:85L/MinR(oil-Resistance),95,99,100防护非油性悬浮颗粒及汗油性悬浮颗粒时限八小时;举例结构:42克纺粘布+蓬松静电棉+熔喷布+55克纺粘布;P(oil-Proof),95,99,100防护非油性悬浮颗粒及汗油性悬浮颗粒无时限,一般情况下,供应商建议使用40小时或30天,口罩能够解除有机气味及异味。
结构一般是,测试物质:0.3μm油性气溶胶DOP或石蜡油,测试流速:85L/Min;3M口罩举例结构:纺粘布+阻燃滤棉+静电滤棉+活性炭层+纺粘布;具体克重不详。
3、GB2626-2006自吸防护用品—自吸过滤式防颗粒物呼吸器表1过滤元件的类别表2过滤效率注:吸气阻力不大于350pa,呼气阻力不大于250pa,加载测试不大于200mg,测试流量为85lpm4、GB32610-2016日常防护型口罩技术规范表1过滤效率级别及要求表2不同防护效果级别口罩的防护效果要求表3不同防护效果级别适用的环境空气质量及允许暴露的细菌颗粒物(PM2.5)浓度高限值注:当口罩的防护级别达到*,其过滤效率应该95%以上(包括95%),当口罩的防护级别在B、C、D级时其过滤效率应该在90%以上(包括90%),测试是口罩的数量不少于10个。
口罩微生物检验操作规程

口罩微生物检验操作规程口罩微生物检验操作规程1 目的为了使口罩产品的微生物检验规范化,制定此操作规程,以保证最终产品质量。
2 范围本程序适用于我司的口罩。
3 职责质量部微生物实验员对此规范负责。
4 取样4.1取样频次在生产环境及各道生产工序未发生变化,每周对口罩的微生物检验进行一次抽样检测。
4.2取样采集于同一批号的三个运输包装中至少抽取12个最小销售包装样品,1/4样品用于检测,1/4样品用于留样,另1/2样品(可就地封存)必要时用于复检。
抽样的最小销售包装不应有破裂,检验前不得启开。
4.3样品处理在100级净化条件下用无菌方法打开用于检测的至少3个包装,从每个包装中取样,准确称取10 g±1g样品,剪碎后加入到200 mL 灭菌生理盐水中,充分混匀,得到一个生理盐水样液。
注:如被检样品含有大量吸水树脂材料而导致不能吸出足够样液时,稀释液量可按每次50mL递增,直到能吸出足够测试用样液。
在计算细菌菌落总数与真菌菌落总数时应调整稀释度。
5 操作程序5.1细菌菌落总数测试方法本方法适用于产品细菌菌落总数(以下统称为细菌菌落总数)检测。
5.1.1 操作步骤待上述生理盐水样液自然沉降后取上清液作菌落计数。
共接种5个平皿,每个平皿中加入1 mL样液,然后用冷却至45℃左右的熔化的营养琼脂培养基15 ~20mL倒入每个平皿内混合均匀。
待琼脂凝固后翻转平皿置35℃±2℃培养48h后,计算平板上的菌落数。
5.1.2 结果报告菌落呈片状生长的平板不宜采用;计数符合要求的平板上的菌落,按式(1)计算结果:)1....(51K A X ?=式中:X 1――细菌菌落总数,cfu/g 或cfu/mL ;A――5块营养琼脂培养基平板上的细菌菌落总数;K――稀释度。
当菌落数在100以内,按实有数报告,大于100时采用二位有效数字。
如果样品菌落总数超过产品标准的规定,按5.1.3进行复检和结果报告。
5.1.3 复检方法将留存的复检样品依前法复测2次,2次结果平均值都达到本标准的规定,则判定被检样品合格;其中有任何1次结果平均值超过本标准规定,则判定被检样品不合格。
口罩的执行标准

口罩的执行标准口罩是一种用于防护呼吸道的防护用具,广泛应用于医疗、工业和日常生活中。
为了确保口罩的质量和有效性,各国都制定了相应的口罩执行标准,以便对口罩进行评估和监管。
本文将介绍口罩的执行标准,帮助大家更好地了解口罩的质量和选择。
首先,口罩的执行标准主要包括材料、结构、过滤效率、透气性、紧密性等方面的要求。
针对不同用途和场景,口罩的执行标准也有所不同。
例如,医用口罩的执行标准通常包括对细菌过滤效率、防护液体喷溅的要求;工业用口罩的执行标准则可能更注重对颗粒物的过滤效率和适应不同工作环境的要求。
其次,口罩的执行标准通常由国家标准化组织或相关部门制定和发布。
在中国,口罩的执行标准由国家质量监督检验检疫总局和中国标准化委员会负责制定和管理。
这些标准经过严格的科学评估和实验验证,确保口罩在使用过程中能够达到预期的防护效果。
另外,口罩的执行标准也需要经常更新和修订,以适应新的科学技术和医学知识的发展。
特别是在面对突发传染病和公共卫生事件时,口罩的执行标准可能需要根据病原体的特性和传播途径进行相应的调整和完善。
总的来说,口罩的执行标准对于保障口罩的质量和有效性至关重要。
只有符合执行标准的口罩才能够真正起到防护作用,保护使用者的健康和安全。
因此,在选择口罩时,我们应该关注口罩是否符合相应的执行标准,避免购买劣质或不合格的产品。
在日常生活中,我们也应该正确使用口罩,按照标准的要求进行佩戴和更换,以确保口罩的防护效果。
同时,定期检查口罩的外观和性能,及时更换损坏或过期的口罩,避免使用不合格的产品带来的健康风险。
综上所述,口罩的执行标准是保障口罩质量和有效性的重要依据,对于生产厂家、销售商和消费者都具有重要的指导意义。
我们应该加强对口罩执行标准的了解和学习,提高口罩的选择和使用能力,共同维护我们的健康和安全。
熔喷布测试标准

熔喷布测试标准熔喷布是一种非织造布,它通过高温熔融聚合的方式将纤维形成连续的纤维网,具有良好的过滤性能和防护效果。
熔喷布在医疗、卫生、工业等领域得到广泛应用,如医用口罩、防护服等。
为确保熔喷布的质量和性能达到要求,需要进行一系列的测试和评估。
本文将介绍熔喷布的测试标准,包括物理性能测试、过滤性能测试及生物相容性测试等。
1. 物理性能测试物理性能测试是熔喷布测试的重要内容之一,它可以评估熔喷布的强度、拉伸性能和耐磨性等。
常见的物理性能测试项目包括:- 断裂强度测试:通过拉伸试验仪测量熔喷布在一定条件下的最大拉伸力,评估其耐拉伸性能。
- 撕裂强度测试:通过撕裂试验仪测量熔喷布在一定条件下的撕裂强度,评估其耐撕裂性能。
- 抗磨损性能测试:使用磨损试验仪对熔喷布进行磨损测试,评估其耐磨性能。
2. 过滤性能测试过滤性能是熔喷布在医疗和卫生领域应用中的重要指标,它可以评估熔喷布对微粒和颗粒物的过滤效果。
常见的过滤性能测试项目包括:- 阻力测试:通过测量熔喷布在一定流量下的阻力,评估其过滤效果。
- 颗粒物捕集效率测试:使用颗粒物计数器测量熔喷布对不同粒径颗粒物的捕集效率,评估其过滤性能。
3. 生物相容性测试由于熔喷布在医疗领域广泛应用,因此需要进行生物相容性测试,以确保其在患者或使用者身上不引起过敏或其他不良反应。
常见的生物相容性测试项目包括:- 细胞毒性测试:将熔喷布与细胞培养基接触,观察细胞的存活情况,评估其细胞毒性。
- 皮肤刺激性测试:将熔喷布与动物或人体皮肤接触,观察是否引起红肿、过敏等不良反应。
4. 其他测试除了上述测试项目外,还可以根据具体的需求进行其他测试,比如:- 温度耐受性测试:通过将熔喷布放置在不同温度下观察其变化,评估其温度耐受性。
- 湿重度测试:将熔喷布置于一定湿度环境中,测量其湿重度,评估其湿度吸湿性能。
在进行熔喷布的测试过程中,需要参考相关的标准和规范,确保测试结果的准确性和可靠性。
医用口罩鼻梁条检验操作规程

文件制修订记录1.0目的为加强质量控制,规范指导检验过程,制定本规程。
2.0适用范围适用于鼻梁条的质量检验,评价其质量水平。
3.0职责质量部4.0要求4.1外观包装完整,表面光滑,无肉眼可见污渍、无棱刺。
4.2尺寸长度应为(XX±XX)cm,横截面直径应为(XX±XX)mm。
4.3重量重量应为(XX±XX)g。
4.4可调节性鼻夹条弯折后能定型保持4.5微生物限度细菌菌落总数≤200cfu/g;真菌菌落总数≤100cfu/g,大肠群菌,致病性化脓菌不得检出。
5.0检验方法5.1外观目视观察,应符合要求。
5.2尺寸使用通用器具测量,应符合要求。
5.3重量取样品,使用千分之一天平称重,应符合要求。
5.4可调节性取样品,将其固定保持水平位置,在水平方向施加10N的静拉力,持续5s,撤去作用力后,观察,样品应不得回复原来的性状。
5.5微生物限度按照GB 15979-2002中附录B规定进行试验,应符合要求。
6.0检验类型和抽样水平6.1检验分为型式检验和入厂检验。
6.2型式检验所有项目均应检验,必要时,根据YY 0469-2011中规定有关生物学评价要求进行生物学试验。
6.3入厂检验项目为4.1、4.2、4.3和4.5。
入厂检验项目为破坏性试验,考虑生产成本,应将抽样样品放入洁净室后取样,取样完成后封口剩余样品,待检测合格后继续用于生产。
6.4抽样水平6.4.1型式检验选择一次性抽样,判别水平为I,4.1/4.2/4.3RQL为20,4.4RQL 为6.5,4.5必须全部合格。
6.4.2入厂检验选择一次性抽样,抽样水平为I, 4.1、4.2、4.3AQL为6.5,4.6必须全部合格。
7.0包装、储存要求7.1鼻梁条为XX个/包,为双层包装。
7.2储存在阴凉位置。
8.0有效期有效期为2年。
口罩产品有效期确认(加速老化)验证方案

口罩产品有效期确定(加速老化)验证方案2020年验证方案的起草与审批验证小组起草与审核方案实施日期:2020年05月-2020年09月目录1.验证目的 (4)2.验证范围 (4)3.验证职责 (4)4.验证指导文件 (5)5.概述 (5)6.定义 (6)7.验证时间安排 (6)8.人员培训 (6)9.加速老化试验 (6)10.偏差处理 (7)11.风险的接收与评审 (7)12.方案修改记录 (8)13.再验证 (8)14.附件 (8)1、验证目的为确定产品的有效期,按实际储存时间和实际环境储存条件检测需要很长的时间才能获得产品有效期的结果,为了快速确定产品及其包装的无菌完整性和包装材料的物理特性受时间和环境的影响,通过加速老化试验为公司产品的有效期确定提供科学的依据。
2、范围本方案适用于公司生产的一次性使用医用口罩(无菌型)、医用外科口罩(无菌型).3、验证职责3.1验证领导小组3.1.1 负责验证文件格式、内容的审核。
3.1.2 负责对验证系统的风险评估报告进行审核和批准。
3.1.3 负责对系统的变更进行审核和批准。
3.1.4 负责对验证出现的偏差和验证结果进行分析讨论,并作出评价,决定验证周期。
3.1.5 提出全厂的年度及长期验证工作计划,包括验证的项目,周期及时间安排等。
3.1.6 组织协调验证活动,提供验证所需资源,确保验证进度。
3.1.7 审批验证报告。
3.2 验证小组3.2.1 负责验证方案的制订、实施与协调,组织验证的相关培训。
3.2.2 执行并确认验证方案中的内容,并对实施过程中出现的结果进行分析,对出现的偏差,及时调查处理,并上报验证领导小组。
3.2.3 对验证系统的变更,提出变更申请。
3.2.4 负责收集各项验证、试验记录并归入验证文件中。
3.2.5 准备和起草验证报告。
3.3 工程部3.3.1 负责设备的预防性维修、保养计划的制订和实施。
3.3.2 负责仪器、仪表的校准或检定。
