高一化学每课一练 2.2.1 化学能转化为电能(人教版必修2)
高中化学 2.2.1 化学能转化为电能同步训练 新人教版必

第二节化学能与电能第1课时化学能转化为电能A组基础达标(20分钟50分)一、选择题(本题共6个小题,每小题5分,共计30分,每小题只有一个选项符合题意) 1.下列有关能源的说法错误的是( )。
A.风能是人类通过风车等工具获取的能源,但属于一次能源B.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源C.月球土壤中含有丰富的质量数为3的氦,它可作为未来核能的重要原料D.原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源解析风能是直接从自然界中取得的能源,属于一次能源,原电池提供的电能是由化学能转化而得到的,不是直接获得的,属于二次能源,A正确,D错误;随着时代的发展,化石能源逐渐枯竭,所以新能源时代污染小的核能、太阳能、氢能将成为主要能源,B、C正确。
答案 D2.下列装置可以构成原电池的是( )。
答案 C3.各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )。
A.②①③④ B.④③①②C.④②①③D.③②④①解析②③④实质均为原电池装置。
③中Fe为正极,被保护;②④中Fe为负极,均被腐蚀。
但相对来说,Fe和Cu的金属活动性差别较Fe和Sn的差别大,故Fe—Cu原电池中的Fe被腐蚀得更快;①中不能构成原电池,仅发生化学腐蚀反应。
答案 C4.下列叙述中正确的是( )。
A.原电池的负极发生得电子的还原反应B.原电池中较活泼的金属作正极C.原电池中的电极一定要由两种不同的金属组成D.原电池中发生氧化反应的电极是负极解析原电池的两极可以是两种活泼性不同的金属,也可以是由金属与非金属(例如石墨)构成,原电池的负极失去电子发生氧化反应,故A、B、C选项错;只有D选项正确。
答案 D5.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时c极上产生大量气泡。
b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的顺序为( )。
人教版高中化学必修二:化学能转化为电能 讲义及习题
化学能转化为电能 学习目标 核心素养建构 1.熟悉能源的分类和化学能与电能的转化关系。
2.知道原电池是利用氧化还原反应将化学能转化为电能的装置,通过实验会说明原电池的原理,以及判断原电池的正、负极。
3.会正确书写电极反应式,熟知原电池的应用。
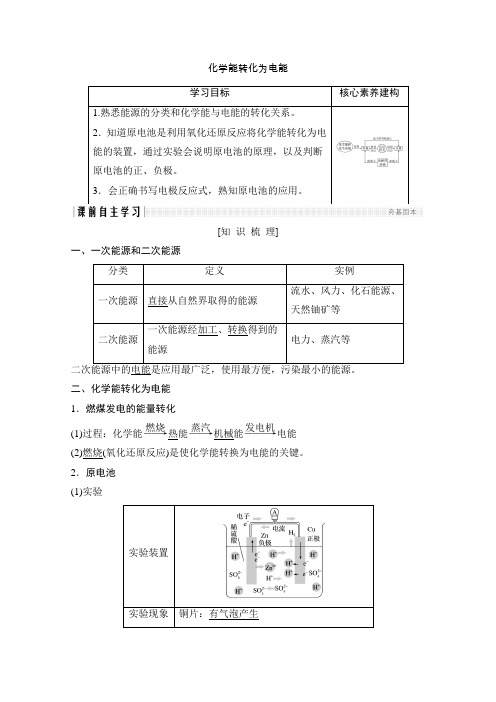
[知 识 梳 理]一、一次能源和二次能源分类 定义 实例一次能源 直接从自然界取得的能源 流水、风力、化石能源、天然铀矿等二次能源一次能源经加工、转换得到的能源 电力、蒸汽等 二次能源中的电能是应用最广泛,使用最方便,污染最小的能源。
二、化学能转化为电能1.燃煤发电的能量转化(1)过程:化学能――→燃烧热能――→蒸汽机械能―――→发电机电能(2)燃烧(氧化还原反应)是使化学能转换为电能的关键。
2.原电池(1)实验实验装置实验现象 铜片:有气泡产生(2)原电池概念:将化学能转变为电能的装置。
(3)铜锌原电池工作原理:2(4)反应本质:原电池反应的本质是氧化还原反应。
(5)构成原电池的条件理论上,自发的氧化还原反应均可设计成原电池。
①两个活泼性不同的金属(或一个为金属,一个为能导电的非金属)电极。
②具有电解质溶液。
③形成闭合回路。
【自主思考】1.原电池是如何构成闭合回路的?(请从电子流向和离子移动方向分析)提示在外电路,电子从负极流出经导线流向正极,在电解质溶液中,阳离子向正极移动,阴离子向负极移动。
2.原电池中作负极的一定是活泼金属,作正极的一定是不活泼金属吗?提示不一定。
在原电池中的两极可以都是活泼金属(如Zn-Fe-稀硫酸,Zn作负极),也可以都是不活泼金属(如Cu-Ag-AgNO3,Cu作负极)也可以是一种金属和一种能导电的非金属(如Cu-C-AgNO3,Cu作负极)。
[效果自测]1.判断正误,正确的打“√”,错误的打“×”。
(1)根据一次能源和二次能源的划分,氢气为二次能源()(2)电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源()(3)火力发电是化学能间接转化为电能的过程()(4)水力发电是将化学能转化为电能的过程()(5)HCl+NaOH===NaCl+H2O是放热反应,可以设计成原电池()(6)将铜片和锌片用导线连接插入酒精中,电流表指针发生偏转()(7)在铜—锌—稀硫酸原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌()(8)原电池中阳离子向正极移动()(9)原电池中的负极反应一定是电极材料失电子()答案(1)√(2)√(3)√(4)×(5)×(6)×(7)×(8)√(9)×2.下列装置中能够组成原电池的是________。
化学人教版必修2训练:2.2.1 化学能转化为电能 Word版含解析

课时提升作业八化学能转化为电能(25分钟50分)一、选择题(本题包括6小题,每小题5分,共30分)1.(2018·成都高一检测)根据如图,判断下列说法中错误的是( )A.铁电极为负极,铜电极为正极B.导线中电流方向为铁→铜C.溶液中阴离子移向铁电极D.正极电极反应式: 2H++2e-H2↑【解析】选B。
铁的金属性强于铜,则铁电极为负极,铜电极为正极,A 正确;导线中电流方向为铜→铁,B错误;溶液中阴离子移向负极铁电极,C正确;正极氢离子放电,电极反应式为2H++2e-H2↑,D正确。
2.下列装置能形成原电池的是( )A.①②③⑦B.①②⑤⑥C.①②③④D.①②③⑥⑦【解析】选A。
根据构成原电池的“两极一液一线一反应”判断,装置④不能形成闭合回路;装置⑤不具有两个活动性不同的电极,只能发生氧化还原反应;装置⑥中酒精不是电解质溶液。
3. (2018·三门峡高一检测)如图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒。
关于此装置的下列叙述中,不正确的是( )A.N上有气体放出B.M为负极,N为正极C.是化学能转变为电能的装置D.导线中有电流通过,电流方向是由M到N【解析】选D。
原电池中活泼金属为负极,失去电子,即M为负极,溶液中的氢离子在正极得到电子被还原为H2,则N为正极。
电流方向与电子流向相反,应由正极(N)流向负极(M)。
4.(2018·珠海高一检测)有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为C2++2e-C,B-2e-B2+,则A、B、C、D金属性由强到弱的顺序为 ( )A.A>B>C>DB.A>B>D>CC.D>A>B>CD.D>C>A>B【解析】选C。
当A、B组成原电池时,电子流动方向A B,可知金属性A>B;当A、D组成原电池时,A为正极,可知金属性D>A;B与C构成原电池时,电极反应式为C2++2e-C,B-2e-B2+,可知金属性B>C,综合可知金属性顺序为D>A>B>C。
人教版高中化学必修2第二章第二节第1课时 《化学能转化为电能》练习题

必修2 第二章第二节第1课时化学能转化为电能一、选择题1.下列说法正确的是()A.原电池是把电能转化为化学能的装置B.原电池中电子流出的一极是正极,发生氧化反应C.原电池两极板均发生氧化还原反应D.原电池内部的阳离子向正极移动2.在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述错误的是()2-浓度逐渐增大A.负极附近的SO4B.电子通过导线向铜片流向锌片C.反应一段时间后,溶液的H+浓度降低D.铜片上有H逸出23.下列装置能形成原电池的是()A.B.C.D.4.原电池发生电流的本质原因是()A.原电池中溶液能电离出自由移动的离子B.用两根导线将两个活动性不同的电极连接C.电极上进行的氧化还原反应的生成物为电子D.电极上进行的氧化还原反应中会有电子的转移5.A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A与B 和酸溶液组成原电池时,B为电池的负极。
A、B、C三种金属的活动性顺序为()A.A>B>CB.A>C>BC.B>A>CD.B>C>A6.如图所示装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的()A.A是Zn,B是Cu,C为稀H2SO4B.A是Cu,B是Zn,C为稀H2SO4C.A是Fe,B是Ag,C为稀AgNO3溶液D.A是Ag,B是Fe,C为稀AgNO3溶液7.有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀硫酸溶液中,A极为负极②C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D流向C③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡④B、D相连后,同时浸入稀硫酸溶液中,D极发生氧化反应据此,判断四种金属的活动性顺序是()A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>D>C>A8.将甲、乙两种金属的性质相比较,已知:①甲与水反应比乙与水反应剧烈;②甲单质能从乙的盐溶液中置换出乙单质;③甲的最高价氧化物的水化物的碱性比乙的最高价氧化物的碱性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤以甲、乙金属为电极构成原电池,甲作负极。
2021年高中化学人教版必修2(练习)2.2.1 化学能转化为电能 Word版含解析

第1课时化学能转化为电能方针导航] 1.了解动力的分类和化学能与电能的转化联系。
2.知道原电池是运用氧化复原反响将化学能转化为电能的设备,经过试验会阐明原电池的原理,以及判别原电池的正、负极。
3.会正确书写电极反响式,熟知原电池的运用。
一、一次动力和二次动力1.动力按其来历可分为一次动力和二次动力。
动力类别界说实例一次动力直接从自然界中取得的动力太阳能、风能、地热能、潮汐能、原煤、石油、天然气等二次动力由一次动力经过加工、转化得到的动力电能(水电、火电、核电)、蒸汽能、机械能等2.二次动力——火力发电1.火力发电原理:首要经过化石燃料焚烧,使化学能转变为热能,加热水使之汽化为蒸汽以推进蒸汽轮机,然后带动发电机发电。
2.能量转化进程:化学能热能机械能电能。
其间能量转化的关键环节是焚烧。
3.火力发电坏处:①煤归于不行再生资源,用一点少一点,用煤发电会构成资源的糟蹋。
②能量经过屡次转化,运用率低,能量丢失大。
③煤焚烧会产生有害物质(如SO2、CO、NO2、粉尘等),污染环境。
议一议判别正误,正确的打“√”,过错的打“×”1.依据一次动力和二次动力的区分,氢气为二次动力()2.电能是现代社会中运用最广泛、运用最便利、污染最小的一种二次动力()3.火力发电是化学能直接转化为电能的进程()4.水力发电是将化学能转化为电能的进程()答案(1)√(2)√(3)√(4)×二、化学能直接转化为电能1.按要求完结下列试验,并填表试验进程现象解说或阐明锌片逐步溶解,外表有气泡;铜片外表无气泡锌与稀硫酸产生置换反响产生H2,而铜则不能锌片逐步溶解,铜片外表有气泡,电流表指针产生偏转锌与稀硫酸反响,但氢气在铜片上产生,导线中有电流两锌片逐步溶解且外表都有气泡,电流表指针不偏转锌与稀硫酸反响,但导线中无电流 无现象乙醇对错电解质,与Zn 、Cu 都不反响2.原电池1. 概念:是将化学能转变为电能的设备;原电池的反响本质是氧化复原反响。
化学必修Ⅱ人教新课标2-2-1化学能转化为电能训练课件(30张)

Zn+ 2H+ = Zn2+ + H2↑
【实验二】
➢再用导线把锌片和铜片连接起来,观察 铜片上有无气泡产生? ➢在导线中间接入一个电流表, 观察电流表的指针是否偏转?
A
[实验现象]:铜片上有气泡产生,锌片不断 溶解,电流表的指针发生偏转。 [实验结论]:导线中有电流通过
2020/12/31
9
明确以下几点
①原电池的工作原理是将氧化还原反应分在 正(氧化)、负(还原)两极进行,负极上失去 的电子流入正极,从而产生电流。
②正负两极上进出电子总数相等,根据电 子守恒原理可进行许多有关电极反应的计算。
③原电池反应跟直接反应差别:
反应速率加快;一般只有一个电极直接参加反应。
④利用原电池原理 可制作各种电池,如干电
池、铅蓄电池、银锌电池、锂电池、氢氧燃料电 池……。
2020/12/31
10
3、化学电池的组成: 正极、负极、电解质溶液以及容器。
4、原电池的构成条件
①两种活泼性不同的金属(或一种金属和 另一种非金属导体)构成电极。 ②电解质溶液。 ③电极用导线相联构成闭合回路。
5,原电池化学反应本质氧: 化还原反应
较活泼的金属发生氧化反应,电子从较活 泼的金属(负极)通过外电路流向较不活泼的 金属(正极)
⒈ 判断下列哪些装置构成了原电池?若不是,
请说明理由;若是,请指出正负极名称,并
练
写出电极反应式.
习
①
②
(×)
(×)
③ (∨)
2020/12/31
负极: Zn-2e-= Zn2+
负极 铜锌原电池 正极
Zn-2e=Zn2+
高一化学每课一练 2.2化学能转化为电能(人教版必修2)两课时

2.2 化学能与电能 第1课时 化学能转化为电能练基础落实 1.对于原电池的电极名称叙述有错误的是( )A .发生氧化反应的为负极B .正极为电子流入的一极C .比较不活泼的金属为负极D .电流的方向由正极到负极2.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )A .Zn +Ag 2O +H 2O===Zn(OH)2+2AgB .Pb +PbO 2+2H 2SO 4===2PbSO 4+2H 2OC .Zn +CuSO 4===Cu +ZnSO 4D .C +CO 2=====高温2CO3.茫茫黑夜中,航标灯为航海员指明了方向。
航标灯的电源必须长效、稳定。
我国科技工作者研制出以铝合金、Pt-Fe 合金网为电极材料的海水电池。
在这种电池中( )①铝合金是正极 ②铝合金是负极 ③海水是电解液 ④铝合金电极发生还原反应A .②③B .②④C .①②D .①④4.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( ) 5.如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a 极上有大量气泡生成,则以下叙述正确的是( )A .a 为负极,是铁片,烧杯中的溶液为硫酸B .b 为负极,是铁片,烧杯中的溶液为硫酸铜溶液C .a 为正极,是碳棒,烧杯中的溶液为硫酸D .b 为正极,是碳棒,烧杯中的溶液为硫酸铜溶液练方法技巧——原电池正、负极及电极反应的判断6.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2Cd +2NiO(OH)+2H 2O 由此可知,该电池放电时的负极材料是( ) A .Cd(OH)2 B .Ni(OH)2 C .Cd D .NiO(OH)7.据报道,美国正在研究用锌电池取代目前广泛使用的铅蓄电池,锌电池具有容量大、污染少等优点,其电池反应为2Zn +O 2===2ZnO ,其原料为锌粉、电解液和空气。
人教版高中化学必修二2.2.1化学能转化为电能

高中化学学习材料金戈铁骑整理制作第二节化学能与电能第1课时化学能转化为电能1.关于原电池的叙述中正确的是()A.构成原电池的两个电极必须是两种不同的金属B.原电池是将化学能转变为电能的装置C.原电池工作时总是负极溶解,正极上有物质生成D.原电池的正极是还原剂发生反应,总是溶液中的阳离子在此被还原解析:构成原电池电极的也可以是非金属导体,A项错;燃料电池中负极不溶解,C项错;D项应是氧化剂在原电池的正极上发生还原反应。
答案:B2.(2013·山东烟台高一检测)如图为番茄电池,下列说法正确的是()A.一段时间后,锌片质量会变小B.铜电极附近会出现蓝色C.电子由铜通过导线流向锌D.锌电极是该电池的正极解析:番茄电池中锌是负极,铜是正极,负极锌会失去电子溶解,质量减小,A正确、D错误;铜极是正极,电子由负极锌移向正极铜,C错误;铜电极不会出现蓝色,B错误。
答案:A3.下列装置能形成原电池的是()解析:A项,酒精溶液是非电解质溶液,B项,两电极都是石墨棒,为惰性电极,D项,不能构成闭合回路,所以A、B、D都不正确。
C项,符合构成原电池的条件,电极反应方程式为:Fe-2e-Fe2+(负极);Cu2++2e-Cu(正极)。
答案:C4.A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A、B和酸溶液组成原电池时,B为电池的负极。
A、B、C三种金属的活动性顺序为()A.A>B>CB.A>C>BC.B>A>CD.B>C>A解析:A能从C的盐溶液中置换出C金属,活动性:A>C。
A与B组成原电池时,B为负极,则金属活动性:B>A。
答案:C5.将相同表面积的纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是()A.两烧杯中铜片表面均无气泡产生B.甲中铜片是正极,乙中铜片是负极C.甲中铜被氧化,乙中锌被氧化D.产生气泡的速率甲比乙大解析:根据图示可知甲构成原电池,乙未构成原电池,所以甲中Zn作负极,被氧化,Cu作正极,H+在铜片上被还原产生H2,而乙中Cu不与稀硫酸作用,Zn与稀硫酸发生氧化还原反应,因甲构成原电池而加大反应速率。
新人教版必修2高一化学课时练习:2.2.1-化学能转化为电能

化学能转化为电能题组一一次能源和二次能源1.下列有关能源的说法错误的是( )A.风能是人类通过风车等工具获取的能源,但属于一次能源B.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源C.月球土壤中含有丰富的质量数为3的氦,它可作为未来核能的重要原料D.原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源考点能源与构成原电池的条件题点能源的分类答案 D解析风能是直接从自然界中取得的能源,属于一次能源,A正确;原电池提供的电能是由化学能转化而得到的,不是直接获得的,属于二次能源,D错误;随着时代的发展,化石能源逐渐枯竭,所以新能源时代污染小的核能、太阳能、氢能将成为主要能源,B、C正确。
2.下面是有关各种形式能量的相互转化途径的叙述,其中错误的是( )A.家庭液化气灶将化学能转变为热能B.灯泡将电能全部转变为光能C.光合作用将光能转变为化学能D.太阳能电池将光能转变为电能考点能源与构成原电池的条件题点能量的转化方式答案 B解析灯泡除了将电能转变为光能之外,还转变为热能等其他形式的能。
题组二化学能转化为电能3.如图所示各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )考点能源与构成原电池的条件题点原电池的形成条件与判断答案 D解析原电池的形成条件包括活动性不同的电极、电解质溶液、形成闭合回路、自发进行氧化还原反应。
对图示各个装置进行观察,发现只有D不能形成闭合回路,因此不能形成原电池。
4.下列关于原电池的叙述,正确的是( )A.构成原电池的正极和负极材料必须是两种活泼性不同的金属B.原电池是将化学能转变为电能的装置C.在原电池中,电子流出的一极是负极,该电极被还原D.原电池放电时,电流的方向是从负极到正极考点原电池工作原理和正负极的判断题点原电池构成和原理的理解答案 B解析构成原电池的正极和负极可以是两种活泼性不同的金属,也可以是导电的非金属(如石墨棒)和金属,A错误;原电池是将化学能转变为电能的装置,B正确;在原电池中,负极上发生失去电子的氧化反应,正极上发生得到电子的还原反应,所以电子从负极沿导线流向正极,C错误;原电池放电时,电子从负极沿导线流向正极,则电流的方向是从正极到负极,D错误。
高一人教版化学必修二全册同步练习:2.2.1化学能转化为电能

其次节化学能与电能第1课时化学能转化为电能一、单项选择题1.能源可分为一次能源和二次能源,自然界中以现成形式供应的能源称为一次能源,需依靠其他能源的能量间接制取的能源称为二次能源。
据此推断,下列叙述正确的是()。
A.自然气是二次能源B.石油是二次能源C.电能是一次能源D.水力是一次能源2.下列说法正确的是()。
A.需要加热的化学反应都是吸热反应B.中和反应都是放热反应C.原电池是将电能转化为化学能的一种装置D.水力发电是将化学能转化为电能的过程3.下列叙述不正确...的是()。
A.依据一次能源和二次能源的划分,氢气为二次能源B.电能是现代社会中应用最广泛、使用最便利、污染最小的一种二次能源C.火电是将燃料中的化学能直接转化为电能的过程D.在火电过程中,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化4.关于原电池的叙述中正确的是()。
A.构成原电池的电极是两种不同的金属B.原电池是将化学能转化为电能的装置C.原电池负极发生的电极反应是还原反应D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原5.某原电池总反应离子方程式为Mg+2H+===Mg2++H2↑,能实现该反应的原电池是()。
A.正极为铜,负极为镁,电解质溶液为稀盐酸B.正极为铜,负极为铁,电解质溶液为稀硫酸C.正极为石墨,负极为镁,电解质溶液为CuSO4溶液D.正极为银,负极为镁,电解质溶液为NaCl溶液6.下列变化是由于原电池反应而引起的是()。
A.在空气中金属铝表面快速氧化形成爱护膜B.常温下,铁被浓硫酸钝化形成爱护膜C.在潮湿的空气中钢铁易生锈D.在潮湿的空气中过氧化钠易变质7.在图2-2-1所示的原电池中,下列说法正确的是()。
图2-2-1A.Zn为负极,Cu为正极B.正极反应为Zn-2e-===Zn2+C.负极反应为Cu-2e-===Cu2+D.该装置能将电能转化为化学能8.某试验爱好小组用如图2-2-2所示装置做完试验后,在读书卡片上登记了如下6条记录,其中合理的是()。
高一化学人教版必修二课时作业:2.2.1化学能转化为电能(有答案)
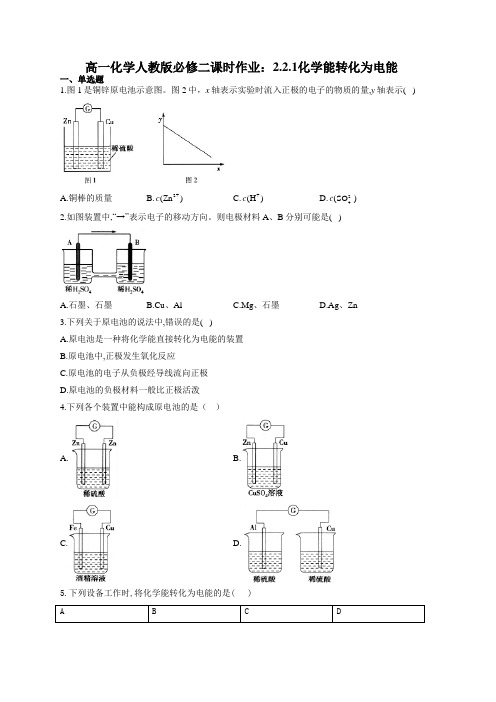
高一化学人教版必修二课时作业:2.2.1化学能转化为电能一、单选题1.图1是铜锌原电池示意图。
图2中,x 轴表示实验时流入正极的电子的物质的量,y 轴表示( )A.铜棒的质量B.2+(Zn )cC.+(H )cD.2-4(SO )c2.如图装置中,“→”表示电子的移动方向。
则电极材料A 、B 分别可能是( )A.石墨、石墨B.Cu 、AlC.Mg 、石墨D.Ag 、Zn3.下列关于原电池的说法中,错误的是( )A.原电池是一种将化学能直接转化为电能的装置B.原电池中,正极发生氧化反应C.原电池的电子从负极经导线流向正极D.原电池的负极材料一般比正极活泼4.下列各个装置中能构成原电池的是( )A. B.C. D.5.下列设备工作时,将化学能转化为电能的是( )铅蓄电池充电锂离子电池放电太阳能集热器燃气灶6.氧化反应和还原反应分别在两个电极上自发进行时,便能构成原电池。
下列氧化还原反应中,在一定条件下不能构成原电池的是( )A.2FeCl2+Cl2=2FeCl3B.Zn+Ag2O+H2O=Zn(OH)2+2AgC.Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2OD.2H2+O2=2H2O7.下列有关原电池的叙述中不正确...的是( )A.原电池是将化学能转化为电能的装置B.在原电池中,电子流出的一极是负极,发生氧化反应C.原电池中,电解质溶液中的阴离子会移向负极D.构成原电池的两个电极必须是活泼性不同的两种金属8.发生原电池的反应通常是放热反应,在理论上可设计成原电池的是( )A.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0B.Ba(OH)2.8H2O+2NH4Cl(s)=BaCl2(aq)+2NH3.H2O(l)+8H2O(l) ΔH>0C.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g) ΔH<0D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<09.可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。
人教版必修2高一化学一课一练:2.2 化学能与电能

2.2 化学能与电能1.一种既能提供电能又能固氮的新型氢氮燃料电池的工作原理如图所示,其中电解质溶液为溶有化合物A的稀盐酸。
下列有关表述错误的是()A.通入N2的电极发生的电极反应式为N2+6e-+8H+===2NH+4B.该装置能将化学能转化为电能,化合物A为NH4ClC.电子从通入N2的电极流出,经过用电器流向通入H2的电极D.反应过程中电解质溶液的pH会变大,故需要通入氯化氢气体解析:该电池的本质是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2+6e-+8H+===2NH+4,A项正确;通入氢气的电极为负极,生成的铵根离子与氯化氢结合生成氯化铵,所以A是NH4Cl,B项正确;该装置是原电池装置,电子由负极通过外电路流向正极,即由通入氢气的电极沿外电路流向通入氮气的电极,C项错误;反应过程中,H +不断消耗导致pH值变大,需要通入氯化氢气体,D项正确。
答案:C2.MgAgCl电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是() A.负极反应式为Mg-2e-===Mg2+B.正极反应式为Ag++e-===AgC.电池放电时Cl-由正极向负极迁移D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑解析:MgAgCl电池的电极反应:负极Mg-2e-===Mg2+,正极AgCl+e-===Ag+Cl-,A项正确,B项错误。
在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极,C项正确。
Mg是活泼金属,能和H2O发生反应生成Mg(OH)2和H2,D项正确。
答案:B3.锌、稀硫酸和铜组成的原电池装置中,当导线中有1 mol电子通过时,理论上两极的变化是()①锌片溶解32.5 g;②锌片增重32.5 g;③铜片上析出1 g H2;④铜片上析出1 mol H2A.①③B.①④C.②③D.②④解析:由电池总反应Zn+2H+===Zn2++H2↑、正极反应2H++2e-===H2↑、负极反应Zn-2e-===Zn2+可知,每当1 mol电子通过铜片时,会有0.5 mol(即32.5 g)锌溶解,铜片上析出0.5 mol(即1 g)H2。
2022高一化学每课一练21化学能与热能(人教版必修2)

2.1 化学能与热能每课一练〔人教版必修2〕练根底落实1.以下过程一定释放能量的是()A.化合反响B.分解反响C.分子拆成原子D.原子组成分子催化剂2.2SO2+O 22SO3为放热反响,对该反响的以下说法正确的选项是() A.O2的能量一定高于SO2的能量B.SO2和O2的总能量一定高于SO3的总能量C.SO2的能量一定高于SO3的能量D.因该反响为放热反响,故不必加热就可发生3.以下反响既是氧化复原反响,又是吸热反响的是()A.铝片与稀H2SO4的反响B.Ba(OH)2·8H2O与NH4Cl的反响C.灼热的炭与CO2的反响D.甲烷在O2中的燃烧反响4.以下有关能量转换的说法不正确的选项是()A.煤燃烧是化学能转化为热能的过程C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成化学能的过程5.化学反响A2+B2===2AB的能量变化如下列图,那么以下说法正确的选项是() A.该反响是吸热反响B.断裂1molA—A键和1molB—B键能放出x kJ的能量C.断裂2molA—B键需要吸收y kJ的能量D.2molAB的总能量高于1molA2和1molB2的总能量练方法技巧——化学能与热能转化的有关计算方法6.25 ℃、101kPa下,含1mol碳原子的石墨完全燃烧生成CO2放出热量393.51kJ;含1mol碳原子的金刚石完全燃烧生成CO2放出395.41kJ的热量。
据此判断,以下说法正确的选项是()A.由石墨制备金刚石是吸热反响;等质量时,石墨的能量比金刚石的低B.由石墨制备金刚石是吸热反响;等质量时,石墨的能量比金刚石的高C.由石墨制备金刚石是放热反响;等质量时,石墨的能量比金刚石的低D.由石墨制备金刚石是放热反响;等质量时,石墨的能量比金刚石的高7.:①1molH2分子中化学键断裂时需要吸收436kJ的能量;②1molCl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量。
精选人教版高中化学必修2练习:2.2.1化学能转化为电能含答案

课时自测·基础达标1.(2018·柳州高一检测)下列可设计成原电池的化学反应是( )A.H2O(l)+CaO(s)Ca(OH)2(s)B.Ba(OH)2·8H2O+2NH4Cl BaCl2+2NH3·H2O+8H2OC.2KClO32KCl+3O2↑D.CH4(g)+2O2(g)CO2(g)+2H2O(l)【解析】选D。
可设计成原电池的化学反应是能自发进行的氧化还原反应,A、B错误,C中反应是氧化还原反应,但是反应物只有一种,不能在正极和负极分别反应,错误。
2.(2018·聊城高一检测)X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。
X、Y、Z三种金属的活动性顺序为( )A.X>Y>ZB.X>Z>YC.Y>X>ZD.Y>Z>X【解析】选C。
根据原电池原理,负极的金属比正极活泼,可知Y>X,根据金属活动性顺序和置换反应原理,可知X>Z,故有Y>X>Z。
3.(2018·湛江高一检测)如图为锌、铜水果电池装置示意图,下列说法正确的是( )A.铜片为负极,发生还原反应B.锌片上发生还原反应:Zn-2e-Zn2+C.该装置将电能转变为化学能D.电子由锌片沿导线流向铜极【解析】选D。
原电池中较活泼的金属是负极,失去电子,发生氧化反应。
电子由负极经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。
A.锌的金属性强于铜,锌是负极,铜是正极,A错误;B.锌片是负极,发生氧化反应:Zn-2e-Zn2+,B错误;C.该装置是原电池,将化学能转变为电能,C错误;D.电子由负极锌片沿导线流向正极铜极,D正确。
4.(2018·南宁高一检测)如图,在银锌原电池中,以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(“氧化”或“还原”)反应,电极反应式为____________,锌片上观察到的现象为____________________,银为______极,电极上发生的是______(“氧化”或“还原”)反应,电极反应式是__________,银片上观察到的现象是________________。
高中化学2-2-1化学能转化为电能课时作业新人教版必修2

2014-2015学年高中化学 2-2-1 化学能转化为电能课时作业新人教版必修2一、选择题(每小题4分,共48分,每小题有1-2个正确选项)1.(多选)下列关于锌、铜和稀硫酸构成的原电池的说法中,正确的是()A.锌是负极、铜是正极B.电子从铜片经导线流向锌片C.负极的反应式为2H++2e-===H2↑D.反应一段时间后,溶液的pH升高2.如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是()①Zn为正极,Cu为负极;②H+向负极移动;③电子是由Zn经外电路流向Cu;④Cu极上有H2产生;⑤若有1 mol电子流过导线,则产生的H2为0.5 mol;⑥正极的电极反应式为Zn-2e-===Zn2+A.①②③B.③④⑤C.④⑤⑥D.②③④3.如图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒。
下列关于此装置的叙述中,不正确的是()A.N上有气体放出B.M为负极,N为正极C.化学能转变为电能的装置D.导线中有电流通过,电流方向由M到N4.锌、稀硫酸和铜组成的原电池装置中,当导线中有1 mol电子通过时,理论上两极的变化是()①锌片溶解32.5 g;②锌片增重32.5 g;③铜片上析出1 g H2;④铜片上析出1 mol H2A.①和③B.①和④C.②和③D.②和④5.两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是()6.如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细。
下表所列M、N、P物质中,可以组合成该装置的是()选项号M N PA 锌铜稀硫酸B 铜铁稀盐酸C 银锌硝酸银溶液D 锌铁硝酸铁溶液7.有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4中,电流由D→导线→C;③A、C用导线相连后,同时浸入稀H2SO4中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀H2SO4中,D极发生氧化反应。
2020年高一化学人教必修2同步课时检测:2.2第1课时《化学能转化为电能》【答案+解析】

2020 年高一化学人教必修2:——《化学能转变成电能》课时检测一、选择题1.将铁片和银片用导线连结置于同一稀盐酸溶液中,经过一段时间后,下列各项表达正确的选项是 ( D )A.负极有 Cl 2逸出,正极有 H2逸出B.负极邻近 Cl -的浓度减小C.正极邻近 Cl -的浓度渐渐增大D.溶液中 Cl -的浓度基本不变分析:铁片、银片、稀盐酸构成的原电池,负极反响-2+,正极Fe- 2e ===Fe反响 2H++ 2e- ===H2↑,溶液中阴离子移向负极,阳离子移向正极,负极邻近Cl -浓度变大,但整个溶液中 Cl -浓度不变,只有 D 项正确。
2.某小组同学用锌片、铜片、导线、电流计、橙汁、烧杯等用品研究原电池的构成。
以下结论错误的选项是 ( D )A.原电池是将化学能转变成电能的装置B.原电池的负极发生氧化反响C.图中 a 极为铜片、 b 极为锌片刻, a 极上有气泡产生D.图中 a 极为铜片、 b 极为锌片刻,电子由铜片经过橙汁流向锌片分析:铜片、锌片、橙汁构成的原电池,将化学能转为电能, A 项正确;锌片作负极,发生氧化反响, B 项正确;橙汁显酸性,在正极铜片上生成H2,C 项正确;电子由负极锌片流出,经导线流向铜片, D 项错误。
3.(2019 ·沈阳高一期中 ) 将等质量的两份锌粉a、 b 分别加入两份同样体积、同样物质的量浓度且过度的稀硫酸中,同时向 a 中加入少许的 CuSO4溶液,以下各图为产生H2的体积 V(L) 与时间 t (min) 的关系,此中正确的选项是( A )分析:锌粉质量相等,硫酸过度, a 中加入 CuSO4溶液,少许锌粉与Cu2+反应而减少, a 中生成 H2量少,锌铜形成原电池,加速反响速率,所以选A。
4.(2019 ·徐州高一检测 ) 一学生用如图装置研究原电池原理,以下说法错误的是 ( D )A.(1)图中铜棒上没有气体产生B.(2)图中假如两极上都有气体产生,则说明锌片不纯C.(2)图与 (3) 图中正极生成物质量之比为 132 时,锌片减少的质量相等D.(3) 图中锌片增重质量与铜棒减少质量的比值为6564分析:装置图 (1) ,锌和稀硫酸发生反响生成氢气,铜和稀硫酸不反响,图(1)中铜棒上没有气体产生,故 A 正确;图 (2) 是原电池装置,锌作负极,铜作正极,溶液中氢离子在铜电极生成氢气,锌片不纯会形成原电池,锌片表面也有气体生成,故 B 正确;图(2) 与图 (3) 中负极电极反响-2+,图 (2) Zn-2e===Zn中正极上电极反响++2e-2 2 +-2H===H↑,图 (3)中正极电极反响为 Cu+ 2e ===Cu,正极生成物质量之比为132 时,依照电子守恒计算两个原电池中电子转移相同,所以反响的锌的质量同样,故C正确;图 (3) 是原电池装置,锌作负极失电子生成锌离子,铜作正极,溶液中铜离子获得电子生成铜,锌电极减少,铜电极增重,故 D错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.2 化学能与电能 第1课时 化学能转化为电能 每课一练
(人教版必修2)
练基础落实
1.对于原电池的电极名称叙述有错误的是( )
A .发生氧化反应的为负极
B .正极为电子流入的一极
C .比较不活泼的金属为负极
D .电流的方向由正极到负极
2.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
A .Zn +Ag 2O +H 2O===Zn(OH)2+2Ag
B .Pb +PbO 2+2H 2SO 4===2PbSO 4+2H 2O
C .Zn +CuSO 4===Cu +ZnSO 4
D .C +CO 2=====高温2CO
3.茫茫黑夜中,航标灯为航海员指明了方向。
航标灯的电源必须长效、稳定。
我国科技
工作者研制出以铝合金、Pt-Fe 合金网为电极材料的海水电池。
在这种电池中( ) ①铝合金是正极 ②铝合金是负极 ③海水是电解液 ④铝合金电极发生还原反应
A .②③
B .②④
C .①②
D .①④
4.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )
5. 如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a 极上有大量气
泡生成,则以下叙述正确的是( )
A .a 为负极,是铁片,烧杯中的溶液为硫酸
B .b 为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C .a 为正极,是碳棒,烧杯中的溶液为硫酸
D .b 为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
练方法技巧——原电池正、负极及电极反应的判断
6.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd(OH)2+2Ni(OH)2Cd +2NiO(OH)+2H 2
O 由此可知,该电池放电时的负极材料是( )
A .Cd(OH)2
B .Ni(OH)2
C .Cd
D .NiO(OH)
7.据报道,美国正在研究用锌电池取代目前广泛使用的铅蓄电池,锌电池具有容量大、 污染少等优点,其电池反应为2Zn +O 2===2ZnO ,其原料为锌粉、电解液和空气。
则下 列叙述正确的是( )
A .锌为正极,空气进入负极
B .负极反应为Zn -2e -===Zn 2+
C .正极发生氧化反应
D .电解液是酸溶液
题号
1 2 3 4 5 6 7 答案
练综合拓展
8.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝
片作电极,但甲同学将电极放入6 mol·L -1 H 2SO 4溶液中,乙同学将电极放入6 mol·L -1
的NaOH 溶液中,如下图所示。
(1)写出甲池中正极的电极反应式:
正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式: 充电 放电
负极:________________________________________________________________。
总反应的离子方程式:______________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金
属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?()
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种
做法________(可靠或不可靠)。
如不可靠,请你提出另一个判断原电池正负极的可行实验方案_________________________________________________________
________________________________________________________________________ ________________________________________________________________________ (如可靠,此空可不填)。
参考答案
1.C[原电池中相对活泼的金属为负极,不活泼的为正极,C项错误;负极发生氧化反应,正极发生还原反应,A项正确;原电池工作时,外电路中电子由负极流出,由正极流入,电流方向与电子流动方向相反,B、D项正确。
]
2.D[D是吸热的氧化还原反应,反应过程中吸收能量,不能设计为原电池。
]
3.A[分析航标灯的电源结构,活泼金属铝合金作负极,相对不活泼金属Pt-Fe合金作正极,电解液是海水;铝合金作负极发生的是氧化反应,故①④错误,②③正确。
] 4.A[由题给装置图知,A、B、C形成原电池,由于金属活动顺序表中Cu、Ag排在H的后面,而Zn排在H的前面,故A中有气体产生。
]
5.C[Fe、C形成的原电池中,负极铁失去电子,变成+2价的亚铁离子,由于a极上有大量气泡生成,所以正极(C)电极反应:2H++2e-===H2↑,a为正极,是碳棒;b为负极,是铁片;电解质溶液为硫酸。
]
6.C[根据镍镉可充电电池放电的反应原理Cd+2NiO(OH)+2H2O===Cd(OH)2+2Ni(OH)2,Cd被氧化生成Cd(OH)2,NiO(OH)被还原生成Ni(OH)2,即Cd发生氧化反应,是失去电子的物质,NiO(OH)发生还原反应,是得到电子的物质,所以,Cd为负极,NiO(OH)为正极,即电池的负极材料是Cd,C项正确。
]
7.B[根据电池反应2Zn+O2===2ZnO判断,锌为负极,负极反应为Zn-2e-===Zn2+,所以A不正确,B正确;正极发生还原反应,所以C不正确;电解液若为强酸,将与锌发生化学反应,而不是O2与锌反应,所以D不正确。
]
8.(1)2H++2e-===H2↑
(2)2Al+8OH--6e-===2AlO-2+4H2O
2Al+2OH-+2H2O===2AlO-2+3H2↑
(3)Mg Al(4)AD
(5)不可靠将两种金属作电极连上电流计后插入电解质溶液,构成原电池。
利用电流
计测定电流的方向,从而判断电子流动方向,再确定原电池正负极
解析甲同学依据的化学反应原理是Mg+H2SO4===MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
但是由于Al与碱的反应是一特例,不可作为判断金属性强弱的依据。
所以判断一个原电池的正负极应依据实验事实。
