HPMC合批记录-1
GMP批生产记录管理制度

目的:规范批生产记录管理,使生产记录能全面地、准确地反映某批产品的生产历史及与质量有关的情况。
适用范围:批生产记录的管理。
责任:岗位操作人员、班组长负责执行,生产部负责人、QA质监员、质保部负责人负责监督本制度的实施。
内容:1.批生产记录定义:1.1批生产记录是为一个批次的产品生产所有完成的活动和达到的结果提供客观证据的文件。
它记录了一个批次的待包装品或成品的所有生产过程,提供该批产品的生产历史、以及与质量有关的情况。
具有以下作用:1.1.1为质量保证部进行批次质量审计,确定是否放行,提供真实、客观的依据,以便质量保证部门做出正确判断;1.1.2提供对有缺陷的产品或用户投拆产品进行调查与追溯的证据和信息,以便做出正确的处理决定,确认是否应该迅速召回产品;1.1.3用于对产品的回顾性评价。
它以批记录为依据,以数理统计为手段,可以发现潜在的质量问题以及批生产指令和批包装指令的不完善处,为标准的修订提供信息和依据;1.1.4用于回顾性验证,提供设备与工艺管理改进的信息。
2.技术依据:2.1产品工艺规程、岗位标准操作规程;2.2原辅料质量标准、中间产品质量标准、成品质量标准、包材质量标准;2.3相关药品法规要求。
3.批生产记录的制定:3.1批生产记录由工艺员制定,生产部负责人审核,质保部负责人批准后执行。
批生产记录的制定、审核、批准、修改、收回、保存等,应遵循《GMP文件的制定、审批、颁发管理规定》要求;3.2批生产记录在下列情况下应进行修改:3.2.1生产工艺或生产实际情况发生改变时;3.2.2质量标准和包装设计发生变更时;3.2.3国家相关法规要求变更时;3.2.4新批生产记录下发时,应从各相应部门及时收回旧批生产记录,以保证工作现场只有现行的批生产记录。
4.批生产记录主要内容:4.1产品特征内容:产品名称、规格等;4.2指令基本内容:批号、计划产量、生产操作方法、质量要求、作业顺序、SOP编号、生产工序、设备及其编号等;4.3记录表格内容:物料名称、生产加工数量、操作人与复核人签名、开始生产日期与时间、炮制过程记录、生产结束日期与时间、生产过程控制记录、各相关生产阶段的产品数量、物料平衡的计算、退料记录、异常、偏差问题分析解释处理及结果记录、特殊问题记录、清场记录、原辅料编号及成品检验报告等;5.批生产记录的填写、复核与审核:5.1填写生产记录按《记录的填写规定》的要求进行填写;5.2复核生产记录的注意事项:5.2.1必须按每批岗位操作记录串联复核;5.2.2必须将记录内容与生产工艺规程,岗位操作规程对照复核;5.2.3上下工序及成品记录中的数量、质量、批号、容器号必须一致、正确;5.2.4对生产记录中不符合要求的填写方法、必须由填写人更正并签字;5.2.5若发现异常情况必须查明原因,做出合理的说明,并作详细的记录、经办人、复核人签字。
净制批记录

中药饮片净制批记录
品名:
批号:
生产前清场结论:
检查者签名:时间:年月日
注:经检查,清场合格后方可进行以下操作(附生产前清场合格证)
批号:生产地点:
批量:生产日期:年月日至年月日
工序负责人:
生产前清场结论:
检查者签名:时间:年月日
注:经检查,清场合格后方可进行以下操作(附生产前清场合格证)
批号:生产地点:
批量:生产日期:年月日至年月日
生产前清场结论:
检查者签名:时间:年月日注:经检查,清场合格后方可进行以下操作(附生产前清场合格证)批号:生产地点:
批量:包装规格:
生产日期:年月日至年月日
包装岗位相关文件:SOP-PM-032-01
中药饮片净制—包装工序批记录(2)
核算人:车间负责人:。
批生产记录簿-HR
转入板蓝根重量Kg
操作人:_____复核人:_____
监控员:_____
1号提取罐投料量:Kg
第一次加水量:L
煎煮时间:从时分至时分
第二次加水量:L
煎煮时间:从时分至时分
2号提取罐投料量:Kg
第一次加水量:L
煎煮时间:从时分至时分
第二次加水量:L
3、分次称量,并记录每次称取量。
编号/批号数量报告单号
清膏_________ _______ _______
蔗糖粉_________ _______ _______
糊精_________ _______ _______
操作人:_____复核人:_____
监控员:_____)
操作人:_____复核人:_____
收率计算
收率=清膏重量/原料总投料量×100%
(应为18.0~20.0%)
收率=()/()×100%
=()%_
计算人:_____复核人:_____
清
场
1、按“洁净区生产操作区清洁规程”进行清洁工作区。
2、按“可倾式真空浓缩罐清洁规程”清洁可倾式真空浓缩罐。
3、按“洁净区容器具清洁规程”清洁容器具。
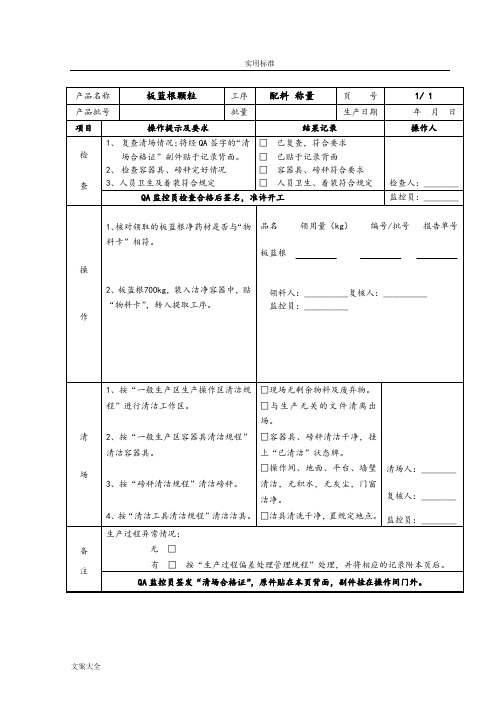
产品名称
板蓝根颗粒
工序
配料称量
页 号
1/ 1
产品批号
批量
生产日期
年 月 日
项目
操作提示及要求
结果记录
操作人
检
查
1、复查清场情况;将经QA签字的“清场合格证”副件贴于记录背面。
2、检查容器具、磅秤完好情况
3、人员卫生及着装符合规定
□ 已复查,符合要求
PMC常用表格【范本模板】

SC—SC/BD——-02XX公司生产计划变更通知单编号: 年月日制单人: 批准人:注:一式六联。
一联生产部存根,一联报生产总监,一联报质量管理部,一联报采购部,一联报库管部,一联报销售部。
SC-SC/BD---01XX公司生产计划通知单编号:年月日制单人:批准人:注:一式六联。
一联生产部存根,一联报生产总监,一联报质量管理部,一联报采购部,一联报库管部,一联报销售部。
XX公司生产月报表编号:制表人:年月日注:一式三联。
一联生产部留存,一联报生产总监,一联报财务核算部。
XX公司生产月报表编号:制表人:年月日注:一式三联.一联生产部留存,一联报生产总监,一联报财务核算部.XX公司生产日报表编号:制表人:年月日注:一式两联。
一联生产部留存,一联报生产总监。
XX公司配料单编号:配料日期:制单人:复核人:退料单编号: 年月日退料人: 退料部门负责人:库管员:注:一式两联。
一联仓库存根,一联交退料部门。
SC—SC/BD---04XX公司领料单编号:年月日付料:领料:配料: 复核:注:一式三联。
一联生产部存根,一联交原料库,一联交生产班组。
SC—SC/BD—-—13XX公司投入产出统计明细表单位:Kg 产品型号:产品名称:制表人:SC—SC/BD---10XX公司反应产品生产记录SC—SC/BD—-—11XX公司生产记录--SC—SC/BD——-05XX公司生产班组长日志组别:组长:年月日注:本表一式两份,一份生产班组长自留,一份上报生产部经理.如有加班加点将人员、工时记入备注栏.SC-SC/BD-—-12XX公司生产计划执行情况明细表制表人/日期:SC—SC/BD———08 XX公司产品生产记录SC—SC/BD—-—09 XX公司反应产品生产记录。
2010版GMP批生产记录模板
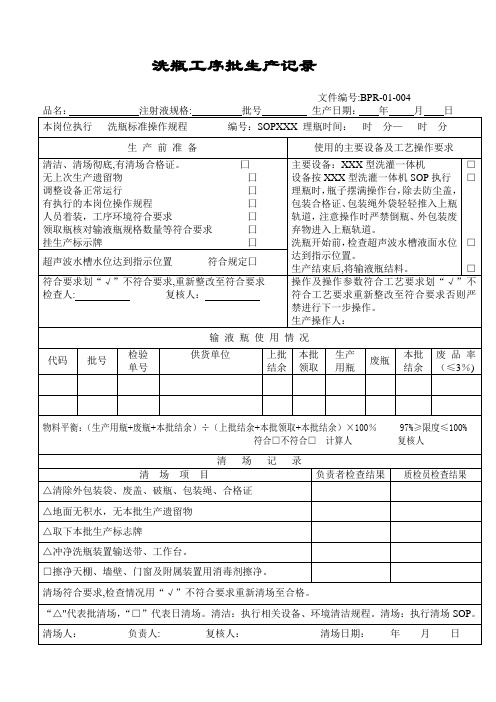
洗瓶工序批生产记录
文件编号:BPR-01-004
文件编号:BPRXXXX
文件编号:BPRXXXX 页数:1/2
文件编号:BPRXXXX 页数:2/2
灌装加塞工序批生产记录
文件编号:BPRXXX
文件编号:BPRXXXX
文件编号:BPRXXX
文件编号:BPRXXX
文件编号:BPRXXX
文件编号:BPRXXX
打批号工序批生产记录
文件编号:BPRXXX
包装工序清场记录
文件编号:XXXXXX
输液瓶贴签工序批生产记录
文件编号:
输液瓶贴签工序清场记录
文件编号:
瓶装输液包装箱贴签工序批生产记录
文件编号:
品名:注射液规格:ml 批号生产日期: 年月日
包装工序清场记录
文件编号:
品名: 注射液规格:ml 批号生产日期:年月日
包装工序批生产记录
文件编号:
包装工序批生产记录
文件编号:BPRXXX
包装工序批生产记录
文件编号:BPRXXXX
包装工序清场记录
文件编号:BPRXXXX。
GMP体系文件 批记录管理规程

目的:建立原版空白批生产记录、批包装记录的起草、审核、批准、复制、发放的管理规程,保证批生产记录准确无误,正确运用及时收集归档,妥善保存。
适用范围:原版空白批生产记录、批包装记录项下的全部文件。
责任人:生产制造部、质量保证部、饮片车间内容:1、批记录是指用于记述每批药品生产、质量检验和放行审核的所有文件和记录,可追溯所有与成品质量有关的历史和信息。
2、批记录的项目包括批生产记录、批包装记录、其他与本批产品有关的记录文件。
3、编制原则3.1 批记录应根据产品工艺规程、操作规程的内容设计编写,应能体现产品特点;3.2 批记录应具有质量的可追溯性。
通过记录,可以了解生产全过程的产品质量情况。
4、原版空白批生产记录、批包装记录的起草:4.1 批生产记录应当依据现行批准的工艺规程及岗位操作规程的相关内容制定。
记录的设计应当避免填写差错。
并能够真实全面的追溯该批产品的生产历史以及与质量有关的情况。
4.2 原版空白批生产记录由车间主任负责召集质监员共同设计、起草,批生产记录的内容应当包括:4.2.1 产品名称、规格、批号;4.2.2 生产以及中间工序开始、结束的日期和时间;4.2.3 每一生产工序的负责人签名;4.2.4 生产步骤操作人员的签名;必要时,还应当有操作(如称量)复核人员的签名;4.2.5 每一原辅料的批号以及实际称量的数量;4.2.6 相关生产操作或活动、工艺参数及控制范围,以及所用主要生产设备;4.2.7 中间控制结果的记录以及操作人员的签名;4.2.8 不同生产工序所得产量及必要时的物料平衡计算;4.2.9 对特殊问题或异常事件的记录,包括对偏离工艺规程的偏差情况的详细说明或调查报告,及车间主任的处理意见。
4.3 批包装记录应当依据工艺规程、岗位操作规程的相关内容制定。
记录的设计应当注意避免填写差错。
批包装记录的每一页均应当标注所包装产品的名称、规格、批号。
4.4 原版空白批包装记录由车间主任负责召集质监员共同设计、起草,空白批包装记录的内容应当包括:4.4.1 产品名称、规格、批号、生产日期和有效期;4.4.2 包装操作日期和时间;4.4.3 包装操作负责人签名;4.4.4 包装工序的操作人员签名;4.4.5 每一包装材料的名称、批号和实际使用的数量;4.4.6 根据工艺规程所进行的检查记录,包括中间控制结果;4.4.7 包装操作的详细情况,包括所用设备及包装生产线;4.4.8 所用印刷包装材料的实样,并印有批号、有效期及其他打印内容;不易随批包装记录归档的印刷包装材料可采用印有上述内容的复制品;4.4.9 对特殊问题或异常事件的记录,包括对偏离工艺规程的偏差情况的详细说明或调查报告,并经签字批准;4.4.10 所有印刷包装材料和待包装产品的名称,以及发放、使用、销毁或退库的数量、实际产量以及物料平衡检查。
GMP批记录范本

ABC生物科技有限公司批生产记录(粉类产品 )产品名称:生产日期:订单号:生产批号:ABC生物科技有限公司批生产记录( )ABC生物科技有限公司批生产记录( )记录清单(表1)文件编号:XS-JL-51生产指令及计划通知单制单年月日第页共页产品配方表编制:审核:ABC生物科技有限公司领料单文件编号:XS-JL-53 日期:ABC生物科技有限公司领料单ABC生物科技有限公司原辅料包材消毒记录表文件编号:XS-JL-77 消毒地点:消毒方式:ABC生物科技有限公司设备调机记录表注:设备调机是为批次生产的需要而调机,如出料装量、压力、速度、时间等。
ABC生物科技有限公司设备调机记录表注:设备调机是为批次生产的需要而调机,如出料装量、压力、速度、时间等。
ABC生物科技有限公司文件编号:XS-JL-72配料、生产操作、质量控制点操作记录表ABC生物科技有限公司清场消毒记录表注:1、各部门按对应的功能间“1、2、3…”打“√”或记录;2、清场、消毒方式在相应方式“1、2、3…”打“√”或记录;3、清场消毒时间按实际日期记录;4、清场消毒情况及批卫生检查情况合格的“√”,不合格的打“×”,不合格按实际情况处置和记录。
ABC生物科技有限公司粉类成品出厂检验报告审核人:检验人:ABC生物科技有限公司微生物检验原始记录文件编号:XS-JL-66样品名称:规格型号:样品批号:室温:℃相对湿度: %检验依据:□《GB4789-2010)检验日期年月~月日检验仪器:□电子天平□压力灭菌锅□恒温水浴锅□恒温培养箱□霉菌培养箱□超净工作台产品留样记录表不合格品及废弃物处置记录表ABC生物科技有限公司入库单ABC生物科技有限公司入库单ABC生物科技有限公司产品销售台账ABC生物科技有限公司运输车辆安全卫生检查表。
混合批生产记录

温度: ℃ 湿度: % 压差: Pa □ 温湿度、压差均符合要求 □ 温湿度、压差不符合要求
6.标签检查
按批生产指令内容核对物料卡中代号、品 名、批号、规格,数量
□已核对代号、品名、批号、规格、数量 且无误 □未核对
以上检查结果全部符合要求,带班长发放“生产证”并 □ 符合要求 “生产证”已挂置
挂置
工、器具清洁,置规定处 地面、门窗、墙壁等,清洁、无积水、粉尘、污 迹 衡器清洁
□ 符合要求 □ 不符合要求
□ 符合要求 □ 不符合要求
□ 符合要求 □ 不符合要求
□ 符合要求 □ 不符合要求
□ 符合要求 □ 不符合要求
检查确认批生产记录和设备使用日志已全部填写 □ 已检查确认批生产记录和
完毕,无错误、缺漏,操作人和复核人在记录上 设备使用日志已全部填写完
件
取样重量:
kg
□已确认物料代号、品名、批号、数量 中间站管理员:
取样后重量:
kg
件
生产结束时间
年
月
日
时
分
1、计算公式=
混合后重量
×100%
混合前提取物重量+辅料重量
6. 物 料
平 衡 2、计算结果
×100% =
%
3、物料平衡标准(98-100%) 结论:□符合规定 □不符合规定
性状: 7. 质 量
混合批生产记录(一)
(5/1)
代号:
产品名称:
产品批号:
批量:
房间名称:
房间编号:
设备名称: HGD1500 固定料斗混合机 NTG200 固定提升加料机
一、生产前检查
设备编号: 020107S 080107S
GMP规范-批生产记录填写要求详解

批记、记录填写要求1)本人填写:记录必须由实际操作人员本人填写,复核人员必须本人签字,且必须是全称,字迹工整,不得简写。
检查内容:代签名,签名潦草不可辨识。
复核人签字处模仿他人笔迹签名。
2)基本要求:黑色中性笔填写、字迹清晰、数据真实、准确、记录及时(按照批记上的时间范围填写)。
或名字简写或用字母代替等。
检查内容:空白漏填(例如,封面的结束日期)、字迹潦草,不可辨识、回忆式填写或提前填写(禁忌)。
3)空白填写:无内容填写时要用“-”划掉或空白面积大于页面面积的1/5时需要整体划掉“/”(从左下角向右上角划,线需要笔直,并在线下签名写日期)。
内容与上项相同时应该重新填写。
检查内容:空白处未划掉,或划线弯弯曲曲,或整体划掉时未签名及日期。
内容与上项相同时,未重新填写。
批记表头未填写日期或未写批号,批号写错等。
4)修改原则:不得涂改,需在更改的内容上划“—”,使原字迹清晰可辨,在旁边记录正确的内容,签名并标明日期。
检查内容:修改不规范-涂改、刀片刮、修正液、修改两次,签名一次。
签名或日期未写。
5)修改次数:单页修改≥3处或有明显作假嫌疑的,需要换页。
检查内容:单页修改次数是否符合,有无明显作假的,是否正常换页。
6)跨天日期:只要涉及到两天的地方,都需要记录日期。
检查内容:相邻两个格子之间,日期不一样,就需要写跨天日期。
且有的是重复写跨天日期。
7)物料名称:全称,不得简写。
检查内容:名称未写全称。
如乙酸乙酯品简称乙酯是不允许的。
8)勾选填写:勾选实际操作的设备或者是勾选相应的结果。
检查内容:未勾选方框。
9)数据填写:看到的数显或表,显示几位,就需要记录几位。
或者批记操作内容描述中有几位有效数字,记录时就需要几位有效数字。
检查内容:位数不对,多或少。
例如显示5.2℃,记录5℃或5.20℃。
10)数据填写:保温时间、反应时间、毛重、皮重、净重等正确计算及填写。
检查内容:数据计算错误。
11)参数填写:需要在批记的规范要求之内。
GMP规范-批生产记录填写要求详解

批记、记录填写要求1)本人填写:记录必须由实际操作人员本人填写,复核人员必须本人签字,且必须是全称,字迹工整,不得简写。
检查内容:代签名,签名潦草不可辨识。
复核人签字处模仿他人笔迹签名。
2)基本要求:黑色中性笔填写、字迹清晰、数据真实、准确、记录及时(按照批记上的时间范围填写)。
或名字简写或用字母代替等。
检查内容:空白漏填(例如,封面的结束日期)、字迹潦草,不可辨识、回忆式填写或提前填写(禁忌)。
3)空白填写:无内容填写时要用“-”划掉或空白面积大于页面面积的1/5时需要整体划掉“/”(从左下角向右上角划,线需要笔直,并在线下签名写日期)。
内容与上项相同时应该重新填写。
检查内容:空白处未划掉,或划线弯弯曲曲,或整体划掉时未签名及日期。
内容与上项相同时,未重新填写。
批记表头未填写日期或未写批号,批号写错等。
4)修改原则:不得涂改,需在更改的内容上划“—”,使原字迹清晰可辨,在旁边记录正确的内容,签名并标明日期。
检查内容:修改不规范-涂改、刀片刮、修正液、修改两次,签名一次。
签名或日期未写。
5)修改次数:单页修改≥3处或有明显作假嫌疑的,需要换页。
检查内容:单页修改次数是否符合,有无明显作假的,是否正常换页。
6)跨天日期:只要涉及到两天的地方,都需要记录日期。
检查内容:相邻两个格子之间,日期不一样,就需要写跨天日期。
且有的是重复写跨天日期。
7)物料名称:全称,不得简写。
检查内容:名称未写全称。
如乙酸乙酯品简称乙酯是不允许的。
8)勾选填写:勾选实际操作的设备或者是勾选相应的结果。
检查内容:未勾选方框。
9)数据填写:看到的数显或表,显示几位,就需要记录几位。
或者批记操作内容描述中有几位有效数字,记录时就需要几位有效数字。
检查内容:位数不对,多或少。
例如显示5.2℃,记录5℃或5.20℃。
10)数据填写:保温时间、反应时间、毛重、皮重、净重等正确计算及填写。
检查内容:数据计算错误。
11)参数填写:需要在批记的规范要求之内。
HPMC复配技术项目介绍

HPMC复配技术项目介绍1.HPMC产品介绍中文名称:羟丙基甲基纤维素英文名称:Hydroxypropyl methylcellulose (HPMC)化学结构式:式中n为纤维素分子中葡萄糖单元个数,R为H或CH 3或CH 2 CH(0H)CH 3技术指标:HPMC特性:保水性、增稠性、粘结性、分散性、成膜性、悬浮性、热凝胶性、耐盐性、pH稳定性、尺寸稳定性、乳化性、润滑性、触变性等特点。
HPMC用途:广泛用于建筑材料、涂料、医药、食品、合成树脂、化妆品、纺织、石油化工等行业, 其中在建筑材料行业用量最大,其次是涂料行业。
包装与贮存:● 包装:外用复合塑纸袋封装,内用聚氯乙烯塑料袋包装。
● 贮存:密封,严禁日晒雨淋、防潮、严禁与酸碱接触。
● 运输:按防潮普通化学品运输。
2.HPMC复配技术介绍技术名称:HPMC复配技术或HPMC改性技术(英文叫做Modified HPMC)技术简介:HPMC复配技术就是以HPMC为主原料,按一定比例再加其他特定的添加剂混合配制改性HPMC的技术。
从生产线出来的原始产品叫做HPMC纯产品,后期经过加添加剂来改良的叫做HPMC复配产品。
HPMC的用途非常广泛,但每种用途对HPMC特性的具体要求各不相同,比如说建材行业要求高保水性,高粘稠性,涂料领域要求高分散性,高抗菌性,缓溶性,需要将HPMC经过复配调整,才能做出最适合的产品。
很多缺乏复配技术的公司,不管客户用在哪种用途,就是提供一种HPMC, 也就是HPMC纯产品,导致有些特性达不到客户所需的要求。
比如说,客户需要高保水性的HPMC,虽然HPMC本身具备很好的保水性,但有时还达不到要求,这时候需要经过借助其他添加剂,加增保水性指标。
复配技术的优势是可以提高品质来满足客户的不同要求,另外还可以有效降低产品成本。
可以用到的建筑材料有腻子,填缝剂,瓷砖粘结剂,自流平,石膏基,水泥基,水泥挤出,砂浆(抹面,机械喷涂,砌筑,保温,修补)等等。
L-HPC合批记录1
合计
8批
1100g
统计人
谢军萍
火菌时间
月日时分一一月日时分
混匀时间
月日时分一一月日时分
混匀时间
月日时分一一月日时分
包装件数
件
包装规格
20kg/件入库量kg
操作者
取样人
取样日期
年 月日
备注
必须将物料平分后混匀,避免斑点不合格。
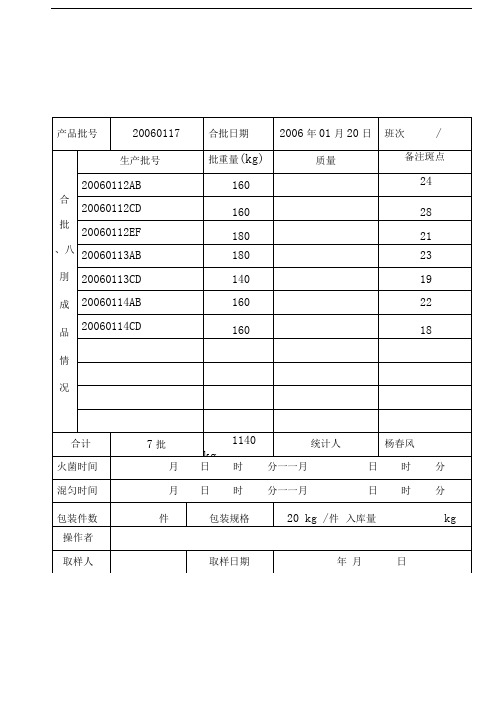
产品批号
20060204
合批日期
2006年03月04日
班次
合
批
、八 刖
备注
20051206BCD
240
合格
200510F11C
160
合格
20051211AB
160
合格
20051211DE
180
合格
20051212AB
160
合格
20051212CD
160
合格
20051212EF
160
合格
合计
7批
1220kg
统计人
王凤英
火菌时间
月日时分一一月日时分
混匀时间
月日时分一一月日时分
产品批号
20060109
合批日期
2006年01月14日
班次/
合 批 、八
刖 成 品 情 况
生产批号
批重量(kg)
质量
备注
20060105CD /EF
320
合格
20060106AB /CD/EF
480
合格
20060107A/BC
240
合格
合计
7批
1040g
统计人
杨春风
火菌时间
批记录

批记录Grünenthal Pharmaceutical (China) Co., Ltd.MANUFACTURING RECORD DOCUMENT No.文件号 COVER SHEET A1/22 MPD-IJP-001-R01 生产指令PRODUCT NAME/品名 BATCH SIZE/批重量 MATERIAL CODE/代号 STRENGTH/规格BATCH NO./批号 Tramadol hydrochloride Capsules 129.60kg 500002 50mg 盐酸曲马多胶囊 corresp. 900,000 caps/粒PLANNING MANAGER/计划主管签名:DATE /日期:PRODUCTION MANAGER/生产主管接收:DATE/日期:Tramadol hydrochloride MASTER FORMULA DOCUMENT NO. Capsules M0201-02 工艺规程文件号盐酸曲马多胶囊MASTER DOCUMENT/文件 SIGNED BY/签名 DATE/日期 ORIGINATED BY 起草人HEAD OF QUALITY CONTROL CHECK 质量部经理审核HEAD OF PRODUCTION CHECK 生产部经理审核APPROVED BY 批准使用人VALID DATE Y/年 M/月 D/日生效日期Grünenthal Pharmaceutical (China) Co., Ltd.DOCUMENT No. MANUFACTURING RECORD 文件号 A2/22 230201-02 CONTENT/目录PRODUCT NAME/品名 BATCH SIZE/批重量 MATERIAL CODE/代号 STRENGTH/规格BATCH NO./批号 Tramadol hydrochloride Capsules 129.60kg 500002 50mg 盐酸曲马多胶囊 corresp. 900,000 caps/粒 PAGE DOCUMENT NAME/文件名页号1 COVER SHEET/生产指令2 CONTENT/目录3 RAW MATERIALS CHECK BEFORE DISPENSING/配料前原辅料检查4 PRE-START CHECK FOR DISPENSING/配料前检查5 RAW MATERIALS DISPENSING/配料6 LINE CLEARANCE AFTER DISPENSING/配料工序清场记录7 PRE-START CHECK FOR BLENDING/混合前检查8 RAW MATERIALS CHECK BEFORE BLENDING/混合前原辅料检查9 BLENDING/混合10 LINE CLEARANCE AFTER BLENDING/混合工序清场记录11 PRE-START CHECK FOR CAPSULE FILLING/胶囊填充前检查12 CAPSULE FILLING/胶囊填充13-14 CAPSULE WEIGHT CHECK /胶囊粒重检查15-19 IPC RECORD OF FILLED CAPSULE WEIGHT AND APPERANCE/胶囊粒重、外观IPC检查20 IPC RECORD FOR DISINTEGRATION /胶囊崩解时限IPC检查21 LINE CLEARANCE AFTER CAPSULE FILLING/胶囊填充工序清场记录22 JUDGEMENT OF MANUFACTURING AND IPC/生产和IPC的评价Documentation checked in each step against work result on site by production manager. 每一步生产结束后,生产主管在工作现场检查生产记录和工作结果。
GMP批生产记录表格(全套使用记录表格)

记录类文件起草(修订)、审核、批准登记表×××中药饮片有限公司请验单×××中药饮片有限公司请验单领料单XX中药饮片有限公司领料单退料单XX中药饮片有限公司退料单XXX中药饮片有限公司生产计划编号:XX-SC-BG-00-004日期:日期:日期:XXX中药饮片有限公司生产流转卡编号:XX-SC-BG-00-005编号:XX-SC-BG-00-006编号:XX-SC-BG-00-007XXX中药饮片有限公司挑选生产记录表编号:XX-SC-BG-00-008XXX中药饮片有限公司洗(润)生产记录表编号:XX-SC-BG-00-009XXX中药饮片有限公司蒸(煮)制生产记录表编号:XX-SC-BG-00-010XXX中药饮片有限公司切制生产记录表编号:XX-SC-BG-00-011编号:XX-SC-BG-00-012编号:XX-SC-BG-00-013编号:XX-SC-BG-00-014编号:XX-SC-BG-00-015编号:XX-SC-BG-00-016编号:XX-SC-BG-00-017XXX中药饮片有限公司包装生产记录表XXX中药饮片有限公司清产记录单编号:XX-SC-BG-00-019XXX中药饮片有限公司清产记录单编号:XX-SC-BG-00-019XXX中药饮片有限公司印刷性包装材料使用记录中间产品进出站台帐包装剩余饮片处理记录药材废品物处理记录生产安全事故调查记录生产状态牌编号:XX-SC-BG-00-025交接班记录。
批生产记录-HR
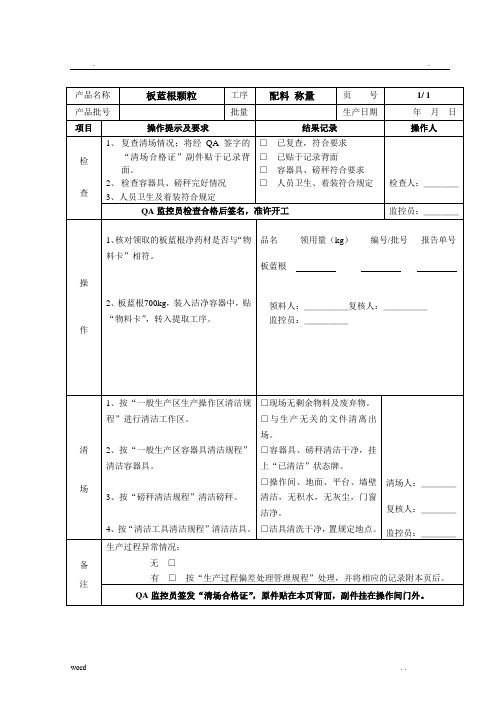
4、将粉碎好的蔗糖粉放到洁净的容器内称重,每个容器外贴上“物料卡”。
蔗糖重量:Kg批号/编号:
报告单号:
领料人:_____复核人:_____
监控员:_____
筛网目数为:
粉碎时间:从时分至时分
粉碎后重量为:Kg
废品量为:Kg
2、检查万能粉碎机、电子秤、容器具完好情况
3、人员卫生及着装符合规定
□ 已复查,符合要求
□ 已贴于记录背面
□ 万能粉碎机、电子秤、容器具符合要求
□ 人员卫生、着装符合规定
检查人:____
QA监控员检查合格后签名,准许开工
监控员:____
操
作
1、核对领取的蔗糖是否与“物料卡”相符。
2、准备洁净的容器接在粉碎机的出料口。
操作人:_____复核人:_____
收率计算
收率=粉碎后重量/粉碎前重量×100%
(应不低于95.0~100.0%)
收率=(___)÷(___)×100%=__%
计算人:_____复核人:_____
清
场
1、按“洁净区生产操作区清洁规程”进行清洁工作区。
2、按“万能粉碎机清洁规程”清洁万能粉碎机。
3、按“电子秤清洁规程”清洁电子秤。
2、检查容器具、电子秤完好情况
3、人员卫生及着装符合规定
□ 已复查,符合要求
□ 已贴于记录背面
□ 容器具、电子秤符合要求
□ 人员卫生、着装符合规定
检查人:____
QA监控员检查合格后签名,准许开工
监控员:________
操
作
1、核对转入的板蓝根清膏、蔗糖粉、糊精是否与“物料卡”相符。
GMP验证记录表

符合■不符合口 符合■不符合口
符合■不符合口 符合■不符合口
符合■不符合口
符合■不符合口 符合■不符合口
5生产过程的卫生要求
按产品品种分类分别建立生产工艺和卫生管理制度,明确 各车间、工序、个人的岗位职责,并在适当的地方明示给员工
符合■不符合口
原材料经过检验后才投入使用
符合■
不符合口
源和排风口,开口处设计防护罩
符合■
不符合口
车间或工作台有充足的自然米光或人工照明, 并且光照
不改变加工物品的本色
符合■
不符合口
位于工作台、食品和原料上方的照明设备加防护罩
是否有与生产能力相适应的原料、 辅料、化学物品、包
符合■
不符合口
装材料、成品等专用的储存间
符合■
不符合口
车间内有适宜的污水排放系统,并且配防鼠设备
符合■
不符合口
车间根据清洁度的不冋设置不冋的区域
符合■
不符合口
车间的人流和物流入口及出口单独设置, 具备防蚊设施
符合■
不符合口
车间、门、窗是否有防蚊蝇、 防尘纱门并便于拆下洗涮
符合■
不符合口
通道是否畅通,便于运输和卫生防护
符合■
不符合口
生产车间、仓库有良好通风
机械通风管道进风口是否距地面2米以上,并远离污染
符合■
不符合口
安装、维护、保养的需要
生产车间人均占地面积不低于1.5m,咼度不低于3m
符合■
不符合口
生产车间地面使用不渗水、不吸水、无毒、防滑材料铺
砌,并保持适当的坡度,在地面最低点设置低漏,以保证不积 水
符合■
不符合口
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
809.5
82370
20060304A
100
128000
合计
4批
2009.5kg
统计人
张彦军
灭菌时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
包装件数
件
包装规格
20㎏/件
入库量
㎏
操作者
取样人
取样日期
164
10800
合计
4批
505.5kg
统计人
谢军萍
灭菌时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
包装件数
件
包装规格
㎏/件
入库量
㎏
操作者
取样人
取样日期
年月日
备注
复核人:审核人:
羟丙甲纤维素批混记录
合批批号
20060204
20060325
15
100000
20060217
17
100000
20060324
9
100000
合计
7批
1021.5
统计人
张彦军
灭菌时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
包装件数
件
包装规格
20㎏/件
入库量
㎏
操作者
680
11190
20060213B
450
1906
20040724
145
4000
20060209
240
10750
合计
4批
1515kg
统计人
张彦军
灭菌时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
包装件数
件
包装规格
20㎏/件
年月日
备注
复核人:审核人:
羟丙甲纤维素批混记录
N0:200602-06
合批批号
20060209
合批日期
2006年02月25
班次
合
批
前
成
品
情
况
生产批号
批重(㎏)
质量
粘度(mPaS)
备注
20060209A
151
11080
20060209BC
118.5
11190
20060210A
72
13380
20060211AB
备注
复核人:审核人:
羟丙甲纤维素批混记录
N0:200603-12
合批批号
20060324
合批日期
2006年03月31
班次
合
批
前
成
品
情
况
生产批号
批重(㎏)
质量
粘度(m791
135000
20060325A
448.5
116000
20060303A
471
70950
20060321BC
羟丙甲纤维素批混记录
N0:200603-08
合批批号
20060316
合批日期
2006年03月22
班次
合
批
前
成
品
情
况
生产批号
批重(㎏)
质量
粘度(mPaS)
备注
20060313BC
482
135100
20060315A
470
88930
20060316A
440
140500
20060315BC
780
78990
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
包装件数
件
包装规格
20㎏/件
入库量
㎏
操作者
取样人
取样日期
年月日
备注
复核人:审核人:
羟丙甲纤维素批混记录
N0:200603-10
合批批号
20060315
合批日期
2006年03月28
班次
合
批
前
成
品
情
况
生产批号
批重(㎏)
质量
粘度(mPaS)
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
包装件数
件
包装规格
20㎏/件
入库量
㎏
操作者
取样人
取样日期
年月日
备注
复核人:审核人:
羟丙甲纤维素批混记录
N0:200602-09
合批批号
20060217
合批日期
2006年03月06
班次
合
批
前
成
品
情
况
生产批号
批重(㎏)
质量
粘度(mPaS)
20060319
合批日期
2006年03月28
班次
合
批
前
成
品
情
况
生产批号
批重(㎏)
质量
粘度(mPaS)
备注
20060307BC
760
159600
20060322BC
840
83320
20060321A
458
81010
合计
3批
2058kg
统计人
张彦军
灭菌时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
羟丙甲纤维素批混记录
N0:200604-01
合批批号
20060401
合批日期
2006年04月10日
班次
合
批
前
成
品
情
况
生产批号
批重(㎏)
质量
粘度(mPaS)
备注
20060401A
460
120000
20060401BC
312
120000
20060216
160
100000
20060319
48.5
100000
取样人
取样日期
年月日
备注
复核人:审核人:
羟丙甲纤维素批混记录
N0:200603-14
合批批号
20060309
合批日期
2006年04月01日
班次
合
批
前
成
品
情
况
生产批号
批重(㎏)
质量
粘度(mPaS)
混匀时间
月日时 分——月日 时 分
包装件数
件
包装规格
20㎏/件
入库量
㎏
操作者
取样人
取样日期
年月日
备注
复核人:审核人:
羟丙甲纤维素批混记录
N0:200603-11
合批批号
20060320
合批日期
2006年03月31
班次
合
批
前
成
品
情
况
生产批号
批重(㎏)
质量
粘度(mPaS)
备注
20060314BC
754
67000
300
95750
合计
4批
2010.5kg
统计人
张彦军
灭菌时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
包装件数
件
包装规格
20㎏/件
入库量
㎏
操作者
取样人
取样日期
年月日
备注
复核人:审核人:
羟丙甲纤维素批混记录
N0:200603-13
36.5
100000
20060105
260
100000
20060313
17.5
100000
合计
8批
2018.5kg
统计人
张彦军
灭菌时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
包装件数
件
包装规格
20㎏/件
入库量
㎏
操作者
813
91040
20060316BC
612
114300
合计
4批
2103kg
统计人
张彦军
灭菌时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
混匀时间
月日时 分——月日 时 分
包装件数
件
包装规格
20㎏/件
入库量
㎏
操作者
取样人
取样日期
年月日
备注
复核人:审核人:
备注
20060206A
336
40.5
20060206B
369
47.5
