高二化学选修五总结卤代烃
高二化学选修五第二章2.3卤代烃知识点总结大全

1、卤代烃(属于烃的衍生物)(1)定义:烃分子中的氢原子被卤素原子取代后所生成的化合物,通式为R-X,官能团是-X。
饱和一卤代烃通式:C n H2n+1X(2)分类:按分子中所含卤素原子种类的不同,分为氟代烃、氯代烃、溴代烃、碘代烃。
(3)物理性质:①状态:常温下,大多数卤代烃为液体或固体。
(CH3Cl为气体)②溶解性:卤代烃都不溶于水,能溶于大多数有机溶剂,某些卤代烃自身就是很好的有机溶剂。
③熔沸点:随碳原子数的增加而升高。
④密度:随碳原子数的增加而降低,除一氟代烃和一氯代烃比水轻外,其余卤代烃都比水重。
注:卤代烃分子中不一定含有H原子。
如CCl4、F2C=CF2等2、溴乙烷A. 分子组成和结构名称分子式结构式结构简式官能团球棍模型比例模型溴乙烷C2H5Br CH3CH2Br—BrB. 物理性质颜色状态沸点密度溶解性无色液体38O CρC2H5Br>ρH2O不溶于水,易溶于有机溶剂C. 化学性质溴乙烷化学性质稳定,一般不会被酸性高锰酸钾、溴水等强氧化剂氧化。
但能与NaOH水溶液、NaOH醇溶液发生反应。
(1)水解反应(取代反应)溴乙烷与NaOH水溶液的反应:(2)消去反应:有机物在一定条件下,从一个分子中相邻的两个碳原子上脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键化合物的反应。
溴乙烷与NaOH的乙醇溶液反应:3、卤代烃的水解反应与消去反应A. 取代(水解)反应(1)反应条件:强碱的水溶液、加热。
(2)反应本质:卤代烃分子中的—X被水分子中的—OH 所取代:RCH 2X+NaOHRCH 2OH+NaX (X 表示卤素原子)2H O △(3)反应规律:所有的卤代烃在强碱(如NaOH )的水溶液中加热均能发生取代(水解)反应。
B. 消去反应(1)反应条件:强碱的醇溶液、加热。
(2)反应本质:相邻的两个碳原子间脱去小分子HX :CH 3CH 2X+NaOHCH 2=CH 2↑+NaX+H 2O (X 表示卤素原子)乙醇△(3)反应规律:①没有邻位碳原子的卤代烃不能发生消去反应,如CH 3Cl 。
高中化学选修五第二章卤代烃知识点

第三节卤代烃一、卤代烃的代表物质——溴乙烷1、基本结构化学式:C2H5Br 结构式:结构简式:CH3CH2Br官能团:—Br2、物理性质无色,液体,无味,密度比水大,难溶于水,易溶于有机溶剂3、化学性质1)取代反应卤代烃的水解:强碱水溶液、加热条件下发生第一步:CH3CH2—Br + HO—H → CH3CH2—OH + H—Br第二步:HBr + NaOH → NaBr + H2O总反应:CH3CH2Br + NaOH → CH3CH2OH + NaBr2)消去反应从分子中脱去一个或几个小分子(H2O、HX等)而形成不饱和键强碱的醇溶液、加热条件下发生CH3CH2Br + NaOH → CH2=CH2↑+NaBr+H2O产物验证:因生成物中常混有乙醇蒸汽,需要出去杂质,试剂选用水,除杂后将气体通入酸性KMnO4,如溶液褪色可证明生成物【习题一】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.(1)写出溴乙烷在NaOH水溶液中的反应方程式:______________反应类型__________.某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3 溶液,加热,产生少量沉淀.该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:___________________(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式________________反应类型_____________.反应中生成的气体可以用上图所示装置检验,现象是___________,水的作用是________.除高锰酸钾酸性溶液外,还可以用_____检验生成的气体,此时还有必要将气体先通入水中吗?______(填“有”或“没有”)【分析】(1)CH3CH2Br和NaOH水溶液加热时,二者发生取代反应生成乙醇;检验卤素原子必须中和过量的碱;(2)加热条件下,溴乙烷和NaOH醇溶液发生消去反应生成乙烯;根据乙烯的不饱和性,能被高锰酸钾溶液氧化、能和乙烯加成反应,溶液褪色,乙醇能被高锰酸钾溶液氧化,溶液褪色,乙醇不能和乙烯反应;【解答】解:(1)CH3CH2Br和NaOH水溶液加热时,二者发生取代反应生成乙和NaBr,反应方程式为CH3CH2Br+NaOHCH3CH2OH+NaBr;检验溴乙烷中含有溴元素,卤代烃水解后,加入硝酸酸化的硝酸银,硝酸酸化目的中和碱,否则生成氢氧化银沉淀,故答案为:CH3CH2Br+NaOHCH3CH2OH+NaBr;取代反应;不合理,没有用硝酸中和氢氧化钠溶液;(2)加热条件下,溴乙烷和NaOH醇溶液发生消去反应生成乙烯,反应方程式为CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O;乙烯气体不溶于水,高锰酸钾能氧化乙烯,所以,它能使高锰酸钾溶液褪色,的四氯化碳溶液能和乙烯发生加成反应,所以,乙烯也能使溴水褪色,因装置1中用水,目的是防止乙醇和高锰酸钾反应,而溴与乙醇不反应,所以,无须用水;故答案为:CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O,消去反应,溶液褪色,吸收乙醇,溴水,没有;【习题二】能够鉴定溴乙烷中溴元素的存在的操作是()A.在溴乙烷中直接加入AgNO3溶液B.在溴乙烷中加蒸馏水,然后加入ANO3溶液C.在溴乙烷中加入NaOH溶液,加热后酸化,然后加入AgNO3溶液D.在溴乙烷中加入乙醇加热后,后加入AgNO3溶液【分析】检验溴乙烷中溴元素使卤代烃中的卤素原子变为卤离子,溴乙烷可以在氢氧化钠水溶液中水解生成溴离子,也可以在氢氧化钠醇溶液中发生消去反应生成溴离子,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成即可.【解答】解:A、溴乙烷中不存溴离子,故A错误;、溴乙烷不溶于水,故B错误;C、检验溴乙烷中溴元素,溴乙烷可以在氢氧化钠水溶液中水解生成溴离子,也可以在氢氧化钠醇溶液中发生消去反应生成溴离子,然后加入硝酸酸化中和多余的氢氧化钠,以排除氢氧根对检验的干扰,最后加入硝酸银,观察是否有黄色沉淀生成,若有黄色沉淀生成,则证明溴乙烷中含有溴原子,否则不含有,故C正确;D、溴乙烷与乙醇不反应,不能产生溴离子,D错误;故选:C。
人教-高二化学选修5第二章知识点总结
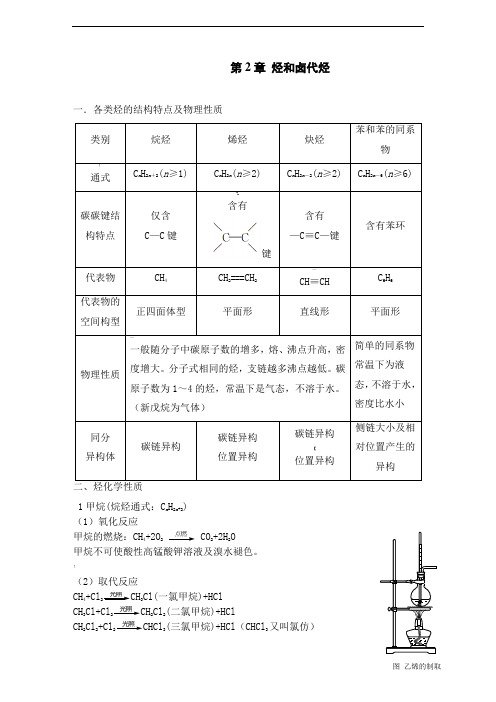
第2章 烃和卤代烃一.各类烃的结构特点及物理性质%含有键1甲烷(烷烃通式:C n H 2n +2) (1)氧化反应甲烷的燃烧:CH 4+2O 2点燃2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
!(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HCl CH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl3+Cl光照4(四氯化碳)+HCl取代1 mol氢原子,消耗1 mol氯分子。
(3)分解反应甲烷分解:CH高温2…2. 乙烯(烯烃通式:C n H2n)乙烯的制取:CH3CH2浓硫酸2=CH2↑+H2O(消去反应)(1)氧化反应乙烯的燃烧:CH2=CH2+3O点燃2+2H2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH2=CH2+Br2Br—CH2Br与氢气加成:CH2=CH2+H2催化剂CH3CH3>与氯化氢加成:CH2=CH2+HCl催化剂CH3CH2Cl与水加成:CH2=CH2+H2O催化剂CH3CH2OH马氏规则:当不对称烯烃与卤化氢加成时,通常氢加到含氢最多的不饱和碳原子一侧。
(3)聚合反应乙烯加聚,生成聚乙烯:n CH2=CH2催化剂 [CH2—CH2 ] n(4)1,3-丁二烯与溴完全加成:CH2=CH-CH=CH2+2Br2Br-CHBr-CHBr-CH2Br与溴1,2-加成:CH2=CH-CH=CH2+Br2Br-CHBr-CH=CH2—与溴1,4-加成:CH2=CH-CH=CH2+Br2Br-CH=CH-CH2Br(5)烯烃的顺反异构(a)并不是所有的烯烃都存在顺反异构,只有当双键两端的同一碳原子上连接不同的原子或原子团时烯烃才存在顺反异构。
(b)判断烯烃是否存在顺反异构的方法:①分子中有碳碳双键;②双键两端的同一碳原子上不能连接相同的基团。
人教 高中化学选修5知识点总结:第二章烃和卤代烃
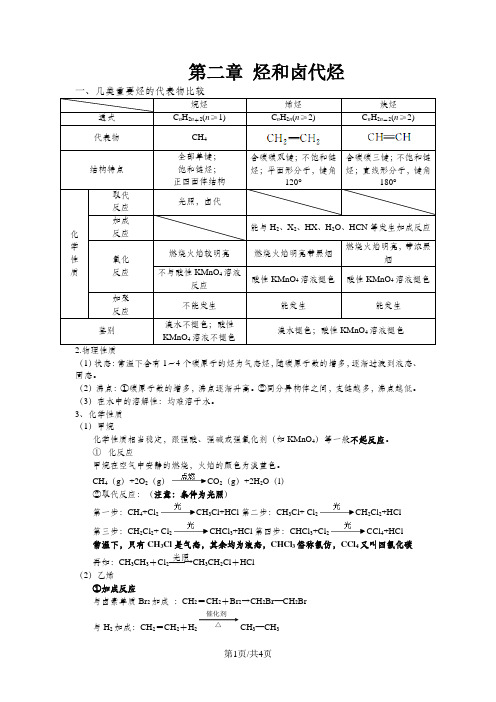
第二章 烃和卤代烃一、几类重要烃的代表物比较C n H 2n (n ≥2)C n H 2n -2(n ≥2)含碳碳双键;不饱和链含碳碳三键;不饱和链(1)状态:常温下含有1~4个碳原子的烃为气态烃,随碳原子数的增多,逐渐过渡到液态、固态。
(2)沸点:①碳原子数的增多,沸点逐渐升高。
②同分异构体之间,支链越多,沸点越低。
(3)在水中的溶解性:均难溶于水。
3、化学性质 (1)甲烷化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO 4)等一般不起反应。
① 化反应甲烷在空气中安静的燃烧,火焰的颜色为淡蓝色。
CH 4(g )+2O 2(g )CO 2(g )+2H 2O (l ) ②取代反应:(注意:条件为光照) 第一步:CH 4+Cl 2CH 3Cl+HCl 第二步:CH 3Cl+ Cl 2CH 2Cl 2+HCl第三步:CH 2Cl 2+ Cl 2CHCl 3+HCl 第四步:CHCl 3+Cl 2CCl 4+HCl 常温下,只有CH 3Cl 是气态,其余均为液态,CHCl 3俗称氯仿,CCl 4又叫四氯化碳再如:CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl (2)乙烯①加成反应与卤素单质Br 2加成 :CH 2=CH 2+Br 2→CH 2Br —CH 2Br与H 2加成:CH 2=CH 2+H 2CH 3—CH 3催化剂 △与卤化氢加成:CH 2=CH 2+HX →CH 3—CH 2X与水加成 :CH 2=CH 2+H 2O CH 3CH 2OH (工业制乙醇的方法) ②氧化反应常温下被氧化,如将乙烯通入酸性高锰酸钾溶液,溶液的紫色褪去。
易燃烧 :CH 2=CH 2+3O 22CO 2+2H 2O 现象(火焰明亮,伴有黑烟) ③加聚反应(口诀:双键变单键,两边添横线,横线加括号,“n ”右下边)例如: n CH 2=CH 2――→催化剂 (3)烯烃的顺反异构①.顺反异构:由于碳碳双键不能旋转,导致分子中原子或原子团在空间的排列方式不同所产生的异构现象。
选修五 2.3 卤代烃(整理)
氟氯烃(氟里昂)(CF2Cl2 等)
1、喷雾推进器 2、冷冻剂 3、起泡剂
氟利昂加压易液化, 使油漆、杀虫 使成型的 剂或化妆品加压易 无味无臭,对金属无腐蚀 液化,减压易汽化 性。当它汽化时吸收大量 塑料内产生很 多细小的气泡 的热而令环境冷却
全面了解和正确使用卤代烃
卤代烃的危害
氟氯烃随大气流上升,在平流层中受紫外线 照射,发生分解,产生氯原子,氯原子可引 发损耗臭氧的反应,起催化剂的作用,数量 虽少,危害却大。
CH2=CH2↑+ NaBr + H2O (2 )
?
水
除CH3CH2OH蒸汽
因为乙醇也能使高锰酸钾酸性溶液褪色,干扰乙烯的检验。
5、卤代烃在有机合成中的应用 ① 制备醇
② 制备烯烃或炔烃
例如: H3C CH2
Br H 2C CH2
OH OH
消去
NaOH 醇 △
H2C CH2
取代
△ NaOH 水
CH2
白 淡 黄 色 黄 色 Cl 色 I Br
练一练
有如下操作步聚:
A.滴加AgNO3溶液;B.加NaOH溶液; C.加热; D.加催化剂MnO2; E.加蒸馏水过滤后取滤液; F.过滤后取滤渣; G.用HNO3酸化
(1)鉴定氯酸钾中氯元素的操作步聚是
DCEGA ;
(2)鉴定1-氯丙烷中氯元素的操作步聚是
卤代烃发生消去反 不饱和 小分子 应的条件是什么?
(3)规律
卤代烃都可水解,但消去需卤素 原子相连碳有邻碳且邻碳有氢!
练一练
A、CH3Cl
下列卤代烃是否能发生消去反应? 若能,请写出有机产物的结构简式。
√
C、CH3-CH-CH3 CH3CH=CH2 Br
高二有机化学知识点卤代烃

高二有机化学知识点卤代烃一、简介卤代烃是有机化合物中含有卤素(氟、氯、溴、碘)的一类化合物。
卤代烃具有独特的化学性质和广泛的应用领域。
本文将介绍高二学习有机化学时需要了解的卤代烃的基本概念、命名规则、物理性质以及反应机制等知识点。
二、命名规则1. 一般命名规则卤代烃的命名规则是在烃的基础上,根据卤素的种类和数目进行命名。
卤代烃的基本命名格式为:烃基名+卤素前缀。
2. 碳链顺序命名时应选择碳链长度最长的路径,若存在两条长度相等的路径,则选择取代基数目最少的路径。
同时,应选择靠近取代基的编号最小的顺序。
3. 确定取代基编号命名时需通过指定取代基在碳链上的位置来进行编号。
编号应使取代基所在的碳原子序号最小。
三、物理性质1. 沸点和熔点卤代烃的沸点和熔点较高,这是由于卤素的原子量较大,存在较强的分子间相互作用力。
2. 溶解度卤代烃通常具有较低的溶解度,尤其是溴代烷和碘代烷。
溴代烷和碘代烷在水中基本不溶解,但在有机溶剂中溶解度较高。
四、反应机制1. 亲核取代反应卤代烃可以发生亲核取代反应,其中亲核试剂会取代卤素原子,生成新的有机化合物。
2. 消除反应卤代烃也可以发生消除反应,其中一种卤素可以与邻近原子上的氢原子反应,形成氢卤酸并生成双键或三键。
3. 氧化反应卤代烃可以发生氧化反应,其中溴代烷和碘代烷较易发生氧化反应。
五、常见的卤代烃1. 溴代烷溴代烷是指含有溴素取代基的烷烃,如溴乙烷、溴丙烷等。
溴代烷常用于有机合成中。
2. 氯代烷氯代烷是指含有氯素取代基的烷烃,如氯乙烷、氯丙烷等。
氯代烷广泛应用于农药、塑料和溶剂等领域中。
3. 碘代烷碘代烷是指含有碘素取代基的烷烃,如碘乙烷、碘丙烷等。
碘代烷在有机合成中具有重要的应用价值。
六、应用领域1. 医药领域卤代烃常被用作医药制剂的重要原料,例如氯霉素等。
2. 农药领域氯代烷和溴代烷广泛应用于农药的合成中,可用于杀虫剂和杂草的防治。
3. 工业领域卤代烃广泛应用于塑料、溶剂、润滑剂、染料等工业制品的制造。
卤代烃总结知识点

卤代烃总结知识点一、卤代烃的分类与命名卤代烃可分为一卤代烷、二卤代烷、卤代烯烃、卤代炔烃等几种类别。
根据卤素的种类可以分为氟代烃、氯代烃、溴代烃和碘代烃。
卤代烃的命名根据IUPAC命名法,以及常用命名法来进行。
例如氯代乙烷可用IUPAC命名法为氯乙烷,也可以用常用命名法称为氯乙烷。
卤代烃的命名方法非常多样,需要通过具体的化学式和结构式来进行正确的命名。
二、卤代烃的物理性质卤代烃的物理性质受到卤素种类和数量的影响。
一般来说,卤代烃具有较高的沸点和熔点,密度较大,易溶于有机溶剂,不溶于水。
卤代烃的物理性质与其分子结构密切相关,例如分子中卤素的位置、数量和附加基团等都会影响卤代烃的物理性质。
三、卤代烃的化学性质卤代烃的化学性质主要包括亲核取代反应、消去反应、活化能、引发剂等。
其中最常见的化学性质是亲核取代反应,是卤代烃最主要的化学反应。
亲核取代反应是卤代烃分子中卤素原子被亲核试剂取代的反应,常见的亲核试剂有氢氧根离子、氨基根离子等。
消去反应是卤代烃中一个氢原子和一个卤原子被去除生成烯烃的反应。
此外,卤代烃的化学性质还包括了活化能、引发剂等。
四、卤代烃的合成方法卤代烃的合成方法主要包括直接氢-卤素置换法、卤代烷的化学反应法和烷基卤化法。
直接氢-卤素置换法是将氢原子替换为卤素原子,常用的溴代亚烷合成法就是通过该方法合成。
卤代烷的化学反应法是其他化合物经过化学反应或实验室合成直接得到卤代烷。
而烷基卤化法是烷烃经过卤化制成卤代烷。
卤代烃的合成方法多种多样,可以根据具体的需求和化学实验选择合适的方法。
五、卤代烃的应用卤代烃是一类非常重要的有机化合物,在医药、农药、化工等领域都有广泛的应用。
在医药领域,卤代烃可以用于生产药物和医疗用品,如消毒剂和麻醉剂等。
在农药领域,卤代烃可以用于生产农药,如杀虫剂和杀菌剂等。
在化工领域,卤代烃可以用于生产有机化工产品,如溶剂和增塑剂等。
卤代烃在各个领域都有非常重要的应用价值。
六、卤代烃的环境影响尽管卤代烃在各个领域有重要的应用,但其对环境的影响也不能忽视。
卤代烃知识点总结

卤代烃知识点总结一、什么是卤代烃卤代烃指的是含有卤素(氯、溴、碘或氟)取代烃烷烃基的有机化合物。
卤代烃可分为单卤代烃、多卤代烃和多卤代芳烃等不同类别。
二、卤代烃的命名规则1.确定主链。
选择最长的连续碳链作为主链。
2.给主链编号。
从卤素基团连接处的碳开始,按照升序编号。
3.指定卤素基团。
将卤素基团的位置编号写在主链名称的前面,并用连字符连接。
4.补充其他基团。
根据需要,可以在主链名称前加入其他有机基团的名称。
三、卤代烃的性质1.溶解性:卤代烃常常是有机溶剂,可以在水中溶解或与其他有机物相溶。
2.沸点和熔点:卤代烃的沸点和熔点通常比相应的烃类物质高,这是由于卤素原子的极性和分子量的增加导致的。
3.反应性:卤代烃比相应的烃类物质更容易发生化学反应,如亲核取代反应、消除反应等。
四、卤代烃的制备方法1.直接卤代:将烃直接与卤素反应得到卤代烃。
2.消氢卤代:通过将醇与卤化氢反应生成卤代烃。
3.同素异化反应:通过使同素异构体发生异构化得到卤代烃。
五、卤代烃的用途1.有机合成:卤代烃可作为有机合成的重要原料,用于合成杂环化合物、药物等有机化合物。
2.溶剂:由于其良好的溶解性,卤代烃常被用作有机溶剂,如四氯化碳、氯仿等。
3.防腐剂:卤代烃的一些衍生物具有杀菌和防腐的功效,常被用于制备防腐剂。
六、卤代烃的环境和健康影响1.环境影响:由于卤代烃具有较高的极性和稳定性,因此在环境中难以降解,易积累。
部分卤代烃会对水生生物和土壤微生物产生毒性影响。
2.健康影响:一些卤代烃被认为对人体有害,如多氯联苯被认为是致癌物质。
然而,一些卤代烃也是药品和消毒剂的成分,适当使用时对人体是安全的。
七、安全操作与防护措施1.避免长时间接触:应尽量避免与卤代烃长时间接触,特别是皮肤和眼睛。
2.通风良好:在操作卤代烃时,应确保操作环境通风良好,以减少有害气体浓度。
3.穿戴防护装备:应佩戴适当的防护手套、眼镜和实验服等防护装备,以避免皮肤接触和吸入。
卤代烃知识点总结

卤代烃知识点总结一、概念介绍卤代烃是指分子中含有卤素原子(氟、氯、溴、碘)的有机化合物,也称为卤代烷。
其分子式为CnH2n+1X,其中X表示卤素原子。
二、命名规则1. 找到主链:选择含有最多碳原子的连续链作为主链。
2. 确定取代基位置:用最小的数来表示取代基在主链上的位置。
3. 确定取代基种类:用前缀表示取代基种类,如氯代(chloro-)、溴代(bromo-)、碘代(iodo-)等。
4. 组合前缀和主名:将前缀和主名组合在一起即可得到完整的化合物名称。
三、物理性质1. 沸点和熔点:随着分子量的增加,沸点和熔点逐渐增加。
2. 密度:通常情况下,卤代烃比水密度大。
3. 溶解性:卤代烃在非极性溶剂中易溶解,在极性溶剂中不易溶解。
四、化学性质1. 取代反应:由于卤素原子具有较强的电负性,因此容易被亲电试剂取代,如氢氧化钠、氢氧化钾等。
2. 消除反应:卤代烃在碱性条件下可以发生消除反应,生成烯烃或炔烃。
3. 氢化反应:卤代烃可以与氢气在催化剂存在下发生加氢反应,生成相应的饱和烃。
4. 氧化反应:卤代烃可以被强氧化剂如高锰酸钾、过硫酸钾等氧化,生成相应的醇、醛、羧酸等。
五、毒性与环境影响1. 毒性:由于卤素原子的电负性和惰性,使得卤代烷比相应的烷基化合物具有更大的毒性。
长期暴露于卤代烷中会导致神经系统损害、肝脏损伤等。
2. 环境影响:卤代烷具有较强的毒性和不良环境影响。
其中最为典型的是三氯乙烯(C2HCl3),它是一种广泛使用的工业溶剂,对水体和土壤污染严重。
六、应用领域1. 医药领域:卤代烷作为一种重要的有机合成中间体,广泛应用于医药领域,如氯霉素、盐酸利多卡因等。
2. 农业领域:卤代烷作为杀虫剂和除草剂的主要原料,广泛应用于农业生产中。
3. 工业领域:卤代烷作为溶剂和清洗剂的主要原料,在化工、电子、纺织等行业得到广泛应用。
卤代烃-化学人教版选修五-知识点整理

卤代烃溴乙烷分子结构分子式:C 2H 5Br 结构式: 结构简式:CH 3CH 2Br 或C 2H 5Br 比例模型: 球棍模型: 官能团:溴原子(-Br )物理性质无色液体,沸点38.4℃,比乙烷(-88.6℃)高,密度比水大,难溶于水,溶于多种有机溶剂。
原因:比较烷烃,卤代烃相对分子质量变大,分子间作用力变大,熔沸点升高,密度变大。
由于卤素原子吸引电子的能力较强,使共用电子对偏移,C -X 键具有较强的极性,易断裂,因此卤代烃的反应活性增强。
化学性质官能团是溴原子(-Br), C -Br 键易断裂,性质活泼。
取代反应(水解反应):①CH 3CH 2-Br +H-OH====CH 3CH 2-OH +HBr ②HBr+NaOH====NaBr+H 2O (中和HBr ,促进水解) 总反应式:CH 3CH 2-Br +Na-OH====CH 3CH 2-OH +NaBr 【检验溴元素】能否直接往溴乙烷中加入用硝酸酸化的硝酸银溶液?无现象。
溴乙烷是非电解质,不能电离,溴乙烷中不存在溴离子,不能与Ag +反应,无法证明。
正确做法:溴乙烷与氢氧化钠溶液加热后静置,取上层清液,加入过量稀HNO 3(中和过量的NaOH ,防止现象干扰),再加入AgNO 3溶液。
现象:产生浅黄色沉淀结论:产物中有Br -,即溴乙烷中含有溴元素【应用】引入羟基制备醇消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H 2O 、HBr 等),而生成含有不饱和键(含双键或三键)化合物的反应,叫做消去反应。
①CH 3-CH 2Br======CH 2=CH 2+HBr ②HBr+NaOH====NaBr+H 2O 总反应式:CH 3-CH 2Br+NaOH==== CH 2=CH 2↑+ NaBr+H 2O 【应用】引入不饱和键制备烯烃或炔烃【卤代烃消去反应条件】1、 分子中碳原子数≥22、 与-X 相连的碳原子的邻位碳原子上必须有氢原子3、 与强碱醇溶液加热【实验注意事项:检验溴乙烷消去反应所生成气体种类】在气体通入KMnO 4酸性溶液前加一个盛有水的试管的作用:除去挥发出来的乙醇。
卤代烃归纳总结

卤代烃归纳总结卤代烃是一类有机化合物,其中的氢原子被卤素取代。
常见的卤代烃包括氯代烃、溴代烃和碘代烃。
在化学和有机合成中,卤代烃被广泛应用于溶剂、试剂和原料等多个领域。
本文将对卤代烃的特性、制备方法和主要应用进行总结和归纳。
一、卤代烃的特性卤代烃的主要特性包括物理性质和化学性质。
物理性质方面,卤代烃的沸点、熔点和密度等与其结构和卤素种类有关。
例如,随着卤素原子数目的增加,沸点和熔点通常会上升。
化学性质方面,卤代烃与其他化合物的反应性较高。
例如,它们能够与碱金属发生剧烈反应,生成相应的卤化物和氢气。
此外,卤代烃还能够进行亲电取代反应、消除反应以及还原反应等。
二、卤代烃的制备方法卤代烃主要通过卤素和有机化合物的反应制备。
常见的制备方法包括以下几种:1. 直接卤代:将有机化合物与卤素直接反应,生成相应的卤代烃。
例如,将碳氢化合物与溴素在适当条件下反应,可以得到溴代烃。
2. 溴代酮法:将碳氢化合物与溴水反应,首先生成溴代酮,再经过还原反应生成溴代烃。
3. 氯代醇法:将碳氢化合物与氯化亚砜反应,生成相应的氯代醇。
然后,通过脱水反应获得氯代烃。
4. 烷基卤化反应:将醇或酸与卤素酸反应,生成相应的卤代烃。
5. 其他方法:还有一些其他特殊情况下的制备方法,如辛卤化法、原料法和Hunsdiecker反应等。
三、卤代烃的应用领域卤代烃在化学工业和实验室中有广泛的应用。
以下为卤代烃的主要应用领域的简要介绍:1. 溶剂:卤代烃常用作有机合成和实验室中的溶剂。
它们具有较高的极性和溶解性,可用于溶解许多有机化合物。
2. 试剂:卤代烃常被用作有机合成中的试剂。
例如,氯代烃可用作烷基化试剂、亲电试剂和还原剂等。
3. 反应中间体:卤代烃在有机合成中作为重要的反应中间体。
它们可以通过取代反应、消除反应等进行化学转化,生成其他有机化合物。
4. 药物和农药:一些卤代烃具有杀菌、杀虫和杀真菌的作用,因此常用于制备药物和农药。
5. 聚合物:卤代烃可以用于合成聚合物,如氯化聚乙烯(PVC)。
高二化学选修五第二章2.3卤代烃 知识点总结大全

知识点、卤代烃1、卤代烃(属于烃的衍生物)(1)定义:烃分子中的氢原子被卤素原子取代后所生成的化合物,通式为R-X,官能团是-X。
饱和一卤代烃通式:C n H2n+1X(2)分类:按分子中所含卤素原子种类的不同,分为氟代烃、氯代烃、溴代烃、碘代烃。
(3)物理性质:①状态:常温下,大多数卤代烃为液体或固体。
(CH3Cl为气体)②溶解性:卤代烃都不溶于水,能溶于大多数有机溶剂,某些卤代烃自身就是很好的有机溶剂。
③熔沸点:随碳原子数的增加而升高。
④密度:随碳原子数的增加而降低,除一氟代烃和一氯代烃比水轻外,其余卤代烃都比水重。
注:卤代烃分子中不一定含有H原子。
如CCl4、F2C=CF2等2、溴乙烷A. 分子组成和结构B.颜色状态沸点密度溶解性无色液体38O CρC2H5Br>ρH2O不溶于水,易溶于有机溶剂C. 化学性质溴乙烷化学性质稳定,一般不会被酸性高锰酸钾、溴水等强氧化剂氧化。
但能与NaOH水溶液、NaOH醇溶液发生反应。
(1)水解反应(取代反应)溴乙烷与NaOH水溶液的反应:(2)消去反应:有机物在一定条件下,从一个分子中相邻的两个碳原子上脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键化合物的反应。
溴乙烷与NaOH的乙醇溶液反应:3、卤代烃的水解反应与消去反应A. 取代(水解)反应(1)反应条件:强碱的水溶液、加热。
(2)反应本质:卤代烃分子中的—X 被水分子中的—OH 所取代:RCH 2X+NaOH RCH 2OH+NaX (X 表示卤素原子)2H O−−−→△(3)反应规律:所有的卤代烃在强碱(如NaOH )的水溶液中加热均能发生取代(水解)反应。
B. 消去反应(1)反应条件:强碱的醇溶液、加热。
(2)反应本质:相邻的两个碳原子间脱去小分子HX :CH 3CH 2X+NaOH CH 2=CH 2↑+NaX+H 2O (X 表示卤素原子)−−−→乙醇△(3)反应规律:① 没有邻位碳原子的卤代烃不能发生消去反应,如CH 3Cl 。
高二化学选修5 卤代烃

高二化学选修5 卤代烃要点:1 卤代烃的概念2 卤代烃在生活中的应用以及对人类生活的影响3 卤代烃的性质:(1)物理性质(2)化学性质:卤代烃的β消去反应卤代烃的取代反应4 卤代烃在有机合成中的应用(格氏试剂的应用)一卤代烃对人类生活的影响1 卤代烃的结构烃分子中的H原子被卤素原子取代后形成的化合物——卤代烃结构通式:R-X(R为烃基)根据烃基结构的不同,卤代烃可以分为卤代烷烃、卤代烯烃及卤代芳香烃2 卤代烃对人类生活的影响(1)合成各种高聚物如:聚氯乙稀、聚四氟乙烯等(2)DDT的“功与过”(3)卤代烃在环境中很稳定,不易降解,有些卤代烃还能破坏大气臭氧层(氟利昂)。
二卤代烃的性质1 物理性质(1)常温下大部分为液体,除CH3Cl、CH3CH2Cl、CH2=CHCl常温下是气体,且密度比水大。
(2)难溶于水,易溶于乙醚、苯、环己烷等有机溶剂。
(3)互为同系物的卤代烃沸点随碳原子数增多而升高。
2 化学性质(1)消去反应——在一定条件下从一个有机物分子中脱去一个或几个小分子生成不饱和化合物的反应原理: CH 2-CH 2 + KOH CH 2=CH 2 ↑+ KBr + H 2O注意:卤代烃要发生消去反应,必须是在强碱的醇溶液中加热才能进行 卤代烃的消去反应属于β消去,因此,必须有βH 才能发生该消除反应 例如:1能发生消去反应生成烯烃吗?为什么?2 你能写出3-溴-3-甲基己烷( )发生消去反应的产物吗?(2)取代反应原理:CH 3CH 2-Br + KOH CH 3CH 2OH + KBr注意:在水溶液中,卤代烃与强碱共热会发生取代反应,又称为水解反应。
一般情况下,若烃基为苯环,则该水解反应较难进行。
3 卤代烃在有机合成中的应用(拓展视野)HBr醇 △CH 3 CH 3 CH 3CCH 2BrCH 3BrCH 3CH 2CCH 2CH 2CH 3水 △4卤代烃的检验卤代烃+NaOH 水溶液加足量硝酸酸化 加入AgNO 3溶液白色沉淀(AgCl ) 说明原卤代烃中含有Cl 原子 浅黄色沉淀(AgBr ) 说明原卤代烃中含有Br 原子 黄色沉淀 (AgI ) 说明原卤代烃中含有I 原子R-X + Mg RMgX格林尼亚( )试剂简称格氏试剂, 年发现( 岁)190029Grignard X = Cl 、BrRMgX +R-H +Mg OCOR X R-H +Mg X X R-H +MgX R-H +MgORXR-H +MgOHX ′′新的格氏试剂,很有用△。
高中选修5卤代烃知识点
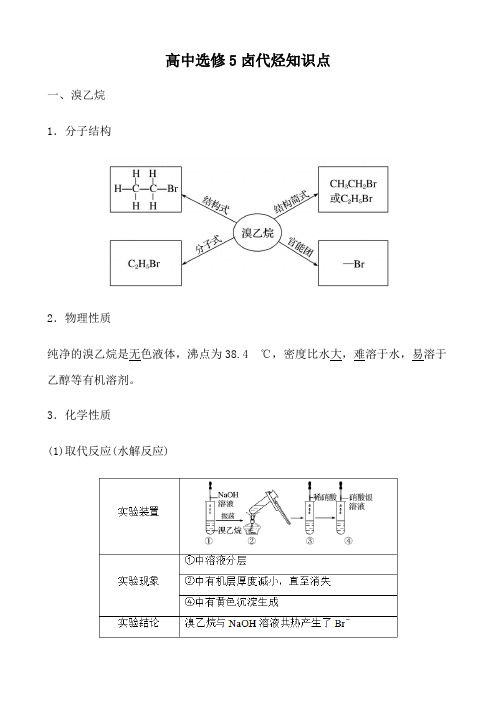
高中选修5卤代烃知识点一、溴乙烷1.分子结构2.物理性质纯净的溴乙烷是无色液体,沸点为38.4 ℃,密度比水大,难溶于水,易溶于乙醇等有机溶剂。
3.化学性质(1)取代反应(水解反应)由实验可知①溴乙烷与氢氧化钠溶液共热时断裂的是C—Br键,水中的羟基与碳原子形成C—O键,断下的Br与水中的H结合成HBr。
②溴乙烷与NaOH溶液共热反应的化学方程式为:反应类型为:取代反应。
(2)消去反应由实验可知:①溴乙烷与氢氧化钠溶液共热反应后,化学方程式为:②消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键化合物的反应。
(1)由溴乙烷的结构认识其水解反应与消去反应溴乙烷分子结构为①在强碱的水溶液中,在b处断键,发生取代(水解)反应。
②在强碱的醇溶液中,在a、b处断键,发生消去反应。
③条件不同,其断键位置不同。
(2)消去反应的特点①从反应机理看:消去反应是从相邻的两个碳原子上脱去一个小分子,相邻的两个碳原子各断一个化学键。
②从产物看:消去反应的产物中一定有不饱和产物和一个或几个小分子。
二、卤代烃1.概念与分类(1)概念:烃分子中的氢原子被卤素原子取代后生成的化合物。
(2)分类:①按分子中卤素原子个数分:一卤代烃和多卤代烃。
②按所含卤素原子种类分:氟代烃、氯代烃、溴代烃、碘代烃。
③按烃基种类分:饱和卤代烃和不饱和卤代烃。
④按是否含苯环分:脂肪卤代烃和芳香卤代烃。
2.物理性质常温下,卤代烃中除少数为气体外,大多为液体或固体,卤代烃不溶于水,可溶于大多数有机溶剂。
某些卤代烃本身就是很好的有机溶剂。
3.化学性质(1)取代反应(水解反应)(2)消去反应4.卤代烃中卤素原子的检验(1)实验流程(2)实验要点:①通过水解反应或消去反应将卤素原子转化为卤素离子。
②排除其他离子对卤素离子检验的干扰,卤素原子转化为卤素离子后必须加入稀硝酸中和过量的碱。
5.卤代烃的用途与危害(1)用途:制冷剂、灭火剂、溶剂、麻醉剂、合成有机化合物。
有机化学:卤代烃总结

Ø Nu-: -OH, -OR, -CN, -X, -C,
等;
Ø Nu: : ROH, RNH2, NH3, H2O 等。
Ø 离去基团 (LG) : 带着一对电子从反应底物上离去的基团。
Ø LG: -X。
Ø 常见的卤代烷的亲核取代反应:
Ø 威廉姆森(Williamson)合成醚
例:
伯卤代烷 Why?
Ø 仲卤代烷、叔卤代烷在碱性条件下易发生消 除反应得到相应的烯烃!
3、卤代烷的氨解
伯胺
仲胺
叔胺
季铵盐
Ø 反应产物胺与卤化氢继续反应得到铵盐,体系加碱(缚酸剂) 释放出游离的胺。
4、被氰基取代---与氰化钠(钾)反应
Ø 腈在有机合成中的应用:
第八章 卤代烃 Halohydrocarbons
卤代烃:烃分子中的一个或几个H原子被卤素原子取 代得到的化合物。
通式:R-X (X = F, Cl, Br, I) 官能团: X (X = F, Cl, Br, I)
主要学习内容
1、卤代烃的结构、分类和命名;
2、卤代烃的反应:亲核取代反应、消除反应及Zaitsev 规则、卤代烷与金属的反应等;
异丁基氟
sec-butyl bromide isobutyl fluoride
I
叔丁基碘 tert-butyl iodide
CHCl3
三氯甲烷 氯仿 chloroform
CHI3
三碘甲烷 碘仿 iodoform
2、系统命名法
命名原则:
Ø选择母体,确定主链:以烃作为母体,卤素作为取代基;
Ø编号:按照烃命名原则进行编号,基团列出顺序按“次序
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【高中化学】寒假第四讲总结—卤代烃
【知识框架】
【重难点知识回顾】
1、卤代烃的结构和物理性质定义
烃分子中的氢原子被卤素原子取代后形成的产物官能团
卤素原子(-X )通式(一卤代烃)
R-X ,饱和一卤代烃:C
n H 2n+1
X 物
理
性
质溶解性
难溶于水,易
溶于有机溶剂状态
①除少数为气体(例如CH 3Cl 、CH 2
ClCH 3等),其他大多为液体和固体②难溶于水,易溶于大部分有机溶剂,很多卤代烃自身就是很好的溶剂密度
①随烃基中碳原子数和卤素原子数的增加而升高,且高于相应的烷烃②同一烃基不同卤代烃:卤素原子相对原子质量越大,密度越大
③脂肪卤代烃密度少数小于水(一氯代物、一氟代物),大多数密度比水大溶沸点①卤代烃沸点随碳原子数升高而增大
②卤代烃同分异构体沸点随支链个数增多而降低
③同一烃基不同卤素的沸点随卤素原子相对质量增大而增大
2、卤代烃的化学性质
水解消去反应条件
NaOH 的水溶液,加热NaOH 的醇溶液,加热
断键方式反应通式
R-X+NaOH R-OH+NaBr 举例
CH 3CH 2Br+NaOH CH 3CH 2OH+NaBr CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 结构条件含有卤素原子
卤素原子有邻位碳原子,且邻位碳原子(非苯环上
的碳)上要有氢原子(1)实验原理:R-X+NaOH R-OH+NaX HNO 3+NaOH=NaNO 3+H 2O AgNO 3+NaX=AgX ↓+NaNO 3
(2)实验步骤:取少量卤代烃于试管中并加入NaOH 溶液,加热煮沸冷却后加过量稀硝酸酸化,加入硝酸银溶
液观察沉淀颜色,根据沉淀(AgX)的颜色(白色、浅黄色、黄色)可确定卤族元素(氯、溴、碘)
(3)①加热煮沸的目的:加快水解速率,因为不同的卤代烃水解的难易程度不同。
②加入稀HNO 3酸化的目的:中和过量的NaOH ,防止NaOH 与AgNO 3反应生成的AgOH 沉淀(不稳定,
会变成棕黑色Ag 2O 沉淀)干扰对实验现象的观察。
