第一章物质结构 元素周期律
第一章第1节元素周期表

二、元素周期表的结构
不同横行中最外层电子数相同的 2、族: 元素按电子层数递增的顺序由上 到下排成纵行。
共 18 个纵行, 16 个族
七 共7个主族 主族序数=最外层电子数 主 (A族)表示为罗马数字加A 七 副族: ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB ,ⅠB , ⅡB 副 族 共7个副族 零 (B族)表示为罗马数字加B 八 包含三列(8、9、10) 第VIII 族: 族 最外层稳定结构的稀有气体元素 零族:
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的 难易程度。置换出氢越容易,则金属性越强。
已知金属A可与冷水反应, 金属B和热水才能反应,金属 C和水不能反应,判断金属A、 B、C金属性强弱如何?
金属性 A〉 B〉 C
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的
碱金属与氧气反应比较
单质 Li Na K Rb Cs 与O2反应 Li2O Na2O、Na2O2 K2O、K2O2、KO2 更为复杂 更为复杂 反应程度
越 来 越 剧 烈
(1)碱金属元素原子的最外层都有 1个电子,它们的化学性质相似 ①与O2的反应
Δ Δ 4Li + O2 = 2Li2O
Li、Rb、Cs 又如何呢?
二、元素周期表的结构
具有相同电子层数的元素,按 1、周期: 照原子序数递增顺序由左往右 排成横行。 共 7 横行— 7 个周期
周期数 = 电子层数
短周期 三 短 周期 四 长周期 长 (横向)
第1周期: 2种元素 第2周期:
第3周期:
第4周期:
8种元素 18种元素
第5周期:
第6周期: 32种元素 第7周期: 26种元素
高一化学物质结构元素周期律

3.元素、核素、同位素 书P4 元素: 具有相同质子数(核电荷数)的同一类原子的总称。 质子数(或核电荷数) 决定元素种类的是_______________
核素: 具有一定数目的质子和一定数目的中子 的一种原子。 决定核素(原子)种类的是质子数和中子数 _______________
同位素: 质子数相同而中子数不同的同一元素的 不同核素互称为同位素。(对于原子来说) 判断条件:①质子数相同 ②中子数不同 ③同一元素的原子
根据以根据以上数据,磷原子的半径可能是( B
)
A. 0.080nm B. 0.110nm C. 0.120nm D. 0.070nm 第四 2、 34号元素是第__________ 周期元素;族序数是
ⅥA +6价 。 _______; 最高正价是________
H2A 若用A表示该元素,其气态氢化物的化学式是________ 。
练:
下列各组物质中,互为同位素的是(ห้องสมุดไป่ตู้(A)O2、、O3 、O4 ) D
40 42 (C)H2O、D2O、 T2O (D) 20Ca 和20 Ca
(B)H2、D2、T2
下列各组中属于同位素关系的是( A ) 39 A. 40 K 与 19 B.T2O与H2O K
19
C.
40 19 K
与
40 20 Ca
元素周期表的结构
短 周 期
周 期
长 周 期
第1周期:2 种元素 第2周期:8 种元素 第3周期:8 种元素 第4周期:18 种元素 第5周期:18 种元素 第6周期:32 种元素
镧系元素:共15 种元素 锕系元素:共15 种元素
不完全周期 第7周期
周期序数 = 电子层数
必修二第一章物质结构元素周期律知识点总结
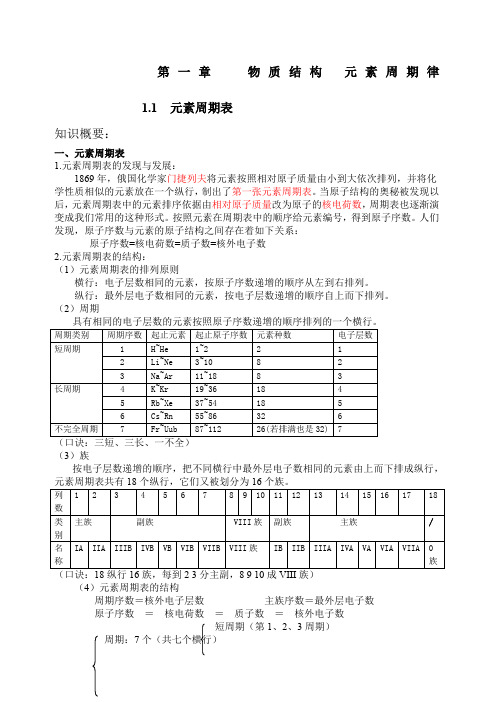
第一章物质结构元素周期律1.1 元素周期表知识概要:一、元素周期表1.元素周期表的发现与发展:1869年,俄国化学家门捷列夫将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表。
当原子结构的奥秘被发现以后,元素周期表中的元素排序依据由相对原子质量改为原子的核电荷数,周期表也逐渐演变成我们常用的这种形式。
按照元素在周期表中的顺序给元素编号,得到原子序数。
人们发现,原子序数与元素的原子结构之间存在着如下关系:原子序数=核电荷数=质子数=核外电子数2.元素周期表的结构:(1)元素周期表的排列原则横行:电子层数相同的元素,按原子序数递增的顺序从左到右排列。
纵行:最外层电子数相同的元素,按电子层数递增的顺序自上而下排列。
(2)周期(3)族按电子层数递增的顺序,把不同横行中最外层电子数相同的元素由上而下排成纵行,(4)元素周期表的结构周期序数=核外电子层数主族序数=最外层电子数原子序数=核电荷数=质子数=核外电子数短周期(第1、2、3周期)周期:7个(共七个横行)周期表长周期(第4、5、6、7周期)主族7个:ⅠA-ⅦA族:16个(共18个纵行)副族7个:IB-ⅦB第Ⅷ族1个(3个纵行)零族(1个)稀有气体元素(5)认识周期表中元素相关信息随堂检测(一)1.已知某主族元素的原子结构示意图如下,判断其位于第几周期?第几族?2.主族元素在周期表中的位置取决于该元素的()A.相对原子质量和核外电子数B.电子层数和最外层电子数C.相对原子质量和最外层电子数D.电子层数和次外层电子数3.下列各表为周期表的一部分(表中为原子序数),其中正确的是()A.B.C.D.4.,同一周期ⅡA、ⅢA的两种元素的原子序数差可能为几?5.已知元素的原子序数,可以推断元素原子的()①质子数②核电荷数③核外电子数④离子所带电荷数A.①③B.②③C.①②③D.②③④6.由长周期元素和短周期元素共同构成的族是()①0族②主族③副族④第Ⅷ族A.①②B.①③C.②③D.③④7.下列说法中正确的是()A.现行元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的B.最外层电子数相同的元素一定属于同一族C.非金属元素的最外层电子数都≥4D.同周期元素的电子层数相同二、元素的性质与原子结构1.碱金属元素:从原子结构上看:相同点:最外层都只有一个电子。
高中化学必修二知识点大全

高中化学必修二知识点大全高中化学必修2知识点归纳总结第一章物质结构、元素周期律一、原子结构原子由质子、中子和电子组成。
其中,质子数量决定了元素的种类,中子数量则决定了同一元素不同核素的存在,而电子则决定了元素的化学性质。
原子序数等于核电荷数等于质子数,也等于核外电子数。
电子按照能量最低的原则排布在不同的电子层中,每个电子层最多容纳2n个电子,最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
二、元素周期表元素周期表是按照原子序数递增的顺序,将元素按照电子层数和最外层电子数的不同排列而成的表格。
周期数等于元素最外层电子层数,主族序数等于元素最外层电子数。
元素周期表中,横行称为周期,纵列称为族,共有7个主族和7个副族,以及三个Ⅷ族和一个零族。
周期表中的元素按照一定的规律排列,能够显示出元素的物理和化学性质的周期性变化。
例如,同一周期内的元素具有相似的电子结构和化学性质,而同一族内的元素具有相同的最外层电子结构和化学性质。
三、元素周期律元素周期律是指元素周期表中元素物理和化学性质的周期性变化规律。
元素周期律包括原子半径、电子亲和能、电离能、电负性等物理和化学性质的周期性变化。
例如,原子半径随着周期数的增加而逐渐减小,而同一周期内原子半径随着原子序数的增加而逐渐减小。
电子亲和能和电离能则相反,随着周期数的增加而逐渐增大,而同一周期内电子亲和能和电离能随着原子序数的增加而逐渐减小。
掌握元素周期律可以帮助我们预测元素的物理和化学性质,从而更好地理解和应用化学知识。
元素周期律是指元素的性质随着核电荷数的递增而呈现周期性变化的规律。
这些性质包括核外电子排布、原子半径、主要化合价、金属性和非金属性。
这种周期性变化实际上是元素原子核外电子排布周期性变化的必然结果。
同一周期内的元素性质也存在递变规律。
以第三周期元素为例,它们的电子排布和原子半径随着核电荷数的增加而发生变化,而主要化合价则依次为+1、+2、+3、-4、+5、-3、+6、-2、+7和-1.此外,金属性和非金属性、单质与水或酸置换、氢化物的化学式、与H2化合的难易、氢化物的稳定性、最高价氧化物的化学式、酸碱性以及变化规律等方面也存在一定的变化规律。
第一章 物质结构元素周期律(知识点总结)

Z 第一章物质结构元素周期律班级姓名一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N) 1.原子(A X)原子序数=质子数= 核电荷数=原子的核外电子数核外电子(Z个)2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷(质子)数的同一类原子的总称。
核素:具有一定数目质子和一定数目中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列;②将电子层数相同......的各元素从左到右排成一横行..③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..(注意:周期序数=原子的电子层数;主族序数=原子最外层电子数)2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)长周期第五周期 5 18种元素周第六周期 6 32种元素期不完全周期:第七周期 7 未填满(已有26种元素)表主族:7个主族族副族:7个副族(18个纵行)第Ⅷ族:三个纵行(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电..........子排布的周期性变化.........的必然结果。
2.同周期元素性质递变规律(从左到右):电子层数相同,最外层电子数依次增加,原子半径依次减小,金属性减弱,非金属性增强,与H2的化合由难到易,氢化物的稳定性由弱到强。
高中化学:物质结构 元素周期律知识点

高中化学:物质结构元素周期律知识点一. 原子结构1. 原子核的构成核电荷数(Z) == 核内质子数 == 核外电子数 == 原子序数2. 质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。
质量数(A)= 质子数(Z)+ 中子数(N)==近似原子量3. 原子构成4. 表示方法二. 元素、核素、同位素、同素异形体的区别和联系1. 区别2. 联系【名师点睛】(1) 在辨析核素和同素异形体时,通常只根据二者研究范畴不同即可作出判断。
(2) 同种元素可以有多种不同的同位素原子,所以元素的种类数目远少于原子种类的数目。
(3) 自然界中,元素的各种同位素的含量基本保持不变。
三. “10电子”、“18电子”的微粒小结1. “10电子”微粒2. “18电子”微粒四. 元素周期表的结构1. 周期2. 族3. 过渡元素元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒元素周期表中主、副族的分界线:(1) 第ⅡA族与第ⅢB族之间,即第2、3列之间;(2) 第ⅡB族与第ⅢA族之间,即第12、13列之间。
五. 元素周期表的应用1. 元素周期表在元素推断中的应用(1) 利用元素的位置与原子结构的关系推断。
等式一:周期序数=电子层数;等式二:主族序数=最外层电子数;等式三:原子序数=核电荷数=质子数=核外电子数。
(2) 利用短周期中族序数与周期数的关系推断。
(3) 定位法:利用离子电子层结构相同的“阴上阳下”推断具有相同电子层结构的离子,如a X(n+1)+、b Y n+、c Z(n+1)-、d M n-的电子层结构相同,在周期表中位置关系为则它们的原子序数关系为a>b>d>c。
2. 元素原子序数差的确定方法(1) 同周期第ⅡA族和第ⅢA族元素原子序数差。
(2) 同主族相邻两元素原子序数的差值情况。
①若为ⅠA、ⅡA族元素,则原子序数的差值等于上周期元素所在周期的元素种类数。
物质结构 元素周期律

第一章 物质结构、元素周期律 知识梳理一、原子结构原子 AZ X 中,Z 为 ,A 为 ,中子数为 ,核外电子数为 。
例:3717Cl -中的质子数是 ,质量数是 ,中子数是 ,核外电子数是 。
同位素 相同而 不同的同一元素的不同原子之间的互称。
例:氕(11H )、氘(2 1D )、氚(3 1T )互为 (2012统测) C 126 C 136 C 146 互为二、元素周期表周期序数= ,主族序数=主族元素的最高正化合价= = ,主族元素的最低负化合价= 8- 。
碱金属元素:最外层电子都是 ,这些元素的化合价都是 价,从锂到铯(从上到下):原子半径 Li Na K Rb Cs ; 金属性(或单质还原性)Li Na K Rb Cs ;与水反应的剧烈程度 Li Na K Rb Cs ;最高价氧化物对应水化物碱性 LiOH NaOH KOH RbOH CsOH 钠与水:2Na+2H 2O==2NaOH+H 2↑,钾与水:2K+2H 2O==2KOH+H 2↑,可写出离子方程式: 卤族元素卤族元素最外层电子数都是 ,这些元素的最低化合价均为 价,从F 到I ,核电荷依次增大,电子层数依次增多,原子半径逐渐增大。
从F 到I ,原子半径:F Cl Br I ; 非金属性(或单质氧化性):F Cl Br I ;与氢气反应的容易程度:F 2 Cl 2 Br 2 I 2;稳定性:HF HCl HBr HI ;还原性: F - Cl - Br - I -;无氧酸的酸性:HF<HCl<HBr<HI ;含氧酸酸性:HClO 4>HBrO 4>HIO 4粒子半径大小的比较(1)同周期元素的原子半径随着核电荷数的增大而逐渐 (稀有气体除外)。
例:Na Mg Al Si , Na + Mg 2+ Al 3+(2)同主族元素的原子半径随核电荷数增大而逐渐 。
例:Li Na K , Li + Na + K +(3)核外电子排布相同的离子半径随核电荷数的增加而 。
第一章 物质结构 元素周期律_课件

一. 原子核外电子的排布
1. 电子层-表示运动着的电子离核远近及能量高低
含多个电子的原子中, 电子是分层排布的。能量较 低的电子运动在离核较近的 区域,能量较高的电子运动 在离核较远的区域。
电子层数( n )
电子层符号
内层
1 K
2 L
3 M
4 N
5 O
6 P
外层
7 Q
能量由低到高
2.核外电子分层排布的一般规律
(主族)最外层电子数 = 最高正价 最外层电子数-8 = 负价
表中位置
同位-化学性质相同
元素性质
同主族
相似性 递变性
同周期
递变性
“元素之最”
最活泼的非金属: F 最活泼的金属: Fr(Cs) 最轻的金属: Li 最重的金属: Os(锇22.6) 最硬的金属: Cr 最轻的单质为: H2 最高熔点的单质: 石墨(3650) 最低熔点的单质: He(-272.2) 最稳定的气态氢化物: HF 最强的含氧酸: HClO4 最强的碱: FrOH(C OH)
五、元素周期律和元素周期表的意义
1、对化学的学习和研究起指导作用
(1)发现新元素并预测它们的性质
(2)一定区域内寻找新物质
2、对实际生产的指导作用
●
半导体材料-金属非金属分界线附近(Si、Ge、Se、Ga)
●耐高温耐腐蚀材料-过渡元素 ●催化剂-Ⅷ族 ●农药-右上角(F、Cl、S、P)
3、学习上的指导作用——位、构、性关系
达稳定结构表现金属性。
非金属元素的原子最外层电子数一般多于4,易得电子
达稳定结构表现非金属性
元素失电子的性质-金属性 元素得电子得性质-非金属性
10
知识点总结化学物质结构

第一章物质结构元素周期律一、原子结构1、原子A ZX中,质子有Z 个,中子有A-Z 个,核外电子有Z 个。
2、质量数(A)= 质子数(Z)+ 中子数(N)(质量数在数值上等于其相对原子质量)原子中:原子序数= 核电荷数= 质子数= 核外电子数阳离子中:质子数=核电荷数=离子核外电子数+ 离子电荷数阴离子中:质子数=核电荷数=离子核外电子数- 离子电荷数3、电子层划分电子层数 1 2 3 4 5 6 7符号K L M N O P Q离核距离近远能量高低低高4、核外电子排布规律(一低四不超)(1)核外电子总是尽先排布在能量低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层摆布(即排满K层再排L层,排满L层再排M层)。
(2)各电子层再多容纳的电子数是2n2 个(n表示电子层)(3)最外层电子数不超过8个(K层是最外层时,最多不超过2 个);次外层电子数不超过18 个;倒数第三层不超过32 个。
5、概念元素:具有相同核电荷数的同一类原子的总称核电荷数决定元素种类核素:具有一定数目质子和一定数目中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子之间的互称。
例:氕(1 1H)、氘(2 1D )、氚(3 1T )同素异形体:同种元素原子组成结构不同的不同单质之间的互称。
例:O2与O3,白磷与红磷,石墨与金刚石等6、粒子半径大小的比较(1)同周期元素的原子或最高价阳离子的半径随着核电荷数的增大而逐渐减小(除稀有气体外)。
例:Na>Mg>Al>Si, Na+>Mg2+>Al3+(2)同主族元素的原子或离子随核电荷数增大而逐渐增大。
例:Li<Na<K, Li+<Na+<K+ (3)电子层结构相同(核外电子排布相同)的离子半径(包括阴阳离子)随核电荷数的增加而减小。
例:O2->F->Na+>Mg2+>Al3+(上一周期元素形成的阴离子与下一周期元素形成的阳离子有此规律)(4)同种元素原子形成的粒子半径大小为:阳离子<中性原子<阴离子;价态越高的粒子半径越小。
元素周期表

4 +4 -4
5 +5 -3
6
7
8 0
-2
-1
除氟和氧两个最活泼的非金属元素外,其他元素: 最高正化合价 = 最外层电子数 从碳元素(最外层4个电子)开始有负化合价: 非金属元素的负化合价 = 最外层电子数-8 稀有气体化学性质稳定,化合价为零。
第一章 物质结构 元素周期律
一、元素周期律
3.元素最高正化合价和负化合价的周期性变化
第一章 物质结构 元素周期律
一、元素周期律
随着原子序数的递增: 元素原子的最外层电子排布呈周期性变化。
元素的原子半径也发生周期性变化。
元素的化合价也呈现出周期性的变化。
元素的性质随着原子序数的递增呈现出周期性的变化,这 个规律叫元素周期律。
第一章 物质结构 元素周期律
第二节 元素周期律
二、元素周期表
35 17
Cl
37 17
Cl
自然界中,元素的各种同位素所占的原子百分含量一般是 不变的,平时所说的元素的相对原子质量实际上是各种天然同 位素的相对原子质量的平均值。
第一章 物质结构 元素周期律
三、同位素
2.元素的平均相对原子质量
已知氯有两种天然同位素,它们的相对原子质量和原子百 分含量的数据如下: 35 相对原子质量34.969,原子百分含量为75.77%; 17 Cl
11Na 12Mg 13Al 14
元 素
原子半径 /nm 示意图 特 点
Si
15P
16S
17Cl
18Ar
0.186
0.160
0.143
0.117
0.110
0.102
0.099
从Na到Cl的原子半径逐渐变小
化学必修2 《 第一章 物质结构 元素周期律》单元复习-人教版 .ppt

注意审题
可用十字交叉法求出原子个数比
[例3] 电解水和重水的混合液,通电一段时间后, 若两极共产生18. 5g 气体,其体积为33. 6L(标准 状况),试求生成的H2 和D2 的物质的量的比。
设生成H2 的物质的量为x ,生成D2 的物质的量为y 2H2O x
电解 电解
2H2 + O2 2D2O 2D2 + O2 x x/2 y y y/2 ( x + x/2 + y + y/2 )× 22. 4 L/mol = 33. 6 L x· 18g/mol + y· 20g/mol = 18. 5 g x = 0. 75mol y = 0. 25mol n ( H2 ) : n ( D2 ) = 0.75mol :0.25mol = 3 : 1
7
元素周期律与元素周期表
⑴ 元素周期律的实质 ⑵ 元素周期表的结构。 (重点:第三周期,ⅠA,ⅦA) ⑶ 元素在周期表的位置、结构及性质的关系。 ⑷ 判断微粒半径大小,元素及化合物的递变 规律,或者它们的逆向推断。 ⑸ 推断未知元素及其化合物的性质。
8
[例1] 在周期表中,第三、四、五、六周期元素的数目 分别是( B )
若甲为第六周期元素(Cs、Ba),则乙的原子序数为 X+32。
10
[例3]X、Y属短周期元素,X原子的最外层电子数 是次外层电子数的一半,Y位于X的前一周期,且 最外层只有一个电子。则X和Y形成的化合物的化 学式可表示为( A )
(A)XY (B) XY2 (C) XY3 (D) X 2Y 3
X原子的最外层电子数是次外层电子数的一半,则 X可能是Li (2,1) 或 Si ( 2,8,4 ) 若 X为Li,则Y为H , 能组成 LiH 。 若 X为Si,则Y为Li ,不可能生成题目所 示 的化合物。
物质结构 元素周期表

第一章 物质结构 元素周期表专题一:元素周期表一、元素周期表1、元素周期表的排列原则:横行:电子层数相同,从左到右原子序数依次递增纵行:最外层电子数相同,自上而下电子层数依次递增2、周期结构:三短(1、2、3周期)、三长(4、5、6周期)、一不全(7周期)3、族的构建巧记:18纵行16族;八九十列成VIII 族;每逢二三分主副,镧系锕系各十五,都在III 副里边住。
第I A 族(除氢):碱金属元素 第VII 族:卤族元素 0族:稀有气体元素4、关系式(1)原子序数=核电荷数=质子数=核外电子数(2)质量数=中子数=质子数二、碱金属1、碱金属元素的原子结构规律周期类别 周期序数 元素种类 短周期 1 2 2 8 3 8 长周期 4 18 5 18 6 32 不完全周期 7 32 列数 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 类别 主族 副族 VIII 族 副族 主族名称 IA II A IIIB IV B V B VI B VII B VIII 族 I B II B III A IV A V A VI A VII A 0族碱金属元素元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 锂 Li 3 钠 Na 11 钾 K 19 铷 Rb 37 铯 Cs 55按Li、Na、K、Rb、Cs顺序,密度依次升高;熔点、沸点依次降低。
2、K、Na性质实验对比与O2反应与水反应钠剧烈燃烧,色火焰熔成小球,浮于水面,四处游走,发出嘶嘶的声音钾更剧烈,色火焰熔成小球,浮于水面,四处游走,轻微爆炸声结论K比Na的活动性强3、碱金属元素原子结构与性质的关系(1)原子结构特点相同点:最外层都只有一个电子不同点:随核电荷数增加,原子半径增大(2)化学性质特点A、相似性:原子都易失去最外层的一个电子,与非金属单质及水反应。
Li、Na、K在O2中燃烧反应,Na、K与H2O反应,B、差异性:随着核电荷数的增加,原子核对最外层电子的引力逐渐减弱。
高一化学必修一第一章第一节元素周期表

同种元素原子的原子核中质子数是相同的。 那么,中子数是否一定相同呢?
1 H 1 2 1
H
3 1H
氕 H 氢
氘 D 重氢
氚 T 超重氢
核素:具有一定数目的质子和一定数目的中子 的一种原子。 即一种原子就是一种核素。
1 H 1 2
1
H
3 H 各为一种核素 1
同位素:质子数相同而中子数不同的同一元素 的不同原子互称为同位素。 同一种元素的不同核素互称为同位素。
一、元素周期表
1. 编排原则: (1)按原子序数递增的顺序从左到右排成横行
(2)按电子层数递增的顺序从上而下排成纵行
一、元素周期表
2.元素周期表的结构:
第一周期:2 种元素 第二周期:8 种元素 第三周期:8 种元素 第四周期:18 种元素 第五周期:18 种元素 第六周期:32 种元素(含 镧系15种) 第七周期(不完全周期):26 种元素 (含 锕系15种)
★主族序数=最外层电子数
习题:
序号位置:
例1:试推测出第32号元素在周期表中的 位置。 分析:0族定位法。即根据与该元素原子 序数最接近的0族元素的位置来确定。
答案:第四周期 第ⅣA族。
原子结构示意图位置:
例2:写出下列元素在周期表的位置:
第 三 周期 第 ⅣA 族
第 二 周期 第 ⅥA 族
13 6 C-NMR(核磁共振)可以用于含碳化
元素相对原子质量的计算:
按各种同位素所占的一定百分 比算出的平均值
A=A1×a1%+A2×a2%+…
A1、A2: 同位素的相对原子质量 a1%、a2%: 同位素原子的个数分数 如
35Cl
——75% , 37Cl——25% 35×0.75+37×0.25=35.5 即:氯的原子量为35.5。(近似值)
高中化学必修2 第1章 《物质结构 元素周期表》核心知识点

第一章 物质结构 元素周期表第一节 元素周期表一、周期表原子序数 = 核电荷数 = 质子数 = 核外电子数1、依据横行:电子层数相同元素按原子序数递增从左到右排列纵行:最外层电子数相同的元素按电子层数递增从上向下排列2、结构周期序数=核外电子层数 主族序数=最外层电子数短周期(第1、2、3周期) 周期:7个(共七个横行)周期表 长周期(第4、5、6、7周期) 主族7个:ⅠA-ⅦA族:16个(共18个纵行)副族7个:IB-ⅦB第Ⅷ族1个(3个纵行) 零族(1个)稀有气体元素二.元素的性质和原子结构(一)碱金属元素:1、原子结构 相似性:最外层电子数相同,都为1个递变性:从上到下,随着核电核数的增大,电子层数增多,原子半径增大2、物理性质的相似性和递变性:(1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
(2)递变性(从锂到铯):①密度逐渐增大(K 反常) ②熔点、沸点逐渐降低 结论:碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性。
3、化学性质(1)相似性:(金属锂只有一种氧化物)4Li + O 2 Li 2O 2Na + O 2 Na 2O 22 Na + 2H 2O = 2NaOH + H 2↑ 2K + 2H 2O = 2KOH + H 2↑ 2R + 2 H 2O = 2 ROH + H 2 ↑产物中,碱金属元素的化合价都为+1价。
点燃 点燃 过渡元素结论:碱金属元素原子的最外层上都只有1个电子,因此,它们的化学性质相似。
(2)递变性:①与氧气反应越来越容易②与水反应越来越剧烈结论:①金属性逐渐增强②原子结构的递变性导致化学性质的递变性。
总结:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。
所以从Li到Cs的金属性逐渐增强。
(二)卤族元素:1、原子结构相似性:最外层电子数相同,都为7个递变性:从上到下,随着核电核数的增大,电子层数增多,原子半径增大2.物理性质的递变性:(从F2到I2)(1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(B r2反常)(3)单质的熔、沸点升高3、化学性质(1)卤素单质与氢气的反应:X2 +H2=2 HXF2Cl2Br2I2卤素单质与H2的剧烈程度:依次增强;生成的氢化物的稳定性:依次增强(HF 最稳定)(2)卤素单质间的置换反应2NaBr +Cl2=2NaCl + Br2氧化性:Cl2________Br2;还原性:Cl-_____Br-2NaI +Cl2=2NaCl + I2氧化性:Cl2_______I2;还原性:Cl-_____I-2NaI +Br2=2NaBr + I2氧化性:Br2_______I2;还原性:Br-______I-结论:F2 F-Cl2 Cl-Br2 Br-I2 I-单质的氧化性:从下到上依次增强(F2氧化性最强),对于阴离子的还原性:从上到下依次增强(I-还原性最强)结论:①非金属性逐渐减弱②原子结构的递变性导致化学性质的递变性。
第一节元素周期表

归纳:碱金属的主要物理性质
相似性: 1) 银白色有金属光泽(铯略带金色) 2) 较柔软,有延展性 3) 密度小 4) 熔点低(均小于200℃) 5) 导电、导热
递变性: 随着核电荷数的增加:
• 密度增大 (但K 反常) • 熔、沸点逐渐降低
2、卤族元素
(1)物理性质
物理性质
随原子序数的递增: 1.颜 色: 颜色逐渐加深 2.状 态: 气态~液态~固态 3.熔沸点: 逐渐升高 4.密 度: 逐渐增大
(2)原子结构
(3)化学性质
①卤素单质与氢气反应
卤素单质与氢气反应 剧烈程度:F2>Cl2>Br2>I2 生成氢化物稳定性:
HF>HCl>HBr>HI
②卤素单质间的置换反应
颜色
溶于水
溶于CCl4
Cl2
黄绿色
黄绿色
黄绿色
Br2
深红棕色 橙黄色
橙红色
I2
紫黑色
褐色
紫红色
实验1—1
实验
现象
化学方程式
57
6 55 56 - 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
71
7 87 88 89103
104
105
106
107
108
109
110
111
112
过渡元素
镧 系 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
碳有两个电子层,位于第二周期,镁有三个电子层, 位于第三周期;溴有四个电子层,位于第四周期。
(2)族(16个) 七个主族 七个副族 一个第Ⅷ族(3个纵行) 一个0族
高一化学必修二第一章物质结构元素周期律知识点总结
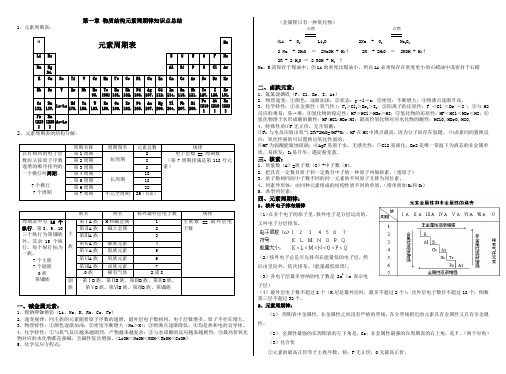
第一章物质结构元素周期律知识点总结1、元素周期表:H 元素周期表HeLi Be B C N O F Ne Na Mg24.Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br KrRb Sr Y Zr Nb Mo95.Tc[98]Ru101.Rh102.Pd106.Ag107.Cd112.In114.Sn118.Sb121.Te127.I126.Xe131.Cs 132.Ba137.La-LuHf178.Ta180.W183.Re186.Os190.Ir192.Pt195.Au197.Hg200.Tl204.Pb207.Bi209.Po[210]At[210]Rn[222]Fr [223 ]Ra[226]Ac-La2、元素周期表的结构分解:周期名称周期别名元素总数规律具有相同的电子层数而又按原子序数递增的顺序排列的一个横行叫周期。
7个横行7个周期第1周期短周期2电子层数 == 周期数(第7周期排满是第118号元素)第2周期8第3周期8第4周期长周期18第5周期18第6周期32第7周期不完全周期26(目前)族名类名核外最外层电子数规律周期表中有18个纵行,第8、9、10三个纵行为第Ⅷ族外,其余15个纵行,每个纵行标为一族。
7个主族7个副族0族第Ⅷ族主族第ⅠA族H和碱金属1主族数 == 最外层电子数第ⅡA族碱土金属2第ⅢA族3第ⅣA族碳族元素4第ⅤA族氮族元素5第ⅥA族氧族元素6第ⅦA族卤族元素70族稀有气体2或8副族第ⅠB族、第ⅡB族、第ⅢB族、第ⅣB族、第ⅤB族、第ⅥB族、第ⅦB族、第Ⅷ族一、碱金属元素:1、锂钠钾铷铯钫(Li、Na、K、Rb、Cs、Fr)2、递变规律:同主族的元素随着原子序数的递增,最外层电子数相同,电子层数增多,原子半径在增大。
3、物理特性:①颜色逐渐加深;②密度不断增大(Na>K);③熔沸点逐渐降低;④均是热和电的良导体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质结构元素周期律按要求填写下表:
用电子式表示下列物质的形成过程:
HCl ;
Na2S 。
判断下列说法是否正确:
1、第IA族元素铯的两种同位素137Cs比133Cs多4个质子
2、多电子原子中,在离核较近的区域内运动的电子能量较高
3、N2的电子式:
4、硫原子的原子结构示意图:
5、NH4Cl
6、144
62
Sm与
150
62
Sm的质量数相同
7、144
62
Sm与
150
62
Sm的性质完全相同
8、144
62
Sm与
150
62
Sm互为同位素
9、144
62
Sm与
150
62
Sm的核外电子数和中子数均为62
10、CS2、H2O、C2H2都是直线型分子
11、原子半径:Na>Mg>O
12、4℃时,纯水的pH=7
13、有化学键断裂的变化属于化学变化
14、离子晶体中一定没有共价键
15、由分子构成的物质中一定存在分子间作用力,不一定存在共价键
16、在CS2、PCl3中各原子最外层均能达到8电子的稳定结构
17、干冰升华时,分子内共价健会发生断裂
18、两种元素组成的分子中一定只有极性键
19、非金属元素组成的化合物一定是共价化合物
20、含有阴离子的化合物一定含有阳离子
21、只有在原子中,质子数才与核外电子数相等
22、14C和14N的质量数相等,它们的中子数不等
23、一个D2O分子所含的中子数为8
24、CO2
25、K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
26、L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
27、L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
28、M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
29、H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
30、同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
主族元素相关通式:
判断下列说法是否正确:
1.同一元素不可能既表现金属性,又表现非金属性
2.第三周期元素的最高正化合价等于它所处的主族序数
3.短周期元素形成离子后,最外层电子都达到8电子稳定结构
4.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
5.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
6.H3BO3的酸性比H2CO3的强
水溶性:HCl>H2S>SO2
7.
8.若M+和R2-的核外电子层结构相同,则原子序数:R>M
9.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
10.同主族元素从上到下,单质的熔点逐渐降低
11.元素的非金属性越强,其单质的活泼性一定越强
12.原子最外层电子数为2的元素一定处于周期表ⅡA族
13.元素周期律是元素原子核外电子排布周期性变化的结果
14.原子晶体中只存在非极性共价键
15.阴离子都只有还原性
16.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
17.副族元素中没有非金属元素
18.碱金属元素是指IA族的所有元素
19.目前使用的元素周期表中,最长的周期含有36种元素
20.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共
价键的离子型化合物
21.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
22.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
23.第三周期元素的离子半径从左到右逐渐减小
24.非金属元素呈现的最低化合价,其绝对值等于元素原子的最外层电子数
25.最外层有2个电子的原子都是金属原子
26.最外层有5个电子的原子都是非金属原子
27.周期表中所有元素都是从自然界中发现的
28.常温常压下,气态单质的分子都是由非金属元素的原子形成的
29.发生化学反应时失去电子越多的金属原子,还原能力越强
30.金属阳离子被还原后,一定得到该元素的单质
31.核外电子总数相同的原子,一定是同种元素的原子
32.非金属元素R所形成的含氧酸盐(M a RO b)中的R元素必定呈现正价
33.只有非金属能形成含氧酸或含氧酸盐
34.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
35.目前已发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
36.俄国化学家道尔顿为元素周期表的建立作出巨大贡献
37.同一主族的元素从上到下,金属性呈周期性变化
38.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
39.第三周期与第四周期同主族元素的原子序数之差均为18
40.同周期第ⅡA、ⅢA族元素原子序数之差为1
短周期元素中:
1、原子核中无中子的原子____
2、最外层只有一个电子的原子_______
3、最外层有两个电子的原子_____
4、最外层电子数等于次外层电子数的原子___
5、最外层电子数是次外层电子数2倍的原子____3倍的是____4倍的是___
6、电子层数与最外层电子数相等的原子___
7、电子总数为最外层电子数2倍的原子______
8、次外层电子是最外层电子数2倍的原子_____
9、内层电子总数是最外层电子数2倍的原子_____
10、原子半径最小的元素____最大的是____
11、气体单质密度最小的元素是___12、原子核中只有质子没有中子的元素是___13、气态氢化物最稳定的元素是___14、只有负价而无正价的元素是___
15、原子序数、电子层数、最外层电子数都相等的元素是____
16、与水反应最剧烈的金属单质是___非金属单质是___
17、最高价氧化物对应水化物酸性最强的是___碱性最强的是______
18、气态氢化物水溶液呈碱性的元素是___
19、单质和其最高价氧化物都是原子晶体的是___
20、单质硬度最大的元素是___形成化合物种类最多的元素是__气态氢化物中氢的含量最高的元素是___
21、单质、最高价氧化物以及对应的水化物既能与盐酸反应又能与氢氧化钠反应的是__
22、地壳中含量最多的金属元素是___含量最多的非金属元素是___。
