锰
锰

锰锰,化学符号是Mn,它的原子序数是25,是一种灰白色、硬脆、有光泽的过渡金属,纯净的金属锰是比铁稍软的金属,含少量杂质的锰坚而脆,潮湿处会氧化。
锰广泛存在于自然界中,土壤中含锰0.25%,茶叶、小麦及硬壳果实含锰较多。
接触锰的作业有碎石、采矿、电焊、生产干电池、染料工业等。
1774年,甘恩分离出了金属锰。
柏格曼将它命名为manganese(锰)。
锰可用铝热法还原软锰矿制得。
银白色金属,质坚而脆。
属于VIIB族元素。
密度7.44克/立方厘米。
熔点1244℃,沸点1962℃。
在固态状态时它以四种同素异形体存在α锰(体心立方),β锰(立方体),γ锰(面心立方),δ锰(体心立方)。
电离能为7.435电子伏特。
锰在元素周期表上位于第四周期,第VIIB族,属于比较活泼的金属,加热时能和氧气化合,易溶于稀酸生成二价锰盐。
锰的化合价为+2、+3、+4、+5+6和+7。
分别颜色为+2粉红色,+3为不稳定红色结晶,+4为黑色粉末,+5为青蓝色,+6为墨绿色的晶体,+7价位暗紫黑色的晶体。
化合价锰的化合价有+2、+3、+4、+6和+7。
其中以+2(Mn2+的化合物)、+4(二氧化锰,为天然矿物)和+7(高锰酸盐,如KMnO4)、+6(锰酸盐,如K2MnO4)为稳定的氧化态。
在酸性溶液中,+3价的锰和+6价的锰均比较容易发生歧化反应:Mn较稳定,不容易被氧化,也不容易被还原。
MnO4和MnO2有强氧化性。
在碱性溶液中,Mn(OH)2不稳定,易被空气中的氧气氧化为MnO2;MnO4也能发生歧化反应,但反应不如在酸性溶液中进行得完全。
下面列出部分其化合价对应的化合物:Mn-3:Na3[Mn(CO)4]Mn-1:Na[Mn(CO)5]Mn0:MnMn2(CO)10 K6[Mn(CN)6]Mn+1:K5[Mn(CN)6]Mn+2:MnO 二价锰盐Mn+3:MnF3 K3[Mn(CN)6]Mn+4:MnO2 K2[MnF6] MnF4Mn+5:Na3MnO4Mn+6:MnO4Mn+7:MnO4- MnO3F KMnO4和氧气的反应在空气中易氧化,生成褐色的氧化物覆盖层。
锰 百度百科

锰百科名片锰是一种化学元素,锰英文为Manganese,拼音为měng)。
它的化学符号是Mn,它的原子序数是25,是一种过渡金属。
目录基本性质发现过程元素描述元素来源锰的用途相关资料锰-- 和精神科关系最密切的金属元素一、锰的生理功能二、锰的盈缺和健康三、锰的日推荐量和食物中的来源四、锰的主要食物来源有哪些?职业性慢性锰中毒诊断标准从营养学角度看锰的简介食物来源代谢吸收生理功能生理需要过量表现锰缺乏症植物中的锰基本性质发现过程元素描述元素来源锰的用途相关资料锰-- 和精神科关系最密切的金属元素一、锰的生理功能二、锰的盈缺和健康三、锰的日推荐量和食物中的来源四、锰的主要食物来源有哪些?职业性慢性锰中毒诊断标准从营养学角度看锰的简介食物来源代谢吸收生理功能生理需要过量表现锰缺乏症植物中的锰展开编辑本段基本性质元素符号:Mn元素原子量:54.94化合价:+2、+3、+4、+6和+7元素类型:金属元素体积弹性模量:120(GPa)原子化焓:280.3 (kJ /mol @25℃)热容:26.32 J /(mol· K)导电性:0.0069510^6/(cm ·Ω )原子体积:7.39(立方厘米/摩尔)锰(5张)元素在太阳中的含量:10(ppm)元素在海水中的含量:太平洋表面:0.0001(ppm)地壳中含量:950(ppm)质子数:25中子数:30相对原子质量:55原子序数:25所属周期:4所属族数:VIIB电子层分布:2-8-13-2氧化态及代表物质[1]:主要:Mn+2 Mn2+ K4[Mn(CN)6]其它:Mn-3 Na3[Mn(CO)4]Mn-1 Na[Mn(CO)5]Mn0 Mn Mn2(CO)10 K6[Mn(CN)6]Mn+1 K5[Mn(CN)6]Mn+3 MnF3 K3[Mn(CN)6]Mn+4 MnO2 K2[MnF6] MnF4Mn+5 Na3MnO4Mn+6 MnO42-Mn+7 MnO4- MnO3F晶体结构:晶胞为体心立方晶胞,每个晶胞含有2个金属原子。
元素化学 锰

元素化学锰
锰是一种重要的化学元素,在元素周期表中位于第25位。
锰在地壳中的丰度相对较高,约为0.08%。
锰具有银白色的外观,是硬而脆的金属。
在标准条件下,锰的熔点为1244℃,沸点为2100℃。
锰在自然界中主要以化合物的形式存在,其中最常见的矿物是软锰矿和硬锰矿。
软锰矿(MnO2)是最常见的形式,它是地壳中最重要的含锰矿物之一。
此外,锰还存在于许多合金中,如钢铁、镍基合金和铝合金等。
锰在工业中有许多重要的应用。
钢铁工业是锰的最大用户,因为锰可以增强钢铁的强度和延展性。
在炼钢过程中,加入少量的锰可以显著提高钢的强度和硬度,同时保持其良好的延展性。
此外,锰还可以用于制造电池、催化剂、颜料和其他化学制品。
在化学上,锰是一种非常活泼的金属元素。
它可以在空气中氧化形成二氧化锰(MnO2),也可以与许多其他元素和化合物发生反应。
例如,锰可以与氢气反应生成氢化锰(MnH2),与氯气反应生成氯化锰(MnCl2)。
此外,锰还可以与其他金属元素形成合金,如锰铜合金和锰镍合金等。
除了在工业和化学领域的应用外,锰还具有生物学意义。
它是生物体内必需的微量元素之一,对于维持生物体的正常生理功能至关重要。
例如,锰是许多酶的激活剂,参与蛋白质合成、能量代谢和DNA修复等过程。
总的来说,锰是一种非常重要的化学元素,在工业、化学、生物学和医学等领域都有广泛的应用。
然而,锰也具有一定的毒性,因此在使用时需要采取安全措施。
锰
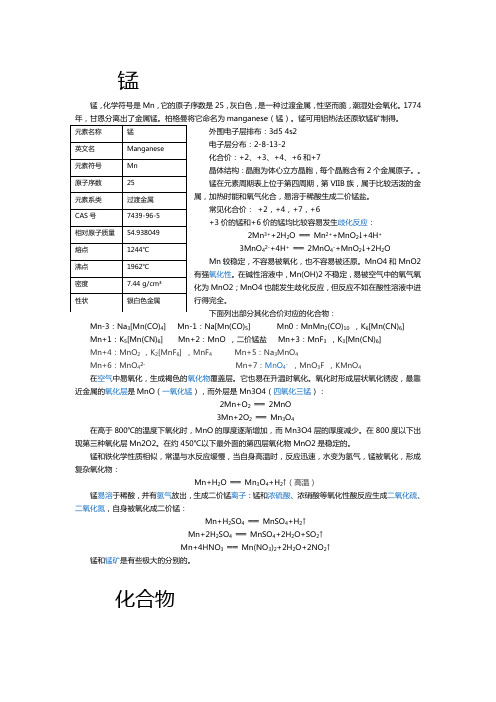
锰锰,化学符号是Mn,它的原子序数是25,灰白色,是一种过渡金属,性坚而脆,潮湿处会氧化。
1774manganese(锰)。
锰可用铝热法还原软锰矿制得。
外围电子层排布:3d5 4s2电子层分布:2-8-13-2化合价:+2、+3、+4、+6和+7晶体结构:晶胞为体心立方晶胞,每个晶胞含有2个金属原子。
锰在元素周期表上位于第四周期,第VIIB族,属于比较活泼的金属,加热时能和氧气化合,易溶于稀酸生成二价锰盐。
常见化合价:+2,+4,+7,+6+3价的锰和+6价的锰均比较容易发生歧化反应:2Mn3++2H2O ══Mn2++MnO2↓+4H+3MnO42-+4H+══2MnO4-+MnO2↓+2H2OMn较稳定,不容易被氧化,也不容易被还原。
MnO4和MnO2有强氧化性。
在碱性溶液中,Mn(OH)2不稳定,易被空气中的氧气氧化为MnO2;MnO4也能发生歧化反应,但反应不如在酸性溶液中进行得完全。
下面列出部分其化合价对应的化合物:Mn-3:Na3[Mn(CO)4] Mn-1:Na[Mn(CO)5] Mn0:MnMn2(CO)10,K6[Mn(CN)6] Mn+1:K5[Mn(CN)6] Mn+2:MnO ,二价锰盐Mn+3:MnF3,K3[Mn(CN)6]Mn+4:MnO2 ,K2[MnF6] ,MnF4 Mn+5:Na3MnO4Mn+6:MnO42- Mn+7:MnO4-,MnO3F ,KMnO4在空气中易氧化,生成褐色的氧化物覆盖层。
它也易在升温时氧化。
氧化时形成层状氧化锈皮,最靠近金属的氧化层是MnO(一氧化锰),而外层是Mn3O4(四氧化三锰):2Mn+O2══2MnO3Mn+2O2══Mn3O4在高于800℃的温度下氧化时,MnO的厚度逐渐增加,而Mn3O4层的厚度减少。
在800度以下出现第三种氧化层Mn2O2。
在约450℃以下最外面的第四层氧化物MnO2是稳定的。
锰和铁化学性质相似,常温与水反应缓慢,当自身高温时,反应迅速,水变为氢气,锰被氧化,形成复杂氧化物:Mn+H2O ══Mn3O4+H2↑(高温)锰易溶于稀酸,并有氢气放出,生成二价锰离子:锰和浓硫酸、浓硝酸等氧化性酸反应生成二氧化硫、二氧化氮,自身被氧化成二价锰:Mn+H2SO4══MnSO4+H2↑Mn+2H2SO4══MnSO4+2H2O+SO2↑Mn+4HNO3══Mn(NO3)2+2H2O+2NO2↑锰和锰矿是有些极大的分别的。
重金属 (锰) 课件综述

二、锰元素致癌、致突变、致畸效应:
Mn2+的致突性可能是由于其具有影响许多聚合酶和核酸酶能力,虽然适量锰对于某些 聚合酶和核酸酶的正常活性是必要的,但浓度过高则会改变另一些酶的特征。高浓度锰 可影响核和线粒体基因。
可大量富集重金属的植物
Thanks
重金属
锰
概述 及 毒理
Summarize and toxicology of heavy metal Manganese
制作:刘霄
目
录
锰金属性质 锰金属的用途及锰矿污染事件 锰—和精神科关系最密切的金属元素 锰中毒类型及其毒理
锰金属基本性质
锰是银白色金属,质坚而脆。锰的英文名为Manganese,拼音为 měng。它的化学符号是Mn,它的原子序数是25,相对原子质量54.93。质 子数:25 中子数:30。它是一种过渡金属,属于VIIB族。在空气中易氧化, 生成褐色的氧化物覆盖层。
锰及其化合物对动物及人类的急性毒性: 大量吸入新生的氧化锰烟雾后,人可出现头 昏、头痛、恶心、胸闷、咽干、气短、寒战、 高热。数小时以至1~2天后热退,全身大汗, 四肢无力,即锰的“金属烟雾热”。
锰中毒及其毒理
二、慢性中毒--------职业性中毒 职业性锰中毒是由于长期吸入含锰浓度较高的锰烟及锰尘而致。 接触锰的作业有碎石、采矿、电焊、生产干电池、染料工业等。
锰中毒及其毒理
锰广泛存在于自然界中,土壤中含锰0.25%,茶叶、小麦及硬壳果实含锰较多 一、急性中毒 锰及其化合物的毒性不一,锰蒸气的毒性大于锰尘,而锰尘又以自然来 源的新鲜粉尘毒性较大,锰合金粉尘的毒性按以下次序递减:锰>二氧 化锰>矽锰。化合物中锰的价态越低,毒性越大。锰与卤素结合后毒性 增加。
慢性锰中毒早期以神经衰弱症候群和植物神经功能障碍为主。有头晕、头痛、 失眠、疲乏无力、嗜睡等症状,还有明显的记忆力降低、性功能减退、易兴 奋、好哭笑等情绪改变。病情进一步发展时,两手摆动不协调,易跌倒、说 话不利落(缓慢、口吃等),举止笨拙、面部缺乏表情。晚期病人可表现为 典型的锥体外系受损的症状:肌张力增高,呈“铅管样”;肌力减退;表情 呆板;眼球运动不灵活;书写困难,字越写越小;走路时表现为前冲步态、 转弯、后退时易跌倒。在接触氧化锰的工人中,可见肺炎的发病率和死亡率 增高。
锰元素介绍

锰锰是一种化学元素,原子序数是25,是一种过渡金属。
元素符号:Mn元素原子量:54.94物化性质银白色金属,质地坚而脆。
密度7.20克/立方厘米。
熔点1244℃,沸点2097℃。
化合价+2、+3、+4、+6和+7。
其中以+2(Mn2+的化合物)、+4(二氧化锰,为天然矿物)和+7(高锰酸盐,如KMnO4)、+6(锰酸盐,如K2MnO4)为稳定的氧化态。
锰的生理作用锰(Mn)是几种酶系统包括锰特异性的糖基转移酶和磷酸烯醇丙酮酸羧激酶的一个成分,并为正常骨结构所必需。
其摄入量差别很大,主要取决于是否食入含量丰富的食品,如非精制的谷类食物,绿叶蔬菜和茶。
此微量元素的通常摄入量为每天2~5mg,吸收率为5%~10%。
成年人每日锰供给量为每千克体重0.1 mg。
食物中茶叶、坚果、粗粮、干豆含锰最多,蔬菜和干鲜果中锰的含量略高于肉、乳和水产品,鱼肝、鸡肝含锰量比其肉多。
一般荤素混杂的膳食,每日可供给5毫克锰,基本可以满足需要。
当正常人出现体重减轻、性功能低下、头发早白可怀疑锰摄入不足。
锰的生理功能可概括如下:1.可促进骨骼的生长发育。
2.保护细胞中细粒体的完整。
3.保持正常的脑功能。
4.维持正常的糖代谢和脂肪代谢。
5.可改善肌体的造血功能。
锰的危害在生产中,锰是应用很广的几种金属之一,近年来,出现了多起关于锰中毒的报道。
职业性锰中毒是由于长期吸入含锰深度较高的锰烟及锰尘而致,慢性锰中毒是职业锰中毒的主要类型。
多见于锰铁冶炼、电焊条的制造与电焊作业以及锰矿石的开采、粉碎、染料或干电池的生产等作业的工人。
职业性慢性锰中毒是长期接触锰的烟尘所引起的以神经系统改变为主的疾病。
早期表现为神经衰弱综合征和植物神经功能紊乱。
中毒较明显时,出现锥体外系损害,并可伴有精神症状。
严重时可表现为帕金森氏综合征和中毒性精神病。
根据职业性慢性锰中毒诊断标准,具有头晕、头痛、容易疲乏、睡眠障碍、健忘等神经衰弱综合征的表现,以及肢体疼痛、下肢无力和沉重感等症状。
重金属-锰

直接以喷雾形式进入水体 施药后弃置的包装品以及清洗 喷洒器械 通过土壤渗透、雨水冲刷
Page 8
农药对空气的污染 由粉剂、可湿性粉剂、烟剂等剂型的农药 具有很强的扩散性和漂浮性,很容易引起 空气污染。 残留农药通过作物根系吸收后逸失在空气 中引起污染。
Page 9
防控举措
Page 5
Page 6
软锰矿
软锰矿的9%, 是重要的锰矿石。软锰矿非常软,还不及人的指甲硬。它的颜色为浅灰到黑, 具有金属光泽。软锰矿一般为块状或肾状或土状,有时具有放射纤维状形态。 有趣的是有些软锰矿还呈现出一种树枝状附于岩石面上,人称假化石。软锰 矿是其他锰矿石变成的,在沼泽、湖海等形成的沉积物中也可以形成软锰矿。 二氧化锰是两性氧化物。它是一种常温下非常稳定的黑色粉末状固体,可作为干 电池的去极化剂。在实验室常利用它的氧化性, 和浓盐酸作用以制取氯气。 二氧化锰在酸碱介质中是一种强氧化剂。与浓硫酸反应有氧气生成;与浓盐 酸反应有氯气生成。二氧化锰与熔融苛性钾在空气中反应生成锰酸钾 (K2MnO4) 。二氧化锰用于干电池、玻璃和陶瓷的着色剂、制锰等。它是强氧 化剂,不能与有机物或其他还原性物质如硫、硫化物、磷化物等一起加热或 摩擦。二氧化锰可用于制造干电池和涂料;在搪瓷、玻璃釉药、陶瓷等方面 做黑色或紫色颜料;在橡胶工业中用作催化剂;加在含铁玻璃中可去掉绿色; 还可制锰化合物。MnO2 一种重要的 无机盐工业 产品。黑色或灰黑色晶体或 无定形粉末。不溶于水,高温下与碳反应生成金属锰。是两性物质,具有良 好的吸附性能和较强的氧化能力。
Page 2
Page 3
来源
褐锰矿 辉锰矿 软锰矿
Page 4
软锰矿
软锰矿的主要成分是二氧化锰,是一种常见的锰矿物。软锰矿含锰为63.19%, 是重要的锰矿石。软锰矿非常软,还不及人的指甲硬。它的颜色为浅灰到黑, 具有金属光泽。软锰矿一般为块状或肾状或土状,有时具有放射纤维状形态。 有趣的是有些软锰矿还呈现出一种树枝状附于岩石面上,人称假化石。软锰 矿是其他锰矿石变成的,在沼泽、湖海等形成的沉积物中也可以形成软锰矿。 二氧化锰是两性氧化物。它是一种常温下非常稳定的黑色粉末状固体,可作为干 电池的去极化剂。在实验室常利用它的氧化性, 和浓盐酸作用以制取氯气。 二氧化锰在酸碱介质中是一种强氧化剂。与浓硫酸反应有氧气生成;与浓盐 酸反应有氯气生成。二氧化锰与熔融苛性钾在空气中反应生成锰酸钾 (K2MnO4) 。二氧化锰用于干电池、玻璃和陶瓷的着色剂、制锰等。它是强氧 化剂,不能与有机物或其他还原性物质如硫、硫化物、磷化物等一起加热或 摩擦。二氧化锰可用于制造干电池和涂料;在搪瓷、玻璃釉药、陶瓷等方面 做黑色或紫色颜料;在橡胶工业中用作催化剂;加在含铁玻璃中可去掉绿色; 还可制锰化合物。MnO2 一种重要的 无机盐工业 产品。黑色或灰黑色晶体或 无定形粉末。不溶于水,高温下与碳反应生成金属锰。是两性物质,具有良 好的吸附性能和较强的氧化能力。
锰

符号:Mn 符号:Mn 原子序数:25 原子序数:25 价电子层结构:3d 价电子层结构:3d54s2 属于第4周期、 族元素。 Mn 属于第4周期、第Ⅷ族元素。
Mn
常见的价态:+ 、+ 、+7 常见的价态:+2、+ 、+ :+ 、+4、+ 也可见:+ 、+ 、+6 也可见:+1、+ 、+ :+ 、+3、+ 天然稳定的放射性核素,有三种同素异形体。 天然稳定的放射性核素,有三种同素异形体。 锰最重要矿是软锰矿; 锰最重要矿是软锰矿;近年来在深海发现大量的 锰矿——锰结核。 锰结核。 锰矿 锰结核
[接触机会] 接触机会]
锰矿开采、运输、加工、电池、锰中毒通 常只限于采矿和精炼矿石的人,长期接触 锰可引起类似帕金森综合征或Wilson病那 锰可引起类似帕金森综合征或Wilson病那 样的神经症状. 样的神经症状.
来源:食物、 来源:食物、水、空气 茶叶、蔬菜、谷物、 茶叶、蔬菜、谷物、牛奶 吸收:在胃液溶解度低,主要经十二指肠吸收; 吸收:在胃液溶解度低,主要经十二指肠吸收; 职业接触者,呼吸道为主; 职业接触者,呼吸道为主; 仅有机锰可经皮肤吸收。 仅有机锰可经皮肤吸收。
锰
分布于所有器官和组织, 分布于所有器官和组织,肝脏和胰腺最丰富 血液 红细胞 80%-90% 80%-90% %-90
锰广泛分布于生物圈内,但是人体内含量甚微。成年人体内锰的总 量约为200-400umol,分布在身体各种组织和体液中。骨、肝、胰、 肾中锰浓度较高;脑、心、肺和肌肉中锰的浓度低于20nmol/g;全 血和血清中的锰浓度分别为200nmol/L和20nmol/L。锰在线粒体中的 浓度高于在细胞浆或其它细胞器中的浓度,所以线粒体多的组织锰 浓度较高。在1913年已经知道锰是动物组织的成分之一,但从1931 年才陆续在多种实验动物中发现缺锰的表现,从而确认锰是动物的 必需微量元素之一。
锰的知识点总结

锰的知识点总结锰的物理性质锰的原子半径为1.25Å,离子半径Mn2+为0.80Å,Mn3+为0.67Å。
锰是一种银白色的金属,具有较高的硬度和韧性。
它是一种比较活泼的金属,可以与许多非金属发生反应,如氧气、氮气等。
锰的熔点为1246°C,沸点为2061°C。
锰的化学性质锰在化学性质上比较活泼,可以形成多种化合价的化合物。
锰主要有+2、+3、+4、+6和+7等多种化合价,其中+2和+3是最常见的。
锰可以与氧、硫、氮等元素发生化学反应,形成氧化物、硫化物、氮化物等。
锰的应用作为一种重要的工业金属,锰在钢铁制造中扮演着至关重要的角色。
它可以与铁形成合金,可以提高钢的硬度、韧性和耐磨性。
此外,锰还用于制造化工产品、电池、陶瓷颜料等。
锰的化合物也被广泛用于农业、医药和环保等领域。
锰的环境影响锰在自然界中存在广泛,并且对人类和环境都有重要的影响。
虽然锰是一种必需元素,但如果摄入过量会对人体造成危害。
长期暴露在含锰尘埃中会导致锰中毒,表现出头晕、乏力、肌肉僵直、运动障碍等症状。
同时,锰的排放也可能对环境造成污染。
锰的生物地球化学循环锰是一种广泛存在于地壳和地球表层的元素,它参与了地球化学循环的过程。
锰的循环主要包括岩石圈、水圈和生物圈。
在岩石圈中,锰存在于矿石、岩石中,与其他元素形成化合物。
在水圈中,锰可以溶解在水中,参与水体的化学反应。
在生物圈中,锰是一种必需元素,对植物和动物的生长和代谢有重要影响。
锰的提取和生产锰的提取和生产主要包括矿石的开采、冶炼和精炼。
锰矿石通常存在于辉锰矿、菱锰矿、褐锰矿等形式。
矿石经过选矿、破碎、浸出等工艺过程,可以提取出含锰的矿浆。
然后通过熔炼、还原等方法可以得到金属锰或者锰合金。
锰的催化作用锰是一种重要的催化剂,具有氧化、还原、酸化、还原等多种催化作用。
锰可以作为氧化剂,参与有机化合物的氧化反应,例如烯烃的合成、醇的氧化等。
锰也可以作为还原剂,参与金属离子的还原反应,例如电解锌离子。
锰的相关内容

锰百科名片编辑本段热容:26.32 J /(mol· K)导电性:0.0069510^6/(cm ·Ω ) 原子体积:7.39(立方厘米/摩尔)锰(5张)元素在太阳中的含量:10(ppm)元素在海水中的含量:太平洋表面:0.0001(ppm)地壳中含量:950(ppm)质子数:25中子数:30相对原子质量:55原子序数:25所属周期:4所属族数:VIIB电子层分布:2-8-13-2氧化态及代表物质[1]:主要:Mn+2 Mn2+ K4[Mn(CN)6]其它:Mn-3 Na3[Mn(CO)4]Mn-1 Na[Mn(CO)5]Mn0 Mn Mn2(CO)10 K6[Mn(CN)6]Mn+1 K5[Mn(CN)6]Mn+3 MnF3 K3[Mn(CN)6]Mn+4 MnO2 K2[MnF6] MnF4Mn+5 Na3MnO4Mn+6 MnO42-Mn+7 MnO4- MnO3F晶体结构:晶胞为体心立方晶胞,每个晶胞含有2个金属原子。
晶胞参数:a = 891.25 pmb = 891.25 pmc = 891.25 pmα = 90° β = 90°γ = 90°莫氏硬度:6电离能 (kJ /mol)M - M+ 717.4M+ - M2+ 1509.0M2+ - M3+ 3248.4M3+ - M4+ 4940M4+ - M5+ 6990M5+ - M6+ 9200锰(Mn)是几种酶系统包括锰特异性的糖基转移酶和磷酸烯醇丙锰砂酮酸羧激酶的一个成分,并为正常骨结构所必需.其摄入量差别很大,主要取决于是否食入含量丰富的食品,如非精制的谷类食物,绿叶蔬菜和茶.此微量元素的通常摄入量为每天2~5mg,吸收率为5%~10%.锰缺乏的人曾报道过1例:一位食用每天含0.1mg锰的纯化饮食者,出现短暂性皮炎,低胆固醇血症以及碱性磷酸酶水平增加.2周内他失去约60%其估计的体内锰池,但在另外4周的缺乏饮食期间未再进一步丢失.锰缺乏在临床文献中已有记载.锰中毒通常只限于采矿和精炼矿石的人,长期接触锰可引起类似帕金森综合征或Wilson病那样的神经症状.锰砂富锰的食品成年人每日锰供给量为每千克体重0.1毫克。
锰元素

若酸根有氧化性,盐类分解时 Mn(II)被氧化
Mn(NO3)2 —△— MnO2 + 2 NO2 Mn(ClO4)2 —△— MnO2 + Cl2 + 3 O2
Mn(II)在酸中稳定,遇强氧 化剂才能被氧化成 Mn(VII )
MnO4- + 8 H+ + 5 e- Mn2+ + 4 H2O E ⊖ = 1.51 V
Mn2+ + 2 CN-
M(n CN)2
Mn(CN)2 沉淀可以溶解在 过量的 KCN 溶液中,最终形 成稳定的正八面体配位单元 [Mn(CN)6]4-
加水稀释该溶液,当 CN- 的 浓度不足时,则有一些绿色沉淀物 K[Mn(CN)3] 生成。
将此稀氰化物溶液煮沸, 生成 Mn(OH)2 沉淀
在电炉中减压蒸馏,可将金 属锰分离出来。
纯的金属锰可以利用电解 MnSO4 的水溶液制取。
20. 8 Mn(II)化合物
MnO 是锰的氧化物中氧化数 最低的一种。
MnO 是绿色碱性氧化物,不 溶于水,可以溶于酸中。
用氢气还原锰的高氧化数氧化物, 均可得 MnO。
但是必须控制还原温度,若高于 1200℃ 则将生成金属锰。
[Mn(CN)6]4 - + 2 H2O 2 HCN + 4 CN- + Mn(OH)2
镍的同类配位化合物 [Mn(CN)6]4 - 比锰的稳定,用 上述方法可以分离镍和锰。
在热的较稀的 [Mn(CN)6]4- 溶液中加热硫化铵时,会生成 MnS 沉淀。
[Mn(CN)6]4- + S2-
6 CN- + MnS
20. 8. 1 难溶性化合物
化学教材关于锰的知识点

化学教材关于锰的知识点锰(Manganese)是一种重要的金属元素,在化学、材料科学和工业中都有广泛的应用。
本节将详细介绍锰的基本性质、存在形式、用途以及与其相关的化学反应。
一、锰的基本性质锰是一种坚硬、有光泽的过渡金属,其原子序数为25。
在常温下,锰可以抵抗空气和水,但在高温下,它会与氧、硫、氯等元素反应。
锰的化学性质较活泼,能与许多元素发生反应,形成化合物。
二、知识点锰及其化合物1、锰的单质金属锰: 银白色金属,粉末状的锰: 灰色。
锰是钢的一种重要添加剂,因为它能脱除氧和硫.2、锰的化合物(1)Mn(VII)化合物1)高锰酸钾的制备以软锰矿为原料 (MnO2) 制备高锰酸钾,先制K2MnO4:3 MnO2 + 6 KOH + KClO3 = 3 K2MnO4 + KCl + 3 H2O (碱熔法)从 K2MnO4 制 KMnO4 有三种方法。
A) 歧化法, 酸性介质中, 有利于歧化:3 MnO42- +4 H+ = MnO2 + 2 MnO4- + 2 H2O2 MnO42- + 2 CO2 = MnO2 + 2 MnO4- + 2 CO32-在中性或弱碱性溶液中也发生歧化反应,但趋势及速率小:3 MnO42- + 2 H2O = 2 MnO4- + MnO2 +4 OH-B) 氧化法:2 MnO42- + 2 Cl2 = 2 MnO4- + 2 Cl-C) 电解法: 电解 K2MnO4 溶液:阳极:MnO42-à MnO4- + e-阴极:2 H2O + 2 e-à H2 + 2 OH-电解总反应:2 K2MnO4 + 2 H2O = 2 KMnO4 + 2 KOH + H22) 高锰酸钾的强氧化性MnO4- + 5 Fe2+ + 8 H+ = Mn2+ + 5 Fe3+ + 4 H2O2 MnO4- + 5 H2C2O4 + 6 H+ = 2 Mn2+ + 10 CO2 + 8 H2OMnO4- + 4 Mn2+ + 15 H2P2O72- + 8 H+ =5 [Mn(H2P2O7)3]3- + 4 H2O 2 MnO4- + 5 SO32- + 6 H+ = 2 Mn2+ + 5 SO42- + 3 H2O2 MnO4- +3 SO32- + H2O = 2 MnO2 + 3 SO42- + 2 OH-2 MnO4- + SO32- + 2 OH-(浓) = 2 MnO42- + SO42- + H2O(2)Mn(IV)化合物二氧化锰在强酸中有氧化性(2) 还原性: 在碱中易被氧化成高价,生成MnO(OH)2. MnO(OH)2 (棕黄色)Mn2+ + 2 OH- = Mn(OH)2¯ (白) 无氧条件Mn(OH)2 + ½O2 = MnO(OH)2 (棕黄色)MnO(OH)2 + (x - 1) H2O = MnO2∙x H2O (黑褐色)Mn(OH)2 + 2 H+ = Mn2+ + 2 H2OMn(II) 在碱性条件下不稳定(还原性强)Mn(II)在酸性条件下稳定 (还原性差)在酸性溶液中,只有用强氧化剂,如NaBiO3、PbO2、(NH4)2S2O8 等,才能将 Mn2+ 氧化为呈现紫红色的高锰酸根(MnO4-)。
锰的简介

原 因
1 2
降低成本:锰的价格1.2万/吨,而镍的为12-13万/吨左右
真正的不锈钢成本太高大概1000元左右,普通消费者买不起
3
利用消费者对产品成分的不关注,进行不锈钢的虚假宣传
锰的生理功能
促进骨骼 的生长发育
保护细胞中 细粒体的完整
改善肌体 的造血功能
保持正常 的脑功能
维持正常的糖 代谢和脂肪代谢
锰的简介
基本性质:银白色金属,质坚而脆。密度7.44克/立方厘米。熔点
1244℃,沸点1962℃。化合价+2.+3.+4.+6和+ 7。
主要来源:重要的矿物是软锰矿、辉锰矿和褐锰矿等。可用铝热法还
原软锰矿制得。
主要用途:冶金工业中用来制造特种钢;钢铁生产上用锰铁合金作为
去硫剂和去氧剂。在实验室中二氧化锰常用作催化剂使用 。
测定方法
高碘酸钠氧化光度法
火焰原子吸收光谱法
锰的毒性
• 锰中毒通常只限于采矿和精炼矿石的人, 长期接触锰可引起类似帕金森综合征或 Wilson病那样的神经症状 。 • 但微量的锰同时也是正常机体必需的微量 无素之一,它构成体内若干种有重要生理 作用的酶,正常每天从食物中摄入锰3-9毫 克。
苏泊尔事件
苏泊尔质量门是指2011年10月有媒体爆出苏泊尔200元以下的产品全部存在 问题,哈尔滨市工商局道外分局的执法人员在检查中发现,大量“苏泊尔”不锈 钢器 皿不合格,存在锰含量超标、镍含量不达标的问题。
钢 铁 中 的 锰
锰在钢铁中的质量分数一般为 0.3~0.8%,超过0.8%的钢称为 锰合金钢。 国家标准中不锈钢的锰含量不 得超过2%,而事实上市场上的 不锈钢基本都达到了6~8%,有 的甚至超过10%,显然是合金 钢,但却打着不锈钢的旗号涌滴定法
锰 矿物质

虽然锰在工业和农业中具有广泛应用,但过量的锰会对环 境造成污染,影响生态平衡。因此,合理开发和利用锰资 源具有重要意义。
02
CATALOGUE
锰矿物质的分布与提取
世界范围内的锰矿分布
锰矿的地理分布
锰矿主要分布在世界的多个地区,包 括中国、南非、澳大利亚、加蓬等国 家。这些地区拥有丰富的锰矿资源, 对全球锰矿市场具有重要影响。
和技术手段。
02
环境保护与可持续发展
锰矿提取过程中产生的废水、废渣等废弃物对环境造成一定的影响。为
了实现可持续发展,需要采取环境保护措施,如废水处理、废渣综合利
用等,降低对环境的不良影响。
03
资源综合利用
提取锰矿后,剩余的矿石和废弃物中仍然含有一定的有价值的元素。综
合利用这些资源,回收其中的有用成分,可以提高资源的利用效率和经
尾矿与废石处理
尾矿和废石进行分类堆放,综合利用,减少占用土地,消除安全 隐患。
安全管理制度
建立健全安全管理体系,开展定期安全检查与培训,确保员工安 全意识得到提升。
锰矿产品的应用与市场反响
钢铁行业
锰矿是钢铁生产的重要原料,该锰矿产品在钢铁行业得到广泛应用 ,市场反响热烈。
电池行业
随着新能源汽车市场的崛起,锰矿作为电池正极材料的需求增加, 市场前景广阔。
亚洲地区,特别是中国和印度,是未来锰矿需求增长的主要市场。
锰矿产业的可持续发展策略
资源循环利用
推动锰矿尾矿、废石等资源的高效回 收和再利用,提高资源利用率。
环境保护
加强锰矿开采、加工过程中的环保措 施,减少对环境的影响。
社区与利益相关者参与
积极与矿区周边社区合作,改善当地 居民生活条件,确保锰矿产业的稳定 发展。
锰 化学元素

锰化学元素
锰,化学元素,元素符号Mn,原子序数25,单质是一种灰白色、硬脆、有光泽的过渡金属。
纯净的金属锰是比铁稍软的金属,含少量杂质的锰坚而脆,潮湿处会氧化。
锰广泛存在于自然界中,土壤中含锰0.25%,茶叶、小麦及硬壳果实含锰较多。
接触锰的作业有碎石、采矿、电焊、生产干电池、染料工业等。
1774年,甘恩分离出了金属锰。
柏格曼将它命名为manganese(锰)。
锰可用铝热法还原软锰矿制得。
物理性质:银白色金属,质坚而脆。
属于VIIB族元素。
密度7.44g/cm3。
熔点1244℃。
在固态状态时它以四种同素异形体存在α锰(体心立方),β锰(立方体),γ锰(面心立方),δ锰(体心立方)。
电离能为7.435eV。
化学性质:锰在元素周期表上位于第四周期,第VIIB族,属于比较活泼的金属,加热时能和氧气化合,易溶于稀酸生成二价锰盐。
1、化合价
锰的化合价有+2、+3、+4、+5、+6、+7、-1,-2,-3价。
其中以+2(Mn2+的化合物)、+4(二氧化锰,为天然矿物)和+7(高锰酸盐,如KMnO4)、+6(锰酸盐,如K2MnO4)为稳定的氧化态。
Mn2+较稳定,不容易被氧化,也不容易被还原。
K2MnO4和MnO2有强氧化性。
Mn(OH)2不稳定,易被空气中的氧气氧化为水合MnO2 [MnO (OH)2 ]即使是水中微量的溶解氧也能将其氧化;K2MnO4也能发生歧化反应,但反应不如在酸性溶液中进行得完全。
锰

锰银白色金属,质坚而脆。
密度7.20克/立方厘米。
熔点1244℃,沸点2097℃。
化合价+2、+3、+4、+6和+7。
其中以+2(Mn2+的化合物)、+4(二氧化锰,为天然矿物)和+7(高锰酸盐,如KMnO4)、+6(锰酸盐,如K2MnO4)为稳定的氧化态。
在固态状态时它以四种同素异形体存在,α锰(体心立方),β锰(立方体),γ锰(面心立方),δ锰(体心立方)。
电离能为7.435电子伏特。
在空气中易氧化,生成褐色的氧化物覆盖层。
它也易在升温时氧化。
氧化时形成层状氧化锈皮,最靠近金属的氧化层是MnO,而外层是Mn3O4。
在高于800℃的温度下氧化时,MnO的厚度逐渐增加,而Mn3O4层的厚度减少。
在800度以下出现第三种氧化层Mn2O2。
在约450℃以下最外面的第四层氧化物MnO2是稳定的。
能分解水,易溶于稀酸,并有氢气放出,生成二价锰离子。
锰和锰矿是有些极大的分别的。
锰的用途锰最重要的用途就是制造合金—锰钢锰钢:如果在钢中加入2.5—3.5%的锰,那么所制得的低锰钢简直脆得象玻璃一样,一敲就碎。
然而,如果加入13%以上的锰,制成高锰钢,那么就变得既坚硬又富有韧性。
高锰钢加热到淡橙色时,变得十分柔软,很易进行各种加工。
另外,它没有磁性,不会被磁铁所吸引。
现在,人们大量用锰钢制造钢磨、滚珠轴承、推土机与掘土机的铲斗等经常受磨的构件,以及铁锰锰轨、桥梁等。
上海新建的文化广场观众厅的屋顶,采用新颖的网架结构,用几千根锰钢钢管焊接而成。
在纵76米、横138米的扇形大厅里,中间没有一根柱子。
由于用锰钢作为结构材料,非常结实,而且用料比别的钢材省,平均每平方米的屋顶只用45公斤锰钢。
1973年兴健的上海体育馆(容纳一万八千人),也同样采用锰钢作为网架屋顶的结构材料。
在军事上,用高锰钢制造钢盔、坦克钢甲、穿甲弹的弹头等。
炼制锰钢时,是把含锰达60一70%的软锡矿和铁矿一起混合冶炼而成的。
除了锰钢外,锰钢也是重要的锰合金,锰钢含有30%的锰,具有很好的机械强度。
锰的介绍及作用

锰元素名称:锰元素原子量:54.94元素类型:金属发现人:甘恩发现年代:1774年发现过程:1774年,瑞典的甘恩,用软锰矿和木炭在坩埚中共热,发现一纽扣大的锰粒。
元素描述:银白色金属,质坚而脆。
密度7.20克/厘米3。
熔点1244+3r,沸点1962r。
化合价+2、+3、+4、+6和+7。
其中以+2 (Mn2+的化合物)、+4 (二氧化锰,为天然矿物)和+7 (高锰酸盐,如KMnO4)为稳定的氧化态。
在固态状态时它以四种同素异形体存在。
电离能为7.435电子伏特。
在空气中易氧化,生成褐色的氧化物覆盖层。
它也易在升温时氧化。
氧化时形成层状氧化锈皮,最靠近金属的氧化层是MnO,而外层是Mn3O4。
在高于800r的温度下氧化时,MnO的厚度逐渐增加,而Mn3O4层的厚度减少。
在800度以下出现第三种氧化层Mn2O2。
在约450r以下最外面的第四层氧化物MnO2是稳定的。
能分解水,易溶于稀酸,并有氢气放出,生成二价锰离子。
元素来源:重要的矿物是软锰矿、辉锰矿和褐锰矿等。
可用铝热法还原软锰矿制得。
元素用途:冶金工业中用来制造特种钢;钢铁生产上用锰铁合金作为去硫剂和去氧剂。
元素辅助资料:锰是在地壳中广泛分布的元素之一。
它的氧化物矿一软锰矿早为古代人们知悉和利用。
但是,一直到18世纪的70年代以前,西方化学家们仍认为软锰矿是含锡、锌和钻等的矿物。
18世纪后半叶,瑞典化学家T.O.柏格曼研究了软锰矿,认为它是一种新金属氧化物。
他曾试图分离出这个金属,却没有成功。
舍勒也同样没有从软锰矿中提取出金属,便求助于他的好友、柏格曼的助手一甘英。
在1774年,甘英分离出了金属锰。
柏格曼将它命名为managnese作孟)。
它的拉丁名称manganum和元素符号Mn由此而来。
锰(Manganese)硫酸锰(Manganese Sulfate)作用与应用:主要存在于垂体、肝胰脏和骨的粒线体中,为多种酶的组成部分。
锰参与体内的造血过程,促进细胞内脂肪的氧化作用,可防止动脉粥样硬化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(一) 含量、分布和营养作用
动物体内含锰低,大约0.2-0.3 mg/kg 。
骨、肝、肾、胰腺含量较高,约1-3 mg/kg ,肌肉中含量较低,约0.1-0.2 mg/kg 。
骨中锰占总体锰量的25%,主要沉积在骨的无机物中,有机基质中含少量。
锰的主要营养生理作用是在碳水化合物、脂类、蛋白质和胆固醇代谢中作为酶活化因子或组成部分。
此外,锰是维持大脑正常代谢功能必不可少的物质。
(二)吸收代谢
消化道吸收细胞都能吸收锰,但主要在十二指肠。
锰的吸收率为5-10%。
影响锰吸收的因素很多。
饲粮锰浓度低、吸收部位存在低分子配位体、动物处于妊娠期以及鸡患球虫病时,可提高锰的吸收率;饲粮中高铁、钙和磷降低锰的吸收;锰的来源对吸收影响较大,鸡对大豆饼、棉籽饼中的锰吸收70%左右,而对菜籽饼中的锰只能吸收50%左右。
进入吸收细胞内的锰以游离形式或与蛋白质结合形成复合物转运到肝。
氧化态锰与转铁蛋白结合后再进入循环,由肝外细胞摄取。
血浆中锰流动速度很快。
肝锰和血锰在激素控制下保持动态平衡。
动物动用体贮锰的能力较低。
锰代谢主要经胆汁和胰液从消化道排泄,经小肠粘膜上皮和肾排出一部分。
(三) 缺乏和过量
动物缺锰可导致采食量下降、生长减慢、饲料利用率降低、骨异常、共济失调和繁殖功能异常等。
骨异常是缺锰典型的表现。
禽类缺锰产生滑腱症(或叫骨短粗症)和软骨营养障碍。
滑腱症的主要表现为:胫骨和跖骨之间的关节肿大畸形,胫骨扭向弯曲,长骨增厚缩短,腓长肌腱滑出骨突,严重者不愿走动,不能站立,甚至死亡。
软骨营养障碍主要表现为:下颌骨缩短呈鹦鹉嘴,鸡胚的腿、翅缩短变粗,死亡率高。
猪缺锰产生骨异常的表现是脚跛、后踝关节肿大和腿弯曲缩短。
绵羊和小牛表现站立和行走困难、关节疼痛和不能保持平衡。
山羊出现跗骨小瘤,腿变形。
缺锰导致骨异常的原因主要是:不能使糖基转移酶活化而影响粘多糖和蛋白质合成,使钙化缺乏沉积基质,造成单位骨基质矿物质沉积过量,骨变粗短。
锰过量可引起动物生长受阻、贫血和胃肠道损害,有时出现神经症状。
禽对锰的耐受力最强,可高达2000 mg/kg,牛、羊可耐受1000 mg/kg,猪对锰敏感,只能耐受400 mg/kg。
各种动物耐受能力可能随锰的拮抗物含量增加而增大。
