高一化学金属及其化合物知识点总结
高一化学钠及其化合物笔记

高一化学钠及其化合物笔记
1.钠的基本性质:钠是一种银白色的金属,在空气中易氧化,与水反应产生氢气和氢氧化钠。
2. 钠的化合物:钠主要形成氯化钠、碳酸钠、硫酸钠等化合物。
3. 氯化钠:氯化钠是钠的最常见化合物,被广泛用于食品加工和腌制,也是制备其他钠化合物的重要原料。
4. 碳酸钠:碳酸钠是一种重要的工业原料,用于玻璃制造、纺织工业、造纸工业等。
5. 硫酸钠:硫酸钠是一种重要的化学原料,在制造洗涤剂、颜料、纤维素等方面具有广泛的应用。
6. 钠与生命:钠在人体中起着重要的作用,参与调节细胞内外液体的平衡,维持神经、肌肉等组织的正常功能。
7. 钠的危害:过量的摄入钠会引起高血压、心脏病等健康问题,需要合理控制钠的摄入量。
8. 钠的环境影响:含钠的废水对水生生物和水环境具有一定的危害,需要加强环保措施,减少钠的排放。
- 1 -。
高一化学金属及其化合物知识点总结

高一化学金属及其化合物知识点总结1.元素的存在形式有两种:游离态和化合态;1钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿;2铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石;2.金属单质的用途:1利用钠元素的特征焰色黄色制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛;2镁条燃烧发出耀眼的白光,用来做照明弹;3利用铝的良好导电性,做导线;利用铝块和铝粉的颜色都是银白色,铝粉制成银粉白色涂料;3.金属化合物的用途:1过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料;2氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器;3明矾做净水剂;4.金属的分类:1根据冶金工业标准分类:铁铬、锰为黑色金属,其余金属钠镁铝等为有色金属;2根据密度分类:密度大于cm3的金属是重金属:如铁、铜、铅、钡,密度小于cm3的金属是轻金属:如钠、镁、铝;5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物;1氧化物根据氧化物中非氧元素的种类分为金属氧化物和非金属氧化物;2金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物;3非金属氧化物分为酸性氧化物、不成盐氧化物;4氧化物根据氧化物是否与碱或酸反应生成盐分为成盐氧化物和不成盐氧化物CO 、NO;5成盐氧化物分为酸性氧化物、碱性氧化物、两性氧化物;6酸性氧化物分为高价态的金属氧化物Mn2O7和非金属氧化物CO2;7碱性氧化物只能是金属氧化物CaO;8两性氧化物只能是金属氧化物Al2O3、ZnO;6.金属氢氧化物的分类:碱性氢氧化物和两性氢氧化物;7.含金属阳离子的物质分为金属单质、金属氧化物、金属氢氧化物、金属无氧酸盐、金属含氧酸盐; 8.酸根离子分为三类:1含金属元素的含氧酸根离子AlO2-、MnO4-;2含非金属元素的含氧酸根离子NO3-;3含非金属元素的无氧酸根离子Cl-等;9.阳离子分类:1金属阳离子Na+和非金属阳离子H+、NH4+;2阳离子分单一价态阳离子Na+和变价态阳离子Fe2+、Fe3+,单一价态的阳离子和最高价态的阳离子只有氧化性,氧化性顺序:Ag+> Fe3+> Cu2+> H+;较低价态的金属离子既有氧化性又有还原性,遇到强氧化剂呈还原性,遇到强还原剂呈氧化性;10.温度不同产物不同的化学方程式:4Na+O2=2Na2O ; 2Na+O2=Na2O211.量不同产物不同的化学方程式:CO2+ NaOH = NaHCO3CO2+2NaOH =Na2CO3+ H2ONa2CO3+HCl =NaHCO3+NaClNa2CO3+2HCl=2NaCl + H2O+CO2↑NaHCO3+CaOH2=CaCO3+NaOH+H2O2NaHCO3+CaOH2=CaCO3↓+Na2CO3+ 2H2OAl2SO43+6NaOH=2AlOH3↓+3Na2SO4Al2SO43+8NaOH=2NaAlO2+3Na2SO4+4H2O2KAlSO42+3BaOH2=2AlOH3↓+3BaSO4↓+K2SO4KAlSO42+2BaOH2=2H2O+2BaSO4↓+KAlO212.物质既能跟强酸反应又能跟强碱反应的的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+6HCl=2AlCl3+3H2↑Al2O3+2NaOH=2NaAlO2+H2O Al2O3+6HCl=2AlCl3+3H2OAlOH3+NaOH=NaAlO2+2H2O AlOH3+3HCl=AlCl3+3H2ONaHCO3+ NaOH= Na2CO3+ H2O NaHCO3+ HCl = NaCl + H2O+CO2↑13.相互转化的化学方程式氧化还原反应实例:除去氯化铁中的氯化亚铁: 2FeCl2+Cl2=2FeCl3氧化还原反应实例:除去氯化亚铁中的氯化铁: 2FeCl3+Fe=3FeCl2酸碱性实例:除去碳酸氢钠中的碳酸钠: Na2CO3+CO2+H2O=2NaHCO3酸碱性实例:除去碳酸钠中的碳酸氢钠: NaHCO3+NaOH = Na2CO3+ H2O2NaHCO3= Na2CO3+CO2↑+H2O14.酸碱性强弱区别的化学方程式硫酸铝溶液中滴入过量的强碱溶液不再有沉淀:Al2SO43+8NaOH=2NaAlO2+3Na2SO4+4H2O离子方程式:Al3++4OH-= AlO2-+2H2O硫酸铝溶液中滴入过量的弱碱氨水溶液始终有沉淀:Al2SO43+6NH3·H2O=2AlOH3↓+3NH42SO4离子方程式:Al3++3 NH3·H2O =AlOH3↓+3NH4+15.互滴法鉴别无色试剂的实验组:碳酸钠溶液和盐酸,硫酸铝溶液和强碱,偏酸盐溶液和强酸16.Fe2+的检验:①取少量待测液于试管中,在试管中滴入可溶性碱溶液,先产生白色沉淀,过一会沉淀变成灰绿色,最终变成红褐色,说明溶液中有Fe2+ ;②取少量待测液于试管中,在试管中先滴入KSCN溶液,无现象,再滴入氯水,溶液马上变成血红色,说明溶液中有Fe2+ ;17.Fe3+的检验:①取少量待测液于试管中,滴入可溶性碱溶液,产生红褐色沉淀,说明溶液中有Fe3+ ;②取少量待测液于试管中,在试管中先滴入KSCN溶液,溶液马上变成血红色,说明溶液中有Fe3+ ; 18.指示剂颜色变化:①在盛有水的试管里,加入过氧化钠,然后滴入指示剂:酚酞先变红后褪色紫色石蕊先变蓝后褪色;②在盛有水的试管里,加入碳酸钠,然后滴入指示剂:酚酞变红紫色石蕊变蓝;③在盛有水的试管里,加入碳酸氢钠,然后滴入指示剂:酚酞变红紫色石蕊变蓝;19.氯化铁溶液可以止血,氯化铁溶液可以用来腐蚀电路板,饱和氯化铁溶液滴入沸水中可以制备氢氧化铁胶体,铝化铁溶液蒸干得到氢氧化铁,灼烧得到氧化铁;20.与Fe3+不能共存的离子有:①发生复分解反应的离子:OH-;②发生络合反应的离子:SCN-;③发生双水解反应的离子:CO32-、HCO3- ;④发生氧化还原反应的离子:S2-、I- ;21.与Al3+不能共存的离子有:①发生复分解反应的离子:OH-;②发生络合反应的离子:F-;③发生双水解反应的离子:CO32-、HCO3-、S2-、AlO- ;222.与H+不能共存的离子有:①发生复分解反应产生气体的离子:CO32-、HCO3-、S2-、HS-、S2O32- ;②发生复分解反应产生沉淀的离子:AlO2-、SiO32-、C6H5O-石炭酸根;③发生复分解反应没有任何现象的离子: OH-、F-、ClO-、PO43-、HPO42-、H2PO4-、CH3COO-、HC2O4-、C2O42- ;23.与OH-不能共存的离子有:①发生复分解反应产生气体的离子:NH4+ ;②发生复分解反应产生沉淀的离子:金属活动顺序表中镁以后的离子:Mg2+、 Al3+、Fe3+、Fe2+、Cu2+、Ag+ ;③发生复分解反应没有任何现象的离子: H+、HCO3-、HS-、HSO3-、HPO42-、H2PO4-、HC2O4- ; 24.易失电子的物质除了金属外,还含有强还原性的物质:H2S 、K2S 、HI 、KI;25.原子的最外层只有1个电子的元素有:1H ;2Na、 K 、Rb 、Cs ;3Cu 、Ag 、Au ;。
化学高一铁知识点

化学高一铁知识点铁是一种常见的金属元素,它在我们的日常生活中起着重要的作用。
本文将介绍高一化学中与铁相关的知识点,以帮助学生更好地理解和掌握这一主题。
一、铁的性质铁是一种具有磁性的金属元素,其化学符号为Fe(来自于拉丁语“ferrum”)。
它的原子序数为26,相对原子质量为55.845。
铁的外观呈现出银白色,并具有良好的导电和导热性。
此外,铁还具有较高的密度和延展性。
二、铁的同位素铁有多种同位素,其中最常见的是两种稳定同位素:铁-56和铁-54。
铁-56是最稳定的同位素,约占自然界铁的91.754%,而铁-54只占约5.845%。
三、铁的化合物1. 氧化物:铁可以形成多种氧化物,例如铁(II)氧化物(FeO)、铁(III)氧化物(Fe2O3)等。
其中,铁(II)氧化物是黑色固体,而铁(III)氧化物则呈红棕色。
2. 酸化物:铁也可以形成酸化物,如二氧化铁(FeO2)、三氧化二铁(Fe2O3)等。
3. 盐类:铁可以与不同的酸反应形成盐类。
例如,与硫酸反应可以得到硫酸亚铁(FeSO4)和硫酸铁(Fe2(SO4)3)。
四、铁的用途铁是一种重要的工业金属,广泛应用于建筑、交通运输、机械制造等领域。
以下是铁的几个主要用途:1. 制造钢铁:铁在制造钢铁过程中起着关键作用。
钢铁是一种含有较低碳量的铁合金,具有高强度和耐用性。
2. 建筑领域:铁及其合金被广泛用于建筑结构、桥梁和其他基础设施的建造。
3. 交通运输:铁和钢铁的轻便性和强度使其成为汽车、火车、飞机等交通工具的重要组成部分。
4. 电子产品:铁和钢铁在电子产品的制造中起着重要作用,如电脑、手机等设备。
5. 家居用品:铁和钢是制造家居用品的常见材料,如锅碗瓢盆、家具等。
五、铁的赋存形式在地球上,铁主要以氧化物、硫化物和碳酸盐的形式存在。
其中,铁矿石是最常见的铁资源,主要是铁的氧化物矿石,如铁磁铁矿、赤铁矿等。
六、铁与人类生活的关系铁在人类的历史和生活中扮演了重要的角色。
高一化学必修一第三章章节总结

学习笔记与氢氧化钠现象:产生白色沉淀,快速变成灰绿色,最终变成红褐色。
FeCl2+2NaOH==F e(O H)2↓+2NaCl4F e(O H)2+O2+2H2O==4F e(O H)3现象:产生红褐色沉淀FeCl3+3NaOH==F e(O H)3↓+ 3NaCl与KSCN溶液无现象产生血红色Fe3++3SCN-==Fe(SCN)3氧化(还原性)主要表现:还原性,举例:2FeCl2+Cl2 ==2FeCl3表现:氧化性,举例:2FeCl3+Fe==3FeCl2相互转化FeCl2FeCl3:2FeCl2+Cl2 ==2FeCl3FeCl3 FeCl2:2FeCl3+Fe==3FeCl2名称氢氧化亚铁氢氧化铁化学式F e(O H)2F e(O H)3颜色、状态白色固体红褐色固体水溶性难溶于水难溶于水与酸反应F e(O H)2+2HCl==FeCl2+2H2OF e(O H)2+2H+==Fe2++2H2OF e(O H)3+3HCl==FeCl3+3H2OF e(O H)3+3H+==Fe3++3H2O氢氧化亚铁露置空气中4F e(O H)2+O2+2H2O ==4F e(O H)33、铁三角二、本章典型题剖析1、滴加依次不同,试验现象不同(1)稀Na2CO3溶液与稀盐酸间的反应向Na2CO3溶液中逐滴加入稀盐酸,起先时无气体产生,达到肯定量后才有气泡冒出,由少到多的过程中依次发生下列反应:是NaOH。
若将1克该样品放入含有HCl 3.65克的盐酸中使其完全反应后,残酸再用50克2%的NaOH溶液恰好中和反应,蒸干溶液,所得固体的质量是多少克?解:所得固体是NaCl ,是5.85克[小结]本题数据众多,反应物不纯,过程困难。
若按常规方法,一步步分析计算,不但费时还易出错,若仔细分析就会发觉,最终所得固体物质NaCl中全部的Cl全来自于HCl中的Cl1、有5.1gMg–Al合金,投入500mL 2mol/L HCl中,金属完全溶解后,又加4mol/LNaOH 溶液VmL,得最多沉淀8.6g,则V等于A. 425mLB. 560mLC. 250mLD. 500mL2、铝三角转化及铝的图像问题(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消逝方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH― ==AlO2―+H2O图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消逝方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀渐渐溶解。
高一化学金属性知识点归纳

高一化学金属性知识点归纳金是一种珍贵的金属,具有许多特殊的化学性质和应用价值。
本文将归纳和总结高一化学中金属性的相关知识点,帮助读者更好地理解金的性质以及其在现实生活和工业中的应用。
1. 金的化学符号和性质- 化学符号:Au(来自于拉丁文“aurum”)- 颜色:金黄色- 密度和熔点:金的密度较高(19.3 g/cm³),熔点较高(约1,064°C)- 可锤打和拉伸性:金是一种非常韧性的金属,可以通过锤打和拉伸加工成各种形状和薄片2. 金的化学稳定性- 抗腐蚀性:金在常温下不与大多数酸、碱和氧气反应,具有较强的抗腐蚀性。
- 惰性金属:金被归类为惰性金属,因为它很少参与化学反应。
3. 金的氧化态和化合物- 氧化态:金主要存在于氧化态+1和+3。
其中氧化态+1较为稳定。
- 氧化物:金的氧化物主要有氧化亚金(Au2O)和三氧化二金(Au2O3)两种。
4. 金的溶解性和配合物形成- 溶解性:金在化学反应中一般不易溶解于水,但可以溶解于一些氰化物、氯化物和硫化物溶液中。
- 配合物形成:金离子常常参与配位键形成配合物,如著名的四氯金酸铵([AuCl4]-)。
5. 金的催化性质- 催化活性:金在催化反应中表现出惊人的活性和选择性,尤其在低温条件下具有较高的催化性能。
- 应用:金催化剂广泛应用于化学工业中的气体处理、有机合成和废气净化等领域。
6. 金的应用- 珠宝首饰:金作为贵金属,被广泛用于制作高档珠宝和首饰。
- 投资和储备:金作为一种稀有金属,被视为一种重要的投资和储备手段。
- 电子行业:金在电子行业中被广泛应用,如制作电路连接器、触摸屏和太阳能电池等。
7. 金的环境影响- 金矿开采:金的开采对环境可能造成影响,如土地破坏、水体污染和生态系统破坏等。
- 废弃物处理:金加工和使用产生的废弃物需要合理处理,以减少对环境的影响。
综上所述,金作为一种珍贵的金属,具有独特的化学性质和广泛的应用价值。
高一化学钠及其化合物知识点

高一化学钠及其化合物知识点
钠是一种金属元素,其原子序数为11,在自然界中分布
广泛,以Na的符号表示,是碱性元素。
钠的原子量为22.99,其原子半径为186pm,比重为0.97,是一种比较活泼的金属
元素,在室温下可以自由溶解于水中。
钠具有强烈的氧化性,能被酸中氧化,形成氢氧根NaOH,并可与碱性氧化物形成盐,如Na2O2、Na2O3等,还可与碳
酸根形成盐,如Na2CO3、NaHCO3等。
钠也可与氯形成盐,
如NaCl、Na2SO4、Na3PO4等。
钠也可用于制造一系列化学品,如钠碳酸、硫酸钠、纳酸、氢氧化钠、钠氯化物、钠磷酸等。
钠碳酸是一种重要的化学原料,主要用于制造洗涤剂、玻璃制造、纸制品的制造、染料的制造等。
硫酸钠常用于医药中,能促进消化,也可用于制造染料,是一种重要的化学原料。
纳酸是一种经济性很强的润滑剂,以其优良的润滑性、耐腐蚀性而著称,还可用于制造润滑油、清洗剂等。
氢氧化钠是一种常用的化学试剂,可用于各种化学实验,如pH测定、滴定等,也可用于制造水处理剂、调味品等。
钠
氯化物是一种重要的有机合成原料,常用于有机合成和染料制造中。
钠磷酸是一种重要的农药原料,可用于杀灭有害的昆虫、虫害等。
钠及其化合物的应用非常广泛,不仅在工业上有着重要的作用,而且在医药、农业、科学技术等领域也有重要的应用。
钠及其化合物的正确使用可以提高生产效率,改善生活质量,对人类健康和社会发展具有重要意义。
高一钠及其化合物的知识点总结

高一钠及其化合物的知识点总结钠(Na)是一种常见的金属元素,位于元素周期表的第11组。
下面是对高一学生有关钠及其化合物的一些重要知识点进行总结。
一、钠的性质和用途1. 物理性质:钠是一种银白色金属,具有良好的延展性和导电性。
在常温下是固态,但与空气中的氧气反应会产生氧化钠(Na2O)。
2. 化学性质:钠具有很强的活泼性,与水反应能剧烈放出氢气并产生碱性溶液氢氧化钠(NaOH)。
钠还能与非金属元素如氯气(Cl2)反应,生成氯化钠(NaCl)。
3. 用途:钠广泛应用于制备金属钠化合物、制造钠光谱灯、生产肥皂和纤维素等工业领域。
此外,氯化钠是重要的食盐,在生物体内发挥着平衡体液、调节神经传导等作用。
二、钠的离子化和原子结构1. 离子化:钠在化学反应中容易失去一个电子,形成带正电荷的钠离子(Na+)。
2. 原子结构:钠原子的电子结构为2-8-1,其中最外层的电子称为价电子,决定了钠的化学性质。
三、钠的化合物1. 氧化物:钠与氧反应形成多种氧化物,例如Na2O、Na2O2和NaO2。
这些氧化物常用于制备其他钠化合物。
2. 氯化物:氯化钠是钠的最常见化合物,具有广泛的应用,如食盐、制备其他氯化物等。
3. 氢氧化物:氢氧化钠(NaOH)是一种强碱,常用于化学实验和工业生产中。
4. 碳酸盐:碳酸钠(Na2CO3)在工业上被称为纯碱,常用于玻璃制造和水处理。
5. 硝酸盐:硝酸钠(NaNO3)在肥料生产和烟火制造中有重要作用。
四、钠的化学反应1. 与非金属元素反应:钠可以与氧、氯、溴和硫等非金属元素直接反应,生成相应的化合物。
2. 与水反应:钠与水反应会剧烈放出氢气,并且反应会放出大量热,形成氢氧化钠。
3. 与酸反应:钠可以与酸反应,产生盐和氢气。
4. 与氨反应:钠与氨气(NH3)在高温下反应,生成钠氨化合物(NaNH2)。
总结:钠是一种活泼的金属元素,具有很强的化学反应性。
它与氧、氢、氯和其他非金属元素反应,形成不同的化合物。
高一化学必修一《金属离子的性质及其化合物》知识点汇总

高一化学必修一《金属离子的性质及其化合物》知识点汇总本文档旨在汇总高一化学必修一课程中关于金属离子的性质及其化合物的知识点。
以下是相关的知识要点和内容:1. 金属离子的特性:- 金属离子指的是失去了一个或多个电子的金属原子,具有正电荷。
- 金属离子通常以离子的形式存在,可形成正离子。
- 金属离子在化学反应中常表现出良好的导电性、热导性和延展性等性质。
2. 金属离子的命名:- 金属离子的命名通常基于其离子的电荷数和原子或离子的名称。
- 单价阳离子(+1电荷)常以金属原子名称后加"离子"表示,例如:钠离子(Na+)、银离子(Ag+)。
- 多价阳离子(+2电荷以上)常在原子或离子名称后添加"(Ⅱ)"、"(Ⅲ)"等表示其电荷数的罗马数字,例如:亚铁离子(Fe2+)、亚铜离子(Cu2+)。
3. 金属离子的性质:- 金属离子常表现出良好的导电性和热导性。
- 金属离子具有良好的延展性和韧性,能够被轻松拉伸成细丝或打成薄片。
- 金属离子能够形成阳离子晶体,具有特殊的晶格结构。
4. 金属离子的化合物:- 金属离子与非金属元素或化合物进行化合反应,形成金属离子化合物。
- 金属离子化合物常采用化合物名称后加"化"表示,例如:氯化钠(NaCl)、硫酸铜(CuSO4)。
- 金属离子化合物的化学式中,正离子和负离子的电荷数必须互补。
以上是关于高一化学必修一《金属离子的性质及其化合物》的知识点汇总。
通过研究这些知识,我们可以更好地理解金属离子的性质和化学反应过程。
请在研究过程中多加实践和巩固,加深对这些知识的理解和掌握。
该文档为汇总文档,内容简洁明了,帮助读者快速了解相关知识。
如有任何补充或疑问,请咨询相关学术资源或教育机构。
高一化学必修一第三章知识点总结归纳

高一化学必修一第三章知识点总结归纳高一化学必修一(一)金属的化学性质一金属的通性1.金属的存在(1)金属元素的存在绝大多数金属以化合态的形式存在于自然界中,如Al、Fe等,极少数化学性质不活泼的金属以游离态的形式存在于自然界中,如Au。
在地壳中的含量较多的为O、Si、Al、Fe、Ca。
2.金属单质的物理通性①状态:常温下,大部分为固体,唯一呈液态的是汞。
②色泽:除Cu、Au外,大多数金属为银白色,有金属光泽。
③三性:良好的导电性、导热性、延展性。
3.单质的化学性质(1)与非金属的反应常温下,镁在空气中跟氧气反应,生成一层致密的氧化物薄膜,能够阻止内部金属继续被氧化。
镁在空气中燃烧,产生耀眼的白光,生成白色固体,反应的化学方程式为:2Mg+O2点燃=====2MgO。
镁还可以和氮气点燃,反应方程式为:3Mg+N2点燃=====Mg3N2。
(2)与酸的反应Fe与稀H2SO4反应的离子方程式:Fe+2H+===Fe2++H2↑。
(3)与盐溶液的反应Cu与AgNO3溶液反应的离子方程式:Cu+2Ag+===Cu2++2Ag。
归纳总结金属的通性(1)金属化学性质特点(2)金属还原性的强弱取决于其失去电子的难易程度,而不是失去电子个数的多少。
活学活用1.判断下列说法是否正确,正确的划“√”,错误的划“×”(1)金属具有良好的导热、导电性()(2)金属单质在氧化还原反应中总是作还原剂()(3)钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以铝比钠活泼()(4)金属在加热条件下均易与O2反应()答案(1)√(2)√(3)×(4)×解析(3)错误,金属的活泼性与原子失去电子个数无关,与失电子能力有关,钠比铝易失电子,钠比铝活泼;(4)错误,Au、Pt等金属不与O2反应。
二钠与氧气的反应按表中要求完成实验,并将观察到的实验现象及其原因解释填入表中。
[归纳总结]钠与氧气的反应(1)钠的性质及其保存钠是一种硬度小、熔点低的银白色的金属,具有金属光泽。
人教版高一化学必修一金属及其化合物知识点总结

第三章金属及其化合物第一节金属的化学性质一、钠及其化合物(一)钠Na1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。
2、单质钠的化学性质:①钠与O2反应常温下:4Na + O2=2Na2O (新切开的钠放在空气中容易变暗)加热时:2Na + O2==Na2O2(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na2O2。
)钠在空气中的变化过程:Na―→Na2O―→NaOH―→Na2CO3·10H2O(结晶)―→Na2CO3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3)。
②钠与H2O反应2Na+2H2O=2NaOH+H2↑离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
③钠与盐溶液反应如钠与CuSO4溶液反应,应该先是钠与H2O反应生成NaOH与H2,再和CuSO4溶液反应,有关化学方程式:2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=Cu(OH)2↓+Na2SO4总的方程式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应④钠与酸反应:2Na+2HCl=2NaCl+H2↑(反应剧烈)离子方程式:2Na+2H+=2Na++H2↑3、钠的存在:以化合态存在。
4、钠的保存:保存在煤油或石蜡中。
5、工业制钠:电解熔融的NaCl :2NaCl(熔融) 2Na + Cl 2↑6、钠的用途:① 在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;② 钠钾合金是快中子反应堆的热交换剂;③ 钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。
高一化学金属及其化合物反应方程式及现象总结
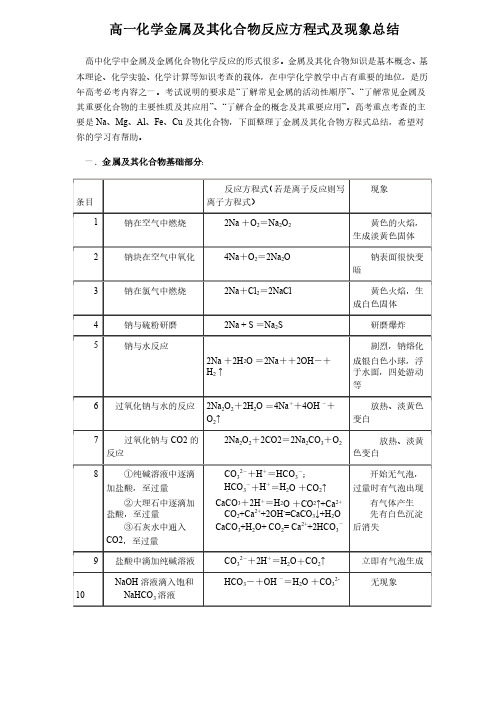
高一化学金属及其化合物反应方程式及现象总结高中化学中金属及金属化合物化学反应的形式很多。
金属及其化合物知识是基本概念、基本理论、化学实验、本理论、化学实验、化学计算等知识考查的载体,化学计算等知识考查的载体,化学计算等知识考查的载体,在中学化学教学中占有重要的地位,在中学化学教学中占有重要的地位,在中学化学教学中占有重要的地位,是历是历年高考必考内容之一。
考试说明的要求是“了解常见金属的活动性顺序”、“了解常见金属及其重要化合物的主要性质及其应用”、“了解合金的概念及其重要应用”。
高考重点考查的主要是Na 、Mg 、Al 、Fe 、Cu 及其化合物,下面整理了金属及其化合物方程式总结,希望对你的学习有帮助。
你的学习有帮助。
一.金属及其化合物基础部分: 条目条目反应方程式(若是离子反应则写离子方程式)离子方程式) 现象现象1 钠在空气中燃烧钠在空气中燃烧2Na +O 2=Na 2O 2黄色的火焰,生成淡黄色固体生成淡黄色固体 2 钠块在空气中氧化钠块在空气中氧化 4Na +O 2=2Na 2O钠表面很快变暗3 钠在氯气中燃烧钠在氯气中燃烧2Na +Cl 2=2NaCl黄色火焰,生成白色固体成白色固体 4 钠与硫粉研磨钠与硫粉研磨 2Na + S =Na 2S 研磨爆炸研磨爆炸 5 钠与水反应钠与水反应2Na +2H 2O =2Na ++2OH -+H 2 ↑剧烈,钠熔化成银白色小球,浮于水面,四处游动等6 过氧化钠与水的反应过氧化钠与水的反应 2Na 2O 2+2H 2O =4Na ++4OH -+O 2↑放热、淡黄色变白变白7 过氧化钠与CO2的反应反应 2Na 2O 2+2CO2=2Na 2CO 3+O 2 放热、淡黄色变白色变白 8 ①纯碱溶液中逐滴加盐酸,至过量加盐酸,至过量②大理石中逐滴加盐酸,至过量盐酸,至过量 ③石灰水中通入CO2,至过量,至过量CO 32-+H +=HCO 3-;HCO 3-+H +=H 2O +CO 2↑CaCO 3+2H +=H 2O +CO 2↑+Ca 2+ CO 2+Ca 2++2OH -=CaCO 3↓+H 2O CaCO 3+H 2O+ CO 2= Ca 2++2HCO 3-开始无气泡,过量时有气泡出现过量时有气泡出现有气体产生有气体产生先有白色沉淀后消失后消失9 盐酸中滴加纯碱溶液盐酸中滴加纯碱溶液 CO 32-+2H +=H 2O +CO 2↑立即有气泡生成立即有气泡生成10NaOH 溶液滴入饱和溶液滴入饱和 NaHCO 3溶液溶液HCO 3-+OH --=H 2O +CO 32- 无现象无现象11①NaOH 溶液中通入CO 2,至过量,至过量②饱和Na 2CO 3溶液中通入CO 2,至过量,至过量 CO 2+2OH-=CO32-+H 2O CO 32-+H 2O+ CO 2= 2HCO 3- Na 2CO 3+H 2O+ CO 2= 2NaHCO 3↓ 2Na ++CO 32-+H 2O+ CO 2= 2NaHCO 3↓ 有晶体析出有晶体析出12小苏打受热分解小苏打受热分解2NaHCO 3=Na 2CO 3+H 2O +CO 2 ↑ 分解,气体通入澄清石灰水变浑浊13 镁条投入沸水中镁条投入沸水中Mg+2H 2O(热水)==Mg(OH)2+H 2↑ 有酚酞的水变红 14 铝片与稀盐酸反应铝片与稀盐酸反应 Al 2O 3+6H+=2Al 3++3H 2O 2Al +6H +=2Al 3++3H 2↑片刻,有气泡产生产生15铝与氢氧化钠溶液反应反应Al 2O 3+2OH -=2AlO 2-+H 2O2Al +2OH -+2H 2O =2AlO 2-+3H 2↑片刻,有气泡产生产生16 氧化铝溶于盐酸溶液氧化铝溶于盐酸溶液 Al 2O 3+6H +==2Al 3++3H 2O 17 氧化铝溶于氢氧化钠溶液Al 2O 3+2OH -=2AlO 2-+H 2O18 硫酸铝溶液中滴过量氨水量氨水Al 3++3 NH 3·H 2O =Al(OH)3↓+3NH 4+有白色絮状沉淀有白色絮状沉淀19 氢氧化铝中加盐酸氢氧化铝中加盐酸 Al(OH)3+3H +=Al 3++3H 2O白色固体溶解白色固体溶解 20 Al(OH)3与NaOH 溶液反应液反应Al(OH)3+OH -=AlO 2-+2 H 2O 白色固体溶解白色固体溶解21 加热氢氧化铝加热氢氧化铝 2Al(OH)3 = Al 2O 3+3H 2O22铁在氯气中燃烧铁在氯气中燃烧2Fe +3Cl 2=3FeCl 3棕褐色的烟,溶于水成黄色溶液溶于水成黄色溶液 23 铜丝在氯气中燃烧铜丝在氯气中燃烧 Cu +Cl 2=CuCl 2棕黄色的烟,溶于水成蓝色溶液溶于水成蓝色溶液 24 铁与水蒸气反应铁与水蒸气反应3Fe +4H 2O (g)=Fe 3O 4+4H 2气体生成,点燃淡蓝色火焰燃淡蓝色火焰25 FeCl 3溶液中滴入氢氧化钠氧化钠Fe 3++3OH-=Fe (OH)3↓ 产生红褐色沉淀产生红褐色沉淀26 氢氧化亚铁放置在空气中空气中4Fe (OH)2+O 2+2H 2O =4Fe(OH)3 沉淀有白色变灰绿最后为红褐色灰绿最后为红褐色 27加热氢氧化铁加热氢氧化铁2Fe(OH)3=Fe 2O 3+3H 2O28 氧化铁溶于盐酸中氧化铁溶于盐酸中 Fe 2O 3 + 6H +==2Fe 3+ + 3H 2O 红色固体溶解,生成黄色溶液黄色溶液29 四氧化三铁溶于盐酸中酸中Fe 3O 4 + 8H +=Fe 2++2Fe 3+ +4H 2O黑色固体溶解生成黄绿色溶液黄绿色溶液30 氧化亚铁溶于盐酸中氧化亚铁溶于盐酸中 FeO+ 2H +==Fe 2++ H 2O 黑色固体溶,浅绿色黑色固体溶,浅绿色31 氯化亚铁溶液中通入氯气入氯气2 Fe 2++Cl 2=2 Fe 3++2Cl -浅绿色溶液变黄浅绿色溶液变黄32氯化亚铁溶液中加入酸性双氧水溶液入酸性双氧水溶液2 Fe 2++2H + + H 2O 2=2 Fe 3++2H 2O浅绿色溶液变黄色溶液溶液33 用KSCN 检验Fe 3+存在存在 Fe 3+ +3SCN -==Fe(SCN)3血红色溶液血红色溶液 34 氯化铁溶液中加入铁粉氯化铁溶液中加入铁粉 2Fe 3+++Fe =3Fe 2++黄色变浅绿色黄色变浅绿色35 氯化铁溶液中插入铜丝氯化铁溶液中插入铜丝 2Fe 3++Cu =2Fe 2++ Cu 2+ 黄色变蓝色黄色变蓝色36 CuO 溶于盐酸中溶于盐酸中CuO+2H +==Cu 2++H 2O黑色粉末溶,变蓝色变蓝色 37 硫酸铜与氢氧化钠溶液硫酸铜与氢氧化钠溶液 Cu 2++2OH- =Cu(OH)2↓ 蓝色沉淀蓝色沉淀38 氢氧化铜溶于盐酸中氢氧化铜溶于盐酸中 Cu(OH)2+ 2H +== Cu 2++ 2H 2O 蓝色沉淀溶,蓝色液蓝色液 39加热氢氧化铜加热氢氧化铜Cu(OH)2 =CuO+H 2O蓝色固体变黑色蓝色固体变黑色二.金属及其化合物提高部分:条目条目反应方程式反应方程式(若是离子反应写离子方(若是离子反应写离子方程式)程式)现象现象 40 钠投入硫酸铜溶液中溶液中2Na+2H 2O+Cu 2+ ===Cu(OH)2↓+2Na + +H 2↑剧烈,钠熔化成银白色小球,浮于水面,四处游动,有蓝色絮状沉淀生成沉淀生成41 NaAlO 2溶液中逐滴加入盐酸,至过量盐酸,至过量 AlO 2-+H ++H 2O===Al(OH)3↓Al(OH)3+3H +===Al 3++3H 2O 先有白色沉淀后又溶解溶解42 NaAlO 2溶液中通入过量液中通入过量 的CO 2AlO 2-+CO 2+2H 2O===Al(OH)3↓+HCO 3-白色沉淀生成,不溶白色沉淀生成,不溶43 氯化铝溶液中逐滴加入NaOH ,至过量至过量Al 3++3OH- ===Al(OH)3↓Al(OH)3+OH-== AlO 2-+2H 2O 先有白色沉淀后又溶解溶解44 Al 3+与AlO 2-溶液混合溶液混合 Al 3++3AlO 2- +6H 2O== 4A l(OH)3↓ 有白色絮状沉淀生成 45 氧化亚铁溶于稀硝酸中稀硝酸中 有NO 生成生成3FeO+10H+ +NO 3- = 3Fe 3+ + NO↑+5H 2O 黑色固体溶解生成气体,黄色溶液气体,黄色溶液46 四氧化三铁溶于氢碘酸铁溶于氢碘酸 Fe 3O 4+ 8H + + 2I - =3Fe 2+ + I 2 +4H 2O黑色固体溶解生成棕红色溶液棕红色溶液 47 酸性KMnO4溶液中加入溶液中加入氯化亚铁溶液氯化亚铁溶液5Fe 2+ +MnO 4- + 8H + = 5Fe 3+ + Mn 2++4H 2O紫色褪去变浅黄色紫色褪去变浅黄色48 FeCl 2溶液中加入稀HNO 3有NO 生成生成 3Fe 2++4H + +NO 3- = 3Fe 3+ + NO↑+2H 2O 生成气体,浅绿色溶液变黄色溶液溶液变黄色溶液49 氯化铁溶液中加入KI2Fe 3+ +2I- = 2Fe 2++ I 2 黄色溶液变棕色溶液黄色溶液变棕色溶液50 明矾溶液中滴加Ba(OH)2至SO 42-完全沉淀完全沉淀 Al 3++2SO 42-+2Ba 2++4OH-=2BaSO 4↓ +AlO 2-+2H 2O有白色沉淀生成有白色沉淀生成51 明矾溶液中滴加Ba(OH)2至Al 3+完全沉淀完全沉淀 2Al 3++3SO 42-+3Ba 2++6OH-=3BaSO 4↓ +2Al(OH)3↓有白色沉淀生成有白色沉淀生成 52 向FeCl 2溶液中投入Na 2O 2固体固体2Na 2O 2+2H 2O=4Na ++ 4OH- +O 2↑4Fe 2++ O 2 + 8OH- +2H 2O= 4Fe(OH)3↓ 有无色气体放出,同时生成红褐色沉淀同时生成红褐色沉淀以上就是高一化学金属及其化合物反应方程式及现象总结,我们不仅要了解常见金属及其重要化合物的主要性质及其应用,更应当在化学学习中全面、正确地运用。
高一钠及其化合物的知识点汇总

高一钠及其化合物的知识点汇总高一化学学习的重要内容之一是对钠及其化合物的认识和理解。
钠是一种常见的金属元素,它在日常生活中广泛应用于食盐、肥皂等制作过程中。
本文将对高一钠及其化合物的相关知识点进行汇总和阐述,帮助读者更好地理解这些内容。
1.钠的物理性质钠是一种银白色的金属,具有良好的延展性和导电性。
它的熔点相对较低,在室温下也可变为液体。
钠的密度相对较小,能够在水中浮起。
在空气中,钠会迅速与氧气反应产生氧化钠。
2.钠的化学性质钠是一种活泼的金属,在水中和氧气中都能与之发生强烈的化学反应。
当钠与水反应时,生成氢气和氢氧化钠;当钠与氧气反应时,生成氧化钠。
钠还能与非金属元素如氯、溴等发生反应,生成相应的盐类。
3.钠的化合物钠氧化物(Na2O)是一种重要的钠化合物,它是无色晶体,可以溶于水生成氢氧化钠。
氢氧化钠(NaOH)是一种强碱,它在水中能够完全离解,产生氢氧根离子和钠离子。
氢氧化钠在日常生活中广泛应用于清洁、脱脂、制取肥皂等过程中。
4.钠的应用领域钠在冶金、化工、医药等领域都有广泛的应用。
在冶金方面,钠可以用作合金添加剂,提高金属的硬度和强度;在化工方面,钠可以用于制取肥皂、化学肥料和染料;在医药方面,钠离子在维持人体酸碱平衡、神经传导等方面起着重要作用。
5.钠的环境影响由于钠的活泼性和广泛应用,它也对环境产生一定的影响。
例如,过量的氢氧化钠排入水体中会导致水体碱化,影响水生生物的生存环境;大量的钠盐在农田灌溉中会影响土壤的肥力。
6.实验探究在学习钠及其化合物的过程中,学生们可以进行一些简单的实验来加深对相关知识的理解。
例如,可以观察将钠放入水中的反应过程,观察钠的活泼性和与水的反应产物;还可以制备氯化钠晶体,观察晶体结构和溶解特性等。
综上所述,高一钠及其化合物是化学学习中的重要内容。
通过对钠的物理性质、化学性质和应用领域的介绍,以及钠化合物的形成和性质的讲解,读者将对钠及其化合物有更深入的了解。
钠及化合物的知识点高一

钠及化合物的知识点高一钠及化合物的知识点钠是一种常见的金属元素,属于第一主族的元素,原子序数为11。
在自然界中存在于多种化合物中,如食盐、碱性岩石等。
钠及其化合物具有广泛的应用价值且具有重要的生物学意义。
下面将对钠及其化合物的知识点进行介绍。
1. 钠的物理性质钠是一种银白色金属,具有良好的延展性和导电性。
它的熔点较低,在室温下可柔软地切割成薄片。
钠具有较低的密度,可浮在水上并能与水剧烈反应,发生放热反应并产生氢气。
2. 钠的化学性质钠是一种高活性金属,在空气中容易与氧气反应生成氧化钠,因此要储存在有限的氧气环境中。
钠与水反应剧烈,产生强烈的碱性溶液和氢气。
它还与酸类反应生成相应的盐类。
3. 钠化合物的种类和性质钠形成多种化合物,主要包括氧化钠、氢氧化钠、氯化钠等。
3.1 氧化钠(Na2O)氧化钠是一种无色晶体,可溶于水并生成氢氧化钠。
它是一种强碱,可用于制备玻璃。
3.2 氢氧化钠(NaOH)氢氧化钠,也称为苛性钠或烧碱,是一种白色固体,是一种强碱。
它具有强腐蚀性,可用于清洁剂、制皂等工业用途。
3.3 氯化钠(NaCl)氯化钠是一种晶体盐,也是食盐的主要成分。
它是一种重要的矿物质,对维持人体的水平衡和神经传导起重要作用。
4. 钠的生物学意义钠是人体内的重要离子之一,对维持细胞的渗透压和神经传导起重要作用。
人体通过饮食摄入钠,而肾脏则通过排泄来控制钠的平衡。
然而,摄入过量的钠会增加血压,增加心脏病和中风的风险。
总结:钠及其化合物在我们的日常生活中有重要的应用,不仅在工业生产中发挥着关键作用,而且在生物体内对维持正常的生理功能至关重要。
了解钠及其化合物的性质和应用,有助于我们更好地理解化学现象和人体生理过程。
通过上述介绍,我们对钠及其化合物的基本知识有了初步的了解。
高一化学必修一 详解总结 元素化合物知识整合化合物知识点总结

化合物知识点总结一.金属钠(一)钠1.物性金属钠是一种柔软,银白色、有金属光泽的金属,是热和电的良导体;它的密度比水的密度小,比煤油的密度大,熔点为℃、沸点为℃2.化性(1)跟非金属反应:4Na+O2=2Na2O,(空气中钠的切面变暗 2Na+O2Na2O2(黄色火焰) Na2O2比Na2O 稳定 2Na+Cl2 NaCl(白烟) 钠与水反应:2Na+2H2O =2NaOH +H2↑现象:①浮:钠投入水中并浮在水面上②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。
③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失,④红:反应后的水溶液使酚酞变红。
钠与CuSO4溶液反应2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2↑3.钠的制取和存放(1)制备:2NaCl(熔融) 2Na+Cl2↑(2)钠的存放:少量金属钠可保存在煤油里。
(3)用途:强还原剂,工业用它还原金属钛、锆、铌等;如:4Na+TiCl4(熔融)=Ti+4NaCl,钠和钾的合金在常温下呈液态,是原子反应堆的导热剂;钠也可用于制高压钠灯(二).钠的化合物12.碳酸钠与碳酸氢钠3.氢氧化钠(NaOH)是常见的强碱,是一种白色片状晶体,。
极易溶于水(并放出大量热),易吸水而发生潮解,在空气中还易变质,反应为:2NaOH+CO2=Na2CO3+H2O。
俗名:苛性钠、烧碱、火碱,氢氧化钠有很强腐蚀性,具有碱的通性。
保存:密封保存。
试剂瓶不能用玻璃塞,应用橡皮塞。
因为烧碱能与玻璃成分中的SiO2发生反应:SiO2+2NaOH=Na2SiO3+H2O,生成的Na2SiO3使玻璃塞与瓶口粘结。
二、镁的性质(1)物理性质:镁是一种银白色金属,密度小,只有铝密度2/3,熔点较低,硬度较小,镁合金的强度高、机械性能好。
金属镁有“国防金属”的美誉。
在冶金工业上,金属镁常做脱氧剂和还原剂。
(2)化学性质(还原性)①与非金属单质反应 2Mg + O2点燃2MgO3Mg + N2点燃Mg3N2 Mg + Cl2点燃MgCl2②与酸反应与镁与非氧化性酸如稀硫酸、盐酸等反应生成氢气:Mg + 2H+=Mg2+ + H2↑与镁与氧化性酸,如浓硫酸、硝酸等反应,但不生成氢气:Mg + 2 H2SO4(浓) = MgSO4 + SO2↑+ 2H2O③与某些氧化物反应2Mg + CO2点燃2MgO + C现象:燃着的镁条在CO2中继续燃烧,发出耀眼的白光,生成白色固体,在集气瓶的内壁有黑色固体附着。
高一化学必修一《金属及其化合物》知识点汇总

高一化学必修一《金属及其化合物》知识点汇总高一化学必修一《金属及其化合物》知识点汇总本文主要介绍钠、铝、铁、铜等金属及其重要化合物的主要物理性质。
1.钠、铝、铁、铜在自然界中的存在形式钠元素的主要存在形式是氯化钠,铝元素的存在形式有铝土矿。
铁的存在形式是游离态的陨铁和化合态的铁矿石(黄铁矿、赤铁矿、磁铁矿),铜的存在形式是游离态的铜和黄铜矿、辉铜矿、赤铜矿和孔雀石。
2.钠、铝、铁、铜单质的物理性质钠、铝、铁单质是银白色金属,纯铜是紫红色金属。
粉末状的铝和铜颜色不变,粉末状的铁屑是黑色。
钠在空气中马上氧化成白色的氧化钠,最终氧化成碳酸钠。
冶金工业中铁属于黑色金属,钠、铝、铜属于有色金属。
钠的密度比水小,铝、铁、铜的密度比水大。
钠、铝的密度小于 4.5g/cm3是轻金属,铁、铜的密度大于4.5g/cm3是重金属。
钠的熔点低,钠与水反应产生的热量就可以使其熔化成小球;铝、铁、铜的熔点很高。
金属具有不透明、导电性、导热性、延展性等共性。
钠钾合金可以做原子反应堆的导热剂。
铝、铁、铜可以做导线。
金属的导电性顺序为Ag>Cu>Al。
铝的延展性可以制成包装用的铝箔。
铝、铁、铜可以制成各种等。
钠的硬度很小,可以用小刀切割;纯铝的硬度较小,铁和铜的硬度较大。
铁可以被磁化,而产生铁磁性。
3.钠、铝、铁、铜的重要化合物的物理性质氧化物的颜色:白色:Na2O、Al2O3;黑色:FeO、Fe3O4、CuO;淡黄色:Na2O2;红棕色:Fe2O3.氧化物的溶解性:Na2O、Na2O2溶于水生成强碱发生化学变化;Al2O3、FeO、Fe2O3、Fe3O4、CuO不溶水。
氢氧化物的颜色:白色:NaOH、Al(OH)3、Fe(OH)2;红褐色:Fe(OH)3;蓝色:Cu(OH)2.氢氧化物的溶解性:溶于水的:NaOH;不溶于水的:Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2;其中Fe(OH)2溶于水变色:先变成灰绿色,再变成红褐色Fe(OH)3.盐酸盐(金属在氯气中燃烧的产物)的颜色:白色:NaCl;棕红色:FeCl3;棕黄色:CuCl2.盐酸盐溶于水的颜色:无色:NaCl;黄色:FeCl3;蓝色:CuCl2.2Na+ + CuSO4 = Na2SO4 + Cu ↓;2Al+3CuSO4+6H2O=Al2(SO4)3+3Cu(OH)2+6H2O;3Fe+2CuSO4=Fe2(SO4)3+2Cu ↓。
2024年高一化学的知识点总结

①知反应方向就知道“一组强弱”
②金属或非金属单质越活泼对应的离子越不活泼(即金属离子氧化性越弱、非金属离子还原性越弱)
③浓度、温度、氧化或还原程度等也可以判断(越容易氧化或还原则对应能力越强)。
高一化学的知识点总结 6
对金属及其化合物知识可横向整理,即按金属单质、金属氧化物、氢氧化物、盐进行分块对比整理。
(2)跟非金属反应
H2+Cl2点燃或光照2HCl
点燃:发出苍白火焰,瓶口有白雾;光照:会发生爆炸
2P+3Cl2点燃2PCl3(雾,Cl2不足);2P+5Cl2点燃2PCl5(烟,Cl2充足)
(3)与水反应:Cl2+H2O=HCl+HClO(HClO是一种不稳定的弱酸,但具有强氧化性。)
a.氯水通常密封保存于棕色试剂瓶中(见光或受热易分解的物质均保存在棕色试剂瓶中)。
2失去电子(偏离电子)→化合价升高→被氧化→是还原剂;升价后生成氧化产物。还原剂具有还原性。
得到电子(偏向电子)→化合价降低→被还原→是氧化剂;降价后生成还原产物,氧化剂具有氧化性。
3常见氧化剂有:Cl2、O2、浓H2SO4、HNO3、KMnO4(H+)、H2O2、ClO-、FeCl3等,常见还原剂有:Al、Zn、Fe;C、H2、CO、SO2、H2S;SO32-、S2-、I-、Fe2+等
2、实验装置:根据反应原理和气体净化、收集、尾气处理等实验步骤及常见仪器的性能,制备干燥、纯净的Cl2。
高一化学的知识点总结 4
一、重点聚集
1.物质及其变化的分类
2.离子反应
3.氧化还原反应
4.分散系胶体
二、知识网络
1.物质及其变化的分类
化学金属细节知识点总结

化学金属细节知识点总结金属元素的特性1. 金属元素的晶体结构:金属元素通常具有紧密的结晶结构,其原子之间通过金属键相互连接。
金属键是一种特殊的化学键,是由金属原子之间的电子云共享形成的。
金属键的存在使得金属元素具有良好的导电性和导热性,因为电子在金属中可以自由流动。
2. 金属元素的物理性质:金属元素通常具有良好的延展性和韧性。
这是由于金属元素的结晶结构和金属键的存在使得金属元素可以在受力作用下发生塑性变形,而不易断裂。
此外,金属元素的延展性还使得金属可以被拉成细丝或者轧制成薄片。
3. 金属元素的化学性质:金属元素通常具有较强的还原性,能够失去电子形成阳离子。
此外,金属元素在化学反应中通常是电负性较低的,因此通常表现出氧化性。
金属元素的化学反应1. 金属的氧化反应:金属在空气中与氧气发生氧化反应,产生金属氧化物。
金属氧化物通常是碱性或者弱碱性的,可以与酸发生中和反应,生成盐和水。
2. 金属的酸反应:金属与酸发生反应,生成氢气和相应的盐。
3. 金属的碱反应:金属与碱发生反应,生成氢气和相应的盐。
4. 金属的还原反应:金属在一些化学反应中可以发生还原反应,失去电子形成阳离子。
例如,金属可以与一些金属离子发生置换反应,生成新的金属和金属离子。
金属元素的应用1. 电工材料:金属元素具有良好的导电性和导热性,因此广泛应用于电线、电缆、电路板等电器材料中。
2. 结构材料:金属元素通常具有较好的机械性能,因此广泛应用于建筑结构、汽车、航空航天器等领域。
3. 金属合金:金属元素可以与其他元素合金化,形成具有特定性能的金属合金。
金属合金具有较好的性能,广泛应用于各种领域。
4. 化学催化剂:一些金属元素及其化合物具有较好的催化活性,被广泛应用于化学反应中。
总之,金属元素是化学中重要的一类元素,具有独特的物理化学性质及广泛的应用价值。
对金属元素的深入了解不仅有助于深入理解化学原理,同时也能够为金属材料的应用提供理论指导。
高一上学期化学知识点总结人教版

高一上学期化学知识点总结人教版(实用版)编制人:______审核人:______审批人:______编制单位:______编制时间:__年__月__日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如教案大全、书信范文、述职报告、合同范本、工作总结、演讲稿、心得体会、作文大全、工作计划、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of practical materials for everyone, such as lesson plans, letter templates, job reports, contract templates, work summaries, speeches, reflections, essay summaries, work plans, and other materials. If you want to learn about different data formats and writing methods, please stay tuned!高一上学期化学知识点总结人教版本店铺为大家整理的,漫长的学习生涯中,大家对知识点应该都不陌生吧?知识点就是学习的重点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学金属及其化合物知识点总结
文档编制序号:[KKIDT-LLE0828-LLETD298-POI08]
高一化学金属及其化合物知识点总结
1.元素的存在形式有两种:游离态和化合态。
(1)钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。
(2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。
2.金属单质的用途:
(1)利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。
(2)镁条燃烧发出耀眼的白光,用来做照明弹。
(3)利用铝的良好导电性,做导线。
利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。
3.金属化合物的用途:
(1)过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。
(2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。
(3)明矾做净水剂。
4.金属的分类:
(1)根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。
(2)根据密度分类:密度大于cm3的金属是重金属:如铁、铜、铅、钡,密度小于cm3的金属是轻金属:如钠、镁、铝。
5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物。
(1)氧化物(根据氧化物中非氧元素的种类)分为金属氧化物和非金属氧化物。
(2)金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
(3)非金属氧化物分为酸性氧化物、不成盐氧化物。
(4)氧化物(根据氧化物是否与碱或酸反应生成盐)分为成盐氧化物和不成盐氧化物(CO 、NO)。
(5)成盐氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
(6)酸性氧化物分为高价态的金属氧化物(Mn2O7)和非金属氧化物(CO2)。
(7)碱性氧化物只能是金属氧化物(CaO)。
(8)两性氧化物只能是金属氧化物(Al2O3、ZnO)。
6.金属氢氧化物的分类:碱性氢氧化物和两性氢氧化物。
7.含金属阳离子的物质分为金属单质、金属氧化物、金属氢氧化物、金属无氧酸盐、金属含氧酸盐。
8.酸根离子分为三类:
(1)含金属元素的含氧酸根离子(AlO2-、MnO4-)。
(2)含非金属元素的含氧酸根离子(NO3-)。
(3)含非金属元素的无氧酸根离子(Cl-)等。
9.阳离子分类:
(1)金属阳离子(Na+)和非金属阳离子(H+、NH4+)。
(2)阳离子分单一价态阳离子(Na+)和变价态阳离子(Fe2+、Fe3+),单一价态的阳离子和最高价态的阳离子只有氧化性,氧化性顺序:Ag+> Fe3+> Cu2+> H+;较低价态的金属离子既有氧化性又有还原性,遇到强氧化剂呈还原性,遇到强还原剂呈氧化性。
10.温度不同产物不同的化学方程式:
4Na+O2=2Na2O ; 2Na+O2=Na2O2
11.量不同产物不同的化学方程式:
CO2+ NaOH = NaHCO3
CO2+2NaOH =Na2CO3+ H2O
Na2CO3+HCl =NaHCO3+NaCl
Na2CO3+2HCl=2NaCl + H2O+CO2↑
NaHCO3+Ca(OH)2=CaCO3+NaOH+H2O
2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+ 2H2O
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
Al2(SO4)3+8NaOH=2NaAlO2+3Na2SO4+4H2O
2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4
KAl(SO4)2+2Ba(OH)2=2H2O+2BaSO4↓+KAlO2
12.物质既能跟强酸反应又能跟强碱反应的的化学方程式:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+6HCl=2AlCl3+3H2↑
Al2O3+2NaOH=2NaAlO2+H2O Al2O3+6HCl=2AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+3HCl=AlCl3+3H2O
NaHCO3+ NaOH= Na2CO3+ H2O NaHCO3+ HCl = NaCl + H2O+CO2↑
13.相互转化的化学方程式
氧化还原反应实例:除去氯化铁中的氯化亚铁: 2FeCl2+Cl2=2FeCl3
氧化还原反应实例:除去氯化亚铁中的氯化铁: 2FeCl3+Fe=3FeCl2
酸碱性实例:除去碳酸氢钠中的碳酸钠: Na2CO3+CO2+H2O=2NaHCO3
酸碱性实例:除去碳酸钠中的碳酸氢钠: NaHCO3+NaOH = Na2CO3+ H2O
2NaHCO3= Na2CO3+CO2↑+H2O
14.酸碱性强弱区别的化学方程式
硫酸铝溶液中滴入过量的强碱溶液不再有沉淀:
Al2(SO4)3+8NaOH=2NaAlO2+3Na2SO4+4H2O
离子方程式:Al3++4OH-= AlO2-+2H2O
硫酸铝溶液中滴入过量的弱碱氨水溶液始终有沉淀:
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
离子方程式:Al3++3 NH3·H2O =Al(OH)3↓+3NH4+
15.互滴法鉴别无色试剂的实验组:碳酸钠溶液和盐酸,硫酸铝溶液和强碱,偏酸盐溶液和强酸16.Fe2+的检验:
①取少量待测液于试管中,在试管中滴入可溶性碱溶液,先产生白色沉淀,过一会沉淀变成灰绿色,最终变成红褐色,说明溶液中有Fe2+。
②取少量待测液于试管中,在试管中先滴入KSCN溶液,无现象,再滴入氯水,溶液马上变成血红色,说明溶液中有Fe2+。
17.Fe3+的检验:
①取少量待测液于试管中,滴入可溶性碱溶液,产生红褐色沉淀,说明溶液中有Fe3+。
②取少量待测液于试管中,在试管中先滴入KSCN溶液,溶液马上变成血红色,说明溶液中有Fe3+。
18.指示剂颜色变化:
①在盛有水的试管里,加入过氧化钠,然后滴入指示剂:酚酞先变红后褪色(紫色石蕊先变蓝后褪色)。
②在盛有水的试管里,加入碳酸钠,然后滴入指示剂:酚酞变红(紫色石蕊变蓝)。
③在盛有水的试管里,加入碳酸氢钠,然后滴入指示剂:酚酞变红(紫色石蕊变蓝)。
19.氯化铁溶液可以止血,氯化铁溶液可以用来腐蚀电路板,饱和氯化铁溶液滴入沸水中可以制备氢氧化铁胶体,铝化铁溶液蒸干得到氢氧化铁,灼烧得到氧化铁。
20.与Fe3+不能共存的离子有:
①发生复分解反应的离子:OH-。
②发生络合反应的离子:SCN-。
③发生双水解反应的离子:CO32-、HCO3-。
④发生氧化还原反应的离子:S2-、I-。
21.与Al3+不能共存的离子有:
①发生复分解反应的离子:OH-。
②发生络合反应的离子:F-。
③发生双水解反应的离子:CO32-、HCO3-、S2-、AlO2-。
22.与H+不能共存的离子有:
①发生复分解反应产生气体的离子:CO32-、HCO3-、(S2-、HS-、S2O32-)。
②发生复分解反应产生沉淀的离子:AlO2-、[SiO32-、C6H5O-(石炭酸根)]。
③发生复分解反应没有任何现象的离子: OH-、F-、ClO-、(PO43-、HPO42-、H2PO4-、
CH3COO-、HC2O4-、C2O42-)。
23.与OH-不能共存的离子有:
①发生复分解反应产生气体的离子:NH4+。
②发生复分解反应产生沉淀的离子:金属活动顺序表中镁以后的离子:Mg2+、 Al3+、Fe3+、Fe2+、Cu2+、Ag+。
③发生复分解反应没有任何现象的离子: H+、HCO3-、(HS-、HSO3-、HPO42-、H2PO4-、HC2O4-)。
24.易失电子的物质除了金属外,还含有强还原性的物质:H2S 、K2S 、HI 、KI。
25.原子的最外层只有1个电子的元素有:
(1)H 。
(2)Na、 K 、Rb 、Cs 。
(3)Cu 、Ag 、Au 。
