【课时讲练通】高中化学 1.2.1原子核外电子的排布 元素周期律课时提升卷 新人教版必修2
高中化学人教版必修2(练习)1.2.1 原子核外电子的排布元素周期律 Word版含解析 (2)

第1课时原子核外电子的排布元素周期律目标导航] 1.了解原子的核外电子能量高低与分层排布的关系。
2.了解核外电子分层排布的规律。
3.了解元素的原子结构和元素性质的周期性变化。
4.理解元素周期律的内容和实质。
一、原子核外电子的排布1.核外电子的分层排布在多电子的原子里,电子的能量并不相同。
能量低的,通常在离核近的区域运动;能量高的,通常在离核远的区域运动。
核外电子的分层运动,又叫核外电子的分层排布。
其关系如下:2.3.(1)原子(离子)结构的表示方法,如下所示:(2)原子结构示意图中,核内质子数等于核外电子数,而离子结构示意图中,二者则不相等。
如:Na+;Cl-。
阳离子:核外电子数小于核电荷数。
阴离子:核外电子数大于核电荷数。
点拨(1)电子层实质上是一个“区域”,或者说是一个“空间范围”,它与宏观上层的含义完全不同。
(2)核外电子排布的规律是互相联系的,不能孤立地理解。
如钙原子由于受最外层电子数不超过8个的限制。
其原子结构示意图为而不应该是。
议一议判断正误,正确的打“√”,错误的打“×”(1)锂的原子结构示意图是()(2)某原子M层电子数为L层电子数的4倍()(3)某离子M层和L层电子数均为K层的4倍()(4)离子的核电荷数一定等于其核外电子数()答案(1)×(2)×(3)√(4)×二、元素周期律1.原子结构的周期性变化(1)元素原子核外电子排布的周期性变化规律:随着原子序数的递增,元素原子的最外层电子排布呈现由1到8的周期性变化(第一周期除外)。
(2)元素原子半径的周期性变化规律:随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。
2.元素性质的周期性变化(1)元素主要化合价的周期性变化规律:随着原子序数的递增,元素的最高正化合价呈现+1→+7,最低负化合价呈现-4→-1的周期性变化。
点拨元素化合价的“三个二”(1)二“特殊”F无正价,O无最高正价。
课时作业8:1.2.1 原子核外电子的排布

第1课时原子核外电子的排布1.某元素的原子核外有3个电子层,最外层有4个电子,该原子核内的质子数为()A.14 B.15C.16 D.172.原子核外的M电子层和L电子层最多容纳的电子数的关系是()A.大于B.小于C.等于D.不能确定3.X原子L层上的电子数等于次外层上的电子数、电子层数,X是元素。
4.根据中学化学教材所附元素周期表判断,下列叙述不正确的是()A.K层电子数为奇数的所有元素所在族的序数与该元素原子的K层电子数相等B.L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等C.L层电子数为偶数的所有元素所在族的序数与该元素原子的L层电子数相等D.M层电子数为奇数的所有元素所在族的序数与该元素原子的M层电子数相等5.若a A n+与b B2-两种离子的核外电子层结构相同,则a的数值为()A.b+n+2B.b+n-2C.b-n-2D.b-n+26.某元素的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图为7.在离子化合物AB中,A离子和B离子的电子层结构相同,从原子的最外层电子数看A 比B少4,而次外层电子数A比B多6,则AB是()A.MgS B.KCl C.MgO D.CaO8.ⅡA、ⅡA主族金属元素的原子失去电子后,生成的阳离子的电子层结构( )A.与它同周期稀有气体元素原子的电子层结构相同B.与它上一周期稀有气体元素原子的电子层结构相同C.与它下一周期稀有气体元素原子的电子层结构相同D.以上说法都不全面9.核外电子层结构相同的一组粒子是()A.Mg2+、Al3+、Cl―、NeB.Na+、F―、S2―、ArC.K+、Ca2+、S2―、ArD.Mg2+、Na+、Cl―、S2―10.短周期中,原子的最外层电子数是次外层电子数2倍的是,3倍的是,4倍的是,1/2倍的是,1/4倍的是;原子最外层电子数等于次外层电子数的有;原子各电子层都满足2n2的有。
高中化学第一章物质的结构元素周期律原子核外电子的排布元素周期律课时提升卷新人教必修新人教必修

原子核外电子的排布元素周期律一、选择题(本题包括6小题,每小题5分,共30分)1.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )A.在自然界中只以化合态的形式存在B.单质常用作半导体材料和光导纤维C.最高价氧化物不与酸反应D.气态氢化物比甲烷稳定2.(2013·南京高一检测)根据下表信息,判断以下叙述正确的是( )部分短周期元素的原子半径及主要化合价A.R与T形成的化合物RT3中,各原子均满足8电子的稳定结构B.单质与稀盐酸反应产生氢气的剧烈程度为L<QC.M与T形成的化合物具有两性D.L2+与R2-的核外电子数相等3.(2013·山东高考)W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )A.X、Y、Z中最简单氢化物稳定性最弱的是YB.Z元素氧化物对应水化物的酸性一定强于YC.X元素形成的单核阴离子还原性大于YD.Z元素单质在化学反应中只表现氧化性4.(双选)如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )A.原子半径:Z>Y>XB.气态氢化物的稳定性:R>WC.WX3和水反应形成的化合物的是H2WO3D.Y和Z两者最高价氧化物对应的水化物能相互反应5.(2013·邢台高一检测)依据元素周期表及元素周期律,下列推断正确的是( )A.H3BO3的酸性比H2CO3的强B.Mg(OH)2的碱性比Be(OH)2的强C.HCl、HBr、HI的热稳定性逐渐增强D.若M+和R2-的核外电子层结构相同,则离子半径:M+>R2-6.(2013·福建师大附中高一检测)已知短周期元素的离子a A3+、b B+、c C2-、d D-都具有相同的电子层结构,则下列叙述中正确的是( )A.原子半径:A>B>D>CB.原子序数:d>c>b>aC.离子半径:C>D>B>AD.单质的还原性:A>B>D>C二、非选择题(本题包括2小题,共20分)7.(10分)(1)元素周期表前四周期元素中失电子能力最强的元素是(填元素符号,下同),得电子能力最强的元素是。
【课时讲练通】高中化学必修2配套课件:1.2.1原子核外电子的排布 元素周期律(人教版)

逐渐增强。
(2)最外层电子数相同(同主族)时,电子层数越多,原子半径 越大,原子核对最外层电子的引力越小,越易失电子,元素的
金属性越强,非金属性越弱。
短周期金属元素甲~戊在元素周期表中的相对位置如表所示, 下面判断正确的是( A.原子半径:丙<丁<戊 )
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
同主族(从上到下) 逐渐减弱 逐渐增强
非金属气 态氢化物
形成难易
稳定性
难 →易
逐渐增强 逐渐减弱 逐渐增强
易 →难
逐渐减弱 逐渐增强 逐渐减弱
元素金属性 元素非金属性
【规律方法】同周期、同主族元素原子结构及性质的递变规
律 (1)电子层数相同(同周期)时,核电荷数越大,原子核对外层 电子的引力越大,原子半径越小,失电子能力越弱,而得电子 能力越强,故随核电荷数的递增,金属性逐渐减弱,非金属性
外层不超过18个,倒数第三层不超过32个。
②元素周期律与元素性质 a.元素原子核外电子排布的周期性变化决定了元素性质的周
期性变化,也就是原子结构决定元素性质。
b.元素的性质一般指的是元素的金属性、非金属性、原子半 径、元素的主要化合价等,它们随原子序数的递增呈周期性变 化,注意一些特殊情况,如F无正价。
能量较低 能量较高
能量不同
(2)电子层及其与能量的关系。
电子层 序号(n) 电子层 符号 离核距 离远近 电子能 量高低
1
2
3
4
5
6
7
K __
L __
M __
N __
O
P
Q
2.核外电子的排布规律①:核外电子总是尽可能地先从内层排 起,当一层充满后再填充下一层。
最新人教版高中化学必修2练习:1.2.1原子核外电子的排布 元素周期律含答案

课时自测·基础达标1.下列微粒的结构示意图,表示正确的是 ( )【解析】选A。
B中微粒结构示意图表示的是Cl-而不是Cl,C中Ar的原子结构示意图应为,D中K的原子结构示意图应为。
【补偿训练】具有下列结构的原子,其元素一定属于ⅡA族的是( )A.最外层电子数与次外层电子数相等的原子B.K层电子数为M层电子数一半的原子C.最外层有2个电子的原子D.M层电子数等于其内层电子数之和的的原子【解析】选D。
若该元素位于ⅡA族,则其原子最外层电子数为2,A项中元素原子最外层电子数可能为2或8,B项中元素最外层电子数为4,C项中元素可能是He,位于0族。
D项中,元素有三个电子层,其最外层电子数一定为2。
2.(RJ·P19改编题)根据元素在周期表中的位置判断,下列正确的是( )A.金属性:Na>KB.非金属性:S>ClC.酸性:H3PO4>HNO3D.碱性:KOH>Mg(OH)2【解析】选D。
同主族自上而下金属性逐渐增强,A错误;同周期从左到右非金属性逐渐增强,同主族自下而上,最高价氧化物对应水化物的酸性逐渐增强,B、C错误;由同主族元素的最高价氧化物的水化物碱性递变规律可得:KOH>NaOH,由同周期元素的最高价氧化物的水化物碱性递变规律可得NaOH>Mg(OH)2,则碱性:KOH>Mg(OH)2,D正确。
【补偿训练】同周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是( )A.原子序数:X>Y>ZB.非金属性:X>Y>ZC.原子半径:X>Y>ZD.气态氢化物的稳定性:HX>H2Y>ZH3【解析】选C。
同周期元素由左向右元素的非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强。
已知最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则X、Y、Z三种元素由左向右的顺序为Z、Y、X。
课时作业15:1.2.1 原子核外电子的排布

第1课时原子核外电子的排布1.下列微粒中,与氩原子具有相同电子层结构的是()A.Na+B.Cl-C.D.Ne2.下列原子(离子)的结构示意图错误的是()①磷原子②碳原子③钠原子④氧离子A.①②B.②③C.③④D.①④3.下列粒子中,最外层与第一层的电子数之和等于次外层电子数的是()A.S B.MgC.Cl D.Be4.今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是()A.Si和Na B.B和HC.Cl和C D.C和Al5.下列各原子构成的单质中,肯定能与稀硫酸反应产生H2的是()A.原子核内没有中子B.M层有5个电子C.原子核外最外层电子数=电子层数D.N层上电子数与K层电子数相等,次外层有8个电子6.在原子的第n电子层中,当n为最外层时,最多容纳电子数与(n-1)层相同;当n为次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10,则n层是()A.N层B.M层C.L层D.K层7.X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍。
则X、Y、Z三种元素,可能的组合是()A.C、Si、Mg B.Li、C、MgC.C、Mg、Li D.C、O、Mg8.元素A原子最外层电子数是次外层3倍,元素B原子有三个电子层,且最外层电子数等于其电子层数,则A、B两元素组成的化合物的化学式为()A.A2B B.B2A3C.A3B2D.BA29.已知A、B、C、D是中学化学中常见的四种不同微粒。
它们之间存在如图中转化关系:(1)如果A、B、C、D均是10电子的微粒,请写出:A的化学式________;D的化学式________。
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出A与B在溶液中反应的离子方程式__________________________(合理即可)。
人教版高中化学必修二 1.2.1原子核外电子的排布 元素周期律课时提升卷含答案
课时提升卷(四)原子核外电子的排布元素周期律一、选择题(本题包括6小题,每小题5分,共30分)1.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )A.在自然界中只以化合态的形式存在B.单质常用作半导体材料和光导纤维C.最高价氧化物不与酸反应D.气态氢化物比甲烷稳定2.(2013·南京高一检测)根据下表信息,判断以下叙述正确的是( )部分短周期元素的原子半径及主要化合价元素代号L M Q R T原子半径/nm 0.160 0.143 0.112 0.102 0.066主要化合价+2 +3 +2 +6、-2 -2A.R与T形成的化合物RT3中,各原子均满足8电子的稳定结构B.单质与稀盐酸反应产生氢气的剧烈程度为L<QC.M与T形成的化合物具有两性D.L2+与R2-的核外电子数相等3.(2013·山东高考)W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )A.X、Y、Z中最简单氢化物稳定性最弱的是YB.Z元素氧化物对应水化物的酸性一定强于YC.X元素形成的单核阴离子还原性大于YD.Z元素单质在化学反应中只表现氧化性4.(双选)如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )A.原子半径:Z>Y>XB.气态氢化物的稳定性:R>WC.WX3和水反应形成的化合物的是H2WO3D.Y和Z两者最高价氧化物对应的水化物能相互反应5.(2013·邢台高一检测)依据元素周期表及元素周期律,下列推断正确的是( )A.H3BO3的酸性比H2CO3的强B.Mg(OH)2的碱性比Be(OH)2的强C.HCl、HBr、HI的热稳定性逐渐增强D.若M+和R2-的核外电子层结构相同,则离子半径:M+>R2-6.(2013·福建师大附中高一检测)已知短周期元素的离子a A3+、b B+、c C2-、d D-都具有相同的电子层结构,则下列叙述中正确的是( )A.原子半径:A>B>D>CB.原子序数:d>c>b>aC.离子半径:C>D>B>AD.单质的还原性:A>B>D>C二、非选择题(本题包括2小题,共20分)7.(10分)(1)元素周期表前四周期元素中失电子能力最强的元素是(填元素符号,下同),得电子能力最强的元素是。
年春高中化学 第一章 第二节 第1课时原子核外电子的排布 元素周期律课时提升卷

原子核外电子的排布元素周期律(30分钟50分)一、选择题(此题包括6小题,每题5分,共30分)1.(2021·江门高一检测)依照微粒结构示用意的特点,可把、、三种微粒归为一类,以下微粒中可归为此类的是( )A. B.C. D.2.除第1周期外,关于同周期主族元素的以下转变规律中正确的选项是( )A.从左到右,原子半径慢慢增大B.从左到右,元素原子的氧化性减弱,还原性增强C.从左到右,元素最高正价从+1递增到+7(O、F除外),负价由-4递变到-1D.从左到右,元素最高价氧化物对应的水化物的碱性增强,酸性减弱(O、F除外)3.以下粒子半径之比小于1的是( )(Na+)/r(Na) (Cl-)/r(Cl)(Na)/r(Mg) (Ca)/r(Mg)4.(2021·武汉高一检测)以下表达中正确的选项是( )A.两种微粒,假设核外电子排布完全相同,那么其化学性质必然相同B.具有相同电子数的两种微粒必然具有相同的化学性质C.两原子,若是核外电子排布相同,那么必然属于同种元素D.阴离子的核外电子排布必然与上一周期稀有气体元素原子的核外电子排布相同5.(双选)(2021·广东高考)如图是部份短周期元素化合价与原子序数的关系图,以下说法中正确的选项是( )A.原子半径:Z>Y>XB.气态氢化物的稳固性:R>W和水反映形成的化合物是离子化合物和Z二者最高价氧化物对应的水化物能彼此反映6.(能力挑战题)以下有关表达中正确的选项是( )A.元素的化学性质随着相对原子质量的递增而呈周期性转变B.元素周期律的实质是元素原子最外层电子数由1→8周期性转变C.半径由大到小、氧化性由弱到强的是K+、Mg2+、Al3+、H+,而还原性由弱到强的那么是I-、Br-、Cl-、F-D.某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢的质量分数为%,那么R的相对原子质量为28二、非选择题(此题包括2小题,共20分)7.(10分)(1)元素周期表前周围期元素中失电子能力最强的元素是(填元素符号,下同),得电子能力最强的元素是。
高中化学 课时作业4 1.2.1 原子核外电子的排布 元素周期律2高一2化学试题

煌敦市安放阳光实验学校课时作业4 原子核外电子的排布元素周期律一、选择题1.下图微粒的结构示意图,正确的是( )Mg2+ClA. B.Ar KC. D.【解析】B中微粒结构示意图是Cl-而不是Cl,C中Ar的原子结构示意图为,D中K的原子结构示意图为。
【答案】A2.根据下图微粒结构示意图的共同特征,可以把三种微粒、、归为一类,下列微粒中也可以归为这一类的是( )A. B.C. D.【答案】C3.原子核外任意电子层上所容纳电子的最大数目为2n2。
下列叙述不正确的是( )A.n只能取1时,对的元素最多有2种B.n=3时,该电子层上的电子数一是18C.n=3时,该电子层上的电子数可能是6D.n只能取2时,有关原子的核外有2个电子离原子核最近、能量最低【解析】A.n只能取1时,该电子层上的电子数是1或2,对的元素是氢或氦。
B.n=3时,该电子层上的电子数最多为18,也可能小于18。
C.n=3,且该电子层为最外层时,其中的电子数为6是合理的。
D.n只能取2时,有关原子的核外有K和L 2个电子层,K层有2个电子,这2个电子离原子核最近、能量最低。
【答案】B4.短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数于其L 层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )A.C>D>B>A B.D>B>A>CC.A>D>C>B D.B>A>C>D【解析】A元素原子的次外层电子数只能是2,最外层电子数是4,A的原子序数为6;B元素的内层电子总数只能是2,最外层电子数为6,B的原子序数为8;C元素原子有3个电子层,L层必有8个电子,M层有4个电子,C 的原子序数为14;D的阳离子与B的阴离子(即O2-)电子层结构相同,D为Na,原子序数为11;故原子序数:C>D>B>A。
2019-2020学年高三化学人教版必修2课时训练:1.2.1原子的核外电子排布 元素周期律

2019-2020学年人教版高中化学必修2课时练1.2.1原子的核外电子排布元素周期律1、某元素R最高价含氧酸的化学式为H a RO b,则其最低价气态氢化物中R元素的化合价是( )A. 2b-aB. a-2bC. 8+a-2bD. 2b-a-82、核电荷数为1~18的元素中,下列叙述正确的是( )A.最外层只有1个电子的元素一定是金属元素B.最外层只有2个电子的元素一定是金属元素C.原子核外各层电子数相等的元素不一定是金属元素D.核电荷数为17的元素容易获得1个电子3、根据下列原子结构示意图判断,化学性质最稳定的是( )A.B.C.D.4、原子结构决定了元素的性质,核外电子排布是原子结构的重要组成部分。
下列有关原子结构的描述肯定错误的是( )A.某原子K层上只有1个电子B.某原子M层上电子数为L层上电子数的4倍C.某离子M层上和L层上电子数均为K层上电子数的4倍D.某离子的核电荷数与最外层电子数相等5、短周期元素的离子A2+、B+、C3-、D-具有相同的电子层结构,则下列中正确的是()A.原子序数:D>C>B>A B.原子半径:B>A>C>DC.离子半径:C3->D->A2+>B+ D.氧化性:A2+>B+,还原性:C3-<D-6、某电荷数小于18的元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。
下列有关元素X的说法中,不正确的是( )A.元素X的原子核内质子数为(2a2-1)B.元素X形成的单质既能作氧化剂又能作还原剂C.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)D.由元素X形成的某些化合物,可能具有杀菌消毒的作用7、已知P、S、Cl、As、Br五种元素在元素周期表中的位置如图下列关系正确的是( )A.原子半径:As>Cl>PB.热稳定性:HCl>AsH>HBr3C.还原性:3-2--As>S>ClD.酸性:H AsO>H SO>H PO3424348、下列说法中正确的是( )A.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数B.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数C.最外层有2个电子的原子都是金属原子D.金属元素只有正价和零价,而非金属元素既有正价又有负价又有零价9、短周期元素X、Y、Z原子序数之和为36,X、Y在同一周期,X2+与Z2-具有相同的核外电子层结构。
【课时讲练通】高中化学 1.1.2元素的性质与原子结构课时提升卷 新人教版必修2

课时提升卷(二)元素的性质与原子结构一、选择题(本题包括6小题,每小题5分,共30分)1.(2013·南昌高一检测)下列各组比较不正确的是( )A.锂与水反应不如钠与水反应剧烈B.还原性:K>Na>Li,故钾可以从NaCl溶液中置换出金属钠C.熔、沸点:Li>Na>KD.碱性:LiOH<NaOH<KOH2.(2013·兰州高一检测)下列关于碱金属元素的原子结构和性质的叙述不正确的是( )A.碱金属元素原子的最外层都只有1个电子,在化学反应中容易失去B.碱金属单质都是强还原剂C.碱金属单质都能在氧气中燃烧生成过氧化物D.碱金属单质都能与水反应生成碱3.(2013·湖州高一检测)随着核电荷数的增多,卤族元素性质递变正确的是( )①单质颜色加深②单质沸点升高③单质氧化性增强④离子半径增大⑤气态氢化物稳定性增强⑥卤化氢水溶液的酸性增强A.①②③B.④⑤⑥C.①②④⑥D.①②③④⑤⑥4.(双选)下列事实不能说明X元素比Y元素的非金属性强的是( )A.与H2化合时X的单质比Y的单质容易B.X的单质与铁反应生成二价铁,Y的单质与铁反应生成三价铁C.X的单质可以把Y从其氢化物中置换出来D.X原子的最外层电子数比Y的多5.(2013·泰安高一检测)下列排列顺序正确的是( )①热稳定性:H2O>H2Se>H2S②还原性:HI>HBr>HCl③密度:Li>Na>K>Rb④酸性:HNO3>H2CO3>HClOA.①③B.①④C.②③D.②④6.借助碱金属和卤族元素的递变性分析下面的推断,其中正确的是( )A.已知Ca是第4周期、ⅡA族的元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱B.已知As是第4周期、ⅤA族的元素,故AsH3的稳定性比NH3的稳定性强C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈D.已知Cl的核电荷数比F的核电荷数大,故Cl的原子半径比F的原子半径大二、非选择题(本题包括2小题,共20分)7.(8分)四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
鲁科版高中化学选修一课时提升卷(二)1.1.2核外电子排布

温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
关闭Word文档返回原板块。
课时提升卷(二)核外电子排布(30分钟50分)一、选择题(本题包括6小题,每小题5分,共30分)1.(2013·武汉高一检测)下列原子(或离子)结构示意图正确的是( )A.钠离子:B.氧原子:C.氟离子:D.磷原子:2.(2013·淄博高一检测)用原子结构示意图可以方便简明地表示原子,如图是某元素的原子结构示意图,,下列说法正确的是( )A.第一层上有7个电子B.该元素为金属元素C.该原子核电荷数为17D.该原子易形成阳离子3.下列关于Fe、Fe2+、Fe3+的说法中,正确的是( )①它们的质子数不同②它们的核外电子排布不同③它们的最外层电子数不同④它们的相对原子质量相同⑤它们的化学性质相同⑥它们是同种元素A.①③⑤⑥B.②④⑤⑥C.②③④⑥D.①②③⑥4.下列离子中核外电子排布与氖原子不相同的是( )A.Cl-B.F-C.Al3+D.Na+5.(2013·宿迁高一检测)在原子的第n电子层中,当n为最外层时,最多容纳的电子数与(n-1)层相同;当n为次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10个。
则n层是( )A.N层B.M层C.L层D.K层6.(能力挑战题)原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。
下列有关X的说法中不正确的是( )A.X能形成化学式为X(OH)3的碱B.X能与某些金属元素形成化合物C.X原子的最外层电子数和核电荷数肯定为奇数D.X可能形成化学式为KXO3的盐二、非选择题(本题包括2小题,共20分)7.(10分)(2013·枣庄高一检测)某粒子的结构示意图如图所示:,试回答:(1)当m-n=2时,该粒子为(填“原子”“阳离子”或“阴离子”)。
课时作业10:1.2.1 原子核外电子的排布元素周期律

第二节元素周期律第1课时原子核外电子的排布元素周期律[基础过关]题组1原子核外电子的排布1.下列有关主族元素的说法中肯定错误的是()A.某原子K层上只有一个电子B.某原子M层上电子数为L层上电子数的4倍C.某离子M层上和L层上的电子数均为K层的4倍D.某离子的核电荷数与最外层电子数相等2.根据下图微粒结构示意图的共同特征,可以把三种微粒、、归为一类,下列微粒中也可以归为这一类的是()A. B. C. D.题组2元素周期律及其应用3.短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是()A.原子序数A>B B.电子总数A->B2+C.离子半径A->B2+D.原子半径A>B4.下图是部分短周期元素原子半径与原子序数的关系图。
则下列说法正确的是()A.Z、N两种元素的离子半径相比,前者较大B.X、N两种元素的气态氢化物的沸点相比,前者较低C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液5.运用元素周期律分析下面的推断,其中推断错误的是()A.氢氧化铍[Be(OH)2]的碱性比氢氧化镁弱B.砹(At)为有色固体,HAt不稳定C.硫酸锶(SrSO4)是难溶于水的白色固体D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体6.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n 均为正整数)()A.若R(OH)n为强碱,则W(OH)n+1也为强碱B.若H n XO m为强酸,则Y是活泼非金属元素C.若Y的最低化合价为-2,则Z的最高正化合价为+6 价D.若X的最高正化合价为+5价,则五种元素都是非金属元素题组3“位、构、性”关系考查7.A、B两种原子,A的M电子层比B的M电子层少3个电子,B的L电子层电子数恰为A的L电子层电子数的2倍。
A和B分别是()A.硅原子和钠原子B.硼原子和氦原子C.氯原子和碳原子D.碳原子和铝原子8.根据下表信息,判断以下叙述正确的是()部分短周期元素的原子半径及主要化合价A.22B.单质与稀盐酸反应的速率为L<QC.M与T形成的化合物具有两性D.L2+与R2-的核外电子数相等9.A、B、C为短周期元素,在周期表中所处的位置如图所示。
课时作业12:1.2.1 原子核外电子的排布

第1课时原子核外电子的排布一、选择题1.1~18号元素的离子中,原子核电荷数和离子最外层电子数相同的是()A.Cl-B.Na+C.O2-D.S2-2.某元素的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为()A.14B.15C.16D.173.元素X的原子获得3个电子或元素Y的原子失去2个电子后,它们的电子层排布与氖原子的电子层排布相同,X、Y两种元素的单质在高温下反应得到的化合物的化学式是()A.Y3X2B.X2Y3C.X3Y2D.Y2X34.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有()A.1对B.2对C.3对D.4对5.在第n电子层中,当它作为原子的最外电子层时,最多容纳的电子数与n-1层相同,当它作为原子的次外层时,其电子数比n+1层最多能多10个,则此电子层是()A.K层B.L层C.M层D.N层6.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的化学式不可能是()A.X2YZ4B.XYZ3C.X3YZ4D.X4Y2Z77.下列有关主族元素的说法中肯定错误的是()A.某原子K层上只有一个电子B.某原子M层上电子数为L层上电子数的4倍C.某离子M层上和L层上的电子数均为K层的4倍D.某离子的核电荷数与最外层电子数相等二、非选择题8.根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的一半:________。
(2)B元素原子的最外层电子数是次外层电子数的1.5倍:________。
(3)C元素的单质在常温下与水剧烈反应,产生的气体能使带火星的木条复燃:________。
(4)D元素的次外层电子数是最外层电子数的1/4:________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时提升卷(四)
原子核外电子的排布元素周期律
一、选择题(本题包括6小题,每小题5分,共30分)
1.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
A.在自然界中只以化合态的形式存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应
D.气态氢化物比甲烷稳定
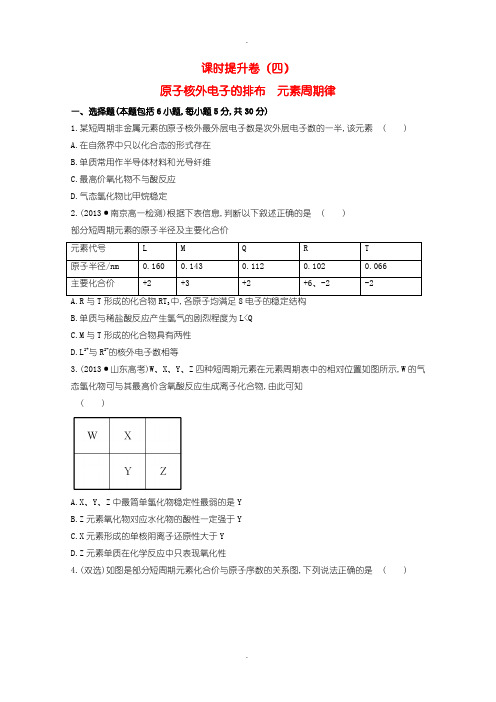
2.(2013·南京高一检测)根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
元素代号L M Q R T
原子半径/nm 0.160 0.143 0.112 0.102 0.066
主要化合价+2 +3 +2 +6、-2 -2
A.R与T形成的化合物RT3中,各原子均满足8电子的稳定结构
B.单质与稀盐酸反应产生氢气的剧烈程度为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
3.(2013·山东高考)W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
( )
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
4.(双选)如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物的是H2WO3
D.Y和Z两者最高价氧化物对应的水化物能相互反应
5.(2013·邢台高一检测)依据元素周期表及元素周期律,下列推断正确的是
( )
A.H3BO3的酸性比H2CO3的强
B.Mg(OH)2的碱性比Be(OH)2的强
C.HCl、HBr、HI的热稳定性逐渐增强
D.若M+和R2-的核外电子层结构相同,则离子半径:M+>R2-
6.(2013·福建师大附中高一检测)已知短周期元素的离子a A3+、b B+、c C2-、d D-都具有相同的电子层结构,则下列叙述中正确的是( )
A.原子半径:A>B>D>C
B.原子序数:d>c>b>a
C.离子半径:C>D>B>A
D.单质的还原性:A>B>D>C
二、非选择题(本题包括2小题,共20分)
7.(10分)(1)元素周期表前四周期元素中失电子能力最强的元素是(填元素符号,下同),得电子能力最强的元素是。
(2)短周期元素X、Y、Z在周期表中的位置关系如图所示,则
①Y、Z原子半径由大到小的顺序是____________________________(填元素符号)。
②Y、Z元素的气态氢化物的稳定性> (填化学式)。
③三种元素形成的单质中熔点最高的是(填化学式)。
8.(10分)四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
W X Y Z
结构或性质最高价氧化物
对应的水化物
与其气态氢化
物反应得到离
子化合物
焰色反应呈黄
色
在同周期主族元素
形成的简单离子中,
离子半径最小
最高正价与最
低负价之和为
零
(1)Z在元素周期表中位于族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是(填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据的是(填序号)。
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:______________________,
原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。
体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是。
答案解析
1.【解析】选A。
短周期元素原子核外最外层电子数是次外层电子数一半的元素有
Li:,Si:两种,故非金属元素为硅,硅为亲氧元素,在自然界中只以化合态形式存在,A正确;单质可用作半导体材料,而光导纤维的主要成分为SiO2,B错;最高价氧化物为SiO2,可与氢氟酸反应,C错;硅的非金属性比碳弱,故气态氢化物的稳定性SiH4<CH4,D错。
2.【解析】选C。
根据表中数据可知L为Mg,M为Al,Q为Be,R为S,T为O,SO3中硫原子不可能为8电子稳定结构,A错;Mg与稀盐酸反应比Be更剧烈,B错;Al与O形成的化合物Al2O3为两性氧化物,C正确;Mg2+核外电子数为10,而S2-核外电子数为18,D错。
3.【解析】选A。
W的气态氢化物可与其最高价含氧酸形成离子化合物,故其气态氢化物具有碱性,为NH3,故W为N,根据四种元素在周期表中的位置关系,可推知X为O,Y为S,Z为Cl。
四种元素的非金属性强弱顺序为S<Cl<N<O,元素非金属性越强,气态氢化物越稳定,故稳定性最弱的氢化物为H2S,A项正确;氯元素对应的氧化物的水化物有多种,如HClO、HClO4等,硫元素的氧化物的水化物也有多种,可能为H2SO4、H2SO3等,其酸性HClO4>H2SO4>H2SO3>HClO,B项错误;硫元素的非金属性小于氧元素,故还原性O2-<S2-,C项错误;Cl2中氯元素化合价为中间价态,可以表现出氧化性和还原性,D项错误。
4.【解析】选B、D。
同周期随着原子序数的递增,最高正化合价逐渐增大且等于原子的最外层电子数,但O、F没有最高正价。
从图示知,前4种元素属于第2周期,后7种元素属于第3周期,进而可知X为O,Y为Na,Z为Al,W为S,R为Cl。
原子半径:Na>Al>O, A错误;非金属性越强,对应气态氢化物就越稳定,所以HCl比H2S稳定,B正确;SO3和水反应形成的化合物是H2SO4,C 错误;Y和Z的最高价氧化物对应的水化物分别是NaOH和Al(OH)3,因Al(OH)3为两性氢氧化物,既能与酸反应又能与强碱溶液反应,D正确。
5.【解析】选B。
B、C位于同一周期,非金属性B<C,故酸性H3BO3<H2CO3,A错;Be、Mg位于同一主族,金属性Be<Mg,故最高价氧化物对应水化物的碱性Mg(OH)2>Be(OH)2,B正确;因为非金属性Cl>Br>I,故气态氢化物稳定性HCl>HBr>HI,C错;M+是M原子失去1个电子形成的,R2-由R原子得电子形成,二者核外电子层结构相同,故M+的核电荷数比R2-多,其离子半径M+<R2-,D错。
6.【解析】选C。
由题给信息可知四种元素在周期表中的相对位置为
,因均为短周期元素,故C、D为第2周期元素O、
F,A、B为第3周期元素Al、Na;其原子半径大小为Na>Al>O>F,A项错误;原子序数Al>Na>F>O,B 项错误;离子半径随核电荷数的增大而减小,O2->F->Na+>Al3+,C项正确;单质还原性Na>Al,F无正价,故F2无还原性,D项错误。
【答题技巧】相同电子层微粒的结构判断
(1)与对应原子相比,阳离子少一个电子层,阴离子电子层数不变,仅是得电子使最外层电子数达稳定结构。
(2)阳离子位于阴离子的下一周期且一般为金属元素,而阴离子位于阳离子的上一周期靠右,为非金属元素。
(3)与稀有气体具有相同电子层结构的微粒是同周期的阴离子和下一周期的阳离子。
7.【解析】(1)依据同周期、同主族元素的性质递变性可得出前四周期元素中失电子能力最强的元素为第4周期第ⅠA族的钾元素,得电子能力最强的元素是第2周期第ⅦA族的氟元素。
(2)依题意及题目所给的部分周期表知,X元素是He,Y元素是F,Z元素是S。
由同主族、同周期元素的递变性可知,①原子半径S>O>F;②气态氢化物的稳定性HF>H2O>H2S;③三种元素形成的单质中S单质常温下是固态,故它们中熔点最高的是S。
答案:(1)K F (2)①S、F ②HF H2S ③S
8.【解析】本题主要考查元素周期表及元素周期律的相关知识。
由信息可知W为N,X为Na,Y 为Al,Z为Si。
(2)NaOH能与HNO3、Al(OH)3、H2SiO3反应。
(3)①自然界中的含量与元素金属性的强弱没有必然联系,a错误;NaCl水溶液呈中性,AlCl3溶液显酸性,说明Al(OH)3是弱碱,NaOH是强碱,元素的金属性越强,其最高价氧化物对应的水化物的碱性越强,b正确;单质越活泼,越易与水反应,元素的金属性越强,c正确;单质与酸反应时失电子数的多少与单质还原性强弱无关,d错误。
②同周期元素,电子层数相同,原子序数越大,原子半径越小。
(4)HW3为HN3,酸性与醋酸相似,故NaOH可与HN3发生中和反应生成盐NaN3和H2O。
答案:(1)ⅣA (2)Na
(3)①b、c ②电子层数相同,原子序数Y>X
(4)HN3+NaOH====NaN3+H2O。
