第6章醇和酚学生学习指导
醇和酚教学文档
1.醇的分类和命名
2.饱和一元醇的命名
三.乙醇
1.乙醇的组成和结构.
分子式C2H6O 结构式 结构简式CH3。
3.化学性质
(1)取代反应
a.乙醇与金属钠(活泼金属)反应. 2CH3CH2OH+ 2Na 2CH3CH2ONa + H2↑
3)写名称:取代基位置——取代基名称
——羟基位置——母体名称(羟基位置用阿拉伯数字表示:羟基的个数用“二”或“三”表示)
【练习】写出下列醇的名称
CH3CH(OH)CH3CH2(OH)CH2(OH)
CH3CH2CH2CH2CH2OH
【讲解】醇的结构对醇的物理性质也产生了影响。
1、沸点:饱和一元醇的沸点比与其相对分子质量接近的烷烃或烯烃的沸点高。
饱和一元醇通式CnH2n+1OH 或CnH2n+2O
【介绍】
乙二醇和丙三醇都是无色、粘稠、有甜味的液体,都易溶于水,和乙醇都是重要的化工原料。乙二醇可用于汽车做防冻剂,丙三醇可用于配制化妆品、
引导学生阅读教材,了解醇的命名规律。
【板书】
2.饱和一元醇的命名
1)选主链:选最长碳链,且含有羟基。
2)编号:从离羟基最近的一端起编。
②.分子间脱水(取代反应).
乙醇的脱水反应随反应条件(温度)不同,脱水的方式不同,产物也不同,因此,可以根据物质的化学性质,按照实际需要,控制反应条件,使反应朝我们需要的方向进行.
(4)乙醇的催化氧化.
将铜丝在酒精灯上烧红后(表面氧化),插入试管中的乙醇溶液.
现象:铜丝表面变红,产生刺激性气味的气体.
联系烃的名命名规则,有相似,也有不同,强调选择主链和编号。
通过对比,让学生印象深刻
第六章 醇、酚、醚习题解答

第六章醇、酚、醚一、学习要求1.掌握醇、酚、醚的结构和命名。
2.掌握醇、酚、醚的主要化学性质和醇的重要的物理性质。
3.了解硫醇、硫醚和冠醚的结构、命名、性质及其重要用途。
二、本章要点醇、酚、醚是三类重要的有机化合物,有的在医药上用作消毒剂、麻醉剂、溶剂,有的是有机合成的常用原料。
(一)醇1.结构醇分子中的羟基氧为不等性sp3杂化,其中2个杂化轨道被2对未成键电子占据,另2个杂化轨道分别与α- C的sp3杂化轨道和氢原子的S轨道形成σ键。
由于氧的电负性大,故羟基氧电子云密度大,氢电子云密度小,因此氢氧键极性较大。
2. 命名醇的普通命名是在“醇”前加上烃基名称,并省去“基”字。
醇的系统命名原则是:(1)选择含有羟基的最长碳链作为主链,称为“某醇”,并使羟基相连的碳原子编号最小,将羟基位次写在“某醇”之前,其余的原则与烷烃相同。
(2)多元醇,应选择含羟基数目最多的最长碳链作主链,按羟基数目的多少称为“某二醇”、“某三醇”等。
(3)不饱和一元醇:选择既含羟基又含不饱和键数目最多的最长碳链作主链,编号时应使羟基位次最小,根据主链碳原子数称为“某烯(炔)醇”,并在“烯(炔)”、“醇”前面标明不饱和键和羟基的位次。
(4)命名芳香醇时,将芳环作为取代基,以侧链脂肪醇为母体。
(5)脂环醇,根据脂环烃基的名称,称为“环某醇”,从羟基所连接的碳原子开始,按“取代基位次之和最小”的原则给环碳原子编号,将取代基的位次、数目、名称依次写在“环某醇”的名称之前。
3. 性质(1)重要物理性质:由于醇可形成分子间氢键,故低级醇的沸点通常比相对分子质量相近的烷烃高得多。
随着醇中烷基的增大,醇羟基与水形成氢键的能力逐渐减弱,因此低级醇易溶于水,中级醇部分溶于水,高级醇则不溶于水。
(2)主要化学性质:①醇与活泼金属(如Na、K、Mg、Al等)反应,生成相应的醇盐,并放出氢气。
醇与活泼金属的反应速率顺序为:1)低级醇>中级醇>高级醇;2)甲醇>伯醇>仲醇>叔醇②醇可以与氢卤酸、卤化磷及氯化亚砜等发生亲核取代反应。
第6章 醇酚醚课后习题答案
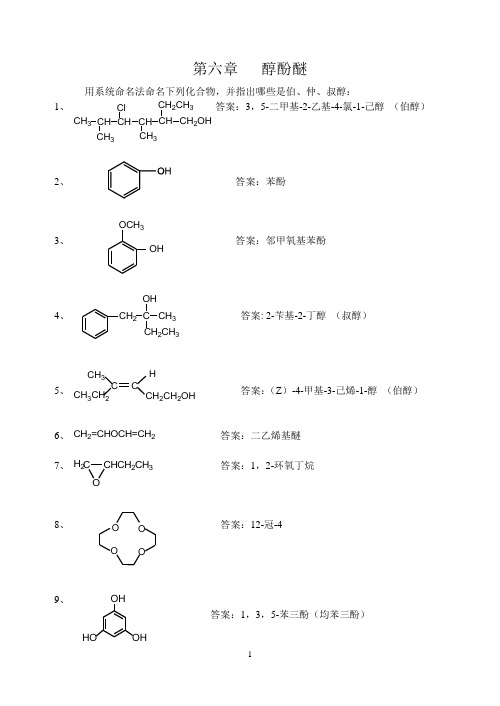
答案:对甲基苯酚
二、写出下列化合物的构造式:
1、异丙醇
答案:
2、甘油
答案:
3、苦味酸
答案:
CH3 -CH-OH CH3
CH2OH CHOH
CH2OH
O2N
OH NO2
4、邻甲苯酚 5、苯甲醚(茴香醚)
答案: 答案:
NO2 OH
CH3
OCH3
6、仲丁醇 7、对苯醌 8、二苯甲醇
答案: 答案:
答案:
OH
OH 8、
Br2 (H2O) ?
答案: Br
OH Br
Br
5
9、 答案:
CH=CHCH2OH
Sarret ?
CH=CHCHO
10、
PCC CH3(CH2) 2CH2OH
CH2Cl2
答案:
11、
OCH3 + (CH3)2CHCH2Cl
AlCl3 110oC
答案:
OCH3
七、用反应式表示环戊醇与下列试剂的反应:
合物(C)C3H6,(C)与浓 HBr 反应得(D)C3H7Br,(D)是(B)的异构体。试推断(A)、
(B)、(C)、(D)的结构,并写出各步反应式。
答案:CH3CH2CH2OH HBr (A)
浓H2SO4
CH3CH2CH2Br (B)
HBr CH3CH=CH2
CH3CHCH3 Br
(C)
(D)
十二、某物质(A)C5H12O 与金属钠反应放出 H2。(A)与浓 H2SO4 共热得烯烃(B)C5H10。
2、它们与金属钠的反应速率有何差异? 答案:与金属钠反应速率:异丁醇>仲丁醇>叔丁醇
3、在实验室里用何试剂鉴别它们?
高中化学醇酚教案

高中化学醇酚教案
主题:醇和酚
一、教学目标
1. 了解醇和酚的基本概念和区别。
2. 理解醇和酚在化学反应中的特性和应用。
3. 掌握醇和酚的物理性质和化学性质。
4. 能够识别和区分不同的醇和酚。
二、教学内容
1. 醇和酚的结构和命名。
2. 醇和酚的物理性质。
3. 醇和酚的化学性质。
4. 醇和酚的应用。
三、教学步骤
1. 引入:通过实验展示几种醇和酚的物理性质,引起学生对醇和酚的兴趣。
2. 讲解醇和酚的结构和命名规则。
3. 探讨醇和酚的物理性质,如沸点、溶解性等。
4. 分析醇和酚的化学性质,包括醇的氧化反应和酚的取代反应等。
5. 展示醇和酚在生活中的应用,如醇的用途和酚的杀菌作用。
6. 进行实验:让学生进行几种简单的醇和酚的化学反应实验,加深他们对醇和酚的理解。
四、课堂练习
1. 下列物质中哪些是醇,哪些是酚?
A. 乙醇
B. 苯酚
C. 丙烯
D. 丙醇
2. 下列物质中哪种具有羟基官能团?
A. 乙烯
B. 乙醇
C. 丙烷
D. 苯酚
3. 乙醇和苯酚的沸点分别是多少?哪个更容易挥发?
五、课堂讨论
1. 为什么醇和酚在化学反应中往往表现出不同的性质?
2. 请举例说明醇和酚在生活中的应用。
六、总结
通过本节课的学习,我们了解了醇和酚的基本概念和区别,掌握了它们的物理性质和化学性质,以及在生活中的应用。
希望同学们能够深入学习化学知识,提高对醇和酚的认识,并应用到实际生活中。
醇酚教案5篇

醇-酚教案5篇醇-酚教案篇1微格教学教案(10分钟)设计者:郭倩教学对象:高一学生科目:地理课题:地球自转与公转主要的教学技能:演示教学目标:认知目标:了解地球自转和公转的概念及方向、周期、速度、轨道灯方面的规律和特点;了解地球自转与公转的关系理解黄赤交角的形成及其导致的太阳直射点的回归运动规律。
技能目标:能够运用地球仪演示地球的自转和公转,能够读懂地球自转和公转的各种示意图,会画地球的自转和公转的方向,能够利用自转和公转相关学问解决实际应用问题。
情感态度与价值观:让学生树立正确的辩证唯物主义思想观,熟悉到一切物质处于运动状态,运动是肯定的静止是相对的,培育学生学科学、爱科学、用科学的兴趣。
教学重点:地球自转和公转的规律和特点;黄赤交角的形成,太阳直射点的回归运动规律教学难点:地球自转和公转空间概念的建立教学过程:醇-酚教案篇2活动目标:1、知道什么是猪流感,了解其危害性。
2、懂得怎样预防猪流感。
活动预备:图片,投影仪。
活动过程:一、利用投影仪请幼儿观看图片并提问:1、图片(一):图片上有谁?他头怎么了?2、图片(二):这个小朋友喉咙怎么了?3、图片(三):这个小朋友身体舒适吗?从哪里看出他很难过,他的表情怎样?(1)这种病叫什么病?教师小结什么是猪流感。
是一种由a型猪流感病毒引起的猪呼吸系统疾病,通常状况下很少感染,近年消失人感染猪流感病例。
二、了解猪流感的危害性。
提问:猪流感有什么危害?重者会继发肺炎和呼吸困难,甚至死亡。
三、怎样预防猪流感。
1、争论:怎样才能预防猪流感?小结:要养成良好的个人卫生习惯,常常使用肥皂和流水洗手,尤其是在咳嗽和打喷嚏后;要加强居室卫生,常开窗通风;尽量避开去人群拥挤、通风不畅的场所;避开接触流感样病症(发热、咳嗽、流涕)或肺炎等呼吸道病人。
2、学习儿歌《洗手五步歌》。
延长活动:请家长协作引导幼儿正确洗手,预防猪流感。
醇-酚教案篇3最小公倍数》这节课,如何让学生的学习的进取性较高,学问的把握也较为自然而扎实,学生的思维也在呈螺旋式上升趋势,取得了良好的教学效果。
2.2《醇和酚》教案2

《醇和酚》教案教学目标乙醇、苯酚的结构特点和主要化学性质。
教学重点、难点醇和酚结构的差别及其对化学性质的影响。
教学过程一、知识回顾1、溴乙烷制取乙烯的化学方程式2、溴乙烷制取乙醇的化学反应方程式二、醇酚概念醇:羟基与烃基或苯环侧链上的碳原子相连的化合物为醇。
(乙醇CH3CH2OH)酚:羟基与苯环直接相连而形成的化合物称为酚。
-OH)三、醇概念:羟基与烃基或苯环侧链上的碳原子相连的化合物为醇。
根据羟基的数目分:一元醇(含一个羟基如CH3CH2OH)、二元醇(含两个羟基例如乙二醇)、多元醇(两个以上的羟基例如丙三醇)物理性质:(1)低级饱和一元醇为无色透明的液体,往往有特殊气味,能与水混溶。
十二个碳原子以上的高级醇为蜡状固体,难溶于水。
饱和一元醇的比重都比分子量相近的烷烃大,但小于1,低级醇的熔点和沸点都比分子量相近的烷烃要高,含支链醇的沸点比同碳原子数的直链醇要低。
(2)醇的沸点比烷烃高得多,是因醇分子间能形成氢键。
羟基是极性很强的基团,在液体状态,醇分子间可通过氢键缔合在一起,而气体状态的醇是不缔合的。
要使液态醇变为蒸气,必须提供断氢键的能量,因此沸点升高。
(3)甲醇,乙醇,丙醇均可与水以任意的比例混溶,这是因为它们都能和水形成氢键。
氢键:醇分子中羟基的氧原子与另一个醇分子羟基的氢原子间存在着相互吸引的作用,这种吸引作用称为氢键。
重点:乙醇的化学性质:1、与金属钠的反应:2CH3CH2OH + 2Na = 2CH3CH2ONa + H2(现象:(1)钠下沉(钠的密度比乙醇的大)(2)有气泡出现,但无爆鸣声(有气体产生,虽然该气体为氢气,但由于被乙醇隔绝,不与空气接触,不与氧气反应,故没有爆鸣声,1mol乙醇中的1mol-OH羟基上的氢参加了反应)(3)反应结束后,试管壁变热,但钠不熔化(反应放热,但热量没达到钠的熔点,反应慢,放热,羟基上的氢不如水活泼)(4)反应结束后往试管滴加酚酞,溶液变红(证明反应生成碱性物质(乙醇钠))(因为在醇分子中,氧原子吸引电子的能力比氢原子和碳原子强,O-H键和C-O键的电子对都向氧原子偏移,因而醇在起反应时,O-H键容易断裂,氢原子可被取代)(1)消去反应:乙醇在浓硫酸的作用下,加热到170度时生成乙烯。
大学有机化学醇酚醚教案

一、教学目标1. 知识目标:(1)掌握醇、酚、醚的分类、命名、结构和性质;(2)了解醇、酚、醚的化学性质及反应条件;(3)熟悉醇、酚、醚的制备方法及在有机合成中的应用。
2. 能力目标:(1)培养学生分析、解决有机化学问题的能力;(2)提高学生的实验操作技能和实验安全意识。
3. 情感目标:(1)激发学生对有机化学的兴趣,培养科学素养;(2)培养学生严谨求实的科学态度。
二、教学内容1. 醇(1)醇的分类、命名、结构和性质;(2)醇的化学性质及反应条件;(3)醇的制备方法及在有机合成中的应用。
2. 酚(1)酚的分类、命名、结构和性质;(2)酚的化学性质及反应条件;(3)酚的制备方法及在有机合成中的应用。
3. 醚(1)醚的分类、命名、结构和性质;(2)醚的化学性质及反应条件;(3)醚的制备方法及在有机合成中的应用。
三、教学过程1. 导入(1)回顾有机化学基础知识,引导学生关注醇、酚、醚这一类有机化合物;(2)介绍醇、酚、醚在生活中的应用,激发学生的学习兴趣。
2. 讲授(1)醇的分类、命名、结构和性质;(2)酚的分类、命名、结构和性质;(3)醚的分类、命名、结构和性质;(4)醇、酚、醚的化学性质及反应条件;(5)醇、酚、醚的制备方法及在有机合成中的应用。
3. 实验操作(1)演示醇、酚、醚的制备实验;(2)学生分组进行实验操作,观察实验现象,记录实验数据;(3)分析实验结果,总结醇、酚、醚的制备方法及反应条件。
4. 课堂小结(1)回顾本节课所学内容,强调重点、难点;(2)布置课后作业,巩固所学知识。
四、教学评价1. 课堂表现:关注学生的课堂参与度,评价学生的提问、回答、实验操作等;2. 课后作业:检查学生的课后作业,了解学生对知识的掌握程度;3. 实验报告:评估学生的实验操作技能和实验安全意识。
五、教学反思1. 教学内容是否符合学生实际需求,是否能够激发学生的学习兴趣;2. 教学方法是否有效,是否能够提高学生的实验操作技能和实验安全意识;3. 教学过程中是否存在问题,如何改进教学方法,提高教学效果。
高中化学选修五醇和酚教案

高中化学选修五醇和酚教案
教学对象:高中化学选修五学生
教学目标:让学生了解醇和酚的基本概念、性质和应用,能够区分和辨别醇和酚,并能够
掌握相关实验操作技能。
教学重点和难点:醇和酚的区分、性质及实验操作技能。
教学准备:实验器材、实验药品、教学PPT、实验操作练习题等。
教学过程:
1.引入:通过举例引入醇和酚的基本概念,引出本节课的学习内容。
2.学习:分别介绍醇和酚的物理性质、化学性质以及常见的应用,并通过实验演示加深学
生对于醇和酚的理解。
3.区分:通过实验操作的方式,让学生能够准确地区分醇和酚,掌握相关的实验操作技能。
4.练习:进行一些关于醇和酚的练习题,巩固学生的知识。
5.总结:对醇和酚的学习内容进行总结,让学生能够清晰地理解醇和酚的区别和应用。
6.作业:布置一定数量的醇和酚的相关练习题作为课后作业。
教学反思:通过本节课的学习,学生应该能够清楚地了解醇和酚的基本概念、性质和应用,并且能够熟练地区分醇和酚。
同时,通过实验操作,能够提高学生的动手能力和实验技能。
第6章-醇酚醚课后习题答案

第六章 醇酚醚用系统命名法命名下列化合物,并指出哪些是伯、仲、叔醇:1、 答案:3,5-二甲基-2-乙基-4-氯-1-己醇 (伯醇)2、 答案:苯酚3、 答案:邻甲氧基苯酚4、 答案: 2-苄基-2-丁醇 (叔醇)5、 答案:(Z )-4-甲基-3-己烯-1-醇 (伯醇)6、 答案:二乙烯基醚7、 答案:1,2-环氧丁烷8、 答案:12-冠-49、答案:1,3,5-苯三酚(均苯三酚)CH 3CH 2CH 3CH 3Cl3CH CH CH CH CH 2OH OHOCH 3OH CH 2C CH 32CH 3C C CH 3CH 3CH 2H CH 2CH 2OH CH 2=CHOCH=CH 2C CHCH 2CH 3H 2O O O O OH OHHO10、答案:对甲基苯酚二、写出下列化合物的构造式:1、异丙醇 答案:2、甘油 答案:3、苦味酸 答案:4、邻甲苯酚 答案:5、苯甲醚(茴香醚) 答案:6、仲丁醇 答案:7、对苯醌 答案:8、二苯甲醇 答案:OHCH 3CH 3 -CH-OHCH 3CH 2OH CHOH CH 2OHOHNO 2NO 2O 2NCH 3OHOCH 3OHCH 3CHCH 2CH 3OOCH HO9、2-甲基-2,3-环氧丁烷 答案:10、(2R ,3S )-2,3-丁二醇 答案:11、(E )-2-丁烯-1-醇 答案:12、18-冠-6 答案:三、将下列化合物按沸点高低排列顺序:(1)2-丙醇 (2)丙三醇 (3)1-丙醇 (4)1,2-丙二醇 (5)乙醇 (6)甲醇 答案: (2)>(4)>(3)>(1)>(5)>(6) 四、将下列化合物按酸性大小排列次序:(1)对硝基苯酚 (2)间甲基苯酚 (3)环己醇 (4)2,4-二硝基苯酚 (5)间硝基苯酚 答案: (4)>(1)>(5)>(2)>(3) 五、试比较仲丁醇、异丁醇和叔丁醇:1、在一般反应条件下,它们的氧化产物有何不同?写出可能发生的氧化反应式答案:HC O C H 3C CH 3CH 3CH 3CH 3H OHH OH C CCH 3CH 2OH HH O OOO O O 仲醇氧化成酮伯醇氧化成羧酸叔醇难氧化CH 3CH 2CHCH 3[O]CH 3CH 2CCH 3CH 3CHCH 2OH[O]CH 3CHCOOHCH 3CH 3C OH [O]XOHOCH 3CH 32、它们与金属钠的反应速率有何差异?答案:与金属钠反应速率:异丁醇>仲丁醇>叔丁醇 3、在实验室里用何试剂鉴别它们?答案:用Lucas 试剂与醇发生卤代反应,醇的作用次序为:叔丁醇>仲丁醇>异丁醇 4、哪个醇的脱水产物有顺反异构体?写出它的反应式。
化学教案醇酚

教案内容课题:醇酚教学目标:一、知识与技能1、了解乙醇在日常生活中的应用。
2、了解乙醇的组成、主要性质。
3、通过对乙醇的分子结构、物理性质和化学性质的探究,学会由事物的表象解析事物的本质、变化。
进一步培养学生的综合探究能力、空间想象力和创造性思维能力,通过动手实验,规范学生操作,全面培养、提高学生的实验能力、观察能力和对实验现象的解析能力。
4、通过从动手实验,规范学生操作,全面培养,提高学生的实验能力、观察能力和对实验现象的解析能力。
二、过程与方法通过提出问题、讨论释疑、动手实验,学习对比、推断等多种科学探究方法。
1、通过对乙醇结构、性质等学习,培养学生的实验技能;2、培养学生提出问题、分析问题和解决问题的能力。
3、尝试建立性质反映结构,结构分析性质;从定性到定量,从宏观到微观的科学思想。
三、情感态度与价值观:1、在自主探究过程中,让学生体验科学实验探究的过程,养成团结合作的品质,形成科学的态度和价值观。
2、关注自身生活实际,体会化学学习的实际意义。
通过乙醇在日常生活中的应用,培养学生形成事物具有两面性的观点。
通过乙醇性质的学习,培养学生敢于和善于提出问题的思维品质,使学生获得物质的结构和性质之间关系的科学观点。
了解酒的酿造、乙醇的应用、过量饮酒和假酒的危害、居室环境污染、乙醇汽油等问题,培养学生关注健康、关心生活和关爱社会的责任意识。
教学重点:乙醇的结构与性质、烃的衍生物及其官能团的概念。
教学难点:乙醇的催化氧化及官能团的判断。
教法和学法:采用“设疑、引思、辅导”的教法学法。
教学用具:板书、多媒体教学过程:【教师活动】:【引入】用PPT展示各种含有酒精的饮料和调味品(图片)【学生活动】:观看课件中的图片【教师活动】:打开一瓶白酒你能闻到什么气味?这是什么物质发出的气味呢?【学生活动】:【小组讨论】思考乙醇的物理性质。
【教师活动】:【质疑】从中得到酒精的哪些物理性质(颜色状态气味等角度思考)?【学生活动】:小组代表回答小组得出的乙醇的物理性质。
高中化学醇和酚教案全套

高中化学醇和酚教案全套一、教学目标:1. 知识目标:- 了解醇和酚的化学结构及物理性质;- 掌握醇和酚的命名方法;- 理解醇和酚在生活中的应用。
2. 能力目标:- 能够区分醇和酚的异同点;- 能够运用所学知识解决相关问题;- 能够实验操作,观察醇和酚的性质。
3. 情感目标:- 培养学生对实验的兴趣和动手能力;- 培养学生的观察和分析能力;- 培养学生的实验安全意识。
二、教学内容:1. 醇和酚的概念及化学结构和命名方法;2. 醇和酚的性质及实验方法;3. 醇和酚在生活中的应用。
三、教学过程:1. 导入新课- 通过引导学生讨论醇和酚在生活中的应用,引起学生的兴趣;- 出示醇和酚的分子结构,让学生观察并讨论。
2. 知识讲解- 讲解醇和酚的概念及化学结构和命名方法;- 着重介绍醇和酚的性质,如溶解性、燃烧性等。
3. 实验操作- 进行醇和酚的实验,观察其性质;- 强调实验安全,让学生掌握正确的实验操作方法。
4. 拓展应用- 分组讨论醇和酚在生活中的应用,并展示给全班;- 引导学生思考如何利用醇和酚解决环境问题。
5. 总结反思- 回顾本节课的重点知识,让学生做思维导图或总结表;- 引导学生思考实验过程中出现的问题及解决方法。
四、课后作业:1. 阅读相关教材,复习本节课内容;2. 完成课堂练习,巩固所学知识;3. 思考醇和酚在生活中的应用,并写出相关应用情景。
五、教学反思:本节课通过实验操作和案例分析,让学生更加深入理解醇和酚的性质及应用。
同时,通过提出问题和引导讨论,激发学生的思考能力和创新能力。
希望能够激发学生对化学学科的兴趣,培养他们的实验技能和思考能力。
高中化学醇和酚的教案

高中化学醇和酚的教案
教学目标:
1. 了解醇和酚的基本概念及其区别
2. 掌握醇和酚的命名方法和结构特点
3. 理解醇和酚的性质及其应用领域
教学重点:
1. 醇和酚的区别和特点
2. 醇和酚的命名方法和结构特点
3. 醇和酚的性质及其应用领域
教学难点:
1. 醇和酚的区别和特点
2. 醇和酚的性质及其应用领域
教学准备:
1. PowerPoint课件
2. 实验器材:醇和酚的化学性质实验器材
3. 实验操作指导书
教学流程:
一、导入(5分钟)
通过展示一些常见的醇和酚的实物图片,引发学生对醇和酚的认识和思考。
二、讲解醇和酚的基本概念(10分钟)
1. 醇和酚的定义及区别
2. 醇和酚的命名方法和结构特点
三、实验操作(20分钟)
进行醇和酚的化学性质实验,观察实验现象并记录实验数据。
四、分析实验结果(10分钟)
根据实验结果,讨论醇和酚的性质及其应用领域。
五、梳理知识点(10分钟)
总结醇和酚的区别和特点,命名方法和结构特点,性质及应用领域。
六、作业布置(5分钟)
布置相关作业,巩固学生对醇和酚的理解和掌握。
七、课堂反馈(5分钟)
回顾本节课的重点内容,解答学生的问题。
教学反思:
本节课采用了理论讲解和实验操作相结合的教学方式,使学生在实践中感受到醇和酚的化学性质,提高了他们的学习兴趣和动手能力。
在以后的教学中,可以多加强实践环节,激发学生学习化学的积极性和探究欲望。
高中化学醇和酚讲解教案

高中化学醇和酚讲解教案【教学目标】1. 了解醇和酚的分类及性质;2. 掌握醇和酚的命名方法;3. 理解醇和酚的合成方法;4. 掌握醇和酚的化学反应。
【教学内容】1. 醇和酚的概念及分类;2. 醇和酚的性质;3. 醇和酚的命名规则;4. 醇和酚的合成方法;5. 醇和酚的化学反应。
【教学重点】1. 醇和酚的概念及分类;2. 醇和酚的性质;3. 醇和酚的命名规则。
【教学难点】1. 醇和酚的合成方法;2. 醇和酚的化学反应。
【教学准备】1. 实验器材:试管、醇和酚样品、试管架、酒精灯、镊子等;2. 实验试剂:碘溶液、卤仿、氢氧化钠溶液等;3. 教学课件、教学视频等。
【教学过程】一、导入(5分钟)教师引导学生回顾醇和酚的定义及性质,并对本节课的内容进行预告。
二、讲解醇和酚的概念及分类(10分钟)1. 醇和酚的定义;2. 醇和酚的主要分类。
三、介绍醇和酚的性质(15分钟)1. 醇和酚的物理性质;2. 醇和酚的化学性质。
四、讲解醇和酚的命名规则(10分钟)1. 醇和酚的命名方法;2. 案例分析。
五、介绍醇和酚的合成方法(10分钟)1. 醇和酚的合成方法及其机理;2. 实验演示。
六、讲解醇和酚的化学反应(15分钟)1. 醇和酚的氧化反应;2. 醇和酚的醚化反应。
七、实验操作(15分钟)根据教师的指导,学生进行实验操作,体会醇和酚的性质及反应。
八、总结(5分钟)教师对本节课的重点内容进行总结,并提出课后作业。
【板书设计】- 醇和酚的概念及分类- 醇和酚的性质- 醇和酚的命名规则- 醇和酚的合成方法- 醇和酚的化学反应【课后作业】1. 能写出以下醇和酚的结构式:乙醇、苯酚、异丙醇;2. 了解醇和酚的应用领域及相关实验。
【教学反思】通过本节课的教学,学生应能掌握醇和酚的基本概念、性质、命名规则及化学反应,从而为日后深入学习有机化学奠定基础。
要注意引导学生在学习过程中注重理论联系实际,提高实验操作技能。
《醇和酚》 学历案

《醇和酚》学历案一、学习目标1、理解醇和酚的结构特点,能够准确区分醇和酚。
2、掌握醇和酚的物理性质和化学性质。
3、了解醇和酚在生活和工业中的重要应用。
二、学习重点1、醇和酚的结构差异对性质的影响。
2、醇的氧化反应、消去反应和取代反应。
3、酚的酸性、取代反应和显色反应。
三、学习难点1、醇的消去反应和酚的显色反应的反应机理。
2、从结构角度理解醇和酚性质的差异。
四、知识链接1、烃的分类和结构特点。
2、有机化合物中官能团的概念和作用。
五、学习过程(一)醇的概念和分类醇是烃分子中饱和碳原子上的氢原子被羟基(—OH)取代形成的化合物。
根据醇分子中羟基所连接的碳原子的类型,醇可以分为伯醇(1°醇)、仲醇(2°醇)和叔醇(3°醇)。
例如,乙醇(CH₃CH₂OH)是伯醇,异丙醇(CH₃CH(OH)CH₃)是仲醇,叔丁醇((CH₃)₃COH)是叔醇。
(二)醇的物理性质1、低级醇(如甲醇、乙醇、丙醇)通常为无色液体,具有特殊的气味。
随着碳原子数的增加,醇的沸点逐渐升高,这是因为醇分子之间可以形成氢键,增加了分子间的作用力。
2、醇的水溶性与羟基的数量和碳原子数有关。
羟基越多,水溶性越好;碳原子数越多,水溶性越差。
例如,乙醇与水以任意比例互溶,而正己醇在水中的溶解度较小。
(三)醇的化学性质1、醇与金属钠的反应2CH₃CH₂OH +2Na → 2CH₃CH₂ONa + H₂↑这个反应类似于水与金属钠的反应,说明醇羟基中的氢原子具有一定的活泼性。
2、醇的氧化反应(1)催化氧化伯醇(如乙醇)在铜或银作催化剂、加热的条件下,被氧化为醛:2CH₃CH₂OH + O₂ → 2CH₃CHO + 2H₂O仲醇(如异丙醇)被氧化为酮:2CH₃CH(OH)CH₃+ O₂ → 2CH₃COCH₃+ 2H₂O叔醇由于没有α氢原子,一般不能被催化氧化。
(2)燃烧氧化醇可以在空气中完全燃烧生成二氧化碳和水:CH₃CH₂OH + 3O₂ → 2CO₂+ 3H₂O3、醇的消去反应醇在浓硫酸、加热的条件下,可以发生消去反应生成烯烃。
醇和酚学习教程.pptx

OH OCH3
pKa 9.98
10.21
理论解释:
9.65
O-
δ
δ O
δ OCH3
δ δ O
δ
OCH3 δ
8
第9页/共26页
OH OCH3
OCH3 δ
2、酚醚的生成和克莱森(Claisen)重排
==
OH
OH + CH3Br
O
OH
OH + CH3O S OCH3 O
O CH3 + H2O + Br
O CH3 + CH3OSO2O
O
O
O
N+
O
O
N+ OO
N+
O
O
共轭碱(负离子)可通过 -C传递到硝基。
只有-I
δ
δ O
δ NO2
δ δ O
δ
δ
6
第7页/共26页
NO2 δ
OH
OH
OH
甲基:
CH3
CH3
CH3
pKa 10.29 10.09
理论解释:
10.26
供电子基,主要是+I(与传递距离有关)。
7
第8页/共26页
甲氧基:
OH OCH3
三、物理性质
➢大多数酚是结晶性固体,少数酚是高沸点液体。 ➢具有特殊气味 ➢能形成分子间氢键,沸点较高,在水中有一定溶解度 ➢具有腐蚀性和杀菌能力
波谱性质: IR:O-H伸缩振动 3650~3600cm-1;
缔合“O-H” 3500~3200cm-1 C-O伸缩振动 1220~1250cm-1 1HNMR:酚羟基质子的化学位移4~12。
《醇和酚》 教学设计

《醇和酚》教学设计一、教学目标1、知识与技能目标(1)学生能够准确区分醇和酚的结构特点,并掌握醇和酚的定义。
(2)学生能够理解醇和酚的物理性质和化学性质,包括醇的氧化反应、取代反应、消去反应,以及酚的酸性、取代反应等。
(3)学生能够熟练书写醇和酚的相关化学反应方程式。
2、过程与方法目标(1)通过实验探究和观察分析,培养学生的实验操作能力、观察能力和思维能力。
(2)通过小组讨论和交流,培养学生的合作学习能力和表达能力。
3、情感态度与价值观目标(1)激发学生对有机化学的学习兴趣,感受化学在生活中的广泛应用。
(2)培养学生严谨的科学态度和创新精神。
二、教学重难点1、教学重点(1)醇和酚的结构特点及分类。
(2)醇和酚的化学性质。
2、教学难点(1)醇的消去反应和催化氧化反应的机理。
(2)酚的酸性强弱比较及取代反应的特点。
三、教学方法讲授法、实验探究法、小组讨论法、多媒体辅助教学法四、教学过程1、导入新课通过展示生活中常见的含有醇和酚类物质的图片,如酒精、苯酚软膏等,引导学生思考这些物质在生活中的用途,从而引出本节课的主题——醇和酚。
2、讲授新课(1)醇的结构与分类结合多媒体展示醇的分子结构模型,讲解醇的定义、官能团(羟基)以及醇的分类方法(根据羟基所连接的碳原子类型分为伯醇、仲醇、叔醇;根据醇分子中羟基的数目分为一元醇、二元醇、多元醇)。
(2)醇的物理性质让学生观察实验桌上的乙醇,引导学生从颜色、状态、气味、溶解性、密度等方面总结醇的物理性质。
强调醇的沸点随碳原子数的增加而升高,且醇分子间可以形成氢键,使其沸点高于相应的烷烃。
(3)醇的化学性质①醇的取代反应通过实验演示乙醇与氢溴酸的反应,让学生观察实验现象,写出化学反应方程式,讲解醇与卤化氢发生取代反应的机理。
②醇的消去反应以乙醇为例,讲解醇在浓硫酸作用下发生消去反应生成烯烃的条件和反应机理。
通过动画演示,帮助学生理解消去反应的过程。
③醇的氧化反应组织学生进行实验,将铜丝在酒精灯上灼烧后迅速插入乙醇中,观察实验现象。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第6章 醇、酚6.1 基本要求● 掌握醇和酚的分类和命名方法。
● 熟悉醇和酚的结构特点及氢键对物理性质的影响。
● 掌握醇和酚的主要化学性质。
6.2 基本知识点6.2.1 醇1. 醇的结构醇的结构特点:羟基直接和饱和碳原子结合,醇羟基中的氧是sp 3不等性杂化:CH H。
·2. 醇的分类根据羟基所连接的饱和碳原子类型,可将醇分为三类,即:伯醇(一级醇,1°醇)、仲醇(二级醇,2°醇)和叔醇(三级醇,3°醇);根据分子中所含羟基数目的多少,醇又分为一元醇、二元醇和三元醇,含两个以上羟基的醇统称为多元醇,羟基连接在相邻碳原子上的多元醇又称为“邻二醇”类;根据羟基所连的烃基结构不同分为饱和醇、不饱和醇和芳香醇;两个羟基在同一碳原子上的二元醇醇称为偕二醇。
偕二醇结构很不稳定,容易脱水变成羰基化合物:C OHOH-H 2OC O羟基连在双键上的醇称为烯醇,简单的烯醇不稳定,容易重排为羰基化合物,例如:2CH 3C HO乙烯醇 乙醛 3. 醇的命名结构简单的醇在“醇”字前面加上烃基名称构成,通常省去“基”字。
例如:CH 3OH 甲醇 C 6H 5CH 2OH 苄醇结构复杂的醇用系统命名法,其原则为:(1)选择包含羟基所在碳原子的最长碳链为主链,主链母体醇的命名是由主链所对应碳链的烃基名称后加“醇”字构成;(2)主链从距羟基最近端开始编号。
英文命名用词尾-ol 代替相应烷烃词尾-ane 中的e 即可,例如:CH 3CHCH 2CH 2CCH 2CH 3OH CH 3CH 35,5-二甲基-2-庚醇(5,5-dimethyl-2-heptanol )4. 醇的物理性质醇与水之间可以形成氢键,因此,醇的沸点比相对分子质量相近的烃类高得多。
醇与水之间也能形成氢键,故醇的水溶性也较烃和卤代烃等大,小分子醇可与水混溶,随着醇分子中烃基的增大,疏水的烃基与水之间的排斥力逐渐占主导作用,醇在水中的溶解度明显下降。
随着醇相对分子质量的增大,烷基对整个醇分子的影响越来越大,醇的物理性质越来越接近烷烃。
5. 醇的化学性质醇不但可发生氧-氢键断裂和碳-氧键断裂,其羟基的影响使α或β碳上的氢活泼,易发生氧化或脱氢反应。
(1)醇羟基的酸性 醇羟基的氢原子具有一定的酸性,可以和活泼金属反应,放出氢气。
ROH + NaRONa + 1/2 H 2醇的活性为:甲醇 > 伯醇 > 仲醇 > 叔醇 (2)醇羟基的取代反应CH 3CH 2-OH + HICH 3CH 2-I + H 2O不同氢卤酸及不同醇的反应活性顺序为:HI > HBr > HCl 叔醇 > 仲醇 > 伯醇无水氯化锌和浓盐酸的混合物称为Lucas 试剂,通常可用来鉴别6个碳以下的伯醇、仲醇和叔醇。
叔醇或烯丙醇的反应主要按S N 1机理进行,有碳正离子中间体产生,容易发生重排。
伯醇的取代主要按S N 2机理进行,醇羟基还可被卤化磷(PX 3、PX 5)或氯化亚砜(SOCl 2)所取代,生成卤代烃,不发生重排。
R + PI 3+ H 3PO 3OH R IR OH + SOCl 2醚R Cl + SO 2↑ + HCl ↑(3)脱水反应 分子内脱水:CH 2CH 2H OH24170℃CH 2=CH 2+ H 2O不同醇的脱水活性的顺序为:叔醇 > 仲醇 > 伯醇;仲醇和叔醇分子内脱水也遵守Saytzeff 规律:即生成双键上取代基多的烯烃;某些特殊结构的醇也发生重排反应。
分子间脱水:140H 2SO 4浓℃CH 3CH 2OCH 2CH 3 + H 2OCH 3CH 2CH 3伯醇可以分子间脱水成醚,而仲醇和叔醇主要发生分子内脱水,生成烯烃。
(4)无机含氧酸酯的生成 醇与无机含氧酸(如硝酸、亚硝酸、硫酸和磷酸等)脱水,生成无机酸酯。
CH 2CH CH 2OH OHOH+ 3HONO 224CH 2CH CH 2ONO 2ONO 2ONO 2+ 3H 2O(5)醇的氧化和脱氢反应 CH 3CH 2OHCH 3C HO CH 3C OH O[O]伯醇 醛 羧酸CH 3CH CH 3[O]OHCH 3C CH 3O仲醇 酮氧化试剂:KMnO 4、K 2Cr 2O 7酸性溶液。
伯醇在次条件下不能停留在醛的一步,最终产物是羧酸;仲醇氧化生成酮;叔醇α碳上无氢原子,通常不被氧化。
在无水条件下用CrO 3-吡啶(称为Sarrett 试剂或Collins 试剂)氧化伯醇,反应可停留醛的阶段。
例如:C 6H 5CH=CHCH 2OH + CrO 3(C 5H 5N)CH 2Cl 2C 6H 5CH=CHCHO苯丙烯醇 苯丙烯醛 伯醇和仲醇还可脱氢生成醛或酮,叔醇无α-氢,不能发生脱氢反应。
R CH 2OH℃Cu,325R C H O+ H 2R CH R C R'O+ H 2OHR'(6)邻二醇类的特性醇羟基的活泼氢可以被金属钠所置换,放出氢气;伯醇和仲醇能被氧化,通过颜色变化进行鉴别;Lucas 试剂还能区别伯醇、仲醇和叔醇;CH 3CH(OH)—结构的醇可发生碘仿反应。
邻二醇类的鉴别: 与氢氧化铜的反应CH 2OHCHOH CH 2OH+ Cu2+OHCH 2CH CH 2OH OO Cu(降兰色)与过碘酸的反应+ HIO 4R C H O +R'C OH + HIO 3 + H 2O R CH CH OH R'OH醛 醛+ 2HIO 4R R'O +H OOH + 2HIO 3 + 2H 2OR C OH CH OH CH 2OH+H O H 酮 甲酸 甲醛 6.2.2 酚 1. 酚的结构羟基直接连在芳环上的化合物称为酚,酚羟基中氧原子呈sp 2杂化状态,处于未杂化的p 轨道中的未共用电子对与苯环的大π键形成p —π共轭体系:2. 酚的命名简单的酚通常以酚为母体,多元酚及取代酚通常用邻、间、对(o-、m-、p-)标明取代基的位置;对于结构比较复杂的酚可以烃为母体,许多酚的衍生物还有俗名。
例如:OHCH 3COOHOHOHNO 2O 2N 2邻苯二酚 邻羟基苯甲酸 2,4,6-三硝基苯酚 (儿茶酚) (水杨酸) (苦味酸)3. 酚的化学性质(1)酚羟基的酸性 酚羟基与苯环形成p —π共轭,羟基O —H 键极性增大,氢容易电离,酚的酸性比醇强很多,pK a =9.96,可与NaOH 反应成盐而溶于水。
OH+ NaOHO Na+ H 2O(2)酚的氧化反应 空气中的氧就可以氧化酚,由无色晶体变为粉红色、红色、暗红色等颜色。
用重铬酸钾和硫酸试剂,酚氧化成醌类化合物,多元酚就更容易被氧化。
OH OOK Cr O H 2SO 41,4-苯醌(对苯醌)OH O 无水乙醚Ag 2O OHO1,2-苯醌(邻苯醌)(3)酚的鉴别反应 酚羟基及烯醇式结构(C C )能与三氯化铁水溶液起颜色反应;苯酚还可与溴水反应生成2,4,6-三溴苯酚白色沉淀,可用来鉴别。
OH+ 3Br 2+ 3HBr2,4,6-三溴苯酚(白色)6.3 典型例题解析6.3.1 命名下列化合物:(1)CH 3CH 2CHCHCH 3CH 2CH 3CH 2OH(2)C C C HH 3C OHCH 3H(3)H OHPh H 3C(4)CH 2OHC 2H 5(5)HO CH 2OH(6) H 3CCH CH 3OH(7)CH 2CH 2OH(8)OHOH(9)CH 3CHCHCH 2OHOHOH(10) CH 3CHC CHCH 3CH 3OH解:(1)3-甲基-2-乙基戊醇 (2)(3E ,2R )-3-戊烯-2-醇 (3)4-甲基-4-苯基环己醇 (4)4-乙基-1-萘甲醇 (5)对-羟甲基苯酚(6)1-间甲苯基乙醇(7)2-环己基乙醇(8)1,4-萘二酚(9)1,2,3-丁三醇 (10)3-甲基-3-戊烯-2-醇6.3.2 写出下列化合物的结构式:(1)苦味酸 (2)苄醇 (3)1,2-二苯基乙醇(4)β-萘酚 (5)2-甲基-4-叔丁基环己醇 (6)4-甲基-3-丙基-2-己醇 (7)顺-1,4-环己二醇(8)3-甲基-6-氯-2-己醇 (9)2,4,6-三溴苯酚 (10)(1R ,3R )-3-甲己环己醇解:(1)OHO 2NNO 22(2)CH 2OH(3)CH 2CHOH(4)OH(5)CH 3OH(CH 3)3C (6) CH 3CHCHCHCH2CH 3OH CH 2CH 2CH 3CH 3(7)(8) CH 3CHCHCH 2CH 2CH 2Cl OHCH 3(9)OHBrBrBr(10)36.3.3 完成下列反应式: (1)CH 2CHCH 3OH +(2)CH 2CHCH 2CH 3OH+(3) OH227H +(4) HOCH 2OH + NaOH(5)CH 3CHCH2CH 2OH CH 3+ HNO 3解:(1)CH 2CHCH 3OH H+CH CHCH 3(2)CH 2CHCH 2CH 3OH+CH CHCH 2CH 3 (3)OH227H +O(4) HOCH 2OH + NaOHNaOCH 2OH(5)CH 3CHCH2CH 2OH CH 3+ HNO 3CH 3CHCH 2CH 2ONO 2CH 36.3.4 写出正丙醇与下列试剂作用的产物:(1)冷浓硫酸 (2)硫酸,加热140℃ (3)硫酸,加热170℃ (4)金属钠 (5)SOCl 2 (6)CrO 3,吡啶 (7)KMnO 4 + H +解:(1)CH 3CH 2CH 2OSO 2OH (2)CH 3CH 2CH 2OCH 2CH 2CH 3 (3)CH 3CH CH 2(4)CH 3CH 2CH 2ONa (5)CH 3CH 2CH 2Cl(6)CH 3CH 2CHO (8)CH 3CH 2COOH 6.3.5 按酸性大小排列下列各组化合物:(1)OHCOCH 3OHCOCH 3OH(2)OHClOHCH 3OH(3)OH OH OHCl解:(1)OHCOCH 3OHCOCH 3OH(2)OHClOHCH 3OHBr(3)OHOHOHCl6.3.6 用化学方法鉴别下列各组化合物: (1)苄醇、间甲苯酚、氯化苄、氯苯 (2)庚烷、1-丁醇、1-溴戊烷、2-丁炔 解:(1) 苄醇 间甲苯酚 氯化苄 氯苯 FeCl 3 (-) 显色AgNO 3(醇) AgCl ↓ (-) Na H 2↑ (-)(2)庚烷1-丁醇1-溴戊烷2-丁炔Na (-)H2↑(-)(-)KMnO4(H+)(-)(-)褪色AgNO3(乙醇) (-)AgBr↓6.3.7 三种醇A、B、C经HIO4氧化后得到的下列产物,试写出醇的结构。
