一律2物理化学热力学2律 课件
合集下载
《物理化学》第三章 热力学第二定律PPT课件

例一:理想气体自由膨胀
原过程:Q=0,W=0,U=0, H=0
p2,V2
体系从T1,p1,V1 T2, 气体
真空
复原过程:
复原体系,恒温可逆压缩
WR
RT1
ln
V2 ,m V1,m
环境对体系做功
保持U=0,体系给环境放热,而且 QR=-WR
表明当体系复原时,在环境中有W的功变为Q的热,因 此环境能否复原,即理想气体自由膨胀能否成为可逆 过程,取决于热能否全部转化为功,而不引起任何其 他变化。
它们的逆过程都不能自动进行。当借助外力,系统 恢复原状后,会给环境留下不可磨灭的影响。
•化学反应 Zn+H2SO4等?
如图是一个典型的自发过程
小球
小球能量的变化:
热能
重力势能转变为动能,动能转化为热能,热传递给地面和小球。
最后,小球失去势能, 静止地停留在地面。此过程是不可逆转的。 或逆转的几率几乎为零。
能量转化守恒定律(热力学第一定律)的提出,根本上宣布 第一类永动机是不能造出的,它只说明了能量的守恒与转化及 在转化过程中各种能量之间的相互关系, 但不违背热力学第一 定律的过程是否就能发生呢?(同学们可以举很多实例)
热力学第一定律(热化学)告诉我们,在一定温度 下,化学反应H2和O2变成H2O的过程的能量变化可用U(或H) 来表示。
热力学第二定律(the second law of thermodynamics)将解答:
化学变化及自然界发生的一切过程进行 的方向及其限度
第二定律是决定自然界发展方向的根本 规律
学习思路
基本路线与讨论热力学第一定律相似, 先从人们在大量实验中的经验得出热力学第 二定律,建立几个热力学函数S、G、A,再 用其改变量判断过程的方向与限度。
物理化学第2章 热力学第二定律

BSm$ (B)
§3.7 熵变的计算
一、单纯状态变化过程
1. 等温过程 2.变温过程
S QR T
①等容变温过程
S T2 Qr T2 nCp,mdT
T T1
T1
T
nC
p,m
ln
T2 T1
②等压变温过程
S T2 Qr T T1
T2 nCV ,mdT
T1
T
nCV
,m
ln
T2 T1
U3 0
p
W3
nRTc
ln V4 V3
A(p1,V1,Th )
B(p2,V2,Th )
Th
Qc W3
D(p4,V4,TC )
C(p3,V3,TC )
Tc
环境对系统所作功如 DC曲线下的面积所示
a db
c
V
过程4:绝热可逆压缩 D( p4,V4,TC ) A( p1,V1,Th )
Q4 0
p
用一闭合曲线代表任意可逆循环。 在曲线上任意取A,B两点,把循环分成AB和 BA两个可逆过程。 根据任意可逆循环热温商的公式:
δ Q
T R
0
将上式分成两项的加和
B Q
( AT
)R1
A Q
( BT
)R2
0
移项得:
B A
(
Q T
)R1
B A
(
Q T
)R
2
说明任意可逆过程的热温商的值决定于始终 状态,而与可逆途径无关,这个热温商具有状态 函数的性质。
所以Clausius 不等式为
dS 0
等号表示绝热可逆过程,不等号表示绝热不
可逆过程。
熵增加原理可表述为:
§3.7 熵变的计算
一、单纯状态变化过程
1. 等温过程 2.变温过程
S QR T
①等容变温过程
S T2 Qr T2 nCp,mdT
T T1
T1
T
nC
p,m
ln
T2 T1
②等压变温过程
S T2 Qr T T1
T2 nCV ,mdT
T1
T
nCV
,m
ln
T2 T1
U3 0
p
W3
nRTc
ln V4 V3
A(p1,V1,Th )
B(p2,V2,Th )
Th
Qc W3
D(p4,V4,TC )
C(p3,V3,TC )
Tc
环境对系统所作功如 DC曲线下的面积所示
a db
c
V
过程4:绝热可逆压缩 D( p4,V4,TC ) A( p1,V1,Th )
Q4 0
p
用一闭合曲线代表任意可逆循环。 在曲线上任意取A,B两点,把循环分成AB和 BA两个可逆过程。 根据任意可逆循环热温商的公式:
δ Q
T R
0
将上式分成两项的加和
B Q
( AT
)R1
A Q
( BT
)R2
0
移项得:
B A
(
Q T
)R1
B A
(
Q T
)R
2
说明任意可逆过程的热温商的值决定于始终 状态,而与可逆途径无关,这个热温商具有状态 函数的性质。
所以Clausius 不等式为
dS 0
等号表示绝热可逆过程,不等号表示绝热不
可逆过程。
熵增加原理可表述为:
物理化学03章_热力学第二定律(二)

Ssys = 19.14 J K
Ssur = 0
1
(系统未吸热,也未做功)
Siso = Ssys + Ssur = 19.14 J K 1 > 0
(2)为不可逆过程.
例2:在273 K时,将一个 22.4 dm3 的盒子用隔板一分为二,
0.5 mol 0.5 mol O2 (g) N2 (g)
p1 V1 p2 V2 T2 p2 V2 ∵ = ∴ = T1 T2 T1 p1V1
V2 p2V2 ∴ S = nR ln + nCV ,m ln V1 p1V1
V2 p2 V2 = nR ln + nC V ,m ln + nC V ,m ln V1 p1 V1
p2 V2 ∴ S = nCV ,m ln + nC p ,m ln p1 V1
因为在可逆相变中压力恒定,所以可逆热即为相 因为在可逆相变中压力恒定, 变焓.又由于温度一定,所以, 变焓.又由于温度一定,所以,物质 B 由 α 相态 转化为 β 相态
p ,T B (α ) → B ( β )
的相变熵为: 的相变熵为:
β α H β α S = T
用上式,可计算正常熔点下的熔化熵, 用上式,可计算正常熔点下的熔化熵,正常 沸点下的蒸发熵等等. 沸点下的蒸发熵等等.
= TC S > 0
Q W
热源
R2
TC
1
W2
Q W2
TB热源做功能力低于TA
TB热源做功能力低于TA
其原因是经过了一个不可逆的热传导过程 功变为热是无条件的,而热不能无条件 地全变为功. 热和功即使数量相同,但"质量"不等, 功是"高质量"的能量. 高温热源的热与低温热源的热即使数量相 同,但"质量"也不等,高温热源的热"质量" 较高,做功能力强. 从高"质量"的能贬值为低"质量"的能 是自发过程.
物理化学02章_热力学第二定律02

S体系
Qr Qsurr Qsys Q Δ S环 = = = Tsurr Tsurr Tsurr T
Δ S 总 =Δ S 体 + Δ S 环 ≥ 0
上一讲回顾
(1) 熵变的计算: 可逆过程,直接计算过程的热温商 不可逆过程,设计可逆过程计算。 (2) 等温过程,变温过程及相变过程熵变的计算 (3) 利用熵变判断过程的方向
a)恒 T 可逆 b)恒 T 不可逆 V2 V2 V2 Δ S 总 = nRTLn +(-nRLn ) Δ S 总 = nRTLn + 0 V1 V1 V1
= 0
V2 = nRTLn > 0 V1
等温过程的熵变
例: 1mol理想气体在等温下通过:(1)可逆膨胀,(2)真 空膨胀,体积增加到10倍,分别求其熵变。 解:(1)可逆膨胀
简化:
V2 P2 等 T:Δ S= nRLn =- nRLn V1 P1 T2 等 P:Δ S= CP Ln T1
T2 等 V:Δ S= CV Ln T1
变温过程的熵变
1. 先等温后等容 2. 先等温后等压 3. 先等压后等容
T2 nCV ,m dT V2 S nR ln( ) T1 V1 T T2 nC p ,m dT p1 S nR ln( ) T1 p2 T V2 p2 S nC p ,m ln( ) nCV ,m ln( ) V1 p1
S T
T2
1
nCV ,m dT T
(2) 物质的量一定的等压变温过程
S T
T2
1
nC p ,m dT T
等 P 过程:
W`=0, QP = dH = CPdT = QR
QR QP C P dT dS = = = T T T CP S )P 或 ( T T
物理化学 热力学第二定律

上式为
B
A
δ
Q T
ir
A B
δ Qr T
0
B
A
δ
Q T
ir
ABS
0
BAS
B A
δ
Q T
ir
S δTQ
> ir =r
Clausius Inequality
(1) 意义:在不可逆过程中系统的熵变大于过程 的热温商,在可逆过程中系统的熵变等于过 程的热温商。即系统中不可能发生熵变小于 热温商的过程。 是一切非敞开系统的普遍规律。
= r cycle (可逆循环)
意义:的极限 提高的根本途径
Carnot定理的理论意义:
§2-4 熵 (Entropy)
一、熵函数的发现 (Discovery of entropy)
1 T2
T1
即
1 Q2 1 T2
Q1
T1
< ir cycle = r cycle
Q1 Q2 0 T1 T2
1mol He(g) 200K
1m3o0l0HK2(g)
101.3kPa 101.3kPa
解:求末态 过程特点:孤立系统, U = 0
U U (He) U (H 2 )
n
3 2
RT2
200 K
n
5 2
RT2
300 K
0
T2 = 262.5K
1mol He(g) 200K
101.3kPa
1mol H2(g) 300K
对两个热源间的可逆循环:热温商
之和等于0
Q1 Q2 0 T1 T2
对任意可逆循环(许许多多个热源):
pቤተ መጻሕፍቲ ባይዱ
第二章 热力学第二定律 物理化学课件

设始、终态A,B的熵分别为SA 和 SB,则:
SB SA S
B Qr AT
对微小变化
dS Qr
T
上式习惯上称为熵的定义式,即熵的变化值可 用可逆过程的热温商值来衡量。
2 不可逆过程的热温商
• 如果热机进行不可逆循环,则其效率必 然比卡诺循环效率低,即
Q1 Q2 Q1
T1
T 2
T1
或
1+
T K
2
dT T
J K-1
24.3J K-1
• 此过程热温商为
Q
T
2
373 K 273 K
32.22
22.18 103
T K
373
3.49
106
• 故开动此致冷机所需之功率为
1780
1 60
W
50%=59.3
W
§2.4 熵的概念
• 1 可逆过程的热温商及熵函数的引出
• 在卡诺循环中,两个热源的热温商之和 等于零,即
Q1 Q2 QB 0
T1 T2
TB
• 那么,任意可逆循环过程的多个热源的 热温商之和是否仍然等于零?
§2.4 熵的概念
S Qr Qr TT
• 对理想气体定温可逆过程来说 Qr=-Wr
nRT ln V2
S
V1 nR ln V2 nR ln p1
T
V1
p2
例题3
• (1) 在300K时,5mol的某理想气体由 10dm3定温可逆膨胀到100dm3。计算此过 程中系统的熵变;
• (2)上述气体在300K时由10dm3向真空膨 胀变为100dm3。试计算此时系统的S。 并与热温商作比较。
Q1
物理化学电子课件第三章热力学第二定律

第二节 卡诺循环和卡诺定理
一.热机效率
热机是一种把内能转化为机械能的装置,如蒸汽机、汽轮机、燃气轮 机、内燃机、喷气发动机等,它通过工质(传递能量的媒介物质叫工质, 如气缸中的气体)从高温热源吸取热量对环境做功,然后向低温热源放热 而复原。如此循环,热机即可不断将热转化为功。
以内燃机为例,气缸中的气体得到燃料燃烧时产生的热量(Q1),推动 活塞做功(-W),然后排出废气,同时放出热量(Q2)。我们把在一次循环中 热机对环境所做的功(-W)与它从热源吸收的热量(Q1)的比值称作热机的效 率,即
第一节 自发过程的概念和热力学第二定律的表述
二.自发过程的实质
从上面的讨论可以看出,热是否可以无条件地全部转变成功是自发 过程能否成为热力学可逆过程的前提。经验表明,功完全转变成热是可 以的,可以不引起其他变化,但把热完全转变成功而不引起其他变化是 不可能的。进一步研究发现,自发过程具有共同的特征:自发过程有方 向性和限度,自发过程的逆过程虽然并不违反能量守恒定律,但不能无 条件自发进行,必须借助外力;自发过程是不可逆的,自发过程的逆过 程进行的结果是系统恢复原状
一.自发过程
在自然条件下,不需要外力的帮助,任其自然就能自动发生 的过程称为自发过程。反之,如果是需要外力帮助才能进行的过 程则称为非自发过程。
(1)理想气体向真空膨胀。这是一个自发过程,根据热力学 第一定律,在这个过程中Q=0,W=0,ΔU=0,ΔT=0。要使膨胀了 的理想气体恢复原状,这个压缩过程是不可能自动发生的。要使 环境也复原,也就是使理想气体的真空膨胀成为一个可逆过程, 条件是:让系统放出的热全部变为功而不留下其他影响。
第二节 卡诺循环和卡诺定理
4.绝热可逆压缩(状态4到状态1)
第二节 卡诺循环和卡诺定理
物理化学2_热力学第二定律
∆S = ∫
T2
T1
nCV.m dT T
2.等压变温 δQR = nC p ,m dT
∆S = ∫
T2
nC p.m T
T1
dT
3.理想气体状态变化(仅有体积功 WR = −∫ p外dV = − pdV )
δQR=dU-δWR = dU + pdV = nCV,m dT + nRT
于是
dV V
∆S = ∫
Zn+CuSO 4 (aq)
ZnSO 4(aq)+Cu ∆H m *= -216.8 kJ mol -1
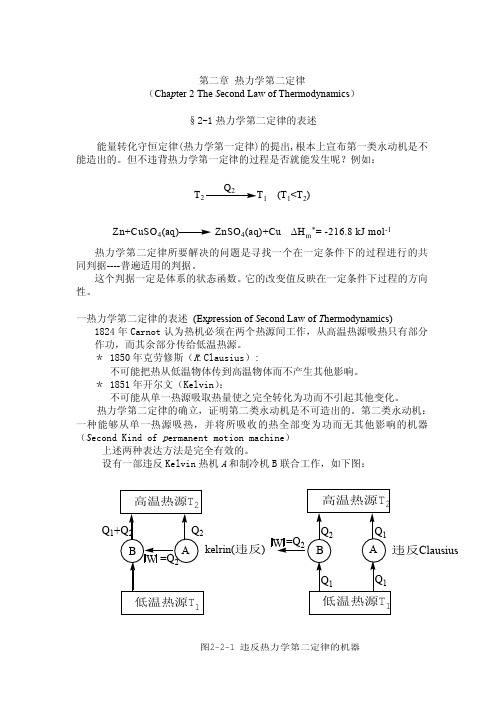
热力学第二定律所要解决的问题是寻找一个在一定条件下的过程进行的共 同判据----普遍适用的判据。 这个判据一定是体系的状态函数。它的改变值反映在一定条件下过程的方向 性。 一热力学第二定律的表述 (Expression of Second Law of Thermodynamics) 1824 年 Carnot 认为热机必须在两个热源间工作,从高温热源吸热只有部分 作功,而其余部分传给低温热源。 * 1850 年克劳修斯(R.Clausius): 不可能把热从低温物体传到高温物体而不产生其他影响。 * 1851 年开尔文(Kelvin) : 不可能从单一热源吸取热量使之完全转化为功而不引起其他变化。 热力学第二定律的确立,证明第二类永动机是不可造出的。第二类永动机: 一种能够从单一热源吸热,并将所吸收的热全部变为功而无其他影响的机器 (Second Kind of permanent motion machine) 上述两种表达方法是完全有效的。 设有一部违反 Kelvin 热机 A 和制冷机 B 联合工作,如下图:
高温热源T2
高温热源 T2
W =Q2 Q2 B Q1
物理化学热力学第二定律

对微小变化
Qr dS T
上式为熵的定义式。 熵的变化必须由可逆过程的热温商求得。
(2) 不可逆过程的热温商
• 如果热机进行不可逆循环,则其效率必然比卡 诺循环效率小,即 Q1 Q2 T2 T Q2 T2
1
• 其中Q表示不可逆过程的热效应。由上式得
Q1* Q2* 0 T1 T2
• 因此,对一任意不可逆循环来说,必有
Q*
T
0
假定一不可逆循环A→B→A,其中A→B为不可 逆过程(标记ir)、B→A为可逆过程(标记r)。
警告:对不可逆过程 A→B (1→2) 不可颠倒积分限。
2 T T 2 Q 2 Q r ir > 1 T 1 T 2 Q > 不可逆 S 1 T = 可逆 Q > 不可逆 dS T = 可逆 1
①A→B 定温可逆膨胀 ②B→C 绝热可逆膨胀 ③C→D 定温可逆压缩 ④D→A 绝热可逆压缩
• 过程①:定温(T2)可逆膨胀 理想气体Δ U= 0, 故 Q2 = -W1 W1 = -RT2*ln(V2/V1) • 过程② :绝热可逆膨胀 由于绝热 Q= 0, 故ΔU = W2 Δ U= Cv*Δ T = Cv*(T1-T2) • 过程③ :定温(T1)可逆压缩 理想气体ΔU=0,故 Q1 = -W3 W3 = -RT1*ln(V4/V3) • 过程④ :绝热可逆压缩 由于绝热 Q= 0, ΔU = W4 ΔU= Cv* ΔT = Cv*(T2-T1)
卡诺定理: 1. 在两个不同温度的热源之间工作的任意 热机,以卡诺热机的效率为最高。 2. 卡诺热机的效率只与两个热源的温度有 关,而与工作物质(水蒸气或其它气体) 无关。
物理化学热力学第二定律课件

节能减排与可持续发展
为了解决环境问题,需要采取节能减排措施,提高能源利 用效率,减少能量耗散和损失。同时,需要推动可持续发 展战略,实现经济发展和环境保护的良性循环。
03
热力学第二定律在环保技术中的应用
热力学第二定律在环保技术中有着广泛的应用,例如在热 力发电、制冷、空调、汽车节能等领域。通过合理利用和 回收能源,可以有效降低能量耗散和损失,提高能源利用 效率,从而减少对环境的负面影响。
热力学第二定律
孤立系统的总熵不会减少,即自然发生的反应总是向着熵增加的 方向进行。
熵与热力学第二定律的关系
热力学第二定律表明孤立系统的总熵总是增加的,即系统总是向着 更加无序和混乱的状态发展。
统计意义
熵的增加反映了自然界的不可逆过程和自发的变化方向,是自然界 的基本规律之一。
06 热力学第二定律的局限性 与发展
非平衡态热力学的提出
01
为了解决热力学第二定律的局限性热力学的应用
02
非平衡态热力学可以描述系统在非平衡态下的性质和行为,为
研究复杂系统提供了有力工具。
非平衡态热力学的挑战
03
非平衡态热力学的理论体系尚不完善,仍需进一步发展和验证
。
理想热机与实际热机的效率
理想热机是指没有能量耗散和损失的热机,其效率可以达到百分之百。然而在实际应用中 ,由于各种原因(如摩擦、不完全燃烧等),实际热机的效率总是低于理想热机的效率。
提高热机效率的方法
为了提高热机效率,可以采取多种方法,例如改善燃烧过程、减少摩擦和内部泄露、回收 和利用余热等。这些方法可以有效降低能量耗散和损失,从而提高热机的转换效率。
系统无序程度的量度。
热力学概率与自发过程的关系
自发过程总是向着热力学概率增加的方向进行,即向着更 加无序的方向发展。这也是热力学第二定律的实质。
为了解决环境问题,需要采取节能减排措施,提高能源利 用效率,减少能量耗散和损失。同时,需要推动可持续发 展战略,实现经济发展和环境保护的良性循环。
03
热力学第二定律在环保技术中的应用
热力学第二定律在环保技术中有着广泛的应用,例如在热 力发电、制冷、空调、汽车节能等领域。通过合理利用和 回收能源,可以有效降低能量耗散和损失,提高能源利用 效率,从而减少对环境的负面影响。
热力学第二定律
孤立系统的总熵不会减少,即自然发生的反应总是向着熵增加的 方向进行。
熵与热力学第二定律的关系
热力学第二定律表明孤立系统的总熵总是增加的,即系统总是向着 更加无序和混乱的状态发展。
统计意义
熵的增加反映了自然界的不可逆过程和自发的变化方向,是自然界 的基本规律之一。
06 热力学第二定律的局限性 与发展
非平衡态热力学的提出
01
为了解决热力学第二定律的局限性热力学的应用
02
非平衡态热力学可以描述系统在非平衡态下的性质和行为,为
研究复杂系统提供了有力工具。
非平衡态热力学的挑战
03
非平衡态热力学的理论体系尚不完善,仍需进一步发展和验证
。
理想热机与实际热机的效率
理想热机是指没有能量耗散和损失的热机,其效率可以达到百分之百。然而在实际应用中 ,由于各种原因(如摩擦、不完全燃烧等),实际热机的效率总是低于理想热机的效率。
提高热机效率的方法
为了提高热机效率,可以采取多种方法,例如改善燃烧过程、减少摩擦和内部泄露、回收 和利用余热等。这些方法可以有效降低能量耗散和损失,从而提高热机的转换效率。
系统无序程度的量度。
热力学概率与自发过程的关系
自发过程总是向着热力学概率增加的方向进行,即向着更 加无序的方向发展。这也是热力学第二定律的实质。
第二章:热力学第二定律(物理化学)

如果是一个隔离系统,环境与系统间既无热 的交换,又无功的交换,则熵增加原理可表述为: 一个隔离系统的熵永不减少。
精选可编辑ppt
31
克劳修斯不等式的意义
克劳修斯不等式引进的不等号,在热力学上可以
作为变化方向与限度的判据。
dS Q T
dSiso 0
“>” 号为不可逆过程 “=” 号为可逆过程
“>” 号为自发过程 “=” 号为处于平衡状态
I < 20% 1度电/1000g煤
高煤耗、高污染(S、N氧化物、粉尘和热污染)
精选可编辑ppt
16
火力发电厂的能量利用
400℃
550℃
ThTC67330055%
Th
673
I < 40% 1度电/500g煤
ThTC82330063%
Th
823
精选可编辑ppt
17
火力发电厂的改造利用
精选可编辑ppt
十九世纪,汤姆荪(Thomsom)和贝塞罗特(Berthlot) 就曾经企图用△H的符号作为化学反应方向的判据。他们认 为自发化学反应的方向总是与放热的方向一致,而吸热反应 是不能自动进行的。虽然这能符合一部分反应,但后来人们 发现有不少吸热反应也能自动进行,如众所周知的水煤气反 应就是一例。这就宣告了此结论的失败。可见,要判断化学 反应的方向,必须另外寻找新的判据。
精选可编辑ppt
4
2.2 自发变化不可逆症结
T1高温热源 Q1
M
W
Q2
T2低温热源
精选可编辑ppt
5
2.3 热力学第二定律(The Second Law of Thermodynamics)
开尔文(Kelvin) :“不可能从单一热源取出热使之完全 变为功,而不发生其它的变化。”
精选可编辑ppt
31
克劳修斯不等式的意义
克劳修斯不等式引进的不等号,在热力学上可以
作为变化方向与限度的判据。
dS Q T
dSiso 0
“>” 号为不可逆过程 “=” 号为可逆过程
“>” 号为自发过程 “=” 号为处于平衡状态
I < 20% 1度电/1000g煤
高煤耗、高污染(S、N氧化物、粉尘和热污染)
精选可编辑ppt
16
火力发电厂的能量利用
400℃
550℃
ThTC67330055%
Th
673
I < 40% 1度电/500g煤
ThTC82330063%
Th
823
精选可编辑ppt
17
火力发电厂的改造利用
精选可编辑ppt
十九世纪,汤姆荪(Thomsom)和贝塞罗特(Berthlot) 就曾经企图用△H的符号作为化学反应方向的判据。他们认 为自发化学反应的方向总是与放热的方向一致,而吸热反应 是不能自动进行的。虽然这能符合一部分反应,但后来人们 发现有不少吸热反应也能自动进行,如众所周知的水煤气反 应就是一例。这就宣告了此结论的失败。可见,要判断化学 反应的方向,必须另外寻找新的判据。
精选可编辑ppt
4
2.2 自发变化不可逆症结
T1高温热源 Q1
M
W
Q2
T2低温热源
精选可编辑ppt
5
2.3 热力学第二定律(The Second Law of Thermodynamics)
开尔文(Kelvin) :“不可能从单一热源取出热使之完全 变为功,而不发生其它的变化。”
物理化学 第二章 热力学第二定律

101.325kPa,变到100℃,253.313 kPa,计
算△S。
S
p S1
S2
T
分析:此题是p、V、T三者都变的过程,若要计 算熵变,需要设计成两个可逆过程再计算。先等 压变温,再等温变压。
S
p S1
S2
T
S
S1
S2
C pm
ln T2 T1
R ln
p1 p2
5 R ln 37315 R ln 101325 114J K 1
-5℃苯(l)→5℃苯(l)
S1
278 Cpm(l) dT 268 T
C pm(l )
ln
T2 T1
126g77 ln 278 268
4 64J K 1
(2) 相变点的相变 5℃苯(l)→5℃苯(s)
S2
H T
9916 08 278
35 66J
K 1
(3) 恒压变温 5℃苯(S)→-5℃苯(S)
4.绝热可逆缩D(p4V4)→A(p1V1)
下面计算每一步的功和热 以1mol理想气体为体系
第一步: U1 0
W1
Q2
RT2
ln V2 V1
第二步:
T1
Q 0 W2 U2 CVmdT
T2
第三步: U3 0 第四步: Q 0
W3
Q1
RT1
ln
V4 V3
T2
W4 U4 CVmdT
T1
解:(1)
S体
nR ln V2 V1
8314 ln10 19 15J
K 1
S环
QR T
nR ln V2 V1
19 15J gK 1
S体 S环 0
热力学第二定律-物理化学-课件-03

7
说明: 1.各种说法一定是等效的。若克氏说法不成 立,则开氏说法也一定不成立(证明见书48页); 2.要理解整个说法的完整性切不可断章取义。如 不能误解为热不能转变为功,因为热机就是一种把 热转变为功的装置;也不能认为热不能完全转变为 功,因为在状态发生变化时,热是可以完全转变为 功的(如理想气体恒温膨胀即是一例) 3.热二律与热一律同样都是建立在无数客观事实基础 上的客观规律。至今还没有发现违背热二律的事实。
平衡
20
(2)真空膨胀 熵是状态函数,始终态相同,系统熵变也相同, 所以:
S sy 19.14 J K
1
S su
Q pra Tex
0
Sis Ssy Ssu 19.14 J K 1 0
自发过程
21
恒容变温
QV= dU = nCV,mdT
S
4
自发过程的定义
没有环境的影响下而能自动发生的过程 自发过程的特点 有方向的,有限度的,是不可逆过程。 要正确理解自发过程具有单向性(不可逆)的含义: 并不是其不能反向进行,环境对系统做功,可以使 系统复原,如利用水泵引水上山;利用空调机,可 以把热量从低温物体传到高温物体,但是一定在环 境中留下痕迹。 5
22
PVT均变化的ΔS的计算-理想气体
( p1 ,V1 , T1 ) ( p2 , V2 , T2 )
恒容 SV
S
( p ',V1 , T2 )
恒温 ST
T2 V2 S SV ST nCV ,m ln nR ln T1 V1
23
( p1 ,V1 , T1 ) ( p2 , V2 , T2 )
V2 p2 Qr Wr nRT ln nRT ln V1 p1 Qr V2 p2 S nR ln nR ln T V1 p1
说明: 1.各种说法一定是等效的。若克氏说法不成 立,则开氏说法也一定不成立(证明见书48页); 2.要理解整个说法的完整性切不可断章取义。如 不能误解为热不能转变为功,因为热机就是一种把 热转变为功的装置;也不能认为热不能完全转变为 功,因为在状态发生变化时,热是可以完全转变为 功的(如理想气体恒温膨胀即是一例) 3.热二律与热一律同样都是建立在无数客观事实基础 上的客观规律。至今还没有发现违背热二律的事实。
平衡
20
(2)真空膨胀 熵是状态函数,始终态相同,系统熵变也相同, 所以:
S sy 19.14 J K
1
S su
Q pra Tex
0
Sis Ssy Ssu 19.14 J K 1 0
自发过程
21
恒容变温
QV= dU = nCV,mdT
S
4
自发过程的定义
没有环境的影响下而能自动发生的过程 自发过程的特点 有方向的,有限度的,是不可逆过程。 要正确理解自发过程具有单向性(不可逆)的含义: 并不是其不能反向进行,环境对系统做功,可以使 系统复原,如利用水泵引水上山;利用空调机,可 以把热量从低温物体传到高温物体,但是一定在环 境中留下痕迹。 5
22
PVT均变化的ΔS的计算-理想气体
( p1 ,V1 , T1 ) ( p2 , V2 , T2 )
恒容 SV
S
( p ',V1 , T2 )
恒温 ST
T2 V2 S SV ST nCV ,m ln nR ln T1 V1
23
( p1 ,V1 , T1 ) ( p2 , V2 , T2 )
V2 p2 Qr Wr nRT ln nRT ln V1 p1 Qr V2 p2 S nR ln nR ln T V1 p1
物理化学2 热力学第二定律

2、自发过程的共同特征 、 •气体向真空膨胀 •热量从高温物体传入低温物体 •锌片与硫酸铜的置换反应
自发过程的共同特征—不可逆性; 自然界的所有自发过程都可以归结为热功转换的 不可逆性
具有普遍意义的过程: 具有普遍意义的过程:热功转换的不等价性
无代价,全部
功
不可能无代价,全部
热
① W
Q 不等价,是长期实践的结果。
1mol 理想气体的卡诺循环在 pV 图上可以分为四步: 过程1:等温(T2)可逆膨胀由 p1,V1到 p2,V2
∆U1 = 0
V2 W = RT2 ln 1 V 1
Q =−W 2 1
过程2:绝热可逆膨胀由 p2 , V2 , T2到 p3 , V3 , T1
Q=0
W2 = ∆U = ∫ CV dT = CV (T1 − T2 )
∆H = ∆H ( He) + ∆H ( H 2 )
= 207.9J
5 7 = n ⋅ R (262.5K − 200K ) + n ⋅ R (262.5K − 300K ) 2 2
(2)
∆S = ∆S ( He ) + ∆S ( H 2 )
3 262.5 5 262.5 = n ⋅ R ln + n ⋅ R ln 2 200 2 300
S是容量性质,J.K-1
T δ Q ≠ ∑ T
2、不可逆过程的热温商
* Q1* + Q2 T2 − T1 < * Q2 T2
Q Q + <0 T1 T2
* 1
* 2
∑
δQ*
T
<0
β
设有一个循环,A→B为不可逆过程, B→A为可逆过程,整个循环为不可逆 循环。 则有
物理化学-热力学第二定律PPT课件

(2) 当T2-T1=0, (3) 当T1=0K,
=0 =100%
表述
第四节 卡诺定理
1. 所有工作在相同的高温热源与低温热源 之间的任意热机以卡诺热机的效率最大。
2.卡诺热机的效率只与两热源的温度有关, 而与工作物质无关
证明:
卡诺定理的数学表达式 R≧ I
T2–T1 ≧ T2
Q2+Q1 Q2
Q1 + T1
低电位
逆过程称为非自发过程
(2)不可逆性 理想气体真空膨胀 Q=0 W=0 U=0 再等温可逆压缩回去 U=0 Q=W 系统恢复,环境失W,而得Q
环境恢复,Q能否全部转变W
自发过程能否成为可逆过程,可归结为: 在不引起其它任何变化条件下,热能
否全部变为功。 焦尔的热功当量测定实验
一切自发过程都是不可逆过程
二、热力学第二定律数学表达式 ——克劳修斯不等式
U=0
W=Q1+Q2
W=W1+W2+W3+W4
=
nRT2ln(V2/V1)
-∫
T1 T2
CV
dT
+
nRT1ln(V4/V3)
-∫
T2 T1
CV
dT
W= nRT2ln(V2/V1) + nRT1ln(V4/V3) (2) 绝热膨胀
T2V2 -1 = T1V3 -1 (3) 绝热压缩
T2V1 -1 = T1V4 -1
式中, K1, K2, K 3 均为常数, Cp /CV
绝热功的求算
理想气体绝热可逆过程的功
W V2 pdV V1
=
K V2 V V1
dV
=
K
(1
物理化学第二章 热力学第二定律

第四节
卡诺定理
一、卡诺定理:所有工作于同温热源和同温冷源之间 的热机,以可逆机的效率最大。 证明:(1)设 I 热机效率大于R,以I 带动 R 倒转: 设I>R ,W1=W2=W
则 Q‘h < Qh
循环一周,热机恢复原态。
低温热源失热: (Qh-W)- (Q'h-W)=Qh- Q'h> 0 高温热源得热: (Qh- Q‘h) > 0 违反Clausius说法,说明假设I>R不成立。
Q1
T1
(
Q2
T2
Ti
Q3
T3
Q4
T4
... 0
Qi
)r 0
( T
Q
)r 0
结论:任意可逆 循环过程的热温 商之和等于零
如图任意可逆循环。在曲线上任意取A,B两点,把 循环分成AB和BA两个可逆过程。根据任意可逆 循环热温商的公式:
( T
B
Q
T2
Q2
2、开不成立克也不成立
T2
Q1 Q2
Q2
A
Q1
W
B
Q1
W
Q1
T1
热机吸热Q2,做功W,放 给低温热源Q1, Q2-Q1=W 若Q1可自动地由低到高温 热源,相当于从单一高温热源 吸热Q2 -Q1全部用来做功W。
T1
热机A吸热Q2,全部做功 W, Q2=W 带动另一可逆机由低热源 吸热Q1,放热 Q1+Q2 ,相当 于Q1自动从低传至高温热源。
第一节
自发过程的特征
一、自发过程(spontaneous process) 任其自然、无需施加任何外力,就能自动发生 的过程。 例如:水:(地势)高低,气体:(压力)大 小,热:(温度):高低,…… 二、自发过程的共同特征(spontaneous process) 1、自发过程具有方向性和限度;
物理化学热力学第二定律完整ppt课件

of Thermodynamics)
克劳修斯(Clausius)的说法:“不可能把热从低 温物体传到高温物体,而不引起其它变化。”
开尔文(Kelvin)的说法:“不可能从单一热源取出 热使之完全变为功,而不发生其它的变化。” 后来 被奥斯特瓦德(Ostward)表述为:“第二类永动机是 不可能造成的”。
可逆过程) S(相变)TH(相 (相变变))
(3)理想气体(或理想溶液)的等温混合过程,并
符合分体积定律,即
xB
VB V总
m ixSR nBlnxB B
精选ppt课件2021
16
等温过程的熵变
例1:1mol理想气体在等温下通过:(1)可逆膨胀, (2)真空膨胀,体积增加到10倍,分别求其熵变。
解:(1)可逆膨胀
Q R inV ,C m T i T 1 niR lV n V 1 2 T nV ,C m T 1 T i
QRi nRTi lnVV12
结论:
始终态相同,途径不同,过程的热 QRi 亦不同。但是
QRi nRlnV2 对所有的可逆途径均相等。
Ti
V1
精选ppt课件2021
6
2.2.2 熵函数
(1) 焦耳热功当量中功自动转变成热;
(2) 气体向真空膨胀;
(3) 热量从高温物体传入低温物体;
(4) 浓度不等的溶液混合均匀;
(5) 锌片与硫酸铜的置换反应等,
它们的逆过程都不能自动进行。当借助外力,体系恢复
原状后,会给环境留下不可磨灭的影响。
精选ppt课件2021
2
2.2 热力学第二定律(The Second Law
第二类永动机:从单一热源吸热使之完全变为功而不 留下任何影响。
克劳修斯(Clausius)的说法:“不可能把热从低 温物体传到高温物体,而不引起其它变化。”
开尔文(Kelvin)的说法:“不可能从单一热源取出 热使之完全变为功,而不发生其它的变化。” 后来 被奥斯特瓦德(Ostward)表述为:“第二类永动机是 不可能造成的”。
可逆过程) S(相变)TH(相 (相变变))
(3)理想气体(或理想溶液)的等温混合过程,并
符合分体积定律,即
xB
VB V总
m ixSR nBlnxB B
精选ppt课件2021
16
等温过程的熵变
例1:1mol理想气体在等温下通过:(1)可逆膨胀, (2)真空膨胀,体积增加到10倍,分别求其熵变。
解:(1)可逆膨胀
Q R inV ,C m T i T 1 niR lV n V 1 2 T nV ,C m T 1 T i
QRi nRTi lnVV12
结论:
始终态相同,途径不同,过程的热 QRi 亦不同。但是
QRi nRlnV2 对所有的可逆途径均相等。
Ti
V1
精选ppt课件2021
6
2.2.2 熵函数
(1) 焦耳热功当量中功自动转变成热;
(2) 气体向真空膨胀;
(3) 热量从高温物体传入低温物体;
(4) 浓度不等的溶液混合均匀;
(5) 锌片与硫酸铜的置换反应等,
它们的逆过程都不能自动进行。当借助外力,体系恢复
原状后,会给环境留下不可磨灭的影响。
精选ppt课件2021
2
2.2 热力学第二定律(The Second Law
第二类永动机:从单一热源吸热使之完全变为功而不 留下任何影响。
《物理化学》第2章

热不是系统的状态函数,所以要分别计算三 个过程的热: 理想气体定温过程,U=0,Q= -W, 计算W即可
实际过程的热温商:
2.热由高温物体传向低温物体:
高温热源T2 Q’=Q1+W Q=W 做功W 吸热Q1 低温热源T1 冷冻机做功后,系统(两个热源)恢复原状,… 传热Q1
结果环境失去功W,得到热Q ,环境是否能恢复原状, 决定于热Q能否全部转化为功W而不引起任何其它变化 ?
3.化学反应:
Cd(s)+PbCl2(aq)=CdCl2(aq)+Pb(s)
用一闭合曲线代表任意可逆循环。在曲线上任 意取A,B两点,把循环分成AB和BA两个可逆过 程,即: A B A
根据任意可逆循环热温商的公式:
B
Qr
Qr Qr 0 T T B T A
B A
p T
Qr
热力学第二定律的提出
19世纪初,资本主义工业生产已经很发达,迫切需要解
决动力问题。当时人们已经认识到能量守恒原理,试图制
造第一类永动机已宣告失败,然而人们也认识到能量是可 以转换的。于是,人们就想到空气和大海都含有大量的能
量,应该是取之不尽的。有人计算若从大海中取热做功,
使大海温度下降1℃,其能量可供全世界使用100年…。于 是人们围绕这一设想,设计种种机器,结果都失败了。这 个问题的实质可归结为热只能从高温物体自动传向低温物 体,没有温差就取不出热来(即从单一热源吸热)。
环境中吸热全部变为功,但体积变大了,压力变小了。
3.“第二类永动机不可能造成”可用来判断过程的方
向。
热力学第二定律的提出是起源于热功转化的研究,寻找相
应的热力学函数需从进一步分析热功转化入手(热机效率)。
实际过程的热温商:
2.热由高温物体传向低温物体:
高温热源T2 Q’=Q1+W Q=W 做功W 吸热Q1 低温热源T1 冷冻机做功后,系统(两个热源)恢复原状,… 传热Q1
结果环境失去功W,得到热Q ,环境是否能恢复原状, 决定于热Q能否全部转化为功W而不引起任何其它变化 ?
3.化学反应:
Cd(s)+PbCl2(aq)=CdCl2(aq)+Pb(s)
用一闭合曲线代表任意可逆循环。在曲线上任 意取A,B两点,把循环分成AB和BA两个可逆过 程,即: A B A
根据任意可逆循环热温商的公式:
B
Qr
Qr Qr 0 T T B T A
B A
p T
Qr
热力学第二定律的提出
19世纪初,资本主义工业生产已经很发达,迫切需要解
决动力问题。当时人们已经认识到能量守恒原理,试图制
造第一类永动机已宣告失败,然而人们也认识到能量是可 以转换的。于是,人们就想到空气和大海都含有大量的能
量,应该是取之不尽的。有人计算若从大海中取热做功,
使大海温度下降1℃,其能量可供全世界使用100年…。于 是人们围绕这一设想,设计种种机器,结果都失败了。这 个问题的实质可归结为热只能从高温物体自动传向低温物 体,没有温差就取不出热来(即从单一热源吸热)。
环境中吸热全部变为功,但体积变大了,压力变小了。
3.“第二类永动机不可能造成”可用来判断过程的方
向。
热力学第二定律的提出是起源于热功转化的研究,寻找相
应的热力学函数需从进一步分析热功转化入手(热机效率)。
大学物理化学 热力学第二定律

说明:
(1)隔离体系中所发生的一切不可逆过程,
都使其熵值增加: 过程方向的标志;
dS隔离,这0 是自发
(2)隔离体系中所发生的一切可逆过程, 其熵值都保持不变:dS隔离 0 ,这是体 系已达到平衡态的标志。平衡态是自发 过程的限度;
(3)隔离体系不可能发生使其熵值减少的 过程。
熵增加原理:隔离体系所发生的一切自 发过程都是朝着使其熵值增加的方向进 行,一直到隔离体系的熵值达到最大为 止,即体系处于平衡态。
三、熵的物理意义
1.自发过程的本质 自发过程的方向性归结为功热转换的不 可逆性。
热:分子混乱运动的表现;
功:一种稳定有序运动的表现;
功热转换:分子由有序状态自发地变为 无序状态,即混乱度增加。无序运动却 不会自动地变为有序运动。
从微观上讲:
热功转换不可逆性是分子运动由混乱程 度较小的状态自发地向混乱程度较大的 状态变化的必然结果。一切不可逆过程 都是向混乱度增加的方向进行。
RT2
ln V4 V3
CV ,m (T2
T1)
RT1
ln
V2 V1
RT2
ln V4 V3
TV 1 常数,有:
T1V2 1 T2V3 1,T2V4 1 T1V1 1
V2 V3
1
V1 V4
1
V2 V1
nA TA
恒容
nB TB
变温
nA T’
n=nA+nB T’
恒温
膨胀
nB T’
S S A S B
S A
nA .CV .m
ln
(1)隔离体系中所发生的一切不可逆过程,
都使其熵值增加: 过程方向的标志;
dS隔离,这0 是自发
(2)隔离体系中所发生的一切可逆过程, 其熵值都保持不变:dS隔离 0 ,这是体 系已达到平衡态的标志。平衡态是自发 过程的限度;
(3)隔离体系不可能发生使其熵值减少的 过程。
熵增加原理:隔离体系所发生的一切自 发过程都是朝着使其熵值增加的方向进 行,一直到隔离体系的熵值达到最大为 止,即体系处于平衡态。
三、熵的物理意义
1.自发过程的本质 自发过程的方向性归结为功热转换的不 可逆性。
热:分子混乱运动的表现;
功:一种稳定有序运动的表现;
功热转换:分子由有序状态自发地变为 无序状态,即混乱度增加。无序运动却 不会自动地变为有序运动。
从微观上讲:
热功转换不可逆性是分子运动由混乱程 度较小的状态自发地向混乱程度较大的 状态变化的必然结果。一切不可逆过程 都是向混乱度增加的方向进行。
RT2
ln V4 V3
CV ,m (T2
T1)
RT1
ln
V2 V1
RT2
ln V4 V3
TV 1 常数,有:
T1V2 1 T2V3 1,T2V4 1 T1V1 1
V2 V3
1
V1 V4
1
V2 V1
nA TA
恒容
nB TB
变温
nA T’
n=nA+nB T’
恒温
膨胀
nB T’
S S A S B
S A
nA .CV .m
ln
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小结: 小结:
体积功的计算
可逆过程:w = ∫ P外 dV = ∫ Pi dV = nRT ln V12 V
V1 V1 V2 V2 V2
非可逆过程:W = ∫ P外 dV
V1
以上过程功的大小的比较: 以上过程功的大小的比较: |W恒外压膨胀| < | W多次恒外压膨胀| < | W可逆膨胀|
能量守恒与转化定律就是热力学第一定律
一律数学表达式
热力学能
任意过程:U = U2 - U1 = Q + W 微变过程: du = δQ +δW
热和功的微变量 非状态函数, 不能用dQ、dW
内能(U): 内能(U):
能 能 能 能 能 的 能
体系内部能量的总和
内 能 包 括
U不
的
能和
能
一律的另一种说法:
对那些变化极快的过程,如爆炸,快速燃烧,系统与环境来不及发生热交换, 那个瞬间可近似作为绝热过程处理。
5)循环过程:系统从始态出发,经过一系列变化后又回到了始 循环过程: 循环过程 态的变化过程。在这个过程中,所有状态函数的变量等于零。
四、准静态过程
准静态过程的特征: 准静态过程的特征: ▲ 过程的推动力为无穷小量df ▲ 由一系列无限接近于平衡态的状态组成 ▲ 完成任一有限量的变化,均需无限长的时间 例: 汽缸内气体膨胀的过程
不提供能量,而能对外输出功的机器。
第一类永动机是不可能造成的。 第一类永动机是不可能造成的。 是不可能造成的
拿爱因斯坦开玩笑的明信片 ( 德国 )
伪科学: 伪科学:
1992年12月19日,《中华工商时报》: 介绍了哈尔滨司机王洪成
以水代油, 以水代油,无能发电神奇的故事
后来发现是假的 记者问: 记者问: 永动机是公认不存在的,你为何不怕碰壁还 要去发明? 王洪成答: 王洪成答: 我认为地球就是最大的永动机,哲学书上不 也说:世界是物质的,物质是运动的,而运动 是有规律的,所以我对永动机的看法与传统的 看法不一致。
膨胀过程: W1= -P0(V2-V1) = -0(V2-V1) = 0 U1 = 0
(记住,理想气体向真空膨胀)
Q1= U1 -W=0 -W 0 恢复过程: W2 = -nRTln(V1/V2) > 0 U2 =- U1 = 0
(状态函数的性质)
体系恢复后(复原): 体系恢复后(复原)
Q2= U2 -W2=- W2 <0
(功变热为能量降级的表现)
《化工热力学》,科学工业出版社。1987年,110面
§1.2
热力学第一定律
一、 热力学第一定律 到1850年,科学界公认能量守恒定律是 1850年 自然界的普遍规律之一。 自然界的普遍规律之一。 能量守恒与转化定律可表述为: 能量守恒与转化定律可表述为: 自然界的一切物质都具有能量, 自然界的一切物质都具有能量,能量有各 种不同的形式, 种不同的形式,它能从一种形式转化为另一种 形式,在转化过程中,能量的总值不变。 形式,在转化过程中,能量的总值不变。
二、内能是状态函数
■ 状态函数的性质
状态函数的改变值只与始、 状态函数的改变值只与始、终态有 关,而与变化的途径无关。 而与变化的途径无关。
途径
即: A
B
U = UB - UA
用反正法证明U为状态函数: 用反正法证明 为状态函数: 为状态函数 U 1 = ( UB - UA )1 U 2 = ( UB - UA )2 若 U 1 > U 2 ,建立循环过程: 循环过程: U = U 1 +(-U 2 ) = U 1 - U 2 > 0
w = ∫ P外dv = P外 (V2 V1 ) = P外V
V1
V2
③多此恒外压膨胀过程的功
( P1,P2,P3分别=常数)
w = p1(V ' V1) p2 (V '' V ' ) p3(V2 V '' ) =W +W2 +W3 1
④可逆膨胀过程的功 (P外 = P内-dP )
(过程的推动力为无穷小量)
结果:体系复原后,内能增加了,第一类永动机可以造成。 因此:必有U 1= U 2 必有
( 违反一律)
■
状态函数具有全微分的性质
若函数Z = Z ( x, y )有以下性质: dZ = ( Z ) y dx + ( Z ) x dy = Mdx + Ndy x y 并有: ( M ) x = ( N ) y y x 则函数Z ( x, y )具有全微分的性质, dZ为全微分。
H:焓
1.为什么要定义焓? 1.为什么要定义焓? 为什么要定义焓 为了使用方便,因为在等压、不作非体积功的条 件下,焓变等于等压热效应Qp。 容易测定 可求其它热力学函数的变化值 2. 焓 是 状 态 函 数 定义式中焓由状态函数组成 虽然具有能量的
3.焓不是能量,无确切的物理意义 焓不是能量, 单位,但不遵守能量守恒定律。
对可逆过程的说明: 对可逆过程的说明: 1. 可逆过程是极限的理想过程 (自然界的一切实际过程均是不可逆过程) 2.可逆过程可以作为过程进行的标准 (提高能量使用效率 实际-→ 可逆) 3.利用可逆过程可以计算状态函数的改变值 (有等量关系,可计算)
接近
七、焓 焓的定义式: 焓的定义式: H = U + pV
准静态过程是一种理想 的过程,实际并不存在严格 意义上的准静态过程,在某 些情况下可以近似地实现。
Water Beaker Gas Piston
如果该过程无摩擦力,则该准静态过程为
五、体积功的计算
当 Pi > P外时,气体膨胀
微体积功: 微体积功:
一定是P外,不是Pi
δW = -fdl= - P外Adl = - P外dV
最大功原理
体积功计算示例 1、计算理想气体发生以下变化过程的功: 、计算理想气体发生以下变化过程的功: 温度: 298.15K 体积: 0.01m3 压力: P
等压膨胀P外=P W=?
298.15K 0.02m3 P
标准压力: P = 105Pa=100KPa
解:W = -P外V = -105× (0.02-0.01) = -1000 J
常见的几种功: 常见的几种功: 功的种类 广义力 f 机械功 p 体积功 E 电 功 mg 势 能 σ 表面功
广义位移 dl dV dQ dh dA dn
功的表达式 δW=fdl - pdV EdQ mgdh σdA 化学功 dn
广义功的一般表达式为: 广义功的一般表达式为: δ W = f dx
对可逆过程的进一步理解: 对可逆过程的进一步理解:
强调 体系:恢复(必然的) 环境:恢复(理解好)
不可逆过程
环境留下了一个永久性的变化(痕迹)
失功,得热(能量降级的表现)
▲ 液体在沸点时蒸发 常见的可 逆过程 ▲ 固体在熔点时熔化 ▲ 可逆电池在E外=E±dE的条件下充放电
对不可逆过程的分析: 理想气体向真空膨胀 对不可逆过程的分析: 理想气体向真空膨胀(P外=0)
分子类型 单原子分子 线型分子 非线型分子 自由度 3 5 6 能量
3/ RT 2 5/ RT 2 6/ RT 2
CV,m
3/ R 2 5/ R 2 6/ R 2
4. 热容与温度的关系
物质的热容与温度有关。 物质的热容与温度有关。 例 C2H4 Cp与T的关系
热容与温度的函数关系因物质、物态和温度区间的不同 热容与温度的函数关系因物质、 而有不同的形式。 而有不同的形式。
dT δ QV dT
= ( H ) p T
= ( U )V T
热容与过程有关
3. H、 U与热容的关系 、 与热容的关系
H = Q p = ∫ C p dT U = QV = ∫ CV dT
等压热效应 等容热效应
公式使用的条件: 公式使用的条件:
无化学变化、无相变化、无非体积功, 无化学变化、无相变化、无非体积功,封闭体系 1mol理想气体的 V,m值: 理想气体的C 理想气体的
现在讨论以下过程的膨胀功(T=C): V1
4个条件下
V2
W=?
恒外压膨胀 可逆膨胀
条件: 条件: 自由膨胀 多次恒外压膨胀
①自由膨胀过程的功 (P外=0)
w = ∫ P外dv = P外 (V2 V1 ) = 0(V2 V1 ) = 0
V1
V2
结论:自由膨胀过程体系对外不做功
②恒外压膨胀过程的功(P外= C) 恒外压膨胀过程的功(
八、 热容
1. 热容的定义 体系在不发生相变化和化学变化的条件下,温 度每升高1度所需要吸收的热量。 即:
C =
δQ
dT
(J K-1)
摩尔热容(C ):物质量为1mol时的热容。 摩尔热容(Cm): 单位为: J K-1 mol-1 2. 热容的类型 等压热容: C p =
δQ p
等容热容: C V =
状态函数改变值的计算
的变化过程
成立的条件
■
任意过程:Z = Z 2 Z1 = ∫ dZ
1
2
循环过程:Z = Z 2 Z1 = ∫ dZ = 0
ห้องสมุดไป่ตู้
三、 过程与途径
二者的区别
1)等温过程:在变化过程中,系统的始态温度与终态温度相同, 等温过程: 等温过程 并等于环境温度。 2)等压过程:在变化过程中,系统的始态压力与终态压力相同, 等压过程: 等压过程 并等于环境压力。 3)等容过程:在变化过程中,系统的体积始终保持不变 等容过程: 等容过程 4)绝热过程:在变化过程中,系统与环境不发生热的传递。 绝热过程: 绝热过程
六、可逆过程
没有因摩擦等因素造成能量的耗散的过程 就是可逆过程。 可逆过程。 可逆过程
