1.1武汉理工大学材料科学基础课件全上(考研,张联盟)
材料科学基础(武汉理工大学,张联盟版)课后习题及答案 第三章

第三章答案3-2略。
3-2试述位错的基本类型及其特点。
解:位错主要有两种:刃型位错和螺型位错。
刃型位错特点:滑移方向与位错线垂直,符号⊥,有多余半片原子面。
螺型位错特点:滑移方向与位错线平行,与位错线垂直的面不是平面,呈螺施状,称螺型位错。
3-3非化学计量化合物有何特点?为什么非化学计量化合物都是n型或p型半导体材料?解:非化学计量化合物的特点:非化学计量化合物产生及缺陷浓度与气氛性质、压力有关;可以看作是高价化合物与低价化合物的固溶体;缺陷浓度与温度有关,这点可以从平衡常数看出;非化学计量化合物都是半导体。
由于负离子缺位和间隙正离子使金属离子过剩产生金属离子过剩(n型)半导体,正离子缺位和间隙负离子使负离子过剩产生负离子过剩(p型)半导体。
3-4影响置换型固溶体和间隙型固溶体形成的因素有哪些?解:影响形成置换型固溶体影响因素:(1)离子尺寸:15%规律:1.(R1-R2)/R1>15%不连续。
2.<15%连续。
3.>40%不能形成固熔体。
(2)离子价:电价相同,形成连续固熔体。
(3)晶体结构因素:基质,杂质结构相同,形成连续固熔体。
(4)场强因素。
(5)电负性:差值小,形成固熔体。
差值大形成化合物。
影响形成间隙型固溶体影响因素:(1)杂质质点大小:即添加的原子愈小,易形成固溶体,反之亦然。
(2)晶体(基质)结构:离子尺寸是与晶体结构的关系密切相关的,在一定程度上来说,结构中间隙的大小起了决定性的作用。
一般晶体中空隙愈大,结构愈疏松,易形成固溶体。
(3)电价因素:外来杂质原子进人间隙时,必然引起晶体结构中电价的不平衡,这时可以通过生成空位,产生部分取代或离子的价态变化来保持电价平衡。
3-5试分析形成固溶体后对晶体性质的影响。
解:影响有:(1)稳定晶格,阻止某些晶型转变的发生;(2)活化晶格,形成固溶体后,晶格结构有一定畸变,处于高能量的活化状态,有利于进行化学反应;(3)固溶强化,溶质原子的溶入,使固溶体的强度、硬度升高;(4)形成固溶体后对材料物理性质的影响:固溶体的电学、热学、磁学等物理性质也随成分而连续变化,但一般都不是线性关系。
武汉理工大学材料科学基础PPT

2、均态核化
1)临界晶核半径r*与相变活化能ΔGr* △Gr=△GV’+△GS=V△GV+AγLS 恒温、恒压下,从过冷液体中形成半径为r的球形新相,且 忽略应变能的变化
dGr 12 2 8r rls r GV 0 dr 3
4 3 2 Gr r GV 4r LS 3
相变过程的浓度条件: 相变过程的推动力:
应为过冷度,过饱和浓度,过饱和蒸汽压,即系统温度、浓 对溶液,用浓度c代替压力P 度和压力与相平衡时温度、浓度和压力之差值。
ΔG=RTlnc0/c
若是电解质溶液还要考虑电离度α,即一个摩尔能离解出 α个离子
c0 c c G RT ln RT ln(1 ) RT c c c
ΔGr=ΔGV ’(-)+ΔGS(+)
存在两种情况: (1)当热起伏较小时,形成的颗粒太小,新生相的颗粒 度愈小其饱和蒸汽压和溶解度都大,会蒸发或溶解而消失 于母相,而不能稳定存在。 将这种尺寸较小而不能稳定长大成新相的区域称为核胚。 (2)当热起伏较大时,界面对体积的比例就减少,当热 起伏达到一定大小时,系统自由能变化由正值变为负值, 这种可以稳定成长的新相称为晶核。
I n ns g
* r
单位体积液体中的临界核胚的数目:
Gr* * nr n exp( ) RT
2.相变过程的压力条件:
从热力学知道,在恒温可逆不作有用功时:
ΔG =VdP
对理想气体而言
RT G VdP dP RT ln P2 / P 1 P
当过饱和蒸汽压力为P的气相凝聚成液相或固相(其 平衡蒸汽压力为P0)时,有
ΔG=RTln P0/P
要使相变能自发进行,必须ΔG <0,即P>P0,也即要 使凝聚相变自发进行,系统的饱和蒸汽压应大于平衡蒸汽 压P0。这种过饱和蒸汽压差为凝聚相变过程的推动力。
武汉理工大学材料科学基础课后习题答案_第二版_张联盟

作业答案晶体学2、解:(1)h:k:l=1/2:1/3:1/6=3:2:1,∴该晶面的米勒指数为(321);(2)(321)5、解:MgO 为NaCl 型,O 2-做密堆积,Mg 2+填充空隙。
r O2- =0.140nm ,r Mg2+=0.072nm ,z=4,晶胞中质点体积:(4/3×πr O2-3+4/3×πr Mg2+ 3)×4,a=2(r ++r -),晶胞体积=a 3,堆积系数=晶胞中MgO 体积/晶胞体积=68.5%,密度=晶胞中MgO 质量/晶胞体积=3.49g/cm 3。
6、解:体心:原子数 2,配位数 8,堆积密度 55.5%; 面心:原子数 4,配位数 6,堆积密度 74.04%; 六方:原子数 6,配位数 6,堆积密度 74.04%。
7、解:u=z 1z 2e 2N 0A/r 0×(1-1/n)/4πε0,e=1.602×10-19,ε0=8.854×10-12,N 0=6.022×1023,NaCl :z 1=1,z 2=1,A=1.748,n Na+=7,n Cl-=9,n=8,r 0=2.81910-10m ,u NaCl=752KJ/mol ;MgO :z 1=2,z 2=2,A=1.748,n O 2-=7,n Mg2+=,n=7,r 0=2.1010m ,u MgO =392KJ/mol ;∵u MgO > u NaCl ,∴MgO 的熔点高。
9、解:设球半径为a ,则球的体积为4/3πa 3,求的z=4,则球的总体积(晶胞)4×4/3πa 3,立方体晶胞体积:(2a)3=16a 3,空间利用率=球所占体积/空间体积=74.1%,空隙率=1-74.1%=25.9%。
10、解:ρ=m/V 晶=1.74g/cm 3,V=1.37×10-22。
11、解:Si4+ 4;K+ 12;Al3+ 6;Mg2+ 6。
武汉理工大学材料科学基础PPT

第三节 固相反应动力学
一. 一般动力学关系
整个过程的速度将由其中速度最慢的一环控制。现 以金属氧化反应M +1/2O 2→ MO为例(图5)说明之。
O2
M MO
C0
C
δ
图5
由化学动力学和菲克第一定律,其反应速度V和扩散速度V分 别为:
dQ P V= = Kc dt
dQ D V= =D dt
dc dx
积分并考虑到初始条件:t = 0,G = 0,得 :
G
dG (1 G ) 2 / 3 K 0dt 0 0
t
F0(G) = 1-(1-G) 2/3 = K0t 球形或立方体颗粒: F0(G) = 1-(1-G) 1/3 = K0t 园柱形颗粒: F0(G) = 1-(1-G) 1/2 = K01t 平板状颗粒: F0(G) = G= K02t
图1 ZnO-Fe2O3混合物加热过程中性质的变化
1.对色剂的吸附性 2.对2CO+O22CO2反应的催化活性 3.物系的吸湿性 4.对2N2O2N2+O2反应的催化活性 5.x-射线图谱上ZnFe2O4的强度
(1)隐蔽期:约低于300℃。 (2)第一活化期:约在300~400℃之间。 (3)第一脱活期:约在400~500℃之间。 (4)二次活化期:约在500~620℃之间。 (5)二次脱活期或晶体形成期:约在620~750℃ 之间。 (6)反应产物晶格校正期:约>750℃。
固相反应
第一节 引言 第二节 固相反应机理 第三节 固相反应动力学 第四节 影响固相反应的因素
第一节 引言
一 固相反应分类 a. 从反应物的组成变化方面分类 b. 从固体中成分的传输距离来分类 c. 按反应性质分类 d.按参加反应的物质的状态可分为 e.按反应机理可分为 f.按生成物的位置分成
材料科学基础(武汉理工大学,张联盟版)课后习题及答案 第九章

第九章答案9-2什么叫相变?按照相变机理来划分,可分为哪些相变?解:相变是物质系统不同相之间的相互转变。
按相变机理来分,可以分为扩散型相变和非扩散型相变和半扩散型相变。
依靠原子或离子长距离扩散进行的相变叫扩散型相变。
非扩散型型相变指原子或离子发生移动,但相对位移不超过原子间距。
9-3分析发生固态相变时组分及过冷度变化相变驱动力的影响。
解:相变驱动力是在相变温度下新旧相的体自由能之差(),而且是新相形成的必要条件。
当两个组元混合形成固溶体时,混合后的体系的自由能会发生变化。
可以通过自由能-成分曲线来确定其相变驱动力的大小。
过冷度是相变临界温度与实际转变温度之差,相变形核的热力学条件是要有过冷度。
已知驱动力与过冷度之间的关系是:,这进一步说明了形核的热力学条件。
9-4马氏体相变具有什么特征?它和成核-生成相变有何差别?解:马氏体相变是替换原子经无扩散切变位移(均匀或不均匀)并由此产生形状改变和表面浮凸、曾不变平面应变特征的一级形核、长大的相变。
特征:具有剪切均匀整齐性、不发生原子扩散、相变速度快、相变有一定范围、有很大的切变型弹性应变能。
成核-生长过程中存在扩散相变,母相与晶相组成可相同可不同,转变速度较慢,无明显的开始和终了温度。
9-5试分析应变能及表面能对固态相变热力学、动力学及新相形状的影响。
解:物质的表面具有表面张力σ,在恒温恒压下可逆地增大表面积dA,则需功σdA,因为所需的功等于物系自由能的增加,且这一增加是由于物系的表面积增大所致,故称为表面自由能或表面能。
应变能和表面能可以影响相变驱动力的大小,和新相的形状。
9-6请分析温度对相变热力学及动力学的影响。
解:当温度降低,过冷度增大,成核势垒下降,成核速率增大,直至达到最大值;当温度继续下降,液相粘度增加,原子或分子扩散速率下降。
温度过高或过低对成核和生长速率均不利,只有在一定的温度下才有最大成核和生长速率。
9-7调幅分解与脱溶分解有何异同点?调幅分解所得到的显微结构与性能有何特点?解:调幅分解通过扩散偏聚由一种固溶体分解成与母相结构相同而成分不同的两种固溶体。
武汉理工大学材料科学基础PPT

二、由于间隙正离子,使金属离子过剩
Zn1+xO和Cdl+xO属于这种类型。过剩的金 属离子进入间隙位置,带正电,为了保持电中 性,等价的电子被束缚在间隙位置金属离子的 周围,这也是一种色心。例如ZnO在锌蒸汽中 加热,颜色会逐渐加深,就是形成这种缺陷的 缘故。
e
图2.23 由于间隙正离子,使金属离子过剩型结构(II)
2.6 非化学计量化合物
实际的化合物中,有一些化合物不符合定比定律,负离 子与正离子的比例并不是一个简单的固定的比例关系,这些 化合物称为非化学计量化合物。
非化学计量化合物的特点:
1)非化学计量化合物产生及缺陷浓度与气氛性质、压力有 关; 2)可以看作是陷浓度与温度有关,这点可以从平衡常数看出;
溶体,具有这样的缺陷。当在晶格中存在间
隙负离子时,为了保持电中牲,结构中引入 电子空穴,相应的正离子升价,电子空穴在 电场下会运动。因此,这种材料是P型半导体。
h
h
图2.25由于存在间隙负离子,使负离子过剩型的结构(III)
对于UO2+x中的缺焰反应可以表示为:
U 3O8 U 2O6 UO2 U 2O6 UO3
为什么TiO2-x是一种n型半导体?
色心、色心的产生及恢复
“色心”是由于电子补偿而引起的一种缺陷。
某些晶体,如果有x射线,γ射线,中子或电子辐照,往 往会产生颜色。由于辐照破坏晶格,产生了各种类型的点 缺陷。为在缺陷区域保持电中性,过剩的电子或过剩正电 荷(电子空穴)就处在缺陷的位置上。在点缺陷上的电荷,具 有一系列分离的允许能级。这些允许能级相当于在可见光 谱区域的光子能级,能吸收一定波长的光,使材料呈现某 种颜色。
把这种经过辐照而变色的晶体加热,能使缺陷扩散掉,
武汉理工大学材料科学基础全幻灯片PPT

用傅立叶分析法将实验获得的玻璃行射强度 曲线在傅立叶积分公式基础上换算成围绕某一 原子的径向分布曲线,再利用该物质的晶体结 构数据,即可以得到近距离内原子排列的大致 图形。在原子径向分布曲线上第一个极大值是 该原子与邻近原子间的距离,而极大值曲线下 的面积是该原子的配位数。图3-23表示SiO2 玻璃径向原子分布曲线。
小时 • 3-在800保温10分
钟和670保温20小 时
图3-20 27Na2O·73SiO2玻璃的X射线散射强度曲 线
5-同上,析晶玻璃, 保温6小时
4-同上连续薄雾析晶, 保温3小时
3-同上,有间断薄雾析晶, 保温3小时
2-玻璃表层部分, 在620℃保温1小时 1-原始玻璃
图3-21 33.3Na2O·66.7SiO2玻璃的反射光谱
I 石英玻璃
sinθ 0 0.04 0.08 0.12 0.16 0.20 0.24 λ
方石英
sinθ 0 0.04 0.08 0.12 0.16 0.20 0.24 λ
硅胶
sinθ 0 0.04 0.08 0.12 0.16 0.20 0.24 λ
图3-22 石英等物X射线衍射图
由图3-22还可看到,硅胶有显著的小角度 散射而玻璃中没有。这是由于硅胶是由尺寸 为1.0~10.0nm不连续粒子组成。粒子间有 间距和空隙,强烈的散射是由于物质具有不 均匀性的缘故。但石英玻璃小角度没有散射, 这说明玻璃是一种密实体,其中没有不连续 的粒子或粒子之间没有很大空隙。这结果与 微晶学说的微不均匀性又有矛盾。
四个参数的关系:
X+ Y= Z
X =2 R - Z
X+ 1/2Y= R
Y =2 Z - 2R
三、两大学说的比较与发展
材料科学基础(武汉理工大学,张联盟版)课后习题与答案第二章
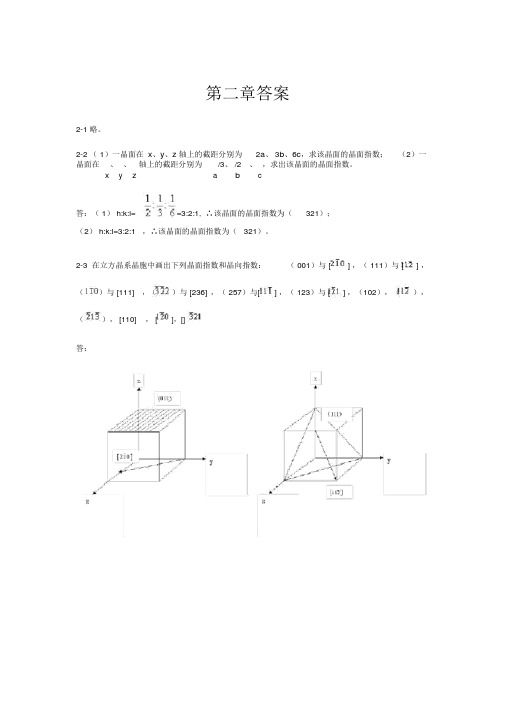
第二章答案2-1 略。
2-2 ( 1)一晶面在x、y、z轴上的截距分别为2a、 3b、6c,求该晶面的晶面指数;(2)一晶面在x 、、z轴上的截距分别为a/3、 /2、,求出该晶面的晶面指数。
y b c答:( 1) h:k:l==3:2:1, ∴该晶面的晶面指数为(321);(2) h:k:l=3:2:1 ,∴该晶面的晶面指数为( 321)。
2-3在立方晶系晶胞中画出下列晶面指数和晶向指数:( 001)与 [] ,( 111)与 [] ,()与 [111],()与 [236],( 257)与[] ,( 123)与 [] ,(102),(),(), [110], [],[]答:2-4 定性描述晶体结构的参量有哪些?定量描述晶体结构的参量又有哪些?答:定性:对称轴、对称中心、晶系、点阵。
定量:晶胞参数。
2-5 依据结合力的本质不同,晶体中的键合作用分为哪几类?其特点是什么?答:晶体中的键合作用可分为离子键、共价键、金属键、范德华键和氢键。
离子键的特点是没有方向性和饱和性,结合力很大。
共价键的特点是具有方向性和饱和性,结合力也很大。
金属键是没有方向性和饱和性的的共价键,结合力是离子间的静电库仑力。
范德华键是通过分子力而产生的键合,分子力很弱。
氢键是两个电负性较大的原子相结合形成的键,具有饱和性。
2-6 等径球最紧密堆积的空隙有哪两种?一个球的周围有多少个四面体空隙、多少个八面体空隙?答:等径球最紧密堆积有六方和面心立方紧密堆积两种,一个球的周围有8 个四面体空隙、6个八面体空隙。
2-7 n个等径球作最紧密堆积时可形成多少个四面体空隙、多少个八面体空隙?不等径球是如何进行堆积的?答: n 个等径球作最紧密堆积时可形成n 个八面体空隙、2n 个四面体空隙。
不等径球体进行紧密堆积时,可以看成由大球按等径球体紧密堆积后,小球按其大小分别填充到其空隙中,稍大的小球填充八面体空隙,稍小的小球填充四面体空隙,形成不等径球体紧密堆积。
武汉理工大学材料科学基础课后习题答案 第二版 张联盟

分类
形成原因
形成条件
缺陷反应
化学式
溶解度、缺陷浓度
热缺陷
肖特基
弗伦克尔
热起伏
T>0k
O VM’’+ Vx··
MM Mi··+ VM’’
MX
MX
只受温度控制
固溶体
无限,有限,置换,间隙
搀杂
溶解
大小,电负性,电价,结构
无:受温度控制
有:搀杂量<固溶度 受温度控制
22、解:(1)有两种配位多面体,[SiO4],[MgO6],同层的[MgO6]八面体共棱,如59[MgO6]和49[MgO6]共棱75O2-和27O2-,不同层的[MgO6]八面体共顶,如1[MgO6]和51[MgO6]共顶是22O2-,同层的[MgO6]与[SiO4]共顶,如T[MgO6]和7[SiO4]共顶22O2-,不同层的[MgO6]与[SiO4]共棱,T[MgO6]和43[SiO4]共28O2-和28O2-;
14、解:
固溶体
机械混合物
化合物
形成原因
以原子尺寸“溶解”生成
粉末混合
原子间相互反映生成
相数
单相均匀
多相
单相均匀
化学计量
不遵守定比定律
/
遵守定比定律
化学组成
不确定
有几种混合物就有多少化学组成
确定
15、解:固溶体、晶格缺陷、非化学计量化合物都是点缺陷,是晶体结构缺陷,都是单相均匀的固体,结构同主晶相。
将化学式与组成式一一对应,求出待定参数x,由于O2-的量不同,将O2-的量化为1
Al0.16/1.16Mg0.92/1.16O Al2x/1+xMg1-2x/1+xO x=0.074,化学式Al0.148Mg0.852O1.074
材料科学基础(张联盟版)课后习题与答案

2-26硅酸盐晶体结构有何特点?怎样表征其学式?
答:硅酸盐晶体结构非常复杂,但不同的结构之间具有下面的共同特点:
(1)结构中的Si4+离子位于O2-离子形成的四面体中心,构成硅酸盐晶体的基本结构单元[SiO4]四面体。Si-O-Si是一条夹角不等的折线,一般在145°左右。
所以 ,即O2-电价饱和。
2-21(1)画出O
解(1)略
(2)四面体空隙数与O2-数之比为2:1,八面体空隙数与O2-数之比为1:1
2-22根据电价规则,在下面情况下,空隙内各需填入何种价数的阳离子,并对每一种结构举出—个例子。(1)所有四面体空隙位置均填满;(2)所有八面体空隙位置均填满;(3)填满—半四面体空隙位置;(4)填满—半八面体空隙位置。
答:设晶胞的体积为V,相对原子质量为M,则晶胞体积 nm3
2-13根据半径比关系,说明下列离子与O
答:对于Si4+、K+、Al3+、Mg2+来说,其 依次是0.295、0.99、0.43、0.59;依据正离子配位数与正负离子半径比的关系知配位数为:Si4+4;K+8;Al3+6;Mg2+6。
2-14为什么石英不同系列变体之间的转化温度比同系列变体之间的转化温度高得多?
层状
3
平面层
[Si4O10]4-
4:10
架状
4
骨架
[SiO4]4-
[(AlxSi4-x)O8]x-
1:4
1:4
2-28下列硅酸盐矿物各属何种结构类型:Mg
答:分别为岛状;架状;单链;层状(复网);组群(双四面体)。
2-29根据Mg
解:(1)有两种配位多面体,[SiO4],[MgO6],同层的[MgO6]八面体共棱,如59[MgO6]和49[MgO6]共棱75O2-和27O2-,不同层的[MgO6]八面体共顶,如1[MgO6]和51[MgO6]共顶是22O2-,同层的[MgO6]与[SiO4]共顶,如T[MgO6]和7[SiO4]共顶22O2-,不同层的[MgO6]与[SiO4]共棱,T[MgO6]和43[SiO4]共28O2-和28O2-;
武汉理工大学材料科学基础PPT.

AHale Waihona Puke C图1-5 等径球体在平面上的最紧密堆积
等径球质点堆积
面心立方最紧密堆积和六方最紧密堆积
球体在空间的堆积是按照 ABAB……的层序来堆积。
这样的堆积中可以取出一个六方晶胞,称为六方最紧密堆
积(A3型)。 另一种堆积方式是按照 ABCABC…… 的堆积方式。 这样的堆积中可以取出一个面心立方晶胞,称为面心立方 最紧密堆积。面心立方堆积中, ABCABC…… 重复层面
面心立方最紧密堆积
1 6 1 2 3 4 6 5 4
2
3
5
A
1
6 5 4 2 3
B C
面心立方最紧密堆积
A C B A C B A
ABCABC……, 即每三层重复一次
面心立方最紧密堆积
1 6 5
2 3 4
面心立方最紧密堆积
面心立方晶胞 ——面心立方最紧密堆积
C
B A
密排面
六方最紧密堆积
1 2
一种是八面体空隙,由 6个球体构成,球心连线形成一个
正八面体。
显然,由同种球组成的四面体空隙小于八面体空隙。 四面体空隙 八面体空隙
最紧密堆积的空隙:
最紧密堆积中空隙的分布情况:
等径球质点堆积
每个球体周围有多少个四面体空隙? 1个球的周围有 每个球体周围有多少个八面体空隙? 8个四面体空隙
1个球的周围有 6个八面体空隙
质点堆积方式:
根据质点的大小不同,球体最紧密堆积方式分为等径
球和不等径球两种情况。
最密堆积方 式 等径球的堆积
面心立方最紧密堆积 六方最紧密堆积
最紧密堆积中的空隙 不等径球的堆积 先堆大球,小球填积中的空隙
等径球质点堆积
材料科学基础(武汉理工大学,张联盟版)课后习题及答案 第四章

第四章答案4-1略。
4-2试简述硅酸盐熔体聚合物结构形成的过程和结构特点。
解:聚合物的形成是以硅氧四面体为基础单位,组成大小不同的聚合体。
可分为三个阶段:初期:石英的分化,架状[SiO4]断裂,在熔体中形成了各种聚合程度的聚合物。
中期:缩聚并伴随变形一般链状聚合物易发生围绕Si-O轴转动同时弯曲,层状聚合物使层本身发生褶皱、翘曲、架状聚合物热缺陷增多,同时Si-O-Si键角发生变化。
[SiO4]Na4+[Si2O7]Na6——[Si3O10]Na8+Na2O(短键)3[Si3O10]Na8——[Si6O18]Na12+2Na2O(六节环)后期:在一定时间和温度范围内,聚合和解聚达到平衡。
缩聚释放的Na2O又能进一步侵蚀石英骨架而使其分化出低聚物,如此循环,直到体系达到分化-缩聚平衡为止。
4-3试用实验方法鉴别晶体SiO2、SiO2玻璃、硅胶和SiO2熔体。
它们的结构有什么不同?解:利用X射线检测。
晶体SiO2——质点在三维空间做有规律的排列,各向异性。
SiO2熔体——内部结构为架状,近程有序,远程无序。
SiO2玻璃——各向同性。
硅胶——疏松多孔。
4-4影响熔体粘度的因素有哪些?试分析一价碱金属氧化物降低硅酸盐熔体粘度的原因。
解:(1)影响熔体粘度的主要因素:温度和熔体的组成。
碱性氧化物含量增加,剧烈降低粘度。
随温度降低,熔体粘度按指数关系递增。
(2)通常碱金属氧化物(Li2O、Na2O、K2O、Rb2O、Cs2O)能降低熔体粘度。
这些正离子由于电荷少、半径大、和O2-的作用力较小,提供了系统中的“自由氧”而使O/Si比值增加,导致原来硅氧负离子团解聚成较简单的结构单位,因而使活化能减低、粘度变小。
4-5熔体粘度在727℃时是107Pa·s,在1156℃时是103Pa·s,在什么温度下它是106Pa·s?解:根据727℃时,η=107Pa·s,由公式得:(1)1156℃时,η=103Pa·s,由公式得:(2)联立(1),(2)式解得∴A=-6.32,B=13324当η=106Pa·s时,解得t=808.5℃。
材料科学基础 第二版(张联盟 著)课后习题答案武汉理工大学出版

材料科学基础第二版(张联盟著)课后习题答案武汉理工大学出版材料科学基础第二版(张联盟著)课后习题大家找到答案了吗?下面是为大家推荐一些材料科学基础第二版(张联盟著)课后习题答案和下载地址,希望大家有用哦。
2-1名词解释晶系晶胞晶胞参数空间点阵晶面指数晶格能原子半径与离子半径配位数离子极化同质多晶与类质同晶正尖晶石与反正尖晶石反萤石结构铁电效应压电效应热释电效应电光效应2-2(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求该晶面的晶面指数;(2)一晶面在x、y、z轴上的截距分别为a/3、b/2、c,求出该晶面的晶面指数。
2-3在立方晶系晶胞中画出下列晶面指数和晶向指数:(001)与[],(111)与[],()与[111],()与[236],(257)与[],(123)与[],(102),(),(),[110],[,[],[]2-4定性描述晶体结构的参量有哪些?定量描述晶体结构的参量又有哪些?2-5依据结合力的本质不同,晶体中的键合作用分为哪几类?其特点是什么?2-6等径球最紧密堆积的空隙有哪两种?一个球的周围有多少个四面体空隙、多少个八面体空隙?2-7n个等径球作最紧密堆积时可形成多少个四面体空隙、多少个八面体空隙?不等径球是如何进行堆积的?2-8写出面心立方格子的单位平行六面体上所有结点的坐标。
2-9计算面心立方、密排六方晶胞中的原子数、配位数、堆积系数。
2-10根据最密堆积原理,空间利用率越高,结构越稳定,金刚石结构的空间利用率很低(只有34.01%),为什么它也很稳定?2-11证明等径圆球六方最密堆积的空隙率为25.9%。
2-12金属镁原子作六方密堆积,测得它的密度为1.74g/cm3,求它的晶胞体积。
2-13根据半径比关系,说明下列离子与O2—配位时的配位数各是多少?已知rO2-=0.132nm,rSi4+=0.039nm,rK+=0.131nm,rAl3+=0.057nm,rMg2+=0.078nm。
材料科学基础(武汉理工大学,张联盟版)课后习题及答案__第五章[1]
![材料科学基础(武汉理工大学,张联盟版)课后习题及答案__第五章[1]](https://img.taocdn.com/s3/m/d1c8315b312b3169a451a427.png)
为了使玻璃消除永久应力,封接件需经退火,良好的退火对封接质量有着重要的意义。退火后的封接件不应快速冷却,因为金属比玻璃的导热性好,因而金属比玻璃冷得快。当金属和玻璃的膨胀系数相同时,这种不同的冷却速率导致金属比玻璃收缩大,当玻璃失去流动性后,金属就不得不在窄的范围内冷却,两者长度的改变影响到玻璃和金属的附着能力。如果开始快速冷却的温度超过玻璃的影响
解:吸附:固体表面力场与被吸附分子发生的力场相互作用的结果,发生在固体表面上,分物理吸附和化学吸附;
粘附:指两个发生接触的表面之间的吸引,发生在固液界面上;
铜丝放在空气中,其表面层被吸附膜(氧化膜)所覆盖,焊锡焊接铜丝时,只是将吸附膜粘在一起,锡与吸附膜粘附的粘附功小,锉刀除去表面层露出真正铜丝表面(去掉氧化膜),锡与铜相似材料粘附很牢固。
必须指出,封接处大量气泡(尤其是成串气泡)的存在是很有害的,因为它能降低机械强度和造成慢性漏气。溶解在金属中的气体在封接加热时放出,是产生气泡的一个原因,这在钨、钼、铂等金属是少见的,而镍、铁及其合金较多。为此,除选用真空治炼法制得的金属外,通常可利用在真空中或氢气中加热金属预先去气来消除此因素。产生气泡的另一个原因是碳,特别是金属表面层中的碳,在封接时会氧化成二氧化碳气体而造成气泡,这在镍、铁及其合金中亦较其它金属为严重。解决过个问题的方法是把金属放在湿氢或真空中退火,以去掉气体和碳。从面杜绝气泡的产生。遇火温度一般在900~I100℃,时间根据金属的厚度而定。
解:(1)由于表面张力的存在,使弯曲表面上产生一个附加压力,如果平面的压力为P0,弯曲表面产生的压力差为△P,则总压力为P=P0+△P。附加压力的正负取决于曲面的曲率,凸面为正,凹面为负。
材料科学基础(武汉理工大学,张联盟版)课后习题及答案 第四章

第四章答案4-1略。
4-2试简述硅酸盐熔体聚合物结构形成的过程和结构特点。
解:聚合物的形成是以硅氧四面体为基础单位,组成大小不同的聚合体。
可分为三个阶段:初期:石英的分化,架状[SiO4]断裂,在熔体中形成了各种聚合程度的聚合物。
中期:缩聚并伴随变形一般链状聚合物易发生围绕Si-O轴转动同时弯曲,层状聚合物使层本身发生褶皱、翘曲、架状聚合物热缺陷增多,同时Si-O-Si键角发生变化。
[SiO4]Na4+[Si2O7]Na6——[Si3O10]Na8+Na2O(短键)3[Si3O10]Na8——[Si6O18]Na12+2Na2O(六节环)后期:在一定时间和温度范围内,聚合和解聚达到平衡。
缩聚释放的Na2O又能进一步侵蚀石英骨架而使其分化出低聚物,如此循环,直到体系达到分化-缩聚平衡为止。
4-3试用实验方法鉴别晶体SiO2、SiO2玻璃、硅胶和SiO2熔体。
它们的结构有什么不同?解:利用X射线检测。
晶体SiO2——质点在三维空间做有规律的排列,各向异性。
SiO2熔体——内部结构为架状,近程有序,远程无序。
SiO2玻璃——各向同性。
硅胶——疏松多孔。
4-4影响熔体粘度的因素有哪些?试分析一价碱金属氧化物降低硅酸盐熔体粘度的原因。
解:(1)影响熔体粘度的主要因素:温度和熔体的组成。
碱性氧化物含量增加,剧烈降低粘度。
随温度降低,熔体粘度按指数关系递增。
(2)通常碱金属氧化物(Li2O、Na2O、K2O、Rb2O、Cs2O)能降低熔体粘度。
这些正离子由于电荷少、半径大、和O2-的作用力较小,提供了系统中的“自由氧”而使O/Si比值增加,导致原来硅氧负离子团解聚成较简单的结构单位,因而使活化能减低、粘度变小。
4-5熔体粘度在727℃时是107Pa·s,在1156℃时是103Pa·s,在什么温度下它是106Pa·s?解:根据727℃时,η=107Pa·s,由公式得:(1)1156℃时,η=103Pa·s,由公式得:(2)联立(1),(2)式解得∴A=-6.32,B=13324当η=106Pa·s时,解得t=808.5℃。
材料科学基础(武汉理工大学_张联盟版)课后习题及答案 第六章

第六章答案6-1略。
6-2什么是吉布斯相律?它有什么实际意义?解:相律是吉布斯根据热力学原理得出的相平衡基本定律,又称吉布斯相律,用于描述达到相平衡时系统中自由度数与组分数和相数之间的关系。
一般形式的数学表达式为F=C-P+2。
其中F为自由度数,C为组分数,P为相数,2代表温度和压力两个变量。
应用相率可以很方便地确定平衡体系的自由度数。
6-3固体硫有两种晶型,即单斜硫、斜方硫,因此,硫系统可能有四个相,如果某人实验得到这四个相平衡共存,试判断这个实验有无问题?解:有问题,根据相律,F=C-P+2=1-P+2=3-P,系统平衡时,F=0,则P=3,硫系统只能是三相平衡系统。
图6-1 图6-26-4如图6-1是钙长石(CaAl2Si2O)的单元系统相图,请根据相图回解:(1)六方、正交和三斜钙长石的熔点各是多少?(2)三斜和六方晶型的转变是可逆的还是不可逆的?你是如何判断出来的?(3)正交晶型是热力学稳定态?还是介稳态?解:(1)六方钙长石熔点约1300℃(B点),正钙长石熔点约1180℃(C点),三斜钙长石的熔点约为1750℃(A点)。
(2)三斜与六方晶型的转变是可逆的。
因为六方晶型加热到转变温度会转变成三斜晶型,而高温稳定的三斜晶型冷却到转变温度又会转变成六方晶型。
(3)正交晶型是介稳态。
6-5图6-2是具有多晶转变的某物质的相图,其中DEF线是熔体的蒸发曲线。
KE是晶型I 的升华曲线;GF是晶型II的升华曲线;JG是晶型III的升华曲线,回答下列问题:(1)在图中标明各相的相区,并写出图中各无变量点的相平衡关系;(2)系统中哪种晶型为稳定相?哪种晶型为介稳相?(3)各晶型之间的转变是可逆转变还是不可逆转变?解:(1)KEC为晶型Ⅰ的相区,EFBC过冷液体的介稳区,AGFB晶型Ⅱ的介稳区,JGA晶型Ⅲ的介稳区,CED是液相区,KED是气相区;(2)晶型Ⅰ为稳定相,晶型Ⅱ、Ⅲ为介稳相;因为晶型Ⅱ、Ⅲ的蒸汽压高于晶型Ⅰ的,即它们的自由能较高,有自发转变为自由能较低的晶型Ⅰ的趋势;(3)晶型Ⅰ转变为晶型Ⅱ、Ⅲ是单向的,不可逆的,多晶转变点的温度高于两种晶型的熔点;晶型Ⅱ、Ⅲ之间的转变是可逆的,双向的,多晶转变点温度低于Ⅱ、Ⅲ的熔点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
但只有在开发了铁和铜等新材料以后,蒸汽机才得
以使用并逐步推广。
第二次产业革命一直延续到20世纪中叶,以石
油开发和新能源广泛使用为突破口,大力发展飞机、
汽车和其他工业,支持这个时期产业革命的仍然是
新材料开发。如合金钢、铝合金以及各种非金属材 料的发展。
材料是当代文明的三大支柱之一
材料、能源、信息是当代社会文明和国民经
4. 复合材料
1.金属材料
金属材料是由化学元素周期 表中的金属元素组成的材料。可 分为由一种金属元素构成的单质 (纯金属);由两种或两种以上 的金属元素或金属与非金属元素
构成的合金。合金又可分为固溶
体和金属间化合物。
在103种元素中,除He,Ne,Ar等6种惰性元素和C、Si、N等16
种非金属元素外,其余81种为金属元素。除Hg之外,单质金属在
常温下呈现固体形态,外观不透明,具有特殊的金属光泽及良好
的导电性和导热性。在力学性质方面,具有较高的强度、刚度、 延展性及耐冲击性。 合金是由两种或两种以上的金属元素,或金属元素与非金属 元素熔合在一起形成的具有金属特性的新物质。合金的性质与组
成合金的各个相的性质有关,同时也与这些相在合金中的数量、
天然矿物原料经过粉碎混练、成型、煅烧等过程而制
成的各种制品。包括日用陶瓷、卫生陶瓷、建筑陶瓷、 化工陶瓷、电瓷以及其它工业用陶瓷。 见表0-1。
表0-1 普通陶瓷的分类方法
类 别 餐具 茶具、咖啡具 酒具 文具 陈设瓷(美术瓷) 建筑陶瓷 建筑卫生陶瓷 卫生瓷砖 低压电瓷 电瓷 高压电瓷 超高压电瓷 耐酸砖 化工瓷 耐酸容器 耐酸机械(部件) 化学瓷 主 要 种 类 用 途 中餐具(盘、碗、碟、羹、壶、杯等) 西餐具(碗、盘、碟、糖缸、奶盅、壶、杯等) 日用陶瓷 茶盘、水果盘、点心盘、杯、壶、碟等 酒壶、酒杯、杯托、托盘 笔筒、笔洗、水盂、EP 色盒、笔架 花瓶、灯具、雕塑瓶、薄胎碗等 玻化砖(渗花或非渗花) 、彩釉砖、锦砖(马赛克) 、内墙砖、 外墙砖、腰线砖、广场砖、劈裂砖、园林陶瓷等 洗面器、大便器、小便器、洗涤器、水箱、水槽、存水弯、 肥皂盒、手纸盒、淋浴盒 用于 1kV 以下的电瓷 用于 1kV 以上的电瓷、如普通高压瓷、铝质高强度瓷 用于 500kV 以上的电瓷 耐酸砖、耐酸耐温砖 储酸缸、酸洗槽、电解槽、耐酸塔等 耐酸离心泵、风机、球磨机等 瓷坩埚、蒸发皿、研钵、漏斗、过滤板、燃烧舟等
硫铝酸盐水泥、氟铝酸盐水泥以及以工业废渣和地方
材料为主要组分的水泥。目前水泥品种已达一百多种。
通用水泥为大量土木工程所使用的一般用途的水泥,
如硅酸盐水泥、普通硅酸盐水泥、矿渣硅酸盐水泥、 火山灰质硅酸盐水泥、粉煤灰硅酸盐水泥和复合硅酸 盐水泥等。
专用水泥指有专门用途的水泥,如油井水泥、砌筑水 泥等。
表0-2 中国日用瓷分类标准
类 性质 别 及特 吸水率 征 (%) 特征
粗陶器
陶器 普通陶器 细陶器 炻瓷器
>15
≤12 ≤15 ≤3 ≤1 ≤0.5
不时施釉,制作粗糙 断面颗粒较粗,气孔较大,表面施釉, 制作不够精细
断面颗粒较细,气孔较小,施釉或不施 釉,制作不够精细 透光性差,通常胎体较厚,呈色,断口 呈石状,制作精细
固溶体和间隙固溶体。
在置换固溶体中,溶质原子位于溶剂晶体结构的晶格格点上; 在间隙固溶体中,溶质原子位于溶剂晶体结构的晶格间隙。溶质 原子在固溶体中的分布可以是随机的,即呈统计分布;也可以是 部分有序或完全有序,在完全有序固溶体中,异类原子趋于相邻,
这种结构亦称为超点阵或超结构。
此外,合金中溶质原子还可能形成丛聚,即同类 原子趋于相邻。丛聚可以呈随机弥散分布。事实上,实 验中还没有见到溶质原子呈完全随机分布的固溶体。因 此,只能在宏观尺度上认为处于热力学平衡态的固溶体 是真正均匀的,而原子尺度上并不要求它也是均匀的。 不同类型固溶体中原子排列情况示于图0.1。
0.1 材料分类
0.1.1 材料按化学组成(或基本组成)分类 0.1.2 根据材料的性能分类 0.1.3 材料按服役的领域来分类 0.1.4 材料按结晶状态分类 0.1.5 材料按材料的尺寸分类
按物理性质可分为:导电材料、绝缘材料、半导体材料、
磁性材料、透光材料、高强度材料、高温材料、超硬材料 等。
按物理效应分为:压电材料、热电材料、铁电材料、非线 性光学材料、磁光材料、电光材料、声光材料、激光材料 等。
按用途分为:电子材料、电工材料、光学材料、感光材料、
耐酸材料、研磨材料、耐火材料、建筑材料、结构材料、
包装材料等。
0.1.1 按化学组成(或基本组成)分类:
1. 金属材料 2. 无机非金属材料 3泥则是某种性能比较突出的一类水泥,如快硬
硅酸盐水泥、抗硫酸盐硅酸盐水泥、中热硅酸盐水泥、
膨胀硫铝酸盐水泥、自应力铝酸盐水泥等。
传统的无机非金属材料 之四:耐火材料
耐火材料是指耐火度不低于1580℃的无机非金属材料。
它是为高温技术服务的基础材料。尽管各国对其定义不同,
但基本含义是相同的,即耐火材料是用作高温窑炉等热工设 备的结构材料,以及用作工业高温容器和部件的材料,并能 承受相应的物理化学变化及机械作用。 大部分耐火材料是以天然矿石(如耐火粘土、硅石、
济的三大支柱,是人类社会进步和科学技术发展
的物质基础和技术先导。
材料是全球新技术革命的四大标志之一(新 材料技术、新能源技术、信息技术、生物技 术)。
什么是材料科学?
材料科学是一门以固体材料为研究对象,以固体物理、 热力学、动力学、量子力学、冶金、化工为理论基础的边缘 交叉基础应用学科,它运用电子显微镜、X-射线衍射、热谱、 电子离子探针等各种精密仪器和技术,探讨材料的组成、结 构、制备工艺和加工使用过程与其机械、物理、化学性能之
传统的无机非金属材料 之三:水泥
水泥是指加入适量水后 可成塑性浆体,既能在空气 中硬化又能在水中硬化,并 能够将砂、石等材料牢固地 胶结在一起的细粉状水硬性
材料。
水泥的种类很多,按其用途和性能可分为:通用
水泥、专用水泥和特性水泥三大类;按其所含的主要
水硬性矿物,水泥又可分为硅酸盐水泥、铝酸盐水泥、
功能陶瓷包括:装置瓷(即电绝缘瓷)、电容器陶
瓷、压电陶瓷、磁性陶瓷(又称为铁氧体)、导电陶瓷、
超导陶瓷、半导体陶瓷(又称为敏感陶瓷)、热学功能 陶瓷(热释电陶瓷、导热陶瓷、低膨胀陶瓷、红外辐射 陶瓷等)、化学功能陶瓷(多孔陶瓷载体等)、生物功 能陶瓷等。
根据陶瓷坯体结构及其基本物理性能的差 异,陶瓷制品可分为陶器和瓷器,见表0-2 。 陶器包括粗陶器、普陶器和细陶器。陶器的坯 体结构较疏松,致密度较低,有一定吸水率, 断口粗糙无光,没有半透明性,断面成面状或 贝壳状。
(a) 随机置换固溶 体
(b) 有序置换固溶体
(c) 随机间隙固溶体
(d) 固溶体中的溶质丛聚
图0.1 不同类型固溶体中原子排列示意图
合金中的金属间化合物:
金属间化合物可分为三类,即由负电性决定的原子
价化合物(简称价化合物)、由电子浓度决定的电子
化合物(亦称为电子相)以及由原子尺寸决定的尺寸 因素化合物。除了这三类由单一元素决定的典型金属 间化合物外,还有许多金属间化合物,其结构由两个 或多个因素决定,称之为复杂化合物。
形状及分布有关。
合金又分为固溶体和金属间化合物。 当金属的晶体结构保持溶剂组元的晶体结构时, 这种合金称为一次固溶体或端际固溶体,简称为固 溶体。 金属元素与其它金属元素或非金属元素之间形成
合金时,除固溶体外,还可能形成金属间化合物。
合金中的固溶体: 根据溶质原子在溶剂晶体结构中的位置,固溶体可分为置换
2. 无机非金属材料
无机非金属材料是由硅酸盐、铝酸盐、硼酸盐、磷酸
盐、锗酸盐等原料和(或)氧化物、氮化物、碳化物、硼
化物、硫化物、硅化物、卤化物等原料经一定的工艺制备
而成的材料。是除金属材料、高分子材料以外所有材料的
总称。它与广义的陶瓷材料有等同的含义。无机非金属材 料种类繁多,用途各异,目前还没有统一完善的分类方法。 一般将其分为传统的(普通的)和新型的(先进的)无机 非金属材料两大类。
特种陶瓷是用于各种现代工业及尖端科学技术领域
的陶瓷制品。包括结构陶瓷和功能陶瓷。结构陶瓷
主要用于耐磨损、高强度、耐高温、耐热冲击、硬
质、高刚性、低膨胀、隔热等场所。功能陶瓷主要
包括电磁功能、光学功能、生物功能、核功能及其 它功能的陶瓷材料。
常见高温结构陶瓷包括:高熔点氧化物、碳化物、
硼化物、氮化物、硅化物。
普通玻璃包括日用玻璃、建筑玻璃、微晶玻璃、光学玻璃和
玻璃纤维等。
特种玻璃(亦称为新型玻璃)是指采用精制、高纯或新
型原料,通过新工艺在特殊条件下或严格控制形成过程制成的 一些具有特殊功能或特殊用途的玻璃。 特种玻璃包括SiO2 含量在85%以上或55%以下的硅酸盐 玻璃、非硅酸盐氧化物玻璃(硼酸盐、磷酸盐、锗酸盐、碲酸 盐、铝酸盐及氧氮玻璃、氧碳玻璃等)、非氧化物玻璃(卤化 物、氮化物、硫化物、硫卤化物、金属玻璃等)以及光学纤维 等。 根据用途不同,特种玻璃分为防辐射玻璃、激光玻璃、 生物玻璃、多孔玻璃、非线性光学玻璃和光纤玻璃等。
种无机非金属化合物经特殊的先进工艺制成的材料。
主要包括先进陶瓷、非晶态材料、人工晶体、无机
涂层、无机纤维等。
传统的无机非金属材料 之一:陶瓷
陶瓷按其概念和用途不同,
可分为两大类,即普通陶瓷和特
种陶瓷。 根据陶瓷坯体结构及其基本 物理性能的差异,陶瓷制品可分 为陶器和瓷器。
普通陶瓷即传统陶瓷,是指以粘土为主要原料与其它
菱镁矿、白云母等)为原料制造的。
按矿物组成分为氧化硅质、硅酸铝质、镁质、白云石
