分光光度法测定化学反应的 平衡常数
分光光度法测溴酚蓝的电离平衡常数

分光光度法测溴酚蓝的电离平衡常数【摘要】溴酚蓝(B.P.B)是一种酸碱指示剂,本身带有颜色且在有机溶剂里电离度很小,所以一般的化学分析法或其他物理化学方法很难测定其电离平衡常数。
然而用分光光度法可以先在蒸馏水的参照下测出 BPB的最大吸收波长,继而测出在最大吸收波长下对不同浓度的BPB溶液的吸收,从而根据贝尔-郎比定律求算出溴酚蓝的电离平衡常数。
【关键词】溴酚蓝,贝尔-郎比定律,分光光度法,最大吸收波长,电离平衡常数Measure the balance constant of ionization ofBromphenalblue by Spectrophotometer 【Abstract】BPB is a PH-indicator, and since it has a bright color itself and a low ionization in organic solvent, general chemical analysis , as well as some other physical methods come across a lot of difficulties in the determination of the ionization constant. However, with a spectrophotometer and an ionic analyzer, we can determinate the furthest absorbing wavelength of BPB with the help of blank corrective liquor of distilled water. Then a series of different copies of liquor of BPB with different acidity should be prepared and their absorbency should be measured by the spectrophotometer. At last, according to the Bel-lanbi’s law, we can compute the ionization constant of BPB through those datas.Keyword:Bromphenalblue, Bel-lanbi’s law, spectrophotometry, maximum absorption wavelength, ionization equilibrium constant【前言】根据BPB 在不同的电离度下有不同的吸光度测量BPB 的电离度,每种物质对于通过它的单色光的吸收具有选择性。
分光光度法测溴酚蓝的电离平衡常数

分光光度法测溴酚蓝的电离平衡常数摘要:溴酚蓝是一种弱电解质,可以作为酸碱指示剂。
溶液pH 不同,溴酚蓝电离程度亦不同,从而显示出不同的颜色。
溴酚蓝的分子和离子对光的最大吸收的位置是不同的,根据这一性质,用分光光度法测定不同酸碱条件下溶液的吸光度,再根据溶液浓度与吸光度的关系,求得溴酚蓝的电离平衡常数。
关键词:溴酚蓝,弱电解质,平衡常数,分光光度法Measurement of equilibrium constant of bromophenol blue by Uv-Vis SpectrophotometryAbstract :Bromophenol blue is a kind of weak electrolyte, and can be used as acid-base indicator. The ionization of bromophenol blue varies with the pH of the solution, resulting in different colors. Different types of bromophenol blue have diverse maximum absorption wavelength, according to which the absorbance of the bromophenol blue solution is acquired by Spectrophotometry. And the equilibrium constant is obtained based on the relationship between the absorbance and the concentration of the solution.Keyword:bromophenolblue,weakelectrolyte,equilibriumconstant,Spectrophotometry1、序言弱电解质在水溶液中不能完全电离,因此无法准确获得溶液中各组分的浓度,在求算弱电解质的电离平衡常数时比较困难。
中科大物理化学实验六:分光光度法测溴酚蓝的电离平衡常数

实验六: 分光光度法测溴酚蓝的电离平衡常数黄晓PB09206242中国科学技术大学14系,合肥230026*联系人:黄晓hxzjy@摘要:本实验中利用分光光度法测得不同溴酚蓝浓度下的吸光度A和相应的pH值,得到A-pH曲线,然后间接计算出溴酚蓝的电离平衡常数。
Experiment 6: The Determination of the Ionization Equilibrium Constant of BPB byUV-SpectrophotometryAbstract:In this experiment, we use UV-Spectrophotometry to determine absorbency of the electrolytic solutions with different pH and get A-pH graph. Via this graph we can calculate the ionization equilibrium constant of BPB indirectly.1前言弱酸、弱碱的电离平衡常数有着重要的应用意义:一定pH值的缓冲溶液的选择,酸碱指示剂的选择等等都需用到弱酸、弱碱的电离平衡常数。
溴酚蓝(BPB)是一种酸碱指示剂,本身带有颜色且在水中的电离度很小,所以用一般的化学分析法或是其他物理化学方法很难测定其电离平衡常数。
而分光光度法可以利用不同波长对其组分的不同吸收来确定体系中组分的含量,从而求算溴酚蓝的电离平衡常数。
不同物质的分子轨道跃迁情况不一,在不同波长单色光照射下会存在一个最大吸收波长,称为特征吸收波长,本实验中溴酚蓝溶液中HA和A-分别有各自的特征吸收波长并且不相互重叠。
故确定出不同pH下溴酚蓝的最大吸收波长后,在此最大吸收波长下测量不同pH下的溴酚蓝溶液的吸光度D,通过以下原理计算即可得电离度。
1溴酚蓝在水中的电离平衡常数:K a=[H+][A−][HA]溶液的颜色是由显色物质HA与A-引起的,其变色范围PH在3.1~4.6之间,当PH 3.1时,溶液的颜色主要由HA引起的,呈黄色;在PH≥4.6时,溶液的颜色主要由A-引起,呈蓝色。
甲基红酸解离平衡常数的测定

实验十三 甲基红酸解离平衡常数的测定(分光光度法)一、实验目的1、掌握用分光光度法测酸解离常数的方法。
2、学会使用2100型分光光度计和利用酸度计测pH 值的方法。
二、实验原理酸式甲基红:HMR 和碱式甲基红:MR — 有下列平衡存在:HMR (红) ﹦ H + + MR —(黄)其解离平衡常数可表示为:[][][]HMR MR H K -+= ;两边取负对数得:[][]HMR MR pH pK --=lg-------①只要测出溶液的pH 和浓度比〔RM —〕/〔HMR 〕即可。
平衡体系的pH 值可由酸度计直接测出来,而RM —与HMR 在可见区内均有一个强的吸收峰故 〔RM —〕/〔HMR 〕则可通过分光光度法来求的。
物质对光的吸收情况我们要明确下列三点: ①物质对光的吸收符合吸收定律(朗伯—比尔定律)其定义: 0I I T =。
T 为透光度(率)两边取负对数:)(lg 1lglg 0吸光度A II T T ===-。
c l a A =称之吸收定律。
式中l 为溶液的光径长度即比色皿厚度(cm ),C 为溶液的浓度(mol/L ),a 为摩尔吸光系数,a 是与入射光波长0λ、物质种类、温度有关的常数即:0()a f T λ=、物质种类、。
则)(0c l T f A 、、、物质种类、λ=。
②物质对光的吸收是有选择性的。
物质对不同波长的光的吸收能力不同(A 不同),物质对某一波长的光的吸收能力强(A 较大)对另一波长的光的吸收能力弱(A 较小),以0λ→A 作图得到的曲线称吸收曲线(光谱),该曲线上A max 对应的0λ称最大吸收波长m ax λ要测溶液的A 在m ax λ处最灵敏,准确度最高。
③A 具有加和性。
某一溶液中含有i 种物质则溶液的∑=iAA 。
根据c l a A = 要测C HMR 需在)(max A HMR λλ⋅下测HMR 的A ;要测C MR — 需在)(max B MR λλ⋅-下测MR —的A 。
分光光度法测定I2-KI溶液的平衡常数

C一 ,——测定样 品中加入 r 的总浓度 。 [ ] —— 平衡时的浓度。 [2 —— ,平衡 时的浓度 。 ,] 1
温槽 中恒 温 3 0分钟 , 系统充分平 衡 , 使 以蒸馏 水为参
比, 1m液池 在 3 0 m处 分别测定 吸光度 。 用 c 5n
[l卜一 , 平衡时的浓度 。 , l
13实验过 程 .
72型分光 光度计 , 2 北京 瑞利 分析仪 器公 司。
移 液管 ( O , m ) 容 量 瓶 ( O 0 L 5O L 1mL 5 L 、 10 m ,0 r , a
2 m ) 1( . 、/ A R) 5 L 、 A R) K ( . 。 2 12 实验 原理 . 吸收 峰 出 现 在 2 5 m, 一的 吸 收 峰 出 现 在 0n ,
为 10 . 4×1 0~mo ・ ~。 l L
15 m和 20 m 。在 , 一 混合 溶液 中 , 和 r 9r i 3r i 2 , 2 结 合形 成 , 的吸 收 峰 出现 在 30m。而 , 5n 2和
r 在 此波长 没有 吸收 。
I 2+i 一=I j
溶液 配制 : 取 0 17 g / 于 20 L容 量 称 .00 K 溶 5m
则:
A= -[ ]・ z
Z —液层厚度( — Z=1m 液 池 ) c 。 s — 在 3O m 下 的 摩 尔 吸 光 系 数 。 — 5h
() 2
光谱 , 用分 光光度 法测定 平衡 常数 , 不但 大大降低 了 , 的消耗量 , 2 而且 简单方 便 , 定结果 良好 。 测
收 稿 日期 : 0 8一 1— 2 20 O 1
2 结 果 与 讨论
2 1 结果 .
分光光度法测溴酚蓝的电离平衡常数

分光光度法测溴酚蓝的电离平衡常数【摘要】弱电解质电离平衡常数可以通过分光光度计法测量。
本实验以利用分光光度法通过测量不同pH条件下溶液的吸光度,从而得到吸光度D的函数lg D DD D--12和pH的关系曲线,然后通过线性拟合间接的计算出溴酚蓝(BPB)溶液的电离平衡常数。
【关键词】分光光度法溴酚蓝(BPB)电离平衡常数贝尔-朗比定律一、前言弱酸、弱碱的电离平衡常数是重要的物化参数,一定pH值的缓冲溶液的选择、酸碱指示剂的选择等都需用到弱酸、弱碱的电离平衡常数。
溴酚蓝是一种酸碱指示剂,本身带有颜色且在有机溶剂中电离度很小,用一般的化学分析法或其他物理化学方法很难测定其电离平衡常数。
而分光光度法可以利用不同波长对其组分的不同吸收来确定体系中组分的含量,从而求算溴酚蓝的电离平衡常数。
BPB溶液在pH≤3.1时,溶液呈黄色,主要由HA产生;在pH≥4.6时,溶液呈蓝色,是由A—产生的。
实验证明,被A—最大吸收的蓝色单色光不被黄色的HA 吸收,即消光为0或很小,据此我们可以在A—的最大吸收波长下通过测量不同pH 值下溶液的吸光度,确定溶液中A—组分的浓度,进而得到BPB的电离平衡常数。
本实验旨在让学生了解测定酸碱指示剂电离平衡常数的方法,熟悉722型分光光度计的性能和使用方法,并利用分光光度计测量溴酚蓝(Bromphenalblue)的最大吸收波长,了解溶液浓度对λmax的影响,了解酸度对B.P.B的影响,学会用缓冲溶液调节溶液酸度的方法。
二、实验部分:1、仪器与药品:仪器:722分光光度计科大仪器设备HK—2A型超级恒温水浴南京大学应用物理研究所TU—1901紫外—可见分光光度计北京普析通用仪器Inolab pH计(WTW)10mL移液管3支,25mL移液管1支25mL量筒1只,滴管若干100mL容量瓶11个药品:5×10-5 M的溴酚蓝溶液,0.1 M的HCl溶液1 M的HCl溶液0.1 M NaOH溶液0.2 M NaOH溶液0.1 M邻苯二甲酸氢钾溶液2、实验流程:一)打开超级恒温水浴恒温25℃,打开分光光度计预热仪器,掀开样品室盖。
实验一 分光光度法测 液相反应的化学平衡常数
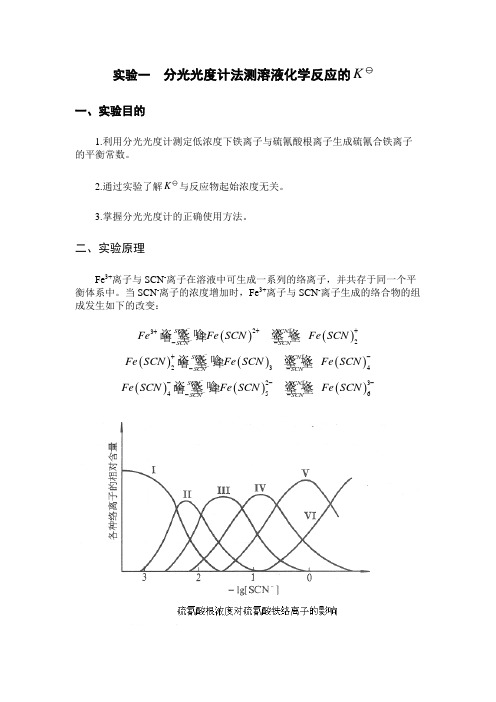
实验一 分光光度计法测溶液化学反应的K一、实验目的1.利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子的平衡常数。
2.通过实验了解K与反应物起始浓度无关。
3.掌握分光光度计的正确使用方法。
二、实验原理Fe 3+离子与SCN -离子在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。
当SCN -离子的浓度增加时,Fe 3+离子与SCN -离子生成的络合物的组成发生如下的改变:()()232SC NSC NSC NSC NFeFe SC N Fe SC N ----+++-- ()()()234SC NSC NSC NSC N Fe SC N Fe SC N Fe SC N ----+--- ()()()23456SC NSC NSC NSC NFe SC NFe SC N Fe SC N ---------而这些不同的络离子颜色也不同。
由图可知,当Fe 3+离子与浓度很低的SCN -离子(一般应小于5×10-3mol·dm -3)时,只进行如下反应:()23FeSCN Fe SCN++-+即反应被控制在仅仅生成最简单的Fe(SCN)2+络离子。
其标准平衡常数23()///Fe SC N C K Fe C SC N C ++-⎡⎤⎣⎦=⎡⎤⎡⎤⎣⎦⎣⎦根据朗伯-比尔定律,吸光度与溶液中Fe(SCN)2+络离子浓度成正比。
()20lgI A K L Fe SC NI+⎡⎤==⎣⎦(A 为吸光度,K 为常数, L 为液层厚度)。
借助于分光光度计测定溶液的吸光度,可计算出平衡时Fe(SCN)2+络离子的浓度以及Fe 3+离子和SCN -离子的浓度,从而求出该反应的平衡常数K。
由于:(1) Fe 3+离子在水溶液中存在下列水解平衡11232322kkK Fe SC N FeSC N FeH O FeO H H-+-+++++++ 快334222kkK FeO HSC N FeO H SC N FeO H SC NHFeSC N H O-+-+++++++ 快达平衡时22331134()/[][]//Fe SC N C K k k k k K H K H Fe C SC N C +--+++-⎡⎤⎛⎫⎛⎫⎣⎦=+÷+= ⎪ ⎪⎡⎤⎡⎤⎝⎭⎝⎭⎣⎦⎣⎦平平K与酸度有关。
分光光度法测定醋酸—醋酐体系中锰离子歧化的平衡常数

4 08 ; 广 东工 业 大学 轻工 化工 学 院 , 东 广 州 10 3 2 广
5 0 9) 1 00
要 :果 用分 光 光 度法 和 滴 定 法 , 定 2 ℃时 在 1 8to ・L-醋 酸 钾 + 醋 酸 一醋 酐 ( 积 比 8: 测 5 l o 。 体
1 体 系 中 M n Ⅱ) 化 成 Mn(V) Mn ) ( 歧 I 和 (I) 的平 衡 常 数. 果 表 明 , 结 该体 系 中 Mn(Ⅱ) 可 见光 区 在 基 本 没有 吸 收 , 2 m 下 Mn(Ⅱ) Mn 4 5E l 和 (Ⅳ) 摩 尔 吸 光 系 数 分 别 为 1 0 ・ mo - c 的 68L l 。・ m叫和 3 6 9L ・ l ・ m一 , (n) 化平 衡 常数 为 8 o 2 . mo c Mn 1 歧 . 8X1 ~. 0 关 键词 :分光 光度 法 ;己酸 ;醋 酸 酐 {锰 离 子 ;歧化 反 应 ; 衡常 数 平 中 图分 类 号 : 4 06 5 文 献 标识 码 : A
r n M (Ⅲ) ]
() 1
…
为了用 分光光 度 法测定 平衡 常 数 , 需要分析 在平 衡 中涉及 的各 种锰 离子 的 吸收光谱 及 浓 度 . (Ⅱ 的吸 收光谱 很 容 易得 到 , Mn Mn ) 对 (I) 的醋酸 一酷酐 溶 液测 定 即可 . 定结 果 表 明 , 测 由于 Mn I) (I 在测 量 波长 范围 内的 摩尔 吸光系 数很 小 , 因此 在本研 究中它 对整 体 吸光 度 的贡 献 可以忽略. 为了确 定 Mn Ⅱ) ( 的特征 吸收波 长 , 配制 Mn Ⅲ) ( 标准溶液. 即在 Mn Ⅱ 过量 ( 于 l 倍 ) ( ) 大 O 的情况 下 , 在醋酸 一醋酐溶液 中加入 K O , Mn 与 Mn Ⅱ) Mn K O ( 反应生成 Mn Ⅲ)Mn Ⅱ) ( . ( 过 量的 目的是保证 生成 的 Mn( 不发 生歧 化 反应 , 而 不会带 入 Mn Ⅳ) Ⅲ) 从 ( 而受 干 扰. 由于 Mn ( ) Ⅱ 的吸收光谱很 小 , 不影响 Mn Ⅲ) ( 的吸收光谱 , 而可得到 Mn Ⅱ) 从 ( 的特 征吸收光谱 . 图 1中曲线 1 Mn Ⅲ) 醋酸 一醋酐 溶液 中的吸收光 谱 , 光谱 中可 得到 最大 吸 收波 是 ( 在 从 长 为 4 5n 在此 波长下测 定 Mn Ⅲ) 2 m. ( 的吸光系数 的灵敏 度最 高 , 因而选 定在 4 5n 处 测定 2 m Mn( 和 Mn( 的 摩 尔 吸 光 系 数 . Ⅲ) Ⅳ) 图 1中曲线 2 KMn 为 O 用空 白溶液 溶解 后立 即测 定得 到的 吸收 光谱 , 见其 吸收 波长 可 与 Mn Ⅲ) 明显 不 同 , ( 的 其最大 吸收波长 为 5 0r 由于 Mn Ⅲ) KMn 1 m. i ( 和 O 的特 征吸收 波长 相 差颇远 , 可作 为 判定 两种物质 存在和转 变的根据 . 电解 含 Mn ) (Ⅱ 的醋酸 一醋 酐溶 液 , 所得溶液 的 吸收光 谱 与图 1中曲线 1的 Mn Ⅲ) 吸 ( 的 收光谱 相 同 , 明由 Mn Ⅱ) 说 ( 电氧化得 到 的是 Mn Ⅲ) 不 含有 KMn 循 环伏 安试 验 中不 同 ( , O. 电 位 范 围 扫 描 时还 原 峰 电位 相 同 也 说 明 了这 一 点 [. 4 ] 摩尔吸光 系数 可 由公 式 A一 [ ( ] 得. 制摩 尔浓度 约 0 0 5to ・ 的 Mn Mn Ⅲ) 求 配 . 0 l L o ( -KO — 2 溶 液 , Ⅲ) Ac o 分别移 取 1 0 l 5 2 0 2 5 3 0 3 5mL该溶 液 到 1 . , ,. ,. ,. , . 0mL 比色管 中 , 空 白溶 液 稀释 至刻度 , 用 分别 测 量每 支 比色 管 中溶液 的吸光度. 通过 硫酸 亚铁 铵标 准溶 再 液进行滴 定 , 来确 定每个 吸光度对 应 的溶液 的浓度. 根 据 吸光度对 应 的 Mn Ⅲ) ( 的浓度 , 作 一[ ( ] Mn Ⅱ) 曲线 , 图 2 由图 2中曲线 的斜率 见 . 求 得 在 波 长 4 5n 下 M n Ⅲ) 摩 尔 吸 光 系数 为 一 1 0 ・ o_ c 2 m ( 的 6 8L t l1・ m一. o
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2 [ Fe ( SCN ) ] [ H ]平 平 K [ Fe 3 ]平 [ HSCN ]平
方法:[Fe(SCN)]2+呈红色,其他无色,故用分光光度法 测得其A 。 由A 求得浓度[Fe(SCN)2+]平 再由方程式和Fe3+、
HSCN、H+的初始浓度求得各离子平衡浓度 计算KΘ。
H2O (mL) 0 1.00
5.00
5.00
3.00
2.00
2.00
3.00
3. 1~5号溶液吸光度的测定
分光光度计,λ=447nm,1cm比色皿,去离子水作参比
溶液。
【数据处理】
平均常数文献值为104
烧杯编号 吸光度A 初始浓度 c(Fe3+) (mol/L) c(HSCN) [Fe(SCN)2+] 平衡浓度 (mol/L) [Fe3+] [HSCN] [H+]
[ H ] [SC N ]平 平 K ( HSCN ) [HSC N] 平
c(HSCN)初= [HSCN]平 + [Fe(SCN)2+]平 + [SCN-]平
K ( HSCN ) [ HSCN ]平 2 c( HSCN )初=[HSC N] 平 [Fe (SC N) ]平 [ H ]平
试剂:
Fe3+溶液(0.200mol/L、0.0020mol/L):用 Fe(NO3)3· 9H2O溶解在1mol/L HNO3中配制,HNO3浓度 必须标定); KSCN(0.0020 mol/L)
【实验步骤】
1. [Fe(SCN)]2+标准溶液的配制 10.00mLFe3+溶液 2.00mLKSCN溶液 8.00mLH2O
[Fe3+]=c(Fe3+)初-[Fe(SCN)2+]平
2 [ Fe ( SCN ) ] [ H ]平 平 K [ Fe 3 ]平 c( HSCN )初 [ Fe( SCN ) 2 ]平
【仪器与试剂】
仪器:
722型分光光度计;吸量管(10mL);烧杯(50或100mL, 洁净、干燥);洗ቤተ መጻሕፍቲ ባይዱ球。
分光光度法测定化学反应的
平衡常数
北京石油化工学院化学工程学院 基础化学教学与实验中心
【实验目的】
• 掌握用分光光度法测定化学反应平衡常数的原理
和方法。 • 练习吸量管的使用 • 学习分光光度计的使用方法。
【实验原理】
目测法
分光光度法: 基于物质对光的选择性吸收而建立的方法。 溶 液
IO
透过光
I
2 c( HSCN )初 [Fe (S C N) ]平
[HS C N] 平
K ( HSCN ) 1 [ H ] 平
[Fe( SCN ) ]平=
2
A未 A标
K Θ(HSCN)=0.141(25℃)
c标
[H+]=c(HNO3)/2
K ( HSCN ) 1 [H ] 平
求得[Fe(SCN)2+]平方法:
由[Fe(SCN)]2+标准溶液相对比求得。
A标= l c标
A标 A未 = c标 c未
或
A未= l c未
c未= A未 A标 c标
[Fe(SCN)2+]平=c未 由反应Fe3+ + HSCN [Fe(SCN)]2+ + H+得: [Fe3+]=c(Fe3+)初-[Fe(SCN)2+]平 [HSCN]=c(HSCN)初-[Fe(SCN)2+]平 [H+]=c(HNO3)/2
1
2
3
4
5
KΘi KΘ平均 相对误差(%)
【注意事项】
1.首先将烧杯洗干净,干燥,否则会影响溶液浓度的准确性 2. 四个移液管需编号,不能混用,否则会影响溶液浓度,也会污 染试剂 3. 使用完试剂后,应立即盖上瓶塞,以免污染试剂 4. 药品的取用:只能倒出,不能倒回 5. 在配制溶液时,要注意Fe3+的浓度:配制标准溶液用 0.2000mol/L,其余用0.02000mol/L 6. 混合均匀后,再测溶液的吸光度 7. 比色皿用待测液润洗三次,装液量为比色皿的2/3。若溢在外面 应擦干,尤其是透光面。手拿毛玻璃处。 8. 测量时,溶液由稀测到浓。 9. 实验结束,将烧杯洗净和比色皿洗净。
复合光
c
l
吸收光
I 透光率T:T (%) I0
吸光度A:A=-lgT 朗伯-比尔定律: A l c
A—吸光度 Io —入射光强度 I—透射光强度 c—溶液的浓度 b—光程距离(液层厚度) ε—摩尔吸光系数 (当c为mol· L-1,b为cm时)
分光光度法的应用特点:
快速、简便、灵敏度高、准确度高、适用面广 组分浓度、有色弱酸(弱碱)的离解常数、配合物的配位数 本实验是利用分光光度法测定下列反应的平衡常数: Fe3+ + HSCN [Fe(SCN)]2+ + H+ ( cΘ 略 )
1
0.200mol/L
0.0020mol/L
充分混合
[Fe(SCN)2+]标=0.0002000mol ·L-1
[H+]=c(HNO3)/2
2. 待测溶液的配制
烧杯编号 2 3 4 5
5 4 3
0.002mol·L-1 Fe3+(mL) 5.00 5.00
0.002mol·L-1 KSCN(mL) 5.00 4.00
K 的计算:
Θ
2 [ Fe ( SCN ) ] [ H ]平 平 K [ Fe 3 ]平 [ HSCN ]平
不能用!!!
注:K只是近似值。在精确计算时,平衡时的[HSCN]平应
考虑HSCN的电离部分:
HSCN H+ + SCN-
K ( HSCN ) [HSC N] 平 [SC N ]平 [ H ]平
K ( HSCN ) [ HSCN ]平 2 [HSC N] c ( HSCN ) [Fe (SC N) ]平 平 初 [ H ]平
K ( HSCN ) 2 [HS C N] c ( HSCN ) [Fe (SC N) ]平 平1 初 [ H ]平
本实验的基本操作
吸量管的使用
分光光度计的使用
下次实验: EDTA标准溶液的配制、浓度标定及自来水总 硬度的测定
