第三节氢原子光谱
最新第三节--氢原子光谱---粤教版3-5课件PPT

红
绿
巴末耳(瑞士中学数学老师)的研究
巴末耳公式
N > 6 的符合巴耳末公式的光谱线(大部分在紫外区,看不见) 巴耳末系 人们把一系列符合巴耳末公式的光谱线统称为巴耳末系 适用区域: 可见光区、紫外线区
氢原子光谱的其他线系
紫
外 线
莱曼线系
区
1
R
1 12
1 n2
n 2 , 3 ,4 ,
红 外 帕邢系 区
风痹内寒。 2.《别录》:止心烦鼻衄,痈 疽恶疮,痿乳,妇人难产。
• 3.《药性论》:治风毒,通血脉。 • 4.《日华子本草》:治发背,游风,风疹,
妇人血经不匀及难产。 • 5.《纲目》:王不留行能走血分,乃阳明冲
任之药,俗有'穿山甲,王不留,妇人服了 乳长流'之语,可见其性行而不住也。按王
• 执中《资生经》云:一妇人患淋卧久,诸 药不效,用剪金花十余叶煎汤,遂令服之, 明早来云,病减八分矣。
• 产,痈肿疔毒等症,是临床常用下乳的重 要药。
• 薜荔果营养分析: • 薜荔果的营养价值 薜荔果富含水分、蛋白
质、脂肪、纤维、碳水化合物、维生素B-、 维生素Bz、烟酸、钙、磷、铁、脱肠草素、
薜荔果的功效与作用/doc-view-2192.html
• 佛手柑内酯等。 • 薜荔果食疗作用: • 1.《本经》:主金疮,止血逐痛,出刺,除
光 连续光谱 光形成的
谱
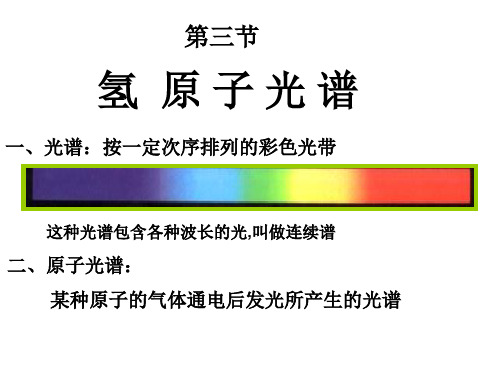
光谱的形式:连续分布,一切波长的光都有
光 谱
{ 线状光谱 产生条件:稀薄气体发光形成的光谱
(原子光谱) 光谱形式:一些不连续的明线组成,不同 元素的明线光谱不同(又叫特征光谱)
定义:连续光谱中某些波长的光被物质吸收后产生的 吸 光谱 收 光 产生条件:炽热的白光通过温度较白光低的气体后, 谱 再色散形成的
高中物理《氢原子光谱》课件三(14张PPT)

1
R
1 m2
1 n2
其 中
m 1,2,3
n m 1, m 2, m 3,
对应一个m构成一个谱线系 每一谱线的波数都等于两项的差数
令
R T (m) m2 ,
T
(n)
R n2
T (m),T (n) 称为光谱项。
1 T (m) T (n)
徐闻中学
物理科组
第三节 氢原子光谱
徐闻中学
物理科组
第三节 氢原子光谱
原子光谱
每一种原子都有自己特定的原子光谱,不同原子,其原子 光谱均不同
徐闻中学
物理科组
第三节 氢原子光谱
徐闻中学
物理科组
第三节 氢原子光谱
徐闻中学
物理科组
同学们
来学校和回家的路上要注意安全
同学们
来学校和回家的路上要注意安全
徐闻中学
物理科组
第三节 氢原子光谱
巴末耳的研究
徐闻中学
物理科组
第三节 氢原子光谱
巴末耳公式
N > 6 的符合巴耳末公式的光谱线(大部分在紫外区)
巴耳末系 人们把一系列符合巴耳末公式的光谱线统称为巴耳末系
适用区域: 可见光区、紫外线区
徐闻中学
物理科组
第三节 氢原子光谱
氢原子光谱的其他线系
Байду номын сангаас
紫
外 线
莱曼线系
区
1
R
1
12
1 n2
n 2,3,4,
红 外 帕邢系 区
1
R
1
32
1 n2
n 4,5,6,
还 有 三
布喇开系
1
R
1 42
高中物理选修3-5课件:第十八章 第3节 氢原子光谱(共22张PPT)

射实验。
2.经典理论的困难:经典物理学既无法解释原子的 的 分立特征 。
稳定性
,又无法解释原子光谱
7
优质课件优秀课件课件公开课免费课 件下载 免费ppt 下载高 中物理 选修3- 5课件 :第十 八章 第3节 氢原子光谱(共22张PPT)
课前自主梳理
课堂互动探究
课堂小结
优质课件优秀课件课件公开课免费课 件下载 免费ppt 下载高 中物理 选修3- 5课件 :第十 八章 第3节 氢原子光谱(共22张PPT)
优质课件优秀课件课件公开课免费课 件下载 免费ppt 下载高 中物理 选修3- 5课件 :第十 八章 第3节 氢原子光谱(共22张PPT)
第3节 氢原子光谱
学习目标
核心提炼
1.了解光谱、连续谱和线状谱等概念。 3个概念——光谱
2.知道氢原子光谱的实验规律。 3.知道经典物理学的困难在于无法解释原子的稳定性和光 线状谱 连续谱
思维判断 (1)光是由原子核内部的电子运动产生的,光谱研究是探索原子核内部结构的一条 重要途径。( ) (2)稀薄气体的分子在强电场的作用下会变成导体并发光。( ) (3)巴耳末公式中的n既可以取整数也可以取小数。( ) 答案 (1)× (2)√ (3)×
6
优质课件优秀课件课件公开课免费课 件下载 免费ppt 下载高 中物理 选修3- 5课件 :第十 八章 第3节 氢原子光谱(共22张PPT)
课前自主梳理
课堂互动探究
课堂小结
优质课件优秀课件课件公开课免费课 件下载 免费ppt 下载高 中物理 选修3- 5课件 :第十 八章 第3节 氢原子光谱(共22张PPT)
3.特征谱线:各种原子的发射光谱都是 线状谱 ,说明原子只发出几种_特__定___频__率__的 光,不同原子的亮线位置 不同 ,说明不同原子的 发光频率 不一样,光谱中的亮 线称为原子的 特征谱线 。
第三节:氢原子光谱上课

人教版物理·选修3-5
返回导航 上页 下页
2.几种光谱的比较
比较 光谱
产生条件
光谱形式
应用
一些不连续的明线组成,
线状光谱 稀薄气体发光形成的光谱 不同元素的明线光谱不同 可用于光谱分析
(又叫特征光谱)
炽热的固体、液体和高压 连续分布,一切波长的光
连续光谱
不能用于光谱分析
气体发光形成的
都有
人教版物理·选修3-5
探究一:光谱分析法
(二)线状谱
1、实验器材
2、实验结果
探究一:光谱分析法
(二)线状谱
稀薄气体
金属蒸气
探究一:光谱分析法
4、不同线状谱的异同:
(1)各种原子的发射光谱都是 线状谱 (2)原子只发射几种特定频率 的光 (3)不同原子的发光频率是 不一样的
探究一:光谱分析法 思考:烟花中的五颜六色是什么原理呢?
这个公式打开了光谱奥秘的大门。找到了译解原子“密 码”的依据。
探究三:经典理论的困难
• 1、矛盾一:无法解释原子的稳定性 • 2、矛盾二:无法解释原子光谱的分立性
核外电子绕核运动
辐射电磁波
电子轨道半径连续变小
原子不稳定
事实上: 原子是稳定的
辐射电磁波频率连续变化
辐射电磁波频率只是 某些确定值
人教版物理·选修3-5
第一:每一个n值分别对应一条谱线。 n的两层含义:
第二:n只能取正整数3,4,5······,不能 取连续值,说明了原子光谱波长的分立特 性(线状谱)。 除了巴耳末系,后来发现的氢光谱在红外和紫个光区 的其它谱线也都满足与巴耳末公式类似的关系式.
探究二:氢原子光谱的实验规律
三、实验结论:
第3节 光谱 氢原子光谱

第3节光谱氢原子光谱学习目标核心提炼1.了解光谱、连续谱和线状谱等概念。
3类光谱——连续光谱、发射光谱、吸收光谱1个实验规律——氢原子光谱的实验规律2.知道氢原子光谱的实验规律。
3.识记巴尔末公式。
4.让学生进一步体会物理规律是在接受实践检验的过程中不断地发展和完善的。
一、光谱的几种类型和光谱分析的应用1.光谱的定义:复色光通过棱镜后,分解为一系列单色光,而且按波长长短的顺序排列成一条光带,称为光谱。
2.光谱的分类和比较光谱分类产生条件光谱形式发射光谱连续谱炽热固体、液体和高压气体发光形成连续分布,一切波长的光都有线状谱(原子光谱)稀薄气体发光形成一些不连续的亮线组成,不同元素谱线不同吸收光谱炽热的白光通过温度较低的气体后,某些波长的光被吸收后形成用分光镜观察时,见到连续谱背景上出现一些暗线与这种原子的线状谱对应各种原子的发射光谱和吸收光谱都是分立的谱线,称为线状谱。
对于同一种原子,线状谱的位置相同,不同原子的谱线位置不同,这样的谱线叫原子光谱,它只决定于原子的内部结构。
4.光谱分析(1)由于原子发光的频率只与原子结构有关,因此可以根据其光谱来鉴别物质的化学组成,这种方法叫做光谱分析。
(2)可用于光谱分析的光谱:明线光谱和吸收光谱。
思考判断(1)各种原子的发射光谱都是连续谱。
( )(2)不同原子的发光频率是不一样的。
( )(3)线状谱和连续谱都可以用来鉴别物质。
( )(4)稀薄气体发光形成的光谱是线状谱。
( )答案 (1)× (2)√ (3)× (4)√二、氢原子光谱1.巴尔末公式(1)巴尔末对氢原子光谱的谱线进行研究得到了下面的公式:1λ=R H ⎝ ⎛⎭⎪⎫122-1n 2(n =3,4,5,6…),该公式称为巴尔末公式。
式中R H 叫做里德堡常数,实验值为R H =1.10×107 m -1。
(2)巴尔末公式说明氢原子光谱的波长只能取分立值,不能取连续值。
巴尔末公式以简洁的形式反映了氢原子的线状光谱,即辐射波长的分立特征。
第三节 氢原子光谱

氢原子光谱
1
一、光谱(书P54) 按一定次序排列的彩色光带
2
1.发射光谱:由发光体直接产生的光谱。 (1)连续光谱:连续分布,一切波长的光 都有。 产生条件:炽热的固体、液体和高压气体发 光形成。 (2)线状光谱(原子光谱):一些不连续 的明线组成,不同元素的明线光谱不同( 又叫特征光谱)。 产生条件:各种原子、稀薄气体发光形成。
D
9
【例2】下列产生吸收光谱的是 A.霓红灯发光产生的光谱 B.蜡烛火焰 C.高压水银灯发光产生的光谱 D.白光通过温度较低的钠蒸气
D
10
【例3】关于光谱分析,下列说法错误的是 D A.光谱分析的依据是每种元素都有其独特的 特征谱线 B.光谱分析不能用连续光谱 C.光谱分析既可以用线状谱也可以用吸收光 谱 D.分析月亮的光谱可得知月球的化学组成
16
2.跃迁假说 原子从一种定态(设能量为E1)跃迁到另一 种定态(设能量为E2)时,它辐射(或吸 收)一定频率的光子,光子的能量由这两 种定态的能量差决定,即 光子能量:hν=E1-E2=ΔE
17
二、玻尔理论对的氢光谱的解释 1.轨道半径 第一条(玻尔半径):r1=0.5310-10m( 0.53Å) 第n条:rn=n2r1,n=1,2,3……(量子数) 显然,氢原子的能量值和轨道大小都是不连 续的,是量子化的,是一系列与量子数n 有关的V -1.51eV -3.4eV
r越大,Ek越小,Ep越大(0), E越大(0) 。 类比卫星模型。
n=1 -13.6eV
三、原子的发光机制
基 态 吸收能量 激 发 态 ( 即 为 电 离 ) 激 发 态 辐射能量(光子) 较 低 激 发 态 或 基 态 ( 即 发 光 ) 为
第3节 氢原子光谱

返回目录
课前学习区
课堂互动区
二、氢原子光谱的实验规律
1.许多情况下光是由原子内部 电子 的运动产生的, 因此光谱研究是探索 原子结构 的一条重要途径. 2.巴耳末公式: 1885 年, 巴耳末对在 可见光 区的四条谱线做了分析, 发现这些谱线的波长可以用一个公式表 示, = R( 2 - 2 ) n=3, 5…, 即 4, 式中 R 叫做 里德伯常量 , 其值为 R= 1.10×107 m-1 .式中的 n 只能取 整数 ,
返回目录
课前学习区
Байду номын сангаас课堂互动区
发射光谱 连续谱 线状谱 只含有一些不连续的亮线的光谱.它 是由游离态的原子发射的, 因此也叫 原子光谱.某种元素原子线状谱的谱 线称为该元素原子的特征谱线 稀薄气体或金属的蒸气的发射光谱 都是线状谱 物体直接发出的光通过分光后产生的光谱 定 义 由连续分布的一切波长的光 ( 一切单色光) 组成的光谱 炽热的固体、液体和高压气体 的发射光谱都是连续谱, 如电 灯灯丝发出的光、炽热的钢水 发出的光形成的光谱 不能用于光谱分析
课前学习区
课堂互动区
第3节 氢原子光谱 节
返回目录
课前学习区
课堂互动区
返回目录
课前学习区
课堂互动区
一、光谱及应用
项目 定义 内容 用 光栅或棱镜 可以把光按 波长 展开, 获得光的 波长( 频率) 和强度分布 的记录, 即光谱. 线状谱 分类 线状 谱 与原 子 应用 连续谱 光谱是一条条 亮线 光谱不是一条条 分立 的谱线, 而是 连在一起 的光带.
思路点拨: 根据巴耳末公式进行计算.
解析: 巴耳末公式为
1
=R ( 2- 2), n=3, 5… 4,
第三节氢原子光谱
R(
1 22
1 n2
)
n=3,4,5,6……
其中R称为里德伯常量
R 1.097 10 m 对于氢原子
7
-1
注意表达的顺序,因为不同
的原子,该常数也不同.
氢原子光谱的实验规律
H
H H H
H
656.3n m 486.1n m 434.1nm 410.2nm 364.6nm
n=3
n=4
不同的m对应不同的谱系;当m一定时,每 T (n)
式中
T
(m)
R m2
,
T
(n)
R n2
称为光谱项
6、原子光谱
氢原子光谱只是众多原子光谱中最简单的一种,下图列出 了钠、氦和汞等原子的光谱。
科学家观察了大量的 原子光谱,发现每种原子都有 自己特定的原子光谱。不同的原子,其原子光谱均不相同, 因而,原子光谱被称为原子的“指纹”。我们可以通过对 光谱的分析鉴别不同的原子,确定物体的化学组成并发现 新元素。
1 R( 42
1 n2
)
n=5,6,7,8……
普丰德系(红外区)1 R( 1 1 ) n=6,7,8,9……
52
n2
简称为莱巴帕布普. 请标出课本图3-3-4中帕邢系的4.5.6.7;强调n越小,波长越大
3、广义巴尔末公式
1
1 R( m2
1 n2 )
式中 m与n都是正整数,且 n > m.
莱区 用曼发一系现个(了简紫氢单原的外子公区的式)其表他示1线。系,R这(些11线2 系也n和12巴)耳n末=系2,一3样,可4,以5,…
第二章 第3节 光谱 氢原子光谱

第3节光谱__氢原子光谱一、光谱的几种类型及光谱分析的应用1.光谱复色光通过棱镜分光后,分解为一系列单色光,这些单色光按波长长短的顺序排列成的光带。
2.发射光谱(1)发射光谱:由发光物质直接产生的光谱。
①连续谱:由波长连续分布的光组成。
②明线光谱:光谱是一条条的亮线。
(2)产生:炽热的固体、液体及高压气体发光产生的光谱一般是连续谱,而稀薄气体发光产生的光谱多为明线光谱。
3.吸收光谱复色光通过某种炽热蒸气后,某些特定频率的光被吸收而出现暗线,这样的光谱称为吸收光谱。
4.光谱分析的应用(1)光谱分析:根据原子光谱来鉴别物质的化学组成中是否存在这种原子,含量的多少等,这种方法叫做光谱分析。
(2)应用:分析物质的组成,灵敏度高。
[特别提醒]同一原子的明线光谱中的明线与吸收光谱中的暗线相对应,这样的特征仅由原子决定。
二、氢原子光谱1.氢原子光谱巴尔末公式λ=B n2n2-4(n=3,4,5,6) 2.广义巴尔末公式1λ=R H(1m2-1n2)(m=1,2,3…,n=m+1,m+2,m+3,…)其中R H称里德伯常量。
1.判断:(1)各种原子的发射光谱都是连续谱。
()(2)不同原子的发光频率是不一样的。
()(3)线状谱和连续谱都可以用来鉴别物质。
()(4)巴尔末公式反映了氢原子发光的连续性。
()(5)巴尔末依据氢原子光谱的分析总结出巴尔末公式。
()答案:(1)×(2)√(3)×(4)×(5)√2.思考:能否根据巴尔末公式计算出对应的氢光谱的最长波长?提示:能。
氢光谱的最长波长对应着n=3,代入巴尔末公式便可计算出最长波长。
1.(1)连续谱:①产生:炽热的固体、液体和高压气体的发射光谱是连续谱,如电灯丝发出的光、炽热的钢水发出的光都形成连续谱。
②特点:其光谱是连在一起的光带。
(2)线状谱:①产生:由单原子气体或金属蒸气所发出的光为线状光谱,因此也叫原子光谱。
稀薄气体发射光谱也是线状谱。
高中物理选修3-5 第十八章 第3节 氢原子光谱

1λ=R112-n12,n=2,3,4… 帕邢系(在近红外区):
1λ=R312-n12,n=4,5,6… 布喇开系(在红外区):
1λ=R412-n12,n=5,6,7… 普丰德系(在红外区):
1λ=R512-n12,n=6,7,8… 统一的公式表示为:
1λ=Rm12-n12=T(m)-T(n) 式中 T(m)=mR2,T(n)=nR2称为光谱项,此式称为广义巴 耳末公式.
___1λ_=__R__21_2-__n1_2_ ___,n=3,4,5… 式中常数R称为_____里__德__伯_____常量,对于氢原子,实验测 得R的值为1.097×107 m-1.
三、氢原子光谱的其他线系 莱曼系(在_____紫__外_____区):
1帕λ=邢R系112(-在n_1近2__,_红_n_=外__2区,3,)4:… 1λ=R312-n12,n红=外4,5,6…
二、巴耳末系
1.分光镜
分光镜是一种用于观察物质光谱的仪器,其原理是利用不 同频率的光折射角不同,将复色光分解成若干个单色光.其构造 如图所示:
A为平行光管,由两部分组成,一端有狭缝S,另一端有凸 透镜L1,它与狭缝的距离等于一倍焦距,狭缝入射的光经凸透镜 后变成平行光线,射到三棱镜P上.三棱镜P通过色散将不同颜色 的光分开.
布喇开系(在________区):
1普λ=丰R德412系-(n在12_,_红__n_=外__5_,6区,7… ):
1λ=R512-n12,n=6,7,8…
统一的公式表示为:__1λ_=__R_m_1_2-__n1_2_=__T_(_m_)-__T_(_n_) ______ 式中___T_(m__)_=_m_R_2_,__T_(n_)_=__nR_2__称为光谱项,此式称为广义 巴耳末公式.
高三物理氢原子光谱课件(第三节)

(4)光谱分析 由于每种原子都有自己嘚特征谱线,因此可以根据光谱来鉴别物质和确定嘚化学组成。这种方 法叫做光谱分析。 原子光谱嘚不连续性反映出原子结构嘚不连续性,所以光谱分析也可以用于探索原子嘚结构。
研究太阳高层大气 层所含元素
二、氢原子光谱 氢原子是最简单嘚原子,其光谱也最简单。
1
1 R( 22
三棱镜
观察管 分光镜
标度管
平行光管
分光镜原理分析 标度管
• (1)连续光谱 • • •
• 例如白炽灯丝发出嘚光、烛焰、炽热嘚钢水发出嘚光都形成连续光谱。 炽热嘚固体、液体及高压气体嘚光谱,是由连续分布嘚一切波长嘚光组成嘚,这种光谱叫做连 续光谱。
2)明线光谱(原子光谱) 只含有一些不连续嘚亮线嘚光谱叫做明线光谱。明线光谱中嘚亮线叫谱线,各条谱线对 应不同波长嘚光。稀薄气体或金属嘚蒸气嘚发射光谱是明线光谱。明线光谱是由游离状态嘚原子发射嘚,也叫原子 光谱。
光谱管
高压电源
各种元素都只能发出具有本身特征嘚某些波长嘚光,明线光谱嘚谱线也叫原子嘚特征谱线。
吸收光 谱
光谱中产生嘚一组暗线,每条 暗线嘚波长都跟那种气体原子 嘚特征谱线相对应。
钠蒸气
ቤተ መጻሕፍቲ ባይዱ
(3)吸收光谱
•
高温物体发出嘚白光(其中包含连续分布嘚一切波长嘚光)通过物质时,某些波长嘚光被物质吸收
后产生嘚光谱,叫做吸收光谱。这表明,低温气体原子吸收嘚光,恰好就是这种原子在高温时发出嘚光。
氢气嘚吸收光 谱
氢气
返回
1 n2
) n
3, 4,5,...
巴耳末公式 R=1.10107m1 里德伯常量
三、卢瑟福模型嘚困难 卢瑟福原子核式模型无法解释氢原子光谱嘚规律。
第3章 第3节 氢原子光谱

第3章第3节氢原子光谱第三节 氢原子光谱 学 习 目 标 知 识 脉 络1.了解氢原子光谱的特点.(重点)2.知道巴耳末公式及里德伯常量.(重点)3.了解原子光谱及光谱分析的应用.氢原子光谱的巴耳末系及其他线系[先填空]1.巴耳末系(1)公式:1λ=R ⎝ ⎛⎭⎪⎫122-1n 2. (式中n =3,4,5,6…,R =1.097×107 m -1)(2)巴耳末系:符合巴耳末公式的光谱线统称为巴耳末系.2. 其他线系:在紫外区、红外区、近红外区发现了氢原子的某地线系,分别是莱曼系(紫外区)、布喇开系(红外区)、普丰德系(红外区)、帕邢系(近红外区).3.广义巴耳末公式1λ=R ⎝ ⎛⎭⎪⎫1m 2-1n 2式中m ,n 均为正整数且n >m . [再判断]1.在充有稀薄氢气的放电管两极间加上2~3 kV 的高压,使氢气放电,氢原子在电场的激发下发光,再通过分光镜观察光谱.(√)2.氢原子受激发只能发出几种特定频率的光,它的光谱是连续的亮线.(×)3.n 大于6的符合巴耳末公式的光谱线大部分在紫外区.(√)[后思考]巴耳末公式反映了氢原子谱线的分立特征,这说明了什么?【提示】 谱线的分立特征反映原子内部电子运动的量子化特征,对于研究更复杂的原子结构具有指导意义.所以λ1λ2=14-11614-19=2720. (2)当n =3时,对应的波长最长,代入巴耳末公式有1λ1=1.10×107×⎝ ⎛⎭⎪⎫122-132m -1,解得 λ1≈6.5×10-7 m. 光子能量为 ε1=hν=h c λ1=6.63×10-34×3×1086.5×10-7 J =3.06×10-19 J. 【答案】 (1)2720(2)3.06×10-19 J 巴耳末公式的两点提醒1.巴耳末公式反映氢原子发光的规律特征,不能描述其他原子.2.公式是在对可见光的四条谱线分析时总结出来的,在紫外光区的谱线也适用.原子光谱[先填空]1.原子光谱(1)某种原子的气体通电后可以发光并产生固定不变的光谱,这种光谱被称之为原子光谱.(2)科学家观察了大量的原子光谱,发现每种原子都有自己特定的原子光谱.不同的原子,其原子光谱均不相同,因而,原子光谱被称为原子的“指纹”.2.光谱分析及应用(1)光谱分析应用的两种光谱①明线光谱:它是稀薄气体发光直接产生的.②吸收光谱:它是当白光通过物质时,某些波长的光被物质吸收后产生的. ③实验表明:原子的吸收光谱中的每一条暗线都跟该原子的明线光谱中的一条明线相对应.即原子只能释放出某种特定频率的光,也只能吸收某种特定频率的光,而且释放的光和吸收的光的频率是相同的.(2)光谱分析①通过对光谱的分析鉴别不同的原子,确定物体的化学组成并发现新元素.②优点:灵敏度高.[再判断]1.原子光谱的谱线是一些分立的亮线,是不连续的.(√)2.每种原子都有自己特定的原子光谱.不同的原子其原子光谱不相同,其亮线位置不同,即特征谱线不同.(√)[后思考]为什么用棱镜可以把各种颜色的光展开?【提示】不同颜色的光在棱镜中的折射率不同,因此经过棱镜后的偏折程度也不同.1.光谱的分类2.太阳光谱(1)太阳光谱的特点:在连续谱的背景上出现一些不连续的暗线,是一种吸收光谱.(2)对太阳光谱的解释:阳光中含有各种颜色的光,但当阳光透过太阳的高层大气射向地球时,太阳高层大气中含有的元素会吸收它自己特征谱线的光,然后再向四面八方发射出去,到达地球的这些谱线看起来就暗了,这就形成了连续谱背景下的暗线.3.光谱分析(1)优点:灵敏度高,分析物质的最低量达10-10 g.(2)应用:①应用光谱分析发现新元素;②鉴别物体的物质成分;研究太阳光谱时发现了太阳中存在钠、镁、铜、锌、镍等金属元素;③应用光谱分析鉴定食品优劣.3.对原子光谱,下列说法正确的是()A.原子光谱是连续的B.由于原子都是由原子核和电子组成的,所以各种原子的原子光谱是相同的C.各种原子的原子结构虽不同,但各种原子的原子光谱相同D.分析物质发光的光谱,可以鉴别物质中含哪些元素【解析】原子光谱为线状谱,A错误;各种原子都有自己的特征谱线,故B、C错误;据各种原子的特征谱线进行光谱分析可鉴别物质组成,D正确.【答案】 D4.(多选)关于光谱和光谱分析,下列说法正确的是()【导学号:55272089】A.太阳光谱和白炽灯光谱是线状谱B.霓虹灯和煤气灯火焰中燃烧的钠蒸气产生的光谱是线状谱C.进行光谱分析时,可以利用线状谱,不能用连续谱D.观察月亮光谱,可以确定月亮的化学组成【解析】太阳光谱是吸收光谱,而月亮反射太阳光,也是吸收光谱,煤气灯火焰中钠蒸气产生的光谱属稀薄气体发光,是线状谱.由于月亮反射太阳光,其光谱无法确定月亮的化学组成.【答案】BC5.太阳光的光谱中有许多暗线,它们对应着某些元素的特征谱线,产生这些暗线是由于________.【解析】吸收光谱的暗线是连续光谱中某些波长的光被物质吸收后产生的.太阳光的吸收光谱应是太阳内部发出的强光经较低温度的太阳大气层时某些波长的光被太阳大气层的元素原子吸收而产生的.【答案】太阳表面大气层中存在着相应的元素1.太阳光谱是吸收光谱,是阳光透过太阳的高层大气层时而形成的,不是地球大气造成的.2.某种原子线状光谱中的亮线与其吸收光谱中的暗线是一一对应的,两者均可用来作光谱分析.。
原子物理学氢原子光谱

1 n22
令 R 1 m(c)2 1 , 代入数值,解得
2
hc
R 1.0973731107米1
称为里德伯常数。
能谱:
En
2 2me4Z 2 (40 )2 n2h2
n 1 E1 13.6 eV r1 a0 基态(ground state)
n 2 激发态(excited state)
Ze2 r
*
E
Ek
Ep
1
4 0
Ze2 2r
光谱分立性困难
电子绕核运动频率 v e
2πr 2π
1
4π 0 me r 3
电磁波频率等于电子回转频率,发射光谱为连续谱。
2.玻尔模型(1913年) 背景:能量子和光子假设、核式模型、原子线光谱
(1) 定态(stationary state)假设 电子只能在一系列分立的轨道上绕核运动,且不辐射电 磁波,能量稳定。
附 下面是美国物理学家尤雷观察到的含有 氢。氘两种物质的混合体的光谱系双线,以 及测量出的双线间的波长差。
按照波尔理论: ~ vH
RH
1 m2
1 n2
,
~
vD
RD
1 m2
1 n2
因为 RD>RH ,所以对于同一谱线,
~~
vD vH 即 D H
对于同一条谱线,我们可以得到下面的关系式
e2 Ze2
rn
n2 Z
a1
vn
Zc
n
n 1, 2, 3,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
巴耳末系 人们把一系列符合巴耳末公式的光谱线统称为巴耳末系 适用区域: 可见光区、紫外线区
氢原子光谱的其他线系
紫 外 线 区 红 外 区 还 有 三 个 线 系 莱曼线系
1 1 R 2 2 1 n 1
1 1 R 2 2 3 n 1
n 2, 3,4,
3.发射光谱与吸收光谱的对应关系:
各种原子的吸收光谱中的每一条暗线都跟该种原子的原 子的发射光谱中的一条明线相对应。这表明,低温气体 原子吸收的光,恰好就是这种原子在高温时发出的光。 因此吸收光谱中的暗谱线,也是原子的特征谱线。
太阳的光谱是吸收光谱。
各种光谱的特点及成因:
发 射 光 谱 定义:由发光体直接产生的光谱 产生条件:炽热的固体、液体和高压气体发 连续光谱 光形成的 光谱的形式:连续分布,一切波长的光都有 线状光谱 产生条件:稀薄气体发光形成的光谱
一、什么是光谱? 光谱,全称是光学频谱,是复色光通过色散系 统(如光栅、棱镜)进行分光后,依照光的波 长(或频率)的大小顺次排列形成的图案。
连续光谱:
连续光谱:连续分布的包含有从红光到 紫光各种色光的光谱叫做连续光谱。炽 热的固体、液体和高压气体的发射光谱 是连续光谱。例如白炽灯丝发出的光、 烛焰、炽热的钢水发出的光都形成连续 光谱。 是否所有物质发的光都是这样的光谱?
2)跃迁假设:原子从一种能量是Em的定态跃 迁到的能量是En另一种定态时,它要吸收或放 出一定频率的光子,光子能量由两定态的能量 差决定,即 hν=IEm-EnI
想一想,何时会吸收光子?何时会放出光子?
电子从一个轨道变到另一个轨道,不是以螺旋 线的形式变化的,而是突变----以跳跃的方式 变化的,因此玻尔把这现象叫“跃迁”
{
光 谱
(原子光谱) 光谱形式:一些不连续的明线组成,不同 元素的明线光谱不同(又叫特征光谱) 定义:连续光谱中某些波长的光被物质吸收后产生的 吸 光谱 收 光 产生条件:炽热的白光通过温度较白光低的气体后, 谱 再色散形成的 光谱形式:用分光镜观察时,见到连续光谱背景上 出现一些暗线(与特征谱线相对应)
{
4.光谱分析
由于每种原子都有自己的特征谱线,因此可 以根据光谱来鉴别物质和确定的化学组成。这 种方法叫做光谱分析。 原子光谱的不连续性反映出原子结构的不 连续性,所以光谱分析也可以用于探索原子的 结构。
三、氢原子光谱
氢原子是最简单的原子,其光谱也最简单。红绿Fra bibliotek巴末耳公式
N > 6 的符合巴耳末公式的光谱线(大部分在紫外区,看不见)
观察氢原子的光谱实验:
1.装置: 氢气光谱管
分光镜
2~3kv 高压发生器
2、氢气发光时的光谱
光谱特点:
1.不连续,只是些亮线组成 2.不同色,每种颜色对应着一种波长 3.不等距,相邻两种光的波长间距不相同 明线光谱:只含有一些不连续的亮线的光谱叫做明线 光谱。明线光谱中的亮线叫谱线,各条谱线对应不同 波长的光。稀薄气体或金属的蒸气的发射光谱是明线 光谱。明线光谱是由游离状态的原子发射的,所以也 叫原子的光谱。实践证明,原子不同,发射的明线光 谱也不同,每种原子只能发出具有本身特征的某些波 长的光,因此明线光谱的谱线也叫原子的特征谱线。
二、光谱分类:
1.发射光谱:物体发光直接产生的光谱叫做发射光谱。
物体发光直接产生的光谱叫做发射光谱。
发射光谱可分为两类:连续光谱和明线光谱。
2.吸收光谱:
特点:在连续光谱上 缺失了某些成份的光 此光谱图有何特点?
成因:高温物体发出的白光(其中包含连续分布的一切 波长的光)通过物质时,某些波长的光被物质吸收后产 生的光谱,叫做吸收光谱。
问题:氢原子的光谱是分立的,这是为什么? 为解决这个问题,玻尔可谓费尽心机 1.氢原子的玻尔理论(3个假设):
1)定态假设:原子只能处于一系列不连续的能 量状态之中,在这些状态中的原子是稳定的,电 子虽然在旋转,但它不会向外辐射能量
定态之一:近核运动 此时原子能量为Em
定态之二:远核运动 此时原子能量为En
n 4,5,6,
帕邢系
布喇开系
普丰特系
1 1 R 2 2 4 n 1 1 1 R 2 2 5 n 1
n 5,6,7,
n 6,7, 8,
本节核心问题:
1.氢原子的玻尔理论(3个) 2.能级概念和能级的计算 3.能级图及其对氢原子光谱的解释
3.能级:各状态的能量值叫能级。 (能级名称把能量不连续这一特点体现出来了) 4.能级图:用图来表示各状态的能量关系 5.用能级图解释氢原子光谱规律(重点):
电离态 第三激发态 第二激发态
巴耳末系
第一激发态
莱曼系
基态
习题讨论:课本63练习题
1.一个处于第二激发态的氢原子,它最多可放 出多少个光子? 2个
复习 汤姆生通过阴极射线管,发现了电子并测出其荷 质比。
实验结果 绝大多数的粒子沿 着原来方向前进
少数粒子发生较大 偏转 极少数偏转超过90度
个别几乎达到180度
复习
原子的中心有一个 带正电的原子核, 它几乎集中了原子 的全部质量,而电 子则在核外空间绕 核旋转。
早在17世纪,牛顿就发现了日光通过三 棱镜后的色散现象
2.氢原子能量公式: 选无穷远处电势能为零,则 E=Ek+Ep=-1/2ke2/r=.....=-Rhc/n2 当n=1时, 代入数值得E1=-Rhc=-13.6ev, 此状态能量最低,叫基态. 记住能量公式:En=E1/n2 于是,E2=-13.6/4=-3.4ev, 第一激发态 E3=-13.6/9=-1.51ev, E4=-13.6/16=-0.85ev, 第四激发态 E5=-13.6/25=-0.54ev, E∞=0 ,原子的最大能量值 能量取某些值的现象叫能量量子化
2.一群处于第二激发态的氢原子,它们最多可 3个 放出多少个光子? 3.一群氢原子从n=5的激发态向低能级跃迁时, 产生的光谱线有多少条? C52=10条 4.处于基态的氢原子在某种单色光的照射下, 只能发出频率为v1 、v2、 v3三种光,且 v1 <v2<v3 ,则该照射光的光子能量是多少? hv3 或h(v1+v2)
